以甘草酸类化合物为膜材的空白脂质体、制备方法及应用与流程
本发明涉及一种以甘草酸类化合物为膜材的空白脂质体、制备方法及应用。
背景技术:
脂质体是一种定向药物载体,属于靶向给药系统的一种新剂型。它可以将药物粉末或溶液包埋在直径为纳米级的微粒中,这种微粒类似于生物膜结构的双分子层微小囊泡,进入人体内主要被网状内皮系统吞噬而激活机体的自身免疫功能,并改变被包封药物的体内分布,使药物主要在肝、脾、肺和骨髓等组织器官中积蓄,从而提高药物的治疗指数,减少药物的治疗剂量和降低药物的毒性。
脂质体的结构与由表面活性剂构成的胶束不同,后者是由单分子层组成,而脂质体由双分子层组成,可以包裹脂溶性药物或水溶性药物。脂质体的成分是磷脂和胆固醇。磷脂为两性物质,其结构中含有磷酸基团和含氨的碱基(均亲水),及两个较长的烃链为疏水链。胆固醇亦属于两亲物质,其结构中亦有疏水与亲水两种基团,但疏水性较亲水性强。其中,磷脂是脂质体的主要成分,磷脂分子形成脂质体时,有两条疏水链指向内部,亲水基在膜的内外两个表面上,磷脂双层构成一个封闭小室,内部包含水溶液,小室中水溶液被磷脂双层包围而独立,磷脂双层形成囊泡又被水相介质分开。胆固醇增加脂质体膜的稳定性,其它辅料起特殊功能性作用。
脂质体主要材料是磷脂和胆固醇,例如南京思科生产的紫杉醇脂质体(商品名为“力扑素”)的主要成份为(除紫杉醇药物以外):卵磷脂(主成份一)、胆固醇(主成份二)、苏氨酸(氨基酸一般作为抗氧化剂或缓冲剂)和葡萄糖(糖类一般作为冻干赋形剂或冻干保护剂)。脂质体中也可以添加其他辅料,例如添加热敏性辅料制成热敏性脂质体、添加pH敏感物质制成pH敏感脂质体、添加阳离子或阴离子制成阳离子脂质体或阴离子脂质体或添加表面活性剂等,用途不同,添加的辅料也不同。一般情况,脂质体冻干之前主要成份是磷脂(比例一般在50-95%)和胆固醇(5-50%左右);但在进行冻干的操作时,会根据具体情况加入一定量的辅料,不同用途的脂质体,所添加的辅料比例差别比较大,有些在冻干时无需加入辅料,有些在冻干时,辅料加入的量甚至达到50%。另外,目前市场上还有许多改性的磷脂,例如Peg化或氨基酸化的磷脂,该类磷脂中辅料的含量很少。因此,不同用途、不同类型的脂质体,具体组分和含量差别较大,相互之间的借鉴意义不大(注:以上出现的百分比均是指各组分占脂质体原料总质量的百分比)。
由于不同类型药物的理化性质差异,如结构、溶解性、稳定性均有相应的制备技术要求,同时在技术、膜材料、中试放大等环节需要不断完善。对于脂质体的质量评价,主要8项指标,脂质体的形态和粒径(含分散性),包封率,载药量,突释和渗漏率,体外释放度,磷脂氧化程度,有机溶剂残留和体内外功能评价。但总体来说,现在脂质体仍然存在靶向性有待进一步提高,包封率低、稳定性差、制备工艺复杂等缺点。
粒径是控制脂质体产品质量稳定一致的关键指标,但目前,对于脂质体的粒径,粒径限度是根据稳定性考察结果以及多批产品实际测定结果,设定平均粒径以及粒径分布限度。如设定的粒径范围较宽,应验证上下限之间的产品是否具有相同的疗效和安全性。安全性研究的重点是考证脂质体制剂药代行为的改变是否引起毒性反应的改变,比如由于药物组织分布的改变,在解决了化合物原限制性毒性的前提下,是否产生新的毒性反应,原有的毒性反应是否有加重等。而且,脂质体制剂在药学质量方面无法保证其一致性,在药理、毒理、药代和组织分布等方面均存在一定的缺陷。例如,脂质体制剂一般会改变药物在体内的组织分布特征,如在网状内皮系统摄取增加,肿瘤组织的药物浓度升高,血液中药物维持时间延长。
因此,研究一种高效、安全、稳定、靶向性强、均一性好、质量稳定和可靠、制备工艺简便的脂质体一直是脂质体研究的重点和方向。
现有技术中还没有任何关于甘草酸可以作为脂质体膜材料,同时又可以作为靶向材料和药物等,用于制备空白脂质体并包载药物等其他成分的报道。
技术实现要素:
本发明所要解决的技术问题是为了克服现有的脂质体靶向性不够明显、包封率低、稳定性差以及制备工艺复杂等缺陷,而提供了一种以甘草酸类化合物为膜材的空白脂质体、制备方法及应用。本发明的空白脂质体具有高效、安全、稳定、靶向性强、均一性好、质量稳定和可靠、制备工艺简便等优点,并可用于包封药物、化妆品中的活性物质、具有保健作用的物质、生物制剂、多聚核苷酸或寡聚核苷酸,形成负载活性物质的脂质体。
本申请的发明人在研发之初,经大量的试验发现,在一些特殊的甘草酸类化合物的参与下,脂质体的构成和性质都能得以大大改善,得到的脂质体,与传统的脂质体相比,各项指标更加优秀,尤其是在成药性、靶向性、抗多药耐药、增效减毒、药物协同作用等方面。
本发明主要是通过以下技术方案解决上述技术难题的。
一种以甘草酸类化合物为膜材的空白脂质体,其原料组成为将普通空白脂质体中的胆固醇替换或部分替换为甘草酸类化合物,即可;所述的甘草酸类化合物为甘草酸、甘草酸单胺盐、甘草酸二胺盐、甘草酸三铵盐、甘草酸一钾盐、甘草酸二钾盐、甘草酸三钾盐、甘草酸一钠盐、甘草酸二钠盐和甘草酸三钠盐中的一种或多种。
所述的空白脂质体中,所述的甘草酸类化合物的HPLC含量较佳地大于或等于90%,更佳地为95%以上,所述的百分比是指质量百分比。
所述的普通空白脂质体可为本领域常规的普通空白脂质体,而本领域常规的普通空白脂质体的原料组分主要包括磷脂和胆固醇。其中,所述的普通空白脂质体中,所述的磷脂和所述的胆固醇的质量比一般为0.1∶1-100∶1,较佳地为0.5∶1-20∶1,更佳地为0.5∶1-10∶1,最佳地为0.5∶1-2∶1。
较佳地,本发明所述的空白脂质体中,其原料包括下列组分:如上所述的甘草酸类化合物、磷脂和胆固醇。其中,所述的磷脂和所述的甘草酸类化合物的质量比较佳地为0.1∶1-100∶1,更佳地0.5∶1-20∶1,最佳地为0.5∶1-10∶1(例如0.5∶1-2∶1)。当所述的空白脂质体中的原料组成为将普通空白脂质体中的胆固醇替换为所述的甘草酸类化合物时,所述的磷脂与所述的甘草酸类化合物的质量比较佳地为0.1∶1-100∶1,更佳地为0.5∶1-20∶1,最佳地为0.5∶1-2∶1。当所述的空白脂质体中的原料组成为将普通空白脂质体中的胆固醇部分替换为甘草酸类化合物时,所述的甘草酸类化合物与所述的胆固醇的质量比较佳地为0.1∶1-100∶1,更佳地为0.5∶1-10∶1,最佳地为1.5∶1-6∶1。
所述的空白脂质体中的原料组分中,所述的甘草酸类化合物的含量较佳地为0.01%~80%;所述的磷脂的含量较佳地为5%~99.9%;所述的胆固醇的含量较佳地为0%-50%;当胆固醇的含量为0%时,是指将普通空白脂质体中的胆固醇全部替换为如上所述的甘草酸类化合物;以上百分比(%)均是指各组分的质量占上述所有原料组分总质量的百分比。
所述的空白脂质体的原料组分中:所述的甘草酸类化合物的含量较佳地为10%-80%,更佳地为10%-40%,最佳地为20%-40%(例如25%-40%,优选25%-35%)。所述的磷脂的含量较佳地为10%-70%,更佳地为30%-70%,最佳地为30%-60%。所述的胆固醇的含量较佳地为0.5%-50%,更佳地为5%-40%,最佳地为5%-30%(例如10%-20%)。
本发明所述的空白脂质体也可像本领域普通空白脂质体一样,其原料组分中还可进一步包含抗氧化剂和冻干保护剂。所述的抗氧化剂的含量一般为0%~25%,但不为0%,较佳地为0.001%-15%,更佳地为0.01%-10%,最佳地为0.01%-5%(例如0.1%-1%,);所述的百分比(%)是指抗氧化剂的质量与除冻干保护剂以外的所有原料组分总质量的百分比;所述的冻干保护剂的含量一般为0%-80%,但不为0%,较佳地为0.5%-60%,更佳地为5%-60%,最佳地为30%-60%;所述的百分比(%)是指冻干保护剂的质量占所有原料组分总质量的百分比。
在本发明一较佳实施例中,所述的空白脂质体由甘草酸类化合物和磷脂组成。
在本发明另一较佳实施例中,所述的空白脂质体由甘草酸类化合物、磷脂、胆固醇、抗氧化剂和冻干保护剂组成。
而近几年来的新处方中,普通空白脂质体中的胆固醇还可替换或部分替换为大豆油和/或油酸钠。因此,在本发明另一较佳实施例中,所述的空白脂质体的原料组成为将前述空白脂质体中的胆固醇替换或部分替换为大豆油和/或油酸钠。当所述的空白脂质体中的原料组成为将前述空白脂质体中的胆固醇部分替换为大豆油和/或油酸钠时,所述大豆油和/或油酸钠和所述的胆固醇的质量比较佳地为1∶0.1-1∶10,更佳地为1∶0.5-1∶5,最佳地为1∶0.5-1∶1。所述的胆固醇的含量较佳地为1%-20%,更佳地为10%-20%;所述的大豆油和/或油酸钠的含量较佳地为1%-30%,更佳地为5%-25%,最佳地为10%-25%(例如10%-15%)。
所述的磷脂可为本领域常规的磷脂,较佳地为天然磷脂、半合成磷脂和全合成磷脂中的一种或多种。
所述的天然磷脂一般是来源于大豆、蛋黄、动物脑或脏器中的天然磷脂,较佳地为天然卵磷脂、大豆磷脂、蛋黄卵磷脂和脑磷脂中的一种或多种。
所述的半合成或全合成磷脂可为本领域常规的半合成或全合成磷脂,较佳地为磷脂酰胆碱类的磷脂、磷脂酰丝氨酸(PS)、磷脂酰肌醇(PI)、磷脂酰乙醇胺类的磷脂、磷脂酰甘油(DSPG)、二鲸蜡磷酸酯(DCP)、PEG修饰的磷脂、琥珀酸胆固醇酯(CHS)和2-油酰-1-棕榈锡甘油-3-磷酸胆碱(16:0-18:1 PC,其中16:0-18:1是指PC的碳链)中的一种或多种。由于二棕榈酰磷脂酰胆碱和二硬脂酰磷脂酰胆碱等半合成或全合成的磷脂本身具有热敏性,可同时作为热敏性辅料使用。
所述的磷脂酰胆碱类的磷脂可为本领域常规的磷脂酰胆碱类的磷脂,较佳地为氢化大豆磷脂(HSPC)、二棕榈酰磷脂酰胆碱(DPPC)、二硬脂酰磷脂酰胆碱(DSPC)、二肉豆蔻酰磷脂酰胆碱(DMPC)、二月桂酰磷脂酰胆碱(DLPC)、二油酰磷脂酰胆碱(DOPC)、磷脂酰胆碱(SPC)、单棕榈酰磷酰胆碱(MPPC)和甘油磷脂酰胆碱(GPC)中的一种或多种。
所述的磷脂酰乙醇胺类的磷脂可为本领常规的磷脂酰乙醇胺类的磷脂,较佳地为1-棕榈酰基-2-油酰基磷脂酰乙醇胺(POPE)、二月桂酰基磷脂酰乙醇胺(DLPE)、二芥酰基磷脂酰乙醇胺(DEPE)、二油酰基磷脂酰乙醇胺(DOPE)、二硬脂酰基磷脂酰乙醇胺(DSPE)、二棕榈酰基磷脂酰乙醇胺(DPPE)和二肉豆蔻酰基磷脂酰乙醇胺(DMPE)中的一种或多种。
所述的PEG修饰的磷脂可为本领域常规的PEG修饰的磷脂,较佳地为磷脂酰乙醇胺-聚乙二醇(DMPE-PEG)、二棕榈酰基磷脂酰乙醇胺-聚乙二醇(DPPE-PEG)、二硬脂酰基磷脂酰乙醇胺-聚乙二醇(DSPE-PEG)、二油酰磷脂酰乙醇胺-聚乙二醇(DOPE-PEG)、C8神经酰胺-聚乙二醇(C8 Ceramide-PEG)、C16神经酰胺-聚乙二醇(C16 Ceramide-PEG)、二硬脂酰基磷脂酰乙醇胺-聚乙二醇(2000)-琥珀酰(DSPE-PEG(2000)Succinyl)、二硬脂酰基磷脂酰乙醇胺-聚乙二醇(2000)-羧基(DSPE-PEG(2000)Carboxylic Acid)、二硬脂酰基磷脂酰乙醇胺-聚乙二醇(2000)-马来酰亚胺基(DSPE-PEG(2000)Maleimide)、二硬脂酰基磷脂酰乙醇胺-聚乙二醇(2000)-丙酰胺双巯基吡啶(DSPE-PEG(2000)PDP)、二硬脂酰基磷脂酰乙醇胺-聚乙二醇(2000)-三聚氯氰(DSPE-PEG(2000)Cyanur)、二硬脂酰基磷脂酰乙醇胺-聚乙二醇(2000)-氨基(DSPE-PEG(2000)Amine)、二硬脂酰基磷脂酰乙醇胺-聚乙二醇(2000)-生物素(DSPE-PEG(2000)Biotin)、二硬脂酰基磷脂酰乙醇胺-聚乙二醇(2000)-叶酸(DSPE-PEG(2000)Folate)、二硬脂酰基磷脂酰乙醇胺-聚乙二醇(5000)-叶酸(DSPE-PEG(5000)Folate)、二月桂酰基磷脂酰乙醇胺-聚乙二醇(DLPE-PEG)、二硬脂酰基磷脂酰乙醇胺-聚乙二醇-活性酯(DSPE-PEG-NHS)、磷脂酰乙醇胺-聚乙二醇-活性酯(DMPE-PEG-NHS)、二棕榈酰基磷脂酰乙醇胺-聚乙二醇-活性酯(DPPE-PEG-NHS)、二月桂酰基磷脂酰乙醇胺-聚乙二醇-活性酯(DLPE-PEG-NHS)、二硬脂酰基磷脂酰乙醇胺-聚乙二醇-马来酰亚胺基(DSPE-PEG-Maleimide)、磷脂酰乙醇胺-聚乙二醇-马来酰亚胺基(DMPE-PEG-Maleimide)、二棕榈酰基磷脂酰乙醇胺-聚乙二醇-马来酰亚胺基(DPPE-PEG-Maleimide)、二月桂酰基磷脂酰乙醇胺-聚乙二醇-马来酰亚胺基(DLPE-PEG-Maleimide)、二硬脂酰基磷脂酰乙醇胺-聚乙二醇-生物素(DSPE-PEG-Biotin)、二硬脂酰基磷脂酰乙醇胺-聚乙二醇-荧光素(DSPE-PEG-FITC)、二硬脂酰基磷脂酰乙醇胺-聚乙二醇-羟基(DSPE-PEG-OH)、二硬脂酰基磷脂酰乙醇胺-聚乙二醇-氨基(DSPE-PEG-NH2)、磷脂酰乙醇胺-聚乙二醇-氨基(DMPE-PEG-NH2)、二棕榈酰基磷脂酰乙醇胺-聚乙二醇-氨基(DPPE-PEG-NH2)、二月桂酰基磷脂酰乙醇胺-聚乙二醇-氨基(DLPE-PEG-NH2)、二硬脂酰基磷脂酰乙醇胺-聚乙二醇-羧基(DSPE-PEG-COOH)、磷脂酰乙醇胺-聚乙二醇-羧基(DMPE-PEG-COOH)、二棕榈酰基磷脂酰乙醇胺-聚乙二醇-羧基(DPPE-PEG-COOH)、二月桂酰基磷脂酰乙醇胺-聚乙二醇-羧基(DLPE-PEG-COOH)、二硬脂酰基磷脂酰乙醇胺-聚乙二醇-硫基(DSPE-PEG-SH)、二硬脂酰基磷脂酰乙醇胺-聚乙二醇-硅烷(DSPE-PEG-Silane)、二硬脂酰基磷脂酰乙醇胺-聚乙二醇-叠氮(DSPE-PEG-N3)、胆固醇-聚乙二醇(CholesterolPEG)、甲氧基-聚乙二醇-胆固醇(mPEG-CLS)、胆固醇-聚乙二醇-活性酯(Cholesterol PEG NHS ester)、胆固醇-聚乙二醇-马来酰亚胺基(Cholesterol PEG Maleimide)、胆固醇-聚乙二醇-马来酰亚胺(CLS-PEG-Mal)、胆固醇-聚乙二醇-生物素(Cholesterol PEG Biotin)、胆固醇-聚乙二醇-荧光素(Cholesterol PEG fluorescein)、胆固醇-聚乙二醇-羧基(Cholesterol PEG COOH)、胆固醇-聚乙二醇-氨基(Cholesterol PEG NH2)和胆固醇-聚乙二醇-硫基(Cholesterol PEG SH)中的一种或多种。
在本发明一较佳实施例中,当所述的磷脂为二硬脂酰基磷脂酰乙醇胺-聚乙二醇(DSPE-PEG)时,较佳地,所述的DSPE-PEG与除DSPE-PEG以外的磷脂联合使用,例如DSPE-PEG和HSPC联用,或者DSPE-PEG和大豆卵磷脂联用。
所述的DMPE-PEG的数均分子量较佳地为350、550、750、1000、2000、3000或5000。所述的DPPE-PEG的数均分子量较佳地为350、550、750、1000、2000、3000或5000。所述的DSPE-PEG的数均分子量较佳地为350、550、750、1000、2000、3000、5000、10000、20000、30000或40000。所述的DOPE-PEG的数均分子量较佳地为350、550、750、1000、2000、3000或5000。所述的C8Ceramide-PEG的数均分子量较佳地为750、2000或5000。所述的C16 Ceramide-PEG的数均分子量较佳地为750、2000或5000。所述的DLPE-PEG的数均分子量较佳地为2000或5000。所述的DSPE-PEG-NHS的数均分子量较佳地为1000、2000、5000、10000、20000、30000或40000。所述的DMPE-PEG-NHS的数均分子量较佳地为3400或5000。所述的DPPE-PEG-NHS的数均分子量较佳地为3400或5000。所述的DLPE-PEG-NHS的数均分子量较佳地为3400或5000。所述的DSPE-PEG-Maleimide的数均分子量较佳地为1000、2000、3400、5000或10000。所述的DMPE-PEG-Maleimide的数均分子量较佳地为1000、2000、3400、5000或10000。、所述的DPPE-PEG-Maleimide的数均分子量较佳地为1000、2000、3400、5000或10000。所述的DLPE-PEG-Maleimid的数均分子量较佳地为1000、2000、3400、5000或10000。所述的DSPE-PEG-Biotin的数均分子量较佳地为1000、2000、3400、5000或10000。所述的DSPE-PEG-FITC的数均分子量较佳地为1000、2000、3400、5000或10000。所述的DSPE-PEG-OH的数均分子量较佳地为2000、3400或5000。所述的DSPE-PEG-NH2的数均分子量较佳地为2000、3400或5000。所述的DMPE-PEG-NH2的数均分子量较佳地为2000、3400或5000。所述的DPPE-PEG-NH2的数均分子量较佳地为2000、3400或5000。所述的DLPE-PEG-NH2的数均分子量较佳地为2000、3400或5000。所述的DSPE-PEG-COOH的数均分子量较佳地为2000、3400或5000。所述的DMPE-PEG-COOH的数均分子量较佳地为2000、3400或5000。所述的DPPE-PEG-COOH的数均分子量较佳地为2000、3400或5000。所述的DLPE-PEG-COOH的数均分子量较佳地为2000、3400或5000。所述的DSPE-PEG-SH的数均分子量较佳地为5000。所述的DSPE-PEG-Silane的数均分子量较佳地为3400。所述的DSPE-PEG-N3的数均分子量较佳地为2000、3400或5000。所述的mPEG-CLS的数均分子量较佳地为1000、2000、5000、10000或20000。所述的Cholesterol PEG NHS ester的数均分子量较佳地为1000、2000、3400、5000或10000。所述的CLS-PEG-Mal的数均分子量较佳地为2000、3400、5000或10000。所述的CLS-PEG-Biotin的数均分子量较佳地为2000、3400或5000。所述的CLS-PEG-FITC的数均分子量较佳地为2000、3400或5000。所述的Cholesterol PEG COOH的数均分子量较佳地为3400。所述的Cholesterol PEG amine的数均分子量较佳地为3400。所述的Cholesterol PEG Thiol/Sulfhydril的数均分子量较佳地为3400。
所述的抗氧化剂可为本领域常规的抗氧化剂,较佳地为焦亚硫酸钠、硫代硫酸钠、抗坏血酸、没食子酸丙酯、抗坏血酸及其衍生物、叔丁基对羟基茴香醚、二叔丁基对甲酚、α-生育酚及其衍生物、α-羟基酸、黄酮类化合物、苯丙素酚类化合物、维生素E、维生素C、反丁烯二酸、半胱氨酸、蛋氨酸、丁羟基茴香醚(BHA)、丁羟基甲苯(BHT)、硫二丙酸、亚硫酸盐(如亚硫酸钠)、亚硫酸氢盐(如亚硫酸氢钠)、二硫代氨基苯甲酸类、枸橼酸、苹果酸、山梨醇、甘油、丙二醇、氢醌、羟基香豆素、乙醇胺、磷酸及其盐和亚磷酸及其盐中的一种或多种。
所述的冻干保护剂可为本领域常规的冻干保护剂,一般包括糖/多元醇类、氨基酸类和缓冲剂中的一种或多种。其中,所述的糖较佳地为单糖、双糖和多糖中的一种或多种。所述的单糖较佳地为葡萄糖、甘露醇、木糖醇和山梨醇中的一种或多种。所述的双糖较佳地为蔗糖、乳糖、半乳糖和麦芽糖中的一种或多种。所述的多糖较佳地为海藻糖。所述的多元醇较佳地为甘露醇、山梨醇和丙三醇中的一种或多种。所述的氨基酸较佳地为α-氨基酸,例如甘氨酸、谷氨酸、精氨酸和组氨酸中的一种或多种。所述的缓冲剂一般是指缓冲溶液。所述的缓冲溶液可为本领域常规的缓冲溶液,较佳地其pH值在3~10之间,更佳地在5-7之间。所述的缓冲溶液较佳地为乙醇-醋酸缓冲溶液、三羟甲基氨基甲烷缓冲溶液、巴比妥缓冲溶液、甲酸钠缓冲溶液、邻苯二甲酸盐缓冲溶液、枸橼酸盐缓冲溶液、枸橼酸-磷酸氢二钠缓冲溶液、氨-氯化铵缓冲溶液、硼砂-氯化钙缓冲溶液、醋酸盐缓冲溶液、醋酸-锂盐缓冲溶液、醋酸-醋酸钠缓冲溶液、醋酸-醋酸铵缓冲溶液、磷酸-三乙胺缓冲溶液或磷酸盐缓冲溶液。
较佳地,所述的空白脂质体,其原料还可进一步包括其他辅料,所述的其他辅料可为本领域制备脂质体时常规添加的除抗氧化剂和冻干保护剂以外的其他辅料,例如表面活性剂、热敏性辅料、pH敏感物质和离子添加剂中的一种或多种。
所述的表面活性剂较佳地为聚乙二醇和/或聚山梨醇酯。其中,所述的聚乙二醇的数均分子量较佳地为200-8000。所述的聚山梨醇酯较佳地为聚氧乙烯失水山梨醇单月桂酸酯、聚氧乙烯失水山梨醇单棕榈酸酯、聚氧乙烯失水山梨醇单硬脂酸酯、聚氧乙烯失水山梨醇三油酸酯、聚乙二醇-磷脂酰乙醇胺、聚乙二醇-聚乳酸、聚赖氨酸-聚丙交酯乙交脂、聚醚酰亚胺-聚乳酸、聚乙二醇-聚己内酯、聚乙二醇-聚乙交酯丙交酯、泊洛沙姆188、聚氧乙烯脂肪酸酯类、聚氧乙烯脂肪酸醚和聚氧乙烯甲基蓖麻油醚中的一种或多种。
所述的热敏性辅料一般是指可使脂质体具有热敏性的聚合物、药物和表面活性剂中的一种或多种。可使脂质体具有热敏性的聚合物较佳地为聚异丙烯酰胺、聚异丙烯酸、聚磷酸酯和聚磷脂酰胺共聚物中的一种或多种。可使脂质体具有热敏性的药物较佳地为莪术油、榄香烯和鸦胆子油中的一种或多种。可使脂质体具有热敏性的表面活性剂较佳地为吐温类表面活性剂(例如吐温80)和/或苄泽类表面活性剂。
所述的离子添加剂较佳地包括阳离子添加剂(例如十八胺)和阴离子添加剂(例如磷脂酸和/或磷脂酰丝氨酸)。
上述各其他辅料的用量可按照本领域含有该类辅料的普通脂质体中的用量进行常规选择。例如,当所述的空白脂质体中含有表面活性剂时,其含量为0%-50%,但不为0%;所述的百分比是指表面活性剂的质量占所述空白脂质体所有原料组分总质量的百分比。当所述的空白脂质体中含有离子添加剂时,其含量为0%-10%,但不为0%,所述的百分比是指离子添加剂的质量占所述空白脂质体所有原料组分总质量的百分比。
所述的空白脂质体可采用本领域常规的脂质体制备方法制备得到,一般地,可采用注入法、逆向蒸发法、冻融法、复乳法、主动包封法、前体脂质体制备法、薄膜分散法、冷冻干燥法以及以上任意两种方法结合使用的方法。本发明较佳地包括下列步骤:
(1)有机溶剂中,将除冻干保护剂以外的所有原料组分混合,得到一澄清溶液;
(2)除去步骤(1)中所得澄清溶液的有机溶剂,成膜,然后与水、硫酸铵水溶液或者冻干保护剂水溶液混合,超声、高压均质或挤推过膜后,得一含有空白脂质体的水溶液,干燥,即得所述的空白脂质体。
步骤(1)中,所述的有机溶剂可为本领域制备空白脂质体常规的有机溶剂,较佳地为腈类溶剂、C1~C4的醇类溶剂和卤代烃类溶剂中的一种或多种,更佳地为C1~C4的醇类溶剂、C1~C4的醇类溶剂和氯代烃类溶剂的混合溶剂(二者体积比较佳地为1∶1)或C1~C4的醇类溶剂和腈类溶剂的混合溶剂(二者体积比较佳地为1∶1)。所述的腈类溶剂较佳地为乙腈。所述的C1~C4醇类溶剂较佳地为甲醇、乙醇、异丙醇和正丁醇中的一种或多种。所述的卤代烃类溶剂较佳地为氯仿和/或二氯甲烷。所述的有机溶剂的用量可为本领域制备空白脂质体常规的用量,可不作具体限定,一般要求各原料和组分混合后能够得到澄清溶液即可,较佳地,所述的有机溶剂与除冻干保护剂以外的所有原料组分的体积质量比为5mL/g-40mL/g(例如5mL/g-20mL/g)。
步骤(1)中,所述的混合的温度可为本领域常规的温度,一般为0℃-80℃,较佳地为10℃-80℃,更佳地为10℃-65℃。根据本领域常识,在一些情况下,为使混合温度达到80℃,需要在加热条件下进行;又或者当除冻干保护剂的所有原料组分中有对温度敏感的组分或者蛋白质类物质,一般选择在0℃下混合。所述混合的时间可不作具体限定,一般以得到澄清溶液,即可。
步骤(2)中,所述的除去步骤(1)中澄清溶液的有机溶剂的操作可为本领域常规操作,一般使用旋转蒸发或者膜蒸发器除去有机溶剂。其中,所述的除去有机溶剂的温度一般根据需要除去的有机溶剂进行常规选择,一般为25℃-80℃。
步骤(2)中,所述的硫酸铵水溶液的摩尔浓度可为本领域脂质体制备方法中常规的摩尔浓度,较佳地为0.2mol/L。所述的冻干保护剂水溶液的质量分数较佳地为1%-20%,更佳地为5%-10%,所述的百分比是指冻干保护剂的质量占所述冻干保护剂水溶液总质量的百分比。当所述的冻干保护剂为液体时,例如为缓冲剂时,可直接使用,此时,所述的冻干保护剂与除冻干保护剂以外的所有原料组分的体积质量比为5mL/g-40mL/g(例如5mL/g-20mL/g)。所述的水、硫酸铵水溶液或所述的冻干保护剂的水溶液的用量可不作具体限定,只要不影响所述空白脂质体的形成即可,较佳地与步骤(1)有机溶剂的用量相同。
由于步骤(2)中会使用到硫酸铵水溶液,在这种情况下,所述的空白脂质体的原料还可进一步包含硫酸铵。当所述的空白脂质体中含有硫酸铵时,其含量为0%-35%,但不为0%,所述的百分比是指硫酸铵的质量占所述空白脂质体所有原料组分总质量的百分比。
步骤(2)中,所述的超声、高压均质或挤推过膜的操作可为本领域常规的操作。所述的超声、高压均质或挤推过膜的操作结束后,所得空白脂质体颗粒粒径一般在0.05-0.3微米。
步骤(2)中,所述的超声、高压均质或挤推过膜的操作结束后,较佳地还可进一步包含过滤的步骤。所述的过滤的操作可为本领域脂质体制备方法中常规的操作,其目的是除去细菌、固体颗粒、特别大的脂质体(在负载活性物质的脂质体的制备方法中,也可除去未包封的游离药物)等。本发明中,所述的过滤较佳地为采用微孔滤膜或者聚碳酸酯膜过滤。所述的微孔滤膜的孔径较佳地为0.22微米。所述的聚碳酸酯膜的孔径较佳地为0.1微米或0.05微米。
步骤(2)中,所述的干燥的操作可为本领域常规的操作,一般采用冷冻干燥机冷冻干燥,或者以上述冻干保护剂的水溶液(例如5%的葡萄糖水溶液,所述的百分比是指葡萄糖)为流动相通过分子筛凝胶柱交换空白脂质体外的水。所述的冷冻干燥的温度和时间为本领域常规的温度和时间,可不作具体限定。
为方便贮存,步骤(2)中,制备得到的空白脂质体的水溶液后,将其分装于西林瓶中,再干燥,然后通入气体保护(例如氩气或氮气),密封保存即可。
所述的空白脂质体可用于包封药物、化妆品中的活性物质、具有保健作用的物质、生物制剂、多聚核苷酸或寡核苷酸(包括核糖核苷酸和脱氧核糖核苷酸),形成负载活性物质的脂质体。
所述的药物可为本领域常规的药物,较佳地为抗肿瘤药物、抗真菌药物、抗病毒药物、抗生素、非甾体抗炎药物、钙离子拮抗剂、免疫抑制剂、麻醉剂、心脑血管及血管扩张药物、肠胃药物和抗抑郁症药物中的一种或多种。
所述的抗肿瘤药物可为本领域常规的抗恶性肿瘤的药物,较佳地为紫杉醇、多西他赛、卡巴他赛、盐酸伊立替康、羟基喜树碱、氨基喜树碱、7-乙基-10-羟基喜树碱、盐酸拓扑替康、勒托替康(Lurtotecan)、托泊替康、贝洛替康、顺铂、卡铂、奥沙利铂、奈达铂(Nedaplatin)、络铂(Lobaplatin)、赛特铂(Satraplatin)、米铂、戊铂、Aroplatin(L-NDDP)、卡氮芥、苯丁酸氮芥、美法仑、三尖杉酯碱、高三尖杉酯碱、雷公藤甲素、他克莫司、盐酸阿霉素、柔红霉素、平阳霉素、盐酸多柔比星、伊达比星、氟尿嘧啶、阿糖胞苷、甲氨蝶呤、磷酸依托泊甙、去氧鬼臼毒素、石杉碱甲、酒石酸长春瑞滨、硫酸长春新碱、硫酸长春碱、异长春花碱、硫酸长春地辛、替莫唑胺、替加氟、环磷酰胺、异环磷酰胺、达卡巴嗪、埃博霉素A、埃博霉素B、埃博霉素C、埃博霉素D、埃博霉素E、埃博霉素F、硼替佐米、盐酸吉西他滨、磷酸氟达拉滨、卡陪他滨、地西他滨、培美曲塞二钠、索拉菲尼、重组人干扰素a2b、阿拉伯糖苷胞嘧啶、全反式维甲酸、白介素-2、足叶乙苷、胸核苷酸合酶抑制剂、米托蒽醌、米诺地尔、阿奇霉素、盐酸表柔比星、盐酸多柔比星(阿霉素)、盐酸氨柔比星、5-氨基酮戊酸(5-ALA)、吉非替尼、伊马替尼、厄罗替尼、苏尼替尼、达沙替尼、拉帕替尼、阿西替尼、阿帕替尼、尼罗替尼、伯舒替尼、凡德他尼、替拉替尼、来那替尼、卡纽替尼、卡奈替尼、塞卡替尼、奥替尼啶、奥克太啶、索拉菲尼、埃克替尼、木利替尼、来他替尼、坦度替尼、多韦替尼、3’,5’-环胞苷二棕榈酸酯和莪术醇中的一种或多种。
所述的抗真菌药物较佳地为两性霉素B、庆大霉素、吲哚美辛、青霉素G、硝酸益康唑、氟胞嘧啶、氟康唑、伊曲康唑、伏立康唑、泊沙康唑、雷夫康唑、卡泊芬净、米卡芬净、阿尼芬净、头孢匹胺钠、头孢噻肟钠、头孢曲松、头孢哌酮、头孢妥仑匹酯、头孢西丁钠、头孢氨苄、头孢呋辛钠、头孢克肟、头孢泊肟、头孢甲肟、头孢地嗪、头孢磺啶、头孢唑南、头孢唑肟、头孢他美酯、头孢特仑酯、头孢布坦、头孢地尼、头孢孟多、头孢替安、头孢雷特、头孢尼西、头孢他啶、头孢拉定、头孢丙烯、头孢唑林钠、头孢羟氨苄、头孢噻吩、头孢硫脒、头孢噻啶、头孢乙氰、头孢替唑、头孢匹林、头孢匹罗、头孢克定、头孢吡肟、夫西地酸钠、氟苯尼考和替加环素中的一种或多种。
所述的抗病毒药物较佳地为利巴韦林、阿昔洛韦、阿糖胞苷、碘苷、无环鸟苷、无环鸟苷月桂酸酯、无环鸟苷棕榈酸酯、碘脱氧尿苷、环胞苷、环胞苷二棕榈酸酯、磷酸甲酸盐、磷酸醋酸盐、西米替丁、双嘧哒莫、利福平、异烟肼、吡喹酮、强力霉素、沙奎那韦、茚地那韦、利托那韦、奈非那韦、安普那韦、替普那韦、BMS232632、拉米夫定、齐多夫定、去羟肌苷(didanosine,ddi)、扎西他滨(zalcitabine,ddc)、司他夫定(stavudine,d4t)、阿巴卡韦(abacavir)、阿迪佛韦(adefovirdipivoail,pmea)、替诺佛韦(tenofovir,pmpa)、氟代拉米夫定(ftc)、奈韦拉平(nevirapine)、地拉韦啶(delavirdine)、依法韦司(efavirens)、白细胞介素2(il-2)、替米考星和地克珠利中的一种或多种。
所述的抗生素较佳地为青霉素、青霉素V、阿莫西林、氨苄西林、苯唑西林、氯唑西林、普鲁卡因青霉素、苄星青霉素、哌拉西林、美洛西林、替卡西林、阿洛西林、美西林、羧苄西林、磺苄西林、呋布西林、萘夫西林、双氯西林、匹氨西林、阿帕西林、阿扑西林、匹美西林、甲氧西林、仑氨西林、福米西林、氟氯西林、卡那霉素、那他霉素、丝裂霉素、丁胺卡那霉素、泰乐菌素、维替泊芬(Verteporfin)、头孢匹胺钠、硫酸奈替米星、阿奇霉素、氧氟沙星、环丙沙星、依诺沙星、洛美沙星、培氟沙星、芦氟沙星、司氟沙星、氟罗沙星、莫西沙星、格帕沙星、曲伐沙星、淋沙星、吉米沙星、加替沙星、妥舒沙星、帕珠沙星、司帕沙星、克拉霉素、克林霉素、多粘菌素、妥布霉素、万古霉素、阿奇霉素、多西环素、四环素、土霉素、米诺环素、金霉素、胍甲环素、地美环素、美他环素、依替米星、奈替米星、西索米星、阿米卡星、阿贝卡星、地贝卡星、氨曲南、美罗培南、亚胺培南、硫霉素、帕尼培南、厄他培南、新霉素、巴龙霉素和大观霉素中的一种或多种。
所述的钙离子拮抗剂较佳地为尼莫地平、硝苯地平、尼卡地平、尼群地平、维拉帕米、硝苯地平、氨氯地平、地尔硫卓、氟桂利嗪、普尼拉明、加洛帕米和噻帕米中的一种或多种。
所述的非甾体抗炎药较佳地为吲哚美辛、阿司匹林、对乙酰氨基酚、萘普生、双氯芬酸、布洛芬、尼美舒利、罗非昔布和塞来昔布中的一种或多种。
所述的免疫抑制剂较佳地为环孢素、前列地尔(又称前列腺E-1)、环孢菌素、他克莫司、雷帕霉素、霉酚酸酯和咪唑立宾中的一种或多种。
所述的麻醉剂较佳地为地氟烷、七氟烷、异氟烷、恩氟烷、氟烷、丙泊酚、芬太尼、乌拉坦、利多卡因、普鲁卡因、丁卡因、布比卡因、戊巴比妥钠、水合氯醛、氯胺酮、氯醛糖和吗啡中的一种或多种。
所述的心脑血管及血管扩张药物较佳地为达比加群酯、阿格列汀、藻酸双酯钠、银杏内酯、银杏黄酮、银杏提取物、细辛脑、奥美沙坦酯、瑞格列奈、硫辛酸、灯盏花素、乌拉地尔、烟酸、卡托普利、氯沙坦、葛根素、丹参酮IIA、盐酸沙格雷酯、氟伐他汀、普伐他汀、辛伐他汀、洛伐他丁、辛伐他汀、美伐他汀、西立伐他汀、罗伐他汀、阿托伐他汀钙和瑞苏伐他汀钙中的一种或多种。
所述的肠胃药物较佳地为奥美拉唑、兰索拉唑、艾普拉唑、半托拉唑、雷贝拉唑、特拉唑嗪、埃索美拉唑、泰妥拉唑、莱米诺拉唑、提那拉唑、二硫拉唑和拉呋替丁中的一种或多种。
所述的抗抑郁药物较佳地为阿戈美拉汀、氟西汀、帕罗西汀、度洛西汀、舍曲林、氟伏沙明、西酞普兰、艾司西酞普兰、文拉法辛、米氮平、丙咪嗪、阿米替林、氯丙咪嗪、多虑平、瑞美隆、万拉法新、苯乙肼、异卡波肼和反苯环丙胺中的一种或多种。
所述的化妆品中的活性物质一般是指化妆品中具有营养、改善皮肤状况和预防皮肤疾病的功效的活性物质,较佳地为熊果酸、超氧化物歧化酶(SOD)、生物蛋白T4N5、维生素D2、烟酸甲酯、精制蛇油、透明质酸、精油和神经酰胺中的一种或多种。
所述的具有保健作用的物质可为本领域常规的具有保健作用的物质,较佳地为甘草甜素、甘草酸、甘草酸二钠盐、甘草酸甲酯、甘草酸二胺、维生素E、白藜芦醇、辅酶Q10、水飞蓟素、花青素、原花青素、叶黄素、叶酸、亚叶酸、姜黄素、大黄素、茶多酚、表没食子儿茶素没食子酸酯(EGCG)、儿茶素、蓝莓提取物、谷胱甘肽和氧化苦参碱中的一种或多种。
所述的多聚核苷酸或寡核苷酸是指由A、T、C、G、U等碱基分别组成的具有遗传等功能的片段,例如SiRNA、反义核酸或小胶质细胞NLRP3基因的RNAi序列。
所述的生物制剂较佳地为本领域常规的单抗类药物、胰岛素、丙种球蛋白、抗毒血清、干扰素、白介素、肿瘤坏死因子、皮肤活性因子、表皮生长因子、流感疫苗、甲肝疫苗、抗癌疫苗、重组人酸性成纤维细胞生长因子、血管内皮生长因子2单克隆抗体(VEGFR-2单克隆抗体)。
本发明还提供了一种负载活性物质的脂质体的制备方法,其为下列任一方法:
方法一包括下列步骤:将如前所述的空白脂质体中,除冻干保护剂以外的所有原料组分与所述的活性物质混合后,按照如上所述的空白脂质体的制备方法进行制备即可;
方法二包括下列步骤:将如前所述的空白脂质体,与活性物质和冻干保护剂水溶液的混合溶剂混合,得一负载活性物质的脂质体的水溶液,干燥,即可制备得到负载活性物质的脂质体;
方法三包括下列步骤:将所述空白脂质体的原料组分,与活性物质和第一冻干保护剂水溶液的混合溶剂混合,超声处理,除去有机溶剂,得一胶状物;然后将所述的胶状物与第二冻干保护剂水溶液混合,除去游离活性物质,得一负载活性物质的脂质体的水溶液,干燥,即可制备得到负载活性物质的脂质体。
上述方法中,所述的活性物质的用量可为本领域常规的用量,较佳地,所述的活性物质与所述的甘草酸类化合物的质量比为1∶0.1-1∶10,更佳地为1∶2-1∶6。
方法一中,各条件均与如上所述的空白脂质体的制备方法相同。
方法二和方法三中,所述的冻干保护剂水溶液、所述第一冻干保护基水溶液和所述第二冻干保护剂水溶液中所述的冻干保护剂均同前所述。所述的冻干保护剂水溶液、所述第一冻干保护基水溶液和所述第二冻干保护剂水溶液的质量分数较佳地为1%-20%,更佳地为5%-15%,所述的百分比是指冻干保护剂的质量占冻干保护剂水溶液总质量的百分比。
方法二和方法三中,所述的混合的温度可为本领域常规的温度,一般为0℃-80℃,较佳地为10℃-80℃,更佳地为10℃-65℃。根据本领域常识,在一些情况下,为使混合温度达到80℃,需要在加热条件下进行;又或者当除冻干保护剂的所有原料组分中有对温度敏感的组分或者蛋白质类物质,一般选择在0℃下混合。所述的混合的时间可不作具体限定,较佳地为10分钟-1小时,更佳地为20分钟-40分钟(例如30分钟)。
方法二和方法三中,所述的干燥的操作可为本领域常规的操作,一般采用冷冻干燥机冷冻干燥。所述的冷冻干燥的温度和时间为本领域常规的温度和时间,可不作具体限定。
方法三中,所述的除去有机溶剂的操作可为本领域常规操作,一般减压蒸馏除去有机溶剂。其中,所述的除去有机溶剂的温度一般根据需要除去的有机溶剂进行常规选择,一般为25℃-80℃。
方法三中,所述的除去游离活性物质的操作可为本领域常规的操作,一般采用凝胶柱层析法除去。所述的凝胶柱层析法中使用的凝胶柱较佳地为葡聚糖凝胶。
为方便贮存,按照上述方法制备得到负载活性物质的脂质体的水溶液后,将其分装于西林瓶中,再干燥,然后通入气体保护(例如氩气或氮气),密封保存即可。
所述的空白脂质体或所述的负载活性物质的脂质体的粒径可为本领域常规的粒径,较佳地为30~2000nm,更佳地为30~300nm,最佳地为50~300nm。所述的负载活性物质的脂质体中,包封率较佳地为80%以上,更佳地为90%以上,最佳地为95%以上。
当所述的负载活性物质的脂质体中所述的活性物质为药物、生物制剂、多聚核苷酸、寡核苷酸或具有保健功能的物质时,所述的负载活性物质的脂质体的给药途径可为本领域常规的给药途径,较佳地为注射给药、口服给药或透皮给药,用于疾病的治疗和/或医疗保健。因此,所述的负载活性物质的脂质体通常制成注射剂、冻干注射剂、口服固体制剂、口服液、搽剂、膏剂、酊剂或气雾剂。其中所述的注射给药的方式较佳地包括:静脉注射、肌肉注射、腹腔注射、皮内注射或皮下注射途径。一般地,所述的负载活性物质的脂质体中加入到生理盐水、磷酸盐缓冲溶液或5%的葡萄糖溶液配置成注射液,用于注射给药。
所述的负载活性物质的脂质体中,当被为抗肿瘤药物时,所述的负载活性物质的脂质体一般都具有对肿瘤细胞的靶向作用、抗多药耐药作用、增效减毒和药物协同作用。
本发明中,涉及的甘草酸类化合物的具体结构如下表所示:
在不违背本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。
本发明中,室温是指10-30℃。
本发明所用试剂和原料均市售可得。
本发明的积极进步效果在于:
本发明的空白脂质体高效、安全、稳定、靶向性强、均一性好、质量稳定和可靠、制备工艺简便。同时,可用于包封药物、化妆品中的活性物质、具有保健作用的物质、生物制剂、多聚核苷酸或寡聚核苷酸,形成负载活性物质的脂质体。
附图说明
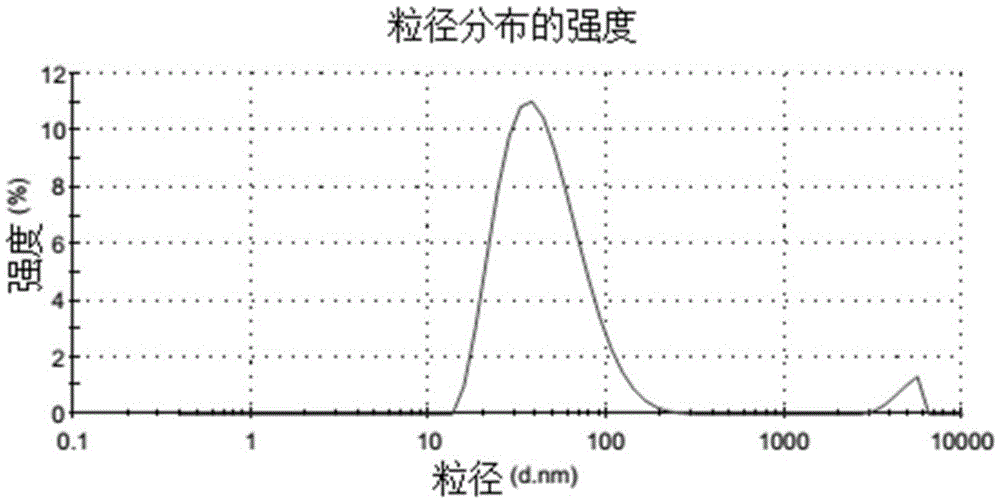
图1为实施例1制得的甘草酸空白脂质体的粒径分布图。
图2为实施例2制得的甘草酸紫杉醇脂质体的粒径分布图。
图3为实施例3制得的甘草酸紫杉醇脂质体的粒径分布图。
图4为实施例4制得的甘草酸紫杉醇脂质体的粒径分布图。
图5为实施例5制得的甘草酸紫杉醇脂质体的粒径分布图。
图6为实施例6制得的甘草酸紫杉醇脂质体的粒径分布图。
图7为实施例7制得的甘草酸紫杉醇脂质体的粒径分布图。
图8为实施例8制得的甘草酸紫杉醇脂质体的粒径分布图。
图9为实施例9制得的甘草酸+甘草酸单铵盐+甘草酸二铵盐紫杉醇脂质体的粒径分布图。
图10为实施例10制得的甘草酸二铵盐紫杉醇脂质体的粒径分布图。
图11为实施例11制得的甘草酸二钠盐紫杉醇脂质体的粒径分布图。
图12为实施例13制得的甘草酸多西他赛脂质体的粒径分布图。
图13为实施例14制得的甘草酸盐酸伊立替康脂质体的粒径分布图
图14为实施例15制得的甘草酸羟基喜树碱脂质体的粒径分布图
图15为实施例16制得的甘草酸盐酸多柔比星脂质体的粒径分布图。
图16为实施例17制得的甘草酸两性霉素B脂质体的粒径分布图。
图17为实施例18制得的甘草酸盐酸表阿霉素脂质体的粒径分布图。
图18为实施例19制得的甘草酸硫酸长春新碱脂质体的粒径分布图。
图19为实施例20制得的甘草酸奥沙利铂脂质体的粒径分布图。
图20为实施例21制得的甘草酸顺铂脂质体的粒径分布图。
图21为实施例22制得的甘草酸氟尿嘧啶脂质体的粒径分布图。
图22为实施例23制得的甘草酸常规SiRNA脂质体的粒径分布图。
具体实施方式
下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。
实施例1甘草酸空白脂质体的制备
将1g大豆卵磷脂、0.6g甘草酸、0.1g大豆油,加入20ml的甲醇中,在室温下,搅拌形成澄清溶液,在40-50℃的恒温水浴中,旋转蒸发除去有机溶剂,成膜,加入20ml的5%葡萄糖水溶液(所述的百分比是指葡萄糖的质量占葡萄糖水溶液总质量的百分比,下同),超声至脂质体颗粒在0.1-0.3微米,依次通过0.1和0.05微米的聚碳酸酯膜均质后,得一含甘草酸空白脂质体的水溶液;然后将溶液分装于西林瓶中,使每瓶含空白脂质体180mg。将上述水溶液放入冷冻干燥机中冷冻干燥72小时,通入保护性气体(氩气或氮气),密封,即得所述甘草酸空白脂质体。经检测,该脂质体的平均纳米粒径为65.99nm(具体见表1和图1)。经6个月加速稳定性实验后,溶解性、粒径均符合质量要求。
表1
实施例2甘草酸紫杉醇脂质体的制备
将1g大豆卵磷脂、0.6g甘草酸、0.3g紫杉醇,加入20ml的乙腈/甲醇(1∶1体积比)中,在室温下,搅拌形成澄清溶液,在50-60℃的恒温水浴中,旋转蒸发除去有机溶剂,成膜,加入20ml的纯化水,超声至甘草酸紫杉醇脂质体脂质体颗粒在0.1-0.3微米,依次通过0.1和0.05微米的聚碳酸酯膜均质后,得一含甘草酸紫杉醇脂质体的水溶液,然后分装于西林瓶中,使每瓶含紫杉醇30mg。将上述水溶液放入冷冻干燥机中冷冻干燥72小时,通入保护性气体(氩气或氮气),密封,即得所述甘草酸紫杉醇脂质体。经检测,该脂质体的平均纳米粒径为40.94nm(具体见表2和图2),包封率大于90%。经6个月加速稳定性实验后,溶解性、粒径和包封率均符合质量要求。
表2
实施例3甘草酸紫杉醇脂质体的制备
将0.75g蛋黄卵磷脂、0.6g甘草酸、0.2g紫杉醇、0.25g胆固醇、0.25g苏氨酸,加入20ml的甲醇中,在室温下,搅拌形成澄清溶液,在60-70℃的恒温水浴中,旋转蒸发除去有机溶剂,成膜,加入20ml质量分数为5%葡萄糖水溶液,超声至脂质体颗粒在0.1-0.3微米,通过0.22微米的微孔滤膜,得一含甘草酸紫杉醇脂质体的水溶液,然后分装于西林瓶中,使每瓶含紫杉醇30mg。将上述水溶液放入冷冻干燥机中冷冻干燥72小时,通入保护性气体(氩气或氮气),密封,即得所述甘草酸紫杉醇脂质体。经检测,该脂质体的平均纳米粒径为118.3nm(具体见表3和图3),包封率大于90%。经6个月加速稳定性实验后,溶解性、粒径和包封率均符合质量要求。
表3
实施例4甘草酸紫杉醇脂质体的制备
将8g大豆卵磷脂、6g甘草酸、1g紫杉醇、4g大豆油、2.5g维生素C,加入200ml的乙醇中,在室温下,搅拌形成澄清溶液,在60-70℃温度下,使用膜蒸发器蒸发除去有机溶剂,成膜,加入200ml质量分数为10%海藻糖水溶液,高压均质机均质至脂质体颗粒在0.1-0.3微米,通过0.22微米的微孔滤膜,得一含甘草酸紫杉醇脂质体的水溶液,然后分装于西林瓶中,使每瓶含紫杉醇30mg。将上述水溶液放入冷冻干燥机中冷冻干燥72小时,通入保护性气体(氩气或氮气),密封,即得所述甘草酸紫杉醇脂质体。经检测,该脂质体的平均纳米粒径为128.6nm(具体见图4和表4),包封率大于90%。经6个月加速稳定性实验后,溶解性、粒径和包封率均符合质量要求。
表4
实施例5甘草酸紫杉醇脂质体的制备
将7g大豆卵磷脂、6g甘草酸、2g紫杉醇、4g大豆油、2.5g胆固醇、0.5g维生素E,加入200ml的甲醇中,在室温下,搅拌形成澄清溶液,在30-40℃温度下,使用膜蒸发器蒸发除去有机溶剂,成膜,加入200ml质量分数为5%蔗糖水溶液,高压匀质机匀质至脂质体颗粒在0.1-0.3微米,通过0.22微米的微孔滤膜,得一含甘草酸紫杉醇脂质体的水溶液,然后分装于西林瓶中,使每瓶含紫杉醇30mg。将上述水溶液放入冷冻干燥机中冷冻干燥72小时,通入保护性气体(氩气或氮气),密封,即得所述甘草酸紫杉醇脂质体。经检测,该脂质体的平均纳米粒径为174.1nm(具体见表5和图5),包封率大于90%。经6个月加速稳定性实验后,溶解性、粒径和包封率均符合质量要求。
表5
实施例6甘草酸紫杉醇脂质体的制备
将8g氢化大豆卵磷脂(HSPC)、6g甘草酸、2g紫杉醇、4g大豆油、0.5g维生素E,加入200ml的乙醇中,在室温下,搅拌形成澄清溶液,在35-45℃温度下,使用膜蒸发器蒸发除去有机溶剂,成膜,加入200ml质量分数为5%甘露醇水溶液,高压匀质机匀质至脂质体颗粒在0.1-0.3微米,通过0.22微米的微孔滤膜,得一含甘草酸紫杉醇脂质体的水溶液,然后分装于西林瓶中,使每瓶含紫杉醇30mg。将上述水溶液放入冷冻干燥机中冷冻干燥72小时,通入保护性气体(氩气或氮气),密封,即得所述甘草酸紫杉醇脂质体。经检测,该脂质体的平均纳米粒径为113.3nm(具体见表6和图6),包封率大于90%。经6个月加速稳定性实验后,溶解性、粒径和包封率均符合质量要求。
表6
实施例7甘草酸紫杉醇脂质体的制备
将8g二肉豆蔻酰磷脂酰胆碱、6g甘草酸、1g紫杉醇、4g大豆油、0.1g抗坏血酸,加入200ml的乙醇中,在55-65℃下,搅拌形成澄清溶液,在60-70℃温度下,使用膜蒸发器蒸发除去有机溶剂,成膜,加入200ml质量分数为5%木糖醇水溶液,高压均质机均质至脂质体颗粒在0.1-0.3微米,通过0.22微米的微孔滤膜,得一含甘草酸紫杉醇脂质体的水溶液,然后分装于西林瓶中,使每瓶含紫杉醇30mg。将上述水溶液放入冷冻干燥机中冷冻干燥72小时,通入保护性气体(氩气或氮气),密封,即得所述甘草酸紫杉醇脂质体。经检测,该脂质体的平均纳米粒径为113.9nm(具体见表7和图7),包封率大于90%。经6个月加速稳定性实验后,溶解性、粒径和包封率均符合质量要求。
表7
实施例8甘草酸紫杉醇脂质体的制备
将2g聚乙二醇-二硬脂酰磷脂酰乙醇胺(DSPE-PEG(2000))、8g大豆卵磷脂、6g甘草酸、2g紫杉醇、4g油酸钠、0.1g丙二醇,加入200ml的甲醇中,在10-20℃下,搅拌形成澄清溶液,在40-50℃温度下,使用膜蒸发器蒸发除去有机溶剂,成膜,加入200ml质量分数为5%乳糖水溶液,高压匀质机匀质至脂质体颗粒在0.1-0.3微米,依次通过0.1和0.05微米的聚碳酸酯膜均质后,得一含甘草酸紫杉醇脂质体的水溶液,然后分装于西林瓶中,使每瓶含紫杉醇30mg。将上述水溶液放入冷冻干燥机中冷冻干燥72小时,通入保护性气体(氩气或氮气)气体,密封,即得所述甘草酸紫杉醇脂质体。经检测,该脂质体的平均纳米粒径为43.57nm(具体见表8和图8),包封率大于90%。经6个月加速稳定性实验后,溶解性、粒径和包封率均符合质量要求。
表8
实施例9甘草酸+甘草酸单铵盐+甘草酸二铵盐紫杉醇脂质体的制备
将2g聚乙二醇-二硬脂酰磷脂酰乙醇胺(DSPE-PEG(2000))、8g氢化大豆卵磷脂(HSPC)、4g甘草酸、2g甘草酸单铵盐、2g甘草酸二铵盐、2g紫杉醇、4g油酸钠、0.01g枸橼酸,加入200ml的乙醇中,在30-40℃下,搅拌形成澄清溶液,在50-60℃温度下,使用膜蒸发器蒸发除去有机溶剂,成膜,加入200ml的pH=5-6枸橼酸-磷酸氢二钠缓冲溶液,高压匀质机匀质至脂质体颗粒在0.1-0.3微米,通过0.22微米的微孔滤膜,得一含甘草酸+甘草酸单铵盐+甘草酸二铵盐紫杉醇脂质体的水溶液,然后分装于西林瓶中,使每瓶含紫杉醇30mg。将上述水溶液放入冷冻干燥机中冷冻干燥72小时,通入保护性气体(氩气或氮气),密封,即得所述甘草酸+甘草酸单铵盐+甘草酸二铵盐紫杉醇脂质体。经检测,该脂质体的平均纳米粒径为110.8nm(具体见表9和图9),包封率大于90%。经6个月加速稳定性实验后,溶解性、粒径和包封率均符合质量要求。
表9
实施例10甘草酸二铵盐紫杉醇脂质体的制备
将8g大豆卵磷脂、6g甘草酸二铵盐、1g紫杉醇、4g大豆油、0.5g维生素C,加入200ml的乙醇中,在室温下,搅拌形成澄清溶液,在60-70℃温度下,使用膜蒸发器蒸发除去有机溶剂,成膜,加入200ml质量分数为10%海藻糖水溶液,高压匀质机匀质至脂质体颗粒在0.1-0.3微米,通过0.22微米的微孔滤膜,得一含甘草酸甘草酸二铵盐紫杉醇脂质体的水溶液,然后分装于西林瓶中,使每瓶含紫杉醇30mg。将上述水溶液放入冷冻干燥机中冷冻干燥72小时,通入保护性气体(氩气或氮气),密封,即得所述甘草酸甘草酸二铵盐紫杉醇脂质体。经检测,该脂质体的平均纳米粒径为177.6nm(具体见表10和图10),包封率大于90%。经6个月加速稳定性实验后,溶解性、粒径和包封率均符合质量要求。
表10
实施例11甘草酸二钠盐紫杉醇脂质体的制备
将1g大豆卵磷脂、0.6g甘草酸二钠盐、0.3g紫杉醇、0.1g大豆油、0.01g维生素E,加入20ml的乙醇中,在室温下,搅拌形成澄清溶液,在50-60℃的恒温水浴中,旋转蒸发除去有机溶剂,成膜,加入20ml质量分数为5%葡萄糖水溶液,超声至脂质体颗粒在0.1-0.3微米,依次通过0.1和0.05微米的聚碳酸酯膜均质后,得一含甘草酸二钠盐紫杉醇脂质体的水溶液,然后将溶液分装于西林瓶中,使每瓶含紫杉醇30mg。将上述水溶液放入冷冻干燥机中冷冻干燥72小时,通入保护性气体(氩气或氮气),密封,即得所述甘草酸二钠盐2紫杉醇脂质体。经检测,该脂质体的平均纳米粒径为49.14nm(具体见表11和图11),包封率大于90%。经6个月加速稳定性实验后,溶解性、粒径和包封率均符合质量要求。
表11
实施例12甘草酸二钠盐紫杉醇脂质体肠溶胶囊的制备
将实施例11的冻干粉末装入空的肠溶胶囊中,制成甘草酸二钠盐紫杉醇脂质体肠溶胶囊,每个胶囊含有效紫杉醇30mg。
实施例13甘草酸多西他赛脂质体的制备
将0.8g大豆卵磷脂、0.6g甘草酸、0.2g多西他赛、0.4g大豆油、0.5g维生素C,加入20ml的乙醇中,在室温下,搅拌形成澄清溶液,在60-70℃温度下,使用旋转蒸发器除去有机溶剂,成膜,加入20ml质量分数为10%海藻糖水溶液,超声法超声至脂质体颗粒在0.1-0.3微米,通过0.22微米的微孔滤膜,得一含甘草酸多西他赛脂质体的水溶液,然后分装于西林瓶中,使每瓶含多西他赛20mg。将上述水溶液放入冷冻干燥机中冷冻干燥72小时,通入保护性气体(氩气或氮气),密封,即得所述甘草酸多西他赛脂质体。经检测,该脂质体的平均纳米粒径为107nm(具体见表12和图12),包封率大于90%。经6个月加速稳定性实验后,溶解性、粒径和包封率均符合质量要求。
表12
实施例14甘草酸盐酸伊立替康脂质体的制备
将0.Sg大豆卵磷脂、0.6g甘草酸、0.2g盐酸伊立替康、0.4g大豆油、0.5g维生素C,加入20ml的乙醇中,在室温下,搅拌形成澄清溶液,在60-70℃温度下,使用旋转蒸发器除去有机溶剂,成膜,加入20ml质量分数为10%海藻糖水溶液,超声法超声至脂质体颗粒在0.1-0.3微米,通过0.22微米的微孔滤膜,得一含甘草酸盐酸伊立替康脂质体的水溶液,然后分装于西林瓶中,使每瓶含盐酸伊立替康100mg。将上述水溶液放入冷冻干燥机中冷冻干燥72小时,通入保护性气体(氩气或氮气),密封,即得所述甘草酸盐酸伊立替康脂质体。经检测,该脂质体的平均纳米粒径为101.1nm(具体见表13和图13),包封率大于90%。经6个月加速稳定性实验后,溶解性、粒径和包封率均符合质量要求。
表13
实施例15甘草酸羟基喜树碱脂质体的制备
将0.Sg大豆卵磷脂、0.6g甘草酸、0.2g羟基喜树碱、0.4g大豆油、0.5g维生素C,加入20ml的乙醇中,在室温下,搅拌形成澄清溶液,在60-70℃温度下,使用旋转蒸发器除去有机溶剂,成膜,加入20ml质量分数为10%海藻糖水溶液,超声法超声至脂质体颗粒在0.1-0.3微米,通过0.22微米的微孔滤膜,得一含甘草酸羟基喜树碱脂质体的水溶液,然后分装于西林瓶中,使每瓶含羟基喜树碱10mg。将上述水溶液放入冷冻干燥机中冷冻干燥72小时,通入保护性气体(氩气或氮气),密封,即得所述甘草酸羟基喜树碱脂质体。经检测,该脂质体的平均纳米粒径为189.2nm(具体见表14和图14),包封率大于90%。经6个月加速稳定性实验后,溶解性、粒径和包封率均符合质量要求。
表14
实施例16甘草酸盐酸多柔比星脂质体的制备
将1.4g氢化大豆卵磷脂、0.6g甘草酸,加入20ml的氯仿/甲醇(v/v=1;1)中,在室温下,搅拌形成澄清溶液,在60℃温度下,使用旋转蒸发器除去有机溶剂,成膜,加入40ml 0.2mol/L的硫酸铵水溶液水化,均质法至脂质体颗粒在0.1-0.2微米,然后以质量分数为5%葡萄糖水溶液为流动相通过分子筛凝胶柱交换空白脂质体外水相,收集得到空白脂质体,再加入含有0.2g盐酸多柔比星的质量分数为5%葡萄糖水溶液,与空白脂质体在60℃温度下孵育半小时,得一含甘草酸盐酸多柔比星脂质体的水溶液,然后分装于西林瓶中,使每瓶含盐酸多柔比星10mg。将上述水溶液放入冷冻干燥机中冷冻干燥72小时,通入保护性气体(氩气或氮气),密封,即得所述甘草酸盐酸多柔比星脂质体。经检测,该脂质体的平均纳米粒径为60.58nm(具体见表15和图15),包封率大于99%。经6个月加速稳定性实验后,溶解性、粒径和包封率均符合质量要求。
表15
实施例17甘草酸两性霉素B脂质体的制备
将0.8g大豆卵磷脂、0.6g甘草酸、0.2g两性霉素B、0.4g大豆油、0.5g维生素C,加入20ml的乙醇中,在室温下,搅拌形成澄清溶液,在60-70℃温度下,使用旋转蒸发器除去有机溶剂,成膜,加入20ml质量分数为10%海藻糖水溶液,超声法超声至脂质体颗粒在0.1-0.3微米,通过0.22微米的微孔滤膜,得一含甘草酸两性霉素B脂质体的水溶液,然后分装于西林瓶中,使每瓶含两性霉素B 10mg。将上述水溶液放入冷冻干燥机中冷冻干燥72小时,通入保护性气体(氩气或氮气)气体,密封,即得所述甘草酸两性霉素B脂质体。经检测,该脂质体的平均纳米粒径为293.9nm(具体见表16和图16),包封率大于90%。经6个月加速稳定性实验后,溶解性、粒径和包封率均符合质量要求。
表16
实施例18甘草酸盐酸表阿霉素脂质体的制备
将2g大豆卵磷脂、0.6g甘草酸、0.5g维生素C,加入20ml的乙醇中,在室温下,搅拌形成澄清溶液,在60-70℃温度下,使用旋转蒸发器除去有机溶剂,成膜,加入20ml200mmol/L的硫酸铵水溶液水化,超声法超声至脂质体颗粒在0.1-0.3微米,然后以质量分数为5%葡萄糖水溶液为流动相通过分子筛凝胶柱交换空白脂质体外的水相,收集得到空白脂质体,再加入含有0.2g盐酸表阿霉素的质量分数为5%葡萄糖水溶液,与空白脂质体在60℃温度下孵育半小时,过0.22微米的微孔滤膜,得一含甘草酸盐酸表阿霉素脂质体的水溶液,然后分装于西林瓶中,使每瓶含盐酸表阿霉素10mg。将上述水溶液放入冷冻干燥机中冷冻干燥72小时,通入保护性气体(氩气或氮气),密封,即得所述甘草酸盐酸表阿霉素脂质体。经检测,该脂质体的平均纳米粒径为68.39nm(具体见表17和图17),包封率大于98%。经6个月加速稳定性实验后,溶解性、粒径和包封率均符合质量要求。
表17
实施例19甘草酸硫酸长春新碱脂质体的制备
将0.8g大豆卵磷脂、0.6g甘草酸、0.2g硫酸长春新碱、0.4g大豆油、0.5g维生素C,加入20ml的乙醇中,在室温下,搅拌形成澄清溶液,在60-70℃温度下,使用旋转蒸发器除去有机溶剂,成膜,加入20ml质量分数为10%海藻糖水溶液,超声法超声至脂质体颗粒在0.1-0.3微米,通过0.22微米的微孔滤膜,得一含甘草酸硫酸长春新碱脂质体的水溶液,然后分装于西林瓶中,使每瓶含硫酸长春新碱1mg。将上述水溶液放入冷冻干燥机中冷冻干燥72小时,通入保护性气体(氩气或氮气),密封,即得所述甘草酸硫酸长春新碱脂质体。经检测,该脂质体的平均纳米粒径为76.88nm(具体见表18和图18),包封率大于90%。经6个月加速稳定性实验后,溶解性、粒径和包封率均符合质量要求。
表18
实施例20甘草酸奥沙利铂脂质体的制备
将0.8g大豆卵磷脂、0.6g甘草酸、0.2g奥沙利铂、0.4g大豆油、0.5g维生素C,加入20ml的乙醇中,在室温下,搅拌形成澄清溶液,在60-70℃温度下,使用旋转蒸发器除去有机溶剂,成膜,加入20ml质量分数为10%海藻糖水溶液,超声法超声至脂质体颗粒在0.1-0.3微米,通过0.22微米的微孔滤膜,得一含甘草酸奥沙利铂脂质体的水溶液,然后分装于西林瓶中,使每瓶含奥沙利铂50mg。将上述水溶液放入冷冻干燥机中冷冻干燥72小时,通入保护性气体(氩气或氮气),密封,即得所述甘草酸奥沙利铂脂质体。经检测,该脂质体的平均纳米粒径为191.7nm(具体见表19和图19),包封率大于90%。经6个月加速稳定性实验后,溶解性、粒径和包封率均符合质量要求。
表19
实施例21甘草酸顺铂脂质体的制备
将0.8g大豆卵磷脂、0.6g甘草酸、0.2g顺铂、0.4g大豆油、0.5g维生素C,加入20ml的乙醇中,在室温下,搅拌形成澄清溶液,在60-70℃温度下,使用旋转蒸发器除去有机溶剂,成膜,加入20ml质量分数为10%海藻糖水溶液,超声法超声至脂质体颗粒在0.1-0.3微米,通过0.22微米的微孔滤膜,得一含甘草酸顺铂脂质体的水溶液,然后分装于西林瓶中,使每瓶含顺铂30mg。将上述水溶液放入冷冻干燥机中冷冻干燥72小时,通入保护性气体(氩气或氮气),密封,即得所述甘草酸顺铂脂质体。经检测,该脂质体的平均纳米粒径为73.96nm(具体见表20和图20),包封率大于90%。经6个月加速稳定性实验后,溶解性、粒径和包封率均符合质量要求。
表20
实施例22甘草酸氟尿嘧啶脂质体的制备
将0.8g大豆卵磷脂、0.6g甘草酸加入20ml的氯仿/甲醇(体积比1∶1)中,将20ml含有0.2g氟尿嘧啶的10%海藻糖水溶液加入上述溶液中,在超声波仪中超声处理5min,然后于45℃温度下减压除去有机溶剂,得到一种稠厚的胶状物,再加20ml 10%海藻糖水溶液,将所得脂质体通过葡聚糖凝胶柱除去游离药物,得一含甘草酸氟尿嘧啶脂质体的水溶液,然后分装于西林瓶中,使每瓶含氟尿嘧啶250mg。将上述水溶液放入冷冻干燥机中冷冻干燥72小时,通入保护性气体(氩气或氮气),密封,即得所述甘草酸氟尿嘧啶脂质体。经检测,该脂质体的平均纳米粒径为69.09nm(具体见表21和图21),包封率大于90%。经6个月加速稳定性实验后,溶解性、粒径和包封率均符合质量要求。
表21
实施例23甘草酸常规SiRNA脂质体的制备
将0.8g大豆卵磷脂、0.6g甘草酸、0.2g常规SiRNA、0.4g大豆油、0.5g维生素C,加入20ml的乙醇中,在室温下,搅拌形成澄清溶液,在60℃-70℃温度下,使用旋转蒸发器除去有机溶剂,成膜,加入20ml质量分数为10%海藻糖水溶液,超声法超声至脂质体颗粒在0.1-0.3微米,通过0.22微米的微孔滤膜,得一含甘草酸常规SiRNA脂质体的水溶液,然后分装于西林瓶中,使每瓶含常规SiRNA20mg。将上述水溶液放入冷冻干燥机中冷冻干燥72小时,通入保护性气体(氩气或氮气),密封,即得所述甘草酸常规SiRNA脂质体。经检测,该脂质体的平均纳米粒径为110.9nm(具体见表22和图22),包封率大于90%。经6个月加速稳定性实验后,溶解性、粒径和包封率均符合质量要求。
表22
实施例24甘草酸二钠盐空白脂质体的制备
将lg大豆卵磷脂、0.6g甘草酸二钠盐、0.1g大豆油,加入20ml的氯仿/甲醇(体积比1∶1)中,在室温下,搅拌形成澄清溶液,在40℃-50℃的恒温水浴中,旋转蒸发除去有机溶剂,成膜,加入20ml的5%葡萄糖水溶液(所述的百分比是指葡萄糖的质量占葡萄糖水溶液总质量的百分比),超声至脂质体颗粒在0.1-0.3微米,通过0.22微米的微孔滤膜,得一含甘草酸二钠盐空白脂质体的水溶液;然后将溶液分装于西林瓶中,使每瓶含脂质体180mg。将上述水溶液放入冷冻干燥机中冷冻干燥72小时,通入保护性气体(氩气或氮气),密封,即得所述甘草酸二钠盐空白脂质体。
实施例25甘草酸卡巴他赛脂质体
将0.8g大豆卵磷脂、0.6g甘草酸、0.2g卡巴他赛、0.4g大豆油、0.5g维生素C,加入20ml的乙醇中,在室温下,搅拌形成澄清溶液,在60℃-70℃温度下,使用旋转蒸发器除去有机溶剂,成膜,加入20ml质量分数为10%海藻糖水溶液,超声法超声至脂质体颗粒在0.1-0.3微米,通过0.22微米的微孔滤膜,得一含甘草酸卡巴他赛脂质体的水溶液,然后分装于西林瓶中,使每瓶含卡巴他赛250mg。将上述水溶液放入冷冻干燥机中冷冻干燥72小时,通入保;护性气体(氩气或氮气),密封,即得所述甘草酸卡巴他赛脂质体。
- 还没有人留言评论。精彩留言会获得点赞!