一种基于光动力疗法和化学疗法的联合肿瘤靶向治疗系统的制作方法
本发明属于药物制剂领域,涉及一种针对多药耐药肿瘤的靶向纳米递释系统及其构建方法和应用,具体涉及一种基于光动力疗法和化学疗法的联合肿瘤靶向治疗系统及其构建方法。本发明以三嵌段共聚物为载体材料,将光敏剂采用化学键合的方法嵌合在纳米材料上,制备纳米粒,然后再包载化疗药物,并在纳米粒表面修饰具有肿瘤细胞和肿瘤新生血管特异性靶向作用以及细胞穿透作用的f3肽,构建靶向双载药递送系统,实现对肿瘤部位光动力和化疗相结合的靶向治疗。
背景技术:
实践显示,多药耐药现象已严重制约了传统化学疗法在肿瘤治疗中的功效,研究显示,其主要作用机制与肿瘤细胞中的药物转运蛋白、应激反应蛋白以及抗凋亡因子有关,在这些引起肿瘤多药耐药的机制中,属于药物转运蛋白的p糖蛋白(p-gp)起着主导作用。临床上广泛应用的广谱性抗肿瘤药物紫杉醇(ptx)是p-gp的底物,在临床化疗中常产生多药耐药现象,从而严重影响了抗肿瘤治疗效果。
光动力疗法(pdt)是一种基于光敏剂、氧和一定波长的光照三者之间相互作用的治疗方法;经特殊光源照射后,光敏剂和氧相互作用产生的单线态氧不仅能够直接杀灭肿瘤细胞,而且能够氧化破坏溶酶体等酸性内含体的膜进而释放出被其吞噬的纳米药物载体,促进药物的溶酶体逃逸。诸多研究表明,pdt具有“光内化作用”,联合化疗可以有效解决多药耐药问题。p糖蛋白(p-gp)外排和溶酶体等酸性细胞器降解可以导致抗癌药物在肿瘤细胞内部积蓄量减少,进而诱导耐药性的产生;而pdt产生的单线态氧能有效抑制由p-gp介导的药物外排,同时破坏内体和溶酶体的脂膜结构,促进化疗药物从酸性细胞器逃逸,从而显著增强化疗效果。基于此,有研究将光敏剂与化疗药物共同载于相同纳米系统中,以达到光动力疗法与化学疗法的协同治疗作用;针对此,较为常见的方案是将光敏剂与化疗药物共同包载于纳米粒的疏水核心,然而,采用此种策略会使光敏剂和化疗药物同时争夺纳米粒的疏水内核而使两者的载药量和包封率均降低;另外,大多光敏剂极度疏水,与纳米粒的相容性较差,在血浆中易泄漏,这不仅减少了光敏剂在肿瘤部位的聚集,而且会对正常组织产生毒副作用。因此,如何构建具有高载药量以及安全稳定的纳米递药系统成为联合疗法的关键。
光敏剂焦脱镁叶绿酸-a(ppa)具有优良的光动力学特性,但由于水溶性较差,限制了其的广泛应用;本课题组曾将ppa和ptx同时物理包载在可生物降解的聚乳酸(pla)纳米粒中,但是共包载的包封率和载药量均低,且稳定性差。基于现有技术的现状,本申请的发明人拟提供一种靶向双载药递送系统及构建方法,尤其是构建具有高载药量以及安全稳定的纳米递药系。
技术实现要素:
本发明的目的是提供涉及一种针对多药耐药肿瘤的靶向纳米递释系统及其构建方法和应用。尤其涉及一种能够靶向肿瘤组织同时递送载光敏剂和化疗药物达到联合治疗效果的新型纳米递送系统及其构建方法。本发明的纳米递送系统能实现光敏剂和化疗药物的高效包载及稳定递释。
本发明采用化学键合的方法将具有光动力治疗特性的光敏剂焦脱镁叶绿酸a(ppa)键合在共聚物羟基化-聚乳酸-聚羟基乙酸(ho-pla-peg-pla-oh)的两端,得到产物光敏剂嵌合的聚乳酸-聚羟基乙酸聚合物(ppa-pla-peg-pla-ppa),然后采用乳化溶媒蒸发法物理包载广谱性化疗药物紫杉醇(ptx)制备成双载药纳米递释系统(ppanp-ptx);为了提高递药系统对肿瘤组织的亲和性,降低其在正常部位蓄积而产生的毒副作用,在ppanp-ptx的表面进一步修饰具有肿瘤细胞和肿瘤新生血管特异性靶向作用以及细胞穿透作用的f3肽,制成具有双级靶向特性的光动力和化疗联合给药纳米递释系统。
本发明中,制得的ho-pla-peg-peg-pla-oh的分子量为20000-50000da;
所制备的纳米递释系统粒径在800-200nm之间,具有良好的分布系数和外观形态。
本发明中,用于构建纳米递释系统的材料含有马来酰亚胺-聚乙二醇-聚乳酸(mal-peg-pla),利用其官能团中的马来酰亚胺与功能靶向多肽中的巯基反应,从而对纳米载体进行修饰,使其具备主动靶向能力。
本发明中,mal-peg-pla的分子量为20000-50000da。
本发明以三嵌段共聚物为载体材料,将较难包载在纳米载体内部的光敏剂采用化学键合的方法嵌合在纳米材料上,制备纳米粒,然后再包载化疗药物,并在纳米粒表面修饰具有肿瘤细胞和肿瘤新生血管特异性靶向作用以及细胞穿透作用的f3肽,实现对肿瘤部位光动力和化疗相结合的靶向治疗。
本发明中,所述三嵌段共聚物为焦脱镁叶绿酸a-聚乳酸-聚乙二醇-聚乳酸-焦脱镁叶绿酸a(ppa-pla-peg-pla-ppa),其通过ppa中的羧基与ho-pla-peg-pla-oh之间的酯化反应合成制得。
本发明中,采用化学方法将两端羟基化的ho-pla-peg-pla-oh与光敏剂中的羧基酯化偶联,将其作为纳米材料制备纳米粒再包载化疗药物,以解决同时高效包载化疗药物和光敏剂的难题;本发明采用f3肽对纳米粒的表面进行修饰,使其能高度靶向在肿瘤细胞和肿瘤新生血管内皮细胞上均高表达的核仁素,因此f3肽的修饰能够实现特异性的肿瘤部位双级靶向递药。
本发明中,光动力疗法中采用的是光敏剂焦脱镁叶绿酸a,其具有优良的光动力学特性,其激发波长为660nm;
本发明中,化学疗法采用的是广谱性抗肿瘤药物紫杉醇,该紫杉醇为抗微管药物,其通过促进微管蛋白聚合抑制解聚,保持微管蛋白稳定,抑制细胞有丝分裂;
本发明中,连接光敏剂的聚乙二醇-聚乳酸嵌段共聚物通过乳化溶媒蒸发法制备粒径在100nm左右的纳米粒,能够有效包载化疗药物紫杉醇而不降低其载药量;本发明中该系统称之为焦脱镁叶绿酸-a—聚乳酸纳米粒(ppanp-ptx),其中,化疗药物、光敏剂-聚乳酸连接物共同组成纳米粒的疏水内核;peg链段构成亲水外壳,能避免体内网状内皮系统的吞噬,显著延长纳米粒在血浆中的半衰期。
本发明中,为进一步提高ppanp-ptx的主动靶向效率和肿瘤细胞内化能力,采用一种高效的肿瘤靶向配体f3肽进行纳米粒表面修饰;所述的f3肽是由31个氨基酸组成的人类高迁移组蛋白2n端肽段,其能与新生血管内皮细胞和肿瘤细胞表面标志分子—核仁素高特异性结合;所述f3多肽的完整氨基酸序列为:ckdepqrrsarlsakpappkpepkpkkapakk,
本发明所述的f3肽具有肿瘤靶向特性,其能靶向肿瘤细胞,以及与新生血管内皮细胞高效结合,该f3肽与靶细胞特异性结合后具有细胞膜穿透特性,能显著提高递释系统的靶向效率。
本发明制备的给药纳米递释系统,进行了体内外实验,结果表明,对耐药肿瘤细胞具有强大的杀伤作用,体内肿瘤靶向效果明显,对荷多药耐药肿瘤小鼠的治疗效果显著。
本发明中采用光动力学性质良好的ppa与广谱性化疗药物ptx作为模型药物,两种物质均可市场获得,利用两者不同的抗肿瘤机制能够达到逆转肿瘤的多药耐药性,最终实现协同治疗的效果。
本发明中以人脐静脉内皮细胞(huvec)作为肿瘤新生血管内皮细胞模型,以p-gp高表达的人结直肠癌细胞(hct-15)作为耐药肿瘤细胞模型,此两种细胞均为本领域所公认且熟知。
本发明通过体外细胞摄取,体内特异性靶向实验表明,该递药系统能够特异性的被hct-15细胞和huvec细胞所摄取;通过活体成像技术显示,所制备的双载药纳米粒在肿瘤部位具有特异性的聚集行为;细胞毒性和荷瘤动物模型的药效学评价验证了本发明中的联合疗法能够高效逆转肿瘤的多药耐药性,取得了十分显著的抗肿瘤效果。
本发明提供了共聚物的合成路线以及双载药纳米递药系统的制备方案,并提供了该递释系统的表征结果、体内外靶向性实验的结果以及药效学的评价。
本发明所构建的纳米递释系统的给药方式为静脉注射方式,除能够应用于本发明中的结直肠癌外,同时还适用于乳腺癌、黑色素瘤、肺癌等多种实体耐药肿瘤的治疗。
附图说明
图1是纳米递释系统的表征,
其中,图a、b分别是ppanp-ptx和f3-ppanp-ptx的粒径图。
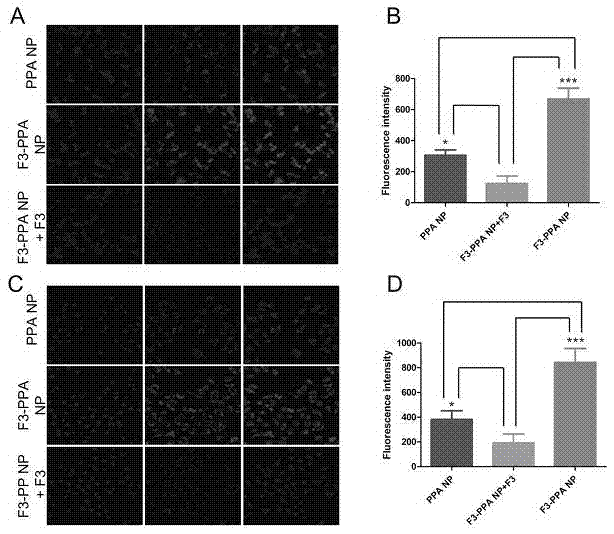
图2是hct-15细胞和huvec细胞对递释系统的摄取考察,
其中,图a、b是hct-15细胞摄取ppanp-ptx和f3-ppanp-ptx的定性和定量结果,图c、d是huvec细胞摄取ppanp-ptx和f3-ppanp-ptx的定性和定量结果。
图3是纳米递送系统的体外细胞毒性考察,
其中,图a、b分别是huvec细胞和hct-15细胞经不同制剂处理后的细胞存活率,图c、d是分别考察ppanp和f3-ppanp在非光照条件下对huvec细胞和hct-15细胞的毒性作用,图e、f采用cck-8的方法分别考察递释系统对huvec细胞和hct-15细胞的增值抑制作用。
图4是对纳米递释系统的体内靶向性评价,
其中,图a中的a、b分别是ppanp-ptx和f3-ppanp-ptx在荷瘤裸鼠的体内分布图,图b中的a、b分别是ppanp-ptx和f3-ppanp-ptx在离体器官的荧光图像,图c是对ppanp-ptx和f3-ppanp-ptx在各组织器官分布的半定量分析。
图5是纳米递释系统的体内药效学评价,
其中,图a是经不同方案治疗后肿瘤的大小变化曲线,图b是观察期截止后各组肿瘤的重量大小,图c是给予治疗后各组小鼠的生存曲线。
具体实施方式
实施例1:纳米递释系统的制备和表征
采用乳化溶媒挥发法制备纳米递药系统;将22.5mg的ppa-pla-peg-pla-ppa和2.5mg的mal-peg-pla溶解于1ml二氯甲烷溶液,并加入ptx使其浓度为0.5mg/ml,随后加入2ml1%的胆酸钠溶液;冰水浴中超声2.4min(间隔时间2s,功率为240w),8ml0.5%胆酸钠溶液分散5min。旋转蒸发除去二氯甲烷后,在4ºc条件下,14500rpm离心1h,即得普通双载药纳米粒(ppanp-ptx);具有靶向功能递药系统的制备是在普通纳米粒的基础上,通过多肽中的巯基(-sh)和纳米粒表面的马来酰亚胺基(-mal)共价连接而成,避光反应6h。制得的纳米粒4ºc保存,以备后续使用;纳米粒的表征采用透射电子显微镜观察其形态,采用马尔文粒径测定仪测定纳米粒的粒径;
结果显示:ppanp-ptx和f3-ppanp-ptx的粒径分别为109.81±3.55nm和118.25±4.43nm;表明功能性多肽的引入并没有显著性的改变纳米粒的粒径,定性图表明,两种纳米粒大小均一,形态圆整,并且没有明显的聚集现象。
实施例2:hct-15细胞和huvec细胞对递释系统的摄取考察
为了验证纳米递释系统具有肿瘤细胞和肿瘤新生血管内皮细胞的双重靶向作用;分别考察其在人脐静脉内皮细胞(huvec)和耐ptx的人结直肠癌细胞(hct-15)上的摄取行为,实施步骤为:将两种细胞以1×104cells/ml的密度接种于共聚焦皿,孵育24h后,加入1ml含有不同浓度介于50μg/ml到400μg/mlppanp-ptx或f3-ppanp-ptx的新鲜培养液,并在标准条件下共同孵育1h。然后用磷酸缓冲盐溶液(ph7.4,pbs)清洗3次,4%多聚甲醛固定,hoechst33258染核,15min后于共聚焦显微镜(lsm710,leica,germany)下观察细胞摄取的定性结果。另有对照组细胞,预先经过f3肽处理,饱和受体,再与两种纳米粒共同孵育并进行荧光检测。对于定量检测,将两种细胞以每孔5×103个的密度接种于96孔板上,24h后,分别与不同浓度介于50μg/ml到400μg/ml的ppanp和f3-ppanp共同孵育1h后,用pbs清洗3次,4%多聚甲醛固定15min,hochest33258染核15min,通过高内涵筛选仪(thermoscientific,usa)读取获得其定量结果;
结果显示:靶向多肽修饰后,纳米载体在两种细胞中的摄取行为提高十分明显,当细胞用多肽预先处理后,f3-ppanp-ptx的摄取受到明显地抑制。上述结果表明f3多肽能够介导纳米粒进入本发明中所采用的两种细胞。
实施例3:纳米递释系统的体外细胞毒性考察
取对数生长期的huvec细胞或hct-15细胞,以5000个每孔的密度接种于96孔板上,24h后,去掉孔板中的培养液,并按ptx和ppa均为100ng/ml的浓度分别加入100μl含np-ptx,ppanp,ppanp-ptx以及f3-ppanp-ptx等制剂的无胎牛血清培养液,于4%co2、37℃的条件下孵育4h后取出,用不同强度的光源(0.005j/cm2-3.0j/cm2)照射细胞,并以未给予光源照射的细胞作为对照,继续培养24h后,加入10μl的cck-8溶液。最后用酶标仪检测吸光度并计算各组细胞的存活率。结果显示,随着光照强度的增加,np-ptx组的细胞存活率没有明显变化,表明光照对细胞的活力不会产生影响。在相同光照条件下,ppanp-ptx对细胞的杀伤作用明显强于np-ptx或ppanp,表明本发明中所采用的联合治疗策略优越于化疗或光动力疗法的任何单一疗法,并且经过f3肽修饰后,对细胞的毒性得到进一步加强;
为考察纳米载体是否对细胞有毒性作用,以5000个每孔的密度接种huvec细胞或hct-15细胞于96孔板上,24h后,用含不同浓度ppa(1-1000ng/ml)的ppanp或f3-ppanp代替孔板中旧的培养液,细胞培养箱中孵育24h后加入10μl的cck-8溶液并采用上述相同方法检测细胞的存活率。结果显示:在各种浓度条件下,ppanp和f3-ppanp对两种细胞的存活率均没有明显的影响,表明本发明所构建的纳米载体具有良好的安全性;
进一步考察纳米粒对细胞的抑制增殖作用。取对数生长期的huvec细胞或hct-15细胞,以5000个每孔的密度接种于96孔板上,24h后,去掉孔板中的培养液,并按ptx1ng/ml至1000ng/ml的浓度梯度分别加入100μl含紫杉醇溶液剂taxol、ppanp-ptx以及f3-ppaptx等制剂的无胎牛血清培养液,于4%co2、37℃的条件下孵育4h后取出,用1.0j/cm2的光照强度照射后(其中ppanp-ptx平行分两组给药,一组给予光照,另一组不给予光照)继续孵育24h后加入10μl的cck-8溶液。用酶标仪检测吸光度并计算各制剂的ic50值。结果显示:各组制剂对huvec和hct-15细胞的ic50值分别为:taxol(122.1ng/ml)、ppanp-ptx(-laser,84.09ng/ml)、ppanp-ptx(+laser,41.21ng/ml)以及f3-ppanp-ptx(+laser,17.0ng/ml)和taxol(大于1000ng/ml)、ppanp-ptx(-laser,426.7ng/ml)、ppanp-ptx(+laser,86.32ng/ml)以及f3-ppanp-ptx(+laser,32.86ng/ml)。
实施例4:纳米递释系统的体内靶向性评价
荷异位结直肠癌动物模型的建立:取对数生长期的hct-15细胞,胰酶消化后离心,用适量无胎牛血清的培养液重悬细胞并使其浓度为2×106cells/ml。取4~6周、20g左右雄性balb/c裸鼠,用5%水合氯醛麻醉后,于右后肢附近接种肿瘤细胞;接种后在标准条件下饲养小鼠并仔细观察肿瘤的生长情况;
采用活体成像考察递药系统的脑肿瘤靶向性:待肿瘤生长至200~300mm3,荷瘤小鼠分别尾静脉注射一定剂量(ppa的给药剂量为2.5mg/kg)的ppanp-ptx和f3-ppanp-ptx。腹腔注射0.2ml5%水合氯醛麻醉,置于活体成像仪内,于设定的各个时间点进行荧光扫描(激发波长600nm)。注射后24h,将裸鼠处死,取出裸鼠的脏器(心、肝、脾、肺、肾以及荷肿瘤脑)进行荧光扫描(激发波长600nm),以考察纳米粒在各组织的分布并进行半定量分析;
结果显示:f3多肽修饰后的递药系统在肿瘤瘤部位明显有更强的分布效果;对组织器官的考察结果;也显示,与未修饰组相比,f3-ppanp-ptx在脑肿瘤中聚集明显,且与ppanp-ptx组在肝、脾和肺等正常组织中大量聚集相比f3-ppanp-ptx在正常组织中分布较少,表明f3肽修饰的递药系统对肿瘤具有明显的靶向作用。
实施例5:纳米递释系统的体内药效学评价
待肿瘤生长至100mm3时,荷瘤裸鼠随机分成六组,按2.5mg/kgppa或ptx的剂量给予不同制剂taxol,ppanp(+laser),ppanp-ptx(-laser),ppanp-ptx(+laser)andf3-ppanp-ptx(+laser)治疗后,在接下来的两个星期中仔细观察肿瘤的生长大小,最后取出肿瘤组织并称重比较。荷瘤小鼠的生存期考察采用相同方法进行治疗,观察给药后小鼠的生存状况,并绘制生存曲线图;
结果显示:与ppanp(+laser),ppanp-ptx(-laser)相比,ppanp-ptx(+laser)治疗组的荷瘤小鼠显示了明显的协同治疗效应,具有更强的肿瘤抑制效果;修饰f3多肽后,对肿瘤的抑制效果进一步提高;对荷瘤小鼠生存期的考察得到类似的结果,分别给予saline,taxol,ppanp(+laser),ppanp-ptx(-laser)和ppanp-ptx(+laser)后,荷瘤小鼠生存期分别为22,24,30,41和53天,而给予f3-ppanp-ptx(+laser)治疗的小鼠,在考察期内大部分均未出现死亡情况;以上结果表明,本发明中的靶向双载药纳米递释系统能够特异性的递送光敏剂和化疗药物至肿瘤组织,进而充分发挥光动力疗法和化学疗法的协同治疗作用。
sequencelisting
<110>复旦大学
<120>一种基于光动力疗法和化学疗法的联合肿瘤靶向治疗系统
<160>1
<170>patentinversion3.3
<210>1
<211>32
<212>prt
<213>f3多肽
<400>1
cyslysaspgluproglnargargseralaargleuseralalyspro
151015
alaproprolysprogluprolysprolyslysalaproalalyslys
202530
- 还没有人留言评论。精彩留言会获得点赞!