用于治疗热处理的器械和方法与流程
下列共同转让的专利申请均通过引用并入本文,且每一个均以整体并入:
2014年4月17日提交的题为用于治疗热处理的装置和方法且序列号为61/980,995(Sutermeister等)的美国专利申请。
2014年4月17日提交的题为用于治疗热处理的医疗装置且序列号为61/980,952(Sutermeister等)的美国专利申请;以及
2014年4月17日提交的题为用于治疗热输送的组合物且序列号为61/981,003(Sutermeister等)的美国专利申请;以及
2014年4月17日提交的题为用于治疗热处理的装置和方法且序列号为61/980,936(Sutermeister等)的美国专利申请。
技术领域
本发明涉及用于使用热进行治疗处理的医疗器械、系统和方法。更具体地,本发明涉及对肿瘤和其他不良组织的热处理。
背景技术:
由于未调节的细胞分裂,身体组织可能会不合意地生长或膨胀,这导致形成良性、癌前或恶性肿瘤。这样的肿瘤通常由各种治疗方法,如切除、化学疗法、放射疗法或这些方法的组合来进行处理。每个方法均具有影响其临床效用的限制。例如,在肿瘤呈现为弥漫性肿块或处于手术不可操作的位置上的情况下,切除可能是不合适的。化疗剂通常是非特异性的,因此会同时导致正常和患病细胞的死亡。放射治疗也是非特异性的并导致暴露于电离辐射的正常组织的死亡。另外,肿瘤块的核心对电离辐射或化疗剂具有相对的抗性。
通常,热疗用于与上述治疗方法一起或作为独立疗法来处理肿瘤。已知的热疗处理具有许多潜在的风险。例如,除了加热癌细胞之外,已知的热疗处理倾向于加热周围的健康细胞。根据热疗处理,对健康细胞的损伤可能至少有点分布广泛。
因此,仍然需要用具有局部聚焦的鲁棒且精确的温度控制来对肿瘤和不良组织进行有效的热处理的装置和方法。
技术实现要素:
在一些实施例中,一种导管包括导管轴、手柄部分和多个微粒。导管轴界定内腔并具有远端部分,其包括弹性孔口。弹性孔口具有闭合形态和开放形态。手柄部分界定贮存器,所述贮存器与内腔连通并存储液体组合物。在一些实施例中,液体组合物为盐溶液。微粒包括居里温度在35℃和100℃之间的金属组分。微粒被配置成行进通过内腔且在弹性孔口处于闭合形态中时具有比弹性孔口的横截面更大的横截面。
在一些实施例中,可植入治疗器械具有金属部分、第一热塑性聚合物部分和治疗药物。金属部分具有居里温度。第一热塑性聚合物部分至少部分地包住治疗药物且具有小于金属部分的居里温度的熔点,其中将金属部分加热至居里温度使第一热塑性聚合物部分熔化并释放出药物。
在一些实施例中,微粒包括内部和围绕内部的外部。内部包括生物相容性聚合物和/或生物相容性陶瓷以及多个居里温度在40℃和100℃之间的磁性纳米粒子。外部包括生物相容性聚合物和/或生物相容性陶瓷以及多个不透射线的纳米粒子。
在一些实施例中,一种处理在体腔或内腔内部的医疗状况的方法包括将第一多个微种插入体腔或内腔中。第一多个微种的微种具有1-30微米的直径和在30℃和440℃之间的居里温度。该方法还包括在第一多个微种之后将第二多个微种插入体腔或内腔中。第二多个微种的微种具有30微米至1000微米的直径和在30℃和440℃之间的居里温度。第一多个微种被配置成在体腔或内腔内执行不同于第二多个微种的功能。
上面有关一些实施例的概述并不旨在描述本发明的每个所公开的实施例或每个实施方式。下面的附图及具体实施方式更具体地举例说明了这些实施例。
附图说明
下面具体参照附图对本发明进行了详细描述。
图1为微粒的一个实施例的截面视图;
图2A和2B为分别在闭合形态和开放形态中的可植入治疗器械的一个实施例的截面视图;
图3A和3B为分别在闭合形态和开放形态中的可植入治疗器械的一个实施例的截面视图;
图4示出可植入治疗器械的一个实施例;
图5示出可植入治疗器械的一个实施例;
图6-8为用于输送可植入治疗器械的导管的示意图;
图9示出在体腔内的图6所示的导管的示意图;
图10示出在体腔内的图7所示的导管的示意图;
图11示出图6所示的导管的一部分的详细示意图;
图12示出组织部位的详细示意图;
图13A和13B示出随时间施加至可植入治疗器械的射频(RF)脉冲;
图14示出在身体组织中的可植入治疗器械;以及
图15示出用于将信号输送至图14所示的可植入治疗器械的分布式天线阵列。
虽然本发明可被修正成各种修改和替代形式,但是在附图中以示例方式示出的细节仍将进行详细描述。然而,应理解的是本发明并不旨在将本发明限制为所述的特定实施例。相反地,本发明旨在涵盖落在本发明的精神和范围内的所有修改、等同物和替代方案。
具体实施方式
热疗提供了对肿瘤细胞的局部热处理并且与化疗和放疗相比缺乏任何累积性毒性。使用多种热疗治疗方法来进行肿瘤的处理。一种这样的方法涉及向肿瘤部位布置磁性纳米粒子。这些磁性纳米粒子具有选定的居里温度且当经受施加的交变场时产生热。尽管本发明的讨论相对于肿瘤细胞的热处理,但是可考虑本文所描述的装置和方法也可应用于其中需要热疗处理或热受控应用的解剖结构的其他部分。例如,装置和方法可以应用于解剖结构的其他部分,诸如但不限于脉管系统、神经系统、胃肠道、泌尿科、妇科等。
尽管磁性纳米粒子提供了对肿瘤的非侵入性局部加热,但是在肿瘤的体积上的磁性纳米粒子的随机和未知分布破坏了对用于处理的肿瘤的均匀加热。此外,对这种磁性纳米粒子的加热通常会在如由磁性纳米粒子的居里温度所界定的小的固定范围内提高其温度。这种受限且固定的温度范围可能不足以引发处理所需的治疗效果。
通过端点表述或公开的数值范围包括在该范围中的所有数字(例如,1至5包括1、1.5、2、2.75、3、3.80、4和5)。
如在本说明书和所附权利要求中所使用的,单数形式“一”、“一个”以及“该”包括复数对象,除非内容另外明确指出外。如在本说明书和所附权利要求中所使用的,术语“或”通常是以包括“和/或”的含义而进行使用的,除非内容另外明确指出外。
在本说明书中对“一个实施例”、“一些实施例”、“其他实施例”等的参照表示实施例包括特定的特性、结构或特征,但每个实施例可能不一定包括特定特性、结构或特征。此外,这种短语不一定是指相同的实施例。进一步地,当结合一个实施例描述特定的特性、结构或特征时,应理解的是不论是否明确地进行描述,这种特性、结构或特征也可与其他实施例结合使用,除非明确地证明或说明与此相反以外。
“居里温度”被定义为材料的永久磁性转化为感应磁性的温度或反之亦然。
“居里材料”是指基于选定的居里温度表现出磁性的那些金属或金属合金。可通过使用可以是或可以不是铁磁性的复合材料来改变居里材料的居里温度。在居里材料的掺杂、添加剂、复合材料、合金化和密度中的变化可改变居里材料的结构和行为以及居里温度。
如本文所使用的,“热固性”聚合物(例如,热固塑料)是指一旦通过化学反应(例如,共价键形成、交联等)固化(或硬化),在随后进行加热时不会软化或熔化的聚合物。
如本文所使用的,“热塑性”聚合物(例如,热塑塑料)是指当加热时软化并且在冷却时硬化的聚合物材料,且该过程是可逆的和可重复的。
如本文所使用的,粒子的“粒度”是指粒子的最大尺寸(选自长度、宽度和高度)。例如,对于球形粒子而言,最大尺寸为直径。如本文所使用的,多个粒子的“粒度”是指基于粒子的群体的粒子粒度的平均值(即,平均数)。如本文所使用的,多个粒子的“粒度范围”是指其中粒子群体中至少90%都具有在该范围中的粒度的范围,这允许合计高达10%的粒子群体位于所引用的范围之上以及位于所引用的范围之下。例如,从1纳米至100纳米的多个粒子的粒度范围是指其中粒子群体中的至少90%具有从1纳米至100纳米的粒度的多个粒子(表示小于1纳米的粒子和大于100纳米的粒子群体的总和不超过总群体的10%),其中群体中的0-10%小于1纳米且群体中的0-10%大于100纳米。
应参照附图阅读下面的详细描述,其中不同的附图中相似的元件具有相同的编号。不一定是按比例绘制的附图描述了说明性实施例且不旨在限制本发明的范围。
图1为可植入治疗器械器械100的一个实施例的截面视图。在一些实施例中,可植入治疗器械100包括微粒。在一些实施例中,可植入治疗器械100包括外部102和内部104。外部102可包围或围绕内部104。内部104包括由居里材料制成的磁性纳米粒子106。术语“磁性纳米粒子”包括反铁磁性、铁磁性和亚铁磁性粒子。在一些实施例中,磁性纳米粒子106由一种以上材料制成,以使其具有在35摄氏度(℃)和100℃之间的选定居里温度(Tc)。在一些实施例中,磁性纳米粒子具有大约为80℃的居里温度。当这些磁性纳米粒子106经受交变磁场时,磁性纳米粒子106经历了在电磁场之后的粒子的磁矩的松弛现象和粒子本身在分散介质内的机械旋转而导致的以热为形式的功率耗散。在小于居里温度的温度(T<Tc)下,磁性纳米粒子106为铁(或亚铁)磁性的,而纳米粒子106则转变为顺磁相以将纳米粒子106的温度稳定在预定的居里温度上。
在一些实施例中,磁性纳米粒子106由一种以上居里材料制成,其具有居里温度大于45℃的预定组合物。这种居里材料可用于将不良组织加热直到患者的痛阈,或者例如,如果使用减轻疼痛的药物和/或麻醉剂可以超过该痛阈。这种居里材料的组合物的实例包括70%Fe和30%Ni,其居里温度为82℃;75%Fe和具有1wt.%的Mn的25%Ni,其居里温度为78℃。在一些实施例中,磁性纳米粒子106包括居里温度为42℃至48℃的预定组合物的居里材料,例如,居里温度为45℃的砷化锰。在通过引用并入本文的于2014年4月17日同时提交的题为“用于治疗热处理的医疗装置”且序列号为61/980,952(Sutermeister等)的美国专利申请中则公开了其他合适的居里材料。另外,在2014年4月17日还提交的题为“用于治疗热输送的组合物”且序列号为61/981,003(Sutermeister等)的美国专利申请的内容通过引用并入本文。
在一个以上的实施例中,居里温度材料包括与稀土元素(例如,镧金属等)相混合(例如,组合、掺杂等)的氧化锌。在一些实施例中,稀土元素是以非零量存在的。例如,包括氧化锌的居里温度材料可以包括基于稀土元素的重量和氧化锌的重量的总和的,至少为5(例如,至少为6、至少为7、至少为8、至少为9、至少为10、至少为15)的重量百分比的稀土元素。在其中居里温度材料包括氧化锌和多于一种的稀土元素的一个以上的实施例中,基于多于一种的稀土元素的重量和氧化锌的重量的总和,稀土元素的重量百分比的总和可以是至少为5(例如,至少为6、至少为7、至少为8、至少为9、至少为10、至少为15)的重量百分比。
在一个以上的实施例中,居里温度材料包括镓、锰和氮(例如,氮化镓锰等)。在一个以上的实施例中,居里温度材料包括镓、锰和氧(例如,氧化镓锰)。在一个以上的实施例中,居里温度材料包括钆、锰和氮(例如,氮化钆锰)。在一个以上的实施例中,居里温度材料包括砷化镓、镝、钴、磁铁矿和钕中的一种以上。
在一个以上的实施例中,居里温度材料可包括由Kim等公开的组合物的磁性纳米粒子(题为“具有位于生物相容性温度范围内的居里温度的磁性纳米粒子及其制备方法”且公开号EP 2671570A2的欧洲专利)。由Kim等公开的磁性纳米粒子包括稀土金属、二价金属和过渡金属氧化物并具有在-80℃至约41℃范围内的居里温度。在本发明中,组合物可包括由Kim等(申请号为EP 2671570A2的欧洲专利)公开的居里材料中的任一种,其具有聚合物粘合剂和热界面材料,其中组合物的居里温度在约17摄氏度至约400摄氏度的范围内。这种磁性纳米粒子可由在Kim等(公开号为EP 2671570A2的欧洲专利)中公开的方法制成。
在一个以上的实施例中,居里温度材料包括选自铁(Tc=770℃)、镍(Tc=354℃)、锌(Tc=415℃)、钴(Tc=1115℃)、钆(Tc=20℃)、铬、锰、铜、镓、钇、铝、银和/或它们的合金中的至少一种元素。在一个以上的实施例中,居里温度材料可包括硼(B)、铋(Bi)、锑(Sb)、砷(As)、碳(C)、硅(Si)、硫(S)、硒(Se)、碲(Te)、锗(Ge)、铈(Ce)、钕(Nd)、铒(Er)、钬(Ho)、锶(Sr)、钛(Ti)、钙(Ca)、镧(La)和/或氧(O)。
在一个以上的实施例中,居里温度材料包括铁-钴-铬化合物,诸如(Fe65Co35)71Cr18Zr7B4(居里温度为74.5℃),其可以适合于包括生物组织消融的热输送的应用。Miller等(参见Miller等,“应用于自调节的射频加热中的Fe–Co–Cr纳米复合材料”,J.Applied Phys.,2010,107,09A313-1至09A313-3)描述了形成(Fe65Co35)71Cr18Zr7B4及其铁磁流体并对这种材料进行热检测的方法。例如:“通过在267kHz施加27.2mT的交流磁场对具有不同[磁性纳米粒子]浓度的铁磁流体进行射频加热。使用Luxtron光纤温度探针,在低温球磨的Fe–Co–Cr铁磁流体中测量温度的变化作为暴露时间的函数。使用在10ml的0.150M的Pluronic F127铁磁流体中的浓度为1.24体积%的(Fe65Co35)71Cr18Zr7B4[磁性纳米粒子],对溶液进行有效加热以在~70[秒]内达到>50℃的温度,同时在~74.5℃[]论证居里限制的自调节行为。”
在一个以上的实施例中,居里材料包括具有式Fe73.5-xCrxSi13.5Cu1B9Nb3(x=0至10)的材料,其可以是非结晶的或结晶的,或者可以是非结晶和结晶相的组合。例如,Gomez-Polo已经报道了在具有和不具有结晶及其磁性表征的情况下制备Fe73.5-xCrxSi13.5Cu1B9Nb3(x=3、7和10)。(参见Gomez-Polo等,“在FeCrSiBCuNb非结晶和纳米结晶线中加热效果(磁性热疗)的分析”,J.Applied Phys.,2012,111,07A314-1至07A314-3)。
在一个以上的实施例中,居里温度材料包括反钙钛矿化合物。例如,由Wang等,“在反钙钛矿化合物Ga1-xCMn3+x(x=0、0.06、0.07和0.08)中具有大温度跨度的可逆室温磁致热效应”,J.Applied Phys.,2009,105,083907-1至083907-5描述了具有式Ga1-xCMn3+x,其中x=0、0.06、0.07和0.08的反钙钛矿化合物。在第083904-2页,Wang等报道了用于制造化合物的实验程序并报道了这种化合物的居里温度,其是根据作为温度曲线的函数的磁性衍生物进行确定的,其被发现对于x=0、0.06、0.07和0.08来说分别为250、281.5、296.5和323.5K。在本发明中,在其中居里材料具有式Ga1-xCMn3+x的一个以上的实施例中,x的值可以是0至0.08甚或大于0.08的任何值。
在一个以上的实施例中,合适的居里温度材料包括YMn5(居里温度为216℃)、Ni(居里温度为357℃)、Gd(居里温度为19℃)、MnBi(居里温度为358℃)、MnSb(居里温度为314℃)、CrO2(居里温度为112℃)、MnAs(居里温度为45℃)、MnOFe2O3(居里温度为300℃)、Y3Fe5O12(居里温度为287℃)、铬(居里温度为113℃)、锰酸锶镧(LSM)(居里温度为75℃)以及这些组合中的一个以上。
Haik等(美国专利号7,842,281;“用于治疗热疗的磁性粒子组合物”)也公开了合适的居里温度材料,诸如基本上具有所需居里温度以及可通过施加磁场进行有效加热的任何组合物,诸如铁、镍、锌、钴、钆、锰和/或其合金、铜和镍的合金、具有71至71.4重量%的镍以及余量基本上是由铜组成的合金、具有71重量%的镍和29重量%的铜的合金、具有式ZnxMn(1-x)Fe2O4,其中x在0.6和0.8之间的Mn—Zn铁氧体、Gd取代的Mn-Zn铁氧体、具有式Mn0.5Zn0.5GdxFe(2-x)O4,其中x在0和1.5之间的铁氧体、具有Fe(1-x)ZnxFe2O4组合物,其中x在0.7和0.9之间的铁化合物、ZnFe2O4和ZnGdxFe(2-x)O4,其中x在0.01和0.8之间。参见Haik等(美国专利号7,842,281)的第5列第10-33行。Haik等(美国专利号7,842,281)在第6列第53行至第9列第11行以及在第10列第45行至第17列第14行的实例中还公开了制造这种材料的方法。
在一个以上的实施例中,居里材料包括具有或不具有铬的铁-镍化合物(例如,Fe70Ni30)。在一个以上的实施例中,居里温度材料包括铁-镍合金,其具有式FexNi1-x,其中x为0.10至0.40(例如,x可以是0.12、0.14、0.15、0.20、0.25、0.30、0.35、0.40等)。在一个以上的实施例中,FexNi1-x可具有被添加至其的锰(例如,被添加至FexNi1-x的1wt%的Mn,如当x=0.25时)。McNerny等描述了具有可调居里温度的单分散Fe-Ni磁性纳米粒子的化学合成。(参见McNerny等,“用于自调节热疗的具有可调居里温度的单分散γ-Fe–Ni磁性纳米粒子的化学合成”,J.Applied Phys.,2010,107,09A312-1至09A312-3)。例如,McNerny报道了Fe0.70Ni0.30磁性纳米粒子具有约为82℃的居里温度,该温度对于热输送来说是有用的(例如,涉及消融的医疗应用等)。在另一个实例中,McNerny报道了被添加至Fe0.75Ni0.25的1重量百分比的锰具有约为78℃的居里温度。
在本发明中,居里温度材料可具有在40℃至80℃范围内的居里温度。例如,Martirosyan已报道了在约45℃至约50℃居里温度范围内的多个居里温度材料。(参见Martirosyan,“用于自控制热疗癌症处理的热敏磁性纳米粒子”,J.Nanomed.Nanotechnol.,2012,3(6):1000e112(1-2))。例如,Martirosyan已公开了具有约为50℃的居里温度的取代铁氧体Co1-xZnxFe2O4和钇铁石榴石Y3Fe5-xAlxO12的超细氧化铝涂覆粒子(引用Giri等,“对用于热疗应用的磁性氧化物的Tc调谐的纳米粒子的研究”,Biomed.Mater.Eng.,2003,13:387-399);具有40至60℃的不同居里温度的铜镍(CuNi)合金纳米粒子,这是通过几种技术合成的(引用Kuznetsov等,“使用具有适于治疗的居里温度的CuNi纳米粒子的局部射频诱导的热疗”,J.Magn.Magn.Mater.,2007,311:197-203);具有在43-44℃范围内的居里温度的镍-铬(Ni1-xCrx)粒子,合金的居里温度随着铬浓度从4.54增加到5.9wt%几乎呈线性下降(引用Akin等,“用于自控制的磁热疗的Ni1-xCrx合金”,Crystal Research and Technology,2009,44:386-390);已研究了Gd5(Si1-xGex)4和(Gd1-xRx)5Si4系列,其中R=Ce、Nd、Er和Ho(引用Ahmad等,“基于(Gd)5Si4材料的优化:自控制热疗应用的步骤”,J.Appl.Phys.,2009,106:064701);具有约为45℃的居里温度的铁磁La0.73Sr0.27MnO3纳米粒子(粒度为20–100nm)(引用Prasad等,“用于磁性热疗的La0.73Sr0.27MnO3的TC调谐的生物相容性悬浮液”,J.Biomed.Mater.Res.B Appl.Biomater.,2008,85:409-416);具有约为43℃的居里温度的平均微晶尺寸为22nm的非聚集的La0.82Sr0.18MnO3+δ钙钛矿纳米粒子;具有式Mg1+xFe2-2xTixO4的复合铁氧体纳米粒子,(其中0≤x≤0.5)其具有在约为45-50℃范围内的居里温度(引用Shimizu等,“Mg1+xFe2-2xTixO4(x=0-0.5)系统的铁磁交换相互作用和居里温度”,J.Magn.Magn.Mater.,2007,310:1835-1837以及Martirosyan,“用于成像和热疗癌症处理的热敏纳米结构介质”,Bulletin of the American Physical Society,2001,56:1);掺杂Zn的Mn-铁氧体、Mn1-xZnxO以及掺杂Gd的Zn-铁氧体,具有调谐至约43℃的居里温度的ZnGdxFe2-xO4纳米粒子;以及由聚乙烯醇封装并通过包括溶胶凝胶燃烧和溶剂浇铸技术的两步化学反应合成的磁性纳米复合材料Ni0.2Ca0.8Gd0.08Fe1.92O4也可适用于自控制热疗(引用Prasad等,“Gd取代的NiCa铁氧体/聚乙烯醇纳米复合材料”,J.Magn.Magn.Mater.,2012,324:869-872)。
在一个以上的实施例中,居里温度材料可包括稀土水锰矿材料。在一个以上的实施例中,居里材料包括氧化镧化合物(例如,La0.8Ag0.15MnO2.95、La0.75Sr0.25MnO3、La0.8Sr0.2MnO3等)。例如,La1-xSrxMnO3-δ(LSMO)和La1-xAgyMnO3-δ(LAMO)可能是有用的。在其中居里温度材料包括La1-xAgyMnO3-δ(LSMO)的一个以上的实施例中,x可以是0.01至0.30(例如,0.20),y可以是0.01至0.30(例如,0.15)且δ可以是0.00至0.10(例如,0.05)(例如,La0.8Ag0.15MnO2.95,其已被报道为具有在约42-44℃范围内的居里温度)。(参见Atsarkin等,“以La1-xAgyMnO3-d纳米粒子实现用于热疗的生物热方程的解决方案:温度自稳定的效果”,Int.J.Hyperthermia,2009年5月;25(3):240-247)。在其中居里温度材料包括La1-xSrxMnO3-δ(LSMO)的一个以上的实施例中,x可以是0.01至0.30(例如,0.05、0.10、0.15、0.20、0.25)且δ可以是0.00至0.10(例如,0.00)(例如,La0.75Sr0.5MnO3(具有约为56℃的居里温度)、La0.8Sr0.2MnO3(具有约为48℃的居里温度)、La0.85Sr0.15MnO3等)。在一个以上的实施例中,具有约为42℃的居里温度的组合物可用于一个以上的热输送应用中(例如,对生物组织的热疗处理,其中在减少或避免对周围组织的不当的热损伤的同时要进行热的输送)。
在一个以上的实施例中,居里温度材料包括铬砷合金,诸如CrAs、CrAs50S50、CrAs50Sb50、CrAs50Se50、CrAs50Te50。
在一个以上的实施例中,组合物包括居里温度材料和辅助材料。在一个以上的实施例中,辅助材料可包括金属(例如,元素金属、金属氧化物、金属盐、合金等),其不同于居里温度材料。在一些实施例中,辅助材料可以是一种金属或可以是两种以上金属的合金。在一个以上的实施例中,辅助材料可包括少量的一种以上的非金属(例如,基于居里温度材料和一种以上的非金属的组合重量,小于5重量百分比)。在本发明中,辅助材料可包括合金,诸如铁-镍合金、镍-铜合金、铁-镍-铬合金等。在本发明中,辅助材料包括但不限于铁、钴、镍、钆、镝、MnBi、MnSb、CrO2、MnAs、EuO、Fe2O3、FeOFe2O3、NiOFe2O3、CuOFe2O3、MgOFe2O3、MnOFe2O3、Y3Fe6O12、铬、锰酸锶镧、YMn5、硅、铝、锰、ZnO和GaMnN。
在一个以上的实施例中,居里温度材料和辅助材料可形成均匀的混合物。或者,居里温度材料和辅助材料可进行混合(例如,组合、掺杂等)以形成非均匀混合物。
在一个以上的实施例中,组合物包括混合物,其包括第一居里温度材料和不同于第一居里温度材料的第二居里温度材料。在一些实施例中,第三居里温度材料可与第一和第二居里温度材料一起被包括在组合物中。用于第一、第二和第三居里温度材料中的每一种的合适材料包括任何居里温度材料,其包括但不限于在本文所公开的居里温度材料。在一个以上的实施例中,一种以上的居里温度材料的混合物表现出在约38摄氏度至约45摄氏度的范围中或在约55摄氏度至约95摄氏度的范围中的居里温度。在一些实施例中,第一和第二居里温度材料的混合物包括第一和第二居里温度材料的合金(例如,第一和第二金属居里温度材料等)。在一些实施例中,第一和第二居里温度材料的混合物包括掺杂有第二居里温度材料的第一居里温度材料。在一个以上的实施例中,第一和第二居里温度材料的混合物包括第一和第二居里温度材料的纳米复合材料(例如,采用纳米粒子等为形式的两种材料的复合材料)。
在一种以上的热输送的应用(例如,治疗性热输送)中,可能需要特定的居里温度或一个范围的居里温度。在本发明中,可考虑选择(例如,配制等)具有目标居里温度(或一个范围的居里温度)的组合物以向受试者(例如,要进行热处理的对象、要进行热处理的组织等)提供所需的温度处理。应认识到本领域的技术人员可选择具有居里温度的居里温度材料且可通过,例如,修改化学组成(例如,混合、掺杂等)、修改形状(例如,提供球形粒子,提供非球形粒子)、修改粒度和/或修改组合物的域控制以达到热输送的所需温度的方式调谐居里温度。
例如,在晶格中的粒度改变了居里温度。虽然不希望受到理论的束缚,但当粒度减小时,电子自旋的波动则变得更加显著,这导致了磁矩紊乱并降低了居里温度。例如,在超顺磁性中,磁矩随机变化,这在小的铁磁粒子中产生紊乱。例如,在一些情况下,通过将粒度减小至纳米级,比吸收率或磁吸收率可增加约10倍。
虽然不希望受到理论的束缚,纳米粒子的居里温度还受晶格结构的影响,由于对于相邻的电子自旋磁矩产生反应,体心立方(bcc)、面心立方(fcc)和六方结构(hcp)均具有不同的居里温度。例如,由于当更靠近在一起时,磁矩具有更强的效应,因此更紧密的晶格结构(例如,fcc和hcp)具有比其他晶格结构(例如,bcc)更高的居里温度。在更小的系统中,用于表面的配位数可能更加显著且磁矩可能对系统具有更强的效应。
在一些实施例中,与不具有(例如,缺乏)辅助材料的组合物相比,包括辅助材料(例如,不同于第一居里温度材料的第二居里温度材料)的组合物可具有降低的居里温度。在一个以上的实施例中,在两种以上的居里材料(例如,每一种具有大于10重量%)的一些组合中,与任一种单独材料相比,组合材料具有降低的居里温度。例如,铁和镍中的每一种具有比至少一些铁-镍合金组合物更高的居里温度。例如,虽然铁的居里温度约为770℃且镍的居里温度约为354℃,但Fe60Ni40合金的居里温度约为300℃。在一个以上的实施例中,使给定的居里温度材料与元素,如硅(Si)、铝(Al)或锰(Mn)进行合金化可产生一种混合物,其具有与给定的居里温度材料相比为降低的居里温度。
在一个以上的实施例中,组合物可包括辅助材料,其为非居里温度材料(例如,不具有居里温度)。在一个以上的实施例中,包含足够量的非居里温度材料的辅助材料可影响(例如,降低或增加)整个组合物的居里温度。
在一个以上的实施例中,可选择居里温度材料的形状以调谐材料的居里温度。例如,Iorga等(“在Fe-Cr-No-Mn合金中的低居里温度”,U.P.B.Sci.Bull.Series B,2011,73(4):195-202)在表3中公开了采用球形和环形形式的四种化学组合物的居里温度从约为1至约为5℃变化。Iorga等发现用于球形和环形样品的下列居里温度:Cr4Ni32Fe62Mn1.5Si0.5(328K对330K);Cr4Ni33Fe62.5Si0.5(393K对398K);Cr10Ni33Fe53.5Mn3Si0.5(283K对285K);Cr11Ni35Fe53.5Si0.5(339K对340K)。Iorga等的结果还例证了增加锰含量对降低居里温度的效果。在这些样品中还可以看出,增加锰含量的效果比增加铬含量的效果更强。
在一个以上的实施例中,居里温度材料可包括非零量的铬和锰。在至少一个实施例中,基于居里温度材料的重量,铬和锰的总和可以是从约4百分比至约13百分比(例如,4-6%)。在一些实施例中,包括锰和铬可以为给定量的居里温度的下降带来成本节约。
Bose等(“在闪锌矿型结构中Cr基合金中的交换相互作用和居里温度:体积和组成依赖性”,arXiv:0912.1760[cond-mat.mtrl-sci],2010年2月5日;16页)在用于采用CrX为形式,其中X=As、Sb、S、Se和Te的Cr基磷族元素化物和硫属化合物以及混合合金CrAs50X50,其中X=Sb、S、Se和Te的图17-19中公开了晶格结构和元素间隔对居里温度的影响。虽然不希望受到理论的束缚,但是晶格间隔通常是由配制控制的,这强调了配制(即,组成)对居里温度的影响。
虽然不希望受到理论的束缚,但通常磁矩的对准和材料密度影响了给定组合物的体积和表面居里温度。包含添加剂影响了组合物的晶格结构,由于添加剂对这两个特征(即,磁矩的对准和组合物的密度)的影响,这是很重要的。例如,磁矩对准的降低使散装材料的总磁性降低,从而通常会使居里温度降低。在另一个实例中,在组合物内居里温度材料的密度降低充当单独的磁矩,从而通常会降低居里温度。
在本发明中,可使用多种不同的粘合剂(例如,聚合物粘合剂、包括金属或陶瓷的非聚合物粘合剂等)中的任一种实现磁矩对准的改变。虽然不希望受到理论的束缚,但在小的居里温度元素(例如,具有纳米和/或微米级的尺寸)内,对准的偏移主要是晶格结构的函数,然而晶界也可能起作用(在更大的体结构中更为常见)。在一些实施例中,纳米复合材料可以包括高和低的体积居里温度,但是将仅表现出一个平均场居里温度。通常,较高比例的较低体积温度导致较低的平均场居里温度。在本发明中,通过形成包括居里温度材料和粘合剂(例如,聚合物、非聚合物、陶瓷、非居里温度金属材料等)的组合物,降低了居里温度材料的磁性,这降低了居里温度。
在一些实施例中,外部102包括位于内部104外面的不透射线的粒子108。如图所示,外部102可以包围不透射线的粒子108,其在一些实施例中是由金制成的。用于这些不透射线的粒子108的材料的其他实例包括但不限于二氧化钛、碱式碳酸铋、铂和硫酸钡、铂铱、铂钨或者铂、钯或金的任何其它合适的合金。不透射线的粒子可以允许使用各种技术在不良组织或肿瘤中或邻近其处检测磁性纳米粒子106的精确分布(以及同样还有密度)。例如,对患者身体的一部分进行的计算机断层成像(CT)扫描可用于查看释放或注射磁性纳米粒子106的地方。在一些实施例中,不透射线的粒子108为纳米粒子。
在一些实施例中,外部102包括代替不透射线的粒子108或除其之外的治疗药物。术语“治疗剂”、“药物”、“生物活性剂”、“药剂”、“药物活性剂”和其它相关术语在本文中可互换使用且包括遗传治疗剂、非遗传治疗剂和细胞。治疗剂可单独或结合使用。各种治疗剂可与本发明的器械结合使用,本领域的技术人员可以很轻易地确定药学有效量且其最终取决于,例如,要进行处理的状况、治疗剂本身的性质、将剂量形式导入其中的组织等。
一些特定的有益剂包括化疗剂、抗血栓剂、抗增殖剂、抗炎剂、抗迁移剂、影响细胞外基质产生和组织的试剂、抗肿瘤剂、抗有丝分裂剂、麻醉剂、抗凝血剂、血管细胞生长促进剂、血管细胞生长抑制剂、胆固醇降低剂、血管扩张剂和干扰内源性血管活性机制的试剂。
治疗药物可以是化疗剂,包括但不限于依维莫司;铂类诸如卡铂和顺铂;紫杉烷类诸如多西紫杉醇和紫杉醇;吉西他滨;VP16;丝裂霉素;碘苷;拓扑异构酶1抑制剂诸如伊立替康、拓扑替康和喜树碱;亚硝基脲诸如BCNU、ACNU或MCNU、甲氨蝶呤、博来霉素、阿霉素、环磷酰胺和长春新碱;免疫调节细胞因子诸如IL2、IL6、IL12和IL13;以及干扰素。已知某些化疗剂是通过加热组织和/或化疗剂而加强的。可能的热激活或热增强化疗剂的实例包括博来霉素、BCNU、顺铂、环磷酰胺、美法仑、米托蒽醌、丝裂霉素C、噻替派、米索硝唑、5-硫-D-葡萄糖、两性霉素B、半胱氨酸、半胱胺和AET。
可用于实践本发明的许多额外的治疗剂可选自其全部内容通过引用并入本文的共同转让的美国专利申请公开号2003/0236514的第[0040]至第[0046]段中所描述的那些。
在一些实施例中,外部102和内部104中的一个或两个是由各种生物相容性热塑性聚合物或陶瓷或其任何组合制成的。这些生物相容性热塑性聚合物的实例包括但不限于聚乙交酯(PGA),乙交酯的共聚物诸如乙交酯/L-丙交酯共聚物(PGA/PLLA)、乙交酯/三亚甲基碳酸酯共聚物(PGA/TMC);聚乳酸(PLA),PLA的立体共聚物诸如聚-L-丙交酯(PLLA)、聚-DL-丙交酯(PDLLA)、L-丙交酯/DL-丙交酯共聚物;PLA的共聚物诸如丙交酯/四甲基乙交酯共聚物、丙交酯/三亚甲基碳酸酯共聚物、丙交酯/δ-戊内酯共聚物、丙交酯ε-己内酯共聚物、聚缩肽、PLA/聚环氧乙烷共聚物、不对称3,6-取代聚-1,4-二恶烷-2,5-二酮;聚-β-羟基丁酸酯(PHBA)、PHBA/β-羟基戊酸酯共聚物(PHBA/HVA)、聚-β-羟基丙酸酯(PHPA)、聚对二氧杂环己酮(PDS)、聚-δ-戊内酯、聚-ε-己内酯、甲基丙烯酸甲酯-N-乙烯基吡咯烷酮共聚物、聚酯酰胺、草酸的聚酯、聚二氢吡喃、聚烷基-2-氰基丙烯酸酯、聚氨酯(PU)、聚乙烯醇(PVA)、多肽、聚-β-马来酸(PMLA)、聚-β-链烷酸或其任何组合。生物相容性陶瓷的实例包括但不限于磷酸钙基陶瓷,诸如羟基磷灰石(HAP)、磷酸三钙β(βTCP)以及HAP和βTCP的混合物。
在一些实施例中,内部104由包括聚酰胺的生物相容性聚合物制成。在一些实施例中,内部104由包括聚乳酸、聚(乳酸-共-乙醇酸)(PLGA)或其组合的生物相容性聚合物制成。在一些实施例中,内部104由包括磷酸三钙的生物相容性陶瓷制成。这些生物相容性聚合物和陶瓷可被制成可生物降解的以在体内进行使用。
在一些实施例中,内部104可涂覆有可生物降解的相变材料,其与治疗药物和居里纳米粒子106结合使用,以在指定温度下触发药物释放。在一些实施例中,居里纳米粒子106具有与可生物降解的材料的相变温度相同或略高于其的居里温度。例如,在存在有施加的电和/或磁场的情况下,居里纳米粒子106可加热至其居里温度。一旦已达到可生物降解材料的相变温度,其可软化并释放在可生物降解材料内的药物。在一些实施例中,可生物降解的相变材料,如1-十四醇具有39℃的熔化或相变温度,然而也可考虑其他合适的可生物降解的相变材料,如月桂酸。在一些实施例中,内部104由多孔PLGA粒子制成。在一些实施例中,在二乙醚中制备1-十四醇的溶液并使用超声喷雾系统添加10重量%的镧锶锰镍氧化物(LSMNO)纳米粒子。LSMNO纳米粒子可涂覆金以增加最终溶液的不透射线性。在一些实施例中,使用流化床系统使在内部104中的PLGA涂覆有金涂覆的LSMNO纳米纳米,其包括1-十四醇层。
基于对组织处理的预期目的,可植入治疗器械100的尺寸范围可以是1微米(μm)至30微米。可植入治疗器械100也可小于1微米以及大于30微米。例如,可植入治疗器械100可以根据其要被植入的位置来确定尺寸。在一些实施例中,由于其具有给定的尺寸范围中的预定尺寸,可植入治疗器械100可被注入或以其它方式植入体内以闭塞不良组织的血管床。除了将热和/或治疗药物输送至要处理的组织外,这种可植入治疗器械100可用于阻塞氧气供给。在其他实施例中,可植入治疗器械100可被注入或以其他方式植入肿瘤或不良组织的本体或主体中。
一旦进行了植入,治疗器械100则可以经受交变电场或磁场。可从位于体外的位置施加电场或磁场并使其指向治疗器械(数个)100的位置。当经受具有足够强度的场时,金属纳米粒子106加热至其磁性转换成顺磁性以及居里温度材料的温度停止上升的特征温度。由金属纳米粒子106产生的热可触发治疗药物的释放并且/或者加热周围组织以提供热疗处理。还可考虑的是可植入治疗器械100可用作另一反应的温度催化剂,其中反应或活性是休眠的直到进行热激活为止。器械100仅在存在有指定的电场或磁场和频率的情况下进行加热且仅加热至纳米粒子106的居里温度。当达到居里温度时,材料从磁性的变为非磁性的,这使加热中断。这是一个循环过程,只要施加了电场或磁场,则会永久和快速地将治疗器械100的温度保持在材料的设定居里点上。
图2A和2B为分别在闭合形态和开放形态中的可植入治疗器械200的一个实施例的截面视图。在一些实施例中,可植入治疗器械200包括金属或金属复合材料壳202,其由具有预定的居里温度的一种以上的居里材料组成。可植入治疗器械200的尺寸范围可以是1微米至3000微米。然而,在一些实施例中,可植入治疗器械200包括微粒,其尺寸范围为1微米至1000微米。例如,可植入治疗器械200可以根据其要被植入的位置来确定尺寸。
如在图2A中所示,金属壳202包括具有第一部分204的腔室205以及第二部分206,第二部分206从第一部分204延伸至金属壳202的外表面207。在一些实施例中,第一部分204基本上大于相对较小的第二部分206,然而这并不是必需的。此外,在一些实施例中,第一部分204位于或接近金属壳202的中心。此外,在一些实施例中,第一和第二部分204、206中的一个或两个包括生物相容性热塑性聚合物和/或生物相容性陶瓷208,其具有药物210或不透射线材料或者两者。或者,第一和第二部分204、206可包括合适的不同和/或单独的生物相容性热塑性聚合物和/或生物相容性陶瓷。在一些实施例中,在释放生物相容性热塑性聚合物和/或生物相容性陶瓷和药物210之前,第二部分206由热塑性聚合物或陶瓷208密封。例如,可将电场或磁场施加至可植入治疗器械200,这使金属壳202加热至其居里温度。可将源于金属壳202的热传递至热塑性聚合物或陶瓷208,这使得热塑性聚合物或陶瓷208软化和/或熔化并释放药物210。为了释放药物210,热塑性聚合物或陶瓷208可具有位于金属壳202的居里温度以下的熔化温度。
在一些实施例中,可植入治疗器械200是使用多孔金属微粒制成的(例如,通过将纳米粒子或较小的微粒烧结在一起而制成)。将多孔金属微粒浸入药物和可溶解蜡的溶液中。在一些实施例中,多孔金属微粒是通过将2微米的铁粒子混合至聚合物溶液(例如,含有50重量%的聚合物)中并将尺寸大约为100微米的微粒喷出溶液而制成的。随后,烧结所产生的微粒(在该阶段含有铁粒子和聚合物)以烧掉聚合物,这留下了可将药物和蜡添加至其中的多孔金属微粒。
如在图2B中所示,在所施加的交变磁场或电场的影响下,将金属壳202(以参考数字209示出)加热至温度T1。在温度T1,热塑性聚合物/陶瓷208变弱、变松、变软和/或熔化以打开用于使药物210和/或不透射线的粒子从金属壳202流出至体腔或身体组织中的路径211。热塑性聚合物/陶瓷208可以在低于金属片202的居里温度的温度T1变弱、变松、变软和/或熔化,然而这并不是必需的。在一些实施例中或在一些处理方法中,一旦释放了药物210,所施加的磁场或电场的强度则可增加以进一步地将金属壳202的温度升高到接近其居里温度或至其居里温度。其结果是,除了从释放的药物210进行的药物治疗之外,可进行对不良组织的局部热疗或烧灼。然而,金属壳202不会加热至其居里温度以上。
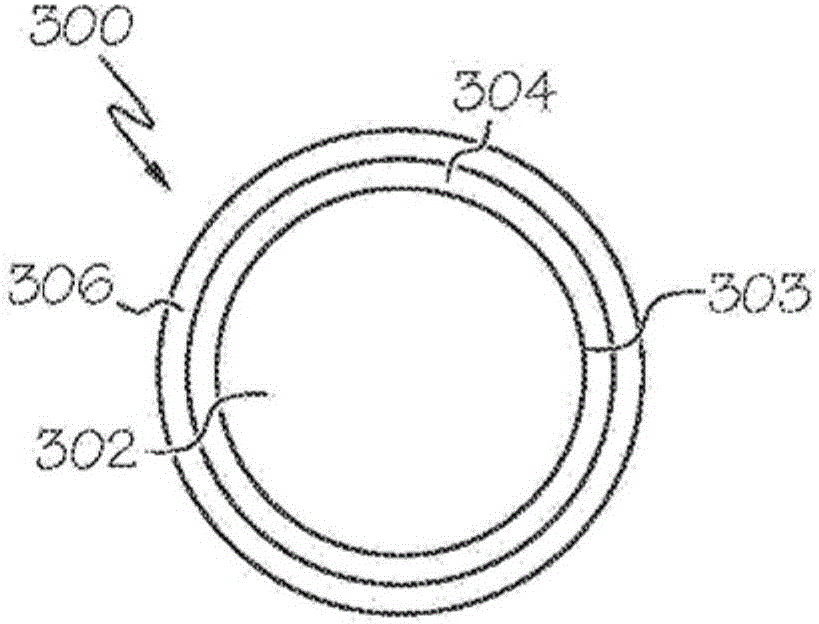
图3A和3B为可植入治疗器械300的一个实施例的截面视图,其在一些实施例中包括微粒。图3A示出在闭合形态中的可植入治疗器械300而图3B则示出在开放形态中的可植入治疗器械。在一些实施例中,可植入治疗器械300包括金属或金属复合材料芯302,其包括具有预定居里温度的居里材料。可植入治疗器械300的尺寸范围可以是1微米至3000微米;其中可植入治疗器械为微粒,其尺寸范围可以是1微米至1000微米。例如,可植入治疗器械200可以根据其要被植入的位置来确定尺寸。
如在图3A中所示,金属芯302的外表面303覆盖有上面讨论了其实例的治疗药物304和/或不透射线的粒子。金属芯302和治疗药物304被围绕在合适的生物相容性热塑性聚合物和/或生物相容性陶瓷306内或由其所包围。热塑性聚合物或生物相容性陶瓷306的熔化温度可低于或大致等于金属芯302的居里温度。当可植入治疗器械300经受合适的交变磁场或电场时,金属芯302开始加热。然而,当金属芯302变成顺磁性时,当达到居里温度,金属芯302的温度可受到限制。
在一些实施例中,生物相容性热塑性聚合物和/或生物相容性陶瓷306的熔化温度位于或稍低于金属芯302的居里温度。然而,在一些实施例中,生物相容性热塑性聚合物和/或生物相容性陶瓷306的熔化温度显著地低于金属芯302的居里温度。可将电场或磁场施加至可植入治疗器械300,这使金属壳302加热至或接近其居里温度。可将源于金属壳302的热传递至热塑性聚合物或陶瓷308,这使得热塑性聚合物或陶瓷308软化和/或熔化并释放药物304。以这种方式,一旦释放了药物304,所施加的磁场或电场的强度则可增加以进一步地将金属芯302的温度升高至接近或至其居里温度。其结果是,金属芯302可在布置治疗药物304后进一步用于不良组织的局部热疗或烧灼。一旦金属芯302的温度达到其居里温度,加热则停止。
在一些实施例中,金属芯302的第一部分被第一热塑性聚合物和/或陶瓷围绕,且金属芯302的第二部分和药物304一起被第二热塑性聚合物和/或陶瓷围绕。第二热塑性聚合物/陶瓷的熔化温度可大于第一热塑性聚合物/陶瓷的熔化温度但却低于金属芯302的居里温度。其结果是,当经受交变磁场或电场时,由金属芯302散发的热首先破坏第一热塑性聚合物,接下来则破坏第二热塑性聚合物,从而部分地释放出药物304。可考虑的是可将药物304设置在第一和第二热塑性聚合物和/或陶瓷中的一个或两个的下方。还可考虑的是可植入治疗器械300可根据需要包括任何数量的热塑性聚合物和/或陶瓷,诸如但不限于一个、两个、三个、四个或者更多。
图4示出可植入治疗器械400的一个实施例的示意图,其在一些实施例中包括微粒。可植入治疗器械400包括基部402,其具有从基部402的外表面403向外突出的尖锐边缘404。尖锐边缘404可被配置成烧灼或切割不良组织。基部402可以是由一种以上具有限定的居里温度的居里材料组成的金属或金属复合材料。在一些实施例中,基部402可基本上为球形。基部402还可采用任何其他所需的形式,诸如但不限于环。在一些实施例中,基部402和尖锐边缘404可由一种以上的具有相同或不同的居里温度的合适的居里材料制成。在交变磁场或电场的影响下,基部402和/或尖锐边缘404可被升高至居里温度,正如之前所讨论的,以烧灼周围组织。在一些实施例中,基部402和/或尖锐边缘404具有在100和400摄氏度之间的居里温度。
关于图5,在一些实施例中,可植入治疗器械500包括由一种以上具有预定居里温度的居里材料组成的部分502。在一些实施例中,可植入治疗器械包括微粒。在一些实施例中,部分502具有延伸通过器械500的通孔504以接收用于输送的导丝。该孔504可位于部分502的中心周围,但也可位于部分502上的任何合适位置上。在交变磁场或电场的影响下,金属部分502将热散发至周围组织。如上面所讨论的,基于对不良组织处理的预期目的,可植入治疗器械400和500可具有在1微米至3000微米的范围中的可变尺寸。
图6、7和8为用于输送可植入治疗器械的导管的示意图。如图所示,导管600、700、800被配置成通过患者的脉管系统导航至所需的治疗部位。导管600、700、800中的每一个包括导管轴601。导管轴601具有远端部分602。导管600、700、800中的每一个的近端可包括附接至其的轮毂(未示出),其用于连接其他诊断和/或治疗器械和/或端口以便进行介入。此外,导管600、700、800具有适于被接收在所需体腔内的横截面形状或形态。例如,导管600、700、800可专门调整大小和进行配置以适应通过血管内路径,其从在例如股、肱或桡动脉中的经皮进入部位引至标靶治疗部位,例如,在患者的胃或其他器官内的。
可设置导管600、700、800的刚度以用于各种体腔直径中。为此,用于制造导管600、700、800的材料可包括任何合适的生物相容性材料,诸如但不限于聚合物或合金,其可以组合使用或单独使用。通常,合适的聚合材料包括但不限于硅酮、聚酰胺、聚醚嵌段酰胺、聚氨酯、聚乙烯、尼龙和聚对苯二甲酸乙二醇酯。在一些实施例中,所采用的材料具有足够的刚性以用于各种体腔直径中,且具有足够的柔韧性以操纵通过曲折和/或狭窄的内腔,从而避免任何不需要的组织损伤。将要理解的是输送装置还可包括用于将可植入治疗器械布置在非内腔的目标位置上的切割、烧灼和/或穿刺能力。
图6示出使用流体将一个以上的可植入治疗器械输送至身体组织的导管600,该流体可进行加压以输送可植入治疗器械。导管600可包括从远端部分602向近端部分延伸的内腔603。导管轴601的远端部分602包括弹性孔口604,其能够在闭合形态和开放形态之间转换。该孔口604可向闭合形态发生偏移。施加的力可使孔口604在闭合形态和开放形态之间移动。
在一些实施例中,导管600包括手柄部分607。手柄部分607具有与内腔603成流体连通的贮存器608。流体609则在该贮存器608内。在一些实施例中,贮存器608包括与内腔603和弹性孔口604成流体连通的注射器。确定内腔603的横截面直径的尺寸以接收一个以上的可植入治疗器械,例如,微粒,诸如但不限于上面所讨论的治疗器械100。虽然相关于参考图1描述的可植入治疗器械100描述了导管600,但可考虑的是本文所述的可植入治疗器械100、200、300、400、500中的任一个可用导管100进行输送。当可植入治疗器械100在导管600的内腔内时,弹性孔口604可向闭合形态偏移。
在一些实施例中,导管600包括精确容积泵606以及存储有流体609,例如,盐水或任何其它合适的生物相容性流体的贮存器608。在一些实施例中,贮存器608被联接至内腔,以使得当激活泵606时,流体609流至内腔中,向远侧推动可植入治疗器械100。源于流体609的压力以及向远侧推进的治疗器械可向孔口604施加力,这使得孔口打开。所推动的可植入治疗器械100可从弹性孔口604流出,弹性孔口604从闭合形态转换至开放形态以将可植入治疗器械100释放至体腔或组织中。在一些实施例中,在闭合形态中的弹性孔口604的存储势能转换成在开放形态中的动能以在微粒100上额外地施加远侧力。在一些实施例中,所施加的力驱动可植入治疗器械100进入体腔或组织中。
图7示出被配置成在导丝610上将可植入治疗器械输送至身体组织的导管700。导管700被配置成接收一个以上可植入的治疗器械,诸如但不限于关于图5所述的可植入治疗器械500,其可在导丝610上进行安装。导管700包括在位于近端620的近侧开口和位于远端624的远侧开口622之间延伸的第一内腔611。第一内腔611的横截面直径足以接受在导丝610上安装的可植入治疗器械500。在近端,导管700具有围绕导丝610的推轴612。推轴612可在导丝610上延伸或向远侧推进以机械地将可植入治疗器械500向远侧推离导丝并推至体腔或组织中。
图8示出用于可植入治疗器械,诸如但不限于使用放电或可释放的机械互锁在熔线614上安装的关于图5进行描述的可植入治疗器械500的可熔释放的导管800。如图所示,导管800被配置成接收多个可植入治疗器械500,诸如微粒,其在熔线614上和/或至熔线614进行安装。导管800包括在位于近端628的近侧开口和位于远端632的远侧开口630之间延伸的内腔626。导管800还包括阴极线616和阳极线618,每一个均附接至导管800的远端且向近侧延伸以联接至位于导管800近端628的电源(未示出)。在一些实施例中,除了在导管602的远端处,线616、618均彼此绝缘。在导管800的远端的阴极和阳极线616、168之间产生放电。放电可能足以断开熔线614,从而使可植入治疗器械500与剩余的可植入治疗器械500断开。这种配置可被称为双极型。此外,本领域技术人员将理解也可采用单极配置,在患者身体上使用接地垫,且熔线包括阳极。
在一些实施例中,导管600、700、800分批地布置多个可植入治疗器械(例如,微粒)。例如,第一批(即,多个)可植入治疗器械可基本上同时进行输送,且随后,第二批(即,多个)可植入治疗器械可基本上同时进行输送。在这个背景下,要理解的是基本上同时包括对布置机构,诸如泵606、推轴612进行单次或连续的激活,或对阴极线616和阳极线618进行电激活以输送可植入治疗器械,然而并非所有的可植入治疗器械可完全同时离开导管600、700、800。可经导管600、700、800布置用于实现所需的治疗效果任何数量的批次。额外地,要理解的是,批次,例如,第一和第二批的可植入治疗器械可不同地进行尺寸的确定并且/或者包括在每批次内具有不同形状、尺寸和/或形态的可植入治疗器械。在一些实施例中,第一批的可植入治疗器械可具有第一尺寸(例如,直径),而第二批的可植入治疗器械则可具有第二尺寸(例如,直径),其可相对大于第一尺寸。可选择这些批次的可植入治疗器械的尺寸,以当在不良组织周围的体腔中进行布置时,使可植入治疗器械阻塞或闭塞体腔,或者能够将预定量的热输送至不良组织。
图9和10示出将可植入治疗器械输送至组织位置的方法。在操作期间,可通过身体内天然开口或切口将导管600、700、800推进至体腔750或腔室中。使用例如,内窥镜将远侧部分602定位在邻近不良组织处以进行处理。一旦进行了定位,通过施加加压流体、机械推动或放电而将具有范围在40℃和440℃之间的一个以上的可植入治疗器械(例如,微粒,其可替代地被称为微种)(诸如微粒100、500)向不良组织注入体腔中,如上面所讨论的。
本文所公开的任何可植入治疗器械均可经任何合适的方法或器械进行植入。例如,可通过经皮无畸变、荧光或MR(磁共振)引导输送来植入可植入治疗器械;可植入治疗器械也可通过外科手术输送。
关于图11,在一些实施例中,弹性孔口604被配置成在布置可植入治疗器械100时扩张且一旦可植入治疗器械已离开弹性孔口604缩回。此外,在一些实施例中,弹性孔口604具有足够的弹性回弹以操纵各种尺寸的可植入治疗器械100。
关于图12,在一些实施例中,将第一组可植入治疗器械中的至少一些注入在组织702的血管床中腔室中,其中由于可植入治疗器械和腔室具有相当的尺寸第一组保持了其位置(例如,可植入治疗器械被存放在组织或体腔中)。在一些实施例中,这种可植入治疗器械阻挡氧气的供给,这可有助于处理组织702。
在一些实施例中,被注入体腔中的可植入治疗器械100、500具有不同的尺寸,例如,第一组的可植入治疗器械具有第一尺寸且第二组的可植入治疗器械具有第二尺寸,其大于或小于第一尺寸。在一些实施例中,第一组的可植入治疗器械可具有第一居里温度且被配置成在体腔750中最远侧进行放置,其邻近于不良组织或与其相连通。此外,第二组的可植入治疗器械可具有第二居里温度且被配置成在体腔750内在第一组的近侧进行放置。在一些实施例中,第一组具有范围在1微米至30微米的第一尺寸的微粒且第二组具有范围在30微米至1000微米的第二尺寸的微粒。这仅仅是一个实例。在一些实施例中,第一组包括第一药物且第二组的微粒包括不同于第一药物的第二药物。
在一些实施例中,可植入治疗器械被配置成将药物释放至组织702中,如上面所讨论的。在一些实施例中,可植入治疗器械中的至少一部分被配置成随时间而降解。特别地,可植入治疗器械100的一些实施例的可生物降解聚合物分解,可生物降解聚合物则由周围组织吸收。因此,磁性纳米粒子与不透射线的粒子一起(如果存在的话)可由身体内的巨噬细胞消耗且可经正常的身体功能去除。
在一些实施例中,通过为高频交流(AC)信号的射频(RF)信号的感应来对所输送的可植入治疗器械进行无线加热。参考图13A和13B,对AC信号进行脉冲以升高可植入治疗器械的温度。基于AC信号的频率和脉冲持续时间输送该数量的能量。例如,图13A示出AC信号802,其具有分别为“a1”和“b1”的有效脉冲和无效脉冲的持续时间,以及AC信号804,其具有分别为“a2”和“b2”的有效脉冲和无效脉冲的持续时间。AC信号802的每个有效脉冲和无效脉冲的持续时间的比率小于AC信号804的,如在等式1中所示。换句话说,在图13A中的时间的开/关比率小于用于图13B的时间的开/关比率。因此,由信号804输送的能量大于由信号802输送的能量。
脉冲AC信号可以无线地施加至注入的可植入治疗器械,诸如可植入的治疗器械100、500,以使得可植入治疗器械经受交变场。交变场可以是电场或在一些实施例中,可施加的磁场。作为所施加的场的结果,可植入治疗器械的居里部分开始温度上升。因此,当注入的可植入治疗器械含有由生物相容性热塑性聚合物或陶瓷层固定的药物和/或不透射线的粒子时,居里部分的温度上升打开或以其他方式熔化热塑性聚合物或陶瓷层以释放药物和/或不透射线的粒子。将要理解的是在一些实施例中,药物(例如,药物210)的释放将不会发生直到已充分加热热塑性聚合物或陶瓷208为止。以这种方式,可以避免将药物释放到不需要药物的身体的各部分中,例如,在使用具有药物的错误的可植入治疗器械的情况下,可通过仅将AC信号聚集在所需的处理区域上而实现。
例如,可基于不透射线的粒子的存在使用各种技术,如CT扫描来检测邻近组织702或在组织702中的所注入的可植入治疗器械的精确分布或密度。在将可植入治疗器械注入体腔之后以及在加热可植入治疗器械之前,可执行这种检测。
基于所检测的可植入治疗器械的密度以及关于可由AC信号的每个有效脉冲转移至每个可植入治疗器械的能量的量的先验知识,可计算在组织702的整个体积中的每个分段的温度上升。用于组织702的每个分段的该计算的温度上升允许将预定量的能量输送至微粒密度较小的分段,且反之亦然(如在图14中所示),从而在组织702的整个体积上实现均匀的温度上升。这种均匀的温度上升便于实现对组织702的安全热处理。为了在组织702的体积上提供均匀的温度上升,具有可植入治疗器械的较高/较低密度的区域,一些实施例采用分布式天线阵列900,如在图15中所示。分布式天线阵列900可用于将更大量的能量引导至具有较低密度的微粒的区域,例如,以在处理区域上实现均匀的温度上升。然而,在一些实施例和方法中,分布式天线阵列900用于提供故意为不均匀的温度上升。以这种方式,可在所需的位置上更多地提高温度。
在一些实施例中,分布式天线阵列包括多个空间分布式天线902、904、906(例如,偶极子),如图15中所示。这些天线902被置于本体外的组织702周围。基于在组织702的体积中的微粒密度,在AC信号的脉冲频率中对每个天线进行调谐以将预定量的电力输送至微粒,从而在组织702上实现所需的电力分布。在一些实施例中,例如,通过向这些区域提供更多的AC脉冲而将更多的电力施加至具有较低密度的微粒的癌组织的区域。
此外,内磁核,诸如上面所讨论的金属壳202和金属芯302,或在微粒中的磁性纳米粒子106可由居里温度为超过45℃的居里材料制成以升高微粒温度超过45℃。在一些实施例中,周围的热塑性聚合物和/或陶瓷层随时间减少能量释放且可充当热质量。此外,由于每个微粒具有磁性纳米粒子106或其他居里材料的已知负载,因此可确定由AC信号的单次有效脉冲所加热至的微粒温度。因此,可将所需量的能量传输至组织,且可根据需要保持均匀的温度。
在AC信号的每次有效脉冲后,源于微粒的热通过周围组织消散并将组织702的体积加热至所需温度。重复这种有效脉冲可将组织702的总体温度升高至进一步所需的温度水平。改变脉冲之间的开关比率,允许操作者精确地控制穿过要处理的组织702的目标温度或温度廓线,且同时保持刚好低于患者的痛阈。每个可植入治疗器械、微粒、纳米粒子等所供给的能量的量可由脉冲频率或脉冲持续时间或两者来调节。尽管如此,温度上限是由居里温度确定的。
在一些实施例中,各种医疗器械,诸如球囊或支架可与居里温度受控元件,诸如可植入治疗器械100和500进行联接以对各种医疗状况进行处理。当经受电磁场时,可植入治疗器械的居里部分开始产生热直到其达到居里温度为止。所产生的热可用于执行但不限于组织调制、组织传播和神经调制以进行处理。组织调制可包括但不限于(1)涉及对血管组织和前列腺组织进行热处理的循环调制;(2)涉及对癌前和癌细胞以及毁损灶、不良组织生长和疣进行热处理的肿瘤调制;(3)涉及使用热对颈动脉体进行处理的传感器调制;以及(4)涉及对粘液变细胞,例如,在唾液腺中的进行热处理的腺体调制。组织传播可能涉及对子宫内膜异位的热处理。此外,神经调制可能涉及对传入和传出交感神经以及副交感神经进行的热处理。可植入治疗器械或其部分也可用于向体内的目标部位提供选择性定节奏或连续加热以缓解疼痛,诸如慢性背痛和月经痛。
下列文件均通过引用并入本文,且每一个均以整体并入:
Ahmad等,“基于(Gd)5Si4材料的优化:至自控制热疗应用的步骤”,J.Appl.Phys.,2009,106:064701
Akin等,“用于自控制的磁热疗的Ni1-xCrx合金”,Crystal Research and Technology,2009,44:386-390
Atsarkin等,“以La1-xAgyMnO3-d纳米粒子实现用于热疗的生物热方程的解决方案:温度自稳定的效果”,Int.J.Hyperthermia,2009年5月;25(3):240-247
Bose等,(“在闪锌矿型结构中Cr基合金中的交换相互作用和元素间隔:独立于体积和组合物的”,arXiv:0912.1760[cond-mat.mtrl-sci],2010年2月5日;16页。)
Giri等,“对用于热疗应用的磁性氧化物的Tc调谐的纳米粒子的研究”,Biomed.Mater.Eng.,2003,13:387-399
Gomez-Polo等,“分析在FeCrSiBCuNb非结晶和纳米结晶线中的加热效果(磁性热疗)”,J.Applied Phys.,2012,111,07A314-1至07A314-3。2012年2月16日在线提供。
Haik等,(美国专利号7,842,281,题为“用于治疗热疗的磁性粒子组合物”)。
Iorga等,(“在Fe-Cr-No-Mn合金中的低居里温度”,U.P.B.Sci.Bull.Series B,2011,73(4):195-202)
Joshi等,“可生物降解的聚合于在药物输送中的作用,”Int.J.Current Pharm.Res.,2012,4(4):74-81。
Kim等,(题为“具有位于生物相容性温度范围内的居里温度的磁性纳米粒子及其制备方法”的申请号EP 2671570A2的欧洲专利)。
Kuznetsov等,“使用具有适于治疗的居里温度的CuNi纳米粒子的局部射频诱导的热疗”,J.Magn.Magn.Mater.,2007,311:197-203。
Martirosyan,“用于自控制热疗癌症处理的热敏磁性纳米粒子”,J.Nanomed.Nanotechnol.,2012,3(6):1000e112(1-2)。
Martirosyan,“用于成像和热疗癌症处理的热敏纳米结构介质”,Bulletin of the American Physical Society,2001,56:1
McNerny等,“用于自调节热疗的具有可调居里温度的单分散γ-Fe–Ni磁性纳米粒子的化学合成”,J.Applied Phys.,2010,107,09A312-1至09A312-3。2012年4月19日在线提供。
Miller等,“应用于自调节的射频加热中的Fe–Co–Cr纳米复合材料”,J.Applied Phys.,2010,107,09A313-1至09A313-3。2012年4月19日在线提供。
Pham等,“通过共价键合在氧化石墨烯片上固定金纳米粒子”,Appl.Surface Sci.,2011,257,3350-3357。2010年11月19日在线提供。
Prasad等,“用于磁性热疗的La0.73Sr0.27MnO3的TC调谐的生物相容性悬浮液”,J.Biomed.Mater.Res.B Appl.Biomater.,2008,85:409-416
Prasad等,“Gd取代的NiCa铁氧体/聚乙烯醇纳米复合材料”,J.Magn.Magn.Mater.,2012,324:869-872。
Shahil等,“作为高效热界面材料的基于石墨烯的纳米复合材料”,arXiv preprint,arXiv:1201.0796,2012(在http://arxiv.org/ftp/arxiv/papers/1201/1201.0796.pdf上在线提供;上次访问日期为2013年12月19日)。
Shahil等,“石墨烯和多层石墨烯的热特性:在热界面材料中的应用”,Solid State Communications,2012,152:1331–1340。2012年4月25日在线提供。
Shimizu等,“Mg1+xFe2-2xTixO4(x=0-0.5)系统的铁磁交换作用和居里温度”,J.Magn.Magn.Mater.,2007,310:1835-1837
Singh等,“聚合物-石墨烯纳米复合材料:制备、特征化、特性和应用”,在“纳米复合材料-新趋势和发展”中的第三章,InTech,Rijeka,Croatia,Ed.Ebrahimi,ISBN978-953-51-0762-0,发布日期:2012年9月27日,第37-71页。
Skomski等,“多相纳米结构的居里温度”,J.Applied Phys.,2000May 1,87(9):4756-4758。
Sperling等,“胶体无机纳米粒子的表面改性、功能化和生物偶联”,Phil.Trans.R.Soc.A,28March 2010,368(1915):1333-1383。
Wang等,“基于石墨烯的纳米复合材料”,在“石墨烯的物理学和应用-实验”中的第8章,nTech,Rijeka,Croatia,Ed.Mikhailov,ISBN 978-953-307-217-3,发布日期:2011年4月19日,第135-168页。
Wang等,“在反钙钛矿化合物Ga1-xCMn3+x(x=0、0.06、0.07和0.08)中具有大温度跨度的可逆室温磁致热效应”,J.Applied Phys.,2009,105,083907-1至083907-5。
在下面编号的声明中的一个以上中含有对一些实施例的描述。
声明1.一种微粒,其包括:
内部和围绕所述内部的外部,所述内部包括生物相容性聚合物和/或生物相容性陶瓷以及多个磁性纳米粒子,所述磁性纳米粒子具有在40℃和100℃之间的居里温度,所述外部包括生物相容性聚合物和/或生物相容性陶瓷和多个不透射线的纳米粒子。
声明2.根据声明1所述的微粒,其中所述磁性纳米粒子的所述居里温度大于45℃。
声明3.根据声明2所述的微粒,其中所述磁性纳米粒子的所述居里温度为42℃至48℃。
声明4.根据前述声明中任一项所述的微粒,其中所述不透射线的纳米粒子包括金。
声明5.根据前述声明中任一项所述的微粒,其具有1-30微米的直径。
声明6.根据前述声明中任一项所述的微粒,其中所述生物相容性聚合物和/或生物相容性陶瓷为可生物降解的。
声明7.根据前述声明中任一项所述的微粒,其中所述外部还包括药物。
声明8.一种导管,其包括:
界定内腔并且具有远端部分的导管轴,所述远端部分包括具有闭合形态和开放形态的弹性孔口;
界定贮存器的手柄部分,所述贮存器与所述内腔连通,所述贮存器在其中具有液体组合物;以及
多个微粒,其包括居里温度在35℃和100℃之间的金属组分,所述微粒被配置成行进通过所述内腔,其中所述微粒在所述弹性孔口处于所述闭合形态中时具有比所述弹性孔口的横截面更大的横截面。
声明9.根据声明8所述的导管,其中所述手柄部分包括注射器,所述注射器界定所述贮存器。
声明10.根据声明9所述的导管,其中所述贮存器在其中具有所述微粒。
声明11.根据声明8、9和10中任一项所述的导管,其中所述微粒中的至少一些含有药物。
声明12.根据声明8、9、10和11中任一项所述的导管,其中所述微粒中的至少一些含有聚合物部分。
声明13.根据声明8-12中任一项所述的导管,其中所述微粒中的至少一些为不透射线的。
声明14.根据声明8-12中任一项所述的导管,其中所述微粒中的至少一些具有界定腔室的金属壳。
声明15.根据声明14所述的导管,其中所述金属壳包括所述金属组件。
声明16.根据声明8-15中任一项所述的导管,其中所述液体组合物为液体和半液体的溶液或悬浮液,所述半液体具有在0.8cP和20,000cP之间的粘度。
声明16.一种导管,其包括:
界定内腔并且具有远端部分的导管轴,所述远端部分包括具有闭合形态和开放形态的弹性孔口;
界定贮存器的手柄部分,所述贮存器与所述内腔连通,所述贮存器在其中具有液体组合物;以及
多个微粒,其包括居里温度在35℃和100℃之间的金属组分,所述微粒被配置成行进通过所述内腔,其中所述微粒在所述弹性孔口处于所述闭合形态中时具有比所述弹性孔口的横截面更大的横截面。
声明17.根据声明16所述的导管,其中所述手柄部分包括注射器,所述注射器界定所述贮存器。
声明18.根据声明16所述的导管,其中所述贮存器在其中具有所述微粒。
声明19.根据声明16所述的导管,其中所述微粒中的至少一些含有药物。
声明20.根据声明16中所述的导管,其中所述微粒中的至少一些为不透射线的。
声明21.根据声明16中所述的导管,其中所述微粒中的至少一些包括聚合物部分。
声明22.一种微粒,其包括:
内部和围绕所述内部的外部,所述内部包括生物相容性聚合物和/或生物相容性陶瓷以及多个磁性纳米粒子,所述磁性纳米粒子具有在40℃和100℃之间的居里温度,所述外部包括生物相容性聚合物和/或生物相容性陶瓷以及多个不透射线的纳米粒子。
声明23.根据声明22所述的微粒,其中所述磁性纳米粒子的所述居里温度大于45℃。
声明24.根据声明22所述的微粒,其中所述磁性纳米粒子的所述居里温度为42℃至48℃。
声明25.根据声明22所述的微粒,其中所述不透射线的纳米粒子包括金。
声明26.根据声明22所述的微粒,其具有1-30微米的直径。
声明27.根据声明22所述的微粒,其中所述生物相容性聚合物和/或生物相容性陶瓷为可生物降解的。
声明28.根据声明22所述的微粒,其中所述外部还包括药物。
声明29.根据声明22所述的微粒,其中所述内部的所述生物相容性聚合物和/或生物相容性陶瓷为生物相容性聚合物且由聚酰胺组成。
声明30.根据声明22所述的微粒,其中所述内部的所述生物相容性聚合物和/或生物相容性陶瓷为生物相容性聚合物且由聚乳酸、聚(乳酸-羟基乙酸共聚物)poly(lactic-co-glycolic acid)或其组合所组成。
声明31.根据声明22所述的微粒,其中所述内部的所述生物相容性聚合物和/或生物相容性陶瓷为生物相容性陶瓷且由磷酸三钙组成。
声明32.一种处理在体腔或内腔内部的医疗状况的方法,其包括:
将第一多个微种插入所述体腔或内腔中,其中所述第一多个微种的所述微种具有1-30微米的直径和在30℃和440℃之间的居里温度;以及
在所述第一多个微种之后将第二多个微种插入所述体腔或内腔中,其中所述第二多个微种的所述微种具有30微米至1000微米的直径和在30℃和440℃之间的居里温度;
所述第一多个微种被配置成在所述体腔或内腔中执行不同于所述第二多个微种的功能。
声明33.根据声明32所述的方法,其中所述第一多个微种的所述微种的所述功能为第一功能,所述第一功能为:从其释放出药物、对组织进行热处理、烧灼组织或闭塞所述体腔或内腔,且所述第二多个微种的所述微种的所述功能为第二功能,所述第二功能为:从其释放出药物、对组织进行热处理、烧灼组织或闭塞所述体腔或内腔,其中所述第一功能不同于所述第二功能。
声明34.根据声明32所述的方法,其中所述第一多个微种的所述微种的所述功能为第一功能,所述第一功能将所述第一多个微种升高至第一居里温度,且所述第二多个微种的所述微种的所述功能为第二功能,所述第二功能将所述第二多个微种升高至不同于所述第一居里温度的第二居里温度。
声明35.根据声明32所述的方法,其中所述第一多个微种的所述微种的所述功能为第一功能,所述第一功能从所述第一多个微种的所述微种释放出第一药物,且所述第二多个微种的所述微种的所述功能为第二功能,所述第二功能从所述第二多个微种的所述微种释放出第二药物,其中所述第一药物不同于所述第二药物。
上述的公开内容旨在是说明性的,而非限制性的。该描述将对本领域中的普通技术人员暗示许多变型和替代方案。所有这些替代方案和变型均旨在被包括在权利要求的范围中,其中术语“包括”表示“包括,但不限于”。熟悉本领域的人员可以认出本文所述特定实施例的其他等同物,其中等同物旨在被权利要求所涵盖。
进一步地,在从属权利要求中提出的特别的特征彼此可在本发明的范围中以其他方式进行组合,因此本发明应被认为是还具体地针对具有从属权利要求的特征的任何其他可能的组合的其他实施例。例如,为了权利要求的公布,后面的任何从属权利要求应被视为可替代地写为所有先前的权利要求的多项从属形式,其中如果这种多项从属格式为管辖范围内的接受的格式,先前的权利要求拥有在这种从属权利要求中参照的所有前项(例如,每个直接从属于权利要求1的权利要求应被可替代地视为从属于所有之前的权利要求)。在多项从属权利要求格式受到限制的管辖范围中,下列从属权利要求中的每一个应被视为可替代地写成单独的从属权利要求格式,其根据现有的拥有前项的权利要求而非在下列这种从属权利要求中列出的特定权利要求创建从属性。
这完成了对本发明的优选和替代实施例的描述。本领域的技术人员可以认出本文所述特定实施例的其他等同物,其中等同物旨在被所附权利要求所涵盖。
- 还没有人留言评论。精彩留言会获得点赞!