一种稳定的卡巴他赛白蛋白组合物及其制备方法与流程
本发明涉及药物制剂领域。更具体地说,本发明涉及一种稳定的卡巴他赛白蛋白无菌冻干组合物及其制备方法。
背景技术:
前列腺癌是男性生殖系统最常见的恶性肿瘤,发病随年龄而增长,其发病率有明显的地区差异,欧美地区较高,亚洲地区发病率较低。前列腺癌的发病率和死亡率仅次于肺癌,位居癌症死亡的第二位。在大多数病例中,前列腺癌在年龄较大的男性中发展缓慢,在亚洲,其发病率低于西方国家,但近年来呈迅速上升趋势。
美国癌症学会统计,前列腺癌占到了美国每年新确诊癌症病例的四分之一,2010年确诊的前列腺癌病患约22万,有超过32,000例患者死于该病。在欧洲,每年的死亡数字是27,000例,但全球前列腺癌死亡数远远超过这个数字。由于前列腺癌的发病年龄通常较晚,因而患者人群呈现出老龄化趋势。前列腺癌药物的市场前景十分广阔。市场调研公司Decision Resources预计,前列腺癌药物的市场价值将从2009年的近40亿美元,增长至2014年的57亿美元;2019年将进一步增至87亿美元。
目前,前列腺癌常用的药物治疗有如下几种:
(1)抗雄激素治疗:抗雄激素制剂主要作用在雄激素对前列腺细胞接受器的阻断,使癌细胞无法接收到雄激素的讯息而不会继续生长,抗雄激素药物有:氟他胺片、康士得(比卡鲁胺片)等。
(2)化学治疗:作为辅助性治疗往往可以起到内分泌治疗及放疗无法替代的效果。前列腺癌最敏感的化疗药物为复方环磷酰胺片,其他化疗药物还有顺铂(PDD)、5-氟尿嘧啶(5-FU)、阿霉素(ADM)、丝裂霉素(MMC)、磷酸雌二醇氮芥(EMP)、紫杉烷类等。
(3)中药治疗:根据不同脉相辨证治疗,有一定治疗效果。
(4)免疫治疗:近年来免疫与肿瘤的关系颇为引人关注,免疫药物是通过提高机体免疫力,提高抗病能力来抑制肿瘤细胞的生长,同时它也可保护细胞功能,减少内分泌药物和抗癌药物对机体的损害。目前临床上应用的有凯因益生(重组人干扰素α2b注射液)、欣吉尔(注射用重组人白介素-2(125Ala))等。
(5)双磷酸盐药物治疗:主要应用在前列腺癌骨转移病人,进行靶向治疗等。
卡巴他赛(cabazitaxel)是一种抗肿瘤药物,属于紫杉烷类,由红豆杉萃取的前体半合成制备得到。
卡巴他赛分子式为C45H57NO14,白色结晶,不溶于水、可溶于乙醇,化学名为(2R,3S)-3-叔丁氧羰基氨基-2-羟基-3-苯基丙酸-4α-乙酰基-2α-苯甲酰基-5β,20-环氧-1β-羟基-7β,10β-二甲氧基-9-氧-11-紫杉烯-13α-酯,其结构式如下所示:
2010年6月17日,美国食品药品管理局(FDA)批准了卡巴他赛作为二线疗法用于治疗前列腺癌。卡巴他赛在抗肿瘤机制上属于抗微管类药物,主要通过与游离微管蛋白结合,促进微管蛋白聚合成微管,同时阻止已组装好的微管解体,形成稳定的非功能性微管,进而抑制细胞的有丝分裂和分裂间期的肿瘤细胞功能。卡巴他赛对前列腺癌有非常好的疗效,可与泼尼松联用,治疗既往用含多烯紫杉醇治疗方案的转移性激素难治的前列腺癌患者。
在理化性质上,卡巴他赛与其他紫衫烷类药物一样,具有非常差的水溶性,约6μg/ml。临床使用卡巴他赛注射液时,须溶解于吐温-80,再用乙醇、葡萄糖或生理盐水稀释注射,不仅会给临床应用带来诸多不便,还会因为吐温-80等辅料的引入而造成一系列的安全问题。
技术实现要素:
一方面,本发明提供了一种安全、稳定的卡巴他赛的白蛋白药物无菌冻干组合物。
本发明的组合物为卡巴他赛或其衍生物例如溶剂合物与白蛋白组成的纳米颗粒系统。
在上述药物组合物中,卡巴他赛或其衍生物与白蛋白质量比为1:2~30,pH为6.0~7.5,平均粒径不大于200nm,冻干后的组合物zeta电位在-2~-9mv,其中,冻干过程中,无需添加冻干保护剂和蛋白稳定剂。
作为本发明的优选,卡巴他赛或其衍生物与白蛋白质量比为1:10~20,更优选为1:12~17;
作为本发明的优选,卡巴他赛或其衍生物与白蛋白组成的无菌冻干药物组合物中,pH为6.5-7.0;
作为本发明的优选,卡巴他赛或其衍生物与白蛋白组成的药物组合物中,冻干后的组合物zeta电位在-5~-8mv,其中,所述复溶溶剂包括如生理盐水。
作为本发明的优选,所述白蛋白为带有巯基或二硫键,优选人血清白蛋白。
另一方面,本发明提供一种所述卡巴他赛和白蛋白的无菌冻干组合物的制备方法,包括如下步骤:
1)将卡巴他赛或其衍生物例如溶剂合物溶于有机溶剂中,形成有机相;所述有机溶剂选自醇类溶剂,在有机相中卡巴他赛或其衍生物的浓度为10~45mg/ml;
2)将所述白蛋白分散于水性介质中,形成水相;所述水相中,白蛋白的浓度为3-20mg/ml;
3)将步骤1)的有机相和步骤2)的水相混合、高速剪切、均质,制备得到颗粒平均粒径不大于200nm的混悬液;其中,均质可以采用例如将混合物转入高压均质机内的方式;
4)将步骤3)所得混悬液进行超滤浓缩,得到卡巴他赛的白蛋白组合物;
5)将步骤4)中所得的组合物进行过滤除菌,然后直接冷冻干燥,制得卡巴他赛和白蛋白的无菌冻干组合物。
在上述制备方法中,步骤5)的冷冻过程无需添加冻干保护剂和蛋白稳定剂,其中,所述冻干保护剂包括但不限于海藻糖、蔗糖、麦芽糖、乳糖、甘露醇;其中,所述蛋白稳定剂包括但不限于海藻糖、蔗糖、辛酸钠、氨基酸(例如乙酰色氨酸、甘氨酸等)中的一种或多种。
作为本发明的优选,步骤1)中所述的醇类溶剂选自甲醇、乙醇、乙二醇,异丙醇、更优选为乙醇;
作为本发明的优选,步骤2)中白蛋白浓度为3-15mg/ml;
作为本发明的优选,步骤4)中超滤浓缩至2~20倍;
作为本发明的优选,步骤3)和4)中卡巴他赛或其衍生物的浓度为0.1~6mg/ml;优选0.4~4mg/ml;
作为本发明的优选,步骤3)中以7000~15000rpm的转速剪切;
作为本发明的优选,步骤3)中在30000~40000psi的压力下进行高压均质;
作为本发明的优选,步骤3)中均质步骤重复5~6个循环。
另一方面,本发明还提供一种采用上述制备方法制备得到的卡巴他赛和白蛋白的无菌冻干组合物。
本发明所述制备方法制备得到的卡巴他赛白蛋白冻干组合物,稳定性好,例如在本发明中采用测定组合物在一定时间段内的卡巴他赛含量变化或者粒径变化或者zeta电位变化来评估组合物的稳定性,经证实,本发明制备方法得到的冻干组合物,在这些方面的稳定性均大于72小时。
另一方面,本发明还提供一种制剂,包含上述的卡巴他赛和白蛋白的无菌冻干组合物以及药学上可接受的载体和/辅料。
作为本发明的优选,用于本发明的药学上可接受的载体和/或辅料包括无菌水、盐水、葡萄糖、油(如玉米油;花生油、芝麻油及类似物)、酸、低级烷醇(二醇;聚亚烷基二醇)。
作为本发明的优选,用于本发明的药学上可接受的载体和/或辅料还可包括防腐剂、润湿剂、乳化剂、渗透促进剂及类似物。
作为本发明的优选,本发明的制剂还可以包括抗微生物剂(如螯合剂,包括但不限于EDTA、依地酸盐(酯)、柠檬酸盐(酯)、喷替酸盐(酯)、缓血酸胺、山梨酸盐(酯)、抗坏血酸盐(酯)、其衍生物或其混合物;如非螯合剂,包括但不限于亚硫酸盐(酯)、苯甲酸、苄醇、氯丁醇和对羟基苯甲酸酯中的任意一种或多种)、糖(如蔗糖等)、重构促进剂、负电荷组分(例如胆汁盐、胆汁酸、甘氨胆酸、胆酸、鹅脱氧胆酸、牛磺胆酸、甘氨鹅脱氧胆酸、牛磺鹅脱氧胆酸、石胆酸、熊脱氧胆酸、脱氢胆酸、磷脂)。
作为本发明的优选,本发明所述制剂可采用无菌制备、终端过滤或射线灭菌制备,所得制剂采用溶液保存或被制备成冻干制剂,进一步优选地,本发明所述制剂为静脉注射制剂。
再一方面,本发明的卡巴他赛和白蛋白的无菌冻干组合物或制剂可用于治疗癌症,包括但不限于前列腺癌、结肠癌、头颈部鳞状细胞癌、乳腺癌、头颈癌、胰腺癌、膀胱癌、脂肪肉瘤、肺癌、胃腺癌、食管癌和卵巢癌中的一种或多种。
本发明的冻干组合物或制剂的给药剂量可随具体给药方法和被治疗的癌症的具体类型而变化。该剂量足以产生期望的有益效果。组合物可以配制用于单一剂量施用或多重剂量施用。
本发明的冻干组合物或制剂可以通过本领域技术人员已知的任何途径施用,包括肌内、静脉内、真皮内、病灶内、腹膜内注射或任何其他适合的途径。施用可以是局部、表面或者全身的,取决于治疗部位。在任何给定情况下的最合适途径取决于多种因素,例如疾病的性质、疾病的进程、疾病的严重性等。作为优选,本发明的药物组合物或药物制剂通过静脉内注射给药。
本发明的冻干组合物或制剂还可以与第二活性化合物/第二治疗剂一起施用。本发明的冻干组合物或药物制剂可以与第二活性化合物/第二治疗剂同时、相继或并行施用。在分别施用时,本发明的冻干组合物或制剂和第二活性化合物或第二治疗剂可以以不同的用药频率或间隔施用。
可用于本发明的第二活性化合物/第二治疗剂可以包括但不限于蒽环类药物(如表柔比星)、核苷类化合物(如吉西他滨)等。
为了解决卡巴他赛的溶解性缺陷,现有技术大多采用人血清白蛋白纳米制剂的方式。通常选用的白蛋白纳米制剂的制备方法为基于二硫键形成法的技术,即首先将药物溶于与水不相混溶的有机溶剂得到油相,将白蛋白溶于水性介质得到水相,然后再将油相与水相混合均化、制备纳米粒。但是此方法必须使用氯仿、二氯甲烷等水不溶性有机溶剂才能保证在制备的过程中得到均匀的混悬液,从而保证能够制备细微的纳米颗粒,然而这些有机溶剂不仅具有较大的毒性不宜于长期大量施用于人体,还会导致白蛋白变性,破坏蛋白纳米粒制剂的稳定性。
专利CN102458112A和专利CN103393632A公开了紫杉烷类药物白蛋白纳米颗粒组合物,在制备中大量使用到了氯仿/二氯甲烷等毒性大的有机溶剂。专利CN103393632A在说明书中特别指出需控制二氯甲烷/氯仿含量在90%(v/v)以上,才能够保证制备得到可无菌过滤的纳米颗粒,并且说明为了得到直径小于200nm并可无菌过滤的颗粒,有机相内含有一种与水不相混溶的有机溶剂是非常必要的,甚至还在实施例中直接使用二氯甲烷作为有机相;而专利CN1515244A则明确指出只有在非常低的乙醇组分(小于3%,V/V)情况下制备的颗粒才能够无菌过滤。
此外,现有技术为了得到稳定的卡巴白蛋白纳米制剂,使用了高浓度的白蛋白。专利CN103393632A指出白蛋白水溶液浓度为5-25%(w/v),范围在10%-20%(w/v)最好,即在浓度范围为50-250mg/ml,在专利CN103393632A中还提到,蛋白质在纳米颗粒中起到分散、稳定微粒的作用,蛋白质用量较少则无法制备得到稳定的白蛋白纳米颗粒。由于高浓度的人血清白蛋白会导致过敏、体液留滞等不良反应,且在白蛋白的收集时,血液采集、储存等过程可能存在污染,也会使得血液制品的安全性存在隐患。因此,白蛋白的大量使用不仅不利于临床安全,还会增加生产成本。本发明卡巴他赛和白蛋白的无菌冻干组合物和制备方法的有益效果如下:
1、本发明卡巴他赛和白蛋白的组合物,无需使用吐温-80等表面活性剂。本发明的药物组合物通过处方和工艺参数的调整,避免了添加吐温-80等表面活性剂,也能够制备得到稳定的组合物,克服了表面活性带来的严重过敏性缺陷。
2、本发明卡巴他赛和白蛋白的组合物在制备过程中仅使用醇类有机溶剂,避免使用二氯甲烷/氯仿等有机溶剂,克服了现有技术中须添加毒性大、与水不混溶的溶剂的缺陷。
3、本发明卡巴他赛和白蛋白的组合物降低了白蛋白的使用浓度,保证了临床用药的安全性,降低了生产成本。
4、本发明卡巴他赛和白蛋白的组合物具有小于200nm的平均粒径和优秀的稳定性。
5、本发明的卡巴他赛和白蛋白的组合物在制备冻干制剂时,不需要添加冻干保护剂和蛋白稳定剂,也能够制备得到合格的冻干制剂。
附图说明
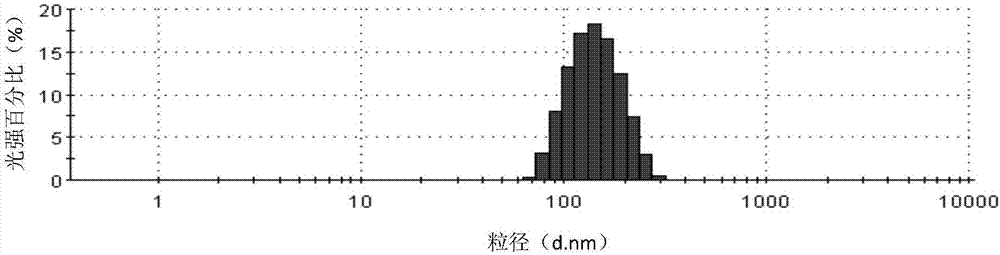
图1示出了实施例1的卡巴他赛白蛋白纳米颗粒的粒径分布图。
图2示出了实施例2的卡巴他赛白蛋白纳米颗粒的粒径分布图。
图3示出了实施例3的卡巴他赛白蛋白纳米颗粒的粒径分布图。
图4示出了实施例4的卡巴他赛白蛋白纳米颗粒的粒径分布图。
图5示出了实施例5的卡巴他赛白蛋白纳米颗粒的粒径分布图。
图6示出了实施例6的卡巴他赛白蛋白纳米颗粒的粒径分布图。
图7示出了实施例7的卡巴他赛白蛋白纳米颗粒的粒径分布图。
图8示出了实施例1的卡巴他赛白蛋白纳米颗粒的zeta电位图。
具体实施方式
下面将结合实施例对本发明作进一步阐述,但这些实施例不对本发明构成任何限制。
本发明中的rpm是转速的单位,即转/分;psi压力的单位,即磅/平方英寸。
本发明中的卡巴他赛衍生物包括但不限制于结构类似于卡巴他赛的化合物,或者在与卡巴他赛、卡巴他赛司类似物、或者卡巴他赛或其类似物的药学上可接受盐同一个总化学类别中的化合物,还可以包括上述化合物的药学上可接受的盐。
本发明的平均粒径的测定:取待测样品加注射用水或0.9%氯化钠等溶液分散均匀,得样品贮备液,取样品贮备液适量,用水稀释至半透明(或用水稀释5-30倍),使用纳米粒度仪(Zetasizer Nano ZS,马尔文仪器有限公司)进行平均粒径的测定。
本发明的Zeta电位的测定:取待测样品加注射用水或0.9%氯化钠溶液分散均匀,使用纳米粒度仪(Zetasizer Nano ZS,马尔文仪器有限公司)进行Zeta电位的测定。
实施例1
将300mg的卡巴他赛溶于30ml的乙醇中,形成有机相,将400ml人血白蛋白水溶液(15mg/ml)作为水相,将水相与有机相混合,置于高速剪切机内以10000rpm的转速剪切后转入高压均质机内,在35000psi的压力下进行均质,5次循环,制备得到混悬液,其颗粒平均粒径为119.8nm,pH为6.7,将混悬液通过0.22μm的无菌滤头过滤除菌,直接冷冻干燥60h即可,得到冻干组合物,将冷冻干燥完成后的组合物,以生理盐水作为复溶介质,测得zeta电位为-5.7mv,使用马尔文粒度测定仪进行粒度分析,测得的平均粒径为120.3nm,室温放置后,经高效液相色谱(HPLC)检测,发现卡巴他赛含量无明显变化,稳定性大于72小时。
实施例2
将300mg的卡巴他赛溶于15ml的乙醇中,形成有机相,将500ml人血白蛋白水溶液(6mg/ml)作为水相,将水相与有机相混合,置于高速剪切机内以7000rpm的转速剪切后转入高压均质机内,在30000psi的压力下进行均质,5次循环,制备得到混悬液,其颗粒平均粒径为134.4nm,pH为6.5,将混悬液通过0.22μm的无菌滤头过滤除菌,直接冷冻干燥60h即可,得到冻干组合物,将冷冻干燥完成后的组合物,以生理盐水作为复溶介质,测得zeta电位为-3.4mv,使用马尔文粒度测定仪进行粒度分析,测得的平均粒径为135.4nm,室温放置后,经HPLC检测,发现卡巴他赛含量无明显变化,稳定性大于72小时。
实施例3
将300mg的卡巴他赛溶于10ml的乙醇中,形成有机相,将180ml人血白蛋白水溶液(20mg/ml)作为水相,将水相与有机相混合,置于高速剪切机内以15000rpm的转速剪切后转入高压均质机内,在40000psi的压力下进行均质,6次循环,制备得到混悬液,其颗粒平均粒径为164.4nm,pH为7.0,将混悬液通过0.22μm的无菌滤头过滤除菌,直接冷冻干燥60h即可,得到冻干组合物,将冷冻干燥完成后的组合物,以生理盐水作为复溶介质,测得zeta电位为-7.5mv,使用马尔文粒度测定仪进行粒度分析,测得的平均粒径为165.7nm,室温放置后,经HPLC检测,发现卡巴他赛含量无明显变化,稳定性大于72小时。
实施例4
将300mg的卡巴他赛溶于6.7ml的乙醇中,形成有机相,将1700ml人血白蛋白水溶液(3mg/ml)作为水相,将水相与有机相混合,置于高速剪切机内以12000rpm的转速剪切后转入高压均质机内,在30000psi的压力下进行均质,6次循环,制备得到混悬液,其颗粒平均粒径为184.1nm,pH为7.5,将混悬液通过0.22μm的无菌滤头过滤除菌,直接冷冻干燥60h即可,得到冻干组合物,将冷冻干燥完成后的组合物,以生理盐水作为复溶介质,测得zeta电位为‐4.6mv,使用马尔文粒度测定仪进行粒度分析,测得的平均粒径为185.1nm,室温放置后,经HPLC检测,发现卡巴他赛含量无明显变化,稳定性大于72小时。
实施例5
将300mg的卡巴他赛溶于15ml的乙醇中,形成有机相,将1125ml人血白蛋白水溶液(4mg/ml)作为水相,将水相与有机相混合,置于高速剪切机内以7000rpm的转速剪切后转入高压均质机内,在40000psi的压力下进行均质,6次循环,制备得到混悬液,其颗粒平均粒径为162.1nm,pH为6.2,将混悬液通过0.22μm的无菌滤头过滤除菌,直接冷冻干燥60h即可,得到冻干组合物,将冷冻干燥完成后的组合物,以生理盐水作为复溶介质,测得zeta电位为-2.8mv,使用马尔文粒度测定仪进行粒度分析,测得的平均粒径为163.6nm,室温放置后,经HPLC检测,发现卡巴他赛含量无明显变化,稳定性大于72小时。
实施例6
将300mg的卡巴他赛溶于15ml的乙二醇中,形成有机相,将150ml人血白蛋白水溶液(3mg/ml)作为水相,将水相与有机相混合,置于高速剪切机内以7000rpm的转速剪切后转入高压均质机内,在40000psi的压力下进行均质,5次循环,制备得到混悬液,其颗粒平均粒径为143.5nm,pH为6.1,将混悬液通过0.22μm的无菌滤头过滤除菌,直接冷冻干燥60h即可,得到冻干组合物,将冷冻干燥完成后的组合物,以生理盐水作为复溶介质,测得zeta电位为-8.3mv,使用马尔文粒度测定仪进行粒度分析,测得的平均粒径为143.6nm,室温放置后,经HPLC检测,发现卡巴他赛含量无明显变化,稳定性大于72小时。
实施例7
将300mg的卡巴他赛溶于10ml的甲醇中,形成有机相,将75ml人血白蛋白水溶液(10mg/ml)作为水相,将水相与有机相混合,置于高速剪切机内以10000rpm的转速剪切后转入高压均质机内,在40000psi的压力下进行均质,5次循环,制备得到混悬液,其颗粒平均粒径为168.7nm,pH为6.8,将混悬液通过0.22μm的无菌滤头过滤除菌,直接冷冻干燥60h即可,得到冻干组合物,将冷冻干燥完成后的组合物,以生理盐水作为复溶介质,测得zeta电位为-6.1mv,使用马尔文粒度测定仪进行粒度分析,测得的平均粒径为169.0nm,室温放置后,经HPLC检测,发现卡巴他赛含量无明显变化,稳定性大于72小时。
试验例1
将实施例1-7冻干后的组合物,用生理盐水复溶后,分别在不同时间点测定其平均粒径和Zeta电位,结果如下表
由上述数据可知,本发明卡巴他赛制剂稳定性优异,用生理盐水复溶后72小时中测得粒径和Zeta电位无明显改变。
试验例2
依照实施例3的制备方法,采用不同有机溶剂制备得到卡巴他赛白蛋白冻干组合物,用生理盐水复溶后,分别在不同时间点测定其粒径,考察不同有机溶剂对于卡巴他赛白蛋白纳米制剂的平均粒径和稳定性的影响,结果如下表:
由上述数据可知,采用“乙酸乙酯”、“二氯甲烷”、“丙酮”、“乙醇/氯仿”、“乙醇/二氯甲烷”等有机溶剂制备得到的卡巴他赛白蛋白冻干组合物,其粒度稳定性小于72小时。
试验例3
依照实施例1的制备方法,采用不同白蛋白浓度制备得到卡巴他赛白蛋白冻干组合物,用生理盐水复溶后,分别在不同时间点测定其粒径,考察不同白蛋白浓度对卡巴他赛白蛋白纳米制剂的平均粒径和稳定性的影响,结果如下表:
由上述数据可知,采用本发明的制备方法时,白蛋白浓度过小时,将无法形成纳米粒,而白蛋白浓度过大时,给制备得到的冻干组合物的粒度稳定性带来较大影响。
试验例4
取实施例1-7制备的冻干组合物,通过HPLC考察放置不同时间后主药卡巴他赛的含量和杂质的变化情况
由上述数据可知,本发明卡巴他赛制剂稳定性优异,主药含量及杂质含量在72小时中无明显变化。
试验例5
考察添加/不添加冻干保护剂和蛋白稳定剂对本发明组合物的性质影响
依照实施例1的制备方法均质制备得到分散悬浮液,将上述分散悬浮液过滤除菌后加5%质量体积百分含量的甘露醇(W:V)直接冻干60小时,生理盐水复溶后,测得卡巴他赛颗粒平均直径为121.5nm,Zeta电位为-5.7mv,主药含量为99.5%,杂质0.08%;
依照实施例1的制备方法直接冷冻干燥60h得到的冻干组合物,以生理盐水作为复溶介质,测得卡巴他赛颗粒平均粒径为120.3nm,zeta电位为-5.7mv,主药含量为99.9%,杂质0.07%。
从本试验例数据可以看出:本发明组合物在冻干步骤中,与添加冻干保护剂和蛋白稳定剂相比,不添加冻干保护剂和蛋白稳定剂的组合物的性质基本不变。因此本发明组合物在冻干步骤中无需添加冻干保护剂和蛋白稳定剂,降低了药物生产成本,保证了临床用药的安全性。
试验例6
考察本发明以外组合物不添加冻干保护剂/稳定剂对性质的影响
将300mg卡巴他赛溶解于1.35ml的三氯甲烷及0.15ml的无水乙醇中,有机相加入到28.5ml(9.47%,w/v)的人血白蛋白水溶液中,混合物在低转速条件下剪切均浆3分钟形成粗乳液,转移至高压均浆器内,3,000~30,000psi压力条件下均浆7次循环。得到的药液转移至旋转蒸发器内,40℃条件下减压(10-15KPa)蒸发30分钟除去有机溶剂。得到的分散悬浮液为半透明,将分散悬浮液通过0.22μm微孔滤膜过滤器,卡巴他赛颗粒平均直径为153nm。
冻干:
A、将上述分散悬浮液直接冷冻干燥48小时,生理盐水复溶后,测得卡巴他赛颗粒平均直径为155nm,zata电位为-21.4mv,主药含量为90.4%,杂质8.4%;
B、将上述分散悬浮液直接冻干60小时,生理盐水复溶后,测得卡巴他赛颗粒平均直径为152nm,zata电位为-18.7mv,主药含量为88.7%,杂质11.2%;
从本试验例数据可以看出,本发明以外的卡巴他赛白蛋白组合物,在未使用冻干保护剂或稳定剂的情况下,直接冻干得到的产品,主药含量和杂质含量均明显劣于本发明。
在本发明提及的所有文献都在本申请中引用作为参考,且每一篇文献被单独引用作为参考。此外,应该理解,在阅读了本发明的上述内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等同替换形式同样落于本申请权利要求书所限定的范围。
- 还没有人留言评论。精彩留言会获得点赞!