以白介素33为治疗靶点的肿瘤疫苗的制作方法
本发明涉及分子生物学及免疫学领域,具体来说是一种以白介素33为治疗靶点的乳腺癌疫苗。
背景技术:
白细胞介素-33是2005年由Schmitz等发现的IL-1家族成员,主要在一些屏障细胞中组成型表达,在细胞坏死或损伤时释放,因此被称为“警报素”。IL-33可与表达在巨噬细胞、DC细胞,NK细胞等Th2细胞表面的ST2受体相结合,激活下游信号通路,调节固有免疫和适应性免疫,另外,在特定的病理条件下,,IL-33还可激活Th1、CD8+T细胞等免疫细胞。IL-33在炎症性疾病中具有双重作用,一方面对肥胖和动脉粥样硬化等具有保护作用,另一方面,在哮喘和过敏性疾病中又具有致炎作用。
IL-33在肿瘤免疫中的作用尚不清楚,相关研究认为IL-33可通过抑制固有抗肿瘤免疫,增加瘤内免疫抑制性细胞的数量,来促进肿瘤的发展和转移,研究发现在乳腺癌模型中IL-33可促进髓源性抑制细胞(MDSC)和调节性T细胞(T-reg)等免疫抑制细胞的在肿瘤组织的浸润,从而促进肿瘤的发展和转移。在胃癌中的研究显示,IL-33可促进胃癌细胞的侵袭和转移。另一方面,有文献指出,在转基因过表达IL-33的B16黑色素瘤和Leiws肺癌小鼠模型中,IL-33可通过增加CD8+T细胞和NK细胞的活性,来增加瘤内肿瘤浸润性CTL效应,进而起到抑制肿瘤转移的作用。因此,IL-33可能在不同的肿瘤模型中,不同的肿瘤微环境中具有不同的作用。具体来说,IL-33可能在肿瘤的免疫逃逸和机体的抗肿瘤效应方面起双重作用。一方面通过增加免疫抑制性细胞在肿瘤组织的富集,促进肿瘤的生长和转移,另一方面,通过募集CD8+T细胞和NK细胞等免疫细胞的浸润,打破肿瘤微环境的免疫耐受,进而抑制肿瘤的增殖。因此,IL-33在抗肿瘤免疫中的角色及确切机制有待进一步的研究。
乳腺癌是女性最常见的恶性肿瘤之一,其死亡率已上升至女性恶性肿瘤第一位,严重威胁女性的生命健康,目前,随着医疗技术的发展,以及放疗、化疗等辅助手段的应用,乳腺癌患者的总体生存率得到极大改善,但是每年还有30%-40%的复发和转移,仍导致患者死亡。临床分离的乳腺肿瘤组织中高表达IL-33,且与肿瘤的发展相关,提示在乳腺癌中,IL-33具有可能的促肿瘤效应。
本发明以HBcAg病毒样颗粒形式呈递IL-33,阐述该重组后的假病毒颗粒的抗肿瘤效力,该重组假病毒颗粒疫苗形式能突破自身的免疫耐受,产生针对自身的抗IL-33的特异性抗体,从而拮抗机体自身的IL-33蛋白水平,下调IL-33,抑制肿瘤生长。
技术实现要素:
以IL33-HBcAg重组病毒样颗粒进行皮下注射,对小鼠进行主动免疫,每隔两周免疫一次,每只100ug,共免疫三次,诱导小鼠产生持续性的IL-33特异的抗体应答,末次免疫后隔两周于小鼠第四脂肪垫原位接种4T1肿瘤细胞,每只1×105cell,第10天成瘤,观察肿瘤生长情况,发现以HBcAg-33病毒样颗粒形式预防性免疫后,小鼠肿瘤生长受到显著抑制,观测时间点结束后,收集免疫后的小鼠脾脏,进行流式检测CTL、Th1/Th2表达水平,ELISPOT检测分泌IFN-γ的淋巴细胞数目,发现疫苗组显著提高了CTL和分泌IFN-γ的淋巴细胞水平。
附图说明
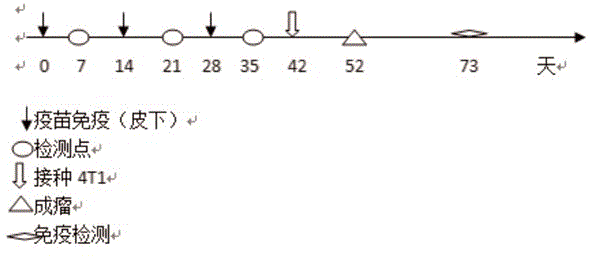
图1显示了免疫记忆的实验程序
图2显示了预防性免疫HBcAg-33疫苗组较载体组显示出较高的IL-33特异性IgG抗体水平。(n=10)
图3显示了疫苗组与载体组的肿瘤生长曲线,预防性免疫HBcAg-33疫苗组,显著抑制了肿瘤的生长。(n=10)
图4显示了疫苗组与载体组小鼠的肺转移情况,预防性免疫HBcAg-33疫苗组没有出现肺部的转移。(n=10)
图5显示了从疫苗组与载体组小鼠体内分离的肿瘤大小情况,疫苗组显著抑制了肿瘤的生长。(n=10)
图6显示了经流式细胞分析,预防性免疫HBcAg-33疫苗组显著提高了CTL的数目。(n=10)
图7显示了经ELISPOT分析,预防性免疫HBcAg-33疫苗组显著提高了分泌IFN-γ的淋巴细胞数目。(n=10)
图8显示了IL-33预防性免疫对Th1/Th2应答偏倚的调控,在肿瘤微环境中,IL-33具有调控Th1应答偏倚的能力。(n=10)
具体实施方式
通过以下实施例详细描述本发明,以便本领域普通技术人员能够更好地理解本发明。下述实施例仅仅出于示范性目的,并非意在限制本发明的范围。已经努力确保有关数字的准确性,但应该考虑到会存在一些误差和偏差。
实施例
实施例1:HBcAg-33的诱导表达及纯化
HBcAg-33的诱导表达及纯化方法如专利<<主动免疫治疗慢性哮喘的呈递IL-33的VLP疫苗构建方法>>(ZL 2014 1 0248884.2)中所述。按照此方法步骤获得HBcAg-33 VLPs及载体HBcAg VLPs 作为免疫原,进行后续实验。
实施例2:小鼠预防性免疫策略
6-8周的Balb/c雌鼠,随机分为3组,8只/组,分别为疫苗组、载体组和PBS组。免疫形式如图1所示,纯化的HBcAg-33 VLPs、载体HBcAg VLPs、PBS分别在对应组的背部皮下免疫,按每只100ug的注射剂量,隔两周免疫1次,共免疫3次。每一次免疫后一周于小鼠大腿隐静脉采血,检测抗体水平。如图2所示,其中抗体滴度最高可达409600。
实施例3:小鼠乳腺癌原位模型建立:
首先,用含10%FBS,1%青链霉素混合溶液的RPMI-1640培养基中,于37℃,5%CO2培养箱中培养4T1肿瘤细胞,末次免疫后隔两周于小鼠腹部第四脂肪垫注射4T1肿瘤细胞,每只1×105cell,第10天成瘤,每隔两天测量肿瘤,绘制肿瘤生长曲线,监测肿瘤生长如图3所示。
实施例4:模型干预
监测肿瘤生长至13mm左右,在小鼠处于麻醉状态时,心脏取血,使小鼠安乐死,分离血清,并借助流质针经气管用1ml印第安墨水灌肺染色5分钟,然后取出肺脏并在含70%乙醇、10%福尔马林、5%乙酸的脱色中进行脱色处理,由于肿瘤结节不吸收墨水而呈现白色,并记录肺转移结节数目。统计结果如图4所示。
实施例5:流式细胞检测
无菌条件下从小鼠体内分离肿瘤和脾脏,各免疫组的肿瘤大小如图5所示,应用小鼠淋巴细胞分离液分离脾脏淋巴细胞,经PMA及离子霉素刺激后,分别进行Th1/Th2、CTL的表面及胞内分子的染色(达科为),此步骤按说明书进行,标记完成后于流式细胞仪上进行检测。统计结果如图6所示。
实施例6:ELISPOT分析
从小鼠体内分离的淋巴细胞,应用ELISPOT试剂盒达科为检测分泌IFN-r的总淋巴细胞数目,分离的脾脏淋巴细胞按3×105个细胞数目铺至96孔细胞培养板中,应用阳性刺激物体外刺激,于37℃ ,5% CO2培养箱中培养16-20h。操作步骤按照说明书进行。统计结果如图7所示。
实施例7:IgG抗体亚型检测
取分离的小鼠全血血清,ELISA检测IL-33对IgG1和IgG2a抗体亚型的调控。以实验室制备的HBcAg包被酶标板,50µl/孔,于湿盒中4℃过夜,用PBST(含5%的Tween20的PBS,pH7.2)洗涤3次,加入含5%BSA的PBST室温封闭2h,PBST洗涤3次,加入小鼠血清或组织灌洗液,室温下孵育1h,PBST洗3次,再加入生物素标记的抗小鼠IgA、IgG1与IgG2a(1:10000稀释),最后,加入亲和素-碱性磷酸酶(1:10000稀释),洗涤后加入碱性磷酸酶底物溶液,30min后,在酶标仪测OD405值,然后计算IgG1与IgG2a的比值结果如图8所示。
- 还没有人留言评论。精彩留言会获得点赞!