一种小鼠乳腺注射针及其应用的制作方法
本发明涉及实验动物学及病理学领域,尤其涉及不会对小鼠乳腺造成机械损伤的乳腺注射器具、以及非治疗目的的乳腺注射方法。
背景技术:
小鼠属于脊椎动物门、哺乳纲、啮齿目、鼠科、小鼠属、小家鼠种,是目前应用最广泛、被研究得最详尽、品种最多的哺乳类实验动物。但由于小鼠乳腺夹在皮肤和腹膜之间,呈薄片状,且小鼠乳头极小,乳头孔在解剖镜下仍不可见,所以增加了利用小鼠进行活体乳腺实验的困难。
目前,常见的小鼠乳腺注射方法有三种。一是皮下注射,由于小鼠乳腺薄片状的结构,皮下注射难以保证注射针伸入乳腺组织中,且会对乳腺造成损伤,引起炎症反应,对实验结果造成误导。二是剪去乳头后使用微量进样针注射,该方法的缺点在于微量进样针的针头直径大,难以通过乳头管进入乳池,且硬质针头易对乳腺组织造成损伤。另有个别研究中使用进口微型注射器,该器材价格昂贵且难以获得,不利于研究工作的快速开展。
技术实现要素:
基于上述现有技术的不足,本发明的目的在于提供一种小鼠乳腺注射针及其应用,本发明能够实现快速有效的向小鼠乳池中灌注液体等试剂。
为达到上述目的,本发明采用了以下技术方案:
一种小鼠乳腺注射针,该乳腺注射针是对移液器吸头经热拉伸变形形成的细管状结构进行截断处理而制成的。
所述移液器吸头加热位置距离移液器吸头尖端5mm-10mm。
所述截断处理的位置位于细管状结构的直径为0.5mm-1.0mm处,截断处理后拉伸变形部分保留的长度为3-6cm。
一种非治疗目的的小鼠乳腺注射的方法,包括以下步骤:
步骤一:制备乳腺注射针
在酒精灯上加热移液器吸头距离其尖端5mm-10mm处,待移液器吸头受热部分熔化变形时移除酒精灯,同时通过向两侧拉伸将移液器吸头受热部分拉成细管;待移液器吸头冷却定型后从细管直径0.5mm-1.0mm处切断细管,得到尖端具有3-6cm长度细管的移液器吸头,即乳腺注射针,细管端部直径及长度与乳导管、乳池结构相适应,可以满足沿乳导管走针和进入乳池的操作要求;
步骤二:将小鼠麻醉后固定于实验台上,然后对小鼠腹部待注射乳腺所对应乳头以及乳头周边区域进行消毒;
步骤三:将试剂装入乳腺注射针内;
步骤四:将乳腺注射针尖端伸入所述乳头后沿着乳导管走向行进,直至达到乳池内;
步骤五:用移液器将乳腺注射针内的试剂注入乳池后将乳腺注射针抽出。
优选地,所述移液器吸头的规格为200μl-1ml。(通过局部受热以及拉伸,无需特殊机械,即可以人工制得满足直径以及长度配合要求的细管)
优选地,在步骤二中,所述小鼠选自进入哺乳期第7-10天的母鼠进行实验。此时期的乳腺腺泡发达,分泌旺盛,常用于乳腺功能研究。
优选地,在步骤二中,所述待注射乳腺选自小鼠腹部靠近尾端的乳腺。
优选地,乳腺注射针尖端伸入乳头后,从腹中部向同侧腹股沟方向水平进针5-10mm,即可达到乳池。
优选地,液体试剂注入乳池后,使乳腺注射针在小鼠体内停留1-3秒后再抽出,以免液体流出。
本发明的有益效果体现在:
本发明通过制作乳腺注射针,可配合移液器对小鼠乳腺进行乳池注射,材料易得、价格低廉,且对小鼠乳腺无机械损伤,为小鼠乳腺病理学、功能学实验提供了切实可行、方便快捷的试验手段。
附图说明
图1为小鼠乳腺注射方法中注射针制作过程的示意图。
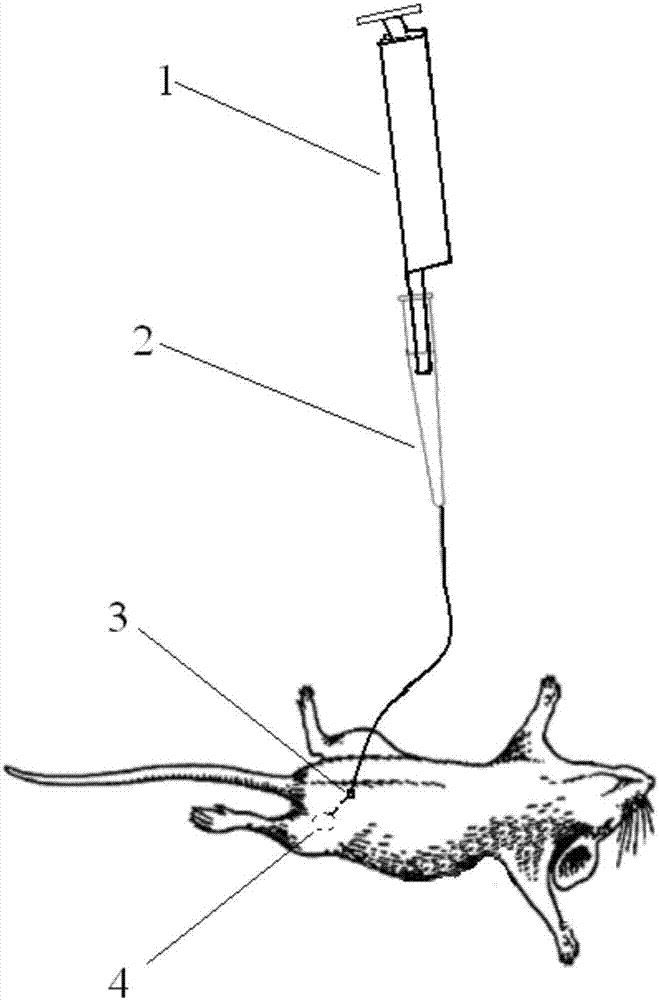
图2为小鼠乳腺注射方法中利用注射针进行小鼠乳腺注射的示意图;其中,1为移液器,2为注射针,3为乳头,4为乳池。
图3为小鼠乳腺在注射后的病理切片之一,其中,(a)为注射lps的小鼠乳腺病理切片;(b)为注射生理盐水的小鼠乳腺病理切片对照。
图4为小鼠乳腺在注射后的病理切片之二,其中,(a)为注射lta的小鼠乳腺病理切片;(b)为注射生理盐水的小鼠乳腺病理切片对照。
具体实施方式
以下结合附图及实施例对本发明进行详细说明。应当理解,此处所描述的实施例仅用以解释本发明,但不用于限定本发明。
实施例1.lps诱导小鼠乳腺炎症反应实验
步骤一:取迷你酒精灯和200μl灭菌移液器吸头(聚丙烯等塑料材质)若干;点燃酒精灯,一手持移液器吸头的尾端,另一手持钢镊夹住移液器吸头尖端,在酒精灯上加热移液器吸头尖端5mm-10mm处;待移液器吸头受热部分熔化变形时迅速移出火焰范围,同时双手快速向两侧拉伸,则可将移液器吸头受热部分拉成极细的细管状结构;待移液器吸头冷却定型后松开钢镊,用手术刀在细管直径0.5mm-1.0mm处切断细管,且以切断后在移液器吸头上保留3-6cm细管为宜,即制成乳腺注射针,参见图1。
步骤二:用盐酸戊巴比妥钠按每10g体重0.1ml腹腔注射小鼠(选择正在哺乳期第7-10天的母鼠进行实验),待小鼠失去意识后使其仰卧于实验台上,固定好胸部及四肢;用酒精棉对小鼠腹部靠近尾端的第4对乳腺区域进行充分消毒,消毒后用消毒眼科镊提起小鼠乳头,用消毒眼科剪剪去乳头3尖端2-3mm。
步骤三:将乳腺注射针2安装在200μl移液器1上,吸取药液(本实施例以脂多糖(lps)为例,生理盐水作对照)20-50μl;由于所述注射针尖端纤细且有一定长度,若吸取药液速度过于缓慢可用移液器1吸取药液从所述注射针尾部注入,再将所述注射针安装在移液器1上。
步骤四:一手持眼科镊提起小鼠乳头断端皮肤,可见乳导管开口,右手持乳腺注射针2前部细管,将所述注射针尖端伸入乳导管中;伸入后沿腹中部向同侧腹股沟方向水平进针5-10mm即至小鼠乳池4,参见图2,进针过程中,注射针尖端细管由于柔软可弯折的特点,可以沿着乳导管行进,直至达到乳池,因而可以避免对乳腺的损伤。
步骤五:用移液器1将药液缓慢注入小鼠乳池4内,若药液注入十分缓慢或停滞,可调整乳腺注射针2深度和位置再推,也可将所述注射针套在1ml移液器吸头前部,用1ml量程移液器推入药液;待药液快推尽时放慢注入速度,药液完全注入后及时松开移液器,停留1-3秒后将所述注射针缓慢抽出。
步骤六:4小时后将小鼠处死,收取小鼠乳腺做组织切片病理学分析;
步骤七:对注射结果进行病理学分析:
(1)参见图3a,注射lps的小鼠乳腺发生炎性浸润,且未观察到注射造成的乳腺机械损伤;
(2)参见图3b,注射生理盐水作为对照的小鼠乳腺无炎性反应,且未观察到注射造成的乳腺机械损伤。
通过注射外源性脂多糖(lps)和生理盐水验证了本发明的小鼠乳腺注射方法,可有效实现对小鼠乳腺的注射,且不会对乳腺造成机械损伤。
实施例2.lta诱导小鼠乳腺炎性反应实验
在实施过程中,也可以不对小鼠乳头进行剪切,而是清除小鼠乳头角质后,利用乳腺注射针尖端(细管切口为斜面)在乳头端面进行一定次数的刺入操作,直至注射针尖端自乳头孔进入乳导管。该方法可满足需多次注射的实验研究。
该实施例的步骤与实施例1基本相同,不同之处在于,注射的液体为脂磷壁酸(lta),且注射完成后(步骤五后)将小鼠放回干净鼠笼,仰卧放置以免伤口感染。此后每2天进行一次注射,共注射3次直至小鼠哺乳期结束。然后处死小鼠,取小鼠乳腺组织,并与实施例1按相同的病理学检测进行分析。
实验结果如下:
(1)参见图4a,注射lta的小鼠乳腺发生炎性浸润,且未观察到注射造成的乳腺机械损伤;
(2)参见图4b,注射生理盐水作为对照的小鼠乳腺无炎性反应,且未观察到注射造成的乳腺机械损伤。
通过注射外源性脂磷壁酸(lta)和生理盐水验证了本发明的小鼠乳腺注射方法,可有效实现对小鼠乳腺的注射,且不会对乳腺造成机械损伤。
本发明利用常用的移液器吸头制成注射针,注射过程具有容易操作、不损伤乳腺的特点,且费用远远低于使用进口微型注射器进行注射,对于降低实验成本,节约开支效果显著,以一次实验为例,相比采用进口微型注射器,可节约500-1000元经费。
综合以上得出以下结果:本发明所述的小鼠乳腺注射针及注射的方法切实可行,经济高效,在病理学、功能学研究等领域应用前景广阔。
- 还没有人留言评论。精彩留言会获得点赞!