治疗抑郁症的方法和药物组合物与流程
本发明涉及疾病治疗和药物领域。具体的,本发明涉及抑郁症的治疗和用于治疗抑郁症的药物组合物和其制备方法。
背景技术
抑郁症在人群中具有很高的发生比例。抑郁症患者如果不进行合适的治疗,在情绪和身体上都会受到重大影响。根据美国国家精神健康研究所(usnationalinstituteofmentalhealth,nimh)的定义和描述,抑郁症包括以下症状:“持续性悲伤、焦虑或空虚”的情绪;绝望感、悲观感;罪恶感、无价值感、无助感;失去对享受过的爱好和活动的兴趣和快乐;精力减少、疲劳;难于集中精神、记忆困难、难于做决定;多动、易怒等。
外侧缰核(lateralhabenula,lhb)是缰核的组成部分,位于上丘脑。外侧缰核是边缘前脑和中脑间传递信息的主要组织。近年来,发现外侧缰核与多巴胺能和5-羟色胺能的神经纤维联接和调控,使得外侧缰核参与了多种生理活动,影响机体功能,与药物成瘾、奖赏-厌恶、疼痛、睡眠等精神状态和病症相关。
已经发现外侧缰核与抑郁症的发生具有关联。研究表明,在抑郁大鼠中,外侧缰核至vta投射神经元的微小兴奋性突触后电流mepsc的频率相对于正常大鼠显著增高,这提示在缰核中,这种抑郁相关的过度兴奋状态有可能是由突触可塑性机制所介导的(li,b.etal.nature470,535–539,2011)。在正常情况下,外侧缰核对vta与drn有低水平的抑制作用。在抑郁症中,精神压力导致βcamkii表达量显著上升,导致外侧缰核神经元的glur1上膜,神经元兴奋性和突触传递效率均显著增强。外侧缰核的高度兴奋增强对vta与drn抑制,导致快感缺失和行为上的绝望表现(lietal.,science341,1016–1020,2013)。.
本领域已经具有一些常用的抗抑郁药物,但这些药物通常在比较长的一段时间后才能见效。而且导致抑郁症的病理机制还未完全被认识。本领域还需要新的,或是起效更快速、使用剂量更安全的治疗抑郁症的方法和药物。
技术实现要素:
本发明首次和意外发现外侧缰核的神经元的簇状放电(burst)在抑郁症的产生中具有重要作用,并发现了影响外侧缰核的簇状放电的关键因素,由此提供了通过抑制外侧缰核的簇状放电来治疗(抑制)抑郁症的方法和药物,特别是快速治疗(抑制)抑郁症的方法和药物。
具体的,本发明提供了通过抑制外侧缰核的簇状放电来治疗抑郁症的方法。本发明提供了抑制外侧缰核中簇状放电的试剂用于治疗抑郁症的药物的用途,特别是施用在外侧缰核的用于治疗抑郁症的药物。本发明还提供了治疗抑郁症的药物组合物,特别是施用在外侧缰核的用于治疗抑郁症的药物组合物,其含有抑制外侧缰核中簇状放电的试剂。
术语“簇状发放”,或“簇状放电”,是指神经元在放电过程中同时产生两个或两个以上锋电位的放电模式。
抑制簇状放电是指抑制簇状放电的发放程度,包括减少簇状放电的频率或簇状放电过程中簇内峰电位的个数,降低簇状放电的强度,甚至是消除簇状放电的发生。
术语“单个发放”,或“单个放电”,是神经元在放电过程中每次发放一个锋电位的放电模式。
抑制簇状放电的试剂包括能够在对簇状放电起抑制作用的化合物、复合物或混合物,以及在抑制簇状放电的方法(含外科手术方法)中使用的制剂等。所述试剂包括小分子化合物或复合物,或是蛋白、核酸等大分子活性成分,例如与簇状放电生理途径上的蛋白结合的拮抗剂如抗体,或是影响这些蛋白的表达水平的核酸等。
本发明中,“治疗”包括:改良、减轻、减少或预防与抑郁症相关的症状的进行中的过程或结果;改善与抑郁症相关的症状的进行中的过程或结果;使处于导致特定机体功能损伤的疾病或病症中的机体功能正常化的进行中的过程或结果;或者引发疾病的一种或多种临床可测定的参数改善的进行中的过程或结果。在一个实施方案中,治疗目的是预防或减慢(减轻)不希望的生理情况、病症或疾病,或获得有益的或期望的结果。该结果可以是,例如医学的、生理学的、临床的、物理治疗、职业治疗,面向保健人员或患者;或本领域理解为“生活品质”或日常生活活动的参数。本发明中,有益的或期望的临床结果包括但不限于,减轻症状;减小/缩小该情况、病症或疾病的程度;稳定(即非恶化)该情况、病症或疾病的状态;延迟该情况、病症或疾病的开始或减慢其进展;改善或缓和该情况、病症或疾病;和减轻(无论部分或总体)、无论可检测出的或不可检测出的;或增强或改善该情况、病症或疾病。在一个实施方案中,治疗包括引发临床有效响应而没有过度水平的副作用。在一个实施方案中,治疗也包括与如果不接受治疗的预期的存活期相比延长存活期。在一个实施方案中,治疗指给药药物或对患者执行医疗程序。本发明中,治疗可以是预防(防止),治愈虚弱或病,或改良患者的临床情况,包括降低病程或疾病严重度,或主观改善患者的生活品质或延长患者的存活期。
在本发明的其中一个方面,本发明的通过抑制外侧缰核的簇状放电来治疗抑郁症的方法,本发明的抑制外侧缰核中簇状放电的试剂用于治疗抑郁症的药物的用途,以及本发明的治疗抑郁症的药物组合物中,所述抑制簇状放电的试剂为n-甲基-d-天冬氨酸受体抑制剂。
n-甲基-d-天冬氨酸是一种兴奋性氨基酸(excitatoryaminoacids,eaa),是中枢神经系统的兴奋性神经递质。n-甲基-d-天冬氨酸受体(nmda受体或nmdar)是一种离子型受体,参与兴奋性突触传递。对nmda受体的调节可调节谷氨酸能神经递质介导的神经作用。
可用于本发明的n-甲基-d-天冬氨酸受体抑制剂包括但不限于:
1)nmda受体的竞争性抑制剂(与谷氨酸结合位点竞争的抑制剂):ap5,ap7,cppene,塞福太(selfotel);
2)nmda受体的非竞争性抑制剂(阻断变构结合位点的抑制剂):阿替加奈(aptiganel),氯胺酮,美金刚(memantine)、huperzinea,伊博格碱(ibogaine),hu-211,加巴喷丁(gabapentin),pd-137889等;
3)nmda受体反竞争性的通道阻断剂(通道阻断剂):金刚胺(amantadine),阿托西汀(atomoxetine),azd6765,右美沙芬(dextromethorphan),盐酸镁金刚胺,mk801(dizocilpine);
4)甘氨酸结合位点抑制剂:tk-40,犬尿酸(kynurenicacid)等。
在本发明的其中一个方面,本发明的通过抑制外侧缰核的簇状放电来治疗抑郁症的方法,本发明的抑制外侧缰核中簇状放电的试剂用于治疗抑郁症的药物的用途,以及本发明的治疗抑郁症的药物组合物中,所述抑制簇状放电的试剂为t型钙离子通道抑制剂。
t型钙离子通道或t型钙通道(transientcalciumchannel)又名低电压激活钙通道(lowvoltageactivatecalciumchannel,t-typecalciumchannel)。t型钙通道在中枢与外周神经系统的兴奋性调节中均有着重要的作用。脊椎动物中,t型钙通道家族包括3个不同的α1亚基基因:cacna1g、cacna1h、cacan1i,分别编码α1g、α1h、和α1i,从而构成了cav3.1,cav3.2和cav3.3,3种t型钙通道亚型。t型钙通道蛋白是四聚体组成的结构,每个单体即α1亚单位含四个同源区域。通道蛋白孔道由上述四个同源区域构成。孔道螺旋与细胞外s6片段的末端连接够成了钙离子选择性通过滤器。每个同源结构域的s4片段每隔三个氨基酸都有带正电的氨基酸残基,形成了通道的电压感受器,以此结构为基础在膜电位发生变化时可以控制通道的开放和关闭。
可用于本发明的t型钙离子通道抑制剂包括但不限于:
琥珀酰亚胺类(succinimides),例如乙琥胺(ethosuximide)、甲琥胺(methsuximide);乙内酰脲类(hydantoins);唑尼沙胺(zonisamide);valproate;phenytoin;mibefradil;苯妥英(phenytoin);sipatrigine;哌嗪类似物如flunarizine、z941;哌啶类似物如z944和fluoropiperidine;tta-p1;tta-p2;喹唑啉酮(quinazolinone);tta-q4;ml218等。
在本发明的其中一个方面,本发明的通过抑制外侧缰核的簇状放电来治疗抑郁症的方法,本发明的抑制外侧缰核中簇状放电的试剂用于治疗抑郁症的药物的用途,以及本发明的治疗抑郁症的药物组合物中,所述抑制簇状放电的试剂为n-甲基-d-天冬氨酸受体抑制剂和t型钙离子通道抑制剂的组合。
在本发明中,抑郁症可以特别指“外侧缰核介导的抑郁症”,尤其是指“外侧缰核簇状放电介导的抑郁症”。本申请的发明人发现并证明了外侧缰核的神经元的异常发放,特别是簇状放电的异常发放在抑郁症的产生中具有重要作用。本申请的发明人还发现了影响外侧缰核的簇状放电的关键因素,通过对这些关键因素的调节,能够抑制或消除抑郁症。
在本发明的其中一个方面,本发明的通过抑制外侧缰核的簇状放电来治疗抑郁症的方法,本发明的抑制外侧缰核中簇状放电的试剂用于治疗抑郁症的药物的用途,以及本发明的治疗抑郁症的药物组合物中,该方法或药物适合用于在其它抗抑郁方法和药物不起效的抑郁症患者中使用。
本领域已经采用的抗抑郁药,根据其抑制抑郁症的机制分类,可包括:
●褪黑激素激动剂;
●选择性5-羟色胺重摄取抑制剂(ssris);
●5-ht和去甲肾上腺素再摄取双重抑制剂(snris);
●单胺氧化酶抑制剂(maois);
●三环类抑郁药(tcas);
●三重单胺摄取阻断剂;
●代谢型谷氨酸受体(mglurs);
●gaba拮抗剂;
●nk1拮抗剂;
●nk2拮抗剂;
●crf1拮抗剂;
●精氨加压素v1b拮抗剂;
●mch受体拮抗剂;
●nt-3、nt-4拮抗剂;
●creb拮抗剂等。
以上种类的抗抑郁药和其具体药物在wo2007/137247中列出。在此通过全文引入。
本申请的发明人首次发现并证明了外侧缰核的神经元的异常发放,特别是簇状放电的异常发放在抑郁症的产生中具有重要作用,因此提供了通过抑制外侧缰核的神经元的异常发放,特别是簇状放电的异常发放来治疗(抑制)抑郁症的方法和药物。这是本领域已知的治疗抑郁症的机制和药物未能针对的病理机制和进行治疗的脑部靶组织或其分子水平上的靶目标。因此,本发明提供的方法和药物或药物组合物特别适合用于在上述抗抑郁方法和药物不起效的抑郁症患者中使用。
本领域已知某些nmda受体拮抗剂可用于治疗抑郁症。但在这些报道中,其发现的或推测的抗抑郁机制与本发明发现的机制,即通过抑制外侧缰核神经元的异常发放,特别是簇状放电的异常发放来抑制抑郁症,完全不同。在不破坏本发明的创新性的情况下,在本发明的其中一个方面,本发明的通过抑制外侧缰核的簇状放电来治疗抑郁症的方法,本发明的抑制外侧缰核中簇状放电的试剂用于治疗抑郁症的药物的用途,以及本发明的治疗抑郁症的药物组合物中,所述抑制簇状放电的试剂不包括这些nmda受体拮抗剂,例如ap5,cppene,mk801、美金刚(memantine)、氯胺酮、非尔氨脂(felbamate)、甘氨酸、d-丝氨酸、d-环丝氨酸、l-谷氨酸艾芬地尔等。
本领域存在个别的报道发现某些化合物可抑制t型钙离子通道,也具有抗抑郁症的现象。例如,氟西汀、曲唑酮和乙琥胺。但在这些报道中,其提出或假设的抗抑郁机制与本发明发现的机制,即通过抑制外侧缰核神经元中簇状放电的异常发放来抑制抑郁症,完全不同。在不破坏本发明的创新性的情况下,在本发明的其中一个方面,本发明的通过抑制外侧缰核的簇状放电来治疗抑郁症的方法,本发明的抑制外侧缰核中簇状放电的试剂用于治疗抑郁症的药物的用途,以及本发明的治疗抑郁症的药物组合物中,所述抑制簇状放电的试剂不包括氟西汀、曲唑酮和乙琥胺。
在本发明的其中一个方面,本发明的通过抑制外侧缰核的簇状放电来治疗抑郁症的方法以及本发明的抑制外侧缰核中簇状放电的试剂用于治疗抑郁症的药物的用途中,所述的抑制簇状放电的试剂不抑制单个放电(tonicpulse)。
在本发明的其中一个方面,本发明的通过抑制外侧缰核的簇状放电来治疗抑郁症的方法,本发明的抑制外侧缰核中簇状放电的试剂用于治疗抑郁症的药物的用途,以及本发明的治疗抑郁症的药物组合物中,所述方法、药物或药物组合物为在外侧缰核中局部起效,即施用在外侧缰核的方法和药物或药物组合物。对于用于神经组织的方法和药物,特别是脑部神经组织,例如外侧缰核来说,将药物的作用限定在目标组织是有益的。用于在外侧缰核中给药对治疗方法和制备药物都是限制性的技术特征。用于lhb的方法或药物需要考虑该方法或药物是否能够在lhb发挥有效性,包括药物是否能到达lhb,以及在lhb中是否能达到起效的浓度等。在本发明中,所述药物或药物组合物为在外侧缰核局部给药的剂型。可以通过局部给药的方式来达到将药物作用限定在目标组织,例如通过将药物制成可通过套管植入外侧缰核局部给药的剂型。又例如,将药物制成植入组织后缓释的剂型等。另外还可将上述药物制成组织特异性的靶向药物递送系统的形式。例如可以通过将具有抑制簇状放电功能的小分子化合物或生物活性分子(核酸如蛋白编码dna或mrna分子、蛋白如抗体等)与能够特异性结合在外侧缰核特异性表达的蛋白结合的抗体或抗体片段连接形成能够识别和结合外侧缰核的细胞的复合分子。
对于上述本发明提供的在外侧缰核中局部起效(施用在外侧缰核)的方法、制备药物的用途或药物组合物中,所述抑制簇状放电的试剂包括nmda受体拮抗剂。具体的,所述nmda受体拮抗剂可包括但不限于:
1)nmda受体的竞争性抑制剂(与谷氨酸结合位点竞争的抑制剂):ap5,ap7,cppene,塞福太(selfotel);
2)nmda受体的非竞争性抑制剂(阻断变构结合位点的抑制剂):阿替加奈(aptiganel),氯胺酮,huperzinea,伊博格碱(ibogaine),hu-211,加巴喷丁(gabapentin),pd-137889等;
3)nmda受体反竞争性的通道阻断剂(通道阻断剂):金刚胺(amantadine),阿托西汀(atomoxetine),azd6765,右美沙芬(dextromethorphan),盐酸镁金刚胺,mk801(dizocilpine);
4)甘氨酸结合位点抑制剂:tk-40,犬尿酸(kynurenicacid)等。
对于上述本发明提供的在外侧缰核中局部起效(施用在外侧缰核)的方法、制备药物的用途或药物组合物,所述抑制簇状放电的试剂包括t型钙离子通道抑制剂。本领域存在个别的报道发现某些化合物在外侧缰核中可抑制t型钙离子通道,也具有抗抑郁症的现象。例如,乙琥胺。但在这些报道中,其发现的或假设的抗抑郁的机制与本发明发现的机制,即通过抑制外侧缰核神经元中簇状放电的异常发放来抑制抑郁症,完全不同。在不破坏本发明的创新性的情况下,本发明提供的上述通过抑制外侧缰核的簇状放电来治疗抑郁症方法或抑制外侧缰核中簇状放电的试剂用于治疗抑郁症的药物的用途中,所述抑制簇状放电的试剂不包括乙琥胺。
在本发明的其中一个方面,本发明的通过抑制外侧缰核的簇状放电来治疗抑郁症的方法,本发明的抑制外侧缰核中簇状放电的试剂用于治疗抑郁症的药物的用途,以及本发明的治疗抑郁症的药物组合物,特别适合用于快速治疗(抑制)抑郁症。本发明提供的药物适合作为快速起效的治疗(抑制)抑郁症。本领域大多数抗抑郁药一般需要一周到几周时间才能发挥抗抑郁的作用,例如常用的5-ht再摄取抑制剂(ssri)通常在2-3周才显效,5-ht和去甲肾上腺素再摄取双重抑制剂通常在1周才显效。本发明提供的抗抑郁方法和药物或药物组合物的起效时间低于一周,优选低于三天,更优选低于一天,例如为低于12小时。本发明提供的药物还适合作为快速起效以及具有中效或长效的治疗(抑制)抑郁症,其单剂量的抗抑郁效果能够持续一天以上,优选持续三天以上,更优选持续一周以上。
本发明提供的治疗抑郁症的药物组合物,其包含治疗有效量的抑制外侧缰核中簇状放电的试剂。
本发明提供的药物组合物中的活性成分为抑制外侧缰核中簇状放电的试剂。尽管适用于治疗的本发明的药物组合物中的活性成分可以以原料化合物的形式给药,但优选将活性成分,任选地以生理上可接受的盐的形式,与一种或多种佐剂、赋形剂、载体、缓冲剂、稀释剂和/或其他常规的药物辅料一起引入药物组合物。
可以通过任意便利的适合于期望疗法的途径给予本发明的药物组合物。优选的给药途径包括口服给药,特别是以片剂、胶囊、锭剂、散剂和液体形式;和胃肠外给药,特别是皮肤、皮下、肌内和静脉内注射。本发明的药物组合物可以由本领域技术人员通过使用适合于期望制剂的标准方法和常规技术制备。如果需要,则可以使用适合于使活性成分缓释的组合物。
本发明的药物组合物可以是那些适合于口服、直肠、支气管、鼻、肺、局部(包括颊和舌下)、透皮、阴道或肠胃外(包括皮肤、皮下、肌内、腹膜内、静脉内、动脉内、脑内、眼内注射或输注)给药的药物组合物,或那些适合于通过吸入或吹入给药(包括粉末和液体气雾剂给药)或适合于通过缓释系统给药的形式的药物组合物。适合的缓释系统的实例包括含有本发明化合物的固体疏水性聚合物的半渗透基质,该基质可以是成形的制品形式,例如薄膜或微囊。
因此可将本发明的药物组合物中的活性成分与常规的佐剂、载体或稀释剂一起制成药物组合物及其单位剂量的形式。这样的形式包括固体、并尤其是片剂、填充胶囊、散剂和微丸的形式,以及液体、尤其是水溶液或非水溶液、混悬剂、乳剂、酏剂和填充上述形式的胶囊,所有这些形式均用于口服,用于直肠给药的栓剂、以及用于胃肠外的无菌可注射溶液。这样的药物组合物及其单位剂型可包括常规比例的常规成分,含有或不含另外的活性化合物或成分,并且这样的单位剂型可含有与所需每日应用剂量范围相当的任何适合的有效量的活性成分。
为从本发明药物组合物中的活性成分制备药物组合物,药学上可接受的载体可以是固体或者液体。固体形式的制剂包括散剂、片剂、丸剂、胶囊、扁囊剂、栓剂以及可分散的颗粒剂。固体载体可以是一种或多种还能用作稀释剂、矫味剂、增溶剂、润滑剂、悬浮剂、粘合剂、防腐剂、片剂崩解剂或包囊材料的物质。
适合于口服使用的含水混悬剂可通过将细粉碎的活性成分分散在含黏性物质、如天然或合成的树胶、树脂、甲基纤维素、羧甲基纤维素钠、或其他众所周知的悬浮剂的水中而制备。
还包括欲在临用之前转化为用于口服给药的液体形式制剂的固体形式制剂。这样的液体形式包括溶液、混悬剂和乳剂。除活性成分之外,这样的制剂还可包含着色剂、矫味剂、稳定剂、缓冲剂、人造和天然的甜味剂、分散剂、增稠剂、增溶剂等。
为了局部施用到表皮,可将本发明化合物配制成软膏剂、霜剂,或洗剂,或透皮贴剂。例如,软膏剂和霜剂可用水性或油性基质外加适合的增稠剂和/或胶凝剂配制而成。洗剂可用水性或油性基质配制而成,且通常还含一种或多种乳化剂、稳定剂、分散剂、悬浮剂、增稠剂或着色剂。
呼吸道给药也可以借助气雾剂实现,其中活性成分与适合的抛射剂一起在加压包装中提供,适合的抛射剂如含氯氟烃(cfc),例如二氯二氟甲烷、三氯氟甲烷或二氯四氟乙烷,二氧化碳或其他适合的气体。气雾剂还可适当地含有表面活性剂,如卵磷脂。药物的剂量可通过配备计量阀控制。
或者,本发明药物组合物中的活性成分可以干粉形式提供,例如化合物在适合的粉末基质(如乳糖、淀粉、淀粉衍生物(如羟丙基甲基纤维素)和聚乙烯吡咯烷酮(pvp))中的粉末混合物。适宜地,粉末载体将在鼻腔内形成凝胶。粉末组合物可以单位剂型呈现,例如以胶囊或药筒(如明胶的胶囊或药筒)形式,或以粉末可借助吸入器从中给药的泡罩包装形式。
需要时,可以应用适合提供活性成分缓释的组合物。
药物制剂优选为单位剂型。这类形式中,制剂被细分为含有适量活性组分的单位剂量。单位剂型可以是包装的制剂,该包装含有离散量的制剂,如包装的片剂、胶囊,以及小瓶或安瓿中的粉末。此外,单位剂型可以是胶囊、片剂、扁囊剂或锭剂本身,或者可以是适合数量的任何这些剂型的包装形式。
用于口服给药的片剂或胶囊和用于静脉内给药和连续输注的液体是优选的组合物。
在一个实施方案中,当意欲使用本发明的药物组合物治疗具有滥用倾向和因烟碱成瘾导致的脱瘾症状时,关注例如树胶、贴剂、喷雾剂、吸入剂、气雾剂等这样的制剂。
治疗有效剂量意指缓解症状或病况的活性成分的量。治疗功效和毒性,例如ed50和ld50,可以通过在细胞培养物或实验动物中的标准药理学程序而测定。治疗性和毒性效果之间的剂量比例是治疗指数,其可以通过ld50/ed50的比例而表达。
给予的剂量当然必须针对所治疗的个体的年龄、体重和病症,以及给药途径、剂型及给药方案,以及期望的结果而小心地调整,且确切的剂量当然应该由医师决定。
本发明还提供了一种抑郁症动物模型,优选为大鼠或小鼠。本发明所述抑郁症动物模型具有抑郁症特征,其存在外侧缰核神经元簇状放电的异常发放。
本发明还提供了采用上述动物模型筛选用于治疗抑郁症的潜在物质的方法,包括步骤:
(1)给抑郁症动物模型施用待筛选的测试物;和
(2)观察所述抑郁症动物模型中的抑郁症的相关症状和/或指标,并与对照组进行比较。
其中,如果所述抑郁症动物模型中抑郁症的相关症状有显著改善,则表示该测试物是可用于治疗抑郁症潜在物质。
在本发明的其中又一个方面,所述筛选用于治疗抑郁症的潜在物质的方法还包括以下一个或多个步骤:
对上一步骤筛选出的潜在物质,进一步测试其对神经元簇状发放的影响;
对上一步骤筛选出的潜在物质,施用于动物模型,观察其对抑郁症症状的影响;
在测试其对神经元簇状发放的影响时,如果与阴性对照组(或空白对照组)相比,加入或施用所述测试物的测试组中神经元簇状发放比例显著降低,则表示该测试物是治疗抑郁症的潜在物质。
附图说明
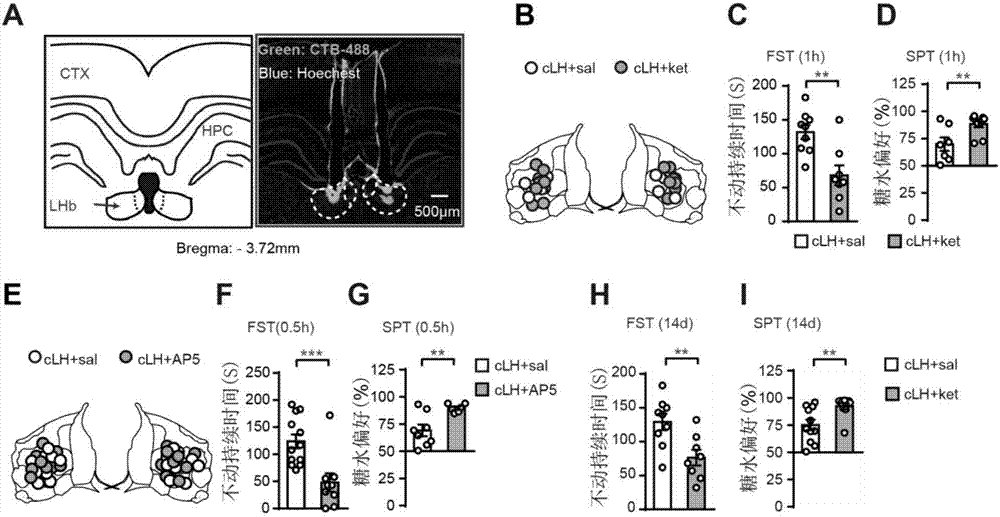
图1外侧缰核局部阻断nmda受体足以产生快速抗抑郁效果。(a)clh大鼠外侧缰核双侧套管植入示意图。白色虚线指示缰核位置。(b-g)局部双侧施加氯胺酮(25μg每侧,b-d)和ap5(40nmol每侧,e-g)到lhb,在短时间内(0.5或1小时)能有效逆转clh大鼠的抑郁表型:显著降低强迫游泳中的不动时间(c和f)和显著增高抑郁动物对糖水的偏好性(d和g)。(h-i)lhb双侧施加氯胺酮的抗抑郁效果可以持续到给药后第14天。所有数据均表示为平均值±sem。*p<0.05,**p<0.01,***p<0.001,****p<0.0001与对照组相比。n.s.表示差异不显著。其他的图标相同。
图2大鼠和小鼠抑郁动物模型中外侧缰核神经元簇状发放增强并可被氯胺酮所反转。(a)指示了全细胞膜片钳记录的记录位点,记录位点分布于外侧缰核的不同亚区。(b-d)外侧缰核中神经元的三种自发放模式典型图,分别是不放电(silent),单个放电(tonic)和簇状放电(burst)。中间是同一个神经元对ttx的反应,ttx可阻断单个放电和簇状放电的峰电位。右边放电轨迹图是左边阴影区的放大图。(e-f)散点图(e)和累积曲线(f)显示静息膜电位(rmps)的均值和分布。(g-h)簇内发放频率而非簇间发放频率与静息膜电位超级化程度正相关。(i-n)在先天抑郁(clh)大鼠和慢性束缚应激诱导的小鼠抑郁模型中,簇状放电的神经元比例显著增高。(i,l)饼状统计图显示在大鼠和小鼠抑郁模型中,簇状放电神经元数目增加。(j,m)柱图显示所有发放细胞中单个放电和簇状放电的细胞比例。(k,n)柱形统计图显示不动抑郁动物缰核中神经元峰电位间隔的分布。
图3在体电生理记录显示氯胺酮抑制慢性束缚应激小鼠缰核神经元簇状放电活性和θ波段的同步化活动。(a)在体记录电极在对照和crs小鼠lhb中的记录位点。(b)在体记录对照,crs和crs+氯胺酮的小鼠lhb神经元放电的代表性示例(左)和平均发放波形(右),通过分析峰电位间隔(isi)来分离簇状放电。(c-d)crs小鼠lhb神经元簇状放电比例和每分钟簇状放电的个数都显著高于对照小鼠,且可以被氯胺酮所反转。(e)对照小鼠和crs小鼠在氯胺酮注射前后峰电位间隔的累积分布曲线(对照组:143ms,crs组:33ms,crs+氯胺酮组:121ms)。虚线指示峰电位50%变化的点。(f)对照组和crs组小鼠在给氯胺酮前后神经元发放相关场电位,crs组相邻波谷之间的时间间隔为140ms左右(周期约为7hz)(g)对照小鼠和crs小鼠在氯胺酮注射前后单个神经元放电与场电位的相关性(sfc)。每个放电单位的sfc(左),平均的sfc(中),θ波段(4-10hz)中sfc百分比。所有数据均表示为平均值±sem。*p<0.05,**p<0.01,***p<0.001,****p<0.0001与对照组相比。n.s.表示差异不显著。其他的图标相同。
图4lhb的簇状放电需要激活nmda受体。(a)将神经元钳制在-80mv时产生的兴奋性突触后电流典型图。通过在无mg2+的人工脑脊液(acsf)中加入gaba受体抑制剂(picrotoxin)和ampa受体阻断剂(nbqx)来分离nmda受体介导的兴奋性突触后电流(nmdar-epscs),并用nmda受体阻断剂ap5来确认电流。(b)lhb神经元钳制在不同电压下记录到的nmdar-epscs,该电流可被ap5完全阻断。(c-h)lhb中氯胺酮(c-d),ap5(e-f)和nbqx(g-h)对自发簇状放电的影响。左侧为典型图,右侧为统计图。(i-j)nmda灌流可使不发放的细胞产生簇状放电,这种诱发的簇状放电可被氯胺酮所抑制。nmda可诱发大的兴奋性突触后电位和簇状放电。所有数据均表示为平均值±sem。*p<0.05,**p<0.01,***p<0.001,****p<0.0001与对照组相比。n.s.表示差异不显著。其他的图标相同。
图5lhb簇状放电需要神经元膜超级化和t型电压敏感型干通道的参与。(a)斜坡电流注射诱导lhb神经元从簇状放电向单个放电转化的典型图,神经元在相对超级化的状态下容易产生簇状放电,而在相对去极化的状态下产生单个放电。(b)统计图显示大小鼠中lhb神经元注入超级化电流后能诱导产生簇状放电的神经元比例。(c-e)电流钳加记录到的簇状放电频率(c),簇状放电持续时间(d)和簇内放电个数(e)与神经元静息膜电位的相关性。(f)超级化下自发单个放电神经元向簇状放电转化的典型示例图。(g)去极化下自发簇状放电向单个放电转化的典型示例图。(h,i)t-vscc阻断剂mibefradil(h)和hcn通道阻断剂zd7288(i)对lhb神经元自发簇状放电的影响。左侧为典型图,右侧为统计图。(j)一个发放示例图总结了lhb神经元簇状放电中所需要的各种离子和通道。激活的t-vscc使得阻断nmda受体的镁离子被移开,t-vscc和nmda受体通道的打开驱动神经元膜电位超簇状放电阈值方向变化。当快速失活t-vscc和nmda受体通道时,神经元静息膜电位恢复到-55mv一下,起始另一个簇状放电周期。所有数据均表示为平均值±sem。*p<0.05,**p<0.01,***p<0.001,****p<0.0001与对照组相比。n.s.表示差异不显著。其他的图标相同。
图6t-vscc拮抗剂表现出快速抗抑郁的作用。(a-c)局部注射mibefradil到双侧lhb,在fst(b)和spt(c)行为中均表现出快速的抗抑郁效果。(a)为lhb注射ctb确定套管的注射位点图。所有数据均表示为平均值±sem。*p<0.05,**p<0.01,***p<0.001,****p<0.0001与对照组相比。n.s.表示差异不显著。其他的图标相同。
图7enphr光激活诱导的反弹式簇状放电使动物表现出可被氯胺酮反转的厌恶和抑郁表型。(a)enphr病毒表达载体构建示意图(上图),光电及记录示意图(下图)。(b,c)在aav2/9-enphr病毒表达的小鼠lhb中,黄光激活的脑片神经元(b)和在体记录到的神经元(c)反弹簇状放电的典型图。成功诱导出簇状放电的细胞百分比显示于右侧统计图。(d)点阵图和刺激后时间柱图显示在体光电极记录中一个代表性的lhb神经元对100ms黄光刺激的反应。(e)enphr光激活引起的反弹式簇状放电的簇内发放频率和簇内发放个数的分布与crs小鼠缰核中记录到的相当。中央的十字交叉代表平均值。(f)enphr光激活引起的反弹式簇状放电诱发的实时位置厌恶(rtpa)。左侧显示rtpa的代表性热图,右侧显示定量分析的厌恶回避参数。(g)enphr光激活引起的反弹式簇状放电诱发的fst抑郁表型。(h)enphr光激活引起的反弹式簇状放电诱发的spt抑郁表型。所有数据均表示为平均值±sem。*p<0.05,**p<0.01,***p<0.001,****p<0.0001与对照组相比。n.s.表示差异不显著。其他的图标相同。
图8与簇状放电相同频率的单个放电不能引起抑郁表型。(a)离体电生理记录显示5hz的光激活ochief光通道产生5hz的单个放电。(b)与表达对照非光通道的egfp小鼠相比,光激活并不改变动物的运动能力。(c)5hz的光激活产生的单个放电不能诱导出抑郁表型。
具体实施方式
下面将结合实施例进一步说明本发明的实质内容和有益效果,该实施例仅用于说明本发明而非对本发明的限制。
实施例1材料和方法
动物材料
雄性clh大鼠(4-12周龄),spraguedawley大鼠(4-12周龄)。clh大鼠是一个选择性培育的具有先天习得性无助抑郁表型的抑郁症动物模型(d.schulz,m.m.mirrione,f.a.henn,neurobiollearnmem93,291,feb,2010)。本实验的clh大鼠从美国冷泉港malinow实验室引进。clh大鼠饲养和繁殖如前述d.schulz,etal,feb,2010中描述。大鼠4只/笼,12小时的明暗周期(7am-7pm有光)。用于套管实验的clh大鼠1只/笼饲养。成年(8-12周龄)c57bl/6小鼠被用于行为测试:4只/笼,12小时明暗周期(5am-5pm有光)。大鼠和小鼠都能够自由摄取稳定的水和食物,所有的动物实验经过浙江大学动物保护和使用委员会的批准。
病毒构建
aav9-camkii-enphr3.0-eyfp,质粒购自于addgene,cat#26971,病毒由上海泰廷生物科技有限公司包被;aav9-ubi-egfp由umass的gaoguangping实验室馈赠;aav9-hsyn-ochief-tdtomato,质粒购自于addgene,cat#50977,病毒由上海泰廷生物科技有限公司包被。
立体定位注射和组织学
小鼠注射病毒:小鼠腹腔注射氯胺酮(100mg/kg体重)和赛拉嗪(8mg/kg)混合液麻醉后,固定于立体定位仪上(stoeltinginstruments)。每只小鼠每侧lhb注入0.1-0.2ul纯化浓缩的aav病毒(~1013感染单位/ml),lhb立体定位坐标(前后距离bregma:-1.7mm(ap),左右旁开±0.46mm(ml),皮层表面往下-2.56mm(dv))。使用自行拉制的玻璃微电极缓慢注入(~100-150nl/min),注射结束留针5min,然后再5min内缓慢移出注射电极。
术后至少14天,开展行为实验或者电生理实验。行为实验结束后检查注射位置,只使用正确注射的那些动物数据。
注射了aav病毒的脑切片在荧光显微镜下检查,或其它标记了gfp的病毒在显微检查之前用抗体检查gfp蛋白。每个大脑的缰核区切成6组连续的切片(小鼠30um的切片,每组6片;大鼠40um切片,每组8-9片)。所有的切片在安装到固定片之前用hoechst复染色。
大鼠双侧lhb埋置套管:大鼠腹腔注射4%戊巴比妥那(60mg/kg体重)麻醉后,固定于大鼠立体定位仪上。置管用lhb立体定位坐标(前后距离bregma:-3.7mm(ap),左右旁开±0.7mm(ml),皮层表面往下-4.1mm(dv))。在lhb对应的颅骨上方,颅钻钻孔,之后在颅骨上固定三颗螺丝。按置管lhb坐标使双侧套管(购自于美国plasticsone公司)进入缰核的上方,并用牙托水泥固定套管,待牙托水泥完全凝固后,在套管中插入与套管等长的平端堵芯,并拧上螺帽以防止堵芯脱落。术后7天,待大鼠从手术创伤中恢复后,可用于检测药物的行为学效果。大鼠使用气体(异氟烷)麻醉机麻醉后,用套管配套的注射针,自套管中缓慢注入1ul待测试药物(约100nl/min),注射结束留针10min,然后移出注射内芯。根据药物的有效时程进行行为学测试。行为实验结束后,通过套管注射ctb-488or555检查套管位置,lhb注射位点准确的动物行为学数据才用于统计分析。
离体电生理记录
出生后40-50天的大鼠或出生8周的小鼠经异氟烷麻醉后,用20ml冰冷充氧的切片液进行灌流。快速断头取出大脑,放进充氧的切片液中。随后利用leica振动切片机在充氧的冰冷的切片液中,进行350um的管状切面切片。缰核脑片在充氧的34℃的acsf(118mmnacl,2.5mmkcl,26mmnahco3,1mmnah2po4,10mmglucose,1.3mmmgcl2and2.5mmcacl2,gassedwith95%o2and5%co2)中,恢复至少1小时后转移到室温进行记录。注射氯胺酮组的大鼠和小鼠均在动物取脑前1h进行。
外侧缰核脑片的膜片钳记录采用axonmulticlamp700b放大器,在32±1℃环境下,在装配红外微分干涉相差光学镜头的olympus显微镜下进行记录。所有细胞均在全细胞模式下记录。神经元记录电极阻抗为4-6mω,电极内液成分为(mm):105k-gluconate,30kcl,4mg-atp,0.3na-gtp,0.3egta,10hepesand10na-phosphocreatine,ph为7.35。记录外液所用人工脑脊液(acsf)成分为(mm):125nacl,2.5kcl,25nahco3,1.25nah2po4,1mgcl2and25葡萄糖。数据经过2khz过滤后使用digidata1322a在10khz下采样记录。数据使用pclamp10软件进行分析。
大小鼠lhb神经元中动作电位自发放频率,是在i=0电流钳记录模式下进行,持续60秒,平均发放频率由这60s发放来统计。对lhb中产生的不同的放电模式的定义为:不发放细胞,指在整个记录过程中没有动作电位发放的细胞;单个放电的细胞,指放电频率在0.1-10hz,极少有10-20hz;簇状放电细胞,是指能产生成簇的发放,且簇内发放频率极高,但表现出逐渐递减趋势,簇间发刚频率高达200hz。
诱发的nmda受体介导的兴奋性突触后电流是在零镁的acsf下,将细胞牵制在-50mv到-80mv下所记录到的。诱发的t型电压敏感型钙通道电流,是将细胞钳制在-50mv下,然后再将细胞钳制到-100mv,持续1秒。刺激按照常规频率0.1hz给出。钙电流通过线性渗漏相减得到。
在体电生理记录
成年雄性小鼠腹腔注射氯胺酮(100mg/kg体重)和赛拉嗪(8mg/kg)混合液麻醉后,固定于立体定位仪上(stoeltinginstruments)。将由8个tetrode(由四根电极丝组成的)(电阻为250-500kω,californiafinewire)组成的可移动电极阵列植入到lhb(ap:-1.72mm;ml:±0.46mm;dv:-2.44mm)。不锈钢丝缠绕到固定在颅骨上的两个螺钉上用于接地。电极用牙托水泥固定在颅骨表面。动物恢复5-7天后,开始适应记录所用的转接头,一天10分钟,共适应2-3天。记录采用64通道的omniplex-d神经信号采集系统(plexoninc.,dallas,tx),在饲养笼中记录30分钟动物lhb的自发放电活动(采样频率40khz,300-6000hz带通滤波))和场电位(lfp,采样率为1khz,250hz低通滤波),增益为5000。将没有可辨别的神经元放电信号的通道作为参考电极。每次记录后tetrode以70μm深度往下步进,并恢复2天以开始下一次记录。对于慢性束缚应激小鼠,记录氯胺酮给药前30min和给药1h后的放电活动。所用记录的动物最后都用电损毁的方式确定电极位点。
动作电位分选:将所有记录到的电信号导入到offlinesorterv3(plexoninc.),然后使用阈值法和主成分分析(pca)对单个神经元放电进行手动分选。峰电位间隔小于不应期(1.4ms)的发放被排除在外,并通过互相关分析确保没有分选出的神经元不发生重复。与背景噪音无法分离的信号被排除。数据分析:该部分数据分析所用软件为neuroexplorer4(plexoninc.)和matlab。数据分析:该部分数据分析所用软件为neuroexplorer4(plexoninc.)和matlab。
行为学实验
强迫游泳测试(forcedswimtest,fst)
实验在正常日光灯下进行。小鼠强迫游泳圆柱形容器的直径为12cm,高25cm。测试水深为14cm,水温23-24℃。摄像头从侧边记录小鼠在6min内的游泳情况。采用双盲方式统计小鼠游泳6min内后4min的不动时间(动物的漂浮姿势或者四肢完全没有活动的时间)。
糖水偏好测试(sucrosereferencetest,spt)
实验小鼠单独饲养1周,然后连续2天给予小鼠两瓶普通水,之后两天将水换为两瓶2%的蔗糖水进行训练。训练结束后,给予动物一瓶普通水和一瓶2%的蔗糖水进行测试,每12小时交换一次水瓶的位置,每24小时记录一次水和糖水的消耗量(对水瓶称重),共记录48小时。
慢性束缚应激(chronicrestraintstress,crs)小鼠抑郁模型构建
动物随机分成两组,一组每天11:00到14:00间放入50ml离心管束缚2h,连续束缚14天,为了利于动物呼吸,所用50ml的离心管上钻有2mm直径的数个小孔;另一组对照动物则不接受束缚应激。每天的束缚结束后,动物放回自己的笼子并与对照组动物饲养在同一饲养室。在第15天进行强迫游泳和糖水偏好测试去评估动物的抑郁表型。
自由活动清醒小鼠光遗传行为测试
该部分所有动物行为学检测都是动物处于生物节律的黑暗时期,且在病毒表达至少三周后进行。植入的光纤通过陶瓷套管连接到插线电缆(陶瓷套管购自于中国杭州newdoon公司),插线电缆接通过一个fc/pc适配器连接到到一个转动接头(购自于加拿大doric,québec)上,使得动物可以无限制地自由运动。另一根插线电缆通过fc/pc适配器连接到电脑和473nm的dpss激光器(aurora-220-473)或者589nmdpss激光器(aurora-220-589),激光器均购自于中国杭州newdoon公司。
实时位置回避(real-timeplaceaversion,rtpa)测试
基于前人的实验方法(matthewsetal.,2016;zhuetal.,2016),一个中间连通的52x26x23厘米敞口箱子,分左右两个相同大小的箱子(26x26x23厘米)用于行为学测试。小鼠被放置到箱内自由活动20分钟,用于评估小鼠对两侧箱子的基础偏好水平。接下来的20分钟测试阶段,将小鼠平均分配到左右侧箱子,并以这一侧作为刺激箱,另一侧则为每只小鼠对应的非刺激箱。将小鼠放到非刺激箱开始实验。小鼠一旦进入刺激箱便能激活黄光刺激(enphr3.0:589nm,1hz,16mw,100ms间隔),直到小鼠返回非刺激侧结束。回避箱子的正上方安装有摄像头,记录每次实验动物的活动情况。并用any-maze软件(美国stoelting公司)分析动物的相关行为指标。回避分数=后20min刺激侧与非刺激侧停留时间差值-前20min刺激侧与非刺激侧停留时间差值。
旷场测试:基于前人研究的实验方法(matthewsetal.,2016),所用旷场测试箱大小为:45x45x45厘米,四个壁和底部均为白色树脂材料。动物先在旷场内一共自由探索9分钟,中间3分钟给予激光刺激(enphr3.0:589nm,1hz,16mw,100ms间隔)。旷场正上方摄像头记录每次实验动物的运动情况,用any-maze软件分析动物的相关行为指标。
强迫游泳测试:基于已有的强迫游泳测试方法(lietal.,2013)。实验在正常光照(约100lux)下进行。小鼠强迫游泳圆柱形透明容器的直径为12cm,高25cm。测试水深为14cm,水温22.5-23℃。当小鼠放入水中后,激光刺激即开始,持续6分钟(enphr3.0:589nm,1hz,16mw,100ms间隔)。摄像头从侧边记录小鼠在6min内的游泳情况。实验结束后,采用双盲方式统计视频中小鼠游泳6min内后4min的不动时间(动物的漂浮姿势或者四肢完全没有活动的时间)。
统计分析
所有的数据都以平均值±sem。对于所有的行为数据,采用two-tailedstudent'st-tests。
实施例2在大鼠的外侧缰核局部给药nmda受体抑制剂可产生快速抗抑郁效果
通过对clh抑郁症大鼠在外侧缰核双侧套管植入后给予氯胺酮来观察抑郁表型的变化。图1的a是clh大鼠外侧缰核双侧套管植入示意图,白色虚线指示缰核位置。图1的b-g给出实验的结果:局部双侧施加不同的nmdar抑制剂氯胺酮(25μg每侧,图1的b-d)和ap5(40nmol每侧,图1的e-g)到lhb,在短时间内(0.5或1小时)能有效逆转clh大鼠的抑郁表型,包括显著降低强迫游泳中的不动时间(图1的c和f),显著增高抑郁动物对糖水的偏好性(图1的d和g)。
在实验中还观察到,lhb双侧施加nmdar抑制剂氯胺酮的抗抑郁效果可以持续到给药后第14天(如图1的h-i所示)。
以上实验证明,在大鼠的外侧缰核局部对nmda受体进行抑制处理,可产生快速和持久的抗抑郁效果。
这是在本领域第一次发现在脑部的局部组织中给予nmda受体抑制剂,例如氯胺酮,能够产生快速和持久的抗抑郁效果。
实施例3外侧缰核中三种神经元自发放电模式(不放电,单个放电和簇状放电)在抑郁动物中的发放特性
运用全细胞膜片钳技术在离体脑切片观察抑郁症动物外侧缰核神经元的放电模式。图2的a显示全细胞膜片钳记录的记录位点,记录位点分布于外侧缰核的不同亚区。发现外侧缰核中神经元存在三种自发放模式典型图,分别是不放电(silent)(图2的b所示),单个放电(tonic)(图2的c所示)和簇状放电(burst)(图2的d所示)。
图2的e(散点图)和f(累积曲线)显示静息膜电位(rmps)的均值和分布。结果显示,相较于不发放的细胞,单个放电细胞静息膜电位表现出去极化而簇状放电细胞表现为超级化。
另外,实验发现,在大鼠和小鼠抑郁动物模型中,外侧缰核自发簇状放电的神经元比例显著高于对照正常动物,且nmdar抑制剂氯胺酮可显著降低抑郁动物自发簇状放电的神经元比例。提示抑郁症中外侧缰核神经元簇状放电增强。如图2的i和l(饼状统计图)显示,大鼠和小鼠抑郁模型中,簇状放电神经元数目增加。图2的j和m(柱状统计图)显示所有发放细胞中单个放电和簇状放电的细胞比例。图2的k和n(柱状统计图)显示不动抑郁动物缰核中神经元峰电位间隔的分布。
实施例4体内实验观察抑郁症动物外侧缰核神经元的放电模式
为了进一步确证外侧缰核神经元簇状放电对抑郁症的作用,运用在体多通道电生理记录方法,一种更好模拟动物生理状态的记录方法,在清醒的小鼠外侧缰核置入多通道电生理记录电极,记录外侧缰核神经元的发放,包括小鼠簇状放电活性和θ波段的同步化活动等。结果如图3所示。
图3的a显示在体记录电极在对照和crs抑郁症小鼠(crs,chronicrestrainstress)的lhb中的记录位点。图3的b为在体记录对照,crs和crs+氯胺酮的小鼠lhb神经元放电的代表性示例(左)和平均发放波形(右),通过分析峰电位间隔(isi)来分离簇状放电。图3的c-d显示,crs小鼠lhb神经元簇状放电比例和每分钟簇状放电的个数都显著高于对照小鼠,且可以被氯胺酮所反转。图3的e显示,对照小鼠和crs小鼠在氯胺酮注射前后峰电位间隔的累积分布曲线(对照组:143ms,crs组:33ms,crs+氯胺酮组:121ms)。虚线指示峰电位50%变化的点。
已知簇状放电可以增强神经元网络的同步化发放。我们通过计算神经元发放相关场电位(spike-triggeredaverages,stas),去检测发放和场电位间振荡的同步化效应。图3的f显示对照小鼠和crs小鼠在氯胺酮注射前后神经元发放相关场电位,对照小鼠发放相关场电位分布呈较平缓的趋势,提示没有神经元同步化效应。crs组则出现7hz的发放相关场电位分布,提示crs抑郁小鼠外侧缰核神经元网络放电呈现出θ波段(4-10hz)节律,且这种同步化效应可被氯胺酮所阻断。
图3的g通过分析每个放电单位的神经元放电与场电位的相关性(sfc,左),平均的sfc(中)和θ波段(4-10hz)中sfc百分比(右),进一步证实了crs抑郁小鼠外侧缰核神经元网络放电呈现出可被氯胺酮所阻断的θ波段(4-10hz)节律。
以上结果显示,慢性束缚应激诱导的抑郁小鼠模型中,外侧缰核神经元簇状放电频率和簇内发放个数都显著高于对照正常小鼠,这种增高可被nmdar抑制剂氯胺酮所反转。
实施例5离体实验证明,nmda受体的激活是lhb神经元产生簇状放电的充分必要条件
已有在其他脑区的研究结果显示,簇状放电的产生需要有nmda受体介导的钙离子内流。本发明进一步研究为了阐明外侧缰核中nmda受体在簇状放电产生过程中的作用,首先确证了lhb有nmdar的表达:膜片钳记录到lhb脑片中nmda电流。图4的a是将神经元钳制在-80mv时产生的兴奋性突触后电流典型图。通过在无mg2+的人工脑脊液(acsf)中加入gaba受体抑制剂(picrotoxin)和ampa受体阻断剂(nbqx)来分离nmda受体介导的兴奋性突触后电流(nmdar-epscs),并用nmda受体阻断剂ap5来确认电流。
图4的b显示lhb神经元钳制在不同电压下记录到的nmdar-epscs,该电流可被nmdar抑制剂ap5完全阻断。这确证了lhb有nmdar的表达。
图4的c-h显示外侧缰核中氯胺酮(c-d),ap5(e-f)和nbqx(g-h)对自发簇状放电的影响。左侧为典型图,右侧为统计图。以图4的c-d为例,可以看到氯胺酮不影响神经元的静息膜电位(restingmembranepotentials,rmps),但是几乎完全阻断了自发簇状放电。如4的c显示,在以氯胺酮处理后10秒,lhb的簇状放电转化为了单个放电。结果显示,nmda受体抑制剂氯胺酮和ap5均有效降低自发簇状放电的频率,而阻断另一种谷氨酸受体ampa,对自发簇状放电的影响远比nmda受体抑制剂的为弱。
进一步的实验在脑片中直接灌流nmda,发现可使lhb中不发放的细胞产生簇状放电,而且这种簇状放电能被氯胺酮所阻断。如图4的i和j所示,nmda灌流可使不发放的细胞产生簇状放电,这种诱发的簇状放电可被氯胺酮所抑制。nmda可诱发大的兴奋性突触后电位和簇状放电。
结果证明,lhb中nmda受体的激活是lhb神经元产生簇状放电的充分必要条件。
实施例6lhb簇状放电需要神经元膜超级化和t型电压敏感型干通道的参与
实施例3中所发现的现象,即lhb中不同发放模式的神经元有不同的静息膜电位(rmp),自发簇状放电的神经元表现出超级化的静息膜电位。
发明人进一步确认静息膜电位与神经元发放模式间的关系。如图5所示,首先,给记录的神经元注入一个递增的斜坡电流,使细胞的静息膜电位从-80到-40mv间变化。超级化电流注入,使细胞产生簇状放电。簇状放电的簇内个数的峰值在-56~-60mv之间,与自发簇状放电细胞的静息膜电位相近。同时对自放放电的细胞给予超级化或去极化的电流注入也可以使细胞在单个发放和簇状发放之间相互转化。
图5中的a是斜坡电流注射诱导lhb神经元从簇状放电向单个放电转化的典型图。如图所示,神经元在相对超级化的状态下容易产生簇状放电,而在相对去极化的状态下产生单个放电。图5中的b为统计图,显示大小鼠中lhb神经元注入超级化电流后能诱导产生簇状放电的神经元比例。图5中的c-e为:电流钳加记录到的簇状放电频率(c),簇状放电持续时间(d)和簇内放电个数(e)与神经元静息膜电位的相关性。
由于nmda受体是一个去极化条件下才激活的通道,而产生簇状放电的神经元静息膜电位是超级化的,本申请发明人那么进一步研究超级化条件下nmda受体是怎么被激活而参与到簇状放电中。
本申请的发明人发现了在神经元超级化时被激活并能使神经元去极化的离子通道:t型电压敏感的钙离子通道。t型电压敏感的钙离子通道是一类超级化下激活的钙通道,通道激活后使钙离子内流而导致神经元去极化。该通道有三个亚型,cav3.1,cav3.2和cav3.3,三个亚型在lhb中均有表达。
发明人通过实验证明了在lhb中t型电压敏感的钙离子通道的激活能引发簇状放电。图5中的f是超级化下自发单个放电神经元向簇状放电转化的典型示例图。图5中的g是去极化下自发簇状放电向单个放电转化的典型示例图。
发明人测试了t-vscc对lhb自发或诱发的簇状放电的影响。另外,测试另一个离子通道-hcn通道(hyperpolarization-activatedcyclicnucleotide–gatedchannel)对lhb自发或诱发的簇状放电的影响。实验通过测试t-vscc阻断剂和hcn的阻断剂对lhb自发或诱发的簇状放电的影响来进行。图5中的h,i显示,t-vscc阻断剂mibefradil(h)和hcn通道阻断剂zd7288(i)对lhb神经元自发簇状放电的影响。左侧为典型图,右侧为统计图。结果证明,t-vscc阻断剂能显著抑制lhb自发或诱发的簇状放电频率。而hcn通道阻断剂对lhb自发或诱发的簇状放电的影响远小于t-vscc阻断剂。
由此,发明人首次发现了nmda受体和t-vsccs协同引起外侧缰核中的自发簇状放电。该簇状放电生理过程如图5中的j所示:激活的t-vscc使得阻断nmda受体的镁离子被移开,t-vscc和nmda受体通道的打开驱动神经元膜电位超簇状放电阈值方向变化。当快速失活t-vscc和nmda受体通道时,神经元静息膜电位恢复到-55mv一下,起始另一个簇状放电周期。
实验的电生理记录和模型的数据都证明了t-vscc和nmda受体协同介导lhb神经元的簇状放电。
实施例7在动物模型的外侧缰核局部给药,阻断外侧缰核的t-vscc,消除抑郁症症状
发明人在先天抑郁大鼠外侧缰核双侧置入套管,给予t-vscc的阻断剂mibefradil(10nmol/ul/侧),如图6所示。图6的a为lhb注射ctb确定套管的注射位点图。观察到mibefradil作用1h即可有快速的抗抑郁效果:在fst(图6的b)和spt(图6的c)行为中均表现出快速的抗抑郁效果。证明了局部阻断lhbt-vscc可快速抗抑郁。
实施例8簇状放电而不是整个发放频率的增加贡献于抑郁症的产生
发明人首次发现,簇状放电模式而不是整个发放频率的增加贡献于抑郁症的产生。
发明人通过激活抑制性的光敏感通道enphr3.0,在离体脑片上能检测到回弹的簇状放电。同时,发明人通过体内实验,在动物中光激活外侧缰核表达的enphr3.0光敏感通道,发现也可快速介导厌恶情绪和抑郁表型的产生。
图7的a给出了enphr病毒表达载体构建示意图(上图),光电及记录示意图(下图)。
图7的b,c是在aav2/9-enphr病毒表达的小鼠lhb中,黄光激活的脑片神经元(b)和在体记录到的神经元(c)反弹簇状放电的典型图。成功诱导出簇状放电的细胞百分比显示于图c的右侧统计图。(d)点阵图和刺激后时间柱图显示在体光电极记录中一个代表性的lhb神经元对100ms黄光刺激的反应。黄光结束后神经元有一个反弹式的放电频率增高。1hz黄光照射enphr3.0所产生的簇内动作电位的发放频率与crs抑郁动物lhb中记录到的频率相当,提示1hz黄光照射enphr3.0可模拟抑郁状态下的簇状放电水平。同时行为学研究结果也发现,enphr光激活诱导的反弹式簇状放电使动物表现出厌恶和抑郁表型。而图7的f,g,h表明,enphr光激活引起的反弹式簇状放电可诱发实时位置厌恶(rtpa)和抑郁表型。以上结果说明,增加lhb簇状放电足以产生抑郁样表型。
与此相对,运用5hz的光激活ochief光通道产生5hz的单个放电(图8a),且放电中频率与1hz的光激活enphr3.0激活产生的总放电频率(每秒产生一个簇状放电,每簇内有5个发放,总放电频率为5hz)相当(图7b),但不能诱导出抑郁表型(图8c)。与表达对照非光通道的egfp小鼠相比,光激活并不改变动物的运动能力(图8b)。
以上结果证明,簇状放电模式而不是整个发放频率的增加贡献于抑郁症的产生。
结论
本发明首次和意外发现外侧缰核的神经元的簇状放电在抑郁症的产生中具有重要作用,并发现了影响外侧缰核的簇状放电的关键因素,包括nmda受体的激活是lhb神经元产生簇状放电的充分必要条件,以及lhb簇状放电需要神经元膜超级化和t型电压敏感型干通道的参与。特别是意外发现了是簇状放电而不是整个发放频率的增加贡献于抑郁症的产生。由此发明人提供了通过抑制外侧缰核的簇状放电来治疗(抑制)抑郁症的方法和药物,特别是快速治疗(抑制)抑郁症的方法和药物。
上面是对本发明进行的说明,不能将其看成是对本发明进行的限制。除非另外指出,本发明的实践将使用有机化学、聚合物化学、生物技术等的常规技术,显然除在上述说明和实施例中所特别描述之外,还可以别的方式实现本发明。其它在本发明范围内的方面与改进将对本发明所属领域的技术人员显而易见。根据本发明的教导,许多改变和变化是可行的,因此其在本发明的范围之内。
如无特别表示,本文中出现的温度的单位“度”是指摄氏度,即℃。
- 还没有人留言评论。精彩留言会获得点赞!