DSPE‑PEG聚合物作为口服和经肺吸收促进剂的应用的制作方法
本发明涉及药物制剂技术领域,具体涉及dspe-peg聚合物作为口服和经肺吸收促进剂的应用。
背景技术:
近年来,随着生物技术及基因技术的迅猛发展,生产出了大量的生物大分子药物,主要包括蛋白质、多肽、核酸、疫苗、抗体等,多用于治疗肿瘤、肝炎、神经退行性疾病、心脑血管疾病、免疫性疾病等重大疾病。这类药物与化学药物相比,具有作用靶点专一,特异性强,不良反应少,药效强等特点,在疾病的预防和治疗中应用越来越广泛。但是,这些药物在具有良好活性的同时也存在着局限性。蛋白质、多肽类药物一般在体内不稳定,易被体内的酸和蛋白酶水解而降解;脂溶性低、分子量大、透过生物膜屏障能力弱等,最终导致这些药物给药后很难被吸收。故临床应用多以注射途径为主,但长期频繁注射给药所造成的肌体损伤及精神、经济压力往往令患者难以承受。因此对该类药物非注射给药途径的研究意义重大。
长期以来,口服给药因其简便、患者顺应性好、可接受程度高而引人关注。同时,经肺给药是一种非侵入性的给药途径,具有吸收面积巨大,毛细血管丰富,肺泡腔至毛细血管腔间转运距离极小,患者耐受性高等众多优势,也逐渐应用于非注射给药途径中。
目前,提高大分子难吸收药物生物利用度研究主要通过以下途径:(1)通过对药物进行适当的结构修饰制成前体药物,或与大分子载体蛋白或聚合物结合,以增加药物的脂溶性,提高跨膜性能,减少酶解,从而提高生物利用度;(2)开发新剂型,采用兼具显著的免疫反应、优良的组织相容性及生物降解性的新型材料制成微粒剂等亦可避免和降低胰岛素、降钙素等多肽类药物受体内酶的降解,同时增强黏膜渗透性等,提高药物吸收;(3)应用吸收促进剂,以提高药物稳定性,膜渗透性,从而增加水溶性大分子药物生物利用度。但是,通过设计合成前体药物改变药物的物理化学特性以增加其脂溶性和代谢稳定性,具有不同的研究与批准进入临床试验应用的程序,且对此类前体药物目前局限于仅对其结构或少数基团的修饰,对于具有复杂结构的大分子亲水性药物作用有限;微粒剂需要高分子物质作为骨架材料,而生物组织相容性好又可生物降解的载体种类有限,且这些载体的体内代谢动力学也还需要进一步系统研究,从而在一定程度上限制了其在实践中的广泛应用。
为提高难吸收药物生物利用度而进行的吸收促进剂研究是众多的研究方法中较为简便、经济、安全的方法之一,也是目前药剂学研究的一个主要热点。到目前为止,文献报道的吸收促进剂大概可归纳为以下两类:一类是小分子类吸收促进剂,包括中链脂肪酸钠盐、胆酸盐、环糊精及其衍生物、表面活性剂、螯合剂及其他小分子物质如no供与体、酰基肉碱、杆菌肽等;另一类是聚合物类吸收促进剂,包括阳离子聚合物、阴离子聚合物以及巯基聚合物等。众多研究结果表明,上述吸收促进剂均能显著改善难吸收药物在各给药部位的吸收,但随着其吸收促进作用的增强,这些吸收促进剂对吸收部位的黏膜损伤也逐渐增大,从而限制了这些吸收促进剂在药物制剂中的应用。因此,筛选出一种既能显著改善难吸收药物的吸收,又不会对吸收部位黏膜造成损伤的优良的吸收促进剂是当前亟待解决的问题。
1,2-二硬脂酰-sn-甘油-3-磷脂酰乙醇胺-聚乙二醇即dspe-peg,是一类磷脂类聚合物,具有很好的生物相容性和生物可降解性。由于其化学结构中两亲性功能基团的存在,使其易于功能化修饰,从而使该聚合物形成某些生物功能。聚合物结构中的peg是由氧乙烯单体聚合而成的惰性长链两亲性分子,柔性peg分子链可结合水分子形成水化层,从而可以极大提高该聚合物在水中的溶解度和生物相容性。同时,peg是fda批准使用的非离子水溶性聚合物,无毒、无免疫原性,可溶于水和多种有机溶剂,已用于多种药物制剂、食品和化妆品的载体或基质,因而具有很高的应用安全性能。近些年研究结果表明,dspe-peg可以延长药物在血液循环中的滞留时间、改善药物稳定性能、增加药物包封率等,因而广泛应用于纳米递药系统中。但是,目前尚未见到关于dspe-peg作为吸收促进剂应用于大分子难吸收药物制剂中的报道。
dspe-peg-sh是一种亲水性巯基化磷脂类聚合物,它是经过高分子聚合物接枝共聚后经巯基化合物修饰制得的一种黏膜黏附性材料。在聚合物结构中的巯基可与组织黏液层糖蛋白中富含半胱氨酸的区域形成二硫键,以共价键紧密结合于黏膜,延长所载药物滞留时间,提高局部药物浓度,但是巯基作用的发挥同时受到了所在聚合物整体结构的影响,是否能够促进药物吸收不能一概而论。
技术实现要素:
本发明的目的在于提供dspe-peg聚合物作为口服和经肺吸收促进剂的应用,dspe-peg(1,2-二硬脂酰-sn-甘油-3-磷脂酰乙醇胺-聚乙二醇)聚合物不仅提高了水溶性大分子药物口服和经肺给药的生物利用度,而且对吸收部位黏膜毒性小,安全性能高。
本发明是通过以下技术方案来实现:
dspe-peg聚合物作为经口服或经肺吸收药物的吸收促进剂的应用。
所述的dspe-peg聚合物根据所使用的封端基团的不同,包括以下两种:dspe-peg-sh和dspe-peg-oh。
所述的dspe-peg聚合物作为水溶性大分子难吸收药物,具体包括蛋白质、肽类药物吸收促进剂的应用。
所述的dspe-peg聚合物通过细胞旁路途径打开细胞之间紧密连接促进药物吸收。
所述的dspe-peg聚合物通过细胞途径改变细胞膜流动性促进药物吸收。
上述dspe-peg聚合物在制备口服或经肺给药制剂中的应用。
本发明具有以下有益的效果:
本发明基于多种不同封端的dspe-peg聚合物可有效提高水溶性大分子难吸收药物在肠道吸收和肺部吸收的作用,提出dspe-peg聚合物在药物制剂中作为经口服和经肺吸收药物的吸收促进剂的应用。
dspe-peg聚合物作为吸收促进剂,能明显促进大分子难吸收药物口服和经肺吸收;同时,毒性考察结果显示dspe-peg聚合物对口服和肺部吸收部位黏膜无明显损伤,因此dspe-peg聚合物是安全的吸收促进剂,可应用于大分子药物口服和经肺吸收制剂中,用于改善水溶性大分子难吸收药物,尤其是蛋白肽类药物(如降钙素)口服和经肺吸收的生物利用度。
dspe-peg聚合物作为吸收促进剂,能增加细胞膜流动性,从而促进大分子难吸收药物经细胞途径的吸收;这类聚合物也能下调紧密连接相关蛋白occludin和zo-1的表达,从而打开上皮细胞间紧密连接,促进大分子难吸收药物经细胞旁路途径的吸收;且在给药时间内对吸收部位黏膜没有明显损伤。因此dspe-peg聚合物既能显著改善大分子难吸收药物的吸收,又不会对吸收部位黏膜造成损伤,是一种优良的吸收促进剂。
附图说明
图1为吸收促进剂1,2-二硬脂酰-sn-甘油-3-磷脂酰乙醇胺-聚乙二醇(dspe-peg)聚合物的化学结构示意图,其中:(a)dspe-peg-oh;(b)dspe-peg-sh。
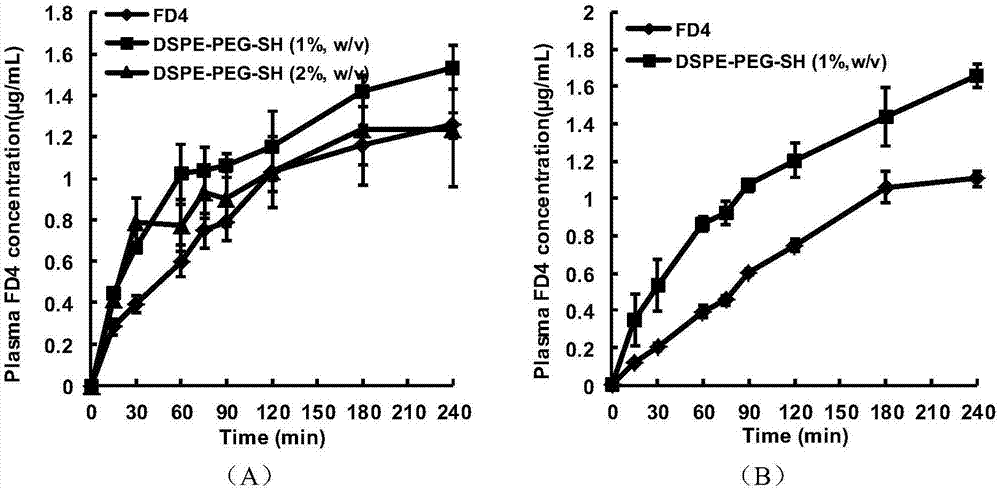
图2为不同浓度的dspe-peg-sh对fd4在大鼠小肠(a)和大肠(b)吸收促进作用结果。
图3为dspe-peg-sh对小肠吸收部位黏膜毒性评价结果;其中,(a)protein;(b)ldh。
图4为不同浓度的dspe-peg-sh分别对fd4(a)、fd10(b)和fd70(c)在大鼠肺部吸收促进作用结果。
图5为不同浓度的dspe-peg-oh分别对fd4(a)、fd10(b)和fd70(c)在大鼠肺部吸收促进作用结果。
图6为dspe-peg聚合物对降钙素在大鼠肺部吸收促进作用结果。
图7为dspe-peg-sh对肺部吸收部位黏膜毒性评价结果;其中,(a)protein;(b)ldh。
图8为dspe-peg-oh对肺部吸收部位黏膜毒性评价结果;其中,(a)protein;(b)ldh。
图9为dspe-peg聚合物通过打开细胞之间紧密连接促进吸收机制考察结果;其中,(a)westernblot蛋白条带图;(b)westernblot蛋白定量结果统计图。
具体实施方式
下面结合不同封端的dspe-peg聚合物(dspe-peg-sh及dspe-peg-oh,结构如图1所示,peg具体为peg2000)促肠道吸收、促肺吸收的实施例来说明dspe-peg聚合物作为经口服、经肺吸收药物的吸收促进剂的作用。
1、dspe-peg-sh促大鼠在体肠道吸收
选取8-10周龄雄性sd大鼠(体重230-250克)构建在体肠道吸收实验模型。实验前16小时禁食,可自由饮水,戊巴比妥钠腹腔注射麻醉(40mg/kg),将大鼠仰卧置于固定板上,沿腹中线剪开,首先结扎胆总管,从待研究的肠段上端插管,以pbs(ph7.4)溶液冲洗肠道,另一端从目标肠段末端插管后密封,从肠段上端用注射器将药液缓缓注入,以止血钳密封,缝合腹部开口。剥离大鼠颈静脉,分别于不同的时间间隔取血0.25ml,置于肝素化的离心管中,12000rpm离心5分钟,分离血浆于离心管内,置于冰盒内待测。采用上述在体肠道吸收实验模型,以异硫氰酸荧光素-右旋糖酐即fd4(平均分子量为4400)为模型药物(8mg/kg),以h2o为溶剂,考察不同浓度dspe-peg-sh(1%,2%,w/v,即dspe-peg-sh质量(单位:g)/h2o体积(单位:ml))对fd4在大鼠小肠和大肠吸收的影响,结果如图2所示。
如图2(a)所示,与单独使用fd4的对照相比,两个浓度的dspe-peg-sh均能提高fd4在小肠的吸收,其中,1%(w/v)的dspe-peg-sh吸收促进作用最佳;然后,选取吸收促进作用最佳的浓度,考察其对fd4在大肠的吸收促进能力;如图2(b)所示,与单独使用fd4的对照相比,浓度为1%的dspe-peg-sh能提高fd4在大鼠大肠的吸收。
2、dspe-peg-sh对肠道黏膜毒性评价
选取8-10周龄雄性sd大鼠(体重230-250克),采用上述在体肠道吸收实验模型,配制不同浓度(1%,2%,w/v)dspe-peg-sh溶液给予大鼠小肠部位,给予dspe-peg-sh溶液4小时后,以pbs(ph7.4)分别冲洗给予dspe-peg-sh溶液部位肠段,以灌流液中总蛋白(protein)和乳酸脱氢酶(ldh)为检测指标,评价dspe-peg-sh对吸收部位黏膜毒性,结果见图3。
如图3(a)、图3(b)所示,与阴性对照组(pbs溶液,ph7.4)相比,给予dspe-peg-sh(1%,2%)组乳酸脱氢酶活性和总蛋白量均无显著差异(n.s.,nosignificance);同时,如图3(a)所示,与阳性对照组(tritonx-100,3%)相比,给予dspe-peg-sh(1%,2%)组具显著差异(**p﹤0.01),表明dspe-peg-sh(1%,2%)对各吸收部位黏膜没有明显损伤,在1%-2%浓度范围内可以安全应用。
3、dspe-peg聚合物大鼠体内经肺吸收实验
取健康雄性sd大鼠(体重220-250g)构建体内经肺吸收实验模型。实验前禁食12小时,自由饮水。用戊巴比妥钠麻醉大鼠(40mg/kg,i.p.),仰卧位固定于鼠板上,剥离气管后进行气管插管,丝线固定,微量注射器通过插管注入药液100μl。实验过程中用白炽灯照明,保持大鼠体温在37℃左右。剥离颈静脉,于不同时间点(0,15,30,60,90,120,180,240min)从颈静脉采血。血样取出后立即离心(12000rpm,5min,4℃),分离出血浆,置于冰箱待测。采用上述体内经肺吸收实验模型,分别以不同分子量范围的fds(fd4、fd10和fd70,8mg/kg)和降钙素(4μg/kg)为模型药物,考察不同浓度(0.1%,0.5%,1%,2%,w/v)及不同封端的dspe-peg聚合物(dspe-peg-sh,dspe-peg-oh)对上述模型药物在大鼠肺部吸收的影响,结果见图4、图5、图6。
从图4中可以看到,较高浓度(0.5%,1%,w/v)dspe-peg-sh均能提高fd4、fd10及fd70的肺部吸收(与未使用dspe-peg-sh相比,即图中fd4、fd10及fd70组),并延缓fd4和fd10达峰时间。此外,dspe-peg-sh吸收促进效果与模型药物的分子量相关,当模型药物分子量在4400-10000范围内,分子量越大,其吸收促进率越大;随着模型药物分子量继续增加,吸收促进效果逐渐减小。应用的高、中、低三个浓度(1%,0.5%,0.1%,w/v)中,浓度为1%的dspe-peg-sh对分子量为10000的fd10在肺部吸收显示了最强的吸收促进效果,表明该类吸收促进剂对分子量为10000左右的大分子药物具有很好的吸收促进作用。
从图5可以看到,dspe-peg-oh吸收促进作用与dspe-peg-sh的作用规律相似,各浓度dspe-peg-oh对fds在大鼠肺部的吸收促进作用强弱依次为:2%≦1%>0.5%>0.1%(w/v),表明2%时促吸收作用达到饱和。
为进一步考察dspe-peg-sh和dspe-peg-oh是否能改善蛋白质、肽类大分子难吸收药物在大鼠肺部的吸收,本发明采用降钙素为模型药物,选择吸收促进效果最佳的浓度,评价1%(w/v)dspe-peg-sh和dspe-peg-oh分别对降钙素在大鼠肺部吸收的影响。如图6所示,两种聚合物均能显著降低血钙水平,从而说明1%(w/v)dspe-peg-sh和dspe-peg-oh均能有效提高降钙素在大鼠肺部的吸收(与未使用吸收促进剂的给药组相比,即图中control组,图中blank为仅建立实验模型组)。
通过与肠吸收实验结果的比较,dspe-peg-sh和dspe-peg-oh对难吸收药物经肺吸收的促进效果更为显著。
4、dspe-peg聚合物对肺部黏膜毒性评价实验
选取8-10周龄雄性sd大鼠(体重230-250g),采用上述经肺吸收实验模型,配制不同浓度(0.1%,0.5%,1%)dspe-peg聚合物溶液,分别经肺给予,给予聚合物溶液4小时后,收集肺灌流液并剥离肺组织,以灌流液中总蛋白释放量和乳酸脱氢酶活力为检测指标,评价dspe-peg聚合物对肺部吸收部位黏膜的毒性。本实验设置阴性对照组(pbs溶液)、实验组(不同浓度dspe-peg聚合物溶液)、阳性对照组(10mm去氧胆酸钠溶液),结果见图7、图8。
如图7、图8所示,与阴性对照组(pbs溶液,ph7.4)相比,给予dspe-peg聚合物(0.1%,0.5%,1%,w/v)组总蛋白量和乳酸脱氢酶活性均无显著差异,且与阳性对照组(nadc,10mm)具显著差异(p<0.01),表明dspe-peg聚合物(0.1%,0.5%,1%,w/v)对肺部吸收部位黏膜没有显著损伤,在0.1%~1%范围内可以安全应用。
5、dspe-peg聚合物吸收促进机制考察
吸收促进剂促进药物跨膜转运一般主要以两种方式进行,一种是经细胞途径,另一种是细胞旁路途径,本发明中,通过研究dspe-peg聚合物对紧密连接相关蛋白表达量的影响,以及其对细胞膜流动性的影响,从而确认dspe-peg聚合物促进药物转运的途径。具体实验方案如下:
选取8-10周龄雄性sd大鼠(体重230-250克),实验前16小时禁食,可自由饮水,戊巴比妥钠腹腔注射麻醉(40mg/kg),将大鼠仰卧置于固定板上,打开腹腔,腹主动脉脱血处死,分离出大鼠肺脏。将剔除结缔组织及气管的肺叶用生理盐水洗净,滤纸吸干表面水分,称重后剪碎成小块,置于组织匀浆器中,按重量体积比1:4加入tris-hcl缓冲溶液进行匀浆,取匀浆3400rpm离心10min(4℃),再取上清15000rpm离心15min(4℃),弃上清,再分别向各离心管中加入1mltris-hcl缓冲溶液洗涤一次,15000rpm离心10min(4℃),弃上清,用0.01mpbs分散该沉淀,制成终浓度为10mg/ml的溶液,即膜制剂。取上述膜制剂1ml,加入50μl促进剂(dspe-peg-sh、dspe-peg-oh)溶液,37℃孵育20min。再直接向各管中加入950μl荧光标记物dph或tma-dph,在37℃水浴中标记30min。采用多功能酶标仪测定其荧光偏振度(p),并计算微黏度(η),结果见表1。结果表明,dspe-peg-sh和dspe-peg-oh均能显著降低细胞膜荧光偏振度,说明这两种促进剂能提高生物膜脂质的流动性,从而使药物经细胞途径的转运量增加。
表1.dspe-peg聚合物改变细胞膜流动性促进吸收机制考察结果
注:与对照组比较,*p﹤0.05,**p﹤0.01
为了考察dspe-peg聚合物对紧密连接相关蛋白表达量的影响,本发明选择occludin与zo-1作为研究对象,采用westernblot技术研究dspe-peg-oh和dspe-peg-sh对其在大鼠肺组织表达的影响。采用β-actin(内参)、occludin及zo-1的抗体可分别识别出大鼠肺组织中相应蛋白的表达,结果见图9a,分别于43kda、59kda、220kda处出现条带,计算机灰度扫描软件分析灰度值,occludin与zo-1在肺组织的表达量见图9b。由图9b可以看出,occludin、zo-1在对照组(control,即上述经肺吸收实验中fd4组)大鼠肺组织中均有较高的表达,上述经肺吸收实验中dspe-peg-oh和dspe-peg-sh作用组occludin、zo-1蛋白表达量均下降,经统计学分析,与对照组相比具有显著性差异。以上研究结果表明dspe-peg-oh和dspe-peg-sh均能下调紧密连接相关蛋白occludin和zo-1的表达,从而打开上皮细胞间紧密连接,促进水溶性大分子药物经细胞旁路途径的吸收。
经上述实验表明:dspe-peg聚合物作为吸收促进剂,能明显促进水溶性大分子难吸收药物口服和经肺吸收;同时,毒性考察结果显示dspe-peg聚合物对口服和肺部吸收部位黏膜无明显损伤,由此可以推断,dspe-peg聚合物是安全的吸收促进剂,可应用于大分子药物口服和经肺吸收制剂中,用于改善水溶性大分子难吸收药物,尤其是蛋白肽类药物(如降钙素)口服和经肺吸收的生物利用度。
总之,上述dspe-peg聚合物不仅可以明显提高大分子难吸收药物生物利用度,而且对吸收部位黏膜毒性小,安全性高,是一种安全、高效的吸收促进剂。
- 还没有人留言评论。精彩留言会获得点赞!