一种含有无机盐的分层溶解微针的制作方法
本发明涉及医药技术领域。更具体地,涉及一种含有无机盐的分层溶解微针。
背景技术:
随着溶解微针技术的发展,将具有生物活性的多肽、蛋白等大分子包载到微针中,通过微针将其输送到皮内以达到治疗效果逐渐成为人们研究的热点。在疫苗等蛋白类药物的制作过程中,为了维持生物大分子的活性,要加入无机盐以调整分子所处的微环境中的离子强度和酸碱度使其保持稳定性,也不得不在微针的制作过程中将这些无机盐同生物分子一起包载到针尖中。但无机盐会在微针干燥的过程中容易析出而影响微针的机械性能,严重地,则使针尖无法成型。
使用硫酸软骨素、葡聚糖、聚乙烯吡咯烷酮等具有稳定蛋白分子结构的高分子材料制作微针,由于其本身材料的脆性,再加上溶液中的无机盐的存在,影响微针的成形性。
因此,需要提供一种有效解决含无机盐溶液制作微针针尖不易成型以及多肽和蛋白类活性成分的稳定性问题的微针。
技术实现要素:
本发明的一个目的在于提供一种含有无机盐的分层溶解微针,该微针能改善含无机盐的微针针尖的成形性和提高生物活性成分的稳定性。
本发明的另一个目的在于提供上述分层溶解微针的制备方法。
为达到上述目的,本发明采用下述技术方案:
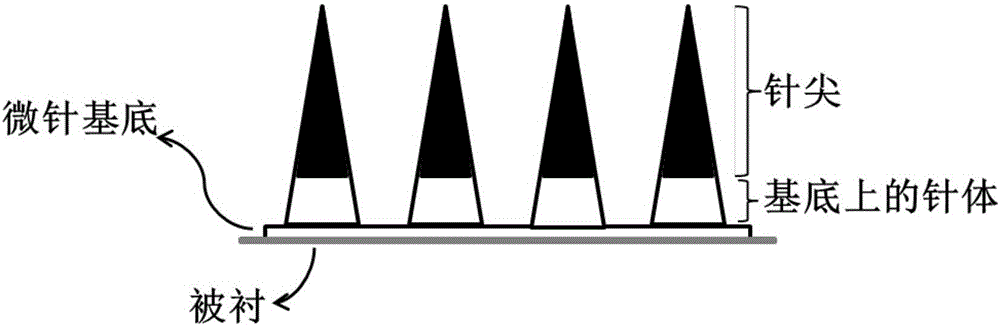
本发明提供了一种含有无机盐的分层溶解微针,包括基底、基底上的针体和针体上的针尖,所述针尖由无机盐溶液、稳定剂、成膜性的水溶性高分子材料和生物活性成分混合制成。其中,所述针尖的长度小于等于微针总长(针尖和基底上的针体)的三分之二。
在本发明优选的实施方式中,所述稳定剂包含小分子活性稳定剂,可以为海藻糖、甘露醇、蔗糖、精氨酸、葡庚糖酸钙中一种或几种的混合物。
在本发明更优选的实施方式中,所述稳定剂还包含高分子活性稳定剂,可以为葡聚糖、硫酸软骨素(cs)、聚乙烯基吡咯烷酮(pvp)中一种或几种的混合物。其中,所述葡聚糖分子量为1万以上,硫酸软骨素分子量为3万-5万,聚乙烯吡咯烷酮分子量为1万-150万。
在本发明优选的实施方式中,所述小分子活性稳定剂与大分子活性稳定剂的质量比为10:1-1:10。
在本发明中,小分子活性稳定剂为亲水性物质,具有良好的保湿性,能与活性成分之间在分子间作用力的作用下,环绕在活性成分周围,具有锁水保湿的作用;而高分子活性稳定剂为亲水性材料,能在分子间作用力(例如氢键)的作用下与活性成分之间相互作用,稳定活性成分的空间结构;而无机盐用于调节活性成分周围的离子强度,使活性成分的电荷保持稳定,从而达到稳定活性成分活性的目的。
在本发明优选的实施方式中,所述成膜性的水溶性高分子材料为纤维素衍生物、壳聚糖衍生物、聚乙烯醇及其衍生物、pvp-va64、透明质酸钠、海藻酸钠等水溶性高分子材料中的一种或几种的混合物。所述纤维素衍生物包括但不限于羧甲基纤维素钠、羟丙基甲基纤维素;所述壳聚糖衍生物包括但不限于羧甲基壳聚糖;所述聚乙烯醇衍生物包括但不限于聚乙烯醇-聚乙二醇;
其中,羧甲基纤维素钠(cmc)分子量为1万-100万以及交联cmc,羟丙基甲基纤维素(hpmc)分子量为5000-100万,羧甲基壳聚糖分子量为1万-100万,聚乙烯醇(pva)分子量为5000以上,聚乙烯醇-聚乙二醇(pva-peg)分子量为5000-10万,pvp-va64分子量为1万-100万,透明质酸钠(ha)分子量为1-100万,海藻酸钠分子量为1万-100万。
在本发明优选的实施方式中,所述成膜性的水溶性高分子材料与稳定剂的质量比与二者的分子量相关,更优选的,所述成膜性的水溶性高分子材料与稳定剂的质量比为10:1-1:10。当所述成膜性的水溶性高分子材料与稳定剂的质量比小于10:1时,稳定剂的比例过小,无法达到长时间稳定活性成分活性的目的;当所述成膜性的水溶性高分子材料与稳定剂的质量比大于1:10时,由于干燥后针尖层主要是由小分子构成,由于其本身的脆性不易成针,针尖无法完整脱模。
在本发明优选的实施方式中,所述生物活性成分包含但不限于具有治疗或修复保健作用的多肽类药物、蛋白类药物、核酸类药物、疫苗。其中,所述多肽类药物可以是干扰素、胰岛素、胸腺活性五肽、去甲状旁腺素、胰高血糖素、生长因子、蚓激酶、六胜肽、催产素、亮丙瑞林、过氧化物歧化酶、降钙素、重组人脑利肽等合成或者提取的具有治疗、预防和增强免疫作用的多肽;所述蛋白类药物可以是白细胞介素、红细胞生成素、肿瘤坏死因子、链激酶、成纤维细胞生长因子、重组人表皮生长因子、重组人生长激素、单克隆抗体、基因工程乙肝疫苗等合成、重组或者提取的具有治疗、预防和增强免疫作用的蛋白;所述核酸类药物可以是福米韦生(fomivirsen)、atp、辅酶a、脱氧核苷酸、ctp、utp、叠氮腺苷、聚肌胞苷酸、阿糖腺苷、阿糖胞苷等合成、重组或者提取的具有治疗、预防和增强免疫作用的核酸;所述疫苗可以是流感疫苗、狂犬疫苗、乙肝疫苗、丙肝疫苗等包括具有治疗或防御作用的蛋白类、灭活病毒类、dna类的疫苗。进一步,所述疫苗中可以含有佐剂。
优选地,所述无机盐溶液的渗透压与人体体液相等,为氯化钠、氯化钾、磷酸二氢钠、磷酸氢二钠、氯化锌等无机盐溶液中的一种或几种的混合物。包含但不限于以下几种盐浓度:(1)0.01mmpbs(ph7.4):8gnacl、0.2gkcl、1.44gna2hpo4和0.24gkh2po4溶于1000ml蒸馏水中配制而成;(2)0.01mmpbs(ph7.2):8.5gnacl、2.86gna2hpo412h2o和0.312gnah2po42h2o溶于1000ml蒸馏水中配制而成;(3)0.3mmnacl溶液:18gnacl溶于1000ml蒸馏水中配制而成;(4)0.1mmnacl溶液:6gnacl溶于1000ml蒸馏水中配制而成;(5)0.022mmzncl2溶液:3gzncl2溶于1000ml蒸馏水中配制而成。
在本发明中,所述生物活性成分与无机盐溶液间的比例关系只要满足能生成均一透明的含有生物活性成分的无机盐溶液即可;含有生物活性成分的无机盐溶液与成膜性的水溶性高分子材料以及稳定剂间的比例关系,只要满足成膜性的水溶性高分子材料以及稳定剂能够在含有生物活性成分的无机盐溶液中溶解成均一透明的溶液即可。
进一步,所述针体和基底采用成膜性的水溶性高分子材料制作而成;优选地,所述针体和基底采用成膜性的水溶性高分子材料与稳定剂制作而成;其中,针体和基底中所述成膜性的水溶性高分子材料与稳定剂的质量比为1:0-5。
其中,所述成膜性的水溶性高分子材料可以是纤维素衍生物、壳聚糖衍生物、聚乙烯醇及其衍生物、pvp-va64、透明质酸钠、海藻酸钠等水溶性高分子材料中的一种或几种的混合物,以保持微针贴片基底的可弯曲性。所述纤维素衍生物包括但不限于羧甲基纤维素钠、羟丙基甲基纤维素;所述壳聚糖衍生物包括但不限于羧甲基壳聚糖;所述聚乙烯醇衍生物包括但不限于聚乙烯醇-聚乙二醇。所述羧甲基纤维素钠分子量为1万-100万以及交联cmc,羟丙基甲基纤维素分子量为5000-100万,羧甲基壳聚糖分子量为1万-100万,聚乙烯醇分子量为5000以上,聚乙烯醇-聚乙二醇分子量为5000-10万,pvp-va64分子量为1万-100万,透明质酸钠分子量为1-100万,海藻酸钠分子量为1万-100万。
在本发明优选的实施方式中,所述稳定剂包含小分子活性稳定剂,可以为海藻糖、甘露醇、蔗糖、精氨酸、葡庚糖酸钙中一种或几种的混合物。
在本发明更优选的实施方式中,所述稳定剂还包含高分子活性稳定剂,可以为葡聚糖、硫酸软骨素、聚乙烯基吡咯烷酮中一种或几种的混合物。所述葡聚糖分子量为1万以上,硫酸软骨素分子量为3万-5万,聚乙烯吡咯烷酮分子量为1万-150万。
在本发明优选的实施方式中,所述小分子活性稳定剂与大分子活性稳定剂的质量比为10:1-1:10。
本发明所述含有无机盐的分层溶解微针还包括基底下的背衬。
本发明还提供了上述含有无机盐的分层溶解微针的制备方法,包括以下步骤:
(1)针尖溶液的制备:将生物活性成分溶于无机盐溶液中,制备得到含有生物活性成分的无机盐溶液;再加入成膜性的水溶性高分子材料、稳定剂到含有生物活性成分的无机盐溶液,溶解后,0-4℃静止5-60min,除气;
(2)针体和基底溶液的制备:成膜性的水溶性高分子材料与水混合,加入或不加入稳定剂,搅拌,溶解后除气;
(3)微针成型:将针尖溶液滴加到每个微针模具单元上,模具底部抽真空5min后,开风吹10min,将针体和基底溶液涂抹到每个微针模具单元上,模具底部抽真空10min后将多余部分刮走,开风干燥60min后,即可。
本发明的有益效果如下:
现有技术中,含无机盐溶液制作微针针尖不易成型以及多肽和蛋白类活性成分的稳定性存在问题。本发明通过对生物活性成分有稳定作用的小分子活性稳定剂如海藻糖、甘露醇、蔗糖、精氨酸、葡庚糖酸钙等,提高生物活性成分的稳定性。通过添加大分子活性稳定剂如硫酸软骨素,葡聚糖、聚乙烯基吡咯烷酮为主材料,通过均匀混合生物相容性的水溶性成膜高分子材料如纤维素衍生物、羧甲基壳聚糖,聚乙烯醇或聚乙烯醇-聚乙二醇、透明质酸钠等,进一步提高了生物活性成分的稳定性和改善含无机盐的微针针尖的成形性。此外,该技术方案相比单纯以一种或多种成膜材料如纤维素衍生物、羧甲基壳聚糖,聚乙烯醇或聚乙烯醇-聚乙二醇、蚕丝蛋白、透明质酸钠等为微针材料制作的微针,具有更快的皮内溶解性,一般3-10分钟可以溶解,能够快速与微针基底分离,减少微针贴片贴付皮肤上的时间,使用更方便。
附图说明
下面结合附图对本发明的具体实施方式作进一步详细的说明。
图1示出含有无机盐的分层溶解微针的示意图。
图2示出体式显微镜观察整片微针形态;a:实施例1,b:对比例3,c:对比例4。
图3示出实施例45微针在荧光显微镜下观察其荧光分布情况。
图4示出实施例45微针的皮肤穿刺能力。
图5示出实施例2微针作用大鼠前后的形态变化;a:扎大鼠皮肤前,b:扎大鼠皮肤5min后。
具体实施方式
为了更清楚地说明本发明,下面结合优选实施例和附图对本发明做进一步的说明。附图中相似的部件以相同的附图标记进行表示。本领域技术人员应当理解,下面所具体描述的内容是说明性的而非限制性的,不应以此限制本发明的保护范围。
实施例1一种以成膜材料羧甲基纤维素钠(cmc)作为基本骨架材料的含有无机盐的分层溶解微针的制备方法
1、针尖溶液配制:
称取cmc(羧甲基纤维素钠,分子量1万-10万)0.08g,硫酸软骨素(cs,分子量3万-5万)0.004g,海藻糖0.004g,加入含有1mg/ml的流感疫苗pbs(0.01m,ph7.2)盐溶液0.912ml,搅拌溶解后,0℃静置5min,离心除气备用。
2、针体和基底溶液:
称取pva(聚乙烯醇,分子量1万-5万)3g,加入超纯水7ml,在80℃条件下水浴磁搅拌,待其完全溶解后除气,并降到室温备用。
3、微针成型:
先将针尖溶液滴加到每个微针模具单元上,pdms模具底部抽真空5min后,开风吹10min后。再将针体和基底溶液涂抹到每个微针模具单元上。pdms模具底部抽真空10min后将多余部分刮走,开风干燥60min后,将模具放置在20%湿度干燥箱中6h,贴被衬脱模制备出入图1所示的微针。
4、检测微针的各参数
1)检测微针中疫苗活性:将成型脱模后的一片微针溶于相应无机盐溶液后,取200ul加入到96孔板中使用elisa试剂盒检测活性,并与相同浓度的控制组进行比对。
2)微针针形:通过体式显微镜观察整片微针形态。
3)微针力学性能测试:
采用仪器:电脑力量行程试验机(model:1220sb),设定力量上限为5n,使用探头为(2mm×2mm),每次测试微针数目为16根。将微针固定到载物台上,针尖朝上,设定载物台移动速度为1.1mm/s。测试完成后,使用体式显微镜观察是否有针尖断裂的情况。
对比例1-5,实施例2-10
按照实施例1的方法,按照表1中给出的物质重量百分比,制备对比例1-5,实施例2-10的微针并考察其生物分子的活性、微针的完整性和力学性能(见表1和图2)。
从表1中可以看出,对比例1是针尖溶液只使用含有成膜性的水溶性高分子材料cmc,其制作出的微针活性成分的活性只有控制组(相同浓度的活性成分盐溶液)的25%,活性损失很多,但其脱模后针形完整,单根针受力0.32n后无断针;而对比例2-5其针尖组成只有稳定剂(成膜性差)制作出的微针活性成分的活性与控制组相比占80%-100%,证明稳定剂能够使活性成分保持活性,但其脱模后针形不完整,单根针受力0.32n后有断针(图2b、2c);实施例1-10同时使用含有成膜性好的cmc和海藻酸钠(水溶液中含量1%-10%)以及稳定剂(cs、葡聚糖、pvp、海藻糖、精氨酸、蔗糖、葡庚糖酸钙)的一种或几种,结果表明其制作出的微针活性成分的活性与控制组相比占75%-95%,脱模后针形完整,单根针受力0.32n后也无断针(图2a)。
表1以成膜材料cmc作为基本骨架材料,对比例1-5、实施例1-10具体配比表
实施例11一种以成膜材料羟丙基甲基纤维素(hpmc)作为基本骨架材料的含有无机盐的分层溶解微针的制备方法
1、针尖溶液配制:
称取hpmc(羟丙基甲基纤维素,分子量1万-10万)0.08g,cs0.004g,海藻糖0.004g,加入含有3mg/ml的乙肝dna疫苗pbs(0.01m,ph7.2)盐溶液0.912ml,搅拌溶解后,2℃静置30min,离心除气备用。
2、针体和基底溶液:
称取hpmc(分子量1万-10万)3.5g,加入超纯水7.5ml,在80℃条件下水浴磁搅拌,待其完全溶解后除气,并降到室温备用。
3、微针成型:
先将针尖溶液滴加到每个微针模具单元上,pdms模具底部抽真空5min后,开风吹10min后。再将针体和基底溶液涂抹到每个微针模具单元上。pdms模具底部抽真空10min后将多余部分刮走,开风干燥60min后,贴被衬脱模。
对比例6,实施例12-21
按照实施例11的方法,按照表2中给出的物质重量百分比,制备对比例6、实施例12-21的微针并根据实施例所述方法考察其生物分子的活性、微针的完整性和力学性能(见表2)。
从表2中可以看出,对比例6是针尖溶液基质只使用含有成膜性的水溶性高分子材料hpmc,其制作出的微针活性成分的活性只有控制组(相同浓度的活性成分盐溶液)的25%,活性损失很多,但其脱模后针形完整,单根针受力0.32n后无断针;实施例11-21同时使用含有成膜性好的hpmc和pvp-va64(水溶液中含量1%-10%)以及稳定剂(cs、葡聚糖、pvp、海藻糖、精氨酸、蔗糖、葡庚糖酸钙)的一种或几种,结果表明其制作出的微针活性成分的活性与控制组相比占75%-95%,脱模后针形完整,单根针受力0.32n后也无断针。
表2以成膜材料hpmc作为基本骨架材料,对比例6、实施例11-21具体配比表
实施例22一种以成膜材料透明质酸钠(ha)作为基本骨架材料的含有无机盐的分层溶解微针的制备方法
1、针尖溶液配制:
称取ha(透明质酸钠,分子量4万-6万)0.08g,cs0.004g,海藻糖0.004g,加入含有2mg/ml的胰岛素pbs(0.01m,ph7.2)盐溶液0.912ml,搅拌溶解后,4℃静置60min,离心除气备用。
2、针体和基底溶液:
称取cmc(分子量1万-10万)1g,pva-peg(分子量5000-1万)2g加入超纯水7ml,在80℃条件下水浴磁搅拌,待其完全溶解后除气,并降到室温备用。
3、微针成型:
先将针尖溶液滴加到每个微针模具单元上,pdms模具底部抽真空5min后,开风吹10min后。再将针体和基底溶液涂抹到每个微针模具单元上。pdms模具底部抽真空10min后将多余部分刮走,开风干燥60min后,贴被衬脱模。
对比例7,实施例23-32,
按照实施例22的方法,按照表3中给出的物质重量百分比,制备对比例7、实施例23-32的微针并按照实施例1方法考察其生物分子的活性、微针的完整性和力学性能(见表3)。
从表3中可以看出,对比例7是针尖溶液基质只使用含有成膜性的水溶性高分子材料ha,其制作出的微针活性成分的活性只有控制组(相同浓度的活性成分盐溶液)的30%,活性损失很多,但其脱模后针形完整,单根针受力0.32n后无断针;实施例22-32同时使用含有成膜性好的ha或者ha与cmc、hpmc、pvp-va64的混合(水溶液中含量1%-10%)以及稳定剂(cs、葡聚糖、pvp、海藻糖、精氨酸、蔗糖、葡庚糖酸钙)的一种或几种,结果表明其制作出的微针活性成分的活性与控制组相比占80%-95%,脱模后针形完整,单根针受力0.32n后也无断针。
表3以成膜材料ha作为基本骨架材料,对比例7、实施例22-32具体配比表
实施例40一种以成膜材料羧甲基壳聚糖作为基本骨架材料的含有无机盐的分层溶解微针的制备方法
1、针尖溶液配制:
称取羧甲基壳聚糖(分子量2万-25万)0.02g,cmc(分子量1万-10万)0.02g,pvp-va640.01g,cs0.02g,海藻糖0.005g,蔗糖0.005g,精氨酸0.005g,葡庚糖酸钙0.005g加入含有2mg/ml的福米韦生nacl(0.1mm)盐溶液0.91ml,搅拌溶解后,4℃静置10min,离心除气备用。
2、针体和基底溶液:
称取pva(分子量10万)3g,cs0.2g,葡聚糖0.2g(分子量10万以上),加入超纯水6.1ml,在80℃条件下水浴磁搅拌,待其完全溶解后除气,并降到室温备用。
3、微针成型:
先将针尖溶液滴加到每个微针模具单元上,pdms模具底部抽真空5min后,开风吹10min后。再将针体和基底溶液涂抹到每个微针模具单元上。pdms模具底部抽真空10min后将多余部分刮走,开风干燥60min后,贴被衬脱模。
对比例8,实施例33-39,41-43
按照实施例40的方法,按照表4中给出的物质重量百分比,制备对比例8、实施例33-39、41-43的微针并考察其生物分子的活性、微针的完整性和力学性能(见表4)。
从表4中可以看出,对比例8是针尖溶液基质只使用含有成膜性的水溶性高分子材料羧甲基壳聚糖,其制作出的微针活性成分的活性只有控制组(相同浓度的活性成分盐溶液)的40%,活性损失很多,但其脱模后针形完整,单根针受力0.32n后无断针;实施例33-39、41-43同时使用含有成膜性好的羧甲基壳聚糖或者羧甲基壳聚糖与cmc、pvp-va64的混合(水溶液中含量0.5%-5%)以及稳定剂(cs、葡聚糖、pvp、海藻糖、精氨酸、蔗糖、葡庚糖酸钙)的一种或几种,结果表明其制作出的微针活性成分的活性与控制组相比占80%-95%,脱模后针形完整,单根针受力0.32n后也无断针。
表4以成膜材料羧甲基壳聚糖作为基本骨架材料,对比例8、实施例33-43具体配比表
实施例44一种含有无机盐的分层溶解微针的制备方法
1、针尖溶液配制:
称取cs(硫酸软骨素,分子量3万-5万)0.1g,cmc(交联cmc)0.05g,海藻糖0.1g,加入含有3mg/ml的戊肝疫苗(裂解疫苗,含有氢氧化铝佐剂)nacl(0.3mm)盐溶液0.835ml,搅拌溶解后,4℃静置10min,离心除气备用。
2、针体和基底溶液:
称取羧甲基壳聚糖(平均分子量2万左右)3g,加入超纯水7ml,搅拌均匀待其完全溶解后离心除气,备用。
3、微针成型:
先将针尖溶液滴加到每个微针模具单元上,pdms模具底部抽真空5min后,开风吹10min后。再将针体和基底溶液涂抹到每个微针模具单元上。pdms模具底部抽真空10min后将多余部分刮走,开风干燥60min后,贴被衬脱模。
实施例45一种含有无机盐的分层溶解微针的微针穿刺性检测
1、针尖溶液配制:
称取pvp(分子量1万-2万)0.05g,hpmc(分子量5000-1万)0.15g,海藻糖0.05g,加入含有1mg/ml的罗丹明nacl(0.3mm)盐溶液0.75ml,搅拌溶解后,4℃静置10min,离心除气备用。
2、针体和基底溶液:
称取cmc(分子量10万-100万)2g,pva-peg1g加入超纯水7ml,搅拌均匀待其完全溶解后减压抽真空除气,备用。
3、微针成型:
先将针尖溶液滴加到每个微针模具单元上,pdms模具底部抽真空5min后,开风吹10min后。再将针体和基底溶液涂抹到每个微针模具单元上。pdms模具底部抽真空10min后将多余部分刮走,开风干燥60min后,贴被衬脱模。
4、微针穿刺性:
将制作成的微针拿到荧光显微镜下观察其荧光分布情况,如图3所示,可以明显的看到药物集中在针尖部分。使用40n的力将其作用于猪皮表面,并使用台盼蓝染色观察其皮肤穿刺性,结果如图4,从图中可以明显的看到微针作用皮肤后台盼蓝染色的阵列针孔。
实施例46微针作用大鼠腹部皮肤前后的形态变化
将实施例1-45制作的微针脱模后拿到光学显微镜下观察微针形态,然后将此微针贴附到已提前24小时脱毛后的大鼠腹部皮肤上,使用手指按压5min,将微针剩余部分揭下并在光学显微镜下观察。结果表明,以实施例2制作的分层微针为例(图5),微针脱模后,针形完整(图5a),在大鼠皮肤上作用5min后,针尖底部的大约三分之二已溶解(图5b),可以认为大部分活性药物均已输送到皮肤内。
显然,本发明的上述实施例仅仅是为清楚地说明本发明所作的举例,而并非是对本发明的实施方式的限定,对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动,这里无法对所有的实施方式予以穷举,凡是属于本发明的技术方案所引伸出的显而易见的变化或变动仍处于本发明的保护范围之列。
- 还没有人留言评论。精彩留言会获得点赞!