一种盐酸普拉克索缓释制剂及其制备方法与流程
本发明属于药物制剂领域,具体涉及一种盐酸普拉克索缓释制剂及其制备方法,尤其是一种盐酸普拉克索缓释胶囊及其制备方法。
背景技术:
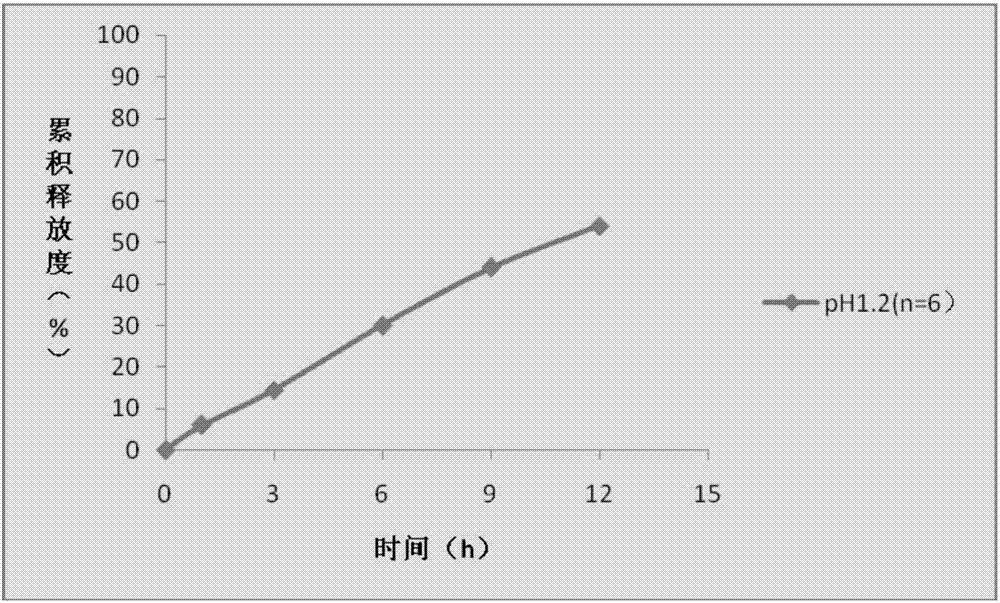
:帕金森病(parkinsonsdisease)是一种常见的发生于中老年人的缓慢进展的神经系统变性疾病,临床以静止性震颤、肌强直和运动障碍为主要特征。随着人口老年化的进程,其患病率逐年增高,已成为仅次于脑血管病的神经系统常见病。长期以来,以左旋多巴为主的药物替代治疗是帕金森病治疗的首选方案,但是现有的治疗措施均不能有效阻止乃至减慢疾病的进展。治疗早期帕金森病近30年来,左旋多巴一直是治疗帕金森病的主要有效药物但长期使用会出现对反应的波动包括“剂末现象”及“开关现象”以及运动并发症,如运动障碍、肌张力障碍。新一代非麦角类多巴胺受体激动剂普拉克索的出现为帕金森病患者带来了希望。普拉克索可单独应用于帕金森病的治疗,减少左旋多巴治疗所致运动障碍的发生率,与左旋多巴联用,可减少左旋多巴的剂量和不良反应。早期使用普拉克索较早期使用左旋多巴能够延缓这些症状的出现,并能够改善患者的生存质量。盐酸普拉克索由勃林格殷格翰(boehringeringelheim)研发,结构如式1所示。盐酸普拉克索于1997年7月1日获得美国fda批准,之后于1997年10月14日获得ema批准,2003年12月2日获得日本pmda批准,其商品名为盐酸普拉克索是一种非麦角类多巴胺激动剂,与多巴胺受体d2亚族具有较高的体外相对专一性和完全的内在活性,对多巴胺d3家族受体亲和力高于d2或d4。用于改善自发性帕金森(pd)和中重度的不宁腿终合症(rls)的症状和体征。盐酸普拉克索在生物药剂分类系统(bcs)中属于第三类,即在生理条件下的高溶解性、低渗透性药物。缓释制剂指在规定的释放介质中,按要求缓慢地非恒速释放药物,与普通制剂相比较,给药频率更低,能增加患者用药顺应性或者疗效的制剂。将盐酸普拉克索做成缓释微丸后,能有效控制活性成分的释放速率从而达到延长药物作用时间的效果。目前已上市的盐酸普拉克索缓释剂型为片剂,中国专利cn101005831b公开的一种包含普拉克索及其盐的延长释放片剂,其包含活性成分、预胶化淀粉于阴离子聚合物和第三种水溶胀性聚合物,从而达到缓释的效果。其中所述的阴离子聚合物选自丙烯酸聚合物、甲级丙烯酸共聚物、海藻酸盐、角叉菜胶、阿拉伯胶、黄原胶、壳聚糖、羧甲纤维素钠和所加纤维素钙。但采用上述方法制备的制剂在酸性条件下存在突释效应,突释效应造成在短时间内释放出大量的药物,使体内的血药水平陡然升高,无法达到药物的最佳作用效果,同时增加不良反应的发生几率。技术实现要素:有鉴于此,本发明的目的在于针对现有技术存在的缺陷,提供一种盐酸普拉克索的缓释制剂及其制备方法。本发明所述盐酸普拉克索的缓释制剂在酸性条件下也可持续缓慢释放,有效避免盐酸普拉克索在酸性条件下的突释效应,减少不良反应的发生率。为实现本发明的目的,本发明采用如下技术方案:一种盐酸普拉克索的缓释制剂,包含第一缓释微丸和第三缓释微丸,所述第一缓释微丸包含盐酸普拉克索第一含药微丸、第一包衣和第二包衣,所述第三缓释微丸包含盐酸普拉克索第三含药微丸和第三包衣,所述第一缓释微丸中的盐酸普拉克索与第三缓释微丸中的盐酸普拉克索的含量比为4:1。本发明所述盐酸普拉克索缓释制剂中所述第一缓释微丸中的盐酸普拉克索与第三缓释微丸中的盐酸普拉克索的含量比为4:1,即第一缓释微丸为高含药缓释微丸,第三缓释微丸为低含药缓释微丸。而第一缓释微丸含有两层包衣,第三缓释微丸含有一层包衣,第一缓释微丸药物释放速度较慢,第三缓释释放速度相对较快,两种缓释微丸释放速度不同,即低含药缓释微丸释放速度相对较快,而高含药缓释微丸释放速度较慢。本发明所述盐酸普拉克索缓释制剂中两种不同含药量、不同释放速度的缓释微丸混合得到一个具有缓释效果制剂,药物释放的前期释放药物主要由低含药缓释微丸提供,而在后期(2h以后)药物的释放主要由高含药缓释微丸提供,在酸性条件下也可持续缓慢释放,可有效避免盐酸普拉克索在酸性条件下的突释效应。其中,所述第一缓释微丸中所述盐酸普拉克索的第一含药微丸由盐酸普拉克索、第一药用微丸丸芯、粘合剂和溶剂制成,所述第一包衣由第一缓释衣膜材料、增塑剂、抗黏剂和溶剂制成,所述第二包衣由第二缓释衣膜材料、增塑剂、抗黏剂和溶剂制成;所述第三缓释微丸中所述盐酸普拉克索的第三含药微丸由盐酸普拉克索、第三药用微丸丸芯、粘合剂和溶剂制成,所述第三包衣由第三缓释衣膜材料、增塑剂、抗黏剂和溶剂制成。本发明所述盐酸普拉克索缓释制剂的第一缓释微丸中盐酸普拉克索与第一药用微丸丸芯在粘合剂和溶剂存在下制成盐酸普拉克索的第一含药微丸。所述第一药用微丸丸芯可以为蔗糖型药用微丸丸芯,优选为0.3-0.425mm蔗糖型药用微丸丸芯或0.5-0.7mm蔗糖型药用微丸丸芯。在一些实施方案中,所述第一药用微丸丸芯为0.3-0.425mm蔗糖型药用微丸丸芯。优选的,所述第一含药微丸中的粘合剂为聚维酮k30。更优选为浓度为8%的聚维酮k30。优选的,所述第一含药微丸中的溶剂为乙醇。更优选为95%乙醇。本发明所述盐酸普拉克索缓释制剂中盐酸普拉克索的第一含药微丸依次进行第一包衣和第二包衣两次包衣。所述第一包衣为第一缓释微丸的内层包衣,第二包衣为第一缓释微丸的外层包衣。所述第一包衣由第一缓释衣膜材料、增塑剂、抗黏剂和溶剂制成,所述第二包衣由第二缓释衣膜材料、增塑剂、抗黏剂和溶剂制成。优选的,所述第一缓释衣膜材料为季铵基甲基丙烯酸酯共聚物b型(rs)和/或季铵基甲基丙烯酸酯共聚物a型(rl);所述第二缓释衣膜材料为乙基纤维素(7cps)、甲基丙烯酸共聚物a型、甲基丙烯酸-丙烯酸乙酯共聚物水分散体(30d-55)、丙烯酸乙酯-甲基丙烯酸甲酯共聚物水分散体(30d)、醋酸纤维素、甲基丙烯酸共聚物b型(s-100)中至少一种。第一缓释衣膜材料季铵基甲基丙烯酸酯共聚物b型(rs)和季铵基甲基丙烯酸酯共聚物a型(rl)两种材料,在水中以及ph7.0以下均不溶解,不同ph值对溶出曲线无影响,但在包衣膜中形成孔道,药物通过这些孔道将药物进行释放。而第二缓释衣膜材料均为水不溶型材料,形成的衣膜可以避免酸降解,防止在胃酸条件下突释,保证盐酸普拉克索缓释制剂中盐酸普拉克索在小肠部位进行释放。在一些实施方案中,所述第一缓释衣膜材料为季铵基甲基丙烯酸酯共聚物b型(rs)与季铵基甲基丙烯酸酯共聚物a型(rl)质量比为9:1的混合物,所述第二缓释衣膜材料为乙基纤维素(7cps)与甲基丙烯酸共聚物b型质量比为3:7的混合物。在一些实施方案中,所述第一缓释衣膜材料为甲基丙烯酸-丙烯酸乙酯共聚物水分散体(30d-55)与丙烯酸乙酯-甲基丙烯酸甲酯共聚物水分散体(30d)质量比为2:1的混合物,所述第二缓释衣膜材料为或醋酸纤维素与甲基丙烯酸共聚物b型(s-100)质量比为2:3的混合物。所述第一包衣和第二包衣中的增塑剂优选为柠檬酸三乙酯。本发明所述包衣过程中还包括抗黏剂。在包衣过程中,含药微丸、包衣膜材料于包衣锅摩擦会产生静电,包衣过程中加入抗黏剂可以及时除静电,以避免含药微丸发生黏连的情况。优选的,本发明所述第一包衣和第二包衣中的抗黏剂为滑石粉。本发明所述第一包衣和第二包衣中溶剂优选为乙醇。更优选为95%乙醇。本发明所述盐酸普拉克索缓释制剂的第三缓释微丸中盐酸普拉克索与第三药用微丸丸芯在粘合剂和溶剂存在下制成盐酸普拉克索的第三含药微丸。所述第三药用微丸丸芯可以为蔗糖型药用微丸丸芯,优选为0.3-0.425mm蔗糖型药用微丸丸芯或0.5-0.7mm蔗糖型药用微丸丸芯。本发明所述盐酸普拉克索缓释制剂的第三缓释微丸中第三药用微丸丸芯与第一缓释微丸中第一药用微丸丸芯可以相同也可以不同。在一些实施方案中,所述第三药用微丸丸芯为0.5-0.7mm蔗糖型药用微丸丸芯。优选的,所述第三含药微丸中的粘合剂为聚维酮k30。优选的,所述第三含药微丸中的溶剂为乙醇。更优选为95%乙醇。本发明所述盐酸普拉克索缓释制剂中盐酸普拉克索的第三含药微丸进行第三包衣。所述第三包衣由第三缓释衣膜材料、增塑剂、抗黏剂和溶剂制成。优选的,所述第三缓释衣膜材料为乙基纤维素(7cps)、甲基丙烯酸共聚物a型、甲基丙烯酸-丙烯酸乙酯共聚物水分散体(30d-55)、丙烯酸乙酯-甲基丙烯酸甲酯共聚物水分散体(30d)、醋酸纤维素、甲基丙烯酸共聚物b型(s-100)中至少一种。在一些实施方案中,所述第三缓释衣膜材料为甲基丙烯酸共聚物b型(s-100)。所述第三包衣中也包括增塑剂和抗黏剂。所述增塑剂优选为柠檬酸三乙酯;所述抗黏剂为滑石粉。本发明所述第三包衣中溶剂优选为乙醇。更优选为95%乙醇。本发明所述盐酸普拉克索缓释制剂中所述第一缓释微丸中所述盐酸普拉克索的第一含药微丸中盐酸普拉克索的含量与第一药用微丸丸芯、粘合剂、溶剂的用量比为1:41.7:(1~2):(11.8~23.6)。在一些实施方案中,所述第一缓释微丸中所述盐酸普拉克索的第一含药微丸中盐酸普拉克索的含量与第一药用微丸丸芯、粘合剂、溶剂的用量比为1:41.7:1.3:15.3。所述第一缓释微丸中第一包衣中所述盐酸普拉克索的第一含药微丸与第一缓释衣膜材料、增塑剂、抗黏剂和溶剂的用量比为1:(0.11~0.15):(0.01~0.03):(0.025~0.035):(1.58~2.16)。在一些实施方案中,第一包衣中所述盐酸普拉克索的第一含药微丸与第一缓释衣膜材料、增塑剂、抗黏剂和溶剂的用量比为1:0.11:0.011:0.031:1.58。第二包衣中所述盐酸普拉克索的第一含药微丸与第二缓释衣膜材料、增塑剂、抗黏剂和溶剂的用量比为1:0.06:(0.005~0.007):(0.01~0.02):(0.075~0.088)。在一些实施方案中,第二包衣中所述盐酸普拉克索的第一含药微丸与第二缓释衣膜材料、增塑剂、抗黏剂和溶剂的用量比为1:0.06:0.006:0.015:0.863。所述第三缓释微丸中所述盐酸普拉克索的第三含药微丸中盐酸普拉克索与第三药用微丸丸芯、粘合剂和溶剂的用量比为1:166.7:(3~4):(34.5~46.0)。在一些实施方案中,所述盐酸普拉克索的第三含药微丸中盐酸普拉克索与第三药用微丸丸芯、粘合剂和溶剂的用量比为1:166.7:3.33:38.3。第三包衣中所述盐酸普拉克索的第三含药微丸与第三缓释衣膜材料、增塑剂、抗黏剂和溶剂的用量比为1:0.025:(0.002~0.003):(0.005~0.0065):0.475。在一些实施方案中,第三包衣中所述盐酸普拉克索的第三含药微丸与第三缓释衣膜材料、增塑剂、抗黏剂和溶剂的用量比1:0.025:0.0025:0.00625:0.475。本发明所述缓释制剂中所述第一缓释微丸与第三缓释微丸的粒径优选为24-40目。本发明所述缓释制剂可以为胶囊剂,第一缓释微丸与第三缓释微丸按照一定比例混合,填入药用胶囊中即可获得盐酸普拉克索缓释胶囊。值得注意的是所述盐酸普拉克索缓释胶囊中第一缓释微丸与第三缓释微丸的混合比例没有限定,只要保证第一缓释微丸中的盐酸普拉克索与第三缓释微丸中的盐酸普拉克索的含量比为4:1即可。优选的,所述药用胶囊为药用明胶胶囊,如0#号胶囊、1#号胶囊、2#号胶囊、3#号胶囊、4#号胶囊、5#号胶囊等。本发明还提供了所述盐酸普拉克索的缓释制剂的制备方法,包括以下步骤:1)将盐酸普拉克索与第一药用微丸丸芯、粘合剂和溶剂混合制备第一含药微丸,干燥后过筛;将盐酸普拉克索与第三药用微丸丸芯、粘合剂和溶剂混合制备第三含药微丸,干燥后过筛;2)将第一缓释衣膜材料与增塑剂、抗黏剂和溶剂混合制成第一包衣液,对第一含药微丸进行包衣形成第一包衣,干燥后过筛得缓释微丸a;将第二缓释衣膜材料与增塑剂、抗黏剂和溶剂混合制成第二包衣液,对缓释微丸a进行包衣形成第二包衣,干燥后过筛得第一缓释微丸;3)将第三缓释衣膜材料与增塑剂、抗黏剂和溶剂混合制成第三包衣液,对第二含药微丸进行包衣形成第三包衣,干燥后过筛得第三缓释微丸;4)将第一缓释微丸与第三缓释微丸混合,控制所述第一缓释微丸中的盐酸普拉克索与第三缓释微丸中的盐酸普拉克索的含量比为4:1;其中,对步骤2)和步骤3)的顺序不分先后。微丸上药过程对物料的粒度有一定的要求。优选的,本发明所述制备方法中,所述盐酸普拉克索原料经过微粉化处理,以增大原料的比表面积,使得微丸上药过程药物能够均匀地分布在微丸上面,同时获得圆整度更好的微丸。在一些实施方案中,所述微粉化盐酸普拉克索的粒径控制在d(90)小于20μm,上述制备方法步骤1)制得第一含药微丸和第三含药微丸需要及时干燥过筛,以免造成微丸的黏连。优选的,所述干燥过筛为30-40℃干燥,过筛收集30-60目之间的微丸。上述制备方法步骤2)和步骤3)中所述包衣过程中,流化床中微丸的温度应控制在20-30℃之间。在喷雾开始阶段,应采用较低的喷速度以防止溶剂/水渗透进入到微丸内部,待微丸包上一层衣膜之后,可以将喷速提高。残余的溶剂或水会产生增速的效果从而影响衣膜的渗透性,因此在完成微丸包衣之后,需要对微丸进行后需干燥处理。优选的,所述干燥过程均采用40℃干燥24h。优选的,步骤2)和步骤3)所述包衣过筛为干燥后过24-40目筛,收集24-40目之间的微丸。由上述技术方案可知,本发明提供了一种盐酸普拉克索缓释制剂及其制备方法。本发明所述盐酸普拉克索的缓释制剂包含第一缓释微丸和第三缓释微丸,所述第一缓释微丸包含盐酸普拉克索第一含药微丸、第一包衣和第二包衣,所述第三缓释微丸包含盐酸普拉克索第三含药微丸和第三包衣,所述第一缓释微丸中的盐酸普拉克索与第三缓释微丸中的盐酸普拉克索的含量比为4:1。两种缓释微丸中的盐酸普拉克索的含量比为4:1,而第一缓释微丸含有两层包衣,第三缓释微丸含有一层包衣,两种缓释微丸释放速度不同。本发明所述盐酸普拉克索缓释制剂中两种不同含药量、不同释放速度的缓释微丸混合得到一个具有缓释效果制剂,在酸性条件下也可持续缓慢释放,可有效避免盐酸普拉克索在酸性条件下的突释效应。本发明所述盐酸普拉克索的缓释制剂制备方法操作简单,适合于产业化。附图说明为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍。图1示实施例3在ph1.2介质的释放曲线;图2示实施例5在各个溶出介质中的释放曲线。具体实施方式本发明公开了一种盐酸普拉克索缓释制剂及其制备方法。本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及产品已经通过较佳实施例进行了描述,相关人员明显能在不脱离本
发明内容、精神和范围内对本文所述的方法进行改动或适当变更与组合,来实现和应用本发明技术。为了进一步理解本发明,下面将结合本发明实施例,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。如无特殊说明,本发明实施例中所涉及的试剂均为市售产品,均可以通过商业渠道购买获得。实施例1:含药微丸的制备1、高含药微丸的处方:2、低含药微丸的处方:3、制备工艺3.1原料前处理:将盐酸普拉克索进行微粉化处理,粒径控制d(90)小于20μm;3.2微丸上药:将药用微丸丸芯加入到离心造粒机中进行微丸上药,粘合剂为8%的聚维酮k30;完成微丸上药之后将微丸置于30-40℃条件下进行干燥。3.3过筛处理:将含药品微丸过筛,保留30-60目之间的微丸。实施例2:取实施例1所制备的高含药微丸进行包缓释衣膜,衣膜材料为季铵基甲基丙烯酸酯共聚物b型(rs)、季铵基甲基丙烯酸酯共聚物a型(rl)、乙基纤维素(7cps)、甲基丙烯酸共聚物b型(s-100)得到高含药缓释微丸。处方如表1所示。表1高含药缓释微丸释衣膜处方制备工艺1、包第一层衣膜1.1、包衣液的配制(1)将季铵基甲基丙烯酸酯共聚物b型(rs)和季铵基甲基丙烯酸酯共聚物a型(rl)溶于95%乙醇中,搅拌至完全溶解;(2)完全溶解后,加入滑石粉、柠檬酸三乙酯搅拌均匀,在包衣过程中持续搅拌。1.2、流化床包衣:将微丸置于流化床进行包衣,流化床中微丸的温度控制在20-30℃之间。1.3、干燥固化:包衣结束之后,加入0.5%滑石粉作为抗粘剂,将微丸置于40℃条件下干燥24小时以上。干燥微丸过24-40目筛,则24到40目之间的微丸即为缓释微丸a。2、包第二层衣膜2.1、包衣液的配制(1)将乙基纤维素(7cps)和甲基丙烯酸共聚物b型(s-100)溶于95%乙醇中,搅拌至完全溶解;(2)完全溶解后,加入滑石粉、柠檬酸三乙酯搅拌均匀,在包衣过程中持续搅拌。2.2、流化床包衣:将包完第一层衣膜的高含药缓释微丸置于流化床包第二层缓释衣膜,操作过程与包第一层衣膜一致。2.3、干燥固化:包衣之后,将微丸置于40℃条件下干燥24小时以上。干燥微丸过24-40目筛,则24到40目之间的微丸即为缓释微丸b(高含药缓释微丸)。实施例3:取实施例1所制备的高含药微丸进行包缓释衣膜,得到高含药缓释微丸。包衣膜材料为甲基丙烯酸-丙烯酸乙酯共聚物水分散体(30d-55)、丙烯酸乙酯-甲基丙烯酸甲酯共聚物水分散体(30d)、醋酸纤维素、甲基丙烯酸共聚物b型(s-100)。处方如表2所示。表2高含药缓释微丸释衣膜处方将实施例1制备的高含药微丸置于流化床进行包衣。制备工艺:1、包第一层衣膜1.1、包衣液的配制(1)将甲基丙烯酸-丙烯酸乙酯共聚物水分散体(30d-55)和季丙烯酸乙酯-甲基丙烯酸甲酯共聚物水分散体(30d)溶于纯化水中,搅拌至完全溶解;(2)待完全溶解后,加入滑石粉、柠檬酸三乙酯搅拌均匀,在包衣过程中持续搅拌。1.2、流化床包衣:将微丸置于流化床进行包衣,流化床中微丸的温度控制在20-30℃之间。1.3、干燥固化:包衣结束之后,加入0.5%滑石粉作为抗粘剂,将微丸置于40℃条件下干燥24小时以上。干燥微丸过24-40目筛,则24到40目之间的微丸即为缓释微丸a。2、包第二层衣膜(1)将醋酸纤维素、甲基丙烯酸共聚物b型(s-100)溶于95%乙醇中,搅拌至完全溶解;(2)完全溶解后,加入滑石粉、柠檬酸三乙酯搅拌均匀,在包衣过程中持续搅拌。2.2、流化床包衣:将包完第一层衣膜的高含药缓释微丸置于流化床包第二层缓释衣膜,操作过程与包第一层衣膜一致。2.3、干燥固化:包衣之后,将微丸置于40℃条件下干燥24小时以上。干燥微丸过24-40目筛,则24到40目之间的微丸即为缓释微丸b(高含药缓释微丸)。制得的缓释微丸b(高含药缓释微丸)中醋酸纤维素为水不溶性包衣材料,甲基丙烯酸-丙烯酸乙酯共聚物水分散体(30d-55)、丙烯酸乙酯-甲基丙烯酸甲酯共聚物水分散体(30d)在ph7.0以下不溶,不同ph值对溶出曲线无影响,药物释放是透过包衣膜空隙扩散。其中在ph1.2介质的释放曲线如图1所示。实施例4取实施例1所制备的低含药微丸包缓释衣膜,得到低含药缓释微丸,包衣膜材料为甲基丙烯酸共聚物b型(s-100)。处方如表3所示。表3低含药缓释微丸释衣膜处方制备工艺:1、包衣液的配制(1)将甲基丙烯酸共聚物b型(s-100)溶于95%乙醇中,搅拌至完全溶解;(2)待完全溶解后,加入滑石粉、柠檬酸三乙酯搅拌均匀,在包衣过程中持续搅拌。2、将实施例1制备的低含药微丸置于流化床中进行包衣处理,之后将微丸置于40℃条件下干燥24小时以上进行固化处理。流化床中微丸的温度控制在20-30℃之间。将上述实施例2、实施例3、实施例4所制备的缓释微丸检测盐酸普拉克索的含量,根据含量计算缓释胶囊的填装量。下表4列出的是3个具体实施例的缓释微丸的盐酸普拉克索的含量:表4各实施例缓释微丸的盐酸普拉克索实施例盐酸普拉克索含量(%)实施例21.98%实施例31.90%实施例40.55%取高含药缓释微丸和低含药缓释微丸以一定比例混合,其中高含药缓释微丸包含4份盐酸普拉克索,低含药缓释微丸包含1份盐酸普拉克索,以此计算两种缓释微丸的用量。实施例5取实施例2制备的缓释微丸121mg以及实施例4制备的缓释微丸109mg装进明胶胶囊,得到规格为3mg的盐酸普拉克索缓释胶囊,其中实施例2制备的高含药微丸中的盐酸普拉克索与实施例4制备的低含药微丸中的盐酸普拉克索含量比例为4:1。分别将制得的3mg的盐酸普拉克索缓释胶囊置于ph1.2、ph4.5、ph6.8和水中进行释放实验,比较在各个溶出介质对制得盐酸普拉克索缓释胶囊的缓释效果的影响,结果如图2所示。比较制得的盐酸普拉克索缓释胶囊在各个溶出介质中的释放曲线,结果显示,制得的盐酸普拉克索缓释胶囊在各个溶出介质均能缓慢释放,不存在突释现象。实施例6取实施例3制备的缓释微丸126mg以及实施例4制备的缓释微丸109mg装明胶胶囊,得到规格为3mg的盐酸普拉克索缓释胶囊,其中实施例3制备的高含药微丸中的盐酸普拉克索与实施例4制备的低含药微丸中的盐酸普拉克索含量比例为4:1。实施例7取实施例2制备的缓释微丸60.5mg以及实施例4制备的缓释微丸54.5mg装明胶胶囊,得到规格为1.5mg的盐酸普拉克索缓释胶囊,其中实施例2制备的高含药微丸中的盐酸普拉克索与实施例4制备的低含药微丸中的盐酸普拉克索含量比例为4:1。实施例8取实施例3制备的缓释微丸63mg以及实施例4制备的缓释微丸54.5mg装明胶胶囊,得到规格为1.5mg的盐酸拉克索缓释胶囊,其中实施例3制备的高含药微丸中的盐酸普拉克索与实施例4制备的低含药微丸中的盐酸普拉克索含量比例为4:1。实施例9取实施例2制备的缓释微丸181.5mg以及实施例4制备的缓释微丸163.5mg装明胶胶囊,得到规格为4.5mg的盐酸普拉克索缓释胶囊,其中实施例2制备的高含药微丸中的盐酸普拉克索与实施例4制备的低含药微丸中的盐酸普拉克索含量比例为4:1。实施例10取实施例3制备的缓释微丸189mg以及实施例4制备的缓释微丸163.5mg装明胶胶囊,得到规格为4.5mg的盐酸普拉克索缓释胶囊,其中实施例3制备的高含药微丸中的盐酸普拉克索与实施例4制备的低含药微丸中的盐酸普拉克索含量比例为4:1。上述实施例5至实施例10中两种微丸的用量并非一个固定值,其用量是基于两种缓释微丸中的盐酸普拉克索含量进行折算而来,上述是其中一个实施方案。其中上述各实施例中高含药微丸中的盐酸普拉克索与低含药微丸中的盐酸普拉克索的比例均为4:1。比较实施例6至实施例10制得的盐酸普拉克索缓释胶囊在各个溶出介质中的释放曲线,结果显示,实施例6至实施例10制得的盐酸普拉克索缓释胶囊在各个溶出介质也均能缓慢释放,不存在突释现象。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1