用于治疗生长激素缺乏症的包含重组HGH的药物组合物的制作方法
本发明涉及用于治疗生长激素缺乏症的药物组合物,其含有hgh-hyfc(gx-h9),hgh-hyfc是通过将杂合fc与人生长激素hgh融合而制备的重组人生长激素。更具体地,本公开涉及施用有效治疗生长激素缺乏症的重组hgh的合适方法和用于治疗生长激素缺乏症的药物组合物,所述药物组合物包括重组hghgx-h9和药学上可接受的载体,其中重组hghgx-h9每周施用一次,剂量为0.1至0.3mg/kg患者体重或每月两次,剂量为0.1至0.4mg/kg患者体重。此外,本公开涉及治疗生长激素缺乏症的方法,其包括将重组hghgx-h9每周一次施用于生长激素缺乏症患者,剂量为0.1至0.3mg/kg患者体重或每月两次,剂量为0.1至0.4mg/kg患者体重。
背景技术:
生长激素是一种从垂体前叶分泌的激素,是由191个氨基酸组成的单分子多肽。胰岛素样生长因子-1(igf-1)与生长激素受体组合表达,参与细胞的生长和再生。众所周知,生长激素是在正常人体的脑垂体中产生的,并逐渐增加到青春期,并随着年龄逐渐减少。
最常见的生长激素缺乏症是成人生长激素缺乏症(aghd)和儿童生长激素缺乏症(pghd)。成人生长激素缺乏症发生在患者的脑垂体受到放射或手术治疗脑肿瘤和脑出血或特发性疾病伤害时。如果生长激素的分泌不能很好地进行,则会显现包括体重减轻,骨矿物质密度降低,脂肪增加,hdl减少,ldl增加,肌肉力量降低等症状,并且因此生活质量恶化。在生长激素缺乏的成年患者中,与同一年龄组的正常人群相比,血清中igf-1的浓度属于-2或更低(<-2sds)或2.5百分位数(<2.5百分位数)的标准差评分(sds)。血液中生长激素的应答值可通过刺激试验测量,如胰岛素耐量试验(itt),精氨酸负荷试验(ghrh+arg),胰高血糖素试验,l-dopa试验和可乐定试验。当在体重指数(bmi)小于25kg/m2的患者中生长激素的峰值gh为11.0μg/l或更低,在bmi为25kg/m2-30kg/m2的患者中为8.0μg/l或更低,在bmi超过30kg/m2的患者中为4.0μg/l或更低时,gh峰值被视为缺乏症(guidelinesforuseofgrowthhormoneinclinicalpractice,endocr.pract.2009;15(suppl2))。
当存在脑垂体损害或发育障碍时,会发生儿童生长激素缺乏症。生长激素分泌紊乱表现为身材矮小,同年龄增长曲线中生长高度每年低于3%或5厘米或更少,并且可能出现低血糖,耐力退化,抑郁和精神不成熟等症状。在相同年龄的高度低于平均值3sd或更多的情况下,在高度低于父母身高的平均值1.5sd或更多的情况下,在高度低于平均身高2sd或更多且低于相同年龄增长1sd或更多持续1年或更长的情况下,在低于相同年龄增长0.5sd或更多持续2年或更长的情况下,或在虽然没有显示低生长症状但高度保持低于2sd持续1年或更长,或保持低于1.5sd持续2年或更长的情况下,症状可以确定为儿童生长激素缺乏症(consensusguidelineforthediagnosisandtreatmentofghdeficiencyinchildhoodandadolescence:summarystatementoftheghresearchsociety.ghresearchsociety,j.clin.endocrinol.metab.,2000nov;85(11):3990-3)。
在成人生长激素缺乏症的情况下,相关现有技术根据患者的体重选择药物剂量,但最近,用个体化剂量治疗患者。即,治疗开始时的剂量低于预期的治疗最佳剂量,并根据临床反应,不良事件(空腹血糖)或igf-1水平通过增加或减少0.1mg/天至0.2mg/天剂量的方法进行调整。在选择生长激素的治疗剂量时,需要考虑患者的性别、雌激素状态和年龄。成人生长激素缺乏症患者的治疗目标是改善新陈代谢的正常化和生活质量。为此,血液中的igf-1水平需要根据年龄和性别优化至剂量正常范围(-2sds至2sds)的中间(第50百分位或0sds)至1sds。
在儿童生长激素缺乏症的情况下,建议患者被确诊后尽快开始治疗。通常,使用每晚皮下施用生长激素的方法,推荐剂量为25μg/kg/天至50μg/kg/天。通常,在3个月或6个月定期检查生长速率,建议验证不良事件,以验证身高增长,生长速度变化,患者个体依从性和安全性,并验证血清中igf-1或igfbp-3水平。儿童生长激素缺乏症患者的治疗目标是正常生长高度,并且需要施用生长激素,使血液中的igf-1水平接近相同年龄的平均值(第50百分位数或0sds)。
在20世纪50年代首次开始生长激素治疗时生长激素是从尸体脑垂体中提取,供应非常有限且成本高昂,因为从一个人体内提取的生长激素量非常少。随着基因重组技术的发展,释放了在大肠杆菌中合成的生长激素(somatropin,1981,genentechcorporationinusa)。目前在美国上市的重组生长激素药物包括pfizer的genotropin、elililly的humatrope、genentech的nutropin、novonordisk的norditropin等。
然而,重组生长激素制剂是每日配制品,需要每周施用6次或7次。在成人生长激素缺乏症中,humatrope的剂量为0.2mg/天(范围为0.15mg/天至0.30mg/天)。当nutropin不是基于体重并且设定为剂量时,起始剂量为0.2mg/天(范围为0.15mg/天至0.3mg/天),并且可以在1到2个月的周期中改变为0.1mg/天至0.2mg/天的剂量。当nutropin的剂量基于体重设定时,使用起始剂量使其不超过0.005mg/kg/天或更多。如果需要增加剂量,则增加剂量,使其在施用4周后不超过0.01mg/kg/天。当norditropin不是基于体重并且设定为剂量时,起始剂量为0.2mg/天(范围为0.15mg/天至0.3mg/天),并且可以在1到2个月的周期中改变为0.1mg/天和0.2mg/天的剂量。当norditropin的剂量基于体重设定时,使用起始剂量使其不超过0.004mg/kg/天或更多。如果需要增加剂量,则增加剂量,使其在施用6周后不超过0.016mg/kg/天或更多。在儿童生长激素缺乏症的情况下,使用的genotropin剂量为0.16mg/kg/周至0.24mg/kg/周,使用的humatrope的剂量为0.026mg/kg/天至0.043mg/kg/天。使用的nutropin的剂量为0.3mg/kg/周,并且使用norditropin的剂量为0.024mg/kg/天至0.034mg/kg/天。
目前,生长激素制剂是一天配制品,特别是在儿童患者的情况下,每天注射药物3至4年的长期治疗是不方便的,并且已知注射引起的精神压力降低了患者的生活质量。此外,患者的给药频率依从性成为阻碍治疗效果的最大因素。此外,还知道随着治疗持续时间的增加,施用失败的次数显著增加(endocrinepractice,2008mar;14(2):143-54)。大约2/3的患者根据默认值具有低依从性,并且实际上,已知降低身高增长速度(plosone,2011jan;6(1):e16223)。
由于这些问题,已经通过使用各种技术尝试开发长效生长激素,但是直到现在,开发是成功的并且作为市场上发布的产品,一种长效配制品是唯一的。nutropin贮库由美国genentech公司开发,作为每月配制品,但由于生产困难,它已退出市场。lglifesciences公司的eutropinplus/declage使用透明质酸(ha)开发了每周配制品,但由于第一代产品针头较大,因此存在不便之处。
因此,有必要开发安全有效的长效生长激素,同时由于依从性降低而满足患者的便利性。gx-h9(hgh-杂合fc)是临床开发中的长效生长激素制剂。在美国专利登记号7,867,491中,通过组合免疫球蛋白igd和免疫球蛋白igg4制备了能够克服补体依赖性细胞毒性和抗体依赖性细胞毒性(它们是现有fc融合技术的问题)的杂合型fc。随后,在美国专利登记号8,529,899中,通过将杂合fc与人生长激素hgh融合,制备了能够替代现有的日常生长激素配制品的重组hgh(hgh-hyfc,gx-h9)。然而,fc融合蛋白的体内实际半衰期和治疗剂量根据与fc结合的药理活性成分的种类而变化很大。尚未发现使用gx-h9治疗生长激素缺乏症的有效和安全剂量及其频率,其中人生长激素hgh与hyfc融合。
因此,在本公开中,针对32名健康成人(2013-002771-18)和45名生长激素缺乏症成年患者(2014-002698-13),eudract)进行临床试验以开发显示重组生长激素gx-h9的最佳效果的剂量和剂量频率。结果,通过确认将igf-1sds值维持在正常范围内同时生长引起的副作用最小的gx-h9剂量、剂量频率和安全性完成本公开。
【公开内容】
【技术问题】
本发明的一个目的是提供一种治疗生长激素缺乏症的方法,其包括向生长激素缺乏症患者施用重组hgh(gx-h9),间隔至少一周施用一次,剂量为至少0.1mg/kg患者体重。
本公开内容的目的是提供通过测定有效治疗生长激素缺乏症的重组hghgx-h9的剂量和剂量频率,使用重组hghgx-h9治疗生长激素缺乏的方法。
本发明的一个方面提供了用于治疗生长激素缺乏症的药物组合物,其包含重组人生长激素gx-h9和药学上可接受的载体,其中重组hgh以间隔至少一周施用一次,剂量为至少0.1mg/kg患者体重。
【技术方案】
本发明的一个方面提供了用于治疗生长激素缺乏症的药物组合物,其包含重组人生长激素gx-h9和药学上可接受的载体,其中重组hgh每周施用一次,剂量为0.1mg/kg患者体重至0.3mg/kg患者体重。
本发明的另一方面提供用于治疗生长激素缺乏症的药物组合物,其包含重组hghgx-h9和药学上可接受的载体,其中重组hgh每月施用两次,剂量为0.1mg/kg患者体重至0.4mg/kg患者体重。
本发明的另一方面提供了治疗生长激素缺乏症的方法,其包括每周一次向生长激素缺乏症患者施用重组人生长激素gx-h9,剂量为0.1mg/kg患者体重至0.3mg/kg患者体重。
本公开的又一方面提供了一种治疗生长激素缺乏症的方法,其包括向患有生长激素缺乏的患者施用重组人生长激素gx-h9,每月两次,剂量为0.1mg/kg患者体重至0.4mg/kg患者体重。
根据本公开内容,当将重组人生长激素gx-h9每周一次(剂量为0.1mg/kg患者体重至0.3mg/kg患者体重)或每月两次(剂量为0.1mg/kg患者体重至0.4mg/kg患者体重)施用于生长激素缺乏症患者时,体内生长激素水平可维持较长时间,并且就hgh水平而言,igf-1sds值可维持在正常范围较长时间。因此,可能的是通过每周一次或每月两次施用生长激素而不需要每日施用来治疗生长激素缺乏症。
【附图说明】
通过以下结合附图的详细描述,将更清楚地理解本公开的上述和其他方面、特征和其他优点,其中:
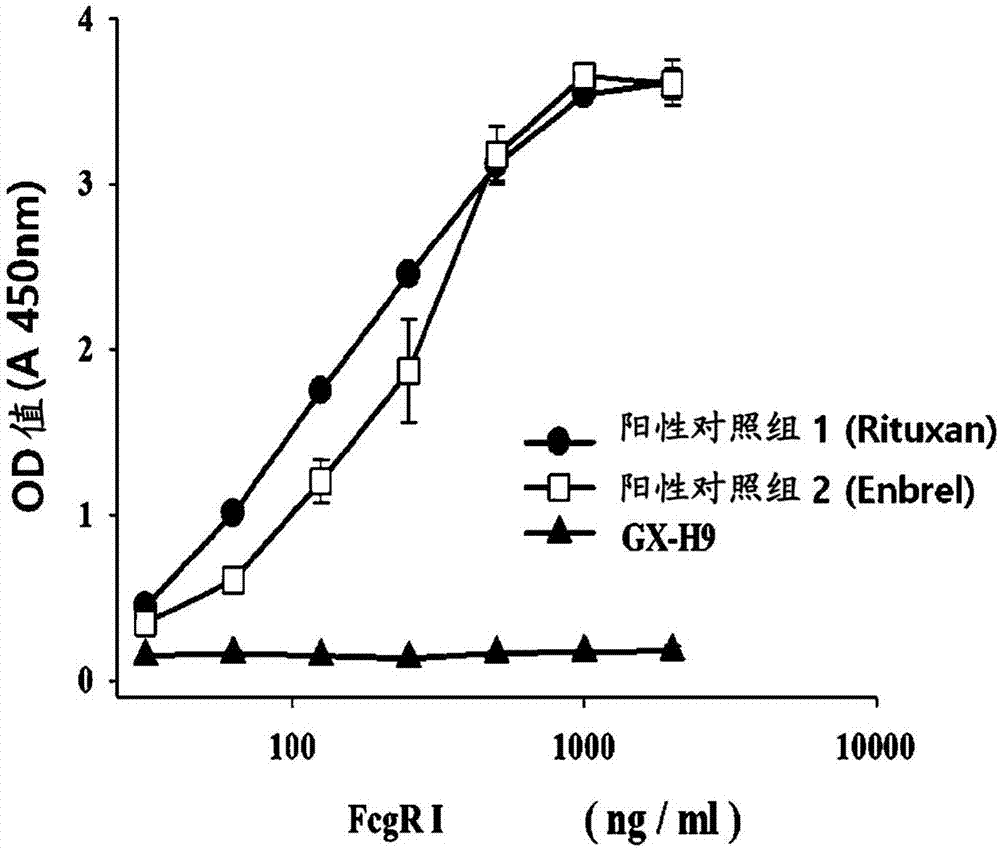
图1说明fcγ受体fcγri对重组hgh(gx-h9)的结合亲和力的结果。
图2说明c1q对重组hgh(gx-h9)的结合亲和力的结果;
图3是垂体切除大鼠体重增加的结果;
图4说明了向大鼠单次皮下施用重组体hgh(gx-h9)的药效学特征。
图5说明了在猴子中单次皮下施用重组hgh(gx-h9)的药效学特征。
图6说明了在猴子中重复皮下施用重组hgh(gx-h9)的药效学特征。
图7说明了在1期临床研究中重组hgh(gx-h9)的药效学特征。
图8说明了在1期临床研究中重组hgh(gx-h9)的药代动力学(igf-1sds)特征。
图9说明了在2期临床研究中重复施用重组hgh(gx-h9)的药效学特征。和
图10显示了在2期临床研究中重复施用重组hgh(gx-h9)的药代动力学特征。
【发明方式】
尚未发现促进人体实际生长的重组人生长激素gx-h9的有效剂量和剂量频率。
发明人通过针对32名健康成人(2013-002771-18)和45名生长激素缺乏症成年患者(2014-002698-13,eudract)进行临床研究以开发能够表现出gx-h9最佳效果的剂量和剂量频率。结果,观察到在将重组hghgx-h9每周一次(剂量为0.1mg/kg患者体重至0.3mg/kg患者体重)或每月两次(剂量为0.1mg/kg患者体重至0.4mg/kg患者体重)施用情况下,体内生长激素维持较长时间,并且igf-1sds值可维持在正常范围。
本公开的一个方面涉及用于治疗生长激素缺乏症的药物组合物,其含有重组hgh(gx-h9)和药学上可接受的载体,其中重组hgh以间隔至少一周施用一次,剂量为至少0.1mg/kg患者体重。
本发明的一个方面涉及用于治疗生长激素缺乏症的药物组合物,其含有重组hgh(gx-h9)和药学上可接受的载体,其中重组hgh每周施用一次,剂量为0.1mg/kg患者体重至0.3mg/kg患者体重。特别地,本公开涉及药物组合物,其中重组hgh每周施用一次,剂量为0.1mg/kg患者体重至0.2mg/kg患者体重。
此外,本公开的另一方面涉及用于治疗生长激素缺乏症的药物组合物,其含有重组hgh蛋白gx-h9和药学上可接受的载体,其中重组hgh每月施用两次,剂量为0.1mg/kg患者体重至0.4mg/kg患者体重。特别地,本公开涉及药物组合物,其中重组hgh每两周施用一次,剂量为0.15mg/kg患者体重至0.4mg/kg患者体重。
在本公开的药物组合物中,重组hghgx-h9可以包括seqidno:1的氨基酸序列。本公开的药物组合物可以皮下施用。
此外,本公开的另一方面提供了用于治疗生长激素缺乏症患者的方法,其包括向生长激素缺乏症患者施用重组hghgx-h9,每周一次,剂量为0.1mg/kg患者体重至0.3mg/kg患者体重。
此外,本公开的另一方面提供了用于治疗生长激素缺乏症患者的方法,其包括向生长激素缺乏症患者施用重组hghgx-h9,每月两次,剂量为0.1mg/kg患者体重至0.4mg/kg患者体重。
本申请中使用的重组hgh“gx-h9”被称为hgh-hyfc,其是与杂合fc融合的人生长激素,并且可以具有seqidno:1的氨基酸序列。重组hghgx-h9可以通过美国专利登记号8,529,899中公开的方法制备。
根据本发明,含有重组hghgx-h9的药物组合物可以施用给患有生长激素缺乏症的成人。
成人生长激素缺乏症意味着与成人中相同年龄组的正常人相比的标准差评分(sds)为-2或更低(<-2sds)或在2.5百分位数内(<2.5百分位数)的情况。在患有垂体疾病和垂体功能减退症的成年人中,生长激素缺乏通常与身体有关,并且可能导致精神障碍以及身体组成和代谢异常。成人生长激素缺乏症可分为三类。成人生长激素缺乏可分为第一儿童期发病的生长激素缺乏症、由于下丘脑-垂体型疾病导致的激素缺乏症的情况和特发性生长激素缺乏症。
本公开的药物组合物可包括药学上可接受的载体,其可以是适于将重组hgh递送至患者的任何无毒材料。可以包括蒸馏水、醇、脂肪、蜡和惰性固体作为载体。药学上可接受的佐剂,例如缓冲剂、分散剂和稀释剂,例如抑菌性注射用水(bwfi)、磷酸盐缓冲盐水、林格氏溶液、右旋糖溶液、蔗糖、泊洛沙姆等可包括在本公开的药物组合物。
在本公开中,重组hghgx-h9可以每周施用一次,剂量为0.1mg/kg患者体重至0.3mg/kg患者体重,并且例如,施用剂量可以根据患者的年龄,性别和雌激素状态在0.1mg/kg患者体重、0.15mg/kg患者体重、0.2mg/kg患者体重、0.25mg/kg患者体重、或0.3mg/kg患者体重的剂量变化。优选地,重组hghgx-h9可以每周施用一次,剂量为0.1mg/kg患者体重至0.2mg/kg患者体重。此外,重组hghgx-h9可以每月施用两次,剂量为0.1mg/kg患者体重至0.4mg/kg患者体重,并且例如,可以每两周施用一次,根据年龄、性别和雌激素状态,剂量为0.1mg/kg患者体重、0.15mg/kg患者体重、0.2mg/kg患者体重、0.25mg/kg患者体重、0.3mg/kg患者体重、0.35mg/kg患者体重、或0.4mg/kg患者体重。优选地,重组hghgx-h9可以每月施用两次,剂量为0.15mg/kg患者体重至0.4mg/kg患者体重。特别地,重组hghgx-h9的优选剂量是每周施用一次0.1mg/kg,每月施用两次0.2mg/kg,或每月施用两次0.3mg/kg。此外,在一些情况下,根据年龄、性别和雌激素状态,重组hgh可以0.3mg/kg至0.6mg/kg每月施用两次、每三周施用一次或每月施用一次。
可以基于患者的年龄、性别和雌激素状态调整重组hgh的剂量,并且可以在监测施用进程的同时增加或减少重组hgh的剂量。随后施用的重组hgh的剂量可以随着igf-1sds水平变化高于或低于初始剂量或等于初始剂量。在初始阶段,应安全地施用少量重组hgh,并且然后在确认无不良反应后逐渐增加。此外,可以调节重组hgh的剂量,同时在患者的血浆或血清样品中监测变化的igf-1sds的水平。适合于每个个体患者的重组hgh的剂量可以根据患者的年龄、性别、体质、体重而变化。
含有重组hghgx-h9的本发明的药物组合物可以通过各种方法施用给受试者。例如,药物组合物可以胃肠外施用,例如皮下、肌内或静脉内施用。可以根据通常公知的灭菌技术对组合物进行灭菌。该组合物可包括调节生理条件如ph调节所需的药学上可接受的辅助物质和佐剂、毒性改性剂及其类似物,例如,可包括乙酸钠、氯化钠、氯化钾、氯化钙、乳酸钠等等。在制剂中,重组hgh的浓度可以是非常多种,并且可以根据所选择的特定施用方法基于体液体积、粘度等优先选择。
在下文中,将通过实施例更详细地描述本公开。这些实施例仅用于举例说明本公开,并且对于本领域技术人员显而易见的是,解释本公开的范围不限于这些实施例。
实施例1.重组hghgx-h9的制备
重组hghgx-h9可以根据美国专利登记号8,529,899中公开的方法制备。
首先,将hif-hyfc的核酸序列(其中hyfc与编码seqidno:1的氨基酸序列的人生长激素(hgh)融合)插入表达载体pad15以产生表达hgh-hyfc的细胞系。为了产生包含hgh-hyfc结构基因的载体,将genbankaaa98618.1序列用于人生长激素hgh基因,并通过融合genbankp01880(igd)和genbankaah25985(igg4)序列产生hyfc基因。使用特异性限制酶将通过基因制造商获得的基因作为表达载体注射以准备细胞系产生。
通过磷酸钙法将通过上述方法确保的表达载体转染到chodg44(columbiauniversity,usa)细胞中。转染6小时后,用磷酸盐缓冲液洗涤转染的细胞,然后用10%dfbs(gibco,usa,30067-334),memα(gibco,12561,usa,catno.12561-049)和ht+(gibco,usa,11067-030)培养基替换培养基。转染48小时后,通过使用不含ht的10%dfbs+memα培养基在100mm平板中连续稀释转染的细胞来进行ht选择。培养基每周更换两次,同时将转染的细胞留下直至形成单个菌落。此后,为了使用dhfr系统扩大生产力,对来自ht选择的克隆进行mtx扩增。在mtx扩增后,进行4至5次亚培养以稳定细胞用于生产力评估,并评估单位生产力。获得适于产生靶蛋白的克隆。
为了获得关于最有生产力克隆的单克隆,进行了有限稀释克隆(ldc)。通过用培养基稀释细胞以使浓度为1个细胞/孔,将ldc接种在96孔板中。接种10至14天后,通过显微镜获得仅具有单克隆的孔的细胞,并在足以进行生产力评估的t25烧瓶中培养,然后确保具有高生产力的细胞系。
从确保的细胞系中获得培养液后,从培养液中纯化目标蛋白质。蛋白质培养溶液样品使用
实施例2.重组hghgx-h9的抗体依赖性细胞介导的细胞毒性(adcc)和补体介导的细胞毒性(cdc)测试
为了验证gx-h9的杂合fc结构域不诱导抗体依赖性细胞介导的细胞毒性(adcc)和补体依赖性细胞毒性(cdc),进行酶联免疫吸附测定(elisa)。
作为阳性对照组,使用已知对fcγ受体fcrγi、ii和iii具有非常高的结合亲和力的rituxan(瑞士罗氏公司(rochecorporation))和enbrel(美国的安进公司(amgencorporation))。gx-h9、rituxan和enbrel包被在每个96孔板上,然后与连续稀释的fcγ受体i反应。在反应时间过去后,用缓冲溶液洗涤反应溶液以除去未与测试物质结合的fcγ受体i。此后,通过使用生物素化的抗fcγri抗体和hrp缀合的链霉亲和素抗体测量fcγ受体i和测试物质之间的结合力。
还通过使用上述elisa方法测量c1q和gx-h9之间诱导细胞介导的细胞毒性的结合力。作为阳性对照组使用rituxan(瑞士罗氏公司(rochecorporation))和enbrel(美国的安进公司(amgencorporation)),并通过使用hrp缀合的抗c1q抗体测量测试物质之间的结合力。
结果证实,gx-h9与fcγ受体i具有低结合力,诱导抗体依赖性细胞介导的细胞毒性(如图1所示)以及与c1q具有低结合力,诱导补体介导的细胞毒性(如图2所示)。
实施例3.重组hghgx-h9的临床前试验结果
3-1:使用垂体切除的大鼠皮下重复施用gx-h9的功效测试
通过使用垂体切除的大鼠作为动物疾病模型来测试gx-h9的功效。作为对照组,使用genotropin(辉瑞公司(pfizercorporation),usa)作为日常施用剂,并且每周一次施用gx-h9,然后比较功效。
在垂体切除术后约1周,针对体重增加10%或更低进行测试。组1是阴性对照组,仅用制剂缓冲液皮下施用两周。组2每天皮下注射0.2mg/kg的genotropin。组3每周施用一次1.4mg/kg的genotropin,这是每周的剂量。组4每周施用一次1.4mg/kg的gx-h9(对应于genotropin的每周剂量)。组5每周施用一次3.5mg/kg的gx-h9(对应于genotropin的每周剂量的摩尔数的1/2)。组6每周施用一次7.0mg/kg的gx-h9(对应于genotropin的每周剂量的相同摩尔数)。施用药物后,观察症状并每天测量体重。
结果,如图3所示,当每天施用一次genotropin时,每天施用0.2mg/kg平均体重增加约20g/kg,但是当每周施用一次剂量(1.4mg/kg)时,没有体重增加。当gx-h9以7mg/kg的剂量每周施用一次(组6)时,体重增加大于施用相同摩尔数的genotropin(组3)的重量增加。另外,当以3.5mg/kg的剂量施用gx-h9(组5)时,对于每天0.2mg/kg施用genotropin的情况(组2)显示出类似的功效。
3-2:使用大鼠单次皮下施用重组hghgx-h9后的药效学试验
为了测试gx-h9的药代动力学,皮下施用大鼠gx-h9一次。作为对照组,皮下施用eutropin(韩国lglifesciences,inc.)一次,并比较功效。组1皮下施用eutropin单次剂量200ug/kg,组2皮下施用gx-h9单次剂量200μg/kg。组3皮下施用gx-h9单次剂量1,000μg/kg。
血液在皮下施用之前和之后1、4、8、12、18、24、36、48、72、96、120、144、168、216、264和336小时获取。通过特异性生物测定(elisa)测量每种物质的血液浓度。
测试结果如图4所示并且单次皮下注射剂量为200ug/kg或1,000ug/kg的gx-h9后的药代动力学在17小时或24小时达到最高血液浓度(tmax),并且直至9天和11天仍在血液中检测到gx-h9。随着剂量的增加,全身暴露也增加。
当与作为对照物质的200ug/kgeutropin的施用组相比时,在血液中检测到测试物质持续更长时间(eutropin24h对比gx-h99天)。在皮下施用200μg/kggx-h9的情况下,达到最大血液浓度(tmax)的时间差为约20小时(eutropin4h对比gx-h924h)。从上述结果可以看出,与对照药物eutropin相比,gx-h9长时间连续暴露于大鼠全身。另外,随着gx-h9的剂量增加,皮下施用后的全身暴露按比例增加。
3-3:在猴子中单次皮下施用重组hghgx-h9后的药效学试验
在食蟹猴中分析gx-h9和作为对照物质的eutropin的药代动力学。在雄性猴(3只/组)中,gx-h9每周重复皮下施用4次,剂量为500μg/kg和1000μg/kg,eutropin作为对照物质以1000μg/kg的剂量皮下施用一次。
在施用gx-h9的组中,在第1次和第4次施用(第0天和第21天施用)前和施用后1、4、8、12、18、24、30、36、48、60、72、96、120、144和168小时采集血液样品。
在施用eutropin的组中,在单次施用前和施用后1、4、8、12、18、24、30、36、48、60、72、96、120、144和168小时采集血液样品。
通过gx-h9和eutropin的特异性生物测定(elisa)测量血液浓度,结果示于图5和6中。当以500μg/kg或1,000μg/kg的剂量皮下施用gx-h9时,观察到在单次施用(第0天)后和重复施用后(4周)与剂量增加相关的全身暴露增加。
与eutropin(1000μg/kg,单次皮下施用)相比,检测(施用eutropin后12至18小时相比于施用gx-h9后168小时)到gx-h9(500μg/kg或1000μg/kg)的施用血液中的时间更长。即,当皮下施用gx-h9时,观察到全身暴露比对照药物eutropin更持久。此外,随着gx-h9的剂量从500μg/kg增加至1000μg/kg,观察到皮下施用后的全身暴露与剂量增加成比例地增加。
实施例4.重组hghgx-h9的1期临床研究结果
4-1:重组hghgx-h9在健康成人中的药代动力学特征
通过针对健康志愿者进行随机、双盲、安慰剂对照、单次递增剂量的1期临床研究。1期临床研究的目的是评估单次皮下施用gx-h9后的安全性、耐受性和药效学/药代动力学特征。将健康志愿者随机分配到研究组或安慰剂组后,在将gx-h9单次皮下施用至四个剂量组(0.2mg/kg、0.4mg/kg、0.8mg/kg和1.6mg/kg)后进行总共56天的评估。
在施用gx-h9的组中,在单次施用前和施用后0.25、1、2、4、6、8、12、16、24、28、32、36、40、48、54、60、72、80、96、144、312、480、648和1320小时采集血样。
通过gx-h9的特异性生物测定(elisa)测量血液浓度,结果示于下表1和图7中。
[表1]
以中位数(范围)评估tmax。
#n=5(来自一名志愿者的t1/2值的衍生参数未被可靠地确定)
在单次皮下施用gx-h9,后约12小时(8至16小时)观察到几何平均浓度的峰值并且在施用后约32小时(28至32小时)观察到较低浓度的第二峰。在最大剂量下,第二峰对应于cmax(参见图7)。在所有剂量下,cmax和auc均增加更多。半衰期(t1/2)从69.2小时到138小时,并且存在个体差异。
4-2:重组hghgx-h9在健康成人中的药代动力学特征
在施用gx-h9的组中,在单次施用前采集血液并且在施用后12、24、36、48、60、72、96、144、312、480、648和1320小时采集血液。通过将施用前测量的血液中igf-1的浓度设定为基线,图8中示出了变化量。
图8显示了将施用安慰剂组的基线和0.2mg/kg、0.4mg/kg、0.8mg/kg和1.6mg/kggx-h9组相比,血液中igf-1浓度(ng/ml)的变化量。以0.2mg/kg、0.4mg/kg、0.8mg/kg和1.6mg/kg皮下单次施用gx-h9后,血液中igf-1的浓度与剂量成比例地增加。在0.2mg/kg、0.4mg/kg、0.8mg/kg和1.6mg/kg的剂量下,平均最大增加(相对基线的变化%)分别为81%、157%、301%和349%。血液中达到igf-1最高浓度的时间为48至96小时,并且与剂量成比例地增加。证实igf-1的平均浓度在以0.2mg/kg的剂量施用后第7天恢复至基线,并且以其他剂量在第14天恢复至基线。
4-3:重组hghgx-h9在健康成人中的安全性结果
下表2总结了根据施用药物、药物与不良事件之间的关系以及不良事件的强度在受试者中观察到的治疗紧急不良事件的结果。
[表2]
n=暴露于药物的个体数目
n=显示不良事件的个体数目
e=不良事件的数目
(%)=根据治疗经历不良事件的个体比例(n/n)*100
未记录严重不良事件或轻度不良事件
如表2所示,总共报道了21名受试者的54例不良事件。未报告死亡或严重不良事件。在一名受试者中报告了重度不良事件,但确定其不是与该药物相关的不良事件。除上述不良事件外,所有不良事件的严重程度均为轻微。最常报告的不良事件是肌肉骨骼和结缔组织障碍(19例),全身性障碍和施用部位障碍(11例)和神经障碍(10例)。报告的三种或更多不良事件为肌痛(7例),导管插入部位反应(6例),头痛(5例),鼻咽炎(5例),关节痛(4例)和肢痛(3例)。
同时,在施用gx-h9的受试者中分析gx-h9抗体的形成。在施用前和第28天和第56天观察到抗药物抗体(ada)。结果,没有患者显示由gx-h9形成的抗体。
实施例5.重组hghgx-h9的2期临床研究结果
5-1:生长激素缺乏症成人患者中gx-h9的药代动力学特征
进行了随机、主动控制、开放标签的2期临床研究,以评估生长激素缺乏症成年患者中gx-h9的安全性、耐受性、功效和药效学/药代动力学特征(表3)。剂量重复施用,共计12周,每周0.1mg/kg(组1),每月两次0.3mg/kg(组2),或每月两次0.2mg/kg(组3)。此外,作为活性对照药物,每天施用6μg/kg的genotropin(g:组4)。
[表3]
在每周一次施用gx-h9的组中,在第一次施用(第1周)和最后一次施用(第12周)过程中采集血液,并在施用后1、2、4、8、12、18、24、48、72和168小时采集血液。
在每月两次施用gx-h9的组中,在第一次施用(第一周)和最后一次施用(第11周)之前采集血液,并在施用后1、2、4、8、12、18、24、48、72、168、240和336小时采集血液。
从获得的血液样品中测量血液中gx-h9的浓度,结果示于表4至6和图9中。
[表4]
[表5]
[表6]
重复施用0.1mg/kg的gx-h912周后,在第一次施用(第1周)和最后一次施用(第12周)时,施用前和施用后1、2、4、8、12、18、24、48、72和168小时分析药代动力学变化。证实gx-h9在施用前(低于定量限,blq)至第一次(第1周)施用后168小时(7天)和至最后一次施用(第12周)的平均(标准偏差)浓度分别为7.41(2.71)和12.75(4.92)。此外,在重复施用0.3mg/kg和0.2mg/kg的gx-h912周后,在第一次施用(第1周)和最后一次施用(第11周)时、在施用前和在施用后1、2、4、8、12、18、24、48、72、168、240和336小时分析药代动力学的变化。证实gx-h9在施用前(低于定量限,blq)至第一次(第1周)施用后336小时(14天)和至最后一次施用(第12周)的平均(标准偏差)浓度分别为9.20(31.66)和11.58(4.70)(0.3mg/kg/间隔每月两次),4.57(1.07)和3.70(0.97)(0.2mg/kg/每月两次)。
因此,显示当在0.1mg/kg至0.3mg/kg的浓度范围内每周或每月两次施用gx-h9时,gx-h9的浓度维持在正常水平,而没有任何体内积累。
5-2:生长激素缺乏症成人患者中重组hghgx-h9的药代动力学特征
在每周一次施用gx-h9的组中,在第一次施用(第1周)和最后一次施用(第12周)过程中采集血液,并在施用后12、24、48、72和168小时采集血液。为了评估igf-1标准差评分(igf-1sds)与正常人相比时间和剂量强度的变化,igf-1sds在第3周、第5周、第7周、第9周和第11周施用后4天进行了分析。在每月两次施用gx-h9的组中,在第一次施用(第1周)和最后一次施用(第11周)过程中采集血液,并在施用后12、24、48、72、168、240和336小时采集血液。为了评估igf-1sds的时间和剂量强度的变化,igf-1sds在第3周、第5周、第7周、和第9周施用后4天进行了分析。
gx-h9的药效学特征的结果示于表7至10和图10中。
[表7]
[表8]
[表9]
[表10]
重复施用0.1mg/kg的gx-h912周后,在第一次施用(第1周)和最后一次施用(第12周)时,施用前和施用后12、24、48、72和168小时分析药效学变化。在生长激素缺乏症患者中,施用前平均(标准偏差)igf-1sds为-2.48(0.93),最后一次施用之后7天内显示变化,最小值为-0.41(0.97),最大值为1.01(0.87)。此外,在重复施用0.3mg/kg和0.2mg/kg的gx-h912周后,在第一次施用(第1周)和最后一次施用(第11周)时、在施用前和在施用后12、24、48、72、168、240和336小时分析药效学的变化。在生长激素缺乏症患者中,施用前平均(标准偏差)igf-1sds为-2.64(1.25)和-2.40(0.82),最后一次施用(第11周)之后14天内显示变化,最小值为-1.36(1.59)和-2.01(0.88),最大值为2.12(1.82)和1.33(1.83)。此外,在每天6μg/kg重复施用活性对照药物genotropin后,在第一次施用(第1周)和最后一次施用(第12周)时,施用前和施用后12、24、48、和72小时分析药效学变化。在生长激素缺乏症患者中,施用前平均(标准偏差)igf-1sds为-2.70(0.88),最后一次施用(第12周)之后3天内显示变化,最小值和最大值为0.42(0.82)。
每周施用0.1mg/kg或每月两次施用0.3mg/kg之后48小时与72小时之间显示gx-h9的igf-1sds的最大平均变化,并且在施用后168至336小时内显示最小平均变化。同时,在每天施用的活性对照药物genotropin中,在施用后12小时内显示最大平均变化,并且在施用后24小时内达到最小平均变化。
治疗成人生长激素缺乏症的目标是改善新陈代谢的正常化和生活质量。由于根据患者的年龄和性别不同,施用gx-h9后血液中的igf-1水平需要优化至正常范围(-2sds至2sds)内的中间(第50百分位数或0sds)至1sds范围。因此,在每周一次施用gx-h9的情况下,证实通过根据igf-1水平在浓度范围为0.1mg/kg至0.2mg/kg调整治疗剂量,治疗的患者的igf-1sds范围可维持在正常水平。此外,在每月两次施用gx-h9的情况下,证实通过根据igf-1水平在浓度范围为0.2mg/kg至0.4mg/kg调整治疗剂量,治疗的患者的igf-1sds范围可维持在正常水平。
5-3:重组hghgx-h9在生长激素缺乏症患者中的安全性结果
根据施用的药物以及药物与不良事件之间的关系分析在受试者中观察到的不良事件的结果总结在下表11中。
[表11]
n=暴露于药物的个体数目
n=显示不良事件的个体数目
e=不良事件的数目
(%)=根据治疗经历不良事件的个体比例(n/n)*100
未观察到严重不良事件或轻度不良事件
在每周一次施用gx-h9的5名患者中报告总共11个不良事件。未报告死亡或严重不良事件。所有不良事件的严重程度均为轻微。最常报告的不良事件是2例肌肉骨骼和结缔组织障碍以及3例血液和淋巴器官障碍。据报道,3种不良事件与药物有关。所有报道的不良事件均在常规生长激素治疗中常见。
5-4:重组hghgx-h9在生长激素缺乏症患者中的抗体反应(ada)结果
为了验证连续施用的药理作用,检查抗体形成是否由gx-h9诱导。在一名患者(样本1502-001)的情况下,显示测试结果是阳性的,因为抗体在临床试验开始之前存在。此外,即使在施用后第1天、第32天和第106天,gx-h9的值也没有增加。此外,作为检查患者的药效学的结果,证实igf-1水平大大增加,因此表明现有的抗hgh抗体与gx-h9疗法无关。结果,gx-h9的施用不会在全体患者中诱导抗体应答。
[表12]
1)筛选:如果样品是非反应性的它将被报告为<20;如果是反应性的,将评估特异性
2)特异性:%抑制定义为100x(1-(平均odgx-h9掺入/平均od未掺入的样品));如果≥17%则将评估抑制样品的滴度3)滴度值:滴度样品定义为稀释的倒数,其产生的平均od大于或等于平板的截点od,其中系列中随后的稀释产生低于截点od的平均od。
na:样品无反应性,不需要额外分析
已知第一代(每日施用)hgh用于治疗成人生长激素缺乏症的推荐剂量为6μg/kg至12μg/kg。当转换成与第一代hgh的7天量相同的摩尔数时,gx-h9配制品的剂量为每周一次0.21mg/kg至0.42mg/kg,以及每月两次0.42mg/kg至0.84mg/kg。然而,显示临床验证的有效剂量与通过简单计算预测的有效剂量不同。根据实际临床试验的药代动力学和药效学模拟和建模的结果,预测成人生长激素缺乏症患者的最佳剂量为每周一次0.1mg/kg至0.2mg/kg或每月两次0.2mg/kg至0.4mg/kg。也就是说,观察到gx-h9的有效剂量低于从现有的每日hgh量预测的剂量。
此外,证实当每周一次施用0.1mg/kg剂量给成年患者12周时,没有显著的不良事件,并且通过药物施用没有抗体应答。作为施用每月两次0.3mg/kg剂量的结果,证实没有不良事件或抗体应答。因此,gx-h9显示出与体内生长激素或第一代生长激素产品相当的功效,并具有增强的半衰期,因此药物的便利性得到了极大改善并且安全性得到了验证。
尽管已经详细描述了本公开的具体部分,但是对于本领域技术人员显而易见的是,这样的具体描述仅是优选实施方案,并且本公开的范围不受限制。因此,本公开的实质范围将由所附权利要求及其等同物限定。
序列表文本文件
参见所附文件
序列表
<110>株式会社吉耐森
韩独(株)
<120>用于治疗生长激素缺乏症的包含重组hgh的药物组合物
<130>pe04846a
<140>pct/kr2017/001726
<141>2017-02-16
<150>10-2016-0018695
<151>2016-02-17
<160>1
<170>patentin版本3.5
<210>1
<211>436
<212>prt
<213>人工序列
<220>
<223>gx-h9
<400>1
pheprothrileproleuserargleupheaspasnalametleuarg
151015
alahisargleuhisglnleualapheaspthrtyrglnglupheglu
202530
glualatyrileprolysgluglnlystyrserpheleuglnasnpro
354045
glnthrserleucysphesergluserileprothrproserasnarg
505560
glugluthrglnglnlysserasnleugluleuleuargileserleu
65707580
leuleuileglnsertrpleugluprovalglnpheleuargserval
859095
phealaasnserleuvaltyrglyalaseraspserasnvaltyrasp
100105110
leuleulysaspleuglugluglyileglnthrleumetglyargleu
115120125
gluaspglyserproargthrglyglnilephelysglnthrtyrser
130135140
lyspheaspthrasnserhisasnaspaspalaleuleulysasntyr
145150155160
glyleuleutyrcysphearglysaspmetasplysvalgluthrphe
165170175
leuargilevalglncysargservalgluglysercysglyphearg
180185190
asnthrglyargglyglygluglulyslyslysglulysglulysglu
195200205
gluglnglugluarggluthrlysthrproglucysproserhisthr
210215220
glnproleuglyvalpheleupheproprolysprolysaspthrleu
225230235240
metileserargthrprogluvalthrcysvalvalvalaspvalser
245250255
glngluaspprogluvalglnpheasntrptyrvalaspglyvalglu
260265270
valhisasnalalysthrlysproargglugluglnpheasnserthr
275280285
tyrargvalvalservalleuthrvalleuhisglnasptrpleuasn
290295300
glylysglutyrlyscyslysvalserasnlysglyleuproserser
305310315320
ileglulysthrileserlysalalysglyglnproarggluprogln
325330335
valtyrthrleuproproserglngluglumetthrlysasnglnval
340345350
serleuthrcysleuvallysglyphetyrproseraspilealaval
355360365
glutrpgluserasnglyglnprogluasnasntyrlysthrthrpro
370375380
provalleuaspseraspglyserphepheleutyrserargleuthr
385390395400
valasplysserargtrpglngluglyasnvalphesercysserval
405410415
methisglualaleuhisasnhistyrthrglnlysserleuserleu
420425430
serleuglylys
435
- 还没有人留言评论。精彩留言会获得点赞!