生物起搏器模型构建方法及终端设备与流程
本发明属于起搏器建模技术领域,尤其涉及一种生物起搏器模型构建方法及终端设备。
背景技术:
近年来,心血管疾病已成为威胁国民健康的首要问题,并有持续走高的趋势。其中,房室传导阻滞等导致的心律失常的唯一治疗手段是电子起搏器,其应用多年来在已挽救了超过几百万患者的生命,使他们可以像正常人生活。但是由于起搏器高昂的价格、植入术前后费用、医保覆盖等经济问题,实际上仅有少数人能够接受植入心脏起搏器治疗。生物起搏器相关实验的出现为治疗心律失常提供了新的方法,生物起搏器是一种通过基因修饰或干细胞诱导分化,获得类似于窦房结细胞的具有自主起搏功能的心肌细胞,将一定数量的自动起搏细胞注射到心脏的某个区域,使心脏在窦房结病变的情况下仍然能够自发起搏的治疗心律失常的方法。研究表明,通过基因治疗,细胞治疗或二者共同作用,能够使心室,心房,房室结等心肌细胞产生自动节律,并带动整个心脏有规律地跳动,进而构成生物起搏器。该生物起搏器具有诸多优点,如植入方便,无需开胸手术;可以与患者的情绪相互响应,更加符合生理需求等。
然而,对生物起搏器的实验研究,目前只能针对动物进行实验,存在诸多局限性,大大减慢了生物起搏器进行应用的进程。
技术实现要素:
有鉴于此,本发明实施例提供了一种生物起搏器模型构建方法及终端设备,以解决现有技术中只能针对动物进行实验,存在诸多局限性,大大减慢了生物起搏器进行应用的进程的问题。
本发明实施例的第一方面提供了一种生物起搏器模型构建方法,包括:
构建内向整流钾电流离子通道模型;
构建起搏电流离子通道模型;
根据所述内向整流钾电流离子通道模型、所述起搏电流离子通道模型和预存的心室肌细胞膜上其他离子通道模型重构生物起搏通道模型,将重构生成生物起搏器模型;
判断所述生物起搏器模型的电生理特性是否合格;
若所述生物起搏器模型的电生理特性合格,则判定所述生物起搏器模型构建成功。
作为进一步的技术方案,所述方法还包括:
将所述生物起搏器模型整合到预存的心室单细胞模型中形成生物起搏器模拟模型;
根据预存的仿真技术获取所述生物起搏器模拟模型中肌浆网漏电流流入细胞质内的第一钙电流和子空间钙泵电流流入细胞质内的第二钙电流;
根据所述第一钙电流和所述第二钙电流判断所述生物起搏器模拟模型中细胞内钙离子浓度在预设时间后是否达到预设稳态;
若所述生物起搏器模拟模型中细胞内钙离子浓度在预设时间后达到预设稳态,则判定所述生物起搏器模型起搏成功。
作为进一步的技术方案,所述方法还包括:
根据表达式
作为进一步的技术方案,所述方法还包括:
根据表达式if=if,na+if,k;if,na=gf,na*y(vm-ena);if,k=gf,k*y(vm-ek)构建所述起搏电流离子通道模型,其中,if为起搏电流,if,na为if电流对na通透的离子通道电流,if,k为if电流对k通透的离子通道电流,gf,na为if,na的最大电导值,gf,k为if,k的最大电导值,ena为钠离子的平衡电位,ek为钾离子的平衡电位,vm为心室细胞跨膜电压,y为起搏电流的激活变量。
作为进一步的技术方案,所述判断所述生物起搏器模型的电生理特性是否合格包括:
根据表达式
iion=ina+ito+ikr+iks+ical+inaca
iion表达式为:+inak+ipca+ipk+ibca+ibna+ix,其中,ina为快速钠电流,ito为瞬时外向电流,ikr为快速延迟整流电流,iks为慢延迟整流电流,ical为l型钙电流,inaca为钠钙交换电流,inak为钠钾泵电流,ipca为钙泵电流,ipk为钾泵电流,ibca为背景钙电流,ibna为背景钠电流,ix为起搏靶向电流,
ix表达式为:
调整模型中α和β的值判断是否在心室肌细胞中诱导自发起搏行为;
若判定诱导了自发起搏行为,则所述生物起搏器模型的电生理特性合格。
本发明实施例的第二方面提供了一种生物起搏器模型构建装置,包括:
钾电流离子通道模型构建模块,用于构建内向整流钾电流离子通道模型;
起搏电流离子通道模型构建模块,用于构建起搏电流离子通道模型;
生物起搏器模型生成模块,用于根据所述内向整流钾电流离子通道模型、所述起搏电流离子通道模型和预存的心室肌细胞膜上其他离子通道模型重构生成生物起搏器模型;
电生理特性判断模块,用于判断所述生物起搏器模型的电生理特性是否合格;
电生理特性判定合格模块,用于若所述生物起搏器模型的电生理特性合格,则判定所述生物起搏器模型构建成功。
作为进一步的技术方案,所述装置还包括:
生物起搏器模拟模型生成模块,用于将所述生物起搏器模型整合到预存的心室单细胞模型中形成生物起搏器模拟模型;
钙电流获取模块,用于根据预存的仿真技术获取所述生物起搏器模拟模型中肌浆网漏电流流入细胞质内的第一钙电流和子空间钙泵电流流入细胞质内的第二钙电流;
钙离子浓度判断模块,用于根据所述第一钙电流和所述第二钙电流判断所述生物起搏器模拟模型中细胞内钙离子浓度在预设时间后是否达到预设稳态;
模型起搏成功认定模块,用于生物起搏器模拟模型中细胞内钙离子浓度在预设时间后达到预设稳态,则判定所述生物起搏器模型起搏成功。
作为进一步的技术方案,所述装置还包括:
起搏电流离子通道模型构建子模块,用于根据表达式
本发明实施例的第三方面提供了一种生物起搏器模型构建终端设备,包括存储器、处理器以及存储在所述存储器中并可在所述处理器上运行的计算机程序,所述处理器执行所述计算机程序时实现如上述第一方面所述的方法。
本发明实施例的第四方面提供了一种计算机可读存储介质,所述计算机可读存储介质存储有计算机程序,所述计算机程序被处理器执行时实现如上述第一方面所述的方法。
本发明实施例与现有技术相比存在的有益效果是:采用上述方案后,通过将构建成功的内向整流钾电流离子通道模型、起搏电流离子通道模型与心室肌细胞膜上其他离子通道模型重构形成生物起搏通道模型,再将生物起搏通道模型整合到心室单细胞模型中形成生物起搏器模型,再根据电生理特性判断形成的生物起搏器模型是否构建成功,若成功,则能够直接定量地反应进行生物起搏器治疗后,心室肌细胞的动作电位变化情况,从细胞膜离子电流层面上解释生物起搏器疗法能够引起心室肌细胞产生自动节律的原因,并且研究多种离子通道对心室肌细胞起搏能力的影响,加快了生物起搏器进行应用的进程,对生物起搏器应用于临床有着重要的指导性意义。
附图说明
为了更清楚地说明本发明实施例中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其他的附图。
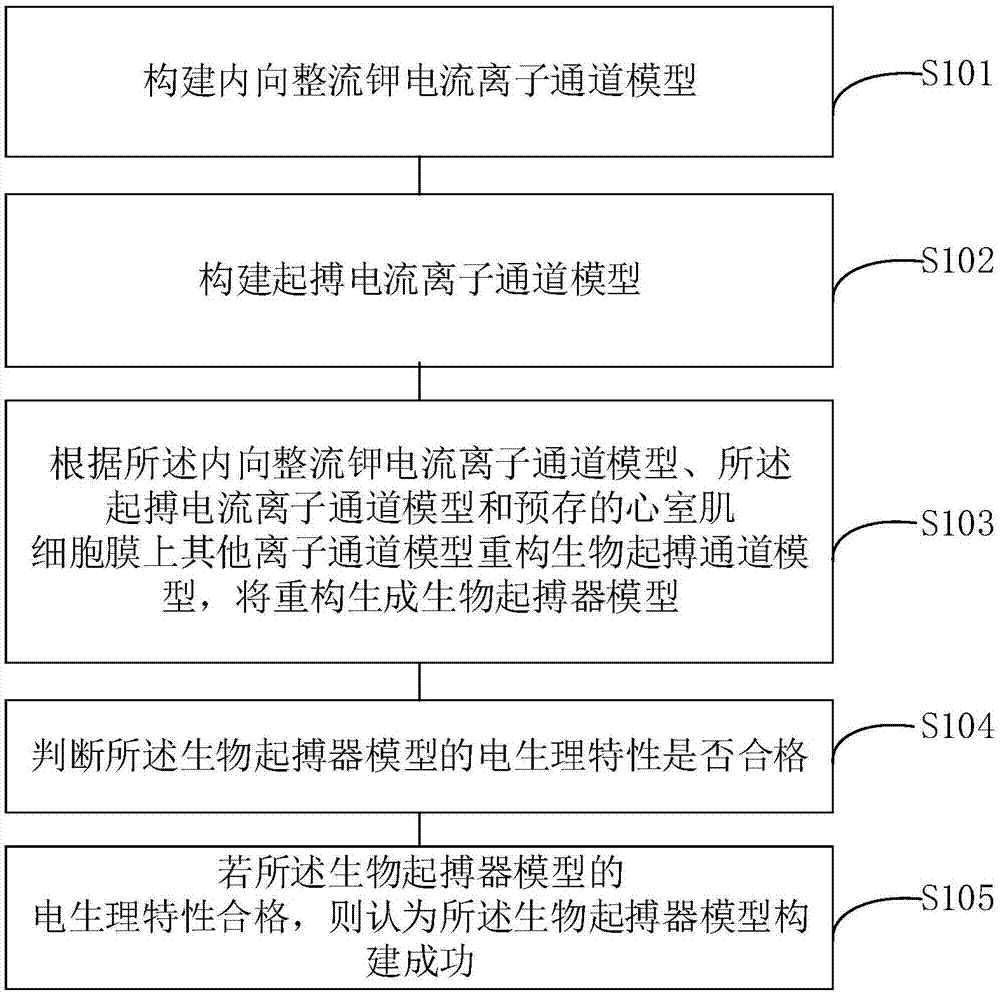
图1是本发明实施例提供的一种生物起搏器模型构建方法的步骤流程图;
图2是本发明另一实施例提供的一种生物起搏器模型构建方法的步骤流程图;
图3是本发明另一实施例提供的一种生物起搏器模型构建装置的结构示意图;
图4是本发明实施例提供的一种生物起搏器模型构建终端设备的示意图;
图5是本发明实施例提供的心室肌细胞重构gk1情况下起搏周期时间的示意图;
图6是本发明实施例提供的心室肌细胞重构gk1情况下起搏周期过程的示意图;
图7是本发明实施例提供的心室肌细胞重构gf情况下起搏周期时间的示意图;
图8是本发明实施例提供的心室肌细胞重构gf情况下起搏周期动作电位时程。
具体实施方式
以下描述中,为了说明而不是为了限定,提出了诸如特定系统结构、技术之类的具体细节,以便透彻理解本发明实施例。然而,本领域的技术人员应当清楚,在没有这些具体细节的其它实施例中也可以实现本发明。在其它情况中,省略对众所周知的系统、装置、电路以及方法的详细说明,以免不必要的细节妨碍本发明的描述。
为了说明本发明所述的技术方案,下面通过具体实施例来进行说明。
如图1所示,为本发明实施例提供的一种生物起搏器模型构建方法的步骤流程图,包括:
步骤s101,构建内向整流钾电流离子通道模型。
具体的,窦房结细胞中内向整流钾电流(inwardrectifiercurrent,ik1)具有弱表达的特性,而ik1电流是促进细胞复极化关键电流,意味着在窦房结细胞中,复极化电流较小,使得细胞的舒张电位处于一个较正的值,与心肌细胞ik1离子通道关联的基因亚型包括kir2.1、kir2.2和kir2.3,实验研究显示,在心室肌细胞中,敲除任一种或几种kir2.x的基因表达,可使兴奋细胞中ik1电流产生不同程度的减小,从而引起细胞动作电位的自动去极化。本方案根据该事实对内向整流钾电流离子通道模型的电导值(gk1)进行修改,优选的,认为gk1初始值为原心室模型的gk1(5.405ns/pf),在0到1倍的范围内调整,模拟在心室细胞中弱表达ik1的效果。
步骤s102,构建起搏电流离子通道模型。
具体的,窦房结细胞中具有高度表达的超极化激活电流起搏电流(funnycurrent,if),if电流是自然起搏电流,它是使细胞的静息电位产生自动去极化的决定性电流,然而在心室细胞中,该离子通道的表达基因不存在或低表达,影响窦房结细胞if电流表达的基因亚型包括hcn1,hcn2与hcn4,实验显示,在心室肌细胞中添加或过度表达hcn基因,可使心室肌细胞表达if电流,从而诱发心室肌细胞的自动起搏行为,本方案基于hcn基因组过度表达产生if电流的事实对该通道的动力学过程进行建模,修改预设的if电流离子通道模型的电导值(gf),优选的,认为gf初始值为窦房结模型的gf(0.027ns/pf),在0到8倍的范围内调整,模拟在心室细胞中表达和过表达if电流的效果。
步骤s103,根据所述内向整流钾电流离子通道模型、所述起搏电流离子通道模型和预存的心室肌细胞膜上其他离子通道模型重构生成生物起搏器模型。
具体的,心室肌细胞膜上有多种类型离子通道,其相应离子流和功能各异,为了诱导心室肌细胞的自动起搏行为,对心室肌细胞模型中的gk1和gf两个重要参数进行调整,以模拟生物实验所示的弱表达ik1电流,过表达if电流引致的心室肌细胞自动起搏行为。特别的,本发明利用计算机模型,设置gk1的比例为α,gf的比例为β,通过对α和β值的调整,量化gk1和gf的比例对起搏稳定性和鲁棒性的影响。
步骤s104,判断所述生物起搏器模型的电生理特性是否合格。
具体的,将重构的生物起搏器模型整合到心室单细胞模型中,优选的,本方案所使用的心室单细胞模型是tentusscher构建的用于描述人类心室细胞生理活动的计算模型,通过分析整合后心室单细胞模型中细胞动作电位的固有指征,如起搏周期时间、动作电位时程,来评价所构建的生物起搏器模型的电生理特性是否合格。
步骤s105,若所述生物起搏器模型的电生理特性合格,则判定所述生物起搏器模型构建成功。
具体的,电生理特性包括动作电位、起搏周期时间、动作电位时程、动作电位舒张间期和动作电位幅值等来定量地评价所构建的生物起搏器模型的电生理特性。优选的,讲过申请人多次测量得出,人类心室细胞的起搏周期时间为800-1000ms,动作电位时程为300-400ms,动作电位舒张间期为500-600ms,动作电位幅值在-80-40mv之间时表明生物起搏器模型的电生理特性合格,若有一项不符合标准,表明生物起搏器模型的电生理特性不合格。为计算动作电位的特性,首先对动作电位的周期进行划分,优选的,将动作电位的最小点作为起点,下一个动作电位的最小点作为终点来划分一个周期的动作电位,同时,电压去极化到一个正的电位才认为其是一个周期。起搏周期时间(cyclelength,cl)计算方法为两个周期的时间差值。动作电位时程(actionpotentialduration,apd)为去极化速率最高的时间与电压复极化到幅值的90%的时间的差值。
实验结果表明,如果只考虑ik1对起搏的影响,当α∈[0,0.08]时,能够在心室肌细胞中诱发自动起搏行为。
如果只考虑if对起搏的影响,当β∈[3.4,8]时,能够在心室肌细胞中诱发自动起搏行为。
此外,如图2所示,在一个具体示例中,所述方法还包括:
步骤s201,将所述生物起搏器模型整合到预存的心室单细胞模型中形成生物起搏器模拟模型。
步骤s202,根据预存的仿真技术获取所述生物起搏器模拟模型中肌浆网漏电流流入细胞质内的第一钙电流和子空间钙泵电流流入细胞质内的第二钙电流。
步骤s203,根据所述第一钙电流和所述第二钙电流判断所述生物起搏器模拟模型中细胞内钙离子浓度在预设时间后是否达到预设稳态。
步骤s204,若所述生物起搏器模拟模型中细胞内钙离子浓度在预设时间后达到预设稳态,则判定所述生物起搏器模型起搏成功。
具体的,通过分析动作电位及细胞内钙瞬变是否呈稳定的周期性变化来评判起搏的稳定性,在if的作用下,心室肌细胞钙瞬变在起搏初期存在静息现象,但是在起搏后期逐渐趋于稳定,展示出良好的起搏能力,其中,肌浆网漏电流流入细胞质内的第一钙电流和子空间钙泵电流流入细胞质内的第二钙电流是流入细胞质内的钙电流,二者的增大共同导致细胞内钙浓度的累积,细胞内钙离子浓度在预设时间后达到了预设的稳态,说明了生物起搏器起搏模型起搏成功,并且具有稳定性。优选的,预设稳态为在一个周期内细胞内钙离子先累积再排出,最终保持细胞内钙离子总量在每个周期的开始和结束达到平衡。
此外,在一个具体示例中,所述方法还包括:
根据表达式
此外,在一个具体示例中,所述方法还包括:
根据表达式if=if,na+if,k;if,na=gf,na*y(vm-ena);if,k=gf,k*y(vm-ek)构建所述起搏电流离子通道模型,其中,if为起搏电流,if,na为if电流对na通透的离子通道电流,if,k为if电流对k通透的离子通道电流,gf,na为if,na的最大电导值,gf,k为if,k的最大电导值,gf,na和gf,k的值相同,统称为gf,ena为钠离子的平衡电位,ek为钾离子的平衡电位,vm为心室细胞跨膜电压,y为起搏电流的激活变量,使得模型与生物起搏器实验测得的离子通道电压电流数据相拟合,并通过改变起搏电流离子通道的电导模拟不同电流强度。
此外,在一个具体示例中,所述方法所述判断所述生物起搏器模型的电生理特性是否合格包括:
根据表达式
iion=ina+ito+ikr+iks+ical+inaca
iion表达式为:+inak+ipca+ipk+ibca+ibna+ix,其中,ina为快速钠电流,ito为瞬时外向电流,ikr为快速延迟整流电流,iks为慢延迟整流电流,ical为l型钙电流,inaca为钠钙交换电流,inak为钠钾泵电流,ipca为钙泵电流,ipk为钾泵电流,ibca为背景钙电流,ibna为背景钠电流,ix为起搏靶向电流,
ix表达式为:
调整模型中α和β的值判断是否在心室肌细胞中诱导自发起搏行为;
若判定诱导了自发起搏行为,则所述生物起搏器模型的电生理特性合格。具体的,如图5、图6、图7和图8所示,为心室肌细胞在重构gk1情况下起搏周期时间和动作电位时程和心室肌细胞重构gf情况下起搏周期时间和动作电位时程,起搏周期时间和动作电位时程的单位均为毫秒(millisecond,ms),gk1和gf的浓度单位为纳秒/皮法(nanosecond/picofarad,ns/pf),生物起搏器模型是基于人类心室肌细胞模型,通过减弱或阻断ik1电流的表达,增加if起搏电流的表达来实现的,在人类心室细胞模型中,gk1为5.405ns/pf;在窦房结细胞模型中,gf为0.027ns/pf。为了研究不同gk1和gf值对生物起搏器起搏能力的影响,设置gk1的比例α为[0,1],gf的比例β为[0,8],本方案以三种方式构建了生物起搏器模型,分别为只有ik1诱导的生物起搏器模型,只有if诱导的生物起搏器模型,以及ik1和if共同诱导的生物起搏器模型,通过调整模型中α和β的值和比例,模拟生物实验在心室肌细胞中诱导的自发起搏行为,如果只考虑ik1对起搏的影响,当α∈[0,0.08]时,能够在心室肌细胞中诱发自动起搏行为。如果只考虑if对起搏的影响,当β∈[3.4,8]时,能够在心室肌细胞中诱发自动起搏行为。在ik1和if共同作用下,当α∈[0,0.2],β∈[0,3]时,能够在心室肌细胞中诱发自动起搏行为。
如图3所示,为本发明实施例提供的一种生物起搏器模型构建装置的结构示意图,包括:
钾电流离子通道模型构建模块301,用于构建内向整流钾电流离子通道模型。
起搏电流离子通道模型构建模块302,用于构建起搏电流离子通道模型。
生物起搏器模型生成模块303,用于根据所述内向整流钾电流离子通道模型、所述起搏电流离子通道模型和预存的心室肌细胞膜上其他离子通道模型重构生成生物起搏器模型。
电生理特性判断模块304,用于判断所述生物起搏器模型的电生理特性是否合格。
电生理特性判定合格模块305,用于若所述生物起搏器模型的电生理特性合格,则判定所述生物起搏器模型构建成功。
此外,在一个具体示例中,所述装置还包括:
生物起搏器模拟模型生成模块,用于将所述生物起搏器模型整合到预存的心室单细胞模型中形成生物起搏器模拟模型。
钙电流获取模块,用于根据预存的仿真技术获取所述生物起搏器模拟模型中肌浆网漏电流流入细胞质内的第一钙电流和子空间钙泵电流流入细胞质内的第二钙电流。
钙离子浓度判断模块,用于根据所述第一钙电流和所述第二钙电流判断所述生物起搏器模拟模型中细胞内钙离子浓度在预设时间后是否达到预设稳态。
模型起搏成功认定模块,用于若所述生物起搏器模拟模型中细胞内钙离子浓度在预设时间后达到预设稳态,则判定所述生物起搏器模型起搏成功。
此外,在一个具体示例中,所述装置还包括:
起搏电流离子通道模型构建子模块,用于根据表达式
此外,在一个具体示例中,所述装置还包括:
起搏电流离子通道模型构建子模块,应用根据表达式if=if,na+if,k;if,na=gf,na*y(vm-ena);if,k=gf,k*y(vm-ek)构建所述起搏电流离子通道模型,其中,if为起搏电流,if,na为if电流对na通透的离子通道电流,if,k为if电流对k通透的离子通道电流,gf,na为if,na的最大电导值,gf,k为if,k的最大电导值,ena为钠离子的平衡电位,ek为钾离子的平衡电位,vm为心室细胞跨膜电压,y为起搏电流的激活变量。
此外,在一个具体示例中,所述电生理特性判断模块还用于:
根据表达式
iion=ina+ito+ikr+iks+ical+inaca
iion表达式为:+inak+ipca+ipk+ibca+ibna+ix,其中,ina为快速钠电流,ito为瞬时外向电流,ikr为快速延迟整流电流,iks为慢延迟整流电流,ical为l型钙电流,inaca为钠钙交换电流,inak为钠钾泵电流,ipca为钙泵电流,ipk为钾泵电流,ibca为背景钙电流,ibna为背景钠电流,ix为起搏靶向电流,
ix表达式为:
调整模型中α和β的值判断是否在心室肌细胞中诱导自发起搏行为。
若判定诱导了自发起搏行为,则所述生物起搏器模型的电生理特性合格。
应理解,上述实施例中各步骤的序号的大小并不意味着执行顺序的先后,各过程的执行顺序应以其功能和内在逻辑确定,而不应对本发明实施例的实施过程构成任何限定。
图4是本发明实施例提供的一种生物起搏器模型构建终端设备的示意图,该实施例的生物起搏器模型构建终端设备4包括:处理器40、存储器41以及存储在所述存储器41中并可在所述处理器40上运行的计算机程序42,例如生物起搏器模型构建程序。所述处理器40执行所述计算机程序42时实现上述各个生物起搏器模型构建方法实施例中的步骤,例如图1所示的步骤101至105。或者,所述处理器40执行所述计算机程序42时实现上述各装置实施例中各模块/单元的功能,例如图2所示模块301至305的功能。
示例性的,所述计算机程序42可以被分割成一个或多个模块/单元,所述一个或者多个模块/单元被存储在所述存储器41中,并由所述处理器40执行,以完成本发明。所述一个或多个模块/单元可以是能够完成特定功能的一系列计算机程序指令段,该指令段用于描述所述计算机程序42在所述生物起搏器模型构建终端设备4中的执行过程。例如,所述计算机程序42可以被分割成同步模块、汇总模块、获取模块、返回模块(虚拟装置中的模块),各模块具体功能如下:
构建内向整流钾电流离子通道模型。
构建起搏电流离子通道模型。
根据所述内向整流钾电流离子通道模型、所述起搏电流离子通道模型和预存的心室肌细胞膜上其他离子通道模型重构生成生物起搏器模型。
判断所述生物起搏器模型的电生理特性是否合格。
若所述生物起搏器模型的电生理特性合格,则认为所述生物起搏器模型构建成功。
将所述生物起搏器模型整合到预存的心室单细胞模型中形成生物起搏器模拟模型。
根据预存的仿真技术获取所述生物起搏器模拟模型中肌浆网漏电流流入细胞质内的第一钙电流和子空间钙泵电流流入细胞质内的第二钙电流。根据所述第一钙电流和所述第二钙电流判断所述生物起搏器模拟模型中细胞内钙离子浓度在预设时间后是否达到预设稳态。
若所述生物起搏器模拟模型中细胞内钙离子浓度在预设时间后达到预设稳态,则判定所述生物起搏器模型起搏成功。
根据表达式
根据表达式if=if,na+if,k;if,na=gf,na*y(vm-ena);if,k=gf,k*y(vm-ek)构建所述起搏电流离子通道模型,其中,if为起搏电流,if,na为if电流对na通透的离子通道电流,if,k为if电流对k通透的离子通道电流,gf,na为if,na的最大电导值,gf,k为if,k的最大电导值,ena为钠离子的平衡电位,ek为钾离子的平衡电位,vm为心室细胞跨膜电压,y为起搏电流的激活变量。
根据表达式
iion=ina+ito+ikr+iks+ical+inaca
iion表达式为:+inak+ipca+ipk+ibca+ibna+ix,其中,ina为快速钠电流,ito为瞬时外向电流,ikr为快速延迟整流电流,iks为慢延迟整流电流,ical为l型钙电流,inaca为钠钙交换电流,inak为钠钾泵电流,ipca为钙泵电流,ipk为钾泵电流,ibca为背景钙电流,ibna为背景钠电流,ix为起搏靶向电流。
ix表达式为:
调整模型中α和β的值判断是否在心室肌细胞中诱导自发起搏行为。
若判定诱导了自发起搏行为,则所述生物起搏器模型的电生理特性合格。
所述生物起搏器模型构建终端设备4可以是桌上型计算机、笔记本、掌上电脑及云端服务器等计算设备。所述生物起搏器模型构建终端设备可包括,但不仅限于,处理器40、存储器41。本领域技术人员可以理解,图4仅仅是生物起搏器模型构建终端设备4的示例,并不构成对生物起搏器模型构建终端设备4的限定,可以包括比图示更多或更少的部件,或者组合某些部件,或者不同的部件,例如所述生物起搏器模型构建终端设备还可以包括输入输出设备、网络接入设备、总线等。
所称处理器40可以是中央处理单元(centralprocessingunit,cpu),还可以是其他通用处理器、数字信号处理器(digitalsignalprocessor,dsp)、专用集成电路(applicationspecificintegratedcircuit,asic)、现成可编程门阵列(field-programmablegatearray,fpga)或者其他可编程逻辑器件、分立门或者晶体管逻辑器件、分立硬件组件等。通用处理器可以是微处理器或者该处理器也可以是任何常规的处理器等。
所述存储器41可以是所述生物起搏器模型构建终端设备4的内部存储单元,例如生物起搏器模型构建终端设备4的硬盘或内存。所述存储器41也可以是所述生物起搏器模型构建终端设备4的外部存储设备,例如所述生物起搏器模型构建终端设备4上配备的插接式硬盘,智能存储卡(smartmediacard,smc),安全数字(securedigital,sd)卡,闪存卡(flashcard)等。进一步地,所述存储器41还可以既包括所述生物起搏器模型构建终端设备4的内部存储单元也包括外部存储设备。所述存储器41用于存储所述计算机程序以及所述生物起搏器模型构建终端设备所需的其他程序和数据。所述存储器41还可以用于暂时地存储已经输出或者将要输出的数据。
所属领域的技术人员可以清楚地了解到,为了描述的方便和简洁,仅以上述各功能单元、模块的划分进行举例说明,实际应用中,可以根据需要而将上述功能分配由不同的功能单元、模块完成,即将所述装置的内部结构划分成不同的功能单元或模块,以完成以上描述的全部或者部分功能。实施例中的各功能单元、模块可以集成在一个处理单元中,也可以是各个单元单独物理存在,也可以两个或两个以上单元集成在一个单元中,上述集成的单元既可以采用硬件的形式实现,也可以采用软件功能单元的形式实现。另外,各功能单元、模块的具体名称也只是为了便于相互区分,并不用于限制本申请的保护范围。上述系统中单元、模块的具体工作过程,可以参考前述方法实施例中的对应过程,在此不再赘述。
在上述实施例中,对各个实施例的描述都各有侧重,某个实施例中没有详述或记载的部分,可以参见其它实施例的相关描述。
本领域普通技术人员可以意识到,结合本文中所公开的实施例描述的各示例的单元及算法步骤,能够以电子硬件、或者计算机软件和电子硬件的结合来实现。这些功能究竟以硬件还是软件方式来执行,取决于技术方案的特定应用和设计约束条件。专业技术人员可以对每个特定的应用来使用不同方法来实现所描述的功能,但是这种实现不应认为超出本发明的范围。
在本发明所提供的实施例中,应该理解到,所揭露的装置/终端设备和方法,可以通过其它的方式实现。例如,以上所描述的装置/终端设备实施例仅仅是示意性的,例如,所述模块或单元的划分,仅仅为一种逻辑功能划分,实际实现时可以有另外的划分方式,例如多个单元或组件可以结合或者可以集成到另一个系统,或一些特征可以忽略,或不执行。另一点,所显示或讨论的相互之间的耦合或直接耦合或通讯连接可以是通过一些接口,装置或单元的间接耦合或通讯连接,可以是电性,机械或其它的形式。
所述作为分离部件说明的单元可以是或者也可以不是物理上分开的,作为单元显示的部件可以是或者也可以不是物理单元,即可以位于一个地方,或者也可以分布到多个网络单元上。可以根据实际的需要选择其中的部分或者全部单元来实现本实施例方案的目的。
另外,在本发明各个实施例中的各功能单元可以集成在一个处理单元中,也可以是各个单元单独物理存在,也可以两个或两个以上单元集成在一个单元中。上述集成的单元既可以采用硬件的形式实现,也可以采用软件功能单元的形式实现。
所述集成的模块/单元如果以软件功能单元的形式实现并作为独立的产品销售或使用时,可以存储在一个计算机可读取存储介质中。基于这样的理解,本发明实现上述实施例方法中的全部或部分流程,也可以通过计算机程序来指令相关的硬件来完成,所述的计算机程序可存储于一计算机可读存储介质中,该计算机程序在被处理器执行时,可实现上述各个方法实施例的步骤。其中,所述计算机程序包括计算机程序代码,所述计算机程序代码可以为源代码形式、对象代码形式、可执行文件或某些中间形式等。所述计算机可读介质可以包括:能够携带所述计算机程序代码的任何实体或装置、记录介质、u盘、移动硬盘、磁碟、光盘、计算机存储器、只读存储器(rom,read-onlymemory)、随机存取存储器(ram,randomaccessmemory)、电载波信号、电信信号以及软件分发介质等。需要说明的是,所述计算机可读介质包含的内容可以根据司法管辖区内立法和专利实践的要求进行适当的增减,例如在某些司法管辖区,根据立法和专利实践,计算机可读介质不包括是电载波信号和电信信号。
以上所述实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的精神和范围,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!