一种核桃多酚的制备工艺及其神经保护用途的制作方法
背景技术:
据统计,目前全球痴呆患者大约为3.65亿,每年新增0.77亿。在我国,早老性痴呆即阿尔茨海默病(alzheimer’sdisease,ad)在65岁以上人群中的患病率约为3%~5%,且每年以8%的速率增长。ad已成为老年人致残致死最严重的疾病之一,ad的高发严重影响了老年人的生活质量,并且给家庭和社会带来巨大的心理和经济负担。因此研制安全有效的抗脑老化及ad的营养补充剂具有重要的现实意义。
大脑衰老及相关神经退行性疾病病理机制复杂,至今不明,其中氧化应激和β淀粉样蛋白(amyloidbeta,aβ)沉积是公认的脑衰老和ad发生发展的重要病因。因此,能够降低神经系统氧化应激损伤或aβ损伤被认为是防治脑老化及相关神经退行性疾病的重要策略。
核桃自古以来就被认为是健脑益智的佳品,在美洲、欧洲被称为“益智果”,在我国有“长寿果”的美誉。现代医学与营养学研究证实,核桃具有益智(促进学习记忆)的功效,经常食用核桃可降低神经退行性疾病的患病风险,并可延缓衰老相关的认知功能障碍。大量研究表明核桃多酚是核桃益智及防治脑老化的重要功效组分,核桃多酚约占核桃总重的5%左右,种类多达120种,以鞣花酸,鞣酸单宁及黄酮类成分为主。然而目前的研究只限于对核桃多酚粗提物的功效研究,以活性为导向的制备工艺及其有效成分的分析研究未见报道,限制了核桃多酚相关药物和保健品等产品的开发。
技术实现要素:
针对上述未解决问题,本发明的目的在于提供一种核桃多酚的提取方法及其神经保护用途,用于缓解衰老相关的氧化应激和aβ沉积性神经损伤。该提取方法是以抗氧化和神经保护活性评价为导向建立的,并分析该提取方法得到的核桃多酚的组成,为核桃多酚相关功能产品的开发提供科学的实验数据,为阐明其神经保护作用的物质基础提供理论依据。
为实现上述目的,同时考虑核桃多酚的药品和食品相关用途,本发明提供了一种核桃多酚的提取方法,该提取方法包括以下步骤:步骤a将去壳的核桃仁粉碎,按料液比1∶3加入石油醚,在室温下持续搅拌浸提6h后,弃滤液,重复三次去除油脂;步骤b将脱脂后的核桃仁粕按料液比1∶5加入75%乙醇溶液,在室温(25℃)下持续搅拌浸提6h,抽滤取滤液,重复三次,将三次得到的提取液合并在45℃下旋蒸浓缩得到核桃粗多酚;步骤c将粗多酚和乙酸乙酯按1∶1混合萃取,第一次萃取12h,后两次萃4h,将三次萃取液合并在45℃下旋蒸得到乙酸乙酯部位浓缩液;步骤d采用极性树脂nka-9对步骤c得到浓缩液进行进一步的纯化和分离。树脂预处理和装柱后用速率为1ml/min将浓度为3mg/ml的核桃多酚极性部位进行上样,用流速为0.5ml/min的50%乙醇进行洗脱,洗脱3次合并洗脱液;步骤e相同方法采用中等极性树脂hp-20对步骤d中得到乙醇洗脱物先进行75%乙醇洗脱,洗脱至少3次,然后采用100%乙醇洗脱3次,收集合并100%乙醇洗脱物于45℃下旋蒸浓缩干燥得核桃多酚。
本发明提供了一种核桃多酚的提取方法,该提取方法是以体外抗氧化活性包括dpph、abts和frap试验和细胞水平神经保护活性包括抗h2o2和aβ诱导的的类神经细胞人神经母细胞瘤(sh-sy5y)细胞损伤为导向的,可以获得具有更高活性的核桃多酚。
本发明还提供了核桃多酚的神经保护用途,采用mtt法分别检测核桃多酚对h2o2和aβ诱导的sh-sy5y细胞损伤具有明显的保护作用(测定细胞活力),并采用dcfh-da法检测核桃多酚显著降低h2o2诱导的细胞内活性氧(reactiveoxygenspecies,ros)水平升高,发挥显著的细胞保护作用,对衰老相关的氧化应激和aβ蛋白沉积性损伤发挥神经保护作用。
本发明还提供了根据上述方法提取得到的核桃多酚,提供了该核桃多酚的组成分析。采用液质联用(lc-ms)分析活性组分主要含有花梗鞣素/木麻黄鞣质异构体、trictinin/isostrictininisomers、tellimagrandiniisomer、木麻黄鞣宁异构体、strictinin/isostrictininisomers、三聚乙酰-葡萄糖、四聚乙酰-葡萄糖、原花青素、valoneicaciddilactone/sanguisorbicaciddilactoneisomer、槲皮素戊糖苷异构体和鞣花酸等11种物质,这些化合物除原花青素外均含有六羟基联苯酰(hhdp)基团。
附图说明
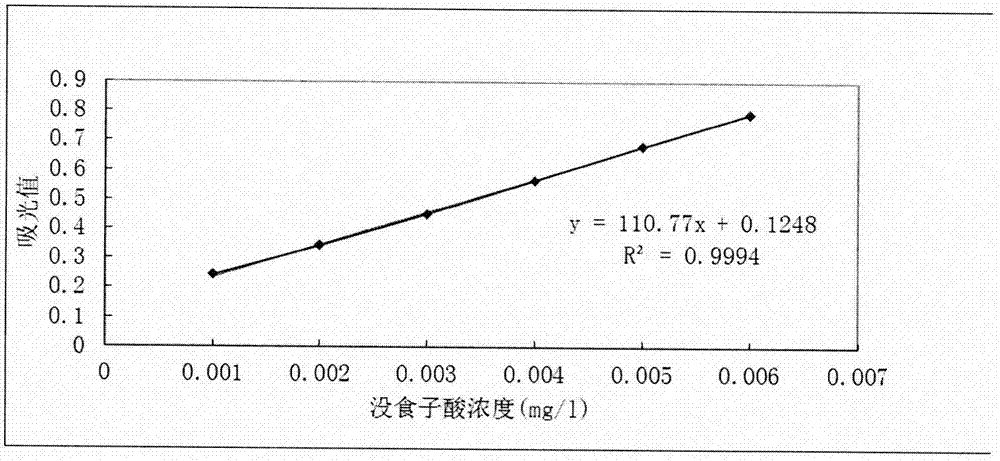
图1没食子酸标准曲线
图2不同浓度的h2o2对sh-sy5y细胞的损伤作用.柱状图代表各组均值±标准差,n=4。**p<0.01,与对照组比较
图3核桃多酚不同极性部位对h2o2损伤细胞的保护作用.柱状图代表各组均值±标准差,n=4。##p<0.01,与对照组比较;**p<0.01,与模型组比较,粗多酚(wcp),乙酸乙酯部位(eaw),正丁醇部位(nw),水层部位(wfw)
图4核桃多酚nka-9树脂纯化部位对h2o2损伤sh-sy5y细胞的保护作用.0eaw,25%eaw,50%eaw和75%eaw分别指核桃多酚乙酸乙酯部位经nka-9树脂纯化0,25%,50%和75%乙醇洗脱物.柱状图代表各组均值±标准差,n=4。##p<0.01,与对照组比较;**p<0.01,与模型组比较.
图5核桃多酚hp-20树脂纯化部位对h2o2损伤sh-sy5y细胞的保护作用.0eaw,25%eaw,50%eaw,75%eaw和100%eaw分别指经hp-20树脂纯化0,25%,50%,75%和100%乙醇洗脱物.柱状图代表各组均值±标准差,n=4。##p<0.01,与对照组比较;*p<0.05、**p<0.01,与模型组比较.
图6核桃多酚多个有效部位对h2o2损伤细胞的保护作用.wcp:粗多酚,eaw:乙酸乙酯部位,eaw1:经nka-9树脂纯化的50%乙醇洗脱物,eaw2:经hp-20树脂纯化100%乙醇洗脱物.柱状图代表各组均值±标准差,n=4。##p<0.01,与对照组比较;**p<0.01,与模型组比较
图7核桃多酚多个有效部位对h2o2损伤模型细胞内ros的影响.wcp:粗多酚,eaw:乙酸乙酯部位,eaw1:经nka-9树脂纯化的50%乙醇洗脱物,eaw2:经hp-20树脂纯化100%乙醇洗脱物.柱状图代表各组均值±标准差,n=4。##p<0.01,与对照组比较;**p<0.01,与模型组比较.
图8不同浓度的aβ对sh-sy5y细胞的损伤作用.柱状图代表各组均值±标准差,n=4.**p<0.01,与对照组比较
图9核桃多酚不同极性部位对aβ损伤细胞的保护作用.柱状图代表各组均值±标准差,n=4。##p<0.01,与对照组比较;**p<0.01,与模型组比较,粗多酚(wcp),乙酸乙酯部位(eaw),正丁醇部位(nw),水层部位(wfw).
图10核桃多酚nka-9树脂纯化部位对aβ损伤sh-sy5y细胞的保护作用.0eaw,25%eaw,50%eaw和75%eaw分别指核桃多酚乙酸乙酯部位经nka-9树脂纯化0,25%,50%和75%乙醇洗脱物.柱状图代表各组均值±标准差,n=4。##p<0.01,与对照组比较;**p<0.01,与模型组比较,乙酸乙酯部位(eaw)
图11核桃多酚hp-20树脂纯化部位对aβ损伤sh-sy5y细胞的保护作用.0eaw,25%eaw,50%eaw,75%eaw和100%eaw分别指经hp-20树脂纯化0,25%,50%,75%和100%乙醇洗脱物.柱状图代表各组均值±标准差,n=4。##p<0.01,与对照组比较;**p<0.01,与模型组比较,乙酸乙酯部位(eaw).
图12核桃多酚活性组分的总离子流图.
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合附图及实施例,对本发明进行进一步详细说明。本领域的技术人员应当理解的是,在不偏离本发明的精神和范围下可以对本发明技术方案的细节和形式进行修改或替换,但这些修改和替换均在本发明的保护范围。
具体实施中用到的实验设备真空冷冻干燥机(德国christ公司),紫外可见分光光度计(上海舜宇恒平科学仪器有限公司),循环水式多用真空泵(郑州长城科工贸有限公司),re-3000旋转蒸发器(上海亚荣生化仪器厂),酶标仪(瑞士tecan公司),bj-150型高速多功能粉碎机(拜杰公司),1290infinityii高效液相色谱仪(美国agilenttechnologies公司),6530accurate-massq-tof质谱仪(美国agilenttechnologies公司)。
实验例1
核桃多酚的制备
本发明提供了一种核桃多酚的提取方法,该提取方法确定过程中得到了包括本发明目标多酚在内的多个样品,作为活性评价样品,总的提取方法包括以下步骤:步骤a将去壳的核桃仁粉碎,按料液比1∶3加入石油醚,在室温下持续搅拌浸提6h后,抽滤取滤液,重复三次去除油脂;步骤b将脱脂后的核桃仁粕按料液比1∶5加入75%乙醇溶液,在室温(25℃)下持续搅拌浸提6h,抽滤取滤液,重复三次,将三次得到的提取液合并在45℃旋蒸浓缩得到核桃粗多酚;步骤c将粗多酚和乙酸乙酯按1∶1混合萃取,第一次萃取12h,后两次萃取4h,将三次萃取液合并在45℃旋蒸得到乙酸乙酯部位浓缩液;萃余液按料液比1∶1加入正丁醇,第一次静置萃取12h,后两次静置萃取4h,将三次萃取的溶液在65℃下旋蒸得到正丁醇部位浓缩液。萃余液在55℃下旋蒸得到水层部位浓缩液,经浓缩后的各萃取部位再经冷冻干燥,得到核桃粗多酚、乙酸乙酯、正丁醇、水层部位样品。步骤d采用极性树脂nka-9,结合活性评价结果,对步骤c得到的目标浓缩液进行进一步的纯化和分离。树脂预处理和装柱后用速率为1ml/min将浓度为3mg/ml的核桃多酚极性部位进行上样,用流速为0.5ml/min的0、25%、50%、75%、100%乙醇进行梯度洗脱,每个梯度洗脱3次,经浓缩后的各洗脱部位再经冷冻干燥得到各洗脱部位样品;步骤e应用相同方法采用中等极性树脂hp-20,结合活性评价结果对步骤d得到的目标洗脱部位进行0、25%、50%、75%、100%乙醇梯度洗脱,结合活性评价结果获得目标多酚于45℃下旋蒸浓缩干燥得核桃多酚。
实验例2
核桃多酚多酚含量测定
在本发明提供的一种具有神经保护作用的核桃多酚提取方法确立过程中,首先建立多酚含量测定的标准曲线,精确称取5mg没食子酸标准品,用去离子水溶解并定容至50ml,即得质量浓度为0.1mg/ml的没食子酸标准液。分别量取0、0.250ml、0.500ml、0.750ml、1.000ml、1.250ml、1.500ml质量浓度为0.1mg/ml没食子酸标准液于试管中,加入5ml超纯水和2.5ml10%福林酚试剂,漩涡震荡,混匀静置3min后加入12%(w/v)na2co3溶液1ml,用去离子水定容至25ml,室温下反应1h后,在765nm波长下测定吸光度值。核桃多酚样品稀释至一定浓度后取1ml按照上述方法进行总多酚的测定。标准曲线见图1,经过本发明提供的一种具有神经保护作用的核桃多酚的提取方法得到的核桃多酚的多酚含量>50%
实验例3
核桃多酚抗氧化活性评价
在本发明提供的一种具有神经保护作用的核桃多酚提取方法确立过程中,应用体外抗氧化活性试验评价不同样品的抗氧化活性,抗氧化试验包括dpph、abts自由基清除试验和fe3+还原力(frap)试验。
dpph自由基清除试验:准确吸取100μl的dpph-乙醇溶液(0.25mmol/l)与100μl的不同浓度的核桃多酚溶液于96孔板中,混匀后在室温条件下避光反应30min,用酶标仪测定波长517nm处的吸光度。以trolox为标准品,测定不同质量浓度的trolox对dpph自由基的清除率,绘制标准曲线。样品对dpph自由基清除能力以trolox当量表示,按下式计算dpph清除率:
其中:a0为反应体系中不含样品,即空白吸光度值;a1为反应体系中含有样品的吸光度值;a2为反应体系中含有样品,但以乙醇代替dpph的吸光度值。
abts自由基清除试验:将5mlabts溶液(7mmol/l)和88μl过硫酸钾溶液(140mmol/l)混合,在室温、避光条件下存放12-16h,制成abts工作母液,使用前用无水乙醇稀释至734nm波长处吸光度为0.7±0.02。量取10μl的核桃多酚样品溶液与200μl的abts工作液于96孔板中,轻轻混匀,反应6min后,用酶标仪于734nm处测定其吸光度值。以trolox为标准品,测定不同质量浓度的trolox对abts自由基的清除率,绘制标准曲线。样品对abts自由基清除能力以结果以mgtrolox/g当量表示,抑制率计算同dpph试验,其中:a0为反应体系中不含样品,即以10%dmso代替样品的吸光度值;a1为反应体系中含有样品的吸光度值;a2为反应体系中含有样品,但以乙醇代替abts的吸光度值。
frap试验:标准曲线绘制:取0.1、0.2、0.4、0.6、0.8、1.0mmol/l的feso4标准液各0.1ml,分别加入3mlfrap工作液,37℃水浴条件下反应10min,分光光度计下于593nm处测定吸光度,绘制标准曲线。样品的测定:准确量0.1ml不同浓度的核桃多酚样品溶液与3mlfrap工作液混匀,37℃水浴下反应10min,用分光光度计于593nm处测定吸光度,并选择在feso4标准曲线内的数值带入测定抗氧化能力。以trolox为标准品,样品的frap值以mmoltrolox/g当量表示。
在本发明提供的一种具有神经保护作用的核桃多酚提取方法确立过程中,不同样品的体外抗氧化活性结果见表1,2,3,4,由表1结果可知提取方法中步骤c得到的乙酸乙酯部位在dpph、abts和frap试验中均显示较强的抗氧化活性,作用优于正丁醇和水部位(p<0.05),因此在提取方法的步骤d中对步骤c中的得到的乙酸乙酯萃取部位进行进一步的纯化分离。由表2结果可知,提取方法步骤d中经nka-9树脂纯化部位(100%乙醇洗脱部位收率极低,未得到样品),25%和50%乙醇洗脱部位的抗氧化活性较好,优于其他洗脱部位(p<0.05),合并它们,在提取方法步骤e中对此合并部分采用hp-20树脂进一步纯化分离。由表3结果可知100%乙醇洗脱部位抗氧化活性优于其他洗脱部位(p<0.05)。表4结果为多个核桃多酚有效部位的抗氧化活性测定结果,结果进一步证实经hp-20树脂纯化的100%乙醇洗脱部位抗氧化活性最好,可能为目标多酚。
本发明实施中数据结果以均值±标准差表示,数据应用软件graphpadprism5.0版本分析,自由基清除试验采用非线性回归(nonlinearregression)方程计算ic50值。多组间采用单因素方差分析(one-wayanalysisofvariance,one-wayanova)dunnett′st-test检验进行分析,当p<0.05认为组间存在显著性差异。
表1核桃多酚不同极性部位的体外抗氧化结果
注:每个值表示为平均值(三个平行)±标准差(sd),乙酸乙酯部位(eaw);正丁醇部位(nw);水层部位(wfw);粗多酚(wcp),同列中不同字母表示两组间差异达显著性水平(p<0.05),1表示为每g核桃多酚样品相当于~mmoltrolox当量。
表2核桃多酚nka-9树脂纯化部位的体外抗氧化活性
注:每个值表示为平均值(三个平行)±标准差(sd),同列中不同字母表示两组间差异达显著性水平(p<0.05),1表示为每g核桃多酚干粉样品的mmoltrolox当量。
表3核桃多酚hp-20树脂纯化部位的体外抗氧化活性
注:每个值表示为平均值(三个平行)±标准差(sd),同列中不同字母表示两组间差异达显著性水平(p<0.05),1表示为每g核桃多酚干粉样品的mmoltrolox当量。
表4核桃多酚多个有效部位的体外抗氧化活性
注:每个值表示为平均值(三个平行)±标准差(sd),同列中不同字母表示两组间差异达显著性水平(p<0.05),1表示为每g核桃多酚干粉样品的mmoltrolox当量。
实验例4核桃多酚细胞保护作用评价
一、核桃多酚对h2o2诱导sh-sy5y细胞损伤的保护作用研究
在本发明提供一种具有神经保护作用的核桃多酚的提取方法确立过程中,采用h2o2诱导sh-sy5y细胞损伤和aβ诱导的sh-sy5y细胞损伤模型评价不同模型的神经保护作用,并采用dcfh-da法检测核桃多酚对h2o2诱导的细胞内ros水平的影响,探讨细胞保护机制。
h2o2损伤模型的建立:取对数期的sh-sy5y细胞,制成单细胞悬液,细胞计数,按照1×104个/ml的密度接种于96孔板中,向96孔板的各孔滴加100μl细胞悬液,孵育过夜并观察,当细胞面积占孔的80%左右时进行实验。用无血清培养基配置100、200、400、600、800μmol/l的h2o2,每个浓度为一组,每组设置6个复孔,分组滴加至细胞孔,孵育6h。按mtt试剂盒的说明操作。方法大致如下:向细胞孔中滴加20μlmtt显色剂,孵育4h后得到紫色结晶。吸净上清液后,滴加100μldmso,震荡10min使结晶充分溶解。在波长为565nm的酶标仪下检测每孔的光密度(od)值。按下列公式计算细胞存活率:
核桃多酚对h2o2损伤模型的保护作用:取对数期的sh-sy5y细胞,制成单细胞悬液,细胞计数,按照1×104个/ml的密度接种于96孔板中,向96孔板的各孔滴加100μl细胞悬液,孵育过夜并观察,当细胞面积占孔的80%左右时进行实验。用无血清培养基配置核桃多酚提取液,混匀后通过滤器除菌,向各细胞孔加入100μl核桃提取液,每组六个复孔,孵育12h。在损伤组和核桃多酚保护组加入100μl的浓度为200μmol/l的h2o2,孵育6h。mtt法及细胞存活率计算同上。
核桃多酚对h2o2损伤细胞内ros的影响:采用dcfh-da方法检测细胞内ros表达水平。取对数期的sh-sy5y细胞,制成单细胞悬液,细胞计数,按照1×104个/ml的密度接种于96孔板中,向96孔板的各孔滴加100μl细胞悬液,孵育过夜并观察,当细胞面积占孔的80%左右时进行实验。用无血清培养基配置核桃多酚提取液,混匀通过滤器除菌,向各细胞孔加入100μl核桃提取液,孵育12h。吸取10μl的dcfh-da加入到10ml的pbs中进行稀释至浓度为10μm,吸出核桃多酚提取液后加100μl的dcfh-da稀释液,孵育40min。用无血清细胞培养液洗涤细胞三次,以充分去除未进入细胞内的dcfh-da。加入200μm的h2o2100μl,孵育6h。在荧光酶标仪上,于激发波长500,发射波长530,测定孔荧光强度(fluorescenceintensity,f)
其中:f处理组为处理组细胞孔的吸光度;f空白组为空白对照组的吸光度
由图2结果可知h2o2可浓度依赖性的(100μm、200μm、400μm、600μm、800μm)对sh-sy5y产生损伤作用。根据文献报道细胞损伤的存活率在40~60%时是开展实验的最佳条件,在本实验中200μmol/l的h2o2损伤6h后sh-sy5y细胞存活率在49%左右(p<0.01),因此选用这个损伤条件建立氧化应激模型。由图2结果可知,多个核桃多酚极性部位均具有抗h2o2损伤的保护作用,其中相同剂量下乙酸乙酯部位细胞保护作用更显著(p<0.05),此结果与体外抗氧化结果相一致。由图3结果可知,经nka-9树脂纯化后在75μg/ml浓度下50%乙醇洗脱部位细胞保护作用最强,优于其他洗脱部位(p<0.05)。由图4可知在较低剂量50μg/ml浓度下hp-20树脂纯化部位中100%乙醇洗脱部位细胞保护作用优于其他部位(p<0.05)。图5结果为核桃多酚多个有效部位对h2o2损伤细胞的保护作用,结果显示核桃多酚经过分离纯化,细胞保护作用明显增强,本发明提供的一种具有神经保护作用的核桃多酚提取方法得到的核桃多酚活性优于其他样品(p<0.05)。图6为核桃多酚多个有效部位对h2o2损伤细胞内ros水平的影响,由结果可知,本发明提供的一种具有神经保护作用的核桃多酚提取方法得到的核桃多酚对ros的抑制作用最强(p<0.05),与体外抗氧化和细胞保护作用结果相一致。
二、核桃多酚对aβ诱导sh-sy5y细胞损伤的保护作用研究
aβ损伤模型的建立:aβ25-35的配制:将0.36ml的超纯水(经灭菌)加入到1mg的aβ25-35中配制成浓度为2.5mmol/l的aβ25-35溶液,将配好的aβ溶液密封好放置在37℃培养箱中老化7天。取对数期的sh-sy5y细胞,制成单细胞悬液,细胞计数,按照1×104个/ml的密度接种于96孔板中,向96孔板的各孔滴加100μl细胞悬液,孵育过夜并观察,当细胞面积占孔的80%左右时进行实验。配置10、20、40、80μmol/l的aβ溶液,每个浓度为一组,每组设置6个复孔,分组滴加至细胞孔,孵育24h。mtt法及细胞存活率计算同h2o2损伤模型。
核桃多酚对模型的保护作用:取对数期的sh-sy5y细胞,制成单细胞悬液,细胞计数,按照1×104个/ml的密度接种于96孔板中,向96孔板的各孔滴加100μl细胞悬液,孵育过夜并观察,当细胞面积占孔的80%左右时进行实验。用无血清培养基配置25、50、75、100μg/ml的核桃提取液,混匀通过滤器除菌,向各细胞孔加入100μl核桃提取液,每组6个复孔,孵育12h。在损伤组和核桃多酚保护组加入100μl的浓度为20μmol/l的aβ溶液,孵育24h后检测。mtt法及细胞存活率计算同h2o2损伤模型。
由图7结果可知aβ(10μm、20μm、40μm、80μm、)可浓度依赖性的诱导sh-sy5y细胞损伤,其中aβ的浓度为20μmol/l时,sh-sy5y细胞的相对细胞活力降至正常培养组的51.9%,为本实施中采用的损伤条件。由图8可知,核桃多酚不同极性部位均具有对aβ诱导的sh-sy5y细胞损伤的保护作用,其中在相同剂量时,乙酸乙酯部位保护作用优于其他极性部位样品(p<0.05)。由图9结果可知,经nka-9树脂纯化后在75μg/ml浓度下50%乙醇洗脱部位细胞保护作用最强,优于其他洗脱部位(p<0.05)。由图4可知在较低剂量50μg/ml浓度下hp-20树脂纯化部位中100%乙醇洗脱部位细胞保护作用优于其他部位(p<0.05)。此结果与体外抗氧化活性和h2o2诱导的细胞损伤保护作用结果相一致,进一步证实本发明提供的一种具有神经保护作用核桃多酚提取方法得到核桃多酚具有较好的神经保护作用,具有抗衰老相关的氧化应激和aβ蛋白沉积的神经损伤作用。
实验例5核桃多酚组分分析
核桃多酚活性组分鉴定:样品制备,取核桃多酚hp-20树脂纯化100%乙醇洗脱部位冻干后的粉末用高纯水溶解,配成5mg/ml,过0.22μm的滤膜,待液相色谱分析。
超高效液相色谱条件:色谱柱:agilentinfinitylabporoshell120ec-c18(4.6×100mm,2.7μm粒度);流动相:a:0.1%甲酸高纯水,b:甲醇;柱温:20℃;流速:0.2μl/min;进样体积:5μl;检测波长:280nm。
表5流动相洗脱表
注:a:0.1%甲酸高纯水,b:甲醇
质谱条件:
一级质谱条件:将agilent1290超高效液相色谱仪中色谱柱流出液,用t-型分流器(分流比1∶3)引入g6530amsq-tof质谱检测器。电喷雾离子源:ms电喷雾离子化负离子模式;扫描范围100~1500u;扫描速率1.00ml/min;干燥气(n2)流速8.0l/min;干燥气温度360℃;喷雾气压力35psi;毛细管电压3000v;碎裂器电压100v。
二级质谱条件:质量扫描范围100~1500u;碰撞能量根据一级质谱所得化合物相对分子质量设定10~30ev。
通过一级质谱信息、二级质谱信息和美国国家标准与技术局数据库(nist)及其与文献报道比较进行分析,结果见表6,结果显示核桃多酚活性组分中主要存在花梗鞣素/木麻黄鞣质异构体、trictinin/isostrictininisomers、特里马素异构体、木麻黄鞣宁异构体、strictinin/isostrictininisomers、三聚乙酰-葡萄糖、四聚乙酰-葡萄糖、原花青素和valoneicaciddilactone/sanguisorbicaciddilactoneisomer、槲皮素戊糖苷异构体和鞣花酸等11种物质,这些化合物除原花青素外均含有hhdp基团。这些结果初步阐明了本发明提供的提取方法得到的核桃多酚组成,其神经保护作用的有效成分,将为核桃多酚功能产品的开发及类似结构化合物功能研究提供科学的实验依据。
表6核桃多酚活性组分中鉴定的多酚化合物的质谱数据
- 还没有人留言评论。精彩留言会获得点赞!