阿伐麦布在制备预防或治疗胶质母细胞瘤药物中的应用的制作方法
本发明涉及一种抗肿瘤药物,具体涉及阿伐麦布及其在制备预防或治疗胶质母细胞瘤的药物中的应用。
背景技术:
神经胶质瘤(glioma)是最常见的原发性颅内肿瘤,约占颅内肿瘤的81%。其中,恶性胶质瘤(glioblastoma,gbm)是最常见的胶质瘤(约占所有胶质瘤的45%),具有病程短和死亡率高的特点。尽管恶性胶质瘤的发病率(4.67-5.73/100,000)不及大多数其它系统的肿瘤,但是它生长迅速并且可以侵袭瘤周重要的生命调控中枢。替莫唑胺(tmz)是恶性胶质瘤最有效的化疗药物,tmz同步放疗联合辅助化疗是恶性胶质瘤治疗的标准治疗方案,但是仅能将2年生存率由10.4%提高到26.5%,中位生存期不超过15个月,且会产生耐药性。因此,寻求新药、新靶点和新机制对gbm的治疗极为重要。
本发明从tcga数据库中下载神经胶质瘤(包括5个正常脑组织样本,169个神经胶质瘤的脑组织样本),生物信息学分析后将差异基因上传到cmap数据库中,寻找能够逆转差异基因变化的小分子。阿伐麦布(avasimibe)是虚拟筛选中排名较高、且细胞实验验证中效果较好的小分子。阿伐麦布即n-(2,6-二异丙基苯氧基)磺酰-2-(2,4,6-三异丙基苯基)乙酰胺,是胆固醇酯化酶acat的小分子抑制剂,可以清除血管斑块,用于治疗动脉粥样硬化。阿伐麦布已在一些临床试验中进行测试用来治疗动脉粥样硬化,具有很好的人类安全记录。已有研究表明,阿伐麦布能够用于肿瘤免疫治疗,通过促进t细胞信号传导和杀伤起到抗肿瘤效应。
到目前为止,关于阿伐麦布通过线粒体通路诱导胶质母细胞瘤的凋亡并且通过p53依赖的途径非特异性阻滞细胞周期来发挥抗肿瘤作用还未见报道。
技术实现要素:
本发明解决的技术问题是提供一种阿伐麦布在制备预防或治疗胶质母细胞瘤药物中的应用。
为解决本发明的技术问题,本发明提供如下技术方案:
本发明的技术方案一方面是提供了一种式i所示的阿伐麦布在制备预防或治疗胶质母细胞瘤的药物中的应用。进一步的,所述的阿伐麦布通过线粒体通路诱导细胞凋亡来实现抗肿瘤作用。所述的阿伐麦布通过非特异性阻滞细胞周期从而诱导细胞凋亡。所述的阿伐麦布通过p53依赖的途径诱导细胞周期阻滞在g0/g1期和g2/m期。
阿伐麦布(n-(2,6-二异丙基苯氧基)磺酰-2-(2,4,6-三异丙基苯基)乙酰胺)的结构式如ⅰ所示。
本发明所述的治疗胶质母细胞瘤的药物,优选的情况下,所述阿伐麦布的有效浓度为3~30μm;更优选的情况下,则为7~25μm。
本发明所述的治疗胶质母细胞瘤的药物,优选的情况下,所述阿伐麦布的稀释溶剂为二甲基亚砜。
本发明的技术方案另一方面提供了含有阿伐麦布的药物组合物在制备预防或治疗胶质母细胞瘤的药物中的应用,所述的药物组合物含有有效剂量的阿伐麦布及药学上可接受的载体或赋形剂。进一步的,所述的阿伐麦布通过线粒体通路诱导细胞凋亡来实现抗肿瘤作用。所述的阿伐麦布通过非特异性阻滞细胞周期从而诱导细胞凋亡。所述的阿伐麦布通过p53依赖的途径诱导细胞周期阻滞在g0/g1期和g2/m期。
本发明的治疗胶质母细胞瘤的药物可采用本领域常规的方法制成适于胃肠道给药或非胃肠道给药的制剂,优选将该药物组合物制成胃肠道给药的制剂,其制剂形式可以为常规片剂、胶囊、控释或缓释制剂。
根据制剂形式和制剂规格的不同,本发明药物组合物在制剂中的含量可在1-99wt%之间进行调整,优选10-90wt%。此外,本发明药物的给药剂量可根据给药对象、给药途径或药物的制剂形式进行适当变化,但以保证该药物在哺乳动物体内能够达到有效的血药浓度为前提。
有益技术效果
(1)虽然已有文献报道阿伐麦布在胶质母细胞瘤方面的抗肿瘤活性报道。但关于其具体的抗肿瘤机制并没有报道。本发明提出的阿伐麦布通过线粒体通路诱导胶质母细胞瘤的凋亡并且通过p53依赖的途径非特异性阻滞细胞周期来发挥抗肿瘤作用还未见报道。
(2)胶质母细胞瘤是恶性程度最高(whoiv级)、侵袭性最强的胶质瘤,在原发性恶性中枢神经系统肿瘤中发病率最高。一方面由于其瘤体侵袭生长或位于重要功能区及脑深部的特性,使肿瘤难以全切;另一方面因为血脑屏障的阻挡,目前用于治疗胶质母细胞瘤的药物很少,且疗效并不理想。因此,本申请发现该化合物明显的抗胶质母细胞瘤活性,可以作为治疗胶质母细胞瘤的候选药物。
附图说明
图1是展示不同浓度的阿伐麦布作用u251-mg细胞不同时间后的细胞存活率变化;
图2是展示不同浓度的阿伐麦布作用u251-mg细胞48h后的细胞凋亡变化;
图3是展示不同浓度的阿伐麦布作用u251-mg细胞48h后的细胞线粒体膜电位变化;
图4是展示不同浓度的阿伐麦布作用u251-mg细胞48h后的caspase3/7蛋白活化水平;
图5是展示不同浓度的阿伐麦布作用u251-mg细胞48h后细胞凋亡相关蛋白的变化;
图6是展示不同浓度的阿伐麦布作用u251-mg细胞48h后细胞周期相关蛋白的变化;
图7是展示不同浓度的阿伐麦布作用u87-mg细胞不同时间后的细胞存活率变化;
图8是展示不同浓度的阿伐麦布作用u87-mg细胞48h后的细胞凋亡变化;
图9是展示不同浓度的阿伐麦布作用u87-mg细胞48h后的细胞线粒体膜电位变化;
图10是展示不同浓度的阿伐麦布作用u87-mg细胞48h后的caspase3/7蛋白活化水平;
图11是展示不同浓度的阿伐麦布作用u87-mg细胞48h后细胞凋亡相关蛋白的变化;
图12是展示不同浓度的阿伐麦布作用u87-mg细胞48h后细胞周期相关蛋白的变化;
具体实施方式
下面结合实施例对本发明作进一步的阐述,但本发明并不受限于此,在不脱离本发明的思想和宗旨的情况下,对本发明的技术方案所做的任何变化都应落入本发明权利要求书所限定的范围内。
实施例1~2中所用的生物材料、药品和实验方法如下:
细胞:u87-mg和u251-mg(人胶质母细胞瘤细胞株)、可从商业途径中获得,例如中国科学院上海生命科学研究院细胞资源中心。
药品:准确称量阿伐麦布(北京药渡经纬科技有限公司),以二甲基亚砜溶解,配成阿伐麦布浓度为30mmol/l的贮存液,在-20℃下保存,使用时用新鲜的培养基稀释到合适的浓度,实施例1~2中使用的培养基为dmem高糖培养基。
cck8检测细胞增殖:细胞于含10%胎牛血清、100ku/l青霉素、100mg/l链霉素的dmem高糖培养基中,37℃、5%co2的条件下培养。将细胞用胰酶消化后,用血细胞计数板进行计数。按每孔100μl体积接种于96孔细胞培养板(细胞接种量8000-10000个/孔,根据细胞大小和生长速度选择),5%co2、37℃培养箱中培养24小时后加入不同浓度梯度的阿伐麦布,5%co2、37℃培养箱中孵育48小时。弃去培养基,用pbs洗一次,而后每孔加入含有1/10cck8的无血清培养基100μl,5%co2、37℃培养箱中孵育1小时。用酶标仪进行检测,检测波长为450nm。
annexinv-vegf和pi(propidiumiodide,碘化丙啶)双染检测细胞凋亡:以5×105个/孔的细胞数将细胞种于6-cm的平皿中,18-24小时后加入不同浓度的阿伐麦布。药物作用48小时后,胰酶消化后,1000rpm离心5分钟收集细胞。用在冰上预冷的pbs洗两次,加入100μl含有2μlannexinv-vegf的bindingbuffer,轻柔的吹散细胞,放置于冰上孵育10分钟。300目的尼龙网过滤后,加入100μl含有2μlpi的生理盐水避光孵育2-3分钟后,流式细胞仪检测分析。
jc-1单染检测线粒体膜电位的变化:以1.5×104/孔的细胞数将细胞种于96孔板中,24小时后加入不同浓度的阿伐麦布。药物作用48小时后,pbs洗2次,并换上终浓度为10μg/mljc-1培养箱孵育20min。在多功能荧光酶标仪检测荧光值,检测jc-1单体时激发光设置为488nm,发射光设置为530nm;检测jc-1聚合物时,激发光设置为529nm,发射光设置为590nm。
caspase3/7单染检测caspase3/7活性的变化:以5×105/孔的细胞数将细胞种于6-cm的平皿中,24小时后加入不同浓度的阿伐麦布。药物作用48小时后,胰酶消化后,1000rpm离心5分钟收集细胞。用在pbs洗两次,加入caspase3/7工作液,轻柔的吹散细胞,放置于37℃培养箱中避光孵育15分钟。300目的尼龙网过滤后,流式细胞仪检测分析。
westernblot检测蛋白水平变化:不同浓度的阿伐麦布处理细胞48h,胰酶消化后,1500rpm离心5分钟收集细胞,提取蛋白,然后用bca蛋白定量分析试剂盒测定蛋白含量。按照每孔30-50μg的蛋白量进行上样,电泳,转膜。用含5%脱脂奶粉的tbst室温封闭1-2小时。一抗4度孵育过夜,tbst洗三次,每次10分钟。二抗室温孵育1小时,tbst洗4次,每次15分钟。加入ecl发光液,用成像仪进行曝光拍照。
实施例1
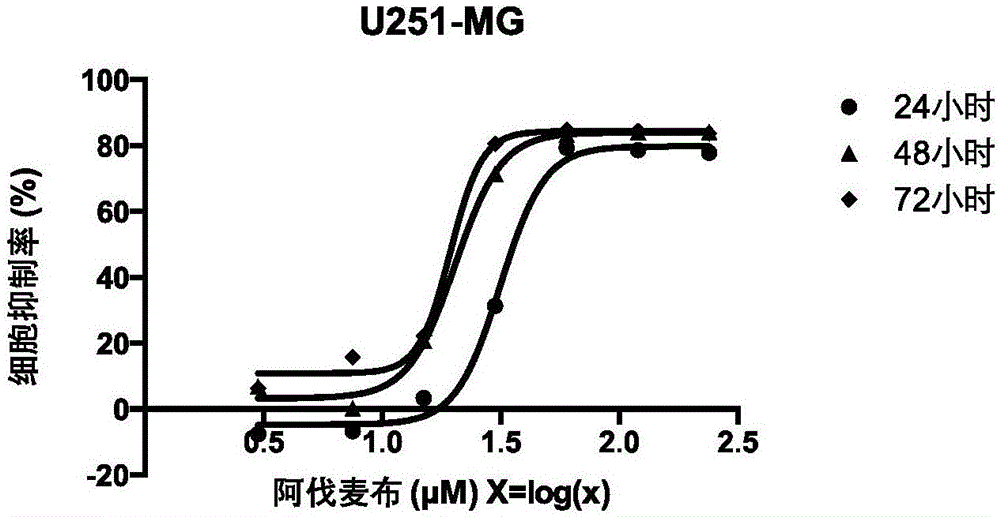
(1)用含10%胎牛血清、100ku/l青霉素、100mg/l链霉素的dmem高糖培养基培养基分别稀释阿伐麦布为表1的浓度,不同浓度的阿伐麦布分别作用u251-mg细胞24、48和72小时后的细胞存活率见图1及表1。
表1阿伐麦布在不同给药剂量下作用u251-mg不同时间的细胞抑制率
由此可见,阿伐麦布以浓度和时间双依赖的形式抑制胶质母细胞瘤u251-mg的增殖,且在作用u251-mg细胞48小时后的半数抑制浓度(ic50)约为20.29μμ。
用含10%胎牛血清、100ku/l青霉素、100mg/l链霉素的dmem高糖培养基培养基分别稀释阿伐麦布为表2的浓度,,不同浓度的阿伐麦布分别作用u251-mg细胞48小时后的细胞凋亡变化见图2及表2。
表2阿伐麦布在不同给药剂量下作用于u251-mg48h的细胞凋亡率
用annexinv-egfp(绿色荧光标记的膜结合蛋白v)和pi(propidiumiodide,碘化丙啶)对药物处理后的细胞进行双染后,流式检测可将细胞分为四个群,分别是左上(q1)、右上(q2)、右下(q3)和左下(q4),其中q2和q4分别代表晚期和早期凋亡,合在一起为总的凋亡率。因此,阿伐麦布以浓度依赖的形式诱导u251-mg细胞的凋亡。
用含10%胎牛血清、100ku/l青霉素、100mg/l链霉素的dmem高糖培养基培养基分别稀释阿伐麦布为7.5,15,30μμ的浓度,不同浓度的阿伐麦布作用u251-mg细胞48小时后的线粒体膜电位的变化见图3。
jc-1在浓度高时成二聚体状态发红光,在浓度低是为单体发绿光。在正常细胞中,带正电荷的jc-1会在带负电荷的线粒体中聚集从而发出强烈的红光。当线粒体膜电位下降时,jc-1无法在线粒体中聚集,从而使得红光减弱。jc-1染色后,在多功能酶标仪分别检测jc-1单体和聚合物的荧光值,并计算单体荧光值/聚合物荧光值的比值。结果表明阿伐麦布以浓度依赖的形式诱导u251-mg细胞的线粒体膜电位的下降。
用含10%胎牛血清、100ku/l青霉素、100mg/l链霉素的dmem高糖培养基培养基分别稀释阿伐麦布为表2的浓度,,不同浓度的阿伐麦布分别作用u251-mg细胞48小时后的细胞caspase3/7蛋白活化水平见图4及表3。
表3阿伐麦布在不同给药剂量下作用于u251-mg48h的细胞caspase3/7蛋白活化
用caspase3/7工作液对药物处理后的细胞进行染色后,流式检测可将细胞分为2个峰,其中右峰代表caspase3/7活化的细胞。因此,阿伐麦布以浓度依赖的形式诱导u251-mg细胞caspase3/7蛋白活化。
分别用7.5,15,30μμ的阿伐麦布作用于u251-mg细胞,48小时后检测细胞凋亡相关蛋白的变化,结果如图5所示。cleaved-parp,cleaved-caspase9和bax的表达量随着阿伐麦布给药浓度的增加而上调,表明阿伐麦布可能是通过上调bax来启动线粒体途径的凋亡。
分别用7.5,15,30μμ的阿伐麦布作用于u251-mg细胞,48小时后检测细胞周期相关蛋白的变化,结果如图6所示。cdk2,cycline1,cdk4和cyclind的表达量随着阿伐麦布给药浓度的增加而下调,表明阿伐麦布将细胞周期阻滞在g0/g1期。cdk1和cyclinb1的表达量随着阿伐麦布给药浓度的增加而下调,表明阿伐麦布将细胞周期阻滞在g2/m期。p53,p21和p27的表达量随着阿伐麦布给药浓度的增加而上调,表明阿伐麦布可能是通过p53依赖的途径阻滞细胞周期。
实施例2
(1)用含10%胎牛血清、100ku/l青霉素、100mg/l链霉素的dmem高糖培养基培养基分别稀释阿伐麦布为表4的浓度,不同浓度的阿伐麦布分别作用u87-mg细胞24、48和72小时后的细胞存活率见图7及表4。
表4阿伐麦布在不同给药剂量下作用u87-mg不同时间的细胞抑制率
由此可见,阿伐麦布以浓度和时间双依赖的形式抑制胶质母细胞瘤u87-mg的增殖,且在作用u87-mg细胞48小时后的半数抑制浓度(ic50)约为28.27μμ。
用含10%胎牛血清、100ku/l青霉素、100mg/l链霉素的dmem高糖培养基培养基分别稀释阿伐麦布为表5的浓度,不同浓度的阿伐麦布分别作用u87-mg细胞48小时后的细胞凋亡率见图8及表5。
表5阿伐麦布在不同给药剂量下作用于u87-mg48h的细胞凋亡率
用annexinv-egfp和pi对药物处理后的细胞进行双染后,流式检测可将细胞分为四个群,分别是左上(q1)、右上(q2)、右下(q3)和左下(q4),其中q2和q4分别代表晚期和早期凋亡,合在一起为总的凋亡率。因此,阿伐麦布以浓度依赖的形式诱导u87-mg细胞的凋亡。
用含10%胎牛血清、100ku/l青霉素、100mg/l链霉素的dmem高糖培养基培养基分别稀释阿伐麦布为7.5,15,30μμ的浓度,不同浓度的阿伐麦布作用u87-mg细胞48小时后的线粒体膜电位的变化见图9。
jc-1在浓度高时成二聚体状态发红光,在浓度低是为单体发绿光。在正常细胞中,带正电荷的jc-1会在带负电荷的线粒体中聚集从而发出强烈的红光。当线粒体膜电位下降时,jc-1无法在线粒体中聚集,从而使得红光减弱。jc-1染色后,在多功能酶标仪分别检测jc-1单体和聚合物的荧光值,并计算单体荧光值/聚合物荧光值的比值。结果表明阿伐麦布以浓度依赖的形式诱导u87-mg细胞的线粒体膜电位的下降。
用含10%胎牛血清、100ku/l青霉素、100mg/l链霉素的dmem高糖培养基培养基分别稀释阿伐麦布为表6的浓度,,不同浓度的阿伐麦布分别作用u87-mg细胞48小时后的细胞caspase3/7蛋白变化见图10及表6。
表6阿伐麦布在不同给药剂量下作用于u87-mg48h的细胞caspase3/7蛋白变化
用caspase3/7工作液对药物处理后的细胞进行染色后,流式检测可将细胞分为2个峰,其中右峰代表caspase3/7活化的细胞。因此,阿伐麦布以浓度依赖的形式诱导u87-mg细胞caspase3/7蛋白活化。
分别用7.5,15,30μμ的阿伐麦布作用于u87-mg细胞,48小时后检测细胞凋亡相关蛋白的变化,结果如图11所示。cleaved-caspase9和bax的表达量随着阿伐麦布给药浓度的增加而上调,表明阿伐麦布可能是通过上调bax来启动线粒体途径的凋亡。
分别用7.5,15,30μμ的阿伐麦布作用于u87-mg细胞,48小时后检测细胞周期相关蛋白的变化,结果如图12所示。cdk2,cycline1,cdk4和cyclind的表达量随着阿伐麦布给药浓度的增加而下调,表明阿伐麦布将细胞周期阻滞在g0/g1期。cdk1和cyclinb1的表达量随着阿伐麦布给药浓度的增加而下调,表明阿伐麦布将细胞周期阻滞在g2/m期。p53,p21和p27的表达量随着阿伐麦布给药浓度的增加而上调,表明阿伐麦布可能是通过p53依赖的途径阻滞细胞周期。
- 还没有人留言评论。精彩留言会获得点赞!