风湿祛痛中药组合物在制备抗血管新生药物中的用途的制作方法
本申请涉及一种风湿祛痛中药组合物新制药用途,特别是在制备抗血管新生药物中的制药用途。
背景技术:
血管新生是指在原有毛细血管或其后静脉发展而来的新的血管,在血管新生的过程中,内皮细胞起着至关重要的作用。首先血管扩张使得通透性增加,其内大分子血浆蛋白如纤维蛋白等发生渗出;同时血管平滑肌细胞分离,血管壁稳定性降低,血管基底膜遭到降解。在这种情况下,具有增殖能力的内皮细胞会根据趋化因子的浓度梯度向低血管密度区域迁移。内皮细胞渐渐聚集并形成血管条索,而间质细胞包绕着内皮细胞增殖、分化形成新的周细胞、血管平滑肌细胞,最终构建新的血管和血管网络。总的来说,血管新生分以下三步:一、内皮细胞的迁移;二、内皮细胞迁移到目的地后,粘附到该区域的细胞上;三、增殖后的内皮细胞形成网状的小管样结构。血管生成是一个复杂的过程,是由促血管新生因子的调节,主要包括生长因子和血管内皮生长因子(vegf),以及促炎性细胞因子、蛋白酶等。研究证实,血管异常增生除了与类风湿关节炎的疾病过程密切相关外,还与肿瘤、糖尿病视网膜病变、银屑病、血管新生性眼病和动脉粥样硬化等多种疾病或病理过程有关。
通化金马药业集团股份有限公司生产的风湿祛痛胶囊(国药准字109),由川黄柏、苍术、威灵仙、鸡血藤、蜂房、乌梢蛇、金钱白花蛇、蕲蛇、红花、土鳖虫、没药(炒)、乳香(炒)、独活、全蝎、蜈蚣、地龙、羌活、桂枝、姜黄共十九味药材组成的中药复方药物。具有燥湿祛风、活血化瘀通络止痛的功效,用于痹病寒热错杂证,症见肌肉关节痛,肿胀,关节活动受限,晨僵,局部发热;风湿性关节炎、类风湿性关节炎见上述证候者。风湿祛痛胶囊含有的十九味药材中峰房、乌梢蛇、金钱白花蛇、蕲蛇、土鳖虫、全蝎、蜈蚣、地龙共8味就是虫类药,而虫类药具有活血化瘀、祛风通络的功效。现代研究表明活血通络的虫类中药一般与抑制血管新生的作用有关。前期的研究证明风湿祛痛胶囊具有抗炎、镇痛作用,抑制巨噬细胞活化,降低类风湿关节炎血清中il-1β、il-6、tnf-α含量,改善机体对氧自由基的清除能力及改善血液流变学性质有关,从而有效治疗类风湿关节炎,但是其对肿瘤、银屑病等血管新生性疾病的作用如何尚无清楚。
技术实现要素:
本发明提供了风湿祛痛中药组合物在制备抗血管新生药物中的用途,所述的风湿祛痛中药组合物由黄柏,苍术,威灵仙,鸡血藤,蜂房,乌梢蛇,金钱白花蛇,蕲蛇,红花,土鳖虫,没药(炒),乳香(炒),独活,全蝎,蜈蚣,地龙,羌活,桂枝,姜黄制成。
其中,所述的抗血管新生药物为抑制肿瘤血管新生的药物。通过抑制肿瘤血管形成,可以减缓肿瘤生长的速度,以及降低肿瘤浸润转移的发生率。
其中,所述的抗血管新生药物为抑制银屑病变组织血管新生的药物。微血管生成异常与银屑病的发生、持续存在及复发有密切关系,在银屑病的发病机制中起重要作用。
其中,所述的抗血管新生药物为抑制新生血管性眼病的药物。新生血管性眼病是眼科难治性疾病,也是很多眼病致盲的重要原因,例如糖尿病视网膜病变、年龄相关性黄斑变性、早产儿视网膜病变、视网膜中央或分支静脉阻塞、新生血管性青光眼和眼外伤等。由于vegf家族能明显促进视网膜新生血管生成,故可从不同层次抑制vegf功能,来预防和治疗新生血管相关性疾病。
其中,所述的抗血管新生药物为抑制动脉粥样硬化病变处血管新生的药物。斑块内血管新生是在动脉粥样硬化病变基础上发生的,新生血管又促进粥样硬化病变的发展,在粥样斑块的发生发展中可能是一个核心事件而起着关键性作用。
其中,所述的抗血管新生药物,其剂型为药学可接受的任意剂型,包括但不限于,胶囊剂、散剂、片剂、微囊制剂、注射剂、栓剂、喷雾剂或软膏剂等。
本发明通过风湿祛痛中药组合物在人脐静脉内皮细胞(huvec)管腔形成实验,mtt、transwell迁移和侵袭以及粘附实验,大鼠主动脉环血管新生实验,肿瘤血管生成实验等方面的作用,发现风湿祛痛中药组合物可以明显抑制内皮细胞的增殖、迁移、侵袭、粘附和管腔形成能力,明显抑制大鼠主动脉环血管和种植肿瘤血管的生成,表明风湿祛痛中药组合物可用于抗血管新生药物的制备。
附图说明
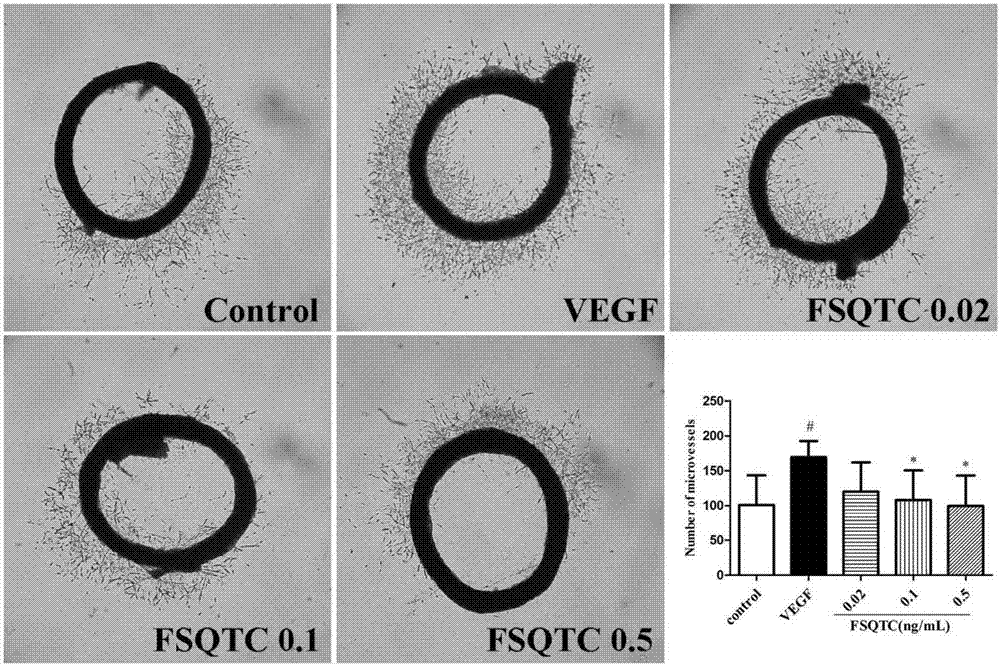
图1所示为风湿祛痛中药组合物对大鼠动脉环新生血管的影响。
图2所示为风湿祛痛中药组合物对huvec增殖活性的影响。
图3所示为风湿祛痛中药组合物对huvectranswell迁移的影响。
图4所示为风湿祛痛中药组合物对huvectranswell侵袭的影响。
图5所示为风湿祛痛中药组合物对huvec粘附的影响。
图6所示为风湿祛痛中药组合物对huvec管腔形成的影响。
具体实施方式
以下实例用于说明本发明,但不用来限制本发明的保护范围。
实施例1风湿祛痛组合物的制备
①原料药:黄柏78.0g,苍术78.3g,威灵仙58.6g,鸡血藤78.0g,蜂房38.8g,乌梢蛇58.0g,金钱白花蛇27.0g,蕲蛇18.7g,红花11.6g,土鳖虫7.5g,没药(炒)18.8g,乳香(炒)18.8g,独活19.6g,全蝎18.7g,蜈蚣11.5g,地龙20.0g,羌活19.6g,桂枝10.0g,姜黄12.0g;
②取苍术、威灵仙加水湿润,润透后,水蒸气,蒸馏6小时,提取挥发油,挥发油液再进行一次精馏,精馏挥发油备用。姜黄、独活、羌活加水湿润,润透后,水蒸气,蒸馏6小时,提取挥发油,挥发油液再进行一次精馏,精馏挥发油备用。
③苍术、威灵仙的药渣与红花加水煎煮三次,加水量依次为10、8、8倍,时间依次为2、1.5、1小时,滤过,合并滤液。
④将姜黄、独活、羌活的药渣,与黄柏、鸡血藤加水煎煮三次,加水量依次为10、8、8倍,时间依次为2、1.5、1小时,滤过,合并滤液。
⑤药渣加入3-15倍量30-90%乙醇提取2-3次,每次1-2小时,滤过,合并滤液,回收乙醇至无醇味,用3-10倍量热水(如40-100℃均可)充分溶解(必要时可以加热至沸腾),趁热过滤,滤液浓缩至稠膏状,备用。
⑥将步骤③和步骤④中的滤液加入步骤②蒸馏后的水溶液,浓缩至相对密度为1.30(60-70℃)的浸膏,备用。
⑦蜂房、乳香(炒)加入3-10倍量热乙醇(30-60℃)浸泡2—3次,每次1-24小时,滤过,合并滤液,回收乙醇至无醇味,浓缩至稠膏状,备用。
⑧金钱白花蛇、蕲蛇、乌梢蛇、土鳖虫、没药(炒)、全蝎、蜈蚣、地龙、桂枝等九味粉碎,过筛,备用。
⑨将步骤⑤、⑥、⑦所得稠膏合并,取步骤⑧生药粉干混30分钟,再加入上述浸膏湿混30分钟,混匀,干燥。
关于风湿祛痛中药组合物的制备方法,可参考cn201410311509.8,该专利公开的内容以参考形式并入本申请。
实施例2风湿祛痛中药组合物对大鼠胸主动脉环血管新生的治疗效果
1、实验动物及材料
sd大鼠,雄性,180-200g,5只,购自中国食品药品检定研究院,许可证:scxk(京)2014-0013。风湿祛痛中药组合物由实施例1制备。
2、大鼠动脉环实验模型的建立及给药
提前高压手术器械一套备用。用基质胶与h-dmem等量混合,包被48孔板,100μl/孔,并于37℃恒温培养箱中孵育30min,使基质胶凝固;颈椎脱臼处死sd大鼠,并于75%乙醇中10min进行消毒;打开大鼠胸腔,剥离大鼠胸主动脉并取出放于含双抗pbs中,用一次性注射器将胸主动脉中的血液冲洗干净,并用冰pbs洗2-3次;用手术刀片将胸主动脉切成1-1.5mm大鼠胸主动脉环;将大鼠胸主动脉环垂直放置于基质胶包被的48孔板中,并加入基质胶与h-dmem1:1等量混合后的液体50μl/孔,并于37℃恒温培养箱中孵育30min,使基质胶凝固;加入含10%fbs,90%h-dmem,1%双抗及各浓度风湿祛痛中药组合物(0.02ng/ml、0.1ng/ml、0.5ng/ml);24h后开始观察,并每隔24h显微镜下观察一次,于大鼠大鼠胸主动脉环开始长出微血管时开始拍照,每3天换液一次(注:在前72h时观察要轻拿轻放,以免动脉环飘起来);选取大鼠胸主动脉环微血管平均生长水平最好的一天用image-proplus分析处理实验图片。
3、实验结果
药物作用6d后,与control组相比,vegf组动脉环周围微血管数目明显增加(p<0.05),说明vegf诱导可显著增加动脉环周围微血管形成能力;风湿祛痛中药组合物在浓度为0.1ng/ml~0.5ng/ml时,动脉环周围微血管数目及长度均显著减少(p<0.05),表明风湿祛痛中药组合物能显著抑制动脉环周围微血管形成能力,见图1。
实验例3风湿祛痛中药组合物对huvec细胞增殖、迁移、粘附、侵袭和管腔形成能力的抑制作用
1、材料
huvec购自上海子实生物科技有限公司,取4-8代用于实验。风湿祛痛中药组合物由实施例1制备。
2、实验方法
2.1细胞冻存
冻存细胞是为了在实验过程中保持细胞代数相近。当融合度达到80%左右,且细胞处于对数生长期时,可进行细胞冻存,具体细胞冻存操作步骤如下:
(1)将培养细胞的培养皿从培养箱中水平取出,放置在显微镜下观察细胞的生长形态和融合度。当细胞处于对数生长期且其融合度达到80%左右时,则是满足冻存要求的细胞,先用4ml/皿pbs洗2-3次,用移液管pbs将吸尽后,加入0.25%胰蛋白酶1ml/皿,细胞约1-2min左右,(在显微镜下观察可发现细胞收缩,形态变圆),此时轻轻吸去胰蛋白酶,此时不要晃动培养瓶,吸完胰蛋白酶后轻轻拍打皿壁,大部分细胞可从贴壁状态变成脱落培养瓶,迅速加入含血清h-dmem培养基终止消化,反复并从各个方向轻柔地吹打贴壁于培养瓶上的细胞,显微镜下观察,尽量使细胞分散成单个细胞。
(2)将皿内细胞悬液用移液管转移至无菌15ml离心管,并1500rpm离心5min,离心后轻轻吸去上清,加入提前配制好的冻存液(fbs:dmso=9:1),并用冻存液重悬细胞,轻柔吹打使细胞分散,使细胞密度控制在1×107/ml左右。
(3)在超净台上取冻存管,每个冻存管分装大约1ml上述混匀细胞混悬液,拧紧盖子,同时用冻存笔在冻存管管壁及管盖上标记上细胞名称、代数、操作者和冻存日期。
(4)用封口膜封冻存管,并让细胞进行梯度冻存,冻存顺序依次为:4℃放置30min,-20℃放置30min,然后移入-80℃放置过夜,最后转移至液氮罐中长期保存。
(5)上述操作均要求无菌。
2.2细胞的复苏
(1)复苏前提前打开恒温水浴锅,并将水浴锅温度调节至37℃。将h-dmem完全培养基放置于水浴锅中复温至37℃,同时于超净台内准备一根管内加入10ml加热的h-dmem培养基15ml无菌离心管。
(2)从液氮或-80℃冰箱中取出所需的冻存好的细胞,并检查冻存管的封闭完好性,立即将冻存管置于37℃恒温水浴中,不断在水浴锅中晃动冻存管,并使其迅速融化,约2min内,彻底融化后用75%酒精涂抹冻存管进行表面消毒后,迅速移取至超净台内将其转移至预先装有10ml加热至37℃的h-dmem培养基的离心管中。
(3)离心:1000rpm,5min,弃上清,加入5ml新鲜配制的h-dmem培养基,轻轻吹打数下,显微镜下观察无细胞团块可见,即将细胞混悬液移至10cm的细胞培养皿中,并在培养皿盖上做好相关标记,包括细胞名称、代数、操作者和复苏日期等,放入5%co2、37℃培养箱中培养。
(4)以上操作注意无菌。
2.3细胞的传代培养
细胞复苏之后,次日换液,以后每隔一天换一次液。培养于培养瓶中的细胞在5%co2、37℃条件下长至80%-90%的融合度时可进行传代,具体方法如下:
(1)弃去细胞培养基,用4mlpbs清洗细胞2-3次。
(2)轻轻吸尽pbs,加入0.25%胰蛋白酶细胞细胞约1-2min,显微镜下观察可发现细胞收缩,形态变圆,用移液管轻轻吸去胰蛋白酶,轻轻拍打培养皿壁,大部分细胞可从贴壁状态变成脱落培养瓶,迅速加入含血清h-dmem培养基终止消化,反复并从各个方向轻柔吹打贴壁于培养瓶上的细胞。
(3)将培养皿中的细胞悬液用移液管转移至无菌15ml离心管,1500rpm,离心3min,离心后,弃去上清,加入适量的完全h-dmem培养基,反复轻柔吹打,显微镜下观察,尽量使细胞分散成单个细胞。
(4)根据细胞密度大小及生长速度,按照1:3-1:5的比例传代。在子代细胞培养瓶上做好标记,包括细胞名称、代数、操作者和传代日期,并将细胞置于5%co2、37℃培养箱中培养。
(5)注意以上操作要求无菌。
3、检测指标
3.1mtt实验
huvec用0.25%胰酶消化,调整细胞浓度为5×104·ml-1,接种于96孔板,每组设4个复孔;培养过夜,加入不同浓度的风湿祛痛中药组合物(0.02、0.1、0.5ng·ml-1)和/或终浓度为20ng·ml-1vegf,并设置control对照组加入相同体积培养基;分别继续培养24h和48h后,每孔加入mtt20μl;培养4h,弃上清,每孔加入dmso150μl,用酶标仪测492nm测吸光度。
3.2transwell迁移实验
3.2.1实验分组
(1)control组:
上室:huvec5×104个+无血清h-dmem培养基;
下室:含10%fbsh-dmem培养基;
(2)tnf-α组:
上室:huvec5×104个+无血清h-dmem培养基;
下室:20ng/mlvegf+含10%fbsh-dmem培养基;
(3)风湿祛痛中药组合物低剂量组:
上室:huvec5×104个+无血清h-dmem培养基+风湿祛痛中药组合物0.02ng/ml;
下室:20ng/mlvegf×104个+含10%fbsh-dmem培养基;
(4)风湿祛痛中药组合物中剂量组:
上室:huvec5×104个+无血清h-dmem培养基+风湿祛痛中药组合物0.1ng/ml;
下室:20ng/mlvegf+含10%fbsh-dmem培养基;
(5)风湿祛痛中药组合物高剂量组:
上室:huvec5×104个+无血清h-dmem培养基+风湿祛痛中药组合物0.5ng/ml;
下室:20ng/mlvegf+含10%fbsh-dmem培养基;
3.2.2实验步骤
(1)当细胞生长至80%-90%时,消化细胞,其中huvec用无血清h-dmem培养基重悬,调整细胞密度,使加入到孔室内的细胞为5×104个;
(2)上室加入150μl用无血清h-dmem培养基重悬的huvec5×104个,以及加入不同浓度的药物50μl(风湿祛痛中药组合物终浓度为0.005ng/ml、0.05ng/ml、0.5ng/ml及5ng/ml);
(3)下室加入600μl用含10%fbs的h-dmem培养基及终浓度为20ng/mlvegf,下层培养液和小室之间容易产生气泡,一旦产生气泡,下层培养液的趋化作用就减弱甚至消失了,因此放置小室的时候要特别留心,一旦有气泡,要将小室提起,去除气泡,再将小室放进培养板;
(4)迁移2小时后,润湿的棉签拭去膜上未迁移的细胞;
(5)用4%多聚甲醛固定10min,用0.1%结晶紫染色10min,600μl/孔,蒸馏水冲洗10min×3次;
(6)将插槽翻转倒置,用正置光学显微镜200×计数迁移到膜下的细胞,每次实验计算5-8个随机视野拍照计数并统计。
3.3transwell侵袭实验
3.3.1实验分组
(1)control组:
上室:huvec5×104个+无血清h-dmem培养基;
下室:含20%fbsh-dmem培养基;
(2)vegf组:
上室:huvec5×104个+无血清h-dmem培养基;
下室:含20%fbsh-dmem培养基+vegf20ng/ml;
(3)风湿祛痛中药组合物低剂量组:
上室:huvec5×104个+无血清h-dmem培养基+风湿祛痛中药组合物0.02ng/ml;
下室:含20%fbsh-dmem培养基+vegf20ng/ml;
(4)风湿祛痛中药组合物中剂量组:
上室:huvec5×104个+无血清h-dmem培养基+风湿祛痛中药组合物0.1ng/ml;
下室:含20%fbsh-dmem培养基+vegf20ng/ml;
(5)风湿祛痛中药组合物高剂量组:
上室:huvec5×104个+无血清h-dmem培养基+风湿祛痛中药组合物0.5ng/ml;
下室:含20%fbsh-dmem培养基+vegf20ng/ml;
3.3.2实验步骤
(1)提前拿一支1ml的基质胶于4℃过夜融化及提前灭菌好的镊子;
(2)用不含血清h-dmem1:8稀释matrigel,包被transwell小室底部膜的上室面,40μl/孔,置37℃30-60min使matrigel聚合成凝胶;
(3)当细胞生长至80%-90%时,消化细胞,无血清培养基重悬,调整细胞密度至5×104/ml,加入到上室,200μl/孔,其中含药物及细胞1×104/孔;
(4)下室加入600μl含20%fbs的培养基及20ng/mlvegf;
(5)侵袭2h后,润湿的棉签拭去膜上未侵袭的细胞;
(6)用4%多聚甲醛固定10min,用0.1%结晶紫染色10min,600μl/孔,蒸馏水冲洗10min×3次;
(7)将插槽翻转倒置,用正置光学显微镜200×计数侵袭到膜下的细胞,每次实验计算5-8个随机视野拍照计数并统计。
3.4粘附实验检测
3.4.1实验分组
(1)control组:fn+1%bsa+huvec;
(2)1%bsa组:1%bsa+huvec;
(3)vegf组:fn+1%bsa+huvec+vegf20ng/ml;
(4)风湿祛痛中药组合物低剂量组:fn+1%bsa+huvec+风湿祛痛中药组合物0.02ng/ml+vegf20ng/ml。
(5)风湿祛痛中药组合物中剂量组:fn+1%bsa+huvec+风湿祛痛中药组合物0.1ng/ml+vvegf20ng/ml。
(6)风湿祛痛中药组合物高剂量组:fn+1%bsa+huvec+风湿祛痛中药组合物0.5ng/ml+vegf20ng/ml。
3.4.2实验步骤
(1)待huvec生长至80%左右融合时,按上面方法进行消化,等密度接种至24孔板,待细胞贴壁后加入vegf使其在孔内终浓度为20ng/ml,1h后,加入不同浓度风湿祛痛中药组合物,使其在孔内终浓度为0.02ng/ml、0.1ng/ml及0.5ng/ml;
(2)将0.2mg/ml的fn配制成浓度为20mg/l的工作液,加至96孔板中,每孔50μl,4℃过夜后吸除多余液体,每孔加入1%bsa100μl/孔,进行封闭,于37℃、5%co2孵箱内培养30-60min,用无血清培养基冲洗2次后,备用;
(3)消化预干预24孔板内的细胞,调整各组细胞浓度,huvec均按5×104个/孔接种至fn及1%bsa包被的96孔板,同时设置相应对照组,每组4复孔;
(4)于37℃、5%co2培养箱孵育1.5h后,pbs清洗2遍去除未黏附细胞;
(5)加入100μl/孔无血清h-dmem与20μlmts,37℃孵育4h;
(6)酶标仪测a值,波长492nm。
3.5管腔形成实验
3.5.1实验分组
(1)control组:huvec+5%fbsh-dmem培养基;
(2)vegf组:huvec+5%fbsh-dmem培养基+vegf20ng/ml;
(3)风湿祛痛中药组合物低剂量组:huvec+5%fbsh-dmem培养基+vegf20ng/ml+风湿祛痛中药组合物0.02ng/ml;
(4)风湿祛痛中药组合物中剂量组:huvec+5%fbsh-dmem培养基+vegf20ng/ml+风湿祛痛中药组合物0.1ng/ml;
(5)风湿祛痛中药组合物高剂量组:huvec+5%fbsh-dmem培养基+vegf20ng/ml+风湿祛痛中药组合物0.5ng/ml。
3.5.2实验步骤
(1)提前将基质胶于4℃冰箱过夜融化,48孔板和高压灭菌的20-200μl枪头在4℃冰箱预冷备用;
(2)用基质胶(10mg/ml)100μl/孔包被48孔板,此过程保持冰上操作,包被好后37℃放置60min使其凝固;
(3)待huvec(4-8代)生长至80%-90%融合时,进行消化,1500rpm,3min离心弃上清后,用含5%fbs的h-dmem培养基重悬huvec,按5×104/孔接种至提前用基质胶包被的48孔板,加入终浓度为20ng/ml的vegf,0.5h后,加入不同浓度风湿祛痛中药组合物(终浓度为0.02ng/ml、0.1ng/ml及0.5ng/ml),对照组加入等体积培养基;
(4)置于37℃、5%co2培养箱中孵育6h(多选时间点,多观察并多拍照),用imageproplus6.0分析系统计数每孔5个随机选定视野下分支点。
3.5.3图像分析
每孔随机选定5个视野下分支点,用imageproplus6.0分析,统计各组管腔分支点数、管腔面积及小管长度。
4、实验结果
4.1风湿祛痛中药组合物对huvec增殖活性的影响
mtt检测结果如图2所示,vegf诱导24h和48h后,均能显著升高huvec的增殖活性(p<0.001);0.02、0.1、0.5ng·ml-1风湿祛痛中药组合物作用24h,与vegf组比,对huvec增殖活性无明显影响,作用48h则能明显抑制vegf诱导的huvec细胞增殖活性(p<0.05,p<0.01或p<0.001),且具剂量依赖关系。
4.2风湿祛痛中药组合物对huvectranswell迁移的影响
药物作用2h后,与control组相比,vegf组迁移下去的细胞数目明显增多(p<0.001),说明vegf诱导可显著增加huvec迁移能力;与vegf组相比,风湿祛痛中药组合物0.02ng/ml、0.1ng/ml、0.5ng/ml组huvec的迁移数目明显减少(p<0.05、p<0.01或p<0.001),表明风湿祛痛中药组合物可抑制vegf诱导的huvec的迁移能力,见图3。
4.3风湿祛痛中药组合物对huvectranswell侵袭的影响
药物作用2h后,与control组相比,vegf组侵袭下去的细胞数目明显增多(p<0.001),说明vegf诱导可显著增加huvec侵袭能力;与vegf组相比,风湿祛痛中药组合物在浓度为0.02ng/ml、0.1ng/ml、0.5ng/ml时huvec侵袭细胞数量显著减少(p<0.05或p<0.01或p<0.001),表明风湿祛痛中药组合物可抑制vegf诱导的huvec的侵袭能力。见图4。
4.4风湿祛痛中药组合物对huvec粘附的影响
huveccontrol组与1%bsa阴性对照组相比,od值增大,说明huvec对fn黏附能力较强;相比于control组,vegf组od值显著增大,可见vegf可促进huvec对fn的黏附能力(p<0.001)。风湿祛痛中药组合物不同浓度干预后od值呈显著的降低(p<0.05或p<0.001),且剂量呈相关性,表明风湿祛痛中药组合物可抑制huvec对fn的黏附能力,见图5。
4.5风湿祛痛中药组合物对huvec管腔形成能力的影响
药物作用6h后,管腔形成实验如图6所示,与正常组相比,vegf组管腔分支点数目、管腔面积及管腔分支长度明显增大(p<0.001),说明vegf诱导可显著增加huvec在基质胶上的管腔形成能力;与vegf组相比,风湿祛痛中药组合物0.02、0.1和0.5ng·ml-1组能管腔形成分支点显著降低(p<0.05或p<0.01或p<0.001),且有剂量依赖性,表明风湿祛痛中药组合物能抑制huvec的管腔形成能力。
实验例4风湿祛痛中药组合物抑制肿瘤血管生成的实验研究
1.实验动物和试剂
6~8周龄c57bl/6小鼠(北京维通利华实验动物技术有限公司),lewis肺癌瘤株。风湿祛痛中药组合物,通化金马药业集团股份有限公司提供。兔抗cd31单克隆抗体(santacruz公司)。sp组化试剂盒(北京中山生物公司)。风湿祛痛中药组合物由实施例1制备。
2.荷瘤小鼠模型建立及分组
无菌条件下摘除生长良好的肿瘤,剪成1mm3大小的组织块,每克肿瘤组织加3ml生理盐水,匀浆,滤过取0.2ml肿瘤匀浆接种于c57bl/6小鼠左肋处皮下,复制肿瘤模型。小鼠接种肿瘤匀浆7h后,随机分成模型组、风湿祛痛中药组合物低剂量组(0.3g/kg)、风湿祛痛中药组合物中剂量组(0.6g/kg)和风湿祛痛中药组合物高剂量组(1.2g/kg),每组10只。
3.动物处理
建立动物模型后第2天开始,风湿祛痛中药组合物各组灌胃给药,模型组灌胃给予同等条件下的蒸馏水。
4、实验指标与测量方法
4.1移植瘤积:肿瘤接种10d后,每5天用游标卡尺测量移植瘤大小,按公式v=(长×宽)×0.52计算肿瘤体积(mm3);
4.2移植瘤内的微血管密度(mvd):肿瘤接种后第20天,小鼠处死后取出移植肿瘤,石蜡包埋、切片、cd31免疫组化染色。mvd计数:从每只小鼠的肿瘤切片中随机选出5张,每张选取5个视野内,对微血管进行计数,每个被染成棕黄色的单个内皮细胞或细胞簇,与周围其他组织有明显界限,无论有无管腔,定义为一条血管,血细胞和大的血管腔不计,取平均值作为每只小鼠每个高倍视野内的mvd。
5、结果
5.1风湿祛痛中药组合物对小鼠移植瘤体积的影响
肿瘤接种9~12d后,肿瘤可长至1.5cm3大小,随着接种时间的延长,部分小鼠移植瘤中心区域开始出现溃烂。尽管风湿祛痛中药组合物各组小鼠肿瘤体积的测量平均值在各时间点均小于模型组,但统计学分析各组之间无统计学意义。
5.2风湿祛痛中药组合物对小鼠移植瘤内微血管密度(mvd)的影响
与模型组相比,风湿祛痛中药组合物中、高剂量组mvd明显减少,且有显著性差异(分别为p<0.05,p<0.01),见表1。
表1风湿祛痛中药组合物对种植肿瘤中mvd的影响
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明技术原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!