利用金属卤化物钙钛矿材料形成激光源的方法、激光治疗装置和系统与流程
本公开涉及医用激光领域,尤其涉及一种形成激光源的方法、激光治疗装置和激光治疗系统。
背景技术:
激光具有方向性好,亮度高、单色性好和高能量密度等特点,是20世纪60年代的新光源。以激光器为基础的激光工业在全球发展迅猛,随着新型激光器的不断出现和激光医学研究的发展,在上世纪70年代,激光技术成功地应用于临床。目前,激光医学应用已渗透到眼科、皮肤科、心血管科等各个学科。
目前,常用的医用激光源有氩离子激光源、二极管激光源、co2激光源等。现有技术中的医用激光源均为体外激光源,体外光源发射激光作用于目标组织,在应用过程中如不注意对外部光源所发射的激光的防护,激光容易损伤人体的正常组织,对人体造成不可逆的损伤。
不同波长的激光及其能量辐射可对人体的不同组织造成不可逆的损伤。例如,激光对眼睛产生的伤害,激光聚于感光细胞时产生过热而引起的蛋白质凝固变性是不能可逆的损伤,一旦损伤以后就会造成眼睛的永久失明。又例如,激光照到皮肤时,如其能量(功率)过大时可引起皮肤的损伤,激光损伤皮肤的机理主要是由激光的热作用所致。
技术实现要素:
本发明人发现,需要一种既能够针对性地作用于目标组织又能够避免发射的激光或者激光的激发光源对生物体的正常组织产生损伤的医用激光源的形成方法、激光治疗装置和激光治疗系统。本发明人提供了本公开以解决现有技术中存在的上述技术问题。
根据本公开的第一方案,提供了一种利用金属卤化物钙钛矿材料形成激光源的方法,所述方法包括:通过从生物体外部施加可见以及近红外光,来激发与目标组织结合的状态下的所述金属卤化物钙钛矿材料,以形成体内的激光源。
在一些实施例中,所述金属卤化物钙钛矿材料采用纳米片、纳米线和量子点中的至少一种结构以在所述激发下形成微米和/或纳米级别尺寸的体内激光源。
在一些实施例中,所述金属卤化物钙钛矿材料包括二维结构的金属卤化物钙钛矿,化学通式为amx3,其中a代表一价阳离子,m代表二价金属离子,x代表卤族元素离子。
在一些实施例中,所述方法包括:通过为所述金属卤化物钙钛矿材料调整化学计量比、替代卤族元素或者混合卤族元素、用无机元素替代有机元素中的至少一种,来扩展其发射激光的波长范围。
在一些实施例中,所述方法包括:将金属卤化物钙钛矿与金纳米壳复合,以得到所述金属卤化物钙钛矿材料。
在一些实施例中,所述方法还包括:所述金纳米壳通过表面修饰来实现与特异性抗体的偶联。
在一些实施例中,所述方法还包括:所述金纳米壳通过表面修饰来实现与治疗靶向药物的偶联和/或承载。
在一些实施例中,所述偶联通过配体修饰来实现。
在一些实施例中,所述金纳米壳的内腔和/或表面被配置为承载药物。
在一些实施例中,所述方法还包括:控制所述从生物体外部施加的可见以及近红外光的照射,来控制所承载药物的释放。
根据本公开的第二方案,提供一种激光治疗装置,所述激光治疗装置利用根据本公开的各种实施例所述的方法与摄入生物体内的金属卤化物钙钛矿材料配合操作,并且包括:外部光源模块,被配置为从生物体外部施加可见以及近红外光。
在一些实施例中,所述外部光源模块所施加的可见以及近红外光具有10-7jcm-2到10-6jcm-2的级别的能量密度。
在一些实施例中,所述激光治疗装置还包括:成像组件,被配置为在所述体内的激光源作用下对所述目标组织进行成像;控制台,被配置为从所述成像组件接收图像数据并进行处理。
在一些实施例中,所述外部光源模块包括光源发射器、适配器、第一分光镜、功率计和显微镜,其中,所述适配器用于适配所述第一分光镜;从所述光源发射器发射的可见以及近红外光传输到所述第一分光镜,并经由所述第一分光镜分别传输到所述目标组织、所述功率计和所述显微镜。
在一些实施例中,所述成像组件包括第二分光镜、照相机、光学相干成像仪、共焦扫描镜和光声成像仪,从所述体内的激光源发射的激光传输到所述第二分光镜,并经由所述第二分光镜分别传输到所述照相机和所述光学相干成像仪。
根据本公开的第三方案,提供一种激光治疗系统,包括:金属卤化物钙钛矿材料,其能够摄入到生物体内;以及根据本公开的各种实施例的激光治疗装置,其被配置为与摄入到生物体内所述金属卤化物钙钛矿材料配合操作,以激发所述金属卤化物钙钛矿材料形成生物体内的激光源。
与现有技术相比,本发明的有益效果在于:
1、本发明利用金属卤化物钙钛矿材料形成的体内激光源能够针对性作用于靶区,且从生物体外部施加的用于激发金属卤化物钙钛矿材料的可见以及近红外光的能量密度低于现有的医用激光源的能量密度,从而能够避免对生物体的正常组织造成不可逆的损伤,安全性较高;
2、本发明的激光治疗系统能够免除现有激光治疗手段中外加激光对正常组织的损伤,并且将光热治疗,激光治疗和药物治疗整合以实现协同治疗,同时对目标组织进行实时成像,以指导治疗过程和评估治疗效果,系统通用性强,且安全性较高。
应当理解,前面的一般描述和以下详细描述都仅是示例性和说明性的,而不是用于限制本公开。
本节提供本公开中描述的技术的各种实现或示例的概述,并不是所公开技术的全部范围或所有特征的全面公开。
附图说明
为了更清楚地说明本公开实施例的技术方案,下面将对实施例的附图作简单地介绍,显而易见地,下面描述中的附图仅仅涉及本公开的一些实施例,而非对本公开的限制。
图1为根据本公开实施例的利用金属卤化物钙钛矿材料形成激光源的方法的示意图;
图2为根据本公开的实施例的具有不同卤族元素或混合卤族元素的金属卤化物钙钛矿材料受到激发后发射激光的波长范围的示意图;
图3为根据本公开的实施例的金纳米壳与特异性抗体的表面修饰的结构示意图
图4为根据本公开实施例的激光治疗系统的结构示意图;
图5为根据本公开的实施例的激光治疗系统的功能实现框图;
图6为根据本公开的实施例的激光治疗的流程图。
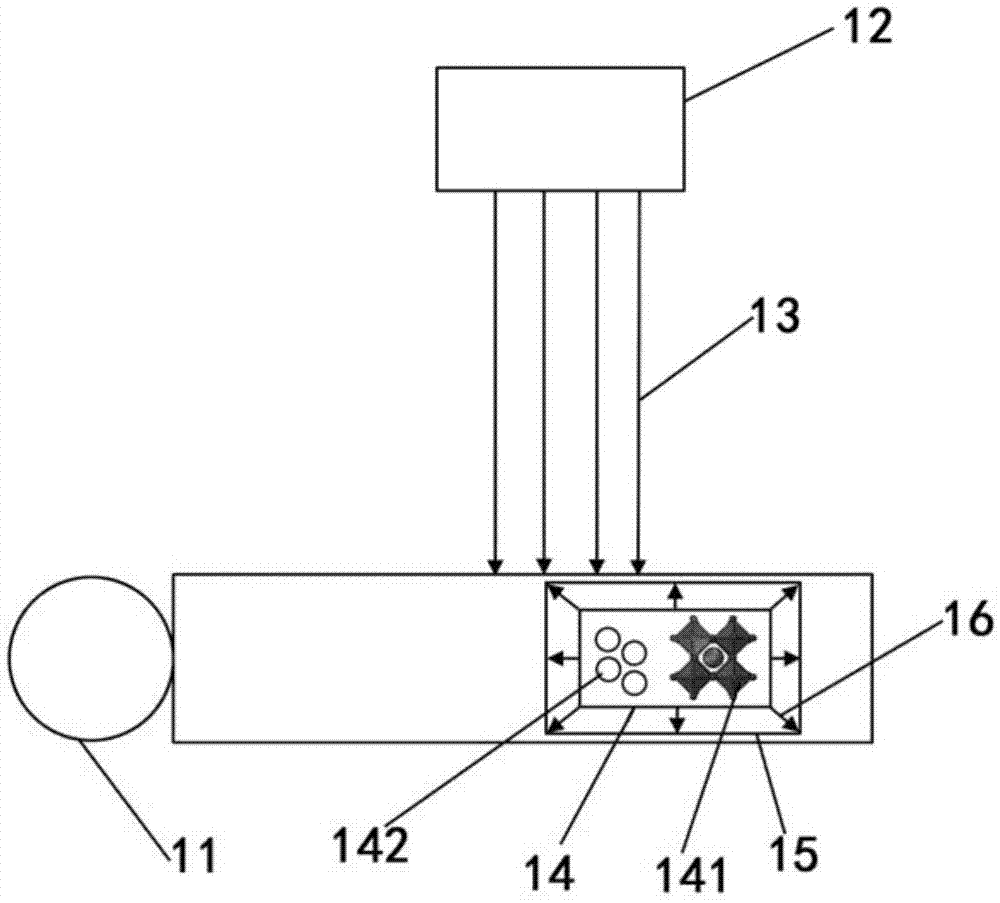
图1附图标记:
11-生物体;12-光源;13-可见以及近红外光;14-金属卤化物钙钛矿材料;141-金属卤化物钙钛矿;142-金纳米壳;15-目标组织;16-激光。
图4附图标记:
41-金属卤化物钙钛矿材料;411-金属卤化物钙钛矿;412-金纳米壳;42-激光治疗装置;43-目标组织;44-外部光源模块;441-光源发射器;442-适配器;443-第一分光镜;444-功率计;445-显微镜;45-成像组件;451-第二分光镜;452-照相机;453-光学相干成像仪;454-共焦扫描镜;455-光声成像仪;46-控制台。
图5附图标记:
51-可见-近红外光外加光源;52-中介物;53-目标组织;54-金属卤化物钙钛矿材料;541-金纳米壳;542金属卤化物钙钛矿。
具体实施方式
为了使得本公开实施例的目的、技术方案和优点更加清楚,下面将结合本公开实施例的附图,对本公开实施例的技术方案进行清楚、完整地描述。显然,所描述的实施例是本公开的一部分实施例,而不是全部的实施例。基于所描述的本公开的实施例,本领域普通技术人员在无需创造性劳动的前提下所获得的所有其他实施例,都属于本公开保护的范围。
除非另外定义,本公开使用的技术术语或者科学术语应当为本公开所属领域内具有一般技能的人士所理解的通常意义。“包括”或者“包含”等类似的词语意指出现该词前面的元件或者物件涵盖出现在该词后面列举的元件或者物件及其等同,而不排除其他元件或者物件。“连接”或者“相连”等类似的词语并非限定于物理的或者机械的连接,而是可以包括电性的连接,不管是直接的还是间接的。“上”、“下”、“左”、“右”等仅用于表示相对位置关系,当被描述对象的绝对位置改变后,则该相对位置关系也可能相应地改变。
为了保持本公开实施例的以下说明清楚且简明,本公开省略了已知功能和已知部件的详细说明。
图1示出了根据本公开实施例的一种利用金属卤化物钙钛矿材料形成激光源的方法的示意图,如图1所示,所述方法包括:通过从生物体11外,例如由光源12,施加的可见以及近红外光13,来激发与目标组织15结合的状态下的金属卤化物钙钛矿材料14,以形成体内的激光源并发射激光16。金属卤化物钙钛矿材料14目前是应用于太阳能电池领域的,其光学增益高、吸光系数高且缺陷密度低,本发明人经过临床试验创造性地发现,该金属卤化物钙钛矿材料14摄入生物体11内后代谢良好,对于生物体11也相对安全,因此可以如上用作激光治疗制剂。该激光源是原位激光源,所生成的激光16在衰减较少的情况下集中作用于目标组织15,从而确保对目标组织15的治疗效果(穿透性较好)同时减少对周边组织的副作用。其中,可见以及近红外光13具有较低的能量密度,从而能够避免对生物体11的正常组织造成不可逆的损伤,安全性较高。
在一些实施例中,金属卤化物钙钛矿材料14包括二维结构的金属卤化物钙钛矿141,其化学通式为amx3,其中a代表一价阳离子,m代表二价金属离子,x代表卤族元素离子,可选的,一价阳离子可为ch3nh3+、cs+、rb+等,二价金属离子可为pb2+、sn2+等,卤族元素离子可为cl-、br-、i-等,在此不作具体限定。在金属卤化物钙钛矿141的二维结构的八面体层中,有机与无机配体之间的介电差异较大,电子和空穴会被强烈的限域在该八面体层中,同时两者之间通过库仑力连接在一起,这种强限域下的电子空穴对的结合能约几百兆电子伏特,可以产生强光物质作用,这种强光物质作用是应用于低阈值极化激光的保证,从而使得金属卤化物钙钛矿材料14能够在可见以及近红外光13的作用下被激发以产生原位激光。在一些实施例中,所产生的激光的强度可以通过外部光源12发射的激光强度(例如能量密度等)来调节,外部光源发射的激光的能量密度越低,则受激发的金属卤化物钙钛矿141所产生的激光的能量密度也越低。
在一些实施例中,金属卤化物钙钛矿材料14采用纳米片、纳米线和量子点中的至少一种结构以在激发下形成微米和/或纳米级别尺寸的体内激光源。这些结构的金属卤化物钙钛矿材料14在外部光源12所发射的激光的激发下,其本身充当“镜子”和增益介质的双重身份形成光学谐振腔,从而通过光学谐振作用来增加激光的强度。优选的,在利用金属卤化物钙钛矿材料14形成体内激光源的同时对目标组织15进行成像以实时观察目标组织15的状况,成像时需要加入造影剂,造影剂对可见以及近红外光13产生响应,并配合外部图像采集装置对目标组织15进行成像,纳米片、纳米线和量子点等结构的金属卤化物钙钛矿材料14在外部光源12的激发下形成的微米和/或纳米级别尺寸的体内激光源更利于对目标组织15进行高分辨生物成像。具体说来,金属卤化物钙钛矿材料14可以是复合材料,可以通过将金属卤化物钙钛矿141与各种造影剂复合得到。金属卤化物钙钛矿141的合成以及配体交换便利,工艺简单,易于与其他纳米材料复合。对目标组织15进行成像的造影剂可以是金纳米材料、碳纳米材料、染料相关纳米材料等,在此不作具体限定。
在一些实施例中,利用金属卤化物钙钛矿材料14形成激光源的方法还包括通过为金属卤化物钙钛矿材料14调整化学计量比、替代卤族元素或者混合卤族元素、用无机元素替代有机元素等多种方法来扩展其发射激光的波长范围,使其发射激光的波长范围覆盖所需要的波长范围的可见及近红外区甚或整个可见及近红外区,以适应实际应用中的不同需求,在此不作具体限定。
图2示出了本公开实施例的具有不同卤族元素或混合卤族元素的金属卤化物钙钛矿材料14受到激发后发射激光的波长范围的示意图,例如,根据图2所示,若金属卤化物钙钛矿材料14中金属卤化物钙钛矿141的化学式为cssnx3,当cssnx3中的x为cl3时,其受到激发后发射波长约为560nm的可见光,当cssnx3中的x为br3时,其受到激发后发射波长约为720nm的可见以及近红外光,当cssnx3中的x为i3,其受到激发后发射波长约为1000nm的近红外光,当cssnx3中的x为混合卤族元素brni3-n时(n≤3),可使其受到激发后发射波长范围约为720nm-1000nm的可见及近红外光。
在一些实施例中,将金属卤化物钙钛矿141与金纳米壳142复合,以得到金属卤化物钙钛矿材料14(如图1所示)。其中,金属卤化物钙钛矿141的合成以及配体交换便利,工艺简单,易于与其他纳米材料复合,能够协同作用于目标组织15,金纳米壳142在可见-近红外区有强烈的吸收(光谱对金纳米壳142的核壳比较为敏感,当壳层厚度减小,导致内外等离子体相互作用增强,增大两杂化共振态的分裂,导致对称共振态能量减低,对应的光谱发生红移;而非对称共振态的能量升高,对应的光谱发生蓝移;例如同样是60nm的二氧化硅内核,当壳层厚度为20nm时其粒子对应的光谱最大吸收峰位于720nm;而当壳层厚度降低至5nm时,对应的光谱最大吸收峰红移至1000nm),金纳米壳光谱的可预见性和可调性可以被充分利用,以例如通过改变反应条件,来合成出光谱符合应用要求的金纳米壳,因而金纳米壳142可以对用于生物成像的近红外激光的窗口产生响应,以作为良好的生物成像造影剂对目标组织15进行成像。并且,当金纳米壳142吸收入射光的能量后,电子从基态跃迁到激发态,此后再从激发态跃迁回基态,在跃迁回基态的过程中,能量以热的方式释放和传递,从而使得金纳米壳142及其周围环境的温度升高,金纳米壳142的表面电子与晶格间通过电子-声子能量传递,晶格通过声子-声子相互作用(100-380ps)将热量传递到周围的环境中,使金纳米壳142的自身温度降低,周围环境温度升高,金纳米壳142的这种特性使其能够应用于对生物体11的目标组织15进行热治疗。由于肿瘤细胞相较于普通健康细胞耐热性低,过高温加热能够优先使得肿瘤细胞膜松弛并破坏其中的蛋白质,从而杀死肿瘤细胞。
在一些实施例中,金纳米壳142通过表面修饰来实现与特异性抗体或非特异性抗体的偶联以及与治疗靶向药物的偶联和/或承载。图3为本公开的实施例的金纳米壳与特异性抗体的表面修饰的结构示意图,根据图3所示,特异性抗体通过共价连接和/或非共价连接的方式对金纳米壳142进行表面修饰,以提高金纳米壳142的分散性、生物相容性以及靶向识别能力等,具体说来,特异性抗体包括多种,如蛋白质、多肽、药物、dna等,在此不作具体限定。
在一些实施例中,偶联通过配体修饰来实现。具体说来,氨基、巯基、羧基和磷酸基等都具有孤对电子,能够与金产生共价相互作用,使得金纳米壳与特异性或非特异性抗体的偶联能够通过配体修饰来实现。
在一些实施例中,金纳米壳142的内腔和/或表面被配置为承载药物,金纳米壳142具有内腔和较大的表面积,这种结构特点使得金纳米壳142能够承载药物。通过对金纳米壳142的独特结构,如内空腔和大的表面积的充分利用,使得合成多功能粒子(例如但不限于承载不同功能的多种药物)成为可能。
在一些实施例中,所述方法还包括:控制从生物体11的外部施加的可见以及近红外光13的照射,来控制所承载药物的释放。具体说来,金纳米壳142的表面承载的药物能够释放作用于目标组织15,而金纳米壳142的内腔中的药物则是通过从可见以及近红外光13的照射来得到释放并作用于目标组织15。通过在金纳米壳的内腔和表面进行药物负载,并通过控制外加光照来控制特定药物的释放,能够促进光热治疗和药物治疗的协同作用,提高治疗效率,同时也能降低传统抗癌药物的生物毒性。
本公开的实施例还提供了一种激光治疗装置42,如图4所示,该激光治疗装置42利用根据本公开的各种实施例所述的方法与摄入生物体内的金属卤化物钙钛矿材料41配合操作,该激光治疗装置42包括外部光源模块44,外部光源模块44用于从生物体外部施加可见以及近红外光,来激发与目标组织43结合的状态下的金属卤化物钙钛矿材料41,以形成体内的激光源并发射原位激光作用于目标组织43,以对目标组织43进行治疗。其中,外部光源模块44所施加的可见以及近红外光的能量密度较低,使得在利用该激光治疗装置42对生物体的目标组织43进行激光治疗的过程中不会损伤生物体的正常组织。
在一些实施例中,外部光源模块44所施加的可见以及近红外光具有10-7jcm-2到10-6jcm-2的级别的能量密度,可选的,外部光源模块44所发射的激光的强度可调,以使得金属卤化物钙钛矿材料41受激发后形成的激光源能够发射不同能量密度的激光,以满足不同的治疗需求。
在一些实施例中,激光治疗装置42还包括成像组件45和控制台46,成像组件45用于对目标组织43进行成像,控制台46用于接收成像组件45发送的图像数据,并对图像数据进行存储、处理等操作,以便指导治疗过程和评估治疗效果。
在一些实施例中,外部光源模块44包括光源发射器441、适配器442、第一分光镜443、功率计444和显微镜445,其中,适配器442用于适配第一分光镜443,从光源发射器441发射的可见以及近红外光传输到第一分光镜443,并经由第一分光镜443分别传输到目标组织43、功率计444和显微镜445。
在一些实施例中,成像组件45包括第二分光镜451、照相机452、光学相干成像仪453、共焦扫描镜454和光声成像仪455,从体内的激光源发射的激光传输到第二分光镜451,并经由第二分光镜451分别传输到照相机452和光学相干成像仪453,光学相干成像仪453将激光数据分别传输至光声成像仪455和共焦扫描镜454,并配合照相机452对目标组织43进行成像,采集到的图像数据被发送至控制台46。
图4示出了本公开实施例的激光治疗系统的结构示意图,如图4所示,本公开的实施例还提供了一种激光治疗系统,该激光治疗系统包括本公开的各种实施例所述的金属卤化物钙钛矿材料41和与摄入生物体内的金属卤化物钙钛矿材料41配合操作的激光治疗装置42,金属卤化物钙钛矿材料41被摄入到生物体内的目标组织43,激光治疗装置42中的外部光源模块44于生物体外发射可见以及近红外光,来激发与目标组织43结合的状态下的金属卤化物钙钛矿材料41,金属卤化物钙钛矿材料41受到激发在生物体内形成激光源,激光源发射激光作用于目标组织43,以对目标组织43进行治疗,成像组件45对目标组织43进行局部造影或三维成像,并将图像数据发送至控制台46,控制台46接收图像数据并进行处理,以便指导治疗过程和评估治疗效果。其中,外部光源模块44于生物体外发射的可见以及近红外光的能量密度低于现有的医用激光源的能量密度,从而能够避免对生物体的正常组织造成严重的损伤,该激光治疗系统的安全性较高。
具体地,根据图5所示,可见-近红外光外加光源51发射的可见以及近红外光经由中介物52作用于与目标组织53结合状态下的金属卤化物钙钛矿材料54,金属卤化物钙钛矿材料54中的金纳米壳541识别目标组织53,同时金纳米壳541吸收可见以及近红外光的能量后释放其所承载的药物,对目标组织53进行药物治疗,进一步的,金纳米壳541在吸收可见以及近红外光的能量后还释放热能于目标组织53,对目标组织53进行热治疗,再者,金纳米壳541在吸收可见以及近红外光的能量后作为造影剂,以对目标组织53进行成像,而金属卤化物钙钛矿材料54中的金属卤化物钙钛矿542受可见以及近红外光的激发形成体内激光源,并发射特定波长的激光作用于目标组织53,以对目标组织53进行激光治疗。该激光治疗系统中的金属卤化物钙钛矿542所发射的激光对目标组织53的穿透性好且不伤害目标组织53周围的其他组织,并能够配合金纳米壳541协同作用于目标组织53,以实现对目标组织53的多种治疗,该系统安全性高,且通用性较强。
进一步地,图6为本公开的实施例的激光治疗的流程图,如图6所示,静脉注射金属卤化物钙钛矿材料制剂于生物体内(s1),与金属卤化物钙钛矿材料偶联的特异性抗体对目标组织进行识别(s2),如特异性抗体未识别到目标组织,金属卤化物钙钛矿材料则继续参与人体代谢(s3),以被排出体外,若特异性抗体识别到目标组织,则金属卤化物钙钛矿材料与目标组织结合(s4),随后外部光源发射可见以及近红外光作用于目标组织(s5),金属卤化物钙钛矿材料中的金纳米壳吸收光能(s6),将其所承载的药物释放于目标组织(s7),对目标组织进行热治疗(s8)并作为造影剂配合外部图像采集装置对目标组织进行成像(s9),与此同时,金属卤化物钙钛矿材料中的金属卤化物钙钛矿受到外部光源所发射的可见以及近红外光的激发形成体内激光源(s10),并发射原位激光作用于目标组织,以对目标组织进行激光治疗(s11),目标组织经金纳米壳和金属卤化物钙钛矿的协同治疗后失去活性或被彻底消除(s12),随后金属卤化物钙钛矿材料继续参与人体代谢(s13),以被排出体外。
以上描述旨在是说明性的而不是限制性的。例如,上述示例(或其一个或更多方案)可以彼此组合使用。例如本领域普通技术人员在阅读上述描述时可以使用其它实施例。另外,在上述具体实施方式中,各种特征可以被分组在一起以简单化本公开。这不应解释为一种不要求保护的公开的特征对于任一权利要求是必要的意图。相反,本公开的主题可以少于特定的公开的实施例的全部特征。从而,以下权利要求书作为示例或实施例在此并入具体实施方式中,其中每个权利要求独立地作为单独的实施例,并且考虑这些实施例可以以各种组合或排列彼此组合。本公开的范围应参照所附权利要求以及这些权利要求赋权的等同形式的全部范围来确定。
以上实施例仅为本公开的示例性实施例,不用于限制本公开,本公开的保护范围由权利要求书限定。本领域技术人员可以在本公开的实质和保护范围内,对本公开做出各种修改或等同替换,这种修改或等同替换也应视为落在本公开的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!