可降解蚕丝人工神经的制作方法
本发明属于生物医学领域,具体涉及一种可降解蚕丝人工神经及其制备方法。
背景技术:
降解是组织工程材料研究所面临的最基本问题之一,促进或抑制材料的降解是这一问题同等重要的两个方面,即如何人工调控组织工程材料在体内的降解速率,这一问题的解决有助于人工血管、神经和骨等移植体的研究。如何促进材料在体内降解问题的探讨,有助于如何抑制材料在体内降解问题的解决。
材料在体内的降解,是由材料与组织液的生化反应和细胞吞噬两个方面的因素所决定的。对于化学稳定性较好的材料而言,细胞吞噬作用是其在体内降解的主要原因。而细胞吞噬活动与炎症反应紧密联系,故通过调控炎症反应间接调控细胞吞噬作用,是调控组织工程材料在体内的降解速率的思路之一。
天然蚕丝纤维是一种优质生物材料,但是难以在体内降解。探讨如何调控炎症反应,进而调控蚕丝在体内的降解速率,有助于拓展蚕丝纤维在生物医药领域的应用前景。
通常情况下,在创伤修复过程中,抑制炎症反应是需要考虑的问题。但是研究表明,在周围神经损伤修复的初期,炎症反应和细胞吞噬是主要事件,适度的炎症反应有助于神经缺损修复。因此,将炎症反应控制在适度范围内,有望实现在促进蚕丝人工神经中蚕丝纤维降解的同时,也能促进周围神经缺损修复。
专利cn201710149780.x公开了一种基于蚕丝丝素蛋白的植入人体可降解生物材料的制备方法,其方法步骤为:将na2co3加入沸水中,加入蚕丝煮沸脱胶,得到脱胶蚕丝;将脱胶蚕丝加入到cacl2·ch3ch2oh·h2o或溴化锂溶液中,得到蚕丝混合溶液;将蚕丝混合溶液过树脂离子交换柱,得到丝素蛋白水溶液;将丝素蛋白水溶液冷冻干燥,得到絮状干态丝素蛋白;将絮状干态丝素蛋白溶解于六氟异丙醇中,得到丝素蛋白醇溶液;将丝素蛋白醇溶液经过静电纺丝机,制成膜状或块状生物材料。该发明可通过溶于有机溶剂的丝素蛋白制作条件的不同,得到不同医疗用途且可调控降解速度的生物材料,该生物材料拥有极佳的生物相容性。但是该材料仅限于可降解,对于促进周围神经缺损修复无效果。
目前尚无促进周围神经缺损修复、可控制降解的蚕丝人工神经报道。
因此开发一种可降解蚕丝人工神经及其制备方法。
技术实现要素:
内毒素(lipopolysaccharide,lps)是革兰氏阴性菌外壁的的一种成分,被称作为脂多糖,能促进炎症反应和细胞吞噬,通常被用于建立炎症反应动物模型。如果内毒素在组织中的含量在机体免疫耐受范围内,它们能够在短时间内被机体全部中和、灭活和清除。为此,本项目拟构建内毒素蚕丝纤维缓释载体,通过内毒素在一定时间内的持续释放,诱导适度的炎症反应,促进吞噬细胞对蚕丝纤维的吞噬从而促进蚕丝纤维的体内降解。
致炎因素会导致机体的炎症反应,在组织环境中生成大量活性氧(ros),而活性氧将进一步促进炎症反应。a.y.kim等(2017)报道了一种活性氧敏感型材料即tpox(tyrosolincorporatedcopolyoxalate)。tpox不溶于水,易溶于二氯甲烷,具有良好的生物相容性。活性氧与tpox进行化学反应,破坏tpox的乙二酰酯键使其发生降解,生成tyrosol(酪醇)和二氧化碳。tpox在降解的过程中由于消耗了组织环境中的活性氧,因而会弱化活性氧导致的细胞吞噬和炎症因子分泌活动,即具有抑制炎症反应的作用。
内毒素的促炎性质,tpox的抗炎性质可用于调控炎症反应相关细胞对材料的吞噬行为,进而调控组织工程材料在体内的降解速率。
周围神经断裂后,远端轴突及部分近端轴突会发生崩解,髓鞘崩解脱失,炎症细胞吞噬细胞残骸,及细胞增生等一系列变化,这一现象被称为瓦勒氏变性,这是周围神经损伤及再生的研究基础。即在创伤修复和周围神经缺损修复过程中,炎症反应是不可避免的一个过程,适度的炎症反应有利于创伤修复和周围神经缺损修复。在本项研究中,主要探讨何种程度的炎症反应及其持续时间既能促进蚕丝纤维的降解又能促进周围神经缺损修复。
有鉴于此,本发明的目的在于提供一种内毒素缓释生物丝纤维、plga抑炎中空神经导管及由二者组装获得的可降解蚕丝人工神经移植体。
本发明的目的之一在于提供一种内毒素缓释生物丝纤维,其制备简单,内毒素层、plga层的厚度及层数方便可控,有利于对于内毒素缓释速度的控制。
为实现上述目的,本发明的技术方案为:
一种内毒素缓释生物丝纤维,其特征在于,由内而外依次由生物丝束和缓释层构成,所述缓释层由内到外依次为内毒素层和plga层;
所述内毒素缓释蚕丝纤维包含所述缓释层的数目为2-10;
所述内毒素缓释生物丝纤维的直径为1-3mm。
优选的,所述内毒素缓释蚕丝纤维包含所述缓释层的数目为3-6。
优选的,所述生物丝束为蚕丝单丝束。
优选的,所述蚕丝单丝束中单丝的直径为10-30微米。
进一步,所述蚕丝单丝束中蚕丝单丝的数目为5000-8000根。
本发明的目的还在于提供一种上述内毒素缓释蚕丝纤维的制备方法,其制备操作简单,便于控制。
为实现上述目的,本发明的技术方案为:
内毒素缓释蚕丝纤维的制备方法,其特征在于,包括以下步骤:
1)生物丝捆扎成束,获得生物丝束;
2)将步骤1)获得的丝束浸泡于内毒素水溶液中5-15min,冷冻干燥;置于plga溶液中2-10min,室温风干;plga溶液中浸泡2秒钟,取出,室温风干,重复若干次控制plga层厚度;
3)重复步骤2)2-10次。
优选的,所述plga溶液为质量体积比为5%的plga二氯甲烷溶液。
优选的,所述内毒素水溶液的浓度为0.001-0.1ug/l。
本发明的目的还在于提供一种plga抑炎中空神经导管,其可通过plga的包裹缓释tpox。
为实现上述目的,本发明的技术方案为:
一种plga抑炎中空神经导管,其特征在于,由内到外依次由plga膜、tpox膜、plga膜构成,所述导管内径为1-3mm;所述plga膜、tpox膜的厚度为1-10微米。
本发明的目的还在于提供一种上述plga抑炎中空神经导管的制备方法,其特征在于,包括以下步骤:
a制膜
取质量体积比为5%的plga二氯甲烷溶液,置于玻璃培养皿中,自然风干,脱膜,裁切成长方形,即制备成plga膜,备用;取质量体积比为10%的tpox二氯甲烷溶液,置于玻璃培养皿中,自然风干,脱膜,裁切成长方形,即制备成tpox膜,备用;
b组装
取2张plga膜,中间夹上1张tpox膜,一起在直径为1-3mm的玻璃棒上卷成管状,用二氯甲烷粘合,即制备成plga抑炎中空神经导管;
所述plga膜、tpox膜的厚度为1-10微米。
本发明的目的还在于提供一种人工神经移植体。
为实现上述目的,本发明的技术方案为:
一种人工神经移植体,其特征在于,由本发明的内毒素缓释生物丝纤维和plga抑炎中空神经导管组装获得。
本发明的目的还在于提供一种本发明的人工神经移植体在用于制备周围神经缺损修复效果的模型中的应用。
本发明的目的还在于提供一种本发明的人工神经移植体在用于制备人工神经体内降解的模型中的应用。
在蚕丝纤维外表面,用plga包封一定剂量的内毒素,在plga降解过程中,释放一定剂量的内毒素,促进炎症细胞对蚕丝纤维的吞噬以达到促进蚕丝纤维降解的目的。调整plga包封层的厚度和内毒素的包封量,可调整内毒素的释放剂量和持续释放时间,进而调控蚕丝纤维的降解速率。在plga神经导管中包封一定剂量的tpox,在plga降解过程中,释放一定剂量的tpox,以抑制内毒素促进的炎症反应,最终使炎症反应的强度和持续时间,处于既能促进蚕丝人工神经中蚕丝纤维的降解,也能促进周围神经缺损修复的范围中。调整plga包封层和tpox层的厚度,可调整tpox的释放剂量和持续释放时间,进而达到调控炎症反应的目的。
本发明的有益效果在于:本发明提供的体内可降解的蚕丝纤维人工神经,通过调控炎症反应的进程,以调控蚕丝纤维在体内的降解速率和周围神经缺损修复效率。上述的人工神经可用来制备评价人工神经体内降解及其促周围神经缺损修复效果的模型,从而为人工神经的设计提供参考依据,实现更好的体内降解和促周围神经缺损修复的效果。
附图说明
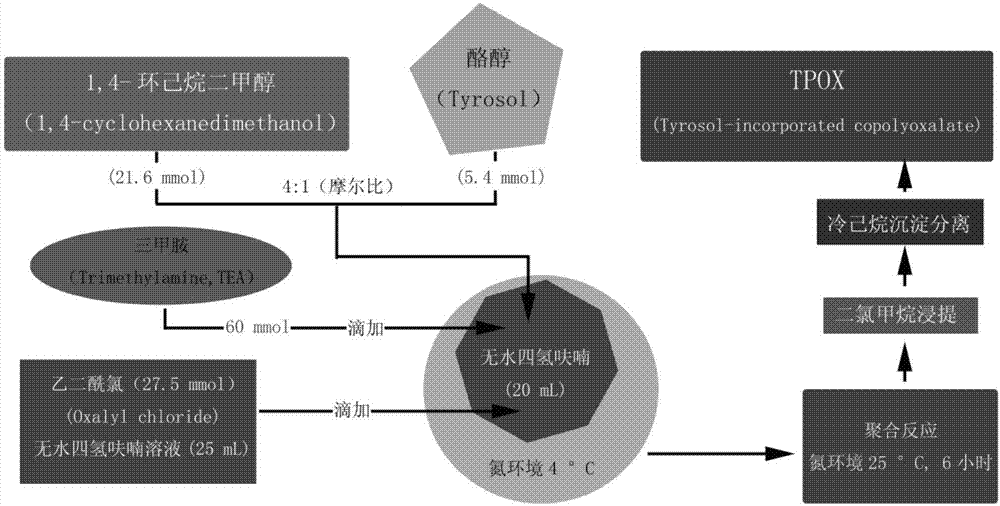
图1为tpox的合成方法示意图。
图2为蚕丝人工神经结构示意图。
具体实施方式
以下将(参照附图)对本发明的优选实施例进行详细描述。优选实施例中未注明具体条件的实验方法,通常按照常规条件,所举实施例是为了更好地对本发明的内容进行说明,但并不是本发明的内容仅限于所举实施例。所以熟悉本领域的技术人员根据上述发明内容对实施方案进行非本质的改进和调整,仍属于本发明的保护范围。
实施例1可降解蚕丝人工神经移植体的制备
1)tpox的合成
tpox的合成按文献报道的方法进行,大体步骤为:将21.6mmol1,4-环己烷二甲醇(1,4-cyclohexanedimethanol)和5.4mmol酪醇(tyrosol)按4:1的摩尔比溶解于20ml无水四氢呋喃中,在4℃条件下滴加入60mmol三甲胺,在氮环境下(4℃)滴加入浓度为27.5mmol的乙二酰氯的无水四氢呋喃溶液25ml,在氮环境下(25℃)聚合6小时,用二氯甲烷浸提,在冷的己烷中沉淀,弃上清液,室温抽干,即可获得tpox固体。制备方法示意图见图1。
2)内毒素剂量预测
①动物模型的建立:
对大鼠胸背部皮肤剃毛,用浓度为1×108/ml的金黄色葡萄球菌(菌号:cmcc26003)琼脂凝胶,皮下注射0.1ml,以建立金黄色葡萄球菌皮下感染模型,作为本项试验的实验组ⅰ,在大鼠胸背部皮肤剃毛,切开皮肤,形成一个长10mm的切口,缝合,作为本项试验的实验组ⅱ,以正常皮肤为对照组。
②样本收集:
分别在试验的第1、2、3、4、5、6、7天,收集样本。在实验组ⅰ中,以注射部位为圆心,取直径为10mm的皮肤,并刮取收集对应部位肌肉和皮肤之间的物质。在实验组ⅱ中,以创口部位为轴线,取直径为10mm的皮肤,并刮取收集对应部位肌肉和皮肤之间的物质。在健康大鼠胸背部,取直径为10mm的皮肤,注意保留皮下疏松结缔组织。
③内毒素表达量的检测:
分别将上述样本进行组织匀浆(4℃),定溶至5ml,离心(5min,3000rpm)取上清液,用鲎试剂测定内毒素的浓度。作为蚕丝纤维内毒素缓释载体制备过程中的参考浓度。
3)内毒素缓释蚕丝纤维、tpox缓释神经导管和人工神经的制备和体外测试
①单丝的制备:
将150根生丝裁切成100mm长度,两端对齐,在两端打节,捆扎成束状,置于1%碳酸氢钠水溶液,100℃搅拌10min,温水(50℃)漂洗10min,重复3次,即制备成由单丝纤维构成的熟丝丝束。本实验选用的生丝中,由20根茧丝即40根单丝构成,每根单丝的平均直径为20μm。在所制备的熟丝丝束中,包含了6000根单丝。
②内毒素缓释蚕丝纤维的制备:
分别用plga、tpox和内毒素制备蚕丝纤维缓释载体(表1,图2)。
将内毒素溶于水,制备成2μg/ml的内毒素水溶液备用。将plga(80:20)制备成5%(w/v)的二氯甲烷溶液备用。将tpox制备成10%(w/v)的二氯甲烷溶液备用。
将每束熟丝丝束单独称重(ws),浸泡于2μg/ml的内毒素水溶液中10min,冷冻干燥,置于5%(w/v)的plga二氯甲烷溶液中5min,室温风干,在内毒素水溶液中浸泡10min,冷冻干燥,置于5%(w/v)的plga二氯甲烷溶液中5min,室温风干,如此重复多次,即制备出plga促炎纤维(表1)。重复次数等于内毒素被包被的层数(图2)。每层中被包被的内毒素的量,可通过调整内毒素水溶液的浓度而进行调整。
plga包被层的厚度,由同一个步骤中纤维在plga二氯甲烷溶液中浸泡的次数决定,即,将纤维在plga二氯甲烷溶液中浸泡5min,取出,室温风干,将纤维在plga二氯甲烷溶液中浸泡2秒钟,取出,室温风干,将纤维在plga二氯甲烷溶液中浸泡2秒钟,取出,室温风干,如此重复多次,重复的次数越多,单个plga包被层的厚度就越厚。
表1蚕丝纤维缓释载体
在plga抑炎纤维的制备中(表1),将每束熟丝丝束单独称重(ws),浸泡于10%(w/v)的tpox二氯甲烷溶液中5min,取出,室温风干,再次在tpox二氯甲烷溶液中浸泡3秒钟,取出,室温风干。如此重复多次,重复的次数越多,单个tpox层的厚度就越厚(图2)。然后在5%(w/v)的plga二氯甲烷溶液中浸泡3秒钟,取出,室温风干。如此重复多次,重复的次数越多,单个plga层的厚度就越厚(图2)。在plga和tpox溶液中交替浸泡的次数决定蚕丝纤维表面plga和tpox的层数。
在plga/蚕丝纤维的制备中(表1),将每束熟丝丝束单独称重(ws),浸泡于plga二氯甲烷溶液中5min,取出,室温风干,再次在plga二氯甲烷溶液中浸泡3秒钟,取出,室温风干。如此重复多次,重复的次数越多,plga层的厚度就越厚。
在tpox/蚕丝纤维的制备中(表1),将每束熟丝丝束单独称重(ws),浸泡于tpox二氯甲烷溶液中5min,取出,室温风干,再次在tpox二氯甲烷溶液中浸泡3秒钟,取出,室温风干。如此重复多次,重复的次数越多,tpox层的厚度就越厚。
③神经导管的制备:
分别用plga、tpox和内毒素制备神经导管(表2,图2)。取一定量的5%(w/v)的plga二氯甲烷溶液,置于玻璃培养皿中,自然风干,脱膜,裁切成长方形,即制备成plga膜状材料备用。取一定量的10%(w/v)的tpox二氯甲烷溶液,置于玻璃培养皿中,自然风干,脱膜,裁切成长方形,即制备成tpox膜状材料备用。plga或tpox膜的厚度由所加入的溶液的量决定,即,加入的plga或tpox溶液越多,形成的膜越厚。将玻璃棒在酒精喷灯上灼烧,手工拉伸成直径为2mm的玻璃棒备用。
表2神经导管
分别将plga或tpox膜状材料在玻璃棒上卷成管状,用少许二氯甲烷粘合,即制备成plga导管和tpox导管(表2)。管壁的厚度由plga或tpox膜的厚度和卷的层数决定。
取2张plga膜,中间夹上1张tpox膜,将这三种膜一起在玻璃棒上卷成管状,用少许二氯甲烷粘合,即制备成plga抑炎导管(表2)。管壁的厚度由plga和tpox膜的厚度和卷的层数决定。
将plga导管浸泡于2μg/ml的内毒素水溶液中10min,冷冻干燥,置plga二氯甲烷溶液中5min,室温风干,在内毒素水溶液中浸泡10min,冷冻干燥,置于plga二氯甲烷溶液中5min,室温风干,如此重复多次,即制备出plga促炎导管(表2)。重复次数等于内毒素被包被的层数(图2)。每层中被包被的内毒素的量,可通过调整内毒素水溶液的浓度而进行调整。
④内毒素缓释载体的缓释测定
内毒素缓释载体中内毒素初始含量的测定:
建立鲎试剂测定内毒素浓度标的准曲线。分别取一定重量的plga促炎纤维(表1)和plga促炎导管(表2),放置于10ml离心管中,用去离子水定容至8ml,将电动碾磨棒伸入离心管中对材料进行碾磨,离心,取上清液测定容积(v),测定内毒素浓度(a)。按以下公式折算蚕丝纤维缓释载体中内毒素的初始含量(wlps)。
内毒素缓释载体中内毒素的初始含量(wlps)=v×a
内毒素缓释载体形态观察和力学性质测试:
用扫描电子显微镜观察内毒素缓释载体外表形态和横断面结构,用材料力学测试设备对内毒素缓释载体进行拉伸试验,测定断裂强度、断裂伸长率和杨氏模量。
内毒素缓释载体体外降解和缓释性质考察:
用pbs作为降解液,各取1个内毒素缓释载体(plga促炎纤维(表1)和plga促炎导管(表2)),称重(wr),置于玻璃瓶中,加入pbs液,盖上瓶塞,置于生化培养箱中(37℃),在系列时间点以瓶为单位取材。打开瓶盖,吸除降解液,对瓶中的缓释载体用pbs漂洗3次,每次10min,取出内毒素缓释载体,烘干(37℃),称重(wrn)。放置于离心管中,用去离子水定容,将电动碾磨棒伸入离心管中对材料进行碾磨,离心,取上清液测定容积(v),测定内毒素浓度,折算每束蚕丝纤维缓释载体中内毒素的残留量(wlpsn)。按以下公式计算蚕丝纤维缓释载体的降解率(失重率)。
内毒素缓释载体的降解率(%)={[wr-wrn]÷wr}×100%
按以下公式折算每个内毒素释载体中内毒素的累计释放含量(wlpsr)。
内毒素累计释放含量(wlpsr)=内毒素的初始含量(wlps)-内毒素残留量(wlpsn)
以取材时间为横坐标,以降解率为纵坐标,分别绘制plga促炎纤维(表1)和plga促炎导管(表2)的降解曲线,为后续数据分析提供依据。
以取材时间为横坐标,以内毒素累计释放含量(wlpsr)为纵坐标,分别绘制plga促炎纤维(表1)和plga促炎导管(表2)的内毒素缓释曲线,为后续数据分析提供依据。
⑤tpox缓释载体的缓释测定
tpox缓释载体中tpox初始含量的测定:
建立tpox/酪醇(tyrosol)重量关系标准曲线,即分别称取tpox1、5、10、50、100mg,溶解于5ml二氯甲烷中,加入过量双氧水,反应30min,用去离子水定容至10ml,取样,按hplc法,测定酪醇(tyrosol)的含量,建立tpox重量对应的酪醇重量关系标准曲线。
分别取一定重量的plga抑炎纤维、tpox/蚕丝纤维(表1)和plga抑炎导管(表2),放置于10ml离心管中,加入5ml二氯甲烷浸泡30min,加入过量双氧水,反应30min,用碳酸氢钠水溶液定容至10ml,取样,按hplc法,测定酪醇(tyrosol)的含量(b),以上述标准曲线为标准,折算tpox缓释载体中tpox的初始含量(wtpox)。
tpox缓释载体形态观察和力学性质测试:
用扫描电子显微镜观察tpox缓释载体外表形态和横断面结构,用材料力学测试设备对内毒素蚕丝纤维缓释载体进行拉伸试验,测定断裂强度、断裂伸长率和杨氏模量。
tpox缓释载体体外降解和缓释性质考察:
用pbs作为降解液,各取1个tpox缓释载体,称重(wr),置于玻璃瓶中,加入pbs液,盖上瓶塞,置于生化培养箱中(37℃),在系列时间点以瓶为单位取材。打开瓶盖,吸除降解液,对瓶中的缓释载体用pbs漂洗3次,每次10min,取出tpox缓释载体,烘干(37℃),称重(wrn)。放置于离心管中,加二氯甲烷浸泡30min,加入过量双氧水,反应30min,用碳酸氢钠水溶液定容,取样,按hplc法,测定酪醇(tyrosol)的含量,以上述标准曲线为标准,折算tpox缓释载体中tpox的残留量(wtpoxn)。按以下公式计算tpox缓释载体的降解率(失重率)。
tpox缓释载体的降解率(%)={[wr-wrn]÷wr}×100%
按以下公式折算tpox缓释载体中tpox的累计释放含量(wtpoxr)。
tpox累计释放含量(wtpoxr)=tpox的初始含量(wtpox)-内毒素残留量(wtpoxn)
以取材时间为横坐标,以降解率为纵坐标,分别绘制plga抑炎纤维、tpox/蚕丝纤维(表1)和plga抑炎导管(表2)的降解曲线,为后续数据分析提供依据。
以取材时间为横坐标,以tpox累计释放剂量(wtpoxr)为纵坐标,分别绘制plga抑炎纤维、tpox/蚕丝纤维(表1)和plga抑炎导管(表2)的tpox缓释曲线,为后续数据分析提供依据。
⑥人工神经移植体的制备:
分别将表1中的蚕丝纤维缓释载体和表2中的神经导管进行组合,组装成人工神经移植体(表3),进行后续实验。
表3人工神经移植体
实施例2移植体在皮下的降解效果和神经缺损修复的降解和修复再生效果考察
1)移植体在大鼠皮下降解及其相关机理考察
皮下埋植:
分别将表3中的材料在sd大鼠皮下进行埋植,在系列时间点取材进行后续实验。
实验包括:内毒素缓释载体中内毒素释放性质考察、tpox缓释载体中tpox释放性质考察、蚕丝纤维的降解率考察、蚕丝纤维降解过程中形态和力学性质变化考察、涂片观察、组织切片观察、转录组分析等。
2)移植体在大鼠坐骨神经缺损修复中降解及其对神经再生的影响
建立大鼠坐骨神经10mm缺损动物模型,以表3中未用“*”标记的神经导管和蚕丝纤维组合方式所组装的人工神经为材料,桥接大鼠坐骨神经10mm缺损部位。在系列时间点取材进行下述实验。
进行蚕丝纤维的降解率分析,蚕丝纤维降解过程中形态和力学性质变化考察,内毒素缓释载体中内毒素释放性质考察,tpox缓释载体中tpox释放性质考察,以及蚕丝纤维的形态结构和力学性质变化规律考察。
在涂片和组织切片观察中,考察白细胞细胞、m1和m2型巨噬细胞、成纤维细胞、许旺氏细胞和轴突的数量和相对比例,随不同处理和处理时间的变化规律。
在转录组分析中,考察轴突导向途径中相关分子表达量,随不同处理和处理时间的变化规律。检测手术肢感觉和运动功能恢复程度,以评价蚕丝人工神经修复大鼠坐骨神经缺损的效果。
最后说明的是,以上实施例仅用以说明本发明的技术方案而非限制,尽管参照较佳实施例对本发明进行了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的宗旨和范围,其均应涵盖在本发明的权利要求范围当中。
- 还没有人留言评论。精彩留言会获得点赞!