膀胱内施用用于治疗膀胱疼痛的组合物的制作方法
本发明涉及一种包含顺式-(e)-4-(3-氟苯基)-2’,3’,4’,9’-四氢-n,n-二甲基-2’-(1-氧代-3-苯基-2-丙烯基)-螺[环己烷-1,1’[1h]-吡啶并[3,4-b]吲哚]-4-胺的药物组合物。所述药物组合物适用于局部施用,尤其适用于膀胱疼痛治疗中的膀胱内施用。
膀胱疼痛综合征(bps)(也称为间质性膀胱炎)是影响膀胱的一种类型的慢性疼痛。症状包括经常感觉到需要排尿以及性行为疼痛。bps与抑郁和生活质量低相关。许多罹患bps的患者也患有肠易激综合征和纤维肌痛。
bps的病因未知而且尚无针对bps的治愈方法。可改善症状的常规治疗包括改变生活方式、药物治疗或手术。改变生活方式可包括停止吸烟和减轻压力。药物治疗可包括布洛芬、戊聚糖多硫酸盐或阿米替林。手术可包括膀胱扩张、神经刺激或外科手术。
美国泌尿外科学会(americanurologicalassociation)基于一致意见发布了针对bps诊断和治疗的准则,包括以下治疗:
一线治疗:患者教育、自我照料(饮食调节)、压力管理;
二线治疗:物理治疗、口服药物(阿米替林、西咪替丁或羟嗪、戊聚糖多硫酸盐)、膀胱灌注(dmso、肝素或利多卡因);三线治疗:治疗亨纳溃疡(hunner'sulcer)(激光、电灼疗法或曲安西龙注射)、水扩张(压力低、持续时间短);
四线治疗:神经调节(骶神经或阴部神经);
五线治疗:环孢霉素a、肉毒杆菌毒素(btx-a);以及
六线治疗:外科手术介入(尿流改道、扩大、膀胱切除术)
aua准则也列举了若干种不连续治疗,包括:长期口服抗生素、膀胱内卡介苗(bacilluscalmetteguerin)、膀胱内树胶脂毒素(resiniferatoxin)、高压和长持续时间水扩张以及全身性糖皮质激素。
膀胱滴注药物是bps的一种形式的治疗。在膀胱滴注制剂中通常使用单一药物或药物混合物。此类制剂通常是水性的并且必须在确保最终产品无菌的条件下制备。
用于治疗bps的膀胱滴注中所用的剂包括:dmso、肝素、利多卡因、硫酸软骨素、透明质酸、戊聚糖多硫酸盐、奥昔布宁(oxybutynin)以及肉毒杆菌毒素a。初步证据表明,这些剂可有效减轻bps的症状。已证实阿米替林在许多bps患者中有效减轻诸如慢性骨盆痛和夜尿症的症状。发现抗抑郁剂度洛西汀(duloxetine)作为治疗无效,尽管已知其可缓解神经性疼痛(ch.papandreou等人advancesinurology.2009:1–9)。钙调磷酸酶抑制剂环孢霉素a因其免疫抑制特性已被研究作为bps的治疗。一项前瞻性的随机研究发现,环孢霉素a在治疗bps症状方面将比戊聚糖多硫酸盐更有效,但也具有更多不良作用。据信口服戊聚糖多硫酸盐可修复膀胱的保护性葡糖胺聚糖涂层,但研究在试图确定所述作用与安慰剂相比是否具有统计学显著性时遭遇到复杂的结果。
根据先前技术,针对bps的治疗选择在各个方面均未令人满意,并且因此需要用于治疗bps的新药物。
由wo2012/013343已知,药理学活性成分顺式-(e)-4-(3-氟苯基)-2’,3’,4’,9’-四氢-n,n-二甲基-2’-(1-氧代-3-苯基-2-丙烯基)-螺[环己烷-1,1’[1h]-吡啶并[3,4-b]吲哚]-4-胺是一种止痛剂。
顺式-(e)-4-(3-氟苯基)-2’,3’,4’,9’-四氢-n,n-二甲基-2’-(1-氧代-3-苯基-2-丙烯基)-螺[环己烷-1,1’[1h]-吡啶并[3,4-b]吲哚]-4-胺的水溶性较差并且即使在常规溶解性增强剂存在下,水溶液中的浓度仍较低。此外,顺式-(e)-4-(3-氟苯基)-2’,3’,4’,9’-四氢-n,n-二甲基-2’-(1-氧代-3-苯基-2-丙烯基)-螺[环己烷-1,1’[1h]-吡啶并[3,4-b]吲哚]-4-胺对化学分解敏感,以使得水溶液的储存稳定性差且保质期短。
本发明的目标在于提供可用于改善与间质性膀胱炎相关的疾患和症状,尤其可用于治疗膀胱疼痛综合征(由于间质性膀胱炎引起的疼痛)并且与先前技术相比具有优点的药物组合物。此外,本发明的目标在于提供顺式-(e)-4-(3-氟苯基)-2’,3’,4’,9’-四氢-n,n-二甲基-2’-(1-氧代-3-苯基-2-丙烯基)-螺[环己烷-1,1’[1h]-吡啶并[3,4-b]吲哚]-4-胺或其生理学上可接受的盐的药物组合物,其可用于局部施用,优选膀胱内施用,并且与先前技术相比具有优点。所述药物组合物应含有足够高浓度的溶解形式的顺式-(e)-4-(3-氟苯基)-2’,3’,4’,9’-四氢-n,n-二甲基-2’-(1-氧代-3-苯基-2-丙烯基)-螺[环己烷-1,1’[1h]-吡啶并[3,4-b]吲哚]-4-胺,应符合无菌制剂的要求且应具有足够的储存稳定性和保质期。
这些目标已由专利权利要求的主题来实现。
已令人惊讶地发现,可制备药物组合物,所述药物组合物含有足够高浓度的顺式-(e)-4-(3-氟苯基)-2’,3’,4’,9’-四氢-n,n-二甲基-2’-(1-氧代-3-苯基-2-丙烯基)-螺[环己烷-1,1’[1h]-吡啶并[3,4-b]吲哚]-4-胺或其生理学上可接受的盐(下文中也称为“api”)并且可用于改善与间质性膀胱炎相关的疾患和症状,尤其可用于治疗膀胱疼痛综合征(由于间质性膀胱炎引起的疼痛)。根据本发明的药物组合物可以稳定无菌组合物的形式提供,其在膀胱内施加后由患者良好耐受。
尽管api在水中的溶解度低,但已发现可并入溶液中的溶解度增强赋形剂。
已令人惊讶地发现,某些赋形剂和缓冲剂组合可用于制备具有可接受的恢复和稳定特性的api的水性药物组合物。此外,已令人惊讶地发现,api的稳定性随赋形剂浓度而变化,而api的溶解度随ph值和赋形剂浓度而变化。此外,已令人惊讶地发现,api经受光诱导的降解,并且琥珀色玻璃容器与其他初级封装材料相比具有优点。
为增强所述组合物的抗氧化性,评估存在抗坏血酸作为抗氧化剂且存在氮气作为保护性气体。然而,存在抗坏血酸与氮气两者并未导致稳定性增加的迹象。抗坏血酸由于出现ph变化而使得必需进行ph调节,并且此外对25℃下的稳定性产生不利影响。
通过高压灭菌实验来评估药物组合物的稳定性,其中将所述组合物在121℃和2巴下处理20分钟。
此外,已发现通过采用微粉化api可制备有利的药物组合物,尤其关于api的改善的溶解率而言。用于制备药物组合物的方法可在无菌条件下进行,优选通过制备api与赋形剂的熔体,随后向所述熔体中添加水性缓冲剂并且经由膜过滤器过滤。
本发明的第一方面涉及一种水性药物组合物,其包含浓度为至少5.0μg/ml、更优选至少10μg/ml、更优选至少20μg/ml的顺式-(e)-4-(3-氟苯基)-2’,3’,4’,9’-四氢-n,n-二甲基-2’-(1-氧代-3-苯基-2-丙烯基)-螺[环己烷-1,1’[1h]-吡啶并[3,4-b]吲哚]-4-胺或其生理学上可接受的盐。
根据本发明的药物组合物含有api顺式-(e)-4-(3-氟苯基)-2’,3’,4’,9’-四氢-n,n-二甲基-2’-(1-氧代-3-苯基-2-丙烯基)-螺[环己烷-1,1’[1h]-吡啶并[3,4-b]吲哚]-4-胺,其具有以下结构:
或其生理学上可接受的盐。
api的生理学上可接受的盐包括但不限于柠檬酸盐和盐酸盐。优选地,api以非盐形式,即以其游离碱形式包含于药物组合物中。尽管如此,技术人员意识到,取决于药物组合物成分及药物组合物的ph值,可原位形成酸加成盐。在根据本发明的药物组合物的制备过程中,优选以非盐形式,即以其游离碱形式添加api。
除非另外明确表述,否则所有百分比均为wt.-%。此外,除非另外明确表述,否则api的所有重量和百分比均以相对于非盐形式api的重量的当量来表述。除非另外明确表述,否则所有性质均在50%相对湿度和23℃下测定。
根据本发明的药物组合物是水性的。优选地,所述药物组合物在室温下为液体,优选低粘度的液体。优选地,所述药物组合物的水含量为至少90wt.-%,更优选至少95wt.-%,且最优选至少97wt.-%,在每种情况下均相对于所述组合物的总重量而言。
除水以外,根据本发明的组合物可含有其他溶剂。其他合适的溶剂包括所有类型的生理学上可接受的亲水性溶剂,优选选自由乙醇、甘油、丙二醇、1,3-丁二醇和聚乙二醇300组成的组。
然而,优选地,水为根据本发明的药物组合物中所含的唯一溶剂。
优选地,根据本发明的药物组合物适合于局部施用,优选膀胱内施用,并且因此满足对此类组合物的调节要求。优选地,所述药物组合物在无菌条件下制备且因此可被认为是无菌的。
根据本发明的药物组合物含有浓度为至少5.0μg/ml、更优选至少10μg/ml、更优选至少20μg/ml的api。
所述药物组合物可含有呈溶解形式、分散形式(悬浮和/或乳化)或其组合形式的api。为本说明书的目的,浓度涉及非固相、优选液体水相的组合物中所含的api的量。优选地,所述组合物由这种液体水相组成。
因此,如果药物组合物例如应为在api沉淀物(固相)上的水性顶部溶液(液体水相)形式的饱和溶液,则仅有实际上溶解(或分散)量的在液体水相中所含的api构成浓度。如果药物组合物例如应为悬浮液,其中api悬浮于液体水相中,则悬浮api的量构成浓度。同样,如果药物组合物例如应为乳液,其中api乳化于液体水相中,则乳化api的量构成浓度。
优选地,本发明的药物组合物中所含的总量的api在23℃下溶解。
优选地,在用裸眼观察时,所述药物组合物在23℃下为透明的,即非混浊或非不透明的。
在优选的实施方案中,药物组合物中的api的浓度为至少30μg/ml、或至少40μg/ml、或至少50μg/ml、或至少60μg/ml、或至少70μg/ml、或至少80μg/ml、或至少90μg/ml、或至少100μg/ml、或至少110μg/ml、或至少120μg/ml、或至少130μg/ml、或至少140μg/ml、或至少150μg/ml、或至少160μg/ml、或至少170μg/ml、或至少180μg/ml、或至少190μg/ml或至少200μg/ml。
在优选的实施方案中,药物组合物中的api的浓度为至多300μg/ml、或至多290μg/ml、或至多280μg/ml、或至多270μg/ml、或至多260μg/ml、或至多250μg/ml、或至多240μg/ml、或至多230μg/ml、或至多220μg/ml、或至多210μg/ml、或至多200μg/ml、或至多190μg/ml、或至多180μg/ml、或至多170μg/ml、或至多160μg/ml或至多150μg/ml。
在优选的实施方案中,药物组合物中的api浓度在40±30μg/ml、或60±30μg/ml、或80±50μg/ml、或80±30μg/ml、或100±50μg/ml、或100±30μg/ml、或120±100μg/ml、或120±50μg/ml、或120±30μg/ml、或140±100μg/ml、或140±50μg/ml、或140±30μg/ml、或160±100μg/ml、或160±50μg/ml、或160±30μg/ml、或180±100μg/ml、或180±50μg/ml、或180±30μg/ml、或200±100μg/ml、或200±50μg/ml或200±30μg/ml的范围内。
优选地,在给定条件下(ph相同,剩余成分的性质和含量相同),药物组合物中的api浓度在23℃时的饱和溶液浓度的60%至100%、更优选65%至95%、还更优选70%至90%、还更优选75%至85%的范围内。例如,当api饱和溶液在给定条件下的浓度为188μg/ml时,所述饱和溶液浓度的60%至100%的范围意指112.8μg/ml(即,188μg/ml的60%)至188μg/ml(即,188μg/ml的100%)的范围内的浓度。
在优选的实施方案中,根据本发明的药物组合物具有至少ph2.0、或至少ph2.5、或至少ph3.0、或至少ph3.5、或至少ph4.0、或至少ph4.5的ph值。
在优选的实施方案中,根据本发明的药物组合物具有至多ph8.0、或至多ph7.5、或至多ph7.0、或至多ph6.5、或至多ph6.0或至多ph5.5的ph值。
优选地,所述药物组合物的ph值在ph2.0至ph12、更优选ph2.5至ph8、还更优选ph3.0至ph7.0、还更优选ph3.5至ph6.5、最优选ph4.0至ph6.0且特别是ph4.5至ph5.5的范围内。
已令人惊讶地发现,约ph4至约ph6范围内的ph值在一方面api的溶解度与另一方面其化学稳定性之间提供特别有益的折衷。
优选地,根据本发明的组合物经缓冲,即分别含有一种或多种缓冲剂和缓冲系统(即,共轭酸碱对)。优选的缓冲系统源自以下酸:有机酸,诸如乙酸、丙酸、马来酸、富马酸、乳酸、丙二酸、苹果酸、扁桃酸、柠檬酸、酒石酸、琥珀酸;或无机酸,诸如磷酸。当缓冲系统源自以上任何酸时,缓冲系统由所述酸与其共轭碱组成。源自乙酸、柠檬酸、乳酸、琥珀酸或磷酸的缓冲系统是特别优选的,源自磷酸的缓冲剂是尤其优选的。
已令人惊讶地发现,在相同ph值下,源自磷酸的缓冲剂(磷酸盐缓冲剂)与源自柠檬酸的缓冲剂(柠檬酸盐缓冲剂)相比具有优点。
技术人员充分意识到,多质子酸可形成多于一种的缓冲系统。例如,磷酸为三质子酸,因此其形成共轭酸碱对磷酸-磷酸二氢盐、磷酸二氢盐-磷酸氢盐和磷酸氢盐-磷酸盐。换言之,磷酸、磷酸二氢盐和磷酸氢盐中的任一者均可为具有共轭碱的缓冲系统的酸。为本说明书的目的,表述“分别缓冲剂和缓冲系统”优选是指酸与其共轭碱两者的量。此外,技术人员充分意识到,缓冲系统,例如共轭系统磷酸/磷酸二氢钾可通过添加磷酸与适当量的氢氧化钾、或磷酸钾与适当量的磷酸、或磷酸与磷酸二氢钾本身产生。
优选地,分别优选源自磷酸的缓冲剂和缓冲系统的浓度经调节以提供足够的缓冲能力。
在一个优选的实施方案中,分别优选源自磷酸的缓冲剂和缓冲系统的含量基于组合物的总重量计在0.0001wt.-%至5.0wt.-%、更优选0.0002wt.-%至2.5wt.-%、还更优选0.0005wt.-%至1.0wt.-%、还更优选0.001wt.-%至0.5wt.-%、最优选0.005wt.-%至0.25wt.-%且特别是0.01wt.-%至0.1wt.-%的范围内。
根据本发明的药物组合物优选地包含选自抗氧化剂、表面活性剂和具有抗氧化性质的表面活性剂(具有两亲性质的抗氧化剂)的赋形剂。因此,赋形剂可用于多于一种目的。在一个实施方案中,药物组合物包含抗氧化剂和/或表面活性剂,二者彼此不同。在另一个实施方案中,药物组合物包含一种赋形剂,所述赋形剂为具有抗氧化性质的表面活性剂(即,或者可视为具有两亲性质的抗氧化剂)。
为本说明书的目的,术语“表面活性剂”是指具有两亲性质的任何化合物,因为其含有至少一个疏水基团和至少一个亲水基团。优选地,表面活性剂含有至少一个末端疏水基团(尾)和至少一个末端亲水基团(头)。疏水基团优选地选自由烃基、烷基醚基团、氟碳化合物基团和硅氧烷基团组成的组。
在一个优选的实施方案中,赋形剂含有至少一个包含至少3个碳原子、更优选至少4个碳原子、还更优选至少6个碳原子、还更优选6至30个碳原子且最优选8至24个碳原子的脂族基团。脂族基团可为饱和或不饱和、分枝或未分枝(直链)、末端或内部脂族基团。
优选地,赋形剂包含聚乙二醇残基。
优选地,赋形剂含有至少一个衍生自饱和或不饱和脂肪酸或饱和或不饱和脂肪醇的基团,所述基团优选地为醚基团、羧酸酯基团或硫酸酯基团。优选地,饱和或不饱和的脂肪酸或脂肪醇含有至少6个碳原子、还更优选6至30个碳原子且最优选8至24个碳原子。
在一个优选的实施方案中,赋形剂含有至少一个衍生自饱和或不饱和脂肪酸、优选c6至c30脂肪酸、更优选c8至c24脂肪酸且最优选c12至c22脂肪酸的基团。合适脂肪酸的实例为月桂酸、肉豆蔻酸、棕榈酸、硬脂酸、花生酸、山嵛酸、木蜡酸、12-羟基硬脂酸、油酸以及蓖麻油酸。
在另一个优选的实施方案中,赋形剂含有至少一个衍生自饱和或不饱和脂肪醇、优选c6至c30脂肪醇、更优选c8至c24脂肪醇且最优选c12至c22脂肪醇的基团。合适脂肪醇的实例为鲸蜡醇、硬脂醇、2-辛基十二烷-1-醇以及2-己基癸烷-1-醇。
优选地,赋形剂具有至多20,000g/mol、更优选至多15,000g/mol、还更优选至多10,000g/mol、还更优选至多5,000g/mol、甚至更优选至多4,000g/mol、最优选至多3,000g/mol,且特别是在100g/mol至2,500g/mol、优选1000g/mol至2000g/mol范围内的分子量。
在一个优选的实施方案中,药物组合物含有单一赋形剂。在另一个优选的实施方案中,药物组合物含有两种或更多种赋形剂的混合物。
优选地,药物组合物含有亲水亲油平衡值(hlb)为至少8或至少9的赋形剂。更优选地,亲水亲油平衡值(hlb)为至少10、或至少11、或至少12;和/或至多18、或至多17、或至多16。最优选地,亲水亲油平衡值(hlb)在9至18、优选10至17、更优选11至16、还更优选12至15的范围内。
在一个优选的实施方案中,赋形剂的hlb值在10±3、或10±2、或10±1、或11±3、或11±2、或11±1、或12±3、或12±2、或12±1、或13±3、或13±2、或13±1、或14±3、或14±2、或14±1或15±3、或15±2、或15±1、或16±3、或16±2、或16±1、或17±3、或17±2或17±1的范围内。
赋形剂可为离子性的、两性的或非离子性的。
在一个优选的实施方案中,药物组合物含有离子性赋形剂,特别是阴离子性赋形剂。
合适的阴离子性赋形剂包括但不限于硫酸酯类,诸如月桂基硫酸钠(十二烷基硫酸钠,例如
优选地,阴离子性赋形剂具有通式(i)
cnh2n+1o-so3-m+(i),
其中n为8至30、优选10至24、更优选12至18的整数;并且m是选自li+、na+、k+、nh4+1/2mg2+以及1/2ca2+。
其他合适的阴离子性赋形剂包括胆酸盐,包括甘胆酸钠(例如,
在另一个优选的实施方案中,药物组合物含有非离子性赋形剂。合适的非离子性赋形剂包括但不限于
-脂肪醇类,其可为直链或支链,诸如鲸蜡醇、硬脂醇、鲸蜡硬脂醇、2-辛基十二烷-1-醇以及2-己基癸烷-1-醇;
-固醇类,诸如胆固醇;
-脱水山梨糖醇的部分脂肪酸酯,诸如脱水山梨糖醇单月桂酸酯、脱水山梨糖醇单棕榈酸酯、脱水山梨糖醇单硬脂酸酯、脱水山梨糖醇三硬脂酸酯、脱水山梨糖醇单油酸酯、脱水山梨糖醇倍半油酸酯以及脱水山梨糖醇-三油酸酯;
-聚氧乙烯脱水山梨糖醇的部分脂肪酸酯(聚氧乙烯-脱水山梨糖醇-脂肪酸酯),优选聚氧乙烯脱水山梨糖醇的脂肪酸单酯、聚氧乙烯脱水山梨糖醇的脂肪酸二酯或聚氧乙烯脱水山梨糖醇的脂肪酸三酯;例如单-和三-月桂基、棕榈基、硬脂基以及油基酯,诸如以名称“polysorbat”已知和以商标名称“tween”可商购的类型,包括
其中(w+x+y+z)在15至100、优选16至80、更优选17至60、还更优选18至40且最优选19至21的范围内;
并且亚烷基为包含6至30个碳原子、更优选8至24个碳原子且最优选10至16个碳原子的任选不饱和的亚烷基;
-聚氧乙烯甘油脂肪酸酯,诸如甘油单酯、二酯和三酯与具有200至4000g/mol范围内的分子量的聚乙二醇(macrogol)的二酯和单酯的混合物,例如聚乙二醇辛酰基癸酸甘油酯、聚乙二醇月桂酸甘油酯、聚乙二醇-椰油酸甘油酯、聚乙二醇-亚油酸甘油酯、聚乙二醇-20-单硬脂酸甘油酯、聚乙二醇-6-辛酰基癸酸甘油酯、聚乙二醇-油酸甘油酯;聚乙二醇硬脂酸甘油酯、聚乙二醇羟基硬脂酸甘油酯(例如,
-聚氧乙烯脂肪酸酯,优选具有约8至约18个碳原子的脂肪酸,例如聚乙二醇油酸酯、聚乙二醇硬脂酸酯、聚乙二醇-15-羟基硬脂酸酯、12-羟基硬脂酸的聚氧乙烯酯,诸如以商标名称“solutolhs15”已知且可商购的类型;优选根据通式(iii)
ch3ch2-(och2ch3)n-o-co-(ch2)mch3(iii)
其中n为6至500、优选7至250、更优选8至100、还更优选9至75、还更优选10至50、甚至更优选11至30、最优选12至25且特别13至20的整数;并且
其中m为6至28、更优选6至26、还更优选8至24、还更优选10至22、甚至更优选12至20、最优选14至18且特别16的整数;
-聚氧乙烯脂肪醇醚类,例如聚乙二醇鲸腊基硬脂基醚、聚乙二醇月桂基醚、聚乙二醇-油基醚、聚乙二醇硬脂基醚;
-聚氧丙烯-聚氧乙烯嵌段共聚物(泊洛沙姆);
-蔗糖的脂肪酸酯;例如蔗糖二硬脂酸酯、蔗糖二油酸酯、蔗糖二棕榈酸酯、蔗糖单硬脂酸酯、蔗糖单油酸酯、蔗糖单棕榈酸酯、蔗糖单肉豆蔻酸酯以及蔗糖单月桂酸酯;
-聚甘油的脂肪酸酯,例如聚油酸甘油酯;
-α-生育酚琥珀酸酯的聚氧乙烯酯,例如d-α-生育酚-peg-1000-琥珀酸酯(tpgs);
-聚乙二醇甘油酯,诸如以商标名称“gelucire44/14”、“gelucire50/13”和“labrasol”已知且可商购的类型;
-天然或氢化蓖麻油与氧化乙烯的反应产物,诸如以商标名称“cremophor”已知且可商购的各种液体表面活性剂;以及
-多官能醇的部分脂肪酸酯,诸如甘油脂肪酸酯,例如单-和三-月桂基、棕榈基、硬脂基以及油基酯,例如单硬脂酸甘油酯、单油酸甘油酯,例如以商标名称“peceol”已知且可商购的单油酸甘油酯40;二山嵛酸甘油酯、二硬脂酸甘油酯、单亚油酸甘油酯;单硬脂酸乙二醇酯、单棕榈基硬脂酸乙二醇酯、单硬脂酸季戊四醇酯。
根据本发明的药物组合物中所含的此类尤其优选的赋形剂为亲水亲油平衡值(hlb)为至少8的非离子性赋形剂,特别是hlb值为至少9的非离子性赋形剂,更特别是hlb值在12和15以内的非离子性赋形剂。
在一个优选的实施方案中,赋形剂的含量基于药物组合物的总重量计为至少0.001wt.-%或至少0.005wt.-%、更优选至少0.01wt.-%或至少0.05wt.-%、还更优选至少0.1wt.-%、至少0.2wt.-%或至少0.3wt.-%、还更优选至少0.4wt.-%、至少0.5wt.-%或至少0.6wt.-%,并且特别是至少0.7wt.-%、至少0.8wt.-%、至少0.9wt.-%或至少1.0wt.-%。
在一个优选的实施方案中,赋形剂为抗氧化剂。优选的抗氧化剂包括但不限于抗坏血酸、丁基化羟基苯甲醚(bha)、丁基化羟基甲苯(bht)、抗坏血酸盐、单硫代甘油、亚磷酸、维生素c、维生素e以及其衍生物、苯甲酸松柏酯、去甲二氢愈创木酸、没食子酸(gallusacid)酯、亚硫酸氢钠,特别优选为维生素e及其衍生物。
在一个优选的实施方案中,赋形剂为维生素e衍生物,即包含优选连接至不属于天然维生素e的另一残基的维生素e残基。优选地,所述另一残基为可通过琥珀酸酯共价连接至维生素e残基的聚乙二醇残基。这种类型的维生素e衍生物(琥珀酸酯二酯)也称为维生素e聚乙二醇琥珀酸酯,其为根据本发明特别优选的赋形剂。
维生素e聚乙二醇琥珀酸酯是根据本发明的赋形剂的一种实例,其为具有抗氧化性质的表面活性剂(即,或者可视为具有两亲性质的抗氧化剂)。
赋形剂的浓度通常取决于药物组合物中所需的api浓度。
在优选的实施方案中,赋形剂(优选维生素e聚乙二醇琥珀酸酯)的浓度为至少0.01wt.-%、或至少0.05wt.-%、或至少0.1wt.-%、或至少0.2wt.-%、或至少0.3wt.-%、或至少0.4wt.-%、或至少0.5wt.-%、或至少0.6wt.-%、或至少0.7wt.-%、或至少0.8wt.-%、或至少0.9wt.-%、或至少1.0wt.-%、或至少1.1wt.-%、或至少1.2wt.-%、或至少1.3wt.-%、或至少1.4wt.-%或至少1.5wt.-%;在每种情况下均相对于所述组合物的总重量计。
在优选的实施方案中,赋形剂(优选维生素e聚乙二醇琥珀酸酯)的浓度为至多5.0wt.-%、或至多4.5wt.-%、或至多4.0wt.-%、或至多3.9wt.-%、或至多3.8wt.-%、或至多3.7wt.-%、或至多3.6wt.-%、或至多3.5wt.-%、或至多3.4wt.-%、或至多3.3wt.-%、或至多3.2wt.-%、或至多3.1wt.-%、或至多3.0wt.-%、或至多2.9wt.-%、或至多2.8wt.-%、或至多2.7wt.-%、或至多2.6wt.-%或至多2.5wt.-%。
优选地,赋形剂(优选维生素e聚乙二醇琥珀酸酯)的浓度在0.1wt.-%至5.0wt.-%、优选0.5wt.-%至4.0wt.-%、更优选1.0wt.-%至3.0wt.-%的范围内;在每种情况下均相对于所述组合物的总重量计。
根据本发明的药物组合物可含有常规用于制备水性药物组合物且为技术人员已知的另外药物辅助物质,诸如等渗剂、防腐剂、粘度增强剂、螯合剂等。
优选地,所述组合物不含任何防腐剂。为本说明书的目的,“防腐剂”优选地是指通常添加至药物组合物中以保护它们免于微生物降解或微生物生长的任何物质。在此方面,微生物生长通常具有重要作用,即防腐剂用于避免微生物污染的重要目的。另一方面,也可能需要避免微生物分别对活性成分和赋形剂的任何作用,即避免微生物降解。
防腐剂的代表性实例包括苯扎氯铵、苄索氯铵、苯甲酸、苯甲酸钠、苯甲醇、溴硝醇、西曲溴铵(cetrimide)、氯化十六烷基吡啶、氯己啶、氯丁醇、氯甲酚、氯二甲酚、甲酚、乙醇、甘油、海克替啶(hexetidine)、咪脲(imidurea)、苯酚、苯氧基乙醇、苯基乙醇、苯基硝酸汞、丙二醇、丙酸钠、硫柳汞、对羟基苯甲酸甲酯、对羟基苯甲酸乙酯、对羟基苯甲酸丙酯、对羟基苯甲酸丁酯、对羟基苯甲酸异丁酯、对羟基苯甲酸苄酯、山梨酸以及山梨酸钾。
优选地,根据本发明的药物组合物基本上由以下组成:
-水;
-api;
-缓冲剂,优选源自磷酸;
-赋形剂,优选为维生素e聚乙二醇琥珀酸酯;以及
-任选地,可溶解于液体中的气体。
根据ich准则,优选为在2017年有效的版本,根据本发明的药物组合物优选具有至少6个月的储存稳定性。
根据ich和fda准则,通常接受的用于确定药物稳定性的加速测试涉及(例如在其容器和封装中)储存含有所述药物的药物组合物。根据ich准则,应在40℃±2℃下、在75%rh±5%下对药物组合物进行所谓加速储存测试持续最少6个月的时间。另外,应在25℃±2℃下、在不小于60%rh±5%下对药物组合物进行所谓长期储存测试持续最少12个月的时间。如果在6个月时间期间满足加速储存测试和长期储存测试条件的所有标准,则长期储存测试可缩短至6个月且相应数据加倍以获得12个月的估计数据。
在储存期间,以规定时间间隔取出药物组合物样品且就其药物含量、是否存在杂质以及(如果适用)其他参数方面进行分析。根据ich准则,在所有样品中,药物纯度应≥98%,药物含量应为95%-105%(fda准则:90%-110%)。
在一个优选的实施方案中,药物组合物在密封玻璃容器中在长期储存条件下(25℃和60%相对湿度)储存6个月后,api的降解率不超过2.0%、更优选1.5%、还更优选1.0%且最优选0.5%。
在另一个优选的实施方案中,药物组合物在密封玻璃容器中在加速储存条件下(40℃和75%相对湿度)储存6个月后,api的降解率不超过4%、更优选3%、还更优选2%、还更优选1%且最优选0.5%。
本发明的另一方面涉及如上文所述的根据本发明的水性药物组合物,其用于改善与间质性膀胱炎相关的疾患和症状,尤其用于治疗膀胱疼痛综合征。在此方面,本发明还涉及api用于制造如上文所述的根据本发明的水性药物组合物的用途,所述水性药物组合物用于改善与间质性膀胱炎相关的疾患和症状,尤其用于治疗膀胱疼痛综合征。此外,本发明还涉及一种改善与间质性膀胱炎相关的疾患和症状,尤其用于治疗膀胱疼痛综合征的方法,所述方法包括向有需要的受试者施用如上文所述的根据本发明的水性药物组合物。
本发明的另一方面涉及顺式-(e)-4-(3-氟苯基)-2’,3’,4’,9’-四氢-n,n-二甲基-2’-(1-氧代-3-苯基-2-丙烯基)-螺[环己烷-1,1’[1h]-吡啶并[3,4-b]吲哚]-4-胺或其生理学上可接受的盐,或涉及包含顺式-(e)-4-(3-氟苯基)-2’,3’,4’,9’-四氢-n,n-二甲基-2’-(1-氧代-3-苯基-2-丙烯基)-螺[环己烷-1,1’[1h]-吡啶并[3,4-b]吲哚]-4-胺或其生理学上可接受的盐的药物制剂,任一情况下均用于改善与间质性膀胱炎相关的疾患和症状,尤其用于治疗膀胱疼痛综合征。
优选地,根据本发明的药物组合物经局部施用;优选地膀胱内施用。
优选地,根据本发明的药物组合物每日一次或以更小频率施用,例如每周两次或每周一次施用。
本发明的另一方面涉及一种包括如上文所述的根据本发明的水性药物组合物的容器。
优选地,所述容器为透明玻璃容器或琥珀色玻璃容器,任一情况下所述容器均可覆盖有铝箔。
本发明的另一方面涉及一种用于制备如上文所述的根据本发明的水性药物组合物的方法,所述方法包括以下步骤:
(a)通过在高温下将api与赋形剂混合来制备预混物;以及
(b)将步骤(a)中获得的预混物与任选含有缓冲剂的水性组合物混合,由此提供所述药物组合物。
优选地,步骤(a)在高于赋形剂的熔融温度的温度下进行,以使得预混物成为熔体。优选地,所述温度在50℃至80℃的范围内、更优选在55℃至75℃的范围内、还更优选在60℃至70℃的范围内。
优选地,在步骤(a)中采用微粉化形式的api。已令人惊讶地发现,当采用微粉化形式的api且通过在高温下将api与赋形剂混合来制备优选为熔体的预混物、且随后向所述预混物添加水性缓冲剂时,可实现在令人满意的时段内以工业规模上令人满意的结果制备根据本发明的水性药物组合物。
优选地,api具有具备以下特征的粒度分布:
-d10值为至多20μm、优选至多15μm、更优选至多10μm、还更优选至多5.0μm;和/或
-d50值为至多50μm、优选至多30μm、更优选至多10μm、还更优选至多5.0μm;和/或
-d90值为至多100μm、优选至多50μm、更优选至多25μm、还更优选至多10μm。
优选地,api具有具备以下特征的粒度分布:
-d10值在0.15μm至1.05μm的范围内、优选在0.30μm至0.90μm的范围内、更优选在0.45μm至0.75μm的范围内;和/或
-d50值在0.30μm至2.10μm的范围内、优选在0.60μm至1.80μm的范围内、更优选在0.90μm至1.50μm的范围内;和/或
-d90值在0.50μm至4.00μm的范围内、优选在1.00μm至3.50μm的范围内、更优选在1.50μm至3.00μm的范围内。
技术人员已知用于确定粒度分布的合适方法。优选地,粒度分布通过激光衍射,优选通过优选以干燥模式操作的malvern粒度分析仪,例如malvernmastersizer3000来测定。
优选地,根据本发明的方法包括以下额外步骤:
(c)将步骤(b)中获得的药物组合物封装于容器中;以及
(d)任选地,对含有所述药物组合物的容器进行高压灭菌。
优选地,根据本发明的方法的所有步骤在无菌条件下进行。
以下实施例进一步说明本发明,但不应理解为限制本发明的范围:
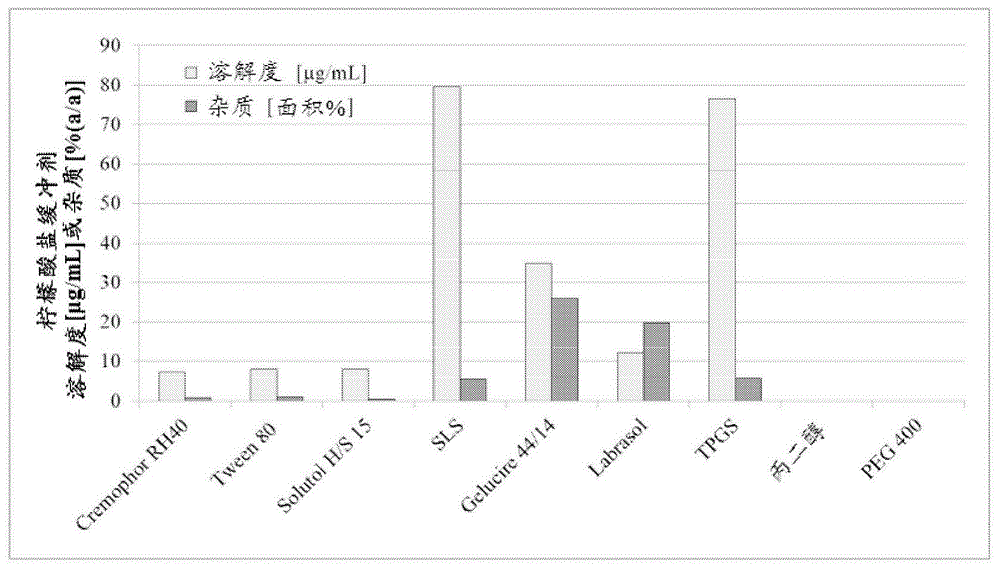
实施例1:-各种赋形剂在ph4.5的两种不同缓冲剂中的溶解作用
评估api在不同缓冲剂与不同赋形剂中的溶解度。制造在100g缓冲剂中含有不同量的非微粉化api(即,1mg、4mg、10mg或15mg)的批料以产生饱和溶液。选择两种不同缓冲剂(柠檬酸盐缓冲剂和磷酸盐缓冲剂)。关于最终组合物的足够溶解性和耐受性,调节4.5的ph值。为改善api的不良溶解性,在缓冲系统中并入0.1wt.-%至2wt.-%浓度范围的不同溶解度增强赋形剂:
首先,根据ph.eur制备缓冲剂。在调节ph之后,将相应赋形剂溶解于缓冲剂中。向含有缓冲剂(即,100g)的赋形剂中添加1mgapi且搅拌。如果api完全溶解,则再添加9mg使100mg缓冲剂/赋形剂混合物中的api的最终量为10mg。将所得组合物搅拌过夜,之后通过0.45μm过滤器过滤并分析,并且所得组合物分别含有1mg或10mgapi。制备以下组合物且实现以下溶解度值:
图1示出在柠檬酸盐缓冲剂中存在溶解度增强赋形剂时,api的溶解度和杂质。图2示出在磷酸盐缓冲剂中存在溶解度增强赋形剂时,api的溶解度和杂质。
由以上数据清楚可见,在sls(在柠檬酸盐缓冲剂中)、
由于杂质的有效溶解作用和较低水平,因此选择维生素etpgs、sls(仅柠檬酸盐缓冲剂)和
实施例2-耐光性:
因为初步研究已证实光敏性很可能是api降解的原因且由于api被搅拌若干小时以获得充分溶解,因此进一步研究api在此步骤期间的稳定性。取决于三种不同等级的光保护来研究搅拌过程:在以下容器中搅拌24小时
-透明玻璃容器,
-琥珀色玻璃容器,以及
-覆盖有铝箔的透明玻璃容器。
选择含有sls或维生素etpgs的柠檬酸盐缓冲剂和含有
图3示出取决于光保护在柠檬酸盐缓冲剂和sls或维生素etpgs中的稳定性测定的结果。图4示出取决于光保护在柠檬酸盐缓冲剂和sls或维生素etpgs中的纯度。
图5示出取决于光保护在磷酸盐缓冲剂和
由图3至6中所示的数据清楚可见,在所有情况下,受光保护的样品(琥珀色玻璃和经覆盖的透明玻璃)均产生优异的测定和纯度概况。在琥珀色玻璃与经覆盖的透明玻璃之间未注意到显著差异,从而表明api与琥珀色玻璃并无普遍的不相容性。在受光保护时,与sls和维生素etpgs组合使用柠檬酸盐缓冲剂产生充分的测定和纯度结果(图3和图4)。然而,当在磷酸盐缓冲剂和
实施例3:-高压灭菌后的稳定性:
进行高压灭菌实验,旨在评价api在指定缓冲系统和赋形剂中的稳定性。选择覆盖有铝箔的透明玻璃作为初级包装,因其为材料提供充分光保护且预期具有比琥珀色玻璃更小的相互作用风险。将所述批料在121℃和2巴下进行高压灭菌持续20分钟,之后分析杂质概况。
图7示出在高压灭菌后在柠檬酸盐缓冲剂和sls或维生素etpgs以及磷酸盐缓冲剂和
由图7中所示的数据清楚可见,高压灭菌导致api的高降解率(所有杂质总和在13%(a/a)与76%(a/a)之间的范围内),其中在柠檬酸盐缓冲剂和sls中观察到最高降解率,并且其中api在磷酸盐缓冲剂和维生素etpgs中显示最低降解率。
实施例4-api取决于表面活性剂浓度的溶解度和稳定性:
为防止表面活性剂浓度过高,浓度过高可导致在膀胱中局部施用后产生刺激性或毒性作用,因此评价较低的浓度。在柠檬酸盐和磷酸盐缓冲剂中制造api的新批料。对于柠檬酸盐缓冲剂而言选择sls和维生素etpgs,并且对于磷酸盐缓冲剂而言选择
图8示出在sls和维生素etpgs各自分别为0.25%和0.5%时,柠檬酸盐缓冲剂中的测定和杂质结果。图9示出在
由图8和9中所示的数据清楚可见,对于两种缓冲剂和所有测试的表面活性剂而言,均观察到api测定取决于表面活性剂浓度的显著增加。相比之下,表面活性剂浓度较高时,杂质较低。磷酸盐缓冲剂与0.50%维生素etpgs的组合产生最高测定和最低杂质值。
实施例5-api取决于表面活性剂浓度的溶解度和稳定性以及抗坏血酸作为抗氧化剂的影响:
为进一步评价充分溶解api所需的表面活性剂的最小浓度,制造若干批料。关于api的溶解度和稳定性概况而言,选择柠檬酸盐缓冲剂与sls和磷酸盐缓冲剂与维生素etpgs。四个不同步骤中的表面活性剂浓度不同(0.1%、0.25%、0.5%和1.0%)。另外,评估1%抗坏血酸作为抗氧化剂的影响,因为api杂质与氧化降解相关。将所制造的批料在光保护下搅拌六天后进行分析。
图10示出在存在和不存在抗坏血酸时,在柠檬酸盐缓冲剂和sls(0.1%、0.25%、0.5%和1.0%)中的测定和杂质结果。图11示出在存在和不存在抗坏血酸时,柠檬酸盐缓冲剂和sls(0.1%、0.25%、0.5%和1.0%)中的ph(+++=极混浊;++=混浊;-=透明;(*)=黄色)。
图12示出在存在和不存在抗坏血酸时,在磷酸盐缓冲剂和维生素etpgs(0.1%、0.25%、0.5%和1.0%)中的测定和杂质结果。图13示出在存在和不存在抗坏血酸时,磷酸盐缓冲剂和维生素etpgs(0.1%、0.25%、0.5%和1.0%)中的ph(+=轻微混浊;-=透明;(“)=可见晶体)。
由图10至13中所示的数据再次清楚可见,对于两种缓冲剂/表面活性剂组合而言均观察到测定取决于表面活性剂浓度的增加,同时api的杂质减少(图10和图12)。含有1%抗坏血酸的制剂显示其ph值减小(图11和图13),其中在柠檬酸盐缓冲剂/sls(ph4.6至4.2)中发生仅轻微的变化,而在磷酸盐缓冲剂/维生素etpgs(ph4.7至3.0)中变化较强。含有1%抗坏血酸的制剂对于所研究组合物的杂质概况未显示显著益处,而在存在抗坏血酸时,磷酸盐缓冲剂中的api测定增加,此可能是由组合物的较低ph所引起的。
此外,含有柠檬酸盐缓冲剂和较低浓度sls(0.1%和0.25%)的组合物出现混浊(在不存在和存在抗坏血酸时),而柠檬酸盐缓冲剂、sls和抗坏血酸的所有组合导致组合物出现黄色。随着表面活性剂浓度降低所观察到的低测定值可能是api的较低溶解度的结果,因为这些组合物出现混浊或宏观可见api晶体(图11和图13)。
磷酸盐缓冲剂和0.5%与1%维生素etpgs中的api显示极低杂质水平,甚至在酸性条件下(图12)。
实施例6-api在存在和不存在抗坏血酸时的短期稳定性:
在短期稳定性研究中研究含有磷酸盐缓冲剂和维生素etpgs的组合物。目的在于评价存在抗坏血酸所可能提供的抗氧化作用益处。将已搅拌六天的组合物在光保护下再搅拌15天,产生总计21天的搅拌期。在14天和21天后(额外t=6天)分析样品(测定和杂质)。仅在14天后评价视觉外观和ph值。
图14示出在存在和不存在抗坏血酸时,api在磷酸盐缓冲剂和0.5%与1%维生素etpgs中的短期稳定性;t=6天、14天和21天时的测定。图15显示在存在和不存在抗坏血酸时,api在磷酸盐缓冲剂和0.5%与1%维生素etpgs中的短期稳定性;t=6天、14天和21天时的杂质。图16示出在存在和不存在抗坏血酸时,api在磷酸盐缓冲剂和0.5%与1%维生素etpgs中的短期稳定性;t=6天、14天和21天时的ph和外观(-=透明;(*)=黄色)。
如图14和图15中所示,对于api的测定和杂质两者而言,在21天的时间段内均未观察到抗坏血酸的明显作用。ph值也保持不变,而含有抗坏血酸的制剂出现浅黄色变色(图16)。
实施例7-抗坏血酸对ph的影响:
在引入抗坏血酸作为抗氧化剂之后,观察到ph变化,且因此观察到api溶解度的差异(参见图12和图13)。为研究抗坏血酸取决于ph对组合物测定和纯度的影响,制造新批料,为此将ph值调节至特定值(ph3、5和7),之后溶解api且过夜搅拌。除测定和杂质的立即测量外,一天之后测量ph值。
图17示出在存在和不存在抗坏血酸时,磷酸盐缓冲剂和0.5%维生素etpgs中的api的测定、杂质和ph的结果。
由图17中所示的数据清楚可见,向组合物中添加抗坏血酸导致ph减小,这使得必需进行ph调节以维持特定ph值。由于api的溶解度取决于ph,因此在ph值较低时,测定结果和杂质较高(图17)。较高的杂质值假定是api在酸性条件下可能不稳定的结果。由于其在api的溶解度与稳定性之间提供良好折衷,因此选定ph5作为进一步研究的值。
实施例8-评价氮气充气对api的氧化稳定性的益处:
评价氮气充气在制造和储存期间可能的有益作用。通过搅拌24小时溶解api来制造所选择的组合物且在经/未经氮气处理后在25℃或6℃下储存长达28天。
图18示出评估氮气充气的影响的流程图。
所制造的批料由磷酸盐缓冲剂和维生素etpgs组成,且另外将其与含有1%抗坏血酸的组合物进行比较。使用0.01wt.-%、0.02wt.-%或0.04w.-%的api。组合物用api饱和,其中在含有0.5wt.-%、1wt.-%或2wt.-%维生素etpgs的100g缓冲剂中分别溶解有10mg、20mg或40mg。将组合物转移至聚苯乙烯瓶中并储存在25℃或6℃下。在制造期间以氮气处理一部分组合物且以氮气充气,之后密封(参见图18)。在制造后以及7天、14天和28天后,测试组合物的api测定和纯度。
下表显示在不存在和存在氮气时,所储存组合物的测定结果(asc.=抗坏血酸;-=不存在;1%=存在;n2=氮气;-=不存在;+=存在):
下表显示在不存在和存在氮气时,所储存组合物的纯度结果(asc.=抗坏血酸;-=不存在;1%=存在;n2=氮气;-=不存在;+=存在):
上表中的数据表明,api的溶解度取决于表面活性剂浓度,因此0.5wt.-%维生素etpgs产生最低测定值,且2wt.-%维生素etpgs产生最高测定值。具有0.5wt.-%和1wt.-%维生素etpgs以及抗坏血酸的组合物显示比不含抗坏血酸的组合物略微较高的测定,而与储存温度无关。这可能是ph在抗坏血酸存在下略微减小的结果,因为api溶解度是ph依赖性的。以氮气进行处理对api测定无明显作用,api测定在28天的研究时间内保持不变。然而,杂质分布在25℃的储存温度下展现出增加趋势。尤其具有0.5wt.-%和1wt.-%维生素etpgs的含抗坏血酸组合物随时间推移展示越来越高的api降解率,而具有1wt.-%和2wt.-%维生素etpgs且不含抗坏血酸的组合物保持稳定。
杂质形成在6℃下保持相对稳定,其中不存在和存在抗坏血酸下不存在差异。在6℃的储存温度下,所有杂质的总和保持低于所有组合物的1%(a/a)。再次,氮气处理并未提供明显益处,与储存温度无关。
实施例9-初步稳定性研究:
指定两种剂量强度:40μg/ml和150μg/mlapi。确定这些浓度以保持低于在前述实验期间所获得的饱和溶解度值的80%。为使api溶解,对于40μg/ml和150μg/mlapi而言分别使用0.5wt.-%和2wt.-%维生素etpgs(24小时搅拌)。以氮气处理组合物且储存在5℃、25℃和40℃下。同时,制备含有1wt.-%抗坏血酸的组合物且仅储存在5℃下,因为前述研究显示出与抗坏血酸组合对api在25℃下的稳定性的不良作用(参见图15)。
下表显示api膀胱内溶液的初步稳定性研究的测定结果(asc.=抗坏血酸;-=不存在;n.d.=未测定):
下表显示api膀胱内溶液的初步稳定性研究的纯度结果(asc.=抗坏血酸;-=不存在;n.d.=未测定):
上表中的数据表明,当储存在6℃或25℃下时,所有研究的组合物的测定值在3个月的时间段内保持稳定。然而,测定在40℃下大幅减少。在25℃下观察到api降解率增加的趋势,且三个月后在40℃下甚至更为显著。
以上实验数据证实,赋形剂对api的溶解度和稳定性提供浓度依赖性的有益作用,其中磷酸盐缓冲剂与维生素etpgs的组合提供最具希望的结果。此外,在组合物制造和储存期间,api降解可能受到光保护的抑制。实施以抗坏血酸作为抗氧化剂使得必需进行ph调节,因为出现了ph变化为更具酸性的ph值,且此外对25℃下的稳定性产生负面作用。使用氮气作为保护气体在3个月的储存时间内并未显示出明显优点。6℃的储存温度对所测试组合物的稳定性提供有益作用。
- 还没有人留言评论。精彩留言会获得点赞!