用于共生疾病进展的综合疫苗设计的制作方法
相关申请的交叉引用
本申请要求2017年10月13日提交的美国临时专利申请号62/572,081和2018年5月11日提交的美国临时专利申请号62/670,419的优先权,其各自内容通过引用其全文纳入本文。
关于联邦资助研究的声明
本发明是在政府支持下由国家卫生研究院(nationalinstitutesofhealth)授予的基金号ai088485和ai117309资助完成。政府对本发明拥有一定的权利。
发明背景
共生微生物通常与寄居的宿主处于共生关系。然而,在某些情况下,向毒性(virulence)的转变可能会促使正常良性共生体(commensal)引起疾病。这提出了这样一个问题,即疗法是否应当防止初始定殖,从而消除未来疾病的任何可能性,但是同时也去除共生体建立所(直接或间接)提供的任何益处,或者疗法是否应当在靶向毒性转变过程的同时保留定殖(以及任何相关益处)。为解决肺炎链球菌(pneumococcal)疾病而正在进行的疫苗接种工作充分体现了这一困境。
肺炎链球菌疾病是一种主要全球传染病威胁,其影响着全球数以百万计的人,尤其是年轻人、老年人和资源有限的人。疾病结果包括肺炎,菌血症,脑膜炎和中耳炎(中耳感染)。如上所述,由于感染范围和疾病进展步骤,治疗该疾病具有挑战性。
更具体地,定殖有引起肺炎链球菌疾病的肺炎链球菌(streptococcuspneumoniae)的人几乎是普遍的(bogaert等,lancetinfectdis4,144-154(2004))。例如,在生命的最初几年中,超过95%的儿童中出现定殖(gray,等,jinfectdis142,923-933(1980);huebner等,thepediatricinfectiousdiseasejournal19,1017-1020(2000))。定殖的组成是复杂的,具有>90种不同的肺炎链球菌血清型,它们通过包覆细菌细胞的多糖成分含量(content)区分(daniels等,jpediatrpharmacolther21,27-35(2016))。当前的疫苗收获、纯化和结合与侵略性侵入性感染相关的肺炎链球菌(s.pneumoniae)血清型的表面荚膜多糖(cps)。该方法已经有效最小化初始定殖,增强群体免疫力并减少疾病(loo等,thepediatricinfectiousdiseasejournal33增补2,s140-151(2014))。
然而,肺炎链球菌疾病的进展需要的不仅仅是定殖。获得后,肺炎链球菌以无症状生物膜在鼻咽中建立定居点(residence)(bakaletz,paediatrrespirrev13,154-159(2012);munoz-elias等,infectionandimmunity76,5049-5061(2008))。换言之,肺炎链球菌代表上呼吸道共生体。疾病在生物膜散播后发生,其通常由促使细菌亚群变得具有毒性的破坏性事件(如病毒感染)所引起(图5)(marks等,mbio4,(2013))。转变时,这些细菌将脱离生物膜;扩散到肺、血液、中耳和其他位置;并导致前述疾病类型(marks等,infectimmun80,2744-2760(2012))。从这个角度来看,通过当前疫苗选择防止定殖是消除后续疾病进展的上游途径。
然而限制定殖仅能够用于当前疫苗所覆盖的13-23种血清型,这远远低于迄今所鉴定的>90种血清型(tintinhtar等,bmcinfectdis15,419(2015))。因此,消除定殖能预防疾病,但是也带来了不希望的后果,即为剩余的血清型在鼻咽中建立定居点并发展出毒性提供生态位(niche)(richter等,emerginfectdis19,1074-1083(2013);weinberger等,lancet378,1962-1973(2011))。根据当前策略,能够提供全面覆盖应用的唯一假想疫苗将纳入各种已知肺炎链球菌血清型的多糖表面抗原。这样的目标从制造角度而言是十分昂贵的,并且仍然没有消除伴随尚未被检测到的肺炎链球菌血清型完全不同的上呼吸道共生体和病原体进行生态位替换的风险(weinberger等,lancet378,1962-1973(2011);hausdorff等,expertreviewofvaccines14,413-428(2015);madhi等,journalofinfectiousdiseases196,1662-1666(2007);keller等,emergenceandpathogenesis.mbio7,e01792(2016);spijkerman等,plosone7,e39730(2012))。
因此,尚无疫苗策略能够用于解决新血清型的问题,或提供针对定殖以及毒性转变的组合方法。
技术实现要素:
在本公开中,提供了组合物和方法,其包括针对定殖所指向的抗原,以及针对毒性转变所指向的抗原。例如,非共价共定位两类互补抗原,一种防止最具攻击性的肺炎链球菌血清型的定殖,而另一种限制毒性转变,从而在动物对象中提供了完全疫苗效力以及对至今为止所报道疾病最全面的覆盖。因此,本发明的疫苗制剂提供了普遍的肺炎链球菌疾病预防,并具有有效管控在全球范围内累及千万到数亿人的疾病的前景。该方法更普遍地提出了应对复杂共生-宿主动力学的平衡预防性治疗策略。
在本公开中,双功能脂质体制剂允许共定位互补抗原类型,其各自与共生疾病进展中的单独状态相关。从制造的角度来看,与当前疫苗生产选择形成鲜明对比的是脂质体的设计允许具有成本效益和可扩大规模的制剂。从效力的角度来看,脂质体制剂能力以及所附抗原的广谱和中和性质能够产生迄今为止针对prevnar和pneumovax对照(肺炎链球菌疾病商业疫苗选择中的当前标准)进行测试所报道的最稳健和全面的免疫应答。
本公开的组合物和方法涉及细菌多糖的脂质体包封(本文称为leps)。在一方面中,本公开提供了包含脂质体的疫苗组合物。组合物中的脂质体可以包封单一类型的细菌多糖或多种类型的细菌多糖,如荚膜多糖。至少一些脂质体具有与表面非共价连接的蛋白质,从而使蛋白质的至少部分暴露于脂质体的外部。例如,脂质体可以包封来自肺炎链球菌血清型的一种或多种荚膜多糖并具有经由非共价连接与表面连接的一种或多种蛋白质,从而使蛋白质的至少一些部分展示于所述脂质体外部的表面上。
疫苗组合物可具有多种类型的脂质体,各种类型包封不同类型的单一血清型或血清型的组合(即,荚膜多糖)。例如,多个脂质体可以包封第一血清型,多个脂质体可以包封第二血清型,多个脂质体可以包封第三血清型,并依此类推,从而使组合物可以总体上具有包封1至约100个已知血清型的脂质体。当鉴定出其他血清型时,可以对组合物进行修饰以向其添加包封了新鉴定的血清型的脂质体。类似地,更进一步地是多个脂质体可以包封血清型的第一组合,多个脂质体可以包封血清型的第二组合,并依此类推。一些脂质体中的所有脂质体可以具有非共价连接的蛋白质,从而使蛋白质的至少部分展示于脂质体外部的表面上。在一实施方式中,提供了20价(20种血清型)疫苗组合物,其中脂质体具有包封在脂质体中的单一或多种血清型,并且脂质体还具有非共价连接的crm197、pnco或glpo,或其组合。在一实施方式中,20种血清型是1、2、3、4、5、6a、6b、7f、8、9n、9v、12f、14、17f、18c、19a、19f、20、22f和23f。在一实施方式中,疫苗是24价(24种血清型)疫苗组合物,其中脂质体具有包封在脂质体中的单一或多种血清型,并且其中所述24种血清型是1、2、3、4、5、6a、6b、7f、8、9n、9v、10a、11a、12f、14、15b、17f、18c、19a、19f、20、22f、23f和33f。
在一个实例中,疫苗组合物包含脂质体,其中脂质体具有单一血清型,并且其中组合物中所有脂质体的血清型成分含量可以是相同的或不同的。因此,例如,组合物可以具有多组脂质体,其中各组脂质体包含多个脂质体,各脂质体包封单一血清型。血清型可以选自图16中所列出的血清型。可以制备包含其他单一血清型的其他脂质体组并添加到该组合物中。
该组合物可以具有下述一种或多种内容:包封血清型1的多个脂质体,包封血清型2的多个脂质体,包封血清型3的多个脂质体,包封血清型4的多个脂质体,包封血清型5的多个脂质体,包封血清型6a的多个脂质体,包封血清型6b的多个脂质体,包封血清型7f的多个脂质体,包封血清型8的多个脂质体,包封血清型9n的多个脂质体,包封血清型9v的多个脂质体,包封血清型10a的多个脂质体,包封血清型11a的多个脂质体,包封血清型12f的多个脂质体,包封血清型14的多个脂质体,包封血清型15b的多个脂质体,包封血清型17f的多个脂质体,包封血清型18c的多个脂质体,包封血清型19a的多个脂质体,包封血清型19f的多个脂质体,包封血清型20的多个脂质体,包封血清型22f的多个脂质体,包封血清型23f的多个脂质体,包封血清型33f的多个脂质体。
可以与脂质体非共价连接的蛋白质的实例包括白喉类毒素突变体crm197或来自细菌的表面暴露的蛋白质或蛋白质部分,如pnco和glpo。能够用于产生多糖免疫原的免疫原性运载体的其他实例包括白喉类毒素(dt),破伤风类毒素(tt),钥孔血兰素(keyholelimpethaemocyanin,klh)和结核菌素(ppd)的纯化蛋白衍生物。
在一个方面中,本公开提供了用于使个体针对细菌感染(如肺炎链球菌感染)免疫的方法,其包括向待保护的个体给予包含脂质体的组合物,所述脂质体具有包封在其中的一种或多种血清型,并且具有与表面非共价连接且暴露于外部的一种或多种蛋白质。
附图说明
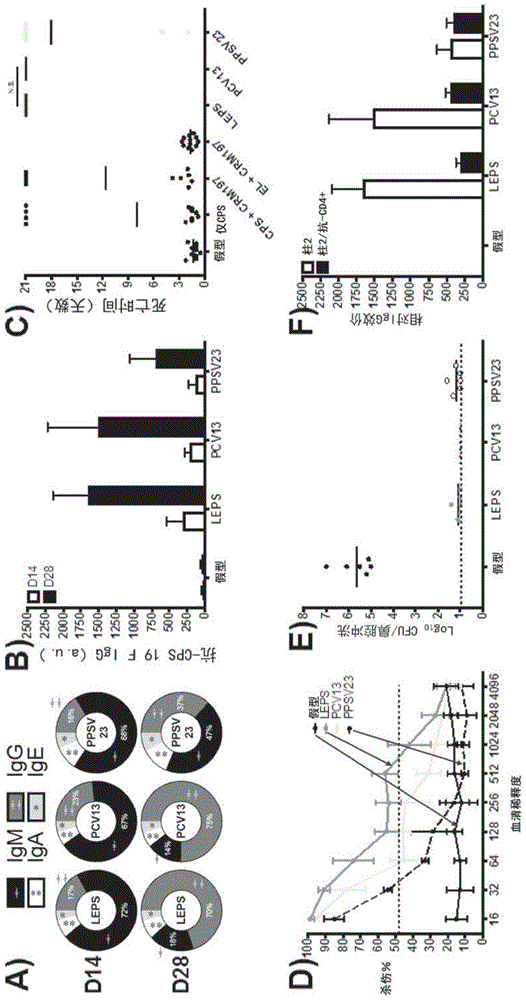
图1.leps疫苗效力与商业标准品比较。在0天和14天对小鼠疫苗接种:1)包含来自肺炎链球菌血清型19f的荚膜多糖(cps)的leps,2)prevnar13(pcv13),3)pneumovax23(ppsv23),4)pbs(假型),和5)各种对照(单独的cps,cps+crm197,和空leps[el]+crm197)。在第14和28天收集血清。(a)leps、pcv13和ppsv23的抗体类型转换(classshifting)和(b)总igg效价。(c)鼠败血症模型中针对血清型19f致死性攻击的保护。(d)使用调理吞噬活性(opa)试验对选择的疫苗接种策略的功能性抗体活性评估。(e)在定殖后5天测量的未免疫或免疫小鼠中评估的鼻咽细菌负荷。(f)在28天(柱2)测量没有进行(白色)或进行(黑色)cd4+t细胞消耗的小鼠血清中的19fcps抗体效价。n.s.:不显著。
图2.pnco和glpo蛋白抗原的免疫应答评估。(a)使用明矾佐剂或空leps初始(柱1;左列)和增强剂(柱2;右列)疫苗接种后小鼠血清中的抗-pnco和抗-glpo抗体效价。(b)增强剂疫苗接种后小鼠中的igg1(对应th2;左列)和igg2a(对应th1;右列)效价;igg1/igg2a比例示于列上方。(c)没有进行(左列)或进行(右列)cd4+t细胞消耗的小鼠血清中的抗-pnco和抗-glpo抗体效价。(d)使用pspa(常用肺炎链球菌蛋白抗原)(li等,sciadv2,e1600264(2016))或pnco+glpo疫苗接种后进行或没有进行cd4+细胞消耗的鼠攻击-保护败血症模型;肺炎链球菌血清型19f是攻击菌株,并且各制剂使用4只小鼠。(e)pnco+glpo疫苗接种后小鼠血清中的ifn-γ(对应th1)和il-17a(对应th17)效价。(f)初始和增强剂疫苗接种后兔血清中的抗-pnco和抗-glpo抗体效价。
图3.完整leps平台的评估,该平台的特征在于超过20种血清型的cps包封以及glpo和pnco的表面定位。(a)针对来自疫苗接种后小鼠血清型中指定肺炎链球菌血清型的pnco(左侧第1列)、glpo(左侧第2列)和包封的cps(剩下的列)的igg效价。(b)使用定殖模型比较prevnar13(pcv13)、pneumovax23(ppsv23)和完整leps系统(leps20:pnco和glpo)之间的鼠攻击-保护数据并通过给予甲型流感病毒体内干扰以促进肺炎的发展。指示当使用指定血清型攻击时的各种疫苗接种方案的存活率,这些血清型被prevnar13(19f)和pneumovax(19f和11a)部分覆盖,而被leps20:pnco和glpo完全覆盖。(c)在使用11a(左)和35c(右)血清型攻击后,iav给药后1天和5天的鼻咽表面(np)、鼻咽洗液(灌洗)、肺和血液的细菌计数。
图4.1998年至2040年儿童(年龄<5;a)和老年人(年龄≥65;b)中侵入性肺炎链球菌病(ipd)的发病率。ipd的总发病率分为由pcv7引起(prevnar7),pcv13(prevnar13),ppsv23(pneumovax)和非疫苗型(nvt)血清型所导致的疾病。nvt血清型定义为pcv13(a)或ppsv23(b)疫苗中未包含的血清型。1998-2007年间pcv7血清型的发病率获自pilishvili等(jinfectdis201,32-41(2010))发表的研究。pcv13血清型的总发病率和发病率获自cdc的肺炎链球菌活跃细菌核心(abc)监测计划(https://www.cdc.gov/abcs/reports-findings/survreports/spneu-types.html)。由过去几年的趋势预测2007年(pcv7血清型)和2015年(pcv13血清型)的发病率有所上升。推断pcv15(prevnar15)引入后的总ipd降低,这基于血清型侵入性(brueggemann等,jinfectdis190,1203-1211(2004);sleeman等,jinfectdis194,682-688(2006))和pcv7和pcv13的先前趋势,其在疫苗引入后四年稳定了速率。对引入(虚线)或没有引入(实线)leps的ipd预测超过2030年。基于glpo和pnco蛋白抗原98%的序列覆盖(li等,procnatlacadsciusa113,6898-6903(2016))以及针对70种肺炎链球菌血清型显示的活性,引入leps后四年内ipd降低80%(a)或十年内ipd降低90%(b)。
图5.以肺炎链球菌病为特征的共生疾病进展模型。(a)肺炎链球菌定殖,生物膜的建立,对毒性的环境刺激以及生物膜释放和疾病症状。(b)跨越当前疫苗选择的免疫靶标(prevnar和pneumovax;靶向特定血清型的荚膜多糖[cps])和leps平台(解决当前覆盖的疫苗血清型的定殖以及非疫苗型[nvt]血清型的生物膜释放)。
图6.leps平台。(a)糖偶联物疫苗(例如,prevnar家族)和leps比较的示意图。。(b)产生leps颗粒的制剂过程示意图。
图7.leps表征。多糖(ps)包封效率(a;实心正方形)或蛋白质表面结合效率(b;实心圆形)相较于初始浓度。颗粒表面电荷评估(c)和大小分布(d)。(e)通过透射电子显微镜的leps颗粒图像;1:leps表面;2:ps包封的脂质体;3:leps。
图8.当使用超过当前prevnar7(pcv7)和13(pcv13)治疗方案的血清型攻击时leps免疫接种的保护能力。在败血症模型中评估了使用包含20种多糖(即leps20)的leps制剂免疫的小鼠,并将攻击株(x轴)基于相应糖偶联物疫苗中内含物分成数个类别。具体地,“pcv7”标签包括prevnar7和prevnar13所覆盖的细菌血清型;然而,“pcv13-独特”分组表示由prevnar13所覆盖的6种其他血清型。“非疫苗类型”标签对应商业糖偶联物疫苗中不包括的血清型。
图9.兔子中的leps疫苗策略。新西兰白兔用含肺炎链球菌血清型19fcps的leps颗粒免疫(第0天)并经增强(第14天),且在第14天(柱1;左栏)和第28天(柱2;右栏)分析外周血液样品的(a)总igg效价以及(b)通过opa试验分析针对血清型19f的功能性抗体活性(柱2样品)。
图10.针对特定的肺炎链球菌细胞类型的glpo和pnco的opa试验。(a)小鼠血清所介导的浮游性(左)和生物膜释放(bfr)(右)血清型19f细菌的opa,所述小鼠用prevnar13(pcv13),具有明矾佐剂的glpo+pnco以及具有空leps的glpo+pnco免疫。(b)浮游细菌、bfr细菌和经ll-37处理去除cps的浮游细菌的沉淀(左)和上清液(右)中的荚膜多糖(cps)含量;“囊体百分比(percentcapsule)”值与各子图中的浮游样品相关。
图11.与prevnar7(pcv7)联合(共同给予)或作为增强剂(附加)给予的glpo和pnco的免疫原性评估。(a)针对pnco、glpo和由颜色编码的疫苗接种样品所导致的特定血清型的igg效价。(b)与prevnar7联合或作为prevnar7增强剂给予glpo和pnco(pg)后,小鼠保护(左;败血症攻击模型)和细菌负荷(右;定殖后5天测量的)。使用血清型19f(由prevnar7和prevnar13[pcv13]覆盖)或1(未被prevnar7涵盖,但被prevnar13涵盖)攻击小鼠。
图12.使用鼠iav诱导的血清型19f的肺炎模型时,对leps20:pnco&glpo的其他评估。iav给药后1天和5天,鼻咽表面(np)、鼻咽洗液(灌洗)、肺和血液的细菌计数。prevnar13(pcv13);pneumovax23(ppsv23)。
图13.leps20:pnco&glpo的其他鼠疾病模型评估。使用(a)败血症和(b)肺炎疾病模型在prevnar13(pcv13),pneumovax23(ppsv23)和完整的leps系统之间进行的小鼠攻击-保护数据比较。当使用指示的血清型攻击时,指示各疫苗接种方案的存活(动物数量加框表示),这些血清型被prevnar13(19f)和pneumovax(19f和11a)部分覆盖,而被leps20:pnco和glpo完全覆盖。
图14.替代的leps制剂过程以及在鼠攻击-保护试验中的比较。将来自肺炎链球菌血清型4、6b、9v和14的多糖混合,并在脂质体制备过程中混合和共同配制,或者在脂质体颗粒中单独配制,然后在接种疫苗之前合并。然后,将败血症疾病模型用于攻击具有单独血清型的小鼠对象(x轴)。
图15(表s1).prevnar13(pcv13)、pneumovax23(ppsv23)和包含20种多糖(即,20价[20v])的leps之间的opa比较。值表示在opa分析中发生50%细胞杀伤处的血清稀释度。虚线指示非疫苗血清型;较高的opa读数归因于特定多糖的较强抗体反应(即,较高效价)。
图16(表s2).prevnar13(pcv13)、pneumovax23(ppsv23)和pnco+glpo蛋白抗原(与明矾佐剂一起使用)之间的opa比较。值表示在opa分析中发生50%细胞杀伤处的血清稀释度。虚线指示非疫苗血清型;较高的opa读数归因于特定多糖的较强抗体反应(即,较高效价)。opa试验中利用的血清型特异性肺炎链球菌菌株包括与初始定殖(浮游性)和疾病(即,生物膜释放[bfr])相关的细胞表型。
图17(表s3).glpo和pnco总结。
图18:用glpo疫苗接种证明了存在潜在脱靶免疫原性风险。a)各相应细菌物种相对于假型疫苗接种的标准化荧光强度(例如,假型疫苗接种读数代表对于各细菌的不同绝对荧光读数);加框的数字代表与glpo的预测蛋白表位之间共有的同源性。b)bfref3030,无乳链球菌(streptococcusagalactiae),唾液乳杆菌(lactobacillussalivarius),植物乳杆菌(lactobacillusplatarum)和嗜酸片球菌(pediococcusacidilactici)的opa试验结果。虚线表示50%细菌杀伤。误差线表示4个技术重复的标准偏差。
图19:bfr肺炎攻击模型中的死亡时间。测试的血清型包括6c(a),35b(b),15c(c),16f(d),23a(e)和9n(f)。使用假型对照,pcv13,ppsv23,和具有crm197,glpo,pnco或glpo+pnco的leps(20v)疫苗接种4只cd-1小鼠。剂量代表各种蛋白质的微克(34、68或136μg)。
图20:leps(20v):pnco剂量递增研究中蛋白质(黑色)和cps(蓝色)抗原的相对抗体效价。使用leps(20v):pnco以34(a)、68(b)和136μg(c)的pnco皮下疫苗接种cd-1小鼠。误差线表示4个生物学重复的标准偏差。
图21:针对pnco剂量递增的iav肺炎。a)各个生理部位(鼻咽,鼻咽灌洗,肺和血液)的细菌负荷。b)相对于整个生理部位的17μg剂量,疫苗接种对细菌负担的作用。pnco剂量包括17(红色)、34(蓝色)、68(绿色)和136μg(橙色)以及假型对照(黑色)。
图22:扩展leps疫苗以包括10a,11a,15b,33fcps。a)各cps柱剂量1(左列)和柱剂量2(右列)的相对抗体效价。b)疫苗接种后被igg、igm、iga和ige分割的cps抗体库的组成。c)由假型,pcv13,ppsv23,leps(24v):pnco和leps(24v)crm197产生的leps(24v)制剂中所包含的所有24种cps的相对抗体效价。误差线表示4个生物学重复的标准偏差。
图23:替代性蛋白质-脂质体连接策略的表征。a)通过emsa试验使用co-pop、ni-nta、co-nta、bsb和bs脂质体测量的与脂质体结合的蛋白质级分。孵育进行10、20、30或60分钟。误差线表示3个技术重复的标准偏差。b)疫苗接种后被igg、igm、iga和ige分割的cps抗体库的组成。c)第一次(左柱)和第二次(右柱)施用后替代蛋白-脂质体连接制剂相对于pcv13和ppsv23的相对抗体效价。误差线表示4个生物学重复的标准偏差。d)使用替代蛋白质-脂质体连接制剂的opa试验;虚线表示50%细菌杀伤。疫苗接种包括假型,pcv13,ppsv23以及ni-nta,co-nta,bsb和bs脂质体。误差线表示4个技术重复的标准偏差。
图24:免疫荧光试验结果和与glpo的细菌同源性之间的相关性。虚线表示95%置信区间。
图25:glpo剂量递增抗体效价。使用蛋白质为34(a)、68(b)或136(c)μg的leps(20v):glpo制剂疫苗接种的小鼠中蛋白质(黑色)和cps(蓝色)抗体的浓度。
图26:glpo+pnco剂量递增抗体效价。使用总蛋白质为34(a)、68(b)、136(c)或272(d)μg蛋白质的leps(20v):glpo+pnco制剂疫苗接种的小鼠中蛋白质(黑色)和cps(蓝色)抗体的浓度。
图27(表s4):具有glpo同源物的细菌,标有各蛋白质区域的同源性百分比(包括测试交叉反应性的那些)。
图28(表s5):cd-1小鼠血液中代谢产物的浓度。
图29(表s6):cd-1小鼠中白细胞的血液学评估。
图30(表s7):leps(20v):pnco剂量递增时50%杀伤稀释度的变化百分比。
图31(表s8):leps(20v):pnco剂量递增时抗体效价的变化百分比。
图32(表s9):leps(20v):pnco剂量递增时完整opa数据。
图33(表s10):leps(20v):glpo+pnco剂量递增时的完整opa数据。
图34(表s11):leps(24v):pncocpsopa效价。
图35(表s12):nvt血清型第一轮研究的cpsopa数据。
发明详述
本文所用术语“免疫应答”指免疫系统细胞(包括淋巴细胞,抗原呈递细胞,吞噬细胞,粒细胞等中的一种或多种)的协同作用,其导致从动物体内选择性损伤,破坏或消除入侵性病原体、感染病原体的细胞或组织。
本文所用术语“免疫原”指能够在哺乳动物中刺激或诱导体液抗体和/或细胞介导的免疫应答的物质。该术语在本文中可以与“抗原”互换使用。
本文所用关于多肽的术语“分离的”是指与其他大分子基本分离的多肽,所述其他大分子在其天然状态下通常与该多肽相关联。分离的多肽可以完全不含在其天然状态下通常与该多肽相关联的其他大分子。例如,多肽可以是至少50、60、70、80、90、95或99%纯的。例如,分离的多肽可以从正常表达该多肽的细胞中纯化,可以合成,或可以使用重组dna方法生产。
多糖通常来自特定的血清型。许多血清型,包括表s1和s2中的血清型(分别为图15和16)是本领域表征和已知的。多糖是来自特定细菌的荚膜多糖。用于制备制剂的多糖可以是分离的荚膜多糖。
术语“多肽”、“肽”和“蛋白质”可以互换使用,以表示包含通过肽键或修饰的肽键彼此连接的两个或更多个氨基酸的聚合物。短链通常称之为肽(约30个氨基酸或更少),中链称之为多肽(从30至1,000个氨基酸),长链称之为蛋白质。多肽可以包含20个基因编码的氨基酸以外的其他氨基酸。多肽包括通过天然过程(如翻译后加工)或通过本领域所熟知的化学修饰技术修饰的氨基酸序列。
与共价多糖-蛋白质偶联不同,本公开利用了脂质体技术来包封所需细菌血清型(多糖)内容物,然后将所需蛋白质非共价连接并在表面展示。因此,本公开提供了脂质体对一种或多种类型的细菌多糖的脂质体包封(leps),所述脂质体还包含非共价连接且表面展示的一种或多种类型的蛋白质,如细菌蛋白,如暴露于细菌表面的那些蛋白质。细菌多糖的实例是肺炎链球菌多糖,如来自肺炎链球菌的多糖。与prevnar制剂不同,本发明的leps制剂通过多糖和蛋白质(例如,crm197)的非共价共定位实现了糖偶联物疫苗效力。与prevnar和pneumovax制剂不同,本发明的leps制剂同时包含多糖和蛋白质,并提供了对抗定殖和毒性转变的策略。在leps制剂中,除了prevnar制剂中包括的多糖靶以外,还有分开的靶抗原(例如,表面展示的肺炎链球菌蛋白)。另外,蛋白抗原代表了共生疾病转变的不同方面,并因此为所得免疫应答的效力和广度增加了新的维度。选择本发明的制剂中的蛋白质抗原是因为它们位于细菌(如肺炎链球菌)的表面,从而使得它们对于免疫应答是可及的。
一方面,本公开提供了一种组合物,其包含包封一种或多种类型的细菌多糖的脂质体,并且还包含非共价连接并展示于脂质体表面上的一种或多种类型的细菌蛋白。
术语“类型”就蛋白质或多糖而言表示任何特定的蛋白质或多糖分子。因此,当仅存在一种“类型”的蛋白质或多糖时,这意味着可以存在特定蛋白质或多糖的一个或多个分子。述及存在一种以上类型的蛋白质或多糖时表示存在多种蛋白质或多糖。
本公开的脂质体可以仅包封一种类型的多糖(血清型)或超过一种类型的多糖。例如,脂质体可以在其中包封唯一类型的细菌荚膜多糖或多种类型的细菌荚膜多糖,如来自肺炎链球菌的荚膜多糖。
可从各种众所周知的来源获得血清型和详细信息。例如,可以从cdc的全球肺炎链球菌菌株库(globalpneumococcalstrainbank)和世界卫生组织(who)(who.int/biologicals/publications/meetings/areas/vaccines/pneumococcal/pneumo%20meeting%20report%20final%20ik%2024_dec_08.pdf?ua=1)获得有关肺炎链球菌各种血清型的信息。肺炎链球菌荚膜多糖的实例包括本公开表s1(图15)和s2(图16)中提供的血清型。在一实施方式中,血清型包括下述一种或多种:4、6b、9v、14、18c、19f、23f、1、3、5、6a、7f、19a。在一实施方式中,血清型是4、6b、9v、14、18c、19f、23f。在一实施方式中,血清型是4、6b、9v、14、18c、19f、23f、1、3、5、6a、7f和19a。在一实施方式中,血清型是4、6b、9v、14、18c、19f、23f、1、5、7f。在一实施方式中,血清型是1、2、3、4、5、6b、7f、8、9n、9v、10a、11a、12f、14、15b、17f、18c、19a、19f、20、22f、23f和33f。在一实施方式中,血清型是1、2、3、4、5、6a、6b、7f、8、9n、9v、12f、14、17f、18c、19a、19f、20、22f和23f。在一实施方式中,血清型是1、2、3、4、5、6a、6b、7f、8、9n、9v、12f、14、17f、18c、19a、19f、20、22f、23f。
多糖可以是表面多糖,如针对伤寒沙门氏菌(salmonellatyphi)的vi多糖抗原,脑膜炎球菌多糖(包括a,c,w135和y型,以及b族脑膜炎球菌的多糖和修饰多糖),金黄色葡萄球菌(staphylococcusaureus)的多糖,无乳链球菌(streptococcusagalactae)的多糖,肺炎链球菌(streptococcuspneumoniae)的多糖,分枝杆菌(mycobacterium)例如结核分枝杆菌(mycobacteriumtuberculosis)的多糖(如甘露糖磷酸肌醇海藻糖,分支菌酸,甘露糖加帽的阿拉伯甘露聚糖,其荚膜和阿拉伯半乳聚糖),新型隐球菌(cryptococcusneoformans)的多糖,非可分型流感嗜血杆菌(non-typeablehaemophilusinfluenzae)的脂多糖,流感嗜血杆菌b的荚膜多糖,卡氏莫拉氏菌(moraxellacatharralis)的脂多糖,索氏志贺氏菌(shigellasonnei)的脂多糖,克氏锥虫(trypanosomacruzi)的脂肽磷酸多糖(lppg),癌症相关神经节苷脂gd3,gd2,肿瘤相关粘蛋白,尤其是t-f抗原,和唾液酸tf抗原,以及与t-f抗原在结构上相关的hiv相关多糖,脑膜炎奈瑟氏菌(neisseriameningitidis)多糖-特别是来自血清型a,b,cw-135和y(流感嗜血杆菌b的荚膜多糖(prp))等。
在一方面中,本公开提供了包含脂质体的组合物,所述脂质体包封一种或多种类型的细菌多糖,如细菌荚膜多糖。在一实施方式中,本公开提供了包含脂质体的组合物,所述脂质体包封来自肺炎链球菌的一种或多种类型的细菌荚膜多糖。本公开内容的组合物可以包含多种脂质体,并且至少一些脂质体各自包封单一类型的细菌(如肺炎链球菌)荚膜多糖。其他脂质体可以包封多种类型的细菌荚膜多糖。一些脂质体可以不包封多糖。在一实施方式中,该组合物包含:i)包含单一类型的多糖的脂质体,其中不同脂质体中的多糖可以是相同的或不同的,和/或ii)包含多种类型的多糖的脂质体,其中不同脂质体中的多种类型可以是不同的。此外,任选地,一些脂质体可以不包封多糖(在本文中称之为空的)。在一实施方式中,组合物包含脂质体,所述脂质体包含超过一种类型的多糖。在一实施方式中,组合物包含脂质体,其中一些脂质体包封单一类型的肺炎链球菌荚膜多糖,且不同脂质体中单一类型的肺炎链球菌荚膜多糖可以是不同的,和/或一些脂质体包封超过一种类型的肺炎链球菌荚膜多糖,且不同脂质体中超过一种类型的荚膜多糖可以是不同的,并且任选地,一些脂质体可以是空的。
组合物中至少一些脂质体在表面上具有非共价连接的蛋白质分子,从而使蛋白质展示于外表面上。表面展示的蛋白质分子不需要存在于多糖所驻留的脂质体的水性腔室中。在一实施方式中,表面展示的蛋白质分子不存在于水性腔室中,即脂质体不包封蛋白质分子。相反,蛋白质分子仅非共价连接表面并展示于脂质体的外部。蛋白质分子可以是细菌蛋白,如表面暴露的细菌蛋白。表面暴露的细菌蛋白和多糖可以来自相同类型的细菌或不同类型的细菌,或者可以是非细菌蛋白。在一实例中,它们来自肺炎链球菌。
在一实施方式中,该组合物包含:
a)包封单一类型的细菌多糖的脂质体,和/或
b)包封多种类型的细菌多糖的脂质体;
并且其中一种或多种脂质体具有在其表面非共价连接的蛋白质分子,所述蛋白质分子展示于脂质体的外部。
在一实施方式中,该组合物包含:
a)包封单一类型的细菌多糖的脂质体,和/或
b)包封多种类型的细菌多糖的脂质体;
并且其中来自a)和/或b)的一种或多种脂质体具有在其表面非共价连接的蛋白质分子,所述蛋白质分子展示于脂质体的外部。
在一实施方式中,该组合物包含:
a)包封单一类型的肺炎链球菌荚膜多糖的脂质体,和/或
b)包封多种类型的肺炎链球菌荚膜多糖的脂质体;
并且其中至少一些脂质体具有在其表面非共价连接的蛋白质分子,从而使蛋白质的至少部分展示于脂质体的外部。在一实施方式中,蛋白质分子是表面暴露的肺炎链球菌蛋白质。
在一实施方式中,该组合物包含:
a)包封单一类型的肺炎链球菌荚膜多糖的脂质体,其中所述荚膜多糖选自表s1和s2的血清型(分别示于图15和16)和/或
b)包封选自表s1和s2的血清型(分别为图15和16)的多种类型的肺炎链球菌荚膜多糖的脂质体;
并且其中至少一些脂质体具有在其表面非共价连接的蛋白质分子,从而使蛋白质的至少部分展示于脂质体的外部。在一实施方式中,蛋白质分子是表面暴露的肺炎链球菌蛋白质。
在一实施方式中,该组合物包含:多组脂质体,其中各组脂质体包封单一类型的肺炎链球菌荚膜多糖,其不同于组合物中其他脂质体组中所包封的单一类型的荚膜多糖,并且其中一些脂质体可能不包封任何荚膜多糖,并且其中至少一些脂质体具有在其表面非共价地连接的蛋白质分子,从而使该蛋白质分子的至少部分展示于脂质体的外部。在一实施方式中,蛋白质分子是表面暴露的肺炎链球菌蛋白质。单一类型的肺炎链球菌荚膜多糖可以选自表s1和s2(分别示于图15和16)。
在一实施方式中,该组合物包含:
a)包封单一类型的肺炎链球菌荚膜多糖的脂质体,其中所述荚膜多糖选自下述血清型组:1、2、3、4、5、6a、6b、7f、8、9n、9v、10a、11a、12f、14、15b、17f、18c、19a、19f、20、22f、23f和33f和/或
b)包封选自下组的多种类型的肺炎链球菌荚膜多糖的脂质体:1、2、3、4、5、6a、6b、7f、8、9n、9v、10a、11a、12f、14、15b、17f、18c、19a、19f、20、22f、23f和33f;
并且其中至少一些脂质体具有在其表面非共价连接的蛋白质分子,从而使蛋白质的至少部分展示于脂质体的外部。在一实施方式中,蛋白质分子是表面暴露的肺炎链球菌蛋白质。
在一实施方式中,该组合物包含:
a)包封单一类型的肺炎链球菌多糖的脂质体,其中所述多糖选自下述血清型组:1、2、3、4、5、6a、6b、7f、8、9n、9v、10a、11a、12f、14、15b、17f、18c、19a、19f、20、22f、23f和33f和/或
b)包封选自下述血清型组的多种类型的肺炎链球菌多糖的脂质体:1、2、3、4、5、6a、6b、7f、8、9n、9v、10a、11a、12f、14、15b、17f、18c、19a、19f、20、22f、23f和33f;
并且其中脂质体具有在其表面非共价连接的蛋白质分子,所述蛋白质分子包含或选自下组:crm197,白喉类毒素(dt或crm197突变体),破伤风类毒素(tt),钥孔血兰素(keyholelimpethaemocyanin,klh),结核菌素纯化的蛋白质衍生物(ppd),来自细菌表面暴露的蛋白质或蛋白质部分,如pnco,glpo及其组合,从而使蛋白质分子的至少部分展示于脂质体的外部。
在一实施方式中,组合物可以包含脂质体,并且各脂质体包封单一血清型多糖。然而,组合物中的不同脂质体可以具有相同或不同的单一血清型多糖。与脂质体表面非共价连接的蛋白质分子在不同脂质体上可以是相同的或不同的。脂质体可具有展示于表面的单一类型的蛋白质分子或展示于表面的多种类型的蛋白质分子。此外,组合物中的某些脂质体可能不包封多糖,而组合物中的某些脂质体可能不具有连接并展示于表面的任何蛋白质。一些脂质体可能仅包封多糖而没有连接于表面的蛋白质,而某些脂质体可能仅有连接于表面的蛋白质而没有包封的多糖。
当脂质体包封多种细菌多糖类型(血清型)时,类型的数量可以为2-100。例如,数量可以是5到50、5到25、5到20或2-100之间的任何数字。在一实施方式中,脂质体可以包封超过100种多糖类型。在特定实施方式中,血清型可以是15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30或更多种(多达100种)。
脂质体双层可包含本领域已知的一种或多种磷脂。包封多糖并通过非共价连接在表面上展示的的白质分子的脂质结构可以是单层的。在一个实例中,组合物可以包含双层、单层或其他脂质结构的混合物。
本文所用“磷脂”是具有亲水性头部基团的脂质,该亲水性头部基团具有经由甘油主链连接疏水性脂质尾部的磷酸基团。磷脂包含6至22个碳的酰基侧链,其包括这之间所有整数的碳和范围。酰基链可以是饱和或不饱和的。磷脂的实例包括磷脂酰丝氨酸,磷脂酰胆碱,磷脂酰乙醇胺,磷脂酰甘油,磷脂酰肌醇等。实例包括1,2-二油酰基-sn-甘油-3-磷酸胆碱(dopc),1,2-二肉豆蔻酰基-sn-甘油-3-磷酸胆碱(dmpc)和1,2-二硬脂酰基-sn-甘油-3-磷酸胆碱(dspc)。
在一实施方式中,例如,磷脂可以是任何饱和的或不饱和的磷脂。磷脂中的酰基链可包含6至22个碳。脂质体可以包含胆固醇和/或其他固醇,并且磷脂可以经peg化。
在一实施方式中,脂质体双层可以包含卟啉偶联物。在一个实例中,卟啉偶联物中的磷脂是1-棕榈酰基-2-羟基-sn-甘油-3-磷酸胆碱。卟啉偶联物的磷脂可以包含或基本上由磷脂酰胆碱,磷脂酰乙醇胺,磷脂酰丝氨酸和/或磷脂酰肌醇组成。在一个实例中,卟啉通过1至20个碳的碳链接头(包括之间所有整数的碳)与磷脂上的甘油基团偶联。
在各种实施方式中,除了卟啉偶联物,脂质体的双层还包含其他磷脂。这些磷脂的脂肪酸链可以包含合适数目的碳原子以形成双层。例如,脂肪酸链可以包含12、14、16、18、20或22个碳原子。在不同实施方式中,双层包含磷脂酰胆碱,磷脂酰乙醇胺,磷脂酰丝氨酸和/或磷脂酰肌醇。
例如,脂质体双层可以包含卟啉磷脂偶联物,不与卟啉偶联的磷脂,任选地胆固醇,和任选地peg-磷脂。peg可以具有任何方便的大小。例如,peg部分的平均分子量可以在500和5000道尔顿之间以及这之间的所有整数值和范围。也可使用其它peg大小。peg-脂质可以0-20mol%的量存在,包括这之间的所有百分数的量(到小数点后第十位)。peg脂质的实例包括dspe-peg,例如dspe-peg-2000,dspe-peg-5000或其他大小的dspe-peg。
本发明的双层和单层也可以包含固醇。固醇可以是动物固醇或植物固醇。固醇的实例包括胆固醇,谷固醇,豆固醇和胆固醇。在实施方式中,胆固醇可以0mol%-50mol%或0.1-50mol%存在。在其他实施方式中,胆固醇可以1-50mol%、5-45mol%或10-30mol%存在。
蛋白质或肽与脂质体双层非共价连接,从而使其展示于表面。在一实施方式中,组氨酸标记的(his标签)蛋白可以非共价地连接脂质体,从而使蛋白质展示于表面。例如,脂质体在双层内可以包含一个或多个基团/部分(例如,卟啉,大环,氨基酸或金属离子螯合脂质)。以金属为例(例如,co2+、ni2+、zn2+、cu2+和fe3+),金属可以与双层中的部分螯合,从而使金属驻留在双层之中或之内,并且蛋白质可以经由蛋白质的部分(例如,与金属结合的基团或部分,例如组氨酸标签)和金属之间的相互作用(例如,配位)与金属非共价连接,从而使蛋白质的至少部分在双层内,而蛋白质的其余部分存在于结构的外部。例如,双层结构可以包含与钴螯合的卟啉,从而使钴金属驻留在双层和卟啉大环内,并且还具有带有与其非共价连接的组氨酸标签的蛋白质分子,从而使至少部分his标签位于双层内并与钴金属核配位。含有his标签的分子的其余部分展示于脂质体的外部。在另一实例中,金属螯合-配体相互作用,诸如次氮基三乙酸(nta)-镍和多组氨酸之间发生的金属螯合-配体相互作用可以提供组氨酸标签标记的蛋白质与脂质体的非共价连接。因此,ni-nta可以存在于双层中,并且组氨酸标签可以与其非共价连接,从而使蛋白质his标签的至少部分在双层内并且与ni配位。该蛋白质分子的其余部分展示于脂质体的外部
在一实施方式中,代替金属螯合化学,可以使用其他基于亲和力的方法,例如基于链霉亲和素-生物素的化学,以使蛋白质非共价方式连接脂质体。脂质体可以在双层中纳入链霉亲和素,然后可以将生物素化的蛋白质与脂质体双层非共价连接。例如,链霉亲和素可以共价或非共价地连接脂质体。在另一实例中,脂质体可以纳入生物素化的脂质(例如dspe-peg-生物素)。可以将生物素化的脂质体与链霉亲和素连接的蛋白质孵育以形成生物素-链霉亲和素连接(bs连接)。在一实施方式中,可以将含生物素的脂质体连接至链霉亲和素和生物素化的蛋白质,以产生生物素-链霉亲和素-生物素连接(bsb连接)。
可以与脂质体非共价偶联的蛋白质的实例是crm197。能够用于产生多糖免疫原的免疫原性运载体的其他实例包括白喉类毒素(dt或crm197突变体),破伤风类毒素(tt),钥孔血兰素(keyholelimpethaemocyanin,klh)和结核菌素(ppd)的纯化蛋白衍生物。此外,另外地或可替代地,也可以使用来自细菌表面暴露的蛋白质或蛋白质的部分,例如pnco或glpo。在一实施方式中,可以使用pnco和glpo。在一实施方式中,仅可以使用pnco或者仅可以使用glpo。
例如,可以使用引起针对链球菌(例如肺炎链球菌)的保护性免疫应答的pnco或其片段。pnco可以是由链球菌属所产生的任何一种,包括来自肺炎链球菌(streptococcuspneumoniae),格氏链球菌(streptococcusgordonii),血链球菌(streptococcussanguinis),嗜热链球菌(streptococcusthermophilus),猪链球菌(streptococcussuis),无乳链球菌(streptococcusagalactiae),酿脓链球菌(streptococcuspyogenes),变异链球菌(streptococcusmutans),粪肠球菌(enterococcusfaecalis),屎肠球菌(enterococcusfaecium),红球菌属(rhodococcussp)的那些。
pnco不必与来自肺炎链球菌的pnco的氨基酸序列相同。可以在不改变其免疫源性以及其所产生的抗体保护能力的情况下对蛋白质序列进行修饰。例如,保守取代可以在下述氨基酸内进行:1)丙氨酸(a),甘氨酸(g);2)天冬氨酸(d),谷氨酸(e);3)天冬酰胺(n),谷氨酰胺(q);4)精氨酸(r),赖氨酸(k);5)异亮氨酸(i),亮氨酸(l),甲硫氨酸(m),缬氨酸(v);6)苯丙氨酸(f),酪氨酸(y),色氨酸(w);7)丝氨酸(s),苏氨酸(t);和8)半胱氨酸(c),甲硫氨酸(m)。例如,抗原可以与本文提供的pnco的序列具有90%至99%的相同性,其中蛋白质可以引发针对链球菌例如肺炎链球菌的保护性抗体。
对于来自肺炎链球菌d39的pnco(blpy),pnco的序列可以genbank登录号abj54598.1获得。序列如下所提供。pnco序列中的表面可及区以粗体示出。
mkkyqllfkisavfsylffvfglsqltlivqnywqfssqignfvwiqnilsllfsgvmiwilvktghgylfriprkkwlwysiltvlvvvlhisfnvqtakhvqstaegwnvligysgtnfaelgiyvtlffltplmeeliyrgllqhaffkhsrfgldlllpsilfalphflslpslldifvfatfgiifagltrytksiypsyavhvinnivatfpflltflhrvlg(seqidno:1)
在一实施方式中,表面展示的蛋白质的序列可以与已知序列具有80-99%的相同性。因此,非共价连接脂质体表面的蛋白质可以与已知序列至少70%,至少75%,至少80%,至少85%,至少90%或至少95%相同,其中蛋白质能够产生针对链球菌例如肺炎链球菌的保护性抗体。在一实施方式中,pnco与seqidno:1的pnco具有至少70%的相同性,优选80或85%,如至少90%或至少95、98或99%的相同性。
glpo的序列可以来自肺炎链球菌d39genbank登录号ec1.1.3.21获得。序列如下所提供。
mefskktrelsikkmqertldlliigggitgagvalqaaasgletgliemqdfaegtssrstklvhgglrylkqfdvevvsdtvseravvqqiaphipkpdpmllpvydedgatfslfrlkvamdlydllagvsntptankvlskdqvlerqpnlkkeglvgggvyldfrnndarlvienikranqdgalianhvkaegflfdesgkitgvvardlltdqvfeikarlvinttgpwsdkvrnlsnkgtqfsqmrptkgvhlvvdsskikvsqpvyfdtglgdgrmvfvlprenktyfgttdtdytgdlehpkvtqedvdyllgivnnrfpesnitiddiesswaglrpliagnsasdynggnngtisdesfdnliatvesylskektredvesavsklesstsekhldpsavsrgssldrddnglltlaggkitdyrkmaegamervvdilkaefdrsfklinsktypvsggelnpanvdseieafaqlgvsrgldskeahylanlygsnapkvfalahsleqapglsladtlslhyamrnelalspvdfllrrtnhmlfmrdsldsivepvldemgrfydwteeekatyradveaalanndlaelkn(seqidno:2)
glpo序列中的表面可及区在上述内容中加粗。例如,表面蛋白可以与本文提供的glpo的序列具有80%-99%的相同性,其中抗原能够产生针对链球菌例如肺炎链球菌的保护性抗体。在一实施方式中,表面蛋白与本文提供的glpo序列具有至少70%的相同性,优选80或85%,如至少90%的相同性或至少95、98或99%的相同性。
表面蛋白可以是本文所述蛋白质或细菌的其他表面暴露的蛋白质或其免疫原性变体的组合。例如,蛋白质可以是stkp或pspa。
脂质体中蛋白质和多糖的量可以变化,例如,以引起所需量的应答以提供保护。例如,各制剂剂量的脂质体中纳入的蛋白质的量可以是1μg/剂-1mg/剂(例如,30–650μg/剂),包括所有0.1μg/剂值和这之间的范围,和/或脂质体中多糖的量可以是10μg/剂-2.0mg/剂(例如,80–1,100μg/剂),包括所有0.1μg/剂值和这之间的范围,和/或脂质体的量是500μg/剂-15mg/剂(例如,900μg/剂-10mg/剂),包括所有0.1μg/剂量值和这之间的范围。制剂中可能存在其他蛋白质或者不可能存在其他蛋白质,例如,以运载体或赋形剂的形式。
在实施方式中,各剂量的脂质体中纳入的蛋白质可以是10-800μg/剂量,包括这之间的所有的值和范围(至小数点后第十位)以及其间的范围,和/或各剂量的脂质体中的多糖可以是10μg/剂量-1.5mg/剂量或50μg/剂量-1mg/剂量,包括这之间的所有的值和范围(至小数点后第十位)以及其间的范围,和/或各剂量的脂质体中脂质体脂质可以是750μg/剂量-10mg/剂量,包括这之间的所有的值和范围(至小数点后第十位)以及其间的范围。
在一实例中,单个多糖的量为2–44μg/剂量,蛋白质的量为15–350μg/剂量,脂质体的量为500–5000μg/剂量。例如,leps20v制剂可以具有约80-900μg多糖/剂量(0.15–1.25mg/kg,标准化至表面积),约30-650μg蛋白质/剂量(0.09–0.9mg/kg),和950–9500μg脂质体/剂量(约1.4–13.5mg/kg),并且其多糖与蛋白质的比例为约0.14–27μg/μg(目标剂量中为1.36),脂质体与多糖的比例为约1.1–110μg/μg(例如,10.82),和脂质体与蛋白质的比例为约1.5–300μg/μg(例如,14.71)。在另一实例中,leps24v制剂具有105–1050μg多糖/剂量(0.15–1.25mg/kg,标准化至表面积),32–650μg蛋白质/剂量(0.09–0.9mg/kg),和950–9500μg脂质体/剂量(1.36–13.55mg/kg),并且其多糖与蛋白质的比例为约0.16–32μg/μg(目标剂量中为1.6),脂质体与多糖的比例为约0.9–90μg/μg(例如,9)和脂质体与蛋白质的比例为约1.5–300μg/μg(例如,15)。
在各种实例中,脂质体中多糖与蛋白质的比例可以是0.1-50w/w(基于多糖和蛋白质的总重量),包括这之间的所有0.1值和范围。在各种实例中,脂质体中多糖与蛋白质的比例可以是0.1-40w/w(基于多糖和蛋白质的总重量)。在各种实例中,表示为脂质体脂质与多糖之比的脂质体的多糖载量可以是0.5-200w/w(基于脂质体脂质和多糖的总重量)。在一实例中,表示为脂质体脂质与蛋白质之比的脂质体的蛋白质载量可以是1-500w/w(基于脂质体脂质和蛋白质的总重量)。
在一实例中,脂质体(例如,组合物中的脂质体(例如,一个剂量))包含0.6-0.7(例如,0.68)的多糖与蛋白质比例和/或10-11(例如,约10.8)的脂质体脂质与多糖比例和/或7-8(例如,约7.35)的脂质体脂质与蛋白质比例。在另一实例中,组合物包含0.75-0.85(例如,约0.8)的多糖与蛋白质比例和/或8.5-9.5(例如,约9.1)的脂质体脂质与多糖比例和/或7-8(例如,约7.35)的脂质体脂质与蛋白质比例。
在leps制剂中规模化地包封其他多糖的选择进一步突出了与当前糖偶联物疫苗选择的差异,当前的糖偶联物疫苗选择需要连续的努力和制造成本以使新的血清型cps各自共价连接crm197,而这限制了广泛的疫苗覆盖范围和全球使用范围。在leps制剂中可规模化地包封其他多糖可以添加仅包封新的一种或多种多糖的脂质体或制备包封现有和新的多糖的脂质体的形式来完成。相似地,通过向现有制剂中添加脂质体(其中添加的脂质体具有表面展示的新的蛋白质)或者通过制备具有现有蛋白质组和新蛋白的脂质体可以将新的表面展示的蛋白质添加到leps制剂中。
制剂可以包含运载体或赋形剂。所述制剂可以包含佐剂以增强免疫反应的程度或性质。可以根据药学或兽医学领域的标准技术确定免疫原性抗原和/或佐剂的量。
在一个实施方式中,本发明的组合物不具有佐剂。虽然本发明的组合物不需要佐剂,但是如果需要可以使用佐剂。例如,可以磷酸盐缓冲盐水溶液中0.001-50wt%使用佐剂,而抗原以微克至毫克的数量级存在,诸如约0.0001-约5wt%,诸如约0.0001-约1wt%,诸如约0.0001-约0.05wt%。抗原可以微克至毫克的量存在,或约0.001-约20wt%,例如约0.01-约10wt%,或约0.05-约5wt%。佐剂可以作为免疫原性组合物中的单独的组分给予,或者可以纳入脂质体中。
制备疫苗中能够采用的佐剂包括:油佐剂,例如,弗氏完全佐剂和不完全佐剂,矿盐,明矾,二氧化硅,高岭土和碳,多核苷酸和微生物来源的某些天然物质。佐剂的一个实例是α-乳白蛋白和脂肪酸的非共价复合物。能够用于制造复合物的脂肪酸包括不饱和顺式c14-c20脂肪酸(参见wo2014/008465)。
对于本发明的疫苗组合物,可以使用运载体和/或非运载体佐剂。实例包括基于铝的佐剂(如明矾,氢氧化铝或磷酸铝),单磷酰脂质a(mpl)和3-o-去酰化的单磷酰脂质a(或3去o-酰化的单磷酰脂质a或3-o-去酰基-4'单磷酰基脂质a)(3d-mpl)。
药物制剂可以包含添加剂,如稀释剂,佐剂,赋形剂或运载体。这类添加剂可以是液体,如水和油,盐水,葡萄糖等,以及辅助剂,稳定剂,增稠剂或润滑剂,润湿剂或乳化剂或ph缓冲剂,胶凝或增粘添加剂,去污剂和增溶剂(例如,
本发明技术的关键特征是它不需要多糖与蛋白质的偶联。偶联步骤并不简单并且在疫苗制剂的偶联类型(conjugationtype)中,可以包含的多糖(血清型)数量受限于蛋白质的大小。不同的是,因为本发明的技术不需要多糖与蛋白质的偶联,所以它不限制制剂中可以代表多少血清型。因此,本发明的制剂适合于包含已鉴定的新血清型。例如,可以将包封新血清型多糖的脂质体添加到现有制剂中。
本发明的组合物可以以液体制备物,混悬液,乳剂,片剂,丸剂,缓释制剂,乳剂,气雾剂,喷雾剂或者适合将组合物引入对象体内以产生针对肺炎链球菌或其他链球菌的免疫应答的任何其他形式。可以将组合物给予人或非人动物。
可以将组合物总体上给予人群,或者可以靶向处于发展出链球菌感染如肺炎链球菌风险的个体。例如,可以给予与感染个体密切接触的任何个体。
可以使用任何合适的给药途径将组合物引入对象,包括但不限于,肠胃外,皮下,腹膜内,肌肉内,静脉内,粘膜(例如,鼻内),局部,皮内和口服给药。
免疫可以通过单剂量进行,也可以通过间隔开的多个剂量(例如1、2、3、4或5个剂量)进行。例如,可以使用初始给药和随后的加强剂量。所述组合物可以单独给予,或者可以与其他预防性(例如,其他免疫原性组合物)或治疗性组合物(例如抗生素)共同给予或依次给予。
在一个方面中,本公开提供了制备疫苗组合物(如针对肺炎链球菌的疫苗组合物)的方法,其包括制备一组或多组脂质体,其中各组中的所有脂质体都包封单一且相同类型的荚膜多糖(血清型),和将各组混合以获得包含包封所需血清型的脂质体的组合物。因此,包封例如图15和16中一种或多种血清型的脂质体可以用于形成疫苗组合物。在一个实例中,血清型选自下组:1、2、3、4、5、6a、6b、7f、8、9n、9v、10a、11a、12f、14、15b、17f、18c、19a、19f、20、22f、23f和33f。。当需要其他血清型时,可以制备包封那些其他血清型的脂质体,并将其添加到现有的组合物中,或者可以制备包含先前和新血清型的新组合物。
在一方面中,本公开提供了预防个体中的肺炎的方法,包括向个体给予有效量的本文所述的组合物。本公开还提供了降低群体中肺炎总发病率的方法,该方法包括向群体中的多个个体给予有效量的本文所述的组合物,其中免疫原性组合物的给予防止了群体中的至少一些给体发生肺炎,从而降低了人群中肺炎的总发病率。
虽然特定参考文献描述了与产生针对链球菌的免疫应答直接相关的脂质体组合物,但是本文所描述的策略、组合物和方法可应用于任何细菌。例如,leps制剂可以用作金黄色葡萄球菌(staphylococcusaureus),流感嗜血杆菌(haemophilusinfluenzae),卡他莫拉菌(moraxellacatarrhalis),大肠杆菌(escherichiacoli),艰难梭菌(clostridiadifficile)的疫苗组合物。本发明组合物可用于制备和使用的其他细菌包括无乳链球菌(streptococcusagalactae),分枝杆菌(mycobacterium),例如,结核分枝杆菌(mycobacteriumtuberculosis),新型隐球菌(cryptococcusneoformans),非可分型流感嗜血杆菌(non-typeablehaemophilusinfluenzae),流感嗜血杆菌b(haemophilusinfluenzaeb),索氏志贺氏菌(shigellasonnei),克氏锥虫(trypanosomacruzi),脑膜炎奈瑟氏菌(neisseriameningitides)等。
下述实施例作为说明性实施例提供,并不旨在以任何方式进行限制。
实施例1
同类最佳疫苗接种比较
当前研究的第一个实验中,我们寻求建立prevnar疫苗家族的替代品,该替代品依赖于将来自特定血清型的肺炎链球菌多糖共价连接免疫原性crm197蛋白(白喉毒素的失活突变体,其能够扩大偶联的多糖组分的免疫反应性),产生了所谓的糖偶联物疫苗(例如,prevnar13,其特征在于共价连接crm197的13种不同血清型多糖)。与共价多糖-蛋白质偶联不同,我们利用脂质体技术包封所需多糖内容物并非共价连接和表面展示crm197蛋白(图6和7;称之为多糖的脂质体包封(leps))。通过这样做,我们实现了igm到igg的体内抗体转换模式以及与prevnar13相当的总抗体效价的有效性和针对肺炎链球菌细菌攻击的保护(图1a-c)。在这些比较中,还测试pneumovax23疫苗(其包含来自23种血清型的纯化cps)具有相对于prevnar13和leps制剂降低的有效性(抗体类别转换和效价和细菌攻击保护)。重要的是,leps通过多糖和crm197的非共价共定位实现了糖偶联物疫苗的有效性。在leps制剂中规模化地包封其他多糖的选择进一步突出了与当前糖偶联物疫苗选择的差异,当前的糖偶联物疫苗选择需要连续的努力和制造成本以使新的血清型cps各自共价连接crm197,因此,限制了广泛的疫苗覆盖范围和全球使用范围(gregorio,natrevimmunol14,505-514(2014))。
其他试验方法为leps平台的免疫反应提供了新的思路。也就是,图1d显示了调理吞噬细胞活性(opa)试验的数据,其中在与hl-60人吞噬细胞共培养之前,将来自免疫小鼠的血清添加到了19f肺炎链球菌血清型(被当前的prevnar和pneumovax制剂所识别)。很容易观测到所有三种疫苗制剂的细菌杀伤作用,其中leps再次以与当前标准相当的水平进行。表s1(图15)显示了对通过3种疫苗系统的opa试验评估的血清型更深入的比较。相似地,图8强调了除了leps制剂中包括的7种非疫苗血清型以外,还针对prevnar7和13所覆盖的血清型的保护的有效性。鼻腔冲洗实验表明,19f肺炎链球菌血清型并不在小鼠鼻咽中建立驻留,因为在该情况下进行比较的三种疫苗系统中包含相应的多糖。通过其中抗体效价显著降低的抗cd4+t细胞消耗试验提供了对于免疫应答机制的深入理解,这表明通过胸腺依赖性途径的抗原处理(图1f)。最后,兔子对象体内的抗体效价和opa活性展现出与小鼠对象体内一致的趋势(图9)。
扩展蛋白抗原血清型评估和全面覆盖应用的前景
允许使用替代性肺炎链球菌疾病疫苗的相同脂质体技术对于解决基于共生的疾病发展的互补方面具有令人感兴趣的潜力。也就是说,该制剂提供了同时包封作为当前疫苗基础的多糖(定殖免疫靶标)以及脂质体表面定位蛋白质抗原(glpo和pnco;通过抗原发现和验证模型鉴定(li等,procnatlacadsciusa113,6898-6903(2016))),其选择性地靶向肺炎链球菌毒性转变(图5)。测试这种可能性之前,opa试验能够对glpo和pnco蛋白抗原进行更仔细的评估,作为未来免疫实验的保护相关因素(correlate-of-protection)。然而在这种情况下,opa试验评估了响应相应多糖或蛋白质抗原组分的共生疾病进展的定殖(包含浮游细胞的表面cps)和分散(展示表面蛋白抗原靶标的生物膜释放细胞)方面。由此得出的结论与传统opa试验不同,传统opa试验只评估浮游cps细胞靶标,因此对定殖预防具有固有偏差。如表s2(图16)和图10所示,prevnar13、pneumovax23和glpo/pnco蛋白抗原表现出对其相应细胞靶标的特异性活性。值得注意的是,glpo/pnco串联对>70种生物膜释放的肺炎链球菌血清型具有活性。这是最大且最全面地评估针对肺炎链球菌疾病的先进抗原,以及肺炎链球菌血清型间glpo/pnco基因的高序列保守性(li等,sciadv2,e1600264(2016)),强调了对于毒性转变的肺炎链球菌细胞的通用保护潜力。还对蛋白质抗原的免疫应答机制进行了更彻底的测试(在leps制剂内或与leps制剂分开),显示了主要的th2应答,其中在小鼠中导致th1和th17活性(图2a-e),而在兔子中导致相应的体液应答(图2f)。为了支持抗原类型的互补性方面,pnco和glpo蛋白与prevnar7以共同给药和附加给药形式进行了测试,证明了通过解决共生定殖、毒性转变或两者的保护能力(图11)。
通过leps技术的综合疫苗平台
然后,pnco和glpo蛋白抗原与多糖脂质体包含物(containment)的偶联产生完整的leps载剂(leps20:pnco和glpo;图3),因此,允许对共生疾病进展疫苗接种范例进行最终评估。从图1和图2中的数据来看,完整leps载剂预期将具有理想的免疫应答特性(类别转换,记忆,广泛的t细胞活化)。在肺炎链球菌疾病转变的体内甲型流感病毒(iav)引起的肺炎模型中进行测试时,除了全面和定向保护外,还对完整载剂中的各种抗原类型产生了体液应答(图3a)。策略性血清型之间的攻击试验(19f[图12],11a和35c)确认了prevnar13和pneumovax23的保护极限,并强调了完整leps系统的全面保护功能(图3b)。强调抗原互补性,leps20:pnco和glpo制剂提供了全面保护,即使没有防止11a和35c血清型定殖所必需的cps。相关解剖学特征进一步证实了最终leps制剂抑制非疫苗血清型疾病扩散的能力。肺炎和败血症疾病模型伴随着相似结果(图13)。
尽管leps疫苗的有效性是一个关键结果,但是更广泛的含义是消除肺炎链球菌最具侵入性的血清型的定殖并同时防止当前疫苗制剂未涵盖的生态位替换的血清型的毒性转变的双重潜力。这有可能是因为glpo和pnco抗原具有通用保护潜力(表s2(图16)),这要归功于肺炎链球菌菌株之间的序列保守性以及跨多种抗原的抗原漂移最小化。图4提供了侵入性肺炎链球菌疾病病例的当前和预测时间表,其强调了非疫苗血清型的顽固性以及leps制剂解决这类问题的潜力。值得注意的是,leps平台还通过包封所有已知的肺炎链球菌血清型多糖(除了表面展示glpo和pnco蛋白抗原)的前景为普遍性提供了技术上可行的愿景,这是对于利用多糖-蛋白质偶联化学的当前糖偶联物疫苗产品在经济上不可行的选择。因此,leps平台结合了当前疫苗的最佳方面,同时预计了共生共病发展的基本原则。
本公开提供了两种互补抗原的共定位后作为肺炎链球菌疾病的下一代疫苗。在不影响当前疫苗设计有效性的前提下,我们引入了改进,使疫苗对疾病的反应具有普遍性。因此,所得leps平台使侵入性血清型定殖最小化,同时还防止所有定殖血清型的毒性转变。因此,完整的疾病进展途径指导了疫苗的开发,其为应对肺炎链球菌疾病的挑战性方面提供了全面的答案。广而言之,本研究中概述的概念试图用一种可调节的方法来平衡微生物共生的利与弊,以为了使宿主的利益最大化而消除或保持驻留。
材料和方法
实验设计。在肺炎链球菌疾病疫苗接种的背景下,使用脂质体运载体平台将源自对于基于共生的疾病进展的理解和分析的互补抗原共定位。评估的形式包括:脂质体载体表征;组织特异性疾病进展;抗体,细胞因子和t细胞消耗分析;终点和时间-过程攻击-保护试验;全面的调理吞噬活性试验以及在大鼠和兔子模型中进行的测试。数据统一支持有效的疫苗接种策略,其能够指导基于共生的疾病的各阶段的免疫应答,并且在肺炎链球菌疾病的情况下具有普遍覆盖的潜力。
伦理声明。该研究严格按照《美国国立卫生研究院实验动物的护理和使用指南》(guideforthecareanduseoflaboratoryanimalsofthenationalinstitutesofhealth)中的建议进行。该方案已由布法罗大学(universityatbuffalo)的机构动物护理和使用委员会批准。所有细菌接种和治疗均在设计为最大程度降低动物潜在痛苦的条件下进行。
试剂。细菌和细胞培养基(包括化学成分确定的细菌生长培养基[cdm])和试剂购自飞世尔化学公司(fisherchemical)和西格玛奥德里奇公司(sigma-aldrich)。绵羊血购自贺姆斯特化学公司(hemostatlaboratories)。脂质dopg-na和dspe-peg2000获自nof;dogs-nta-ni购自阿凡提极性脂质制品公司(avantipolarlipids);dopc,胆固醇和明矾(如磷酸铝)以及多糖购自西格玛奥德里奇公司。ll-37购自英韦沃基公司(invivogen)。prevnar7和13和pneumovax23疫苗分别获自辉瑞公司(pfizer)和默克公司(merck)。
抗原制备。所有蛋白质(crm197,绿色荧光蛋白[gfp],pspa,glpo和pnco)通过大肠杆菌使用多组氨酸标签重组生产。通过协作交换获得含有针对gfp、crm197和pspa的基因的质粒(li等,sciadv2,e1600264(2016);stefan等,jbiotechnol156,245-252(2011))。剩余的基因pcr扩增自肺炎链球菌基因组dna,并使用通过pcr引物引入扩增产物的限制性位点saci/xhoi(glpo)和ndei/xhoi(pnco)克隆到单独的pet21c载体(li等,procnatlacadsciusa113,6898-6903(2016))。通过限制性消化和集落pcr确认质粒后,将最终构建体化学转化到大肠杆菌bl21(de3)中,以通过使用异丙基β-d-1-硫代吡喃半乳糖苷(iptg;1mm)诱导od600nm值为0.4-0.6的3ml溶菌肉汤(lb)培养物然后通过sds-page分析来确认个体表达。通过使用弗氏压碎器破坏细胞并使细胞裂物通过快速蛋白液相色谱柱(ge医疗公司(gehealthcare)histraphp,1×1ml)确认的表达促进了规模化的1l培养物的表达和蛋白纯化。使用piercetmmicrobcatm蛋白质试验对最终蛋白质产物进行定量。
leps制备和表征。通过脂质体递送系统将蛋白质和多糖组分共定位。
leps脂质体运载体由摩尔比为3:3:1:4:0.1的dopc:dopg:dogs-nta-ni:胆固醇:dspe-peg2000组成,总脂质质量为500μg。脂质溶解在氯仿中后,使用branson450dsonifier将溶液超声处理1分钟(使用锥形尖端以20%的振幅),然后使用旋转蒸发仪蒸发以形成薄膜。然后使用包含多糖抗原的磷酸盐缓冲盐水(pbs)将脂质再水化以形成脂质体,然后是脂质体通过孔径为200nm的手持式挤出机(阿凡提极性脂质制品公司)10-12次。在冰上,使背景脂质体溶液两次通过50nm孔径的过滤器,并每次替换pbs。然后,将蛋白质与脂质体在4℃孵育30分钟,并通过多组氨酸标签-ni螯合介导表面连接。用于图1;图8;图9;图14;表s1(图15)的leps制剂包含crm197;用于图2;图3;图10;图12;和图13的leps制剂不包含crm197(由glpo/pnco替代)。在该阶段,在4℃下通过过夜透析(100kdamwco)将任何未结合的蛋白质和多糖与最终leps构建体分离。在整个研究中,疫苗接种过程中使用的最终制剂由包含单个多糖的leps颗粒的混合物组成。例如,最终20价的cpsleps制剂由混合20种单独制备的样品得到。或者,还测试了共制剂方法(使用有限数量的血清型多糖),并与以上直接描述的混合方法进行了比较,最终疫苗保护没有差异(图14)。制备所有最终leps制剂,以递送与prevnar和pneumovax制剂中所用相同量的多糖内容物(和crm197蛋白,按需),将其在免疫之前在pbs中以1:10稀释。
通过分析多糖包封和表面蛋白结合效率开始表征leps颗粒。在一定范围的多糖(使用19f)或蛋白质(使用gfp)与脂质比率上完成定量,以鉴定效率的交叉点(图7)。为了进行多糖评估,将浓缩的硫酸(150μl)和30μl苯酚(5%w/v)添加到50μl的脂质体溶液中,然后在80℃孵育30分钟和22℃孵育30分钟,然后在495nm处进行比色分析。以359nm激发波长和508nm发射波长下通过荧光分析法测量蛋白质内容物。两种分析均使用synergy4多模式酶标仪(biotek仪器有限公司(biotekinstruments,inc.))进行,并将测量值与标准品(使用葡萄糖或gfp)进行比较,并与引入leps生产过程的多糖和蛋白质的初始量进行比例分析。zetasizernano-zs90(莫尔文有限公司(malvern,inc.))上的动态光散射(dls)用于评估25℃的脂质体颗粒直径和ζ电位。使用与入射激光束成90°固定测量角度的4mw633nmhene激光器作为光源进行所有实验。这样获得leps颗粒的图像:在100kv下通过jeoljsm-cxii透射电子显微镜分析,通过浸涂200目福尔瓦(formvar)和碳涂层网格(fcf-200-cu-tb,电子显微镜科学公司(electronmicroscopysciences))制备样品,然后使用1%的乙酸铀酰溶液染色阴性。
疫苗免疫。将六周龄的远交雌性cd-1小鼠(哈伦实验室公司(harlanlaboratories))用于免疫实验。小鼠通过皮下注射(200μl)进行免疫;制剂的背景溶液是pbs(“假型”阴性对照是未给予抗原组分的背景溶液)。裸制剂或脂质体制剂(glpo,pnco,crm197和pspa)中的最终蛋白质抗原水平为12.5μg。当组合时,分别以6.25μg给予pnco和glpo。除非另有说明,否则根据生产商说明将明矾佐剂添加到蛋白质样品中。14天后,小鼠经相同的制剂增强;在第14天和第28天通过眼眶后出血收集血清样品用于抗体和opa分析。在第0天和第14天通过肌肉内注射500μl相应的样品对4月龄的新西兰白兔(科拉里克生物公司(cocalicobiologicals))进行免疫;在第14和28天收集外周血液样品用于抗体和opa分析。
细菌制备和生物膜释放。该研究中使用的细菌菌株最初在补充有0.5%酵母提取物和5%羊血的todd-hewitt琼脂板上生长,并在37℃下孵育过夜。使用单个菌落接种5ml含有0.5%酵母提取物的todd-hewitt肉汤,并在37℃下孵育至od600为0.6。此时,通过离心收集细菌,用pbs洗涤一次并重悬于pbs中,并通过od600测量进行定量,用于需要浮游细胞的实验。将浮游细胞引入体外生物膜模型,并用于所有opa试验(除非另有具体说明),小鼠定殖分析和体内流感诱导的肺炎模型。
为了建立生物膜条件,首先将nci-h292上皮细胞(crl-1849;atcc)在rpmi-1640培养基中培养,并在37℃和5%co2下将胎牛血清添加到t75烧瓶中。达到100%融合度后,h292细胞在4%缓冲的多聚甲醛中以34℃预固定48小时,然后用pbs洗涤3次。然后将cdm生长的肺炎链球菌接种到固定的h292细胞上,并每12小时更换一次培养基。将形成的生物膜暴露于热(38.5℃)4小时,然后通过离心收集释放的细胞,用pbs洗涤一次并重悬于pbs中,并通过od600测量进行定量。利用生物膜释放的细胞进行的实验包括体内败血症和肺炎模型。
攻击模型(challengemodels)。通过腹膜内或鼻内(使用异氟烷)给药分别用1×104(败血症模型)或1×106(肺炎模型)菌落形成单位(cfu)的肺炎链球菌菌株攻击小鼠。为了诱导定殖,将1×106cfu细菌鼻内给予小鼠,不使用异氟烷。为了促进流感诱导的肺炎,肺炎链球菌定殖后,鼻内接种40噬斑形成单位的iav(菌株a/pr/8/34[h1n1;atccvr-95];通过噬斑试验确定效价)。。每四个小时监测一次小鼠的发病迹象(蜷缩,皮毛起皱,嗜睡和腹部表面温度)。通过co2窒息和颈脱位法对发现濒死的小鼠实施安乐死。
抗体分析。如先前所述(li等.,sciadv2,e1600264(2016))进行抗原抗体效价分析,并将方法扩展至包括来自相关血清型的20种多糖以及glpo和pnco蛋白抗原。因此,分析扩展到研究中使用的所有抗原。使用fn-γ和il-17aelisa试剂盒(r&d系统公司(r&dsystems))完成细胞因子测量。
组织细菌计数。定殖后第5天,如图1e和s7b&c所示分析样品。在流感诱导肺炎后,在iav给药后1和5天(如所示)或在濒死时对小鼠进行分析,收集鼻咽组织,鼻咽灌洗液,肺和血液样品的组合并如之前所述确定细菌负荷(tyx等,jbacteriol193,3512-3524(2011))。简言之,将组织和器官匀浆,灌洗液和血液均质化以确保细菌聚集体的解离,然后在胰蛋白酶大豆和5%血琼脂板上连续稀释,然后进行计数。
cd4+消耗。对于体内cd4+t细胞消耗,连续三天将0.5mg抗-cd4+单克隆抗体(英杰公司(invitrogen))腹膜内注射到小鼠中。第六天后,使用流式细胞仪确认t细胞消耗≥95%,然后将这些小鼠对象用于指定的实验中。
opa分析。扩展之前的方案(romero-steiner等,clinicalandvaccineimmunology:cvi13,165-169(2006)),用二甲基甲酰胺分化人hl-60细胞以定量抗体介导的调理吞噬作用,以及杀伤暴露于收集自免疫小鼠对象血清的稀释液的肺炎链球菌以鉴定50%杀伤终点(通过cfu计数定量)。hl-60和肺炎链球菌孵育75分钟。
统计学分析。通过graphpadprism软件(6.0h.283;格拉夫派得软件公司(graphpadsoftwareinc),加利福尼亚州拉由拉市),使用针对未配对数据的斯氏t检验分析比较的统计学显著性。所有数据均来自至少3样品,并使用了4-12个对象进行了动物实验。
实施例2
在该实施例中,我们开发了leps制剂的另一实施方式,其解决了潜在的安全问题并建立了理想的肺炎链球菌疫苗。安全性问题通过以下方式解决:评估与glpo相关的潜在脱靶免疫原性并评价替代性蛋白质-脂质体连接策略以消除对于hig标签标记的蛋白质的依赖(并消除潜在的新抗原引入)。通过这样做,我们从制剂中去除了glpo,同时通过pnco的剂量递增和扩展疫苗使其包含24cps保留了生物膜突破性(breakthrough)毒性靶向。然后,我们使用单剂量递增研究评估了全面的leps设计。这些研究代表了通用肺炎链球菌疫苗开发的重要一步。
结果
与glpo相关的脱靶免疫原性的风险评估
肺炎链球菌glpo和pnco蛋白抗原具有对天然微生物组群内同源靶标免疫反应的风险。虽然在初始免疫研究中未观测到阴性毒理学评分,但是使用50%blast同源性筛选对glpo和pnco蛋白针对人共生细菌中的靶标进行了序列同源性搜索。尽管没有鉴定出pnco的命中,但发现大量微生物组群蛋白靶标与glpo具有>50%的同源性(表s4(图27))。从鉴定的细菌的子集中选择了代表不同同源性和生理学位置的10个物种进行进一步分析(图18)。
然后,在免疫荧光试验中测试来自接种glpo的小鼠的血清,以确定针对肺炎链球菌glpo的抗体是否表现出脱靶细菌结合。相对于假型疫苗接种,观测到了对于测试细菌种类的强抗体结合(图18a)。此外,几种物种的免疫荧光与肺炎链球菌ef3030(19f)菌株(其是glpo疫苗的直接靶标)所获得的免疫荧光相当。在蛋白质同源性的背景下评估免疫荧光时(图24),观测到显著的正相关性(r2=0.858),这表明观测到的结合强度与序列同源性相关。考虑到观测到的脱靶抗体结合,使用4种代表性物种进行opa试验,以确定所得抗体结合是否具有中和活性。如图18b所示,相较于bfref3030,观测到对于各种细菌物种具有显著的杀伤活性。综上,这些结果表明,用具有glpo的疫苗接种可能会影响人微生物组。
leps(20v)制剂中的蛋白质抗原剂量递增
对于蛋白质抗原,为了确立剂量极限并评估个体有效性,对具有不同剂量(34、68或136μg)的glpo和pnco的20价leps(leps(20v))疫苗制剂进行了免疫原性和opa评估。使用跨越6种疫苗和nvt血清型(6c,35b,15c,16f,23a和9n)的bfr肺炎攻击模型确定疫苗效力。如图19所示,相较于
为了评估免疫原性,我们测量了疫苗接种产生的抗体的产生和中和活性。当对不同剂量的glpo(图25)、pnco(图3a-c)和glpo+pnco(图26)的抗体效价进行定量时,观测到所有cps和蛋白质抗原显著产生抗体。有趣的是,发现靶向cps的相对抗体效价随着蛋白质剂量从34μg增加到68μg而增加(图20)。然而,当剂量从68μg增加到136μg时,cps抗体显著下降(图20)。然后,使用浮游细菌或bfr细菌测量opa试验对这些抗体的中和活性(表5、6(分别为图28和29))。与抗体效价的观察结果一致,当蛋白质剂量增加至136μg时,浮游细菌的50%杀伤稀释度降低。相反,bfr细菌的50%杀伤稀释度通常随蛋白质剂量而增加。综上所述,这些研究表明,glpo或pnco的独立的剂量递增可以作为共制剂的替代。
iav肺炎攻击模型中的pnco剂量递增
由于担心glpo的脱靶免疫原性,我们使用甲型流感病毒(iav)肺炎攻击模型(其模拟体内生物膜释放毒性肺炎链球菌)来进一步确认pnco作为独立(stand-alone)蛋白质的功效。用iav接种定殖有经调理的ef3030(19f)肺炎链球菌的小鼠,以促进细菌从鼻咽生物膜传播到血液和肺。如图21所示,增加pnco剂量降低各位置的细菌负荷。有趣的是,用pnco疫苗接种导致iav感染后的鼻咽定殖减少。这可能是由于用以增强定殖的细菌初始调理而引起的pnco上调。无论如何,该研究进一步证明,。将pnco剂量增加到超过我们最初的34μg剂量,会明显阻止肺炎链球菌的繁殖和传播。
建立24价leps疫苗
为了证明leps疫苗平台的通用性,我们评估了引入20价制剂中的4种新的血清型cps的免疫原性和opa水平。具体地,选择10a、11a、15b、33f血清型以涵盖当前使用的疫苗中所包括的所有血清型。最初分别评估各种cps的免疫原性,如图21所示。用各种cps实现有效的抗体产生以及igm到igg类型转换(图22a和b)。这些结果表明进一步支持leps包封过程对于任何肺炎链球菌cps都是可通用的。
在单独评估新的cps抗原的初步研究后,我们将所有4个新的制剂与我们的leps20v疫苗组合在一起,以创建新的24价疫苗(leps(24v))。此外,为了评估由于包括其他cps所导致的潜在的免疫原性丧失,我们评估了所有24种血清型的相对抗体效价。如图22c所示,用pnco或crm197配制的leps(24v)对所有血清型产生显著的cps抗体效价。此外,测得的抗体效价通常与市售疫苗的效价相当。此外,将opa试验用于测量获自用leps(24v)制剂疫苗接种的小鼠的血清的中和活性。如表s7(图30)所示,在所有共享和非共享血清型中,crm197和pnco制剂能够获得与pcv13相当的opa效价。综上,这些结果表明,leps配制策略是可通用且可扩大规模的方法,用于组配针对肺炎链球菌的基于cps的疫苗。
研发替代性蛋白质-脂质体连接策略
leps平台的特征之一是蛋白质的非共价表面定位。例如,我们使用了his标签标记的蛋白质和含有镍-nta的脂质。然而,虽然迄今为止我们尚未在免疫研究期间观测到任何不良反应,但是为了解决与使用镍以及his标签标记的螯合成分有关的任何潜在毒性和/或不利免疫原性问题,我们评估了用于运载体或抗原蛋白的其他非共价连接方法。最初的变化包括螯合金属(镍[ni2+]相对钴[co2+])或金属支架(nta相对卟啉)的变化。此外,评价了两种生物素-链霉亲和素系统,两者的特征在于都将生物素化脂质(dspe-peg-生物素)纳入了脂质体。在一系统中,将表示为“bsb”的包含生物素的脂质体与链霉亲和素和生物素化的蛋白质孵育,以产生生物素-链霉亲和素-生物素连接(bsb连接)。在另一系统中,将生物素化的脂质体与链霉亲和素连接的pspa一起孵育,以形成生物素-链霉亲和素连接(bs)。
最初,将电泳迁移率变动分析(emsa)用于通过确定与脂质体表面结合的蛋白质部分来测量结合效率。如图23a所示,所有脂质体变体随时间提供至少50%的蛋白质结合,并且bs和bsb策略两者在所有孵育时间内显示了相对于金属螯合选择相当或增强的结合。有趣的是,当将这些制剂用于递送19fcps时,结合效率作为了免疫原性的一般代表。小鼠免疫后,cps抗体类型转换的程度(图23b)和效价(图23c)与各种制剂的蛋白结合效率相关联。具体地,bs制剂在抗体效价和抗体类型转换方面显著优于co-nta。此外,通过opa试验的测量,观测到了中和活性的这些趋势(图23d)。最后,使用动态光散射对所有制剂进行表征,以确定脂质体大小分布和表面电荷。如表s8(图31)所示,各脂质体制剂的性质相似。但是,包括蛋白质和多糖增加脂质体大小,并且包含蛋白质导致脂质体表面的负电荷增加。综上所述,这些结果凸显了leps平台在保留各种制剂变化功效方面的灵活性,所述制剂变化旨在促进临床转译和实用性。
leps急性毒性的单剂量评估
为了评估leps疫苗的毒性,我们在cd-1小鼠中进行了单剂量递增研究以评估急性毒性并鉴定最大耐受剂量(mtd)。在这些研究中,使用我们的治疗剂量(34μg蛋白质和2.2μg各种cps)以及5和10×剂量对动物进行疫苗接种。如表1所示,雄性和雌性小鼠耐受高达10倍治疗剂量的leps中的蛋白质和cps。此外,通过测量血液中的代谢物和白细胞浓度来评估与疫苗接种相关的血液学影响(表9,表10(分别为图32和图33))。
如表9(图32)所示,血液中的各种化学物质的水平在所有剂量下都大部分相似。虽然不同组的钠浓度在统计学上不同,但是它的浓度没有可辨别的模式。类似地,观测到的是所有组中不同白细胞的浓度相似(表s10(图33))。在这些研究中,观察到与疫苗剂量增加相关的淋巴细胞略有增加,这表明潜在的免疫应答;然而,差异不存在统计学上显著的差异。虽然在疫苗接种时发生了轻微的反应性,但是仅限于最初的疼痛和刺激,不会引起长期困扰。综上所述,这些结果表明,leps疫苗在动物中没有显示出显著的急性毒性。
讨论:
虽然已经开发了针对肺炎链球菌的有效疫苗,但是不完全的血清型覆盖以及突破性疾病的可能性导致全球医疗保健的负担沉重。该实施例说明通过将覆盖扩展至24种血清型,整合为一种表面连接的蛋白抗原(pnco),鉴定各剂量合适量的蛋白质(例如,68μg)和鉴定替代连接策略,使用本发明的leps系统能够应对其他血清型的挑战。综上所述,通过阐明临床开发计划,简化制造过程和解决安全问题,这些结果有助于提高leps系统的临床就绪性。
例如,在此实例中,我们使用了不含glpo的疫苗制剂并增加了pnco剂量。此外,我们证明了leps疫苗可以通过替代性非共价蛋白表面连接方法进行功能性组配。
有趣的是,我们观察到了与疫苗接种中蛋白质浓度的增加以及其他蛋白质与脂质体连接策略的结合亲和力相关的特殊效果。具体地,我们观察到将pnco剂量从34μg增加至68μg改善了所有20种cps的相对抗体效价(表11(图34))并改善了14/20血清型的opa试验结果(表s12(图35))。尽管cps内含物保持恒定,但是仍可以观察到这一点。然而,进一步使pnco内容物倍增至136μg降低相对抗体效价和opa测定性能(分别为表s11,s12(图34和35))。中间蛋白质浓度,有效增加表面蛋白质的浓度,也可以有效激发免疫应答。
材料和方法
待用于研究的细菌和细胞株(全部包括)
这项研究中的肺炎链球菌菌株包括>70种血清型,而肺炎链球菌ef3030(血清型19f)作为opa和免疫荧光研究中的对照。补充表1中所列出的细菌种类用于微生物组群研究,其包括opa和免疫荧光试验。nci-h292上皮细胞(crl1849,美国典型培养物保藏中心(americantypeculturecollection,atcc))被用于支持生物膜的生长。分化人hl60细胞,用于标准和改良的opa研究。
同源性搜索描述
通过考虑可以获自blast(blast.ncbi.nlm.nih.gov)的共生细菌氨基酸序列中的缺口和错配,计算共生细菌物种中glpo同源物的保守性(补充表1)。使用interpro数据库(ebi.ac.uk/interpro)建立了表面可及性,并以使用iedb分析资源(tools.immuneepeepitope.org/bcell)的bepipred线性表位预测方法预测了表位区域。用于该研究的参照glpo序列是肺炎链球菌d39(登录号cp000410.1)。
细菌生长和接种
该研究中使用的肺炎链球菌菌株最初在补充有0.5%酵母提取物和5%(体积/体积)羊血的todd-hewitt琼脂板上生长,并在37℃下孵育过夜。将单个菌落转移至5ml含有0.5%酵母提取物的todd-hewitt肉汤,并在37℃下孵育至od600为0.6。然后将细菌在化学成分确定的培养基(cdm)中以1:10稀释至od600约为0.5ml,然后将其添加到包含固定的h292细胞层的24孔板的各孔中。或者,通过离心收集培养的浮游肺炎链球菌,用pbs洗涤一次并重悬于pbs中,并通过od600测量进行定量,用于需要浮游细胞的实验。
h292细胞生长与固定
首先将nci-h292上皮细胞在rpmi1640中培养,并在37℃和5%co2将胎牛血清添加到t75烧瓶中。达到100%融合度后,去除培养基,并将细胞与胰蛋白酶-edta溶液孵育直至细胞层分散。然后通过离心收集细胞,并在具有fbs的rpmi1640中以1:8稀释,并转移至24孔板中,并如上所述生长直至达到100%融合度。达到100%融合度后,用pbs洗涤h292细胞,在4%缓冲的多聚甲醛中以34℃预固定48小时,并用pbs洗涤3次。
生物膜生长和释放
除非另有说明,否则将如上所述将cdm生长的肺炎链球菌接种到固定的h292细胞上,并在37℃孵育48小时。在整个生物膜生长阶段,每12小时更换一次培养基。为了促进肺炎链球菌的生物膜释放,除非另有说明,否则将生物膜暴露于热(38.5℃)下4小时。所有释放以相同时间进行以减少变异性。然后通过离心收集释放的细胞,用pbs洗涤一次并重悬于pbs中,并通过od600测量进行定量。然后将这些生物膜释放的细胞用于肺炎链球菌疾病性肺炎和败血症模型。
蛋白质产生和纯化
使用大肠杆菌(bl21(de3)),采用多组氨酸或链霉亲和素标签重组产生所有蛋白质[crm197、glpo、pnco、pspa]。首先将细菌菌株接种到3ml的溶菌肉汤中并生长过夜。然后将细菌转移至1l的溶菌肉汤中并生长直至od600到达0.4-0.6。随后使用1mm异丙基β-d-1-硫代吡喃半乳糖苷(iptg)诱导蛋白质产生,并将培养物在22℃孵育过夜。通过使用弗氏压碎器破坏细胞并使细胞裂物通过快速蛋白液相色谱柱(ge医疗公司histraphp,1×1ml和xxxx)进行蛋白质纯化。使用piercemicrobca蛋白质试验试剂盒对最终蛋白质产物进行定量。
leps制剂和组配
leps载体如下配制:除非另有说明,leps运载体由摩尔比为3:3:1:4:0.1的dopc/dopg/dogs-nta-ni/胆固醇/dspe-peg2000组成,其总脂质质量为500μg。将脂质溶解在氯仿中,超声处理一分钟,然后使用旋转蒸发仪蒸发以形成膜。使用包含单个荚膜多糖抗原的磷酸盐缓冲盐水(pbs)将膜再水化,以形成脂质体载体。然后将这些颗粒通过孔径为200nm的手持式挤出机(10-12次)。将20种(或24种)单独制备的leps样品(各自包含不同的cps)与含有多组氨酸或strep标签的蛋白抗原(crm197、glpo、pnco或pspa)于4℃孵育30分钟,以经由多组氨酸标签-镍螯合促进表面结合。通过在4℃的pbs中过夜透析去除未结合的蛋白质或未包封的cp。然后将所有样品组合以形成最终20或24价的leps变体。20价制剂包含20价的:1、2、3、4、5、6a、6b、7f、8、9n、9v、12f、14、17f、18c、19a、19f、20、22f和23f。24价制剂包含1、2、3、4、5、6a、6b、7f、8、9n、9v、10a、11a、12f、14、15b、17f、18c、19a、19f、20、22f、23f和33f。
或者,配制成促进生物素-链霉亲和素连接的脂质体由摩尔比为3:3:1:4:0.1的dopc/dopg/dogs-nta-ni/胆固醇/dspe-peg-生物素组成。如上所述,使用链霉亲和素和生物素化的蛋白质或链霉亲和素偶联的蛋白组配脂质体颗粒。这些孵育进行了不同的持续时间,而结合蛋白质的结合部分使用emsa试验确定。对于使用替代脂质体的后续研究,使用利用30分钟孵育组配的颗粒。
电泳迁移率变动分析
这样进行emsa实验,使用2.5μg蛋白质与50μg脂质体孵育,然后在0.75%琼脂糖凝胶中电泳,施加50v电压90分钟,并使用具有指示激发和发射滤光片的ivisluminaii系统进行成像。对于emsa血清稳定性测试,将3μg蛋白与60μg脂质体在40μlpbs中预孵育。孵育24小时后,添加40μl胎牛血清(fbs,vwr#82013-602)并再孵育8小时。对于咪唑置换实验,1μg报告蛋白与pbs中的20μg脂质体结合。然后滴定咪唑并用荧光评估结合。对于血清稳定性,将1μg报告蛋白与100μlpbs中的20μg脂质体结合,然后加入等体积的fbs,并用荧光监测结合。使用rgd-hisfam荧光团淬灭评估肽结合,然后将500ng肽与20μg脂质体孵育。
动物免疫以及血清收集
六周龄的远交雌性cd-1小鼠用于免疫实验。通过皮下注射(200μl)对小鼠进行免疫。然而,在毒理学评估中,小鼠经肌肉内免疫。用于制剂的背景溶液是pbs(“假型”阴性对照是没有抗原组分的背景溶液)。最终蛋白抗原浓度按以下浓度递增:34、68和136μg。当组合时,分别以68、136和272μg给予glpo和pnco。作为阳性对照,也用pcv13或ppsv23免疫小鼠,如前所述(ref)。免疫后第14天,小鼠经相同的制剂增强。免疫后第14天和第28天,经由眼眶后出血由小鼠收集血清样品以进行抗体和opa分析。
抗体效价和类别的测量
如先前所述(li,y.等scienceadvances2,doi:10.1126/sciadv.1600264(2016))进行抗原抗体效价分析,并将方法扩展至包括来自相关血清型的20种多糖以及glpo和pnco蛋白抗原。因此,分析扩展到研究中使用的所有抗原。
标准opa试验
扩展之前的方案(romero-steiner,s.等clinicalandvaccineimmunology13,165-169,doi:10.1128/cvi.13.2.165-169.2006),用二甲基甲酰胺分化人hl-60细胞以定量抗体介导的调理吞噬作用,以及杀伤暴露于收集自免疫小鼠对象血清的稀释液的肺炎链球菌以鉴定50%杀伤终点(通过cfu计数定量)。hl60细胞和肺炎链球菌孵育75分钟。
bfr改良的opa试验
标准opa试验经改良以对抗体介导的调理吞噬作用和bfr肺炎链球菌的杀伤进行定量。这是这样完成的,其通过用bfr细菌代替浮游肺炎链球菌,然后将其暴露于收集自免疫小鼠对象血清的稀释液以鉴定50%杀伤终点(通过cfu计数定量)。hl60细胞和肺炎链球菌孵育75分钟。
使用微生物组群细菌的opa试验
使用上述标准opa试验,当暴露于收集自经glpo免疫的小鼠对象血清的稀释液时,抗体介导的调理吞噬作用和杀伤共生细菌(如图18a所示)或肺炎链球菌ef303(阳性对照)。这样做是为了鉴定杀伤终点(通过cfu计数定量)。hl60细胞和细菌细胞孵育75分钟。
肺炎链球菌攻击模型(bfr肺炎,iav肺炎)
bfr肺炎:通过鼻内(使用异氟烷)给药,用1×106(肺炎模型)cfu的肺炎链球菌菌株攻击小鼠。每四个小时监测一次小鼠的发病迹象(蜷缩,皮毛起皱,嗜睡和腹部表面温度)。通过co2窒息和颈脱位法对发现濒死的小鼠实施安乐死。
iav肺炎:为了诱导定殖,将1×106cfu小鼠传代的肺炎链球菌ef3030鼻内给予小鼠,不使用异氟烷。为了模拟流感诱导的肺炎,肺炎链球菌定殖后,鼻内接种40噬斑形成单位的iav。使用适应小鼠的iav株a/pr/8/34(h1n1)(atccvr-95),并通过噬斑试验确定效价。每四个小时监测一次小鼠的发病迹象(蜷缩,皮毛起皱,嗜睡和腹部表面温度)。通过co2窒息和颈脱位法对发现濒死的小鼠实施安乐死。
细菌负荷评估
在预定的时间点(分别在腹膜内和鼻内攻击感染后24小时和48小时)或在濒死时对小鼠实施安乐死(如前所述),并收集鼻咽组织,鼻咽灌洗液,肺,肝,脾和血液样品的组合并评估细菌负荷。将组织和器官样品,灌洗液和血液均质化(设置为10持续30秒或直到完全均质化;tissue-tearor,biospec产品有限公司(biospecproductsinc.))以确保细菌聚集体的解离,然后在胰蛋白酶大豆和5%血琼脂板上连续稀释,然后进行计数。
免疫荧光试验
将来自glpo疫苗接种的小鼠的血清以1:10、1:100和1:1000的比例稀释,并与用于研究的细菌菌株在96孔板中孵育以对脱靶glpo影响进行定量(表s4(图27)),其中各孔为105个细菌于25℃孵育1小时。然后在25℃下用3%牛血清白蛋白封闭板1小时。结合后,通过用pbs洗涤去除未结合的抗体,然后将细胞与二抗(抗-小鼠igg)于25℃孵育1小时,所述二抗与碱性磷酸酶偶联。通过pbs洗涤去除未结合的抗体,并添加对硝基苯基磷酸盐/酯以显示信号,并用0.75mnaoh淬灭反应。使用酶标仪分光光度计在405nm吸光度下检测信号。
毒理学研究设计和实施
六周龄的远交雌性cd-1小鼠获自尔斯河公司(charlesriver)。用leps(20v):crm197或明矾:pnco肌肉内注射小鼠,其中crm和pnco以1、5和10×的初始剂量配制(34μg)。在给药前和给药后两天,取血液样品进行血液学评估。免疫后两周,监测小鼠的体重和行为变化。免疫后14天,通过co2窒息处死小鼠,然后进行后颈脱位法并收集和称重重要器官。
血液化学和细胞的血液学评估
六周龄的远交雌性cd-1小鼠获自尔斯河公司。用leps(20v):crm197或明矾:pnco注射小鼠,其中crm197和pnco以1、5和10×的初始剂量给予(12.5μg)。在免疫前后大约6小时和2天后经由眼眶后出血收集血液样品。根据生产商方案对血液样品进行mascot血液学分析(drew科学公司(drewscientific))。
虽然已经通过各种实施方式描述了本公开,但是常规修饰对于本领域技术人员而言将是显而易见的,因此这类修改意图在包括在本公开的范围内。
序列表
<110>纽约州立大学研究基金会(theresearchfoundationofthestateuniversityofnewyork)
<120>用于共生疾病进展的综合疫苗设计
<130>011520.01359
<150>62/572,081
<151>2017-10-13
<150>62/670,419
<151>2018-05-11
<160>2
<170>patentinversion3.5
<210>1
<211>229
<212>prt
<213>肺炎链球菌(streptococcuspneumoniae)
<400>1
metlyslystyrglnleuleuphelysileseralavalphesertyr
151015
leuphephevalpheglyleuserglnleuthrleuilevalglnasn
202530
tyrtrpglnpheserserglnileglyasnphevaltrpileglnasn
354045
ileleuserleuleupheserglyvalmetiletrpileleuvallys
505560
thrglyhisglytyrleupheargileproarglyslystrpleutrp
65707580
tyrserileleuthrvalleuvalvalvalleuhisileserpheasn
859095
valglnthralalyshisvalglnserthralagluglytrpasnval
100105110
leuileglytyrserglythrasnphealagluleuglyiletyrval
115120125
thrleuphepheleuthrproleumetglugluleuiletyrarggly
130135140
leuleuglnhisalaphephelyshisserargpheglyleuaspleu
145150155160
leuleuproserileleuphealaleuprohispheleuserleupro
165170175
serleuleuaspilephevalphealathrpheglyileilepheala
180185190
glyleuthrargtyrthrlysseriletyrprosertyralavalhis
195200205
valileasnasnilevalalathrphepropheleuleuthrpheleu
210215220
hisargvalleugly
225
<210>2
<211>608
<212>prt
<213>肺炎链球菌
<400>2
metglupheserlyslysthrarggluleuserilelyslysmetgln
151015
gluargthrleuaspleuleuileileglyglyglyilethrglyala
202530
glyvalalaleuglnalaalaalaserglyleugluthrglyleuile
354045
glumetglnaspphealagluglythrserserargserthrlysleu
505560
valhisglyglyleuargtyrleulysglnpheaspvalgluvalval
65707580
seraspthrvalsergluargalavalvalglnglnilealaprohis
859095
ileprolysproaspprometleuleuprovaltyraspgluaspgly
100105110
alathrpheserleupheargleulysvalalametaspleutyrasp
115120125
leuleualaglyvalserasnthrprothralaasnlysvalleuser
130135140
lysaspglnvalleugluargglnproasnleulyslysgluglyleu
145150155160
valglyglyglyvaltyrleuasppheargasnasnaspalaargleu
165170175
valilegluasnilelysargalaasnglnaspglyalaleuileala
180185190
asnhisvallysalagluglypheleupheaspgluserglylysile
195200205
thrglyvalvalalaargaspleuleuthraspglnvalphegluile
210215220
lysalaargleuvalileasnthrthrglyprotrpserasplysval
225230235240
argasnleuserasnlysglythrglnpheserglnmetargprothr
245250255
lysglyvalhisleuvalvalaspserserlysilelysvalsergln
260265270
provaltyrpheaspthrglyleuglyaspglyargmetvalpheval
275280285
leuproarggluasnlysthrtyrpheglythrthraspthrasptyr
290295300
thrglyaspleugluhisprolysvalthrglngluaspvalasptyr
305310315320
leuleuglyilevalasnasnargpheprogluserasnilethrile
325330335
aspaspileglusersertrpalaglyleuargproleuilealagly
340345350
asnseralaserasptyrasnglyglyasnasnglythrileserasp
355360365
gluserpheaspasnleuilealathrvalglusertyrleuserlys
370375380
glulysthrarggluaspvalgluseralavalserlysleugluser
385390395400
serthrserglulyshisleuaspproseralavalserargglyser
405410415
serleuaspargaspaspasnglyleuleuthrleualaglyglylys
420425430
ilethrasptyrarglysmetalagluglyalametgluargvalval
435440445
aspileleulysalaglupheaspargserphelysleuileasnser
450455460
lysthrtyrprovalserglyglygluleuasnproalaasnvalasp
465470475480
sergluileglualaphealaglnleuglyvalserargglyleuasp
485490495
serlysglualahistyrleualaasnleutyrglyserasnalapro
500505510
lysvalphealaleualahisserleugluglnalaproglyleuser
515520525
leualaaspthrleuserleuhistyralametargasngluleuala
530535540
leuserprovalasppheleuleuargargthrasnhismetleuphe
545550555560
metargaspserleuaspserilevalgluprovalleuaspglumet
565570575
glyargphetyrasptrpthrglugluglulysalathrtyrargala
580585590
aspvalglualaalaleualaasnasnaspleualagluleulysasn
595600605
- 还没有人留言评论。精彩留言会获得点赞!