一种纳米胶束及其制备方法、应用与流程
本发明涉及光热剂技术领域,且特别涉及一种纳米胶束及其制备方法、应用。
背景技术:
临床的肿瘤治疗一般是全身性化疗为主,辅以手术切除和放疗,但是全身性的化疗有着严重的全身毒副作用对于正常的组织有着严重的损伤,而且存在非选择性,因此许多科研工作者都期望开发一种可以降低全身毒副作用的治疗方法。
光热疗法所用的光疗药剂(纳米剂)可以被动或主动选择性地靶向肿瘤,此外光可以在空间上控制照明以仅照射患病灶(肿瘤)而不损伤正常组织这种高选择性以及最小的侵袭性和微创的优点,使得光热治疗正在成为癌症治疗的有力技术,光热治疗是利用具有光热转化能力的纳米材料,在光照条件下产生热量,温度升高至亚高温。这种亚高温会破坏细胞内的生物活性分子(如蛋白质变性、酶失活等),并诱导产生ros,破坏肿瘤细胞的正常生理代谢功能,导致肿瘤细胞损伤,来达到癌症治疗的目的。然而光热治疗会导致细胞内热休克蛋白(hsp70)表达量的增加,热休克蛋白会减少癌细胞的热损伤,以至于单独的光热治疗往往效果欠佳。
技术实现要素:
本发明的第一目的在于提供一种纳米胶束,其能够实现单一波长光照射下释放一氧化氮的同时产生光热转换作用。
本发明的第二目的在于提供一种纳米胶束在制备肿瘤药物的应用,其利用一氧化氮与光热转换作用的协同作用可抑制肿瘤生长。
本发明的第三目的在于提供一种纳米胶束的制备方法,该方法能够制备得到能同时释放一氧化氮和光热转换作用的纳米胶束。
本发明解决其技术问题是采用以下技术方案来实现的。
本发明提出一种纳米胶束,纳米胶束主要由两亲性高分子嵌段共聚物和卟啉类一氧化氮供体在水中自组装形成,两亲性高分子嵌段共聚物的疏水链段与卟啉类一氧化氮供体相互作用形成内部包载材料;
两亲性高分子嵌段共聚物的亲水链段为甲氧基封端的聚乙二醇,两亲性高分子嵌段共聚物的疏水链段为原卟啉;
卟啉类一氧化氮供体是通过原卟啉二碘乙酯与陆森红盐反应形成。
本发明还提出一种如上述的纳米胶束在制备肿瘤药物的应用。
本发明还提出一种纳米胶束的制备方法,包括:将共同溶解于四氢呋喃的两亲性高分子嵌段共聚物和卟啉类一氧化氮供体逐滴加入到水中,室温下进行搅拌直至四氢呋喃完全挥发;
两亲性高分子嵌段共聚物的亲水链段为甲氧基封端的聚乙二醇,两亲性高分子嵌段共聚物的疏水链段为原卟啉;
卟啉类一氧化氮供体是通过原卟啉二碘乙酯与陆森红盐反应形成。
本发明实施例的有益效果至少包括:
两亲性高分子嵌段共聚物的疏水链段,即原卟啉具有共轭结构,该共轭结构利用π-π堆积作用能够与卟啉类一氧化氮供体相互作用从而堆积在纳米胶束内部。另外,原卟啉对近红外光的吸收较好,能够产生光热转换。亲水链段为甲氧基封端的聚乙二醇,其具有良好的生物相容性且能有效提高血液循环时间。另外,卟啉类一氧化氮供体是通过原卟啉二碘乙酯与陆森红盐反应形成,陆森红盐能够提供一氧化氮,在光照作用下会释放一氧化氮。从而使得该纳米胶束在单一波长光照射下释放一氧化氮的同时产生光热转换作用。
附图说明
为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
图1为本发明实施例1的纳米胶束的粒径测试结果图;
图2为本发明实施例1的纳米胶束的sem图;
图3为本发明实施例1的纳米胶束的临界胶束浓度检测结果图;
图4为本发明实施例1的纳米胶束的光热升温结果图;
图5为本发明实施例1的纳米胶束在光照下的一氧化氮的响应性释放结果图;
图6为本发明实施例1的纳米胶束与细胞样品共孵育光照后的激光共聚焦显微镜测试图;
图7为本发明实施例1的纳米胶束与细胞样品共孵育后的细胞凋亡测试图;
图8为本发明实施例1的纳米胶束与细胞样品共孵育、激光照射后的细胞凋亡测试图。
具体实施方式
为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
下面对本发明实施例的一种纳米胶束及其制备方法、应用进行具体说明。
本发明提出一种纳米胶束,纳米胶束主要由两亲性高分子嵌段共聚物和卟啉类一氧化氮供体在水中自组装形成,两亲性高分子嵌段共聚物的疏水链段与卟啉类一氧化氮供体相互作用形成内部包载材料。
其中,两亲性高分子嵌段共聚物的亲水链段为甲氧基封端的聚乙二醇,两亲性高分子嵌段共聚物的疏水链段为原卟啉;卟啉类一氧化氮供体是通过原卟啉二碘乙酯与陆森红盐反应形成。
两亲性高分子嵌段共聚物的亲水链段在外、疏水链段在内,内部的原卟啉具有共轭结构,该共轭结构利用π-π堆积作用能够与卟啉类一氧化氮供体相互作用从而堆积在纳米胶束内部。另外,原卟啉的吸收波长为630纳米左右,对近红外光的吸收较好,能够产生光热转换。亲水链段为甲氧基封端的聚乙二醇,其具有良好的生物相容性且能有效提高血液循环时间。
由于卟啉类一氧化氮供体是通过原卟啉二碘乙酯与陆森红盐反应形成,陆森红盐能够提供一氧化氮,在光照作用下会释放一氧化氮。从而使得该纳米胶束在单一波长光照射下释放一氧化氮的同时产生光热转换作用。
具体地,本实施方式的两亲性高分子嵌段共聚物主要由氨基化原卟啉、亚甲基双丙烯酰胺和端氨基甲氧基聚乙二醇在惰性气体氛围的保护下以二甲基亚砜做溶剂在50~55℃的温度条件下反应得到。其中,惰性气体氛围可以选择氮气氛围或者氩气氛围。为了得到更加纯净的两亲性高分子嵌段共聚物,还可以对反应得到的产物进行透析,透析采用截留分子量5000的透析袋进行,以除去未反应的反应物,透析完成后将得到的透析液冷冻干燥即可得到亲水链段为甲氧基封端的聚乙二醇、疏水链段为原卟啉的两亲性高分子嵌段共聚物。
进一步地,氨基化原卟啉主要由以下步骤制得:在惰性气体氛围中,将原卟啉、n-羟基琥珀酰亚胺、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐和三乙胺溶解于四氢呋喃,溶解完全后进行冰浴冷却,然后加入乙二胺在室温下反应得到初品。得到初品后,对初品进行抽滤、蒸发浓缩、层析柱分离、真空干燥后即得到氨基化的原卟啉。
另外,原卟啉二碘乙酯主要由原卟啉分子的两个羧基通过酯键连接碘乙醇后形成。具体地,原卟啉二碘乙酯主要由以下步骤制得:将原卟啉、1-羟基苯并三唑、4-二甲氨基吡啶溶解于四氢呋喃中,在冰浴环境下,加入二环己基碳二亚胺继续溶解,然后加入碘乙醇冰浴2~4h后升温至22~28℃反应。其中,在22~28℃的温度条件下反应时间为20~30h,反应完成后对反应物进行过滤,用四氢呋喃淋洗几遍后将滤液置入旋转蒸发仪中除去溶剂,再用冰氯仿溶解后重力过滤,真空干燥得到原卟啉二碘乙酯(英文简称为ppix-i)。
进一步地,陆森红盐主要由以下步骤制得:将陆森黑盐与氢氧化钠溶液混合,加热至75~80℃直至无氨臭,将陆森黑盐与氢氧化钠的反应产物过滤以去除反应产物中的氢氧化铁,得到红棕色溶液进行浓缩,则析出暗红色的结晶,然后进行过滤并用氢氧化钠水溶液洗涤,将过滤得到结晶进行干燥得到陆森红盐。
其中,陆森黑盐主要由以下步骤制得:将亚硝酸钠于水混合得到亚硝酸钠水溶液;将七水硫酸亚铁溶解于水中得到硫酸铁溶液;将亚硝酸钠水溶液加热到125~130℃进行冷凝回流,当有冷凝液滴时,加入硫化铵溶液到亚硝酸钠水溶液中,待反应液变红后,加入硫酸铁溶液,当反应液变黑后,加入氨水使得反应液呈碱性,在125~135℃的温度条件下反应25~35min后进行过滤,取过滤得到的黑色滤液进行避光冻存,最后得到黑色结晶,即为陆森黑盐。
避光操作能够避免陆森黑盐在灯光中特定波长的光会刺激no的产生;冻存能够使得黑色滤液结晶更大更快。需要说明的是,利用现有技术生产的陆森黑盐和陆森红盐在本实施方式中也适用。
本实施方式还提供一种纳米胶束的制备方法,包括:将共同溶解于四氢呋喃的两亲性高分子嵌段共聚物和卟啉类一氧化氮供体逐滴加入到水中,室温下进行搅拌直至四氢呋喃完全挥发。
两亲性高分子嵌段共聚物的亲水链段为甲氧基封端的聚乙二醇,两亲性高分子嵌段共聚物的疏水链段为原卟啉;卟啉类一氧化氮供体是通过原卟啉二碘乙酯与陆森红盐反应形成。
两亲性高分子嵌段共聚物的亲水链段在外、疏水链段在内,内部的原卟啉具有共轭结构,两亲性高分子嵌段共聚物和卟啉类一氧化氮供体在水中自组装,共轭结构利用π-π堆积作用能够与卟啉类一氧化氮供体相互作用从而堆积在纳米胶束内部。
另外,本实施方式还提供一种纳米胶束在制备肿瘤药物的应用。由于该纳米胶束在单一波长光照射下释放一氧化氮的同时产生光热转换作用。
一氧化氮是一种脂溶性气体,对心脑血管系统、免疫系统、神经系统、生殖系统和肿瘤中都起着重要的作用。光热治疗会导致细胞内热休克蛋白(hsp70)表达量的增加,热休克蛋白会减少癌细胞的热损伤。一方面,一定浓度的一氧化氮可以使得热休克蛋白失活从而增加光热治疗的效果。另一方面,热量可以使得一氧化氮的扩散距离增加,从而加速一氧化氮对整个肿瘤组织的弥散分布,加剧一氧化氮对肿瘤组织的毒性作用,从而起到较好的肿瘤治疗效果。
以下结合实施例对本发明的特征和性能作进一步的详细描述。
实施例1
本实施例提供一种纳米胶束,该纳米胶束主要由以下步骤制备得到:
(1)称取7.2g的亚硝酸钠到500毫升的三口瓶中,并加入80毫升的去离子水。称取8g的七水硫酸亚铁到锥形瓶中并加入20毫升的去离子水溶解得到硫酸铁溶液。取8毫升硫化铵于50毫升离心管中加50毫升水稀释得到硫化铵溶液,取30毫升氨水于离心管中备用。
将装有亚硝酸钠溶液的三口瓶放入油浴锅中加热到130℃,然后进行冷凝回流,待冷凝管有液滴滴下时,将之前配好的硫化铵溶液倒入三口瓶中,待反应液变红后加入配好的硫酸铁溶液,溶液变黑后立即加入氨水以保证反应液呈碱性。将反应液在130℃反应30min后立即用玻璃漏斗过滤,取下方的黑色滤液,用铝箔纸包住避光冻存后得到黑色结晶的陆森黑盐。
(2)取3g陆森黑盐放入反应瓶中,加入10毫升的浓度为10%氢氧化钠水溶液,在水浴锅中加热到80℃,直至没有氨臭为止。15分钟后用玻璃过滤器将反应得到的氢氧化铁滤除,得到红棕色溶液。将红棕色溶液在减压干燥器中放置浓缩,析出暗红色的结晶。用玻璃过滤器过滤,并用浓度为0.1%的氢氧化钠水溶液对过滤得到的结晶进行洗涤,然后将洗涤后的结晶放在滤纸中间干燥得到暗红色结晶的陆森红盐。
(3)称取282mg原卟啉,130mg的1-羟基苯并三唑(hobt),12mg的4-二甲氨基吡啶(dmap)在反应瓶中并加入50ml四氢呋喃,反应瓶置于冰水浴中,待上述材料完全溶解后加入207mg二环己基碳二亚胺继续冰浴,溶解后逐滴加入90μl碘乙醇,继续冰浴三小时后升至25℃反应24h。反应完成后过滤,用四氢呋喃淋对过滤物就清洗3遍后将滤液置入旋转蒸发仪中除去溶剂,再用冰氯仿溶解后重力过滤,真空干燥除去氯仿得到原卟啉二碘乙酯(ppix-i)。
(4)将步骤(3)得到的原卟啉二碘乙酯称取0.897g溶解于50毫升四氢呋喃中并用氮气保护备用。在氮气氛围环境中,将步骤(2)中得到的陆森红盐称取0.5g溶解于100毫升的四氢呋喃中,待溶解完全后将其缓慢滴加至ppix-i的四氢呋喃溶液中在室温条件下反应24h。反应完成后在氮气保护下过滤除去反应中析出的固体,旋干得到紫红色固体的原卟啉-陆森红盐二乙酯(ppix-rrs),也即是卟啉类一氧化氮供体。
(5)取原卟啉200mg、n-羟基琥珀酰亚胺122mg、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐410mg和三乙胺287mg加入到圆底烧瓶中,在氮气保护条件下加入四氢呋喃溶解完全,冰浴两小时后逐滴加入128mg的乙二胺,滴加完后升至常温反应48小时得到产物。产物经抽滤、蒸发浓缩、层析柱分离、真空干燥后得到暗红色粉末,即为氨基化的原卟啉。
(6)在氮气保护下,称取步骤(5)得到的氨基化原卟啉100mg、亚甲基双丙烯酰胺106mg、端氨基甲氧基聚乙二醇68.7mg于圆底烧瓶中并溶解于二甲基亚砜溶剂,在55℃的温度条件下反应7天。反应完成后用截留分子量5000的透析袋进行透析,透析完成后将得到的透析液冷冻干燥得到两亲性高分子嵌段共聚物。
(7)将步骤(4)得到的原卟啉-陆森红盐二乙酯与步骤6得到的两亲性高分子嵌段共聚物共同溶于四氢呋喃中,待溶解完全后在搅拌条件下逐滴缓慢加入到去离子水中,室温搅拌直到四氢呋喃全部挥发完,原卟啉-陆森红盐二乙酯与两亲性高分子嵌段共聚物自组装得到纳米胶束。
实施例2
本实施例提供一种纳米胶束,该纳米胶束主要由以下步骤制备得到:
(1)称取7.2g的亚硝酸钠到500毫升的三口瓶中,并加入80毫升的去离子水。称取8g的七水硫酸亚铁到锥形瓶中并加入20毫升的去离子水溶解得到硫酸铁溶液。取8毫升硫化铵于50毫升离心管中加50毫升水稀释得到硫化铵溶液,取30毫升氨水于离心管中备用。
将装有亚硝酸钠溶液的三口瓶放入油浴锅中加热到125℃,然后进行冷凝回流,待冷凝管有液滴滴下时,将之前配好的硫化铵溶液倒入三口瓶中,待反应液变红后加入配好的硫酸铁溶液,溶液变黑后立即加入氨水以保证反应液呈碱性。将反应液在125℃反应35min后立即用玻璃漏斗过滤,取下方的黑色滤液,用铝箔纸包住避光冻存后得到黑色结晶的陆森黑盐。
(2)取3g陆森黑盐放入反应瓶中,加入10毫升的浓度为10%氢氧化钠水溶液,在水浴锅中加热到75℃,直至没有氨臭为止。15分钟后用玻璃过滤器将反应得到的氢氧化铁滤除,得到红棕色溶液。将红棕色溶液在减压干燥器中放置浓缩,析出暗红色的结晶。用玻璃过滤器过滤,并用浓度为0.1%的氢氧化钠水溶液对过滤得到的结晶进行洗涤,然后将洗涤后的结晶放在滤纸中间干燥得到暗红色结晶的陆森红盐。
(3)称取282mg原卟啉,130mg的1-羟基苯并三唑(hobt),12mg的4-二甲氨基吡啶(dmap)在反应瓶中并加入50ml四氢呋喃,反应瓶置于冰水浴中,待上述材料完全溶解后加入207mg二环己基碳二亚胺继续冰浴,溶解后逐滴加入90μl碘乙醇,继续冰浴三小时后升至28℃反应20h。反应完成后过滤,用四氢呋喃淋对过滤物就清洗3遍后将滤液置入旋转蒸发仪中除去溶剂,再用冰氯仿溶解后重力过滤,真空干燥除去氯仿得到原卟啉二碘乙酯(ppix-i)。
(4)将步骤(3)得到的原卟啉二碘乙酯称取0.897g溶解于50毫升四氢呋喃中并用氮气保护备用。在氮气氛围环境中,将步骤(2)中得到的陆森红盐称取0.5g溶解于100毫升的四氢呋喃中,待溶解完全后将其缓慢滴加至ppix-i的四氢呋喃溶液中在室温条件下反应24h。反应完成后在氮气保护下过滤除去反应中析出的固体,旋干得到紫红色固体的原卟啉-陆森红盐二乙酯(ppix-rrs),也即是卟啉类一氧化氮供体。
(5)取原卟啉200mg、n-羟基琥珀酰亚胺122mg、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐410mg和三乙胺287mg加入到圆底烧瓶中,在氮气保护条件下加入四氢呋喃溶解完全,冰浴两小时后逐滴加入128mg的乙二胺,滴加完后升至常温反应48小时得到产物。产物经抽滤、蒸发浓缩、层析柱分离、真空干燥后得到暗红色粉末,即为氨基化的原卟啉。
(6)在氮气保护下,称取步骤(5)得到的氨基化原卟啉100mg、亚甲基双丙烯酰胺106mg、端氨基甲氧基聚乙二醇68.7mg于圆底烧瓶中并溶解于二甲基亚砜溶剂,在50℃的温度条件下反应7天。反应完成后用截留分子量5000的透析袋进行透析,透析完成后将得到的透析液冷冻干燥得到两亲性高分子嵌段共聚物。
(7)将步骤(4)得到的原卟啉-陆森红盐二乙酯与步骤6得到的两亲性高分子嵌段共聚物共同溶于四氢呋喃中,待溶解完全后在搅拌条件下逐滴缓慢加入到去离子水中,室温搅拌直到四氢呋喃全部挥发完,原卟啉-陆森红盐二乙酯与两亲性高分子嵌段共聚物自组装得到纳米胶束。
实施例3
本实施例提供一种纳米胶束,该纳米胶束主要由以下步骤制备得到:
(1)称取7.2g的亚硝酸钠到500毫升的三口瓶中,并加入80毫升的去离子水。称取8g的七水硫酸亚铁到锥形瓶中并加入20毫升的去离子水溶解得到硫酸铁溶液。取8毫升硫化铵于50毫升离心管中加50毫升水稀释得到硫化铵溶液,取30毫升氨水于离心管中备用。
将装有亚硝酸钠溶液的三口瓶放入油浴锅中加热到135℃,然后进行冷凝回流,待冷凝管有液滴滴下时,将之前配好的硫化铵溶液倒入三口瓶中,待反应液变红后加入配好的硫酸铁溶液,溶液变黑后立即加入氨水以保证反应液呈碱性。将反应液在125℃反应35min后立即用玻璃漏斗过滤,取下方的黑色滤液,用铝箔纸包住避光冻存后得到黑色结晶的陆森黑盐。
(2)取3g陆森黑盐放入反应瓶中,加入10毫升的浓度为10%氢氧化钠水溶液,在水浴锅中加热到78℃,直至没有氨臭为止。15分钟后用玻璃过滤器将反应得到的氢氧化铁滤除,得到红棕色溶液。将红棕色溶液在减压干燥器中放置浓缩,析出暗红色的结晶。用玻璃过滤器过滤,并用浓度为0.1%的氢氧化钠水溶液对过滤得到的结晶进行洗涤,然后将洗涤后的结晶放在滤纸中间干燥得到暗红色结晶的陆森红盐。
(3)称取282mg原卟啉,130mg的1-羟基苯并三唑(hobt),12mg的4-二甲氨基吡啶(dmap)在反应瓶中并加入50ml四氢呋喃,反应瓶置于冰水浴中,待上述材料完全溶解后加入207mg二环己基碳二亚胺继续冰浴,溶解后逐滴加入90μl碘乙醇,继续冰浴三小时后升至22℃反应30h。反应完成后过滤,用四氢呋喃淋对过滤物就清洗3遍后将滤液置入旋转蒸发仪中除去溶剂,再用冰氯仿溶解后重力过滤,真空干燥除去氯仿得到原卟啉二碘乙酯(ppix-i)。
(4)将步骤(3)得到的原卟啉二碘乙酯称取0.897g溶解于50毫升四氢呋喃中并用氮气保护备用。在氮气氛围环境中,将步骤(2)中得到的陆森红盐称取0.5g溶解于100毫升的四氢呋喃中,待溶解完全后将其缓慢滴加至ppix-i的四氢呋喃溶液中在室温条件下反应24h。反应完成后在氮气保护下过滤除去反应中析出的固体,旋干得到紫红色固体的原卟啉-陆森红盐二乙酯(ppix-rrs),也即是卟啉类一氧化氮供体。
(5)取原卟啉200mg、n-羟基琥珀酰亚胺122mg、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐410mg和三乙胺287mg加入到圆底烧瓶中,在氮气保护条件下加入四氢呋喃溶解完全,冰浴两小时后逐滴加入128mg的乙二胺,滴加完后升至常温反应48小时得到产物。产物经抽滤、蒸发浓缩、层析柱分离、真空干燥后得到暗红色粉末,即为氨基化的原卟啉。
(6)在氮气保护下,称取步骤(5)得到的氨基化原卟啉100mg、亚甲基双丙烯酰胺106mg、端氨基甲氧基聚乙二醇68.7mg于圆底烧瓶中并溶解于二甲基亚砜溶剂,在50℃的温度条件下反应7天。反应完成后用截留分子量5000的透析袋进行透析,透析完成后将得到的透析液冷冻干燥得到两亲性高分子嵌段共聚物。
(7)将步骤(4)得到的原卟啉-陆森红盐二乙酯与步骤6得到的两亲性高分子嵌段共聚物共同溶于四氢呋喃中,待溶解完全后在搅拌条件下逐滴缓慢加入到去离子水中,室温搅拌直到四氢呋喃全部挥发完,原卟啉-陆森红盐二乙酯与两亲性高分子嵌段共聚物自组装得到纳米胶束。
实施例4
(1)称取282mg原卟啉,130mg的1-羟基苯并三唑(hobt),12mg的4-二甲氨基吡啶(dmap)在反应瓶中并加入50ml四氢呋喃,反应瓶置于冰水浴中,待上述材料完全溶解后加入207mg二环己基碳二亚胺继续冰浴,溶解后逐滴加入90μl碘乙醇,继续冰浴三小时后升至28℃反应20h。反应完成后过滤,用四氢呋喃淋对过滤物就清洗3遍后将滤液置入旋转蒸发仪中除去溶剂,再用冰氯仿溶解后重力过滤,真空干燥除去氯仿得到原卟啉二碘乙酯(ppix-i)。
(2)将步骤(1)得到的原卟啉二碘乙酯称取0.897g溶解于50毫升四氢呋喃中并用氮气保护备用。在氮气氛围环境中,将步骤(2)中得到的陆森红盐称取0.5g溶解于100毫升的四氢呋喃中,待溶解完全后将其缓慢滴加至ppix-i的四氢呋喃溶液中在室温条件下反应24h。反应完成后在氮气保护下过滤除去反应中析出的固体,旋干得到紫红色固体的原卟啉-陆森红盐二乙酯(ppix-rrs),也即是卟啉类一氧化氮供体。
(3)取原卟啉200mg、n-羟基琥珀酰亚胺122mg、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐410mg和三乙胺287mg加入到圆底烧瓶中,在氮气保护条件下加入四氢呋喃溶解完全,冰浴两小时后逐滴加入128mg的乙二胺,滴加完后升至常温反应48小时得到产物。产物经抽滤、蒸发浓缩、层析柱分离、真空干燥后得到暗红色粉末,即为氨基化的原卟啉。
(4)在氮气保护下,称取步骤(3)得到的氨基化原卟啉100mg、亚甲基双丙烯酰胺106mg、端氨基甲氧基聚乙二醇68.7mg于圆底烧瓶中并溶解于二甲基亚砜溶剂,在50℃的温度条件下反应7天。反应完成后用截留分子量5000的透析袋进行透析,透析完成后将得到的透析液冷冻干燥得到两亲性高分子嵌段共聚物。
(5)将步骤(2)得到的原卟啉-陆森红盐二乙酯与步骤(5)得到的两亲性高分子嵌段共聚物共同溶于四氢呋喃中,待溶解完全后在搅拌条件下逐滴缓慢加入到去离子水中,室温搅拌直到四氢呋喃全部挥发完,原卟啉-陆森红盐二乙酯与两亲性高分子嵌段共聚物自组装得到纳米胶束。
试验例
(1)将实施例1制备得到的纳米胶束稀释于磷酸缓冲盐溶液,利用动态光散射粒径仪(dls)对纳米胶束的粒径进行测试,其结果如图1所示。
结果分析:从图1的结果可以看出,实施例1制备得到的纳米胶束其粒径为108nm左右。
(2)将实施例1制备得到的纳米胶束在扫描电子显微镜下观察,得到的sem图如图2所示,其中,图2的比例尺为100nm。
结果分析:从图2的结果可以得知,实施例1的纳米胶束的粒径比较均一,大概在100nm左右。
(3)利用荧光探针法对实施例1制备得到的纳米胶束的临界胶束浓度进行检测,得到的结果如图3所示。
结果分析:从图3的结果可以看出,临界胶束浓度约为2微克每毫升,证明本实施例1形成的纳米胶束具有良好的耐稀释性。
(4)对实施例1制备得到的纳米胶束进行光热升温测试,其光热升温曲线结果图如图4所示。其中,pbs代表空白组,其为磷酸盐缓冲液;nps代表实施例1的纳米胶束稀释于磷酸缓冲盐溶液。另外,实施例1的纳米胶束浓度为1mg/ml,利用波长为637nm、激光功率为0.7w/cm2的激光照射一毫升实施例1的纳米胶束。
从图4中可以看出,5分钟照射时间可使溶液温度由20摄氏度上升至60摄氏度左右,说明了本实施例1的具有纳米胶束良好的光热转换效应。
(5)通过thermal的一氧化氮检测仪实时监测实施例1的纳米胶束在光照下的一氧化氮的响应性释放行为,其监测结果如图5所示。
从图5中可以看出,实施例1的纳米胶束的单次释放量在1200ppb左右,光照开关循环响应释放六次以上无明显衰减。
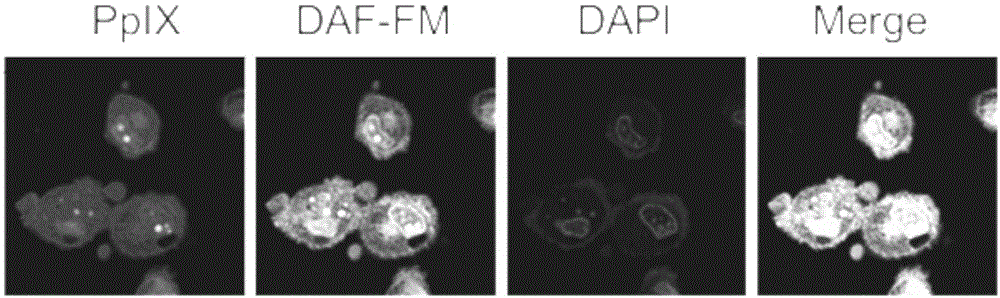
(6)将实施例1的纳米胶束与细胞样品共孵育4小时并给予光照,并使用激光共聚焦显微镜进行观察,得到的激光共聚焦显微镜结果图如图6所示。ppix代表纳米胶束的红色荧光(卟啉的荧光);daf-fm代表一氧化氮荧光探针的阳性信号,为绿色荧光;dapi代表细胞核染料,为蓝色荧光,merge为荧光叠加后的图。
结果分析:从图6可以得知,实验观察到强的绿色荧光信号,证明实施例1的纳米胶束被细胞样品成功内吞,并且光照后在细胞内释放出大量一氧化氮。
(7)将200μg/ml的实施例1的纳米胶束与内皮细胞(ec细胞)以及mcf-7(adr)(人乳腺癌耐药细胞株)细胞共孵育24小时后进行钙黄绿素/碘化吡啶细胞活死染色,进行无光照处理后,利用激光共聚焦显微镜观察内皮细胞以及mcf-7(adr)细胞的凋亡情况,并与空白对照组进行对比,其结果如图7所示。需要说明的是空白对照组为不添加任何其他物质的内皮细胞以及mcf-7(adr)细胞。
结果分析:从图7的结果可以看出,与空白对照组相比,添加了实施例1的纳米胶束的内皮细胞以及mcf-7(adr)细胞没有出现明显的细胞凋亡,证实了本实施例1的纳米胶束具有良好的细胞相容性。
(8)将20μg/ml的实施例1的纳米胶束与mcf-7(adr)(人乳腺癌耐药细胞株)细胞共孵育2小时后给予6分钟的637纳米激光照射(照射功率为0.7w/cm2)后,进行活死细胞染色后利用激光共聚焦显微镜观察,并与空白对照组进行对比,其结果如图8所示。需要说明的是空白对照组为不添加任何其他物质的内皮细胞以及mcf-7(adr)细胞。
从图8的结果可以看出,添加了实施例1的纳米胶束的内皮细胞以及mcf-7(adr)细胞发现了大量的细胞凋亡(其中,绿色为钙黄绿素的活细胞信号,红色为碘化吡啶的死细胞信号)。
以上所描述的实施例是本发明一部分实施例,而不是全部的实施例。本发明的实施例的详细描述并非旨在限制要求保护的本发明的范围,而是仅仅表示本发明的选定实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
- 还没有人留言评论。精彩留言会获得点赞!