一种齐墩果酸接枝的壳聚糖载药纳米颗粒的应用的制作方法
本发明属于壳聚糖载药纳米材料的应用领域,特别涉及一种齐墩果酸接枝的壳聚糖载药纳米颗粒的应用。
背景技术:
据统计,每年全世界大约有八百多万人死于癌症。近几十年来,越来越多的新型药物传递系统(dds),如脂质体、水凝胶、胶束和纳米颗粒,被设计成药物载体来提高疗效和减少副作用的。在这些dds中,纳米颗粒已显示出在癌症治疗中极大的潜在临床应用。结合大量之前的研究也证实了纳米颗粒在药物缓释、延长治疗时间、增强药物在病变部位积累方面的有利作用。值得注意的是,选择具有良好生物相容性、生物降解性和低毒性的共聚物作为基体材料是合适的纳米颗粒成功设计的前提。壳聚糖(cs)是一种天然的阳离子碳水化合物,具有良好的生物相容性、低免疫原性和转运药物通过细胞膜的潜在能力。重要的是,在体内代谢酶的作用下,壳聚糖可以降解为水和二氧化碳,最终不会对机体产生不良影响。与此同时,壳聚糖在弱酸性ph环境(如肿瘤微环境)中具有较强的敏感性,因此壳聚糖广泛应用于ph响应药物传递领域。研究报道,壳聚糖纳米颗粒具有控制药物释放的优势,可以提高药物的溶解性和稳定性,提高药效,降低毒性。此外,壳聚糖纳米颗粒具有纳米级尺寸,使其具有通过体内生物屏障并通过epr效应在病变部位有效积累的特性。
虽然壳聚糖纳米颗粒具有很好的生物相容性,但常见的功能化修饰往往会引入一些外来物质(如nipam、degma、goldnps、msn等),给正常组织带来不可避免的系统毒性。为了克服这一不利因素,可以选择接枝合适的具有系统保护作用的共聚物,并且为壳聚糖提供兼容的疏水嵌段,以提供疏水药物存储的疏水核心。
根据之前报道,chawanmanaspon等,同样利用叶酸修饰的壳聚糖载体,聚合普朗尼克作为dox储药中心,并将这种智能纳米药物传递系统(chawanmanaspon,等.journalofnanomaterials2012),应用于乳腺癌靶向治疗治疗。该方法合成过程简单,操作步骤容易,也得到了较好的治疗效果。但该纳米载药系统对系统毒副作用较大,粒径偏小,极易在体内被代谢掉,药物血循环时间较短,不能最大程度发挥药效。因此对这种共载药系统的深入探究,具有广阔的研究前景。
技术实现要素:
本发明所要解决的技术问题是提供一种齐墩果酸接枝的壳聚糖载药纳米颗粒的应用,该齐墩果酸接枝壳聚糖载药纳米颗粒的生物相容性好,水合粒径大小在160nm左右,能最大程度的发挥epr效应,可以有效发挥抗癌作用,且有减少系统毒副作用的效果,在乳腺癌靶向治疗方面具有巨大应用潜能。
本发明一种齐墩果酸接枝的壳聚糖载药纳米颗粒在制备乳腺癌化疗药物中的应用。
本发明的一种齐墩果酸接枝的壳聚糖载药纳米颗粒在制备减少乳腺癌化疗副作用药物中的应用。
所述齐墩果酸接枝的壳聚糖载药纳米颗粒由下列方法制备,步骤包括:
(1)将叶酸fa经edc和nhs活化,将活化后的fa加到溶有壳聚糖的醋酸缓冲液中,避光搅拌,透析,冻干,得到接枝叶酸的壳聚糖fa-cs,其中fa、edc和nhs的摩尔比为1:1~1.5:1~1.5,叶酸fa与壳聚糖的摩尔比为500:1~100:1;
(2)在dmap的存在下,将步骤(1)中fa-cs溶解在吡啶中,加入齐墩果酸oa,搅拌反应,纯化,得到接枝齐墩果酸的叶酸壳聚糖纳米颗粒fa-cs-g-oa,冻干,其中fa-cs、dmap、吡啶和oa的摩尔比为1:0.00001~1:0.01~1:400~0.0001;
(3)将步骤(2)中冻干后的fa-cs-g-oa溶于水中,将dox溶解于有机溶剂中,将得到的fa-cs-g-oa溶液和dox溶液一起密封在透析袋中透析,离心,得到齐墩果酸接枝的壳聚糖载药纳米颗粒fa-cs-g-oa@dox,其中fa-cs-g-oa溶液浓度为8~15mg/ml,dox溶液浓度为1~3mg/ml,fa-cs-g-oa与dox的摩尔比为4:1~6:1。
所述步骤(1)中将叶酸fa经edc和nhs活化具体为:将叶酸fa、edc和nhs加入到无水dmso溶液中,在室温下搅拌0.5~2h。
所述步骤(1)中醋酸缓冲液浓度为0.8~1.5%w/v;溶有壳聚糖的醋酸缓冲液ph值为4~5;避光搅拌为:室温下避光搅拌过夜。
所述步骤(1)中透析为:用mwco=3000~5000的透析袋在1.0mmnaoh溶液中透析70~80小时。
所述步骤(2)中搅拌反应温度为室温,搅拌反应时间为2~5h。
所述步骤(2)中纯化具体为:旋转蒸发掉溶剂,得到的沉淀物溶解在丙酮中,用水冲洗三次。
所述步骤(3)中透析袋是用mw=8000~10000da的透析袋;透析温度为20~30℃,透析时间为40~50℃。
所述步骤(3)中有机溶剂为dmso;离心为:5000~8000rpm离心20~40分钟。
将上述fa-cs-g-oa@dox载药纳米颗粒与单独的dox、齐墩果酸以及未载药的fa-cs-g-oa,分别通过荷瘤小鼠尾静脉注射入体内,比较各组药物治疗抗癌效果。
所述各组药物注射的量为(7.5mgdoxequiv.kg-1),dox和齐墩果酸使用dmso溶解,fa-cs-g-oa@dox和fa-cs-g-oa使用生理盐水溶解。
将上述各组药物分别通过荷瘤小鼠尾静脉注射入体内,30天后心脏取血,离心收集血清,检测各生化因子含量,比较各组药物引起副作用情况。
所述抽取的血液离心条件为3500rpm离心15分钟,生化因子检测方法为酶联免疫(elisa)法。
有益效果
(1)本发明利用齐墩果酸接枝的壳聚糖材料具有两亲性的特性,在水溶液中自组装成球形壳核结构,利用其疏水核心的疏水性载入大量细胞毒性药物dox,进行抗癌研究,与chawanmanaspon等制备的壳聚糖材料相比,该制备方法实验原理简易、操作程序简单、条件温和;
(2)本发明的齐墩果酸接枝壳聚糖载药纳米颗粒的生物相容性良好,水合粒径大小在160nm左右(chawanmanaspon等制备的壳聚糖材料粒径在37nm左右,极易在体内被迅速代谢掉),能最大程度的发挥epr效应;
(3)本发明齐墩果酸接枝壳聚糖载药纳米颗粒,能够有效促进乳腺癌细胞凋亡,并且减少化疗所引起的系统毒副作用。
附图说明
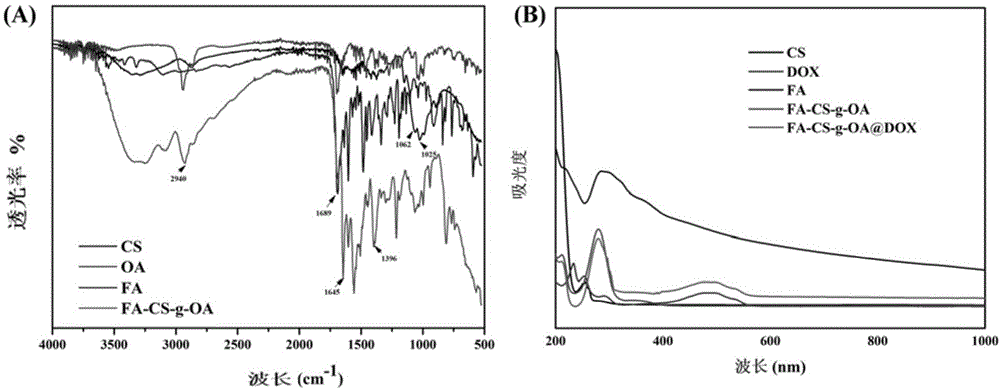
图1为本发明fa-cs-g-oa@dox载药纳米颗粒的红外(a)和紫外(b)图谱;
图2为本发明fa-cs-g-oa@dox载药纳米颗粒的sem图;
图3为本发明fa-cs-g-oa@dox载药纳米颗粒的dls图;
图4为实施例2中药物dox、齐墩果酸(oa)、载体fa-cs-g-oa及载药纳米颗粒fa-cs-g-oa@dox对乳腺癌荷瘤小鼠的抗癌疗效结果;
图5为实施例3中药物dox、齐墩果酸(oa)、载体fa-cs-g-oa及载药纳米颗粒fa-cs-g-oa@dox对乳腺癌荷瘤小鼠的肝功能(a)和肾功能(b)指标的影响;
图6为实施例4中药物dox、齐墩果酸(oa)、载体fa-cs-g-oa及载药纳米颗粒fa-cs-g-oa@dox对乳腺癌荷瘤小鼠的抗炎(a)和抗氧化(b)指标影响;
图7为实施例1中药物dox、单纯的oa、载体fa-cs-g-oa及载药纳米颗粒fa-cs-g-oa@dox对乳腺癌细胞中耐药性相关因子p-gp、mpr1和β-action的灰度值扫描图(a)以及对p-gp、mpr1的表达水平(b)。
具体实施方式
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。此外应理解,在阅读了本发明讲授的内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
cs购买自sinopharm化学试剂有限公司(上海,中国),分子量100kda;dmap,吡啶,edc,nhs,mtt,齐墩果酸和pbs缓冲液购买自sigma-aldrich(mo,美国)试剂公司;叶酸由wakopure化学试剂公司(osaka,日本)提供;dox和透析袋购买自上海源叶生物技术有限公司(上海,中国);dmem培养基,胎牛血清(fbs),青霉素,链霉素,和胰蛋白酶购买自gibco(ca,美国)公司;p-gp,mrp1和β-actin抗体购买自cellsignalingtechnology(ma,美国)试剂公司;实验中所用的去离子水来自于milli-qgradienta10纯水系统。
实施例1
(1)将叶酸(fa)与edc,nhs按照摩尔比为1:1:1加入到无水dmso溶液(dmso与叶酸的比例为15ml:3mg),在室温下不断搅拌,直到fa溶解,时间为1h。然后,激活的fa(3g)缓慢添加到溶有5g壳聚糖的醋酸缓冲液(500ml)(醋酸缓冲液浓度为1.0%w/v)中(ph值4.7),得到的混合溶液在室温下避光搅拌一整夜。将混合液用透析袋(mwco=3500)在1.0mmnaoh溶液中透析72小时,除去未反应的fa。最后,冻干法(将透析后的fa溶液冷冻后,置于冷冻干燥机中冻干3天)得到fa-cs。
(2)通过酯化反应将齐墩果酸(oa)接枝到fa-cs上。在dmap(0.05g)的存在下,将fa-cs(0.50g)溶解在吡啶(12ml)中,加入0.9goa。反应在室温下搅拌3小时,然后旋转蒸发掉溶剂。得到的沉淀物溶解在丙酮中,用水冲洗三次,进一步净化。收集得到微小的晶体(fa-cs-g-oa),产率为92.0%,将洗净后的fa-cs-g-oa冷冻后,置于冷冻干燥机中冻干3天,得到fa-cs-g-oa粉末。
(3)将冻干得到的fa-cs-g-oa纳米颗粒(100mg)溶于10ml水中,将dox(20mg)溶解在dmso(10ml)中,将得到的fa-cs-g-oa溶液和dox溶液一起密封在透析袋(mw=8000da)中,在25℃透析48小时。然后在6000rpm离心30分钟去除未载上的药物,得到自组装成的fa-cs-g-oa@dox纳米颗粒。
将mda-mb-231荷瘤小鼠随机分为5组(每组8只),每2天分别注射生理盐水(saline)、dox、oa、fa-cs-g-oa、fa-cs-g-oa@dox(7.5mg/kgdoxequiv)。30天后取下裸鼠全部肿瘤,用生理盐水洗净,匀浆提取总蛋白。蛋白定量后,每组样本取40μg总蛋白质加在10%sds–page泳道上进行电泳分离。然后将目标蛋白质半干法转移到pvdf膜上,洗膜后,分别加抗体p-gp(1:1000)、mrp1(1:1000)和β-action(1:500),4℃孵育过夜,pbs冲洗10分钟3次后,室温下孵育相应二抗2小时。加入化学发光试剂,曝光,显影,洗膜,采用imagej软件进行灰度值扫描。
如图7所示,与saline组相比,dox显著诱导p-gp蛋白增加,说明dox通过引起p-gp水平的增加导致了乳腺癌细胞耐药性。与dox组相比,fa-cs-g-oa@dox、fa-cs-g-oa、和oa组肿瘤的p-gp表达水平分别降低了61.35%、36.87%和25.34%。而在mda-mb-231肿瘤细胞中mrp1的表达水平也有类似的趋势。当使用fa-cs-g-oa@dox处理时,mrp1的表达几乎无法检测到,如图7所示,当小鼠使用oa和含oa的材料处理后,mrp1蛋白表达量下降明显。显示出fa-cs-g-oa@dox载药纳米颗粒降低肿瘤细胞耐药性方面的巨大潜力。所有这些都表明oa可能是治疗耐药性肿瘤的一个很好的选择,无论是作为佐剂还是作为化疗药物本身。
实施例2
取100ml的mda-mb-231细胞悬液(大约2×107个mda-mb-231细胞)从裸鼠后背皮下右翼区域注射入体内。当肿瘤体积达到100mm3左右时,将荷瘤小鼠随机分为5组(每组8只),每2天分别注射一次生理盐水(saline)、dox、oa、fa-cs-g-oa、fa-cs-g-oa@dox(7.5mg/kgdoxequiv)。每次注射记录下所有裸鼠的肿瘤尺寸变化并按计算方程:vtumor=l×w2/2(l:肿瘤长度、w:肿瘤宽度)计算荷瘤小鼠肿瘤体积。
在治疗过程中,荷瘤小鼠肿瘤体积大小变化如图4所示,可以观察到fa-cs-g-oa@dox处理组的小鼠肿瘤生长明显受到抑制,单纯dox处理组小鼠的肿瘤生长未见明显疗效。用单纯的oa或载体fa-cs-g-oa治疗的小鼠肿瘤体积也有一定的抑制作用。在注射药物治疗30天后,生理盐水治疗组小鼠的肿瘤大小显著增大平均体积为745.78±72.89mm3。而fa-cs-g-oa@dox治疗组成功的抑制了肿瘤组织的生长,肿瘤平均体积为12.68±1.58mm3,这远远小于dox(250.73±23.45mm3)或oa(445.67±43.79mm3)治疗的裸鼠。
实施例3
经过各组药物治疗后,所有剩下的小鼠禁食过夜。用戊巴比妥钠麻醉后,于小鼠心脏穿刺收集血液样本,离心(3500rpm,15分钟,4℃)获得血清。采用全自动奥林巴斯au5400生化分析仪测定血清中肝功能指标丙氨酸转氨酶(alt)、天冬氨酸转氨酶(ast),以及肾功能指标肌酐(scr)、尿素氮(bun)的浓度。
如图5所示,dox治疗显著增加了小鼠血液中ast、alt、bun和cre的含量水平,显示出dox化疗引起的系统损伤。经过齐墩果酸和包含齐墩果酸的纳米颗粒治疗后,alt和ast的含量都在一定程度上减少;特别是共载oa和dox的纳米颗粒(即fa-cs-g-oa@dox载药纳米颗粒)极大程度上降低了血清中alt和ast的含量,与dox组相比(p<0.01)(图5a)。这些数据显示,oa可以有效降低dox引起的肝毒性。同时,fa-cs-g-oa@dox治疗后,小鼠血清中cre和bun的含量也明显低于单纯dox和生理盐水组,说明fa-cs-g-oa@dox可以显著减少dox治疗引起的肾毒性。含有齐墩果酸纳米颗粒的肝保护和肾保护作用可能是由于齐墩果酸能抵消dox的作用并维持体内的氧化还原平衡水平。
实施例4
各组荷瘤小鼠经药物治疗后,收集血清,使用商业elisa试剂盒检测血清中炎性细胞因子如白细胞介素-6(il-6)、白介素-1β(il-1β)和肿瘤坏死因子-α(tnf-α),与氧化应激生物标志物如谷胱甘肽过氧化物酶(gsh-px)、丙二醛(mda)和超氧化物歧化酶(sod)含量,所有操作详细步骤按照试剂盒说明书进行。
gsh-px和sod是两种常见的抗氧化酶,可以通过减少不同类型的活性氧来保护机体免受氧化损伤。如图6(a)所示,dox治疗明显降低了血清中gsh-px和sod水平,但fa-cs-g-oa@dox载药纳米颗粒由于齐墩果酸的保护作用逆转了这一趋势。为了验证齐墩果酸对dox引起的小鼠炎症的影响,可以通过检测血清中il-1β、il-6和tnf-α的含量确定。如图6(b)所示,dox治疗后,小鼠表现出血清中高水平的il-1β、il-6和tnf-α,而在含有齐墩果酸的纳米颗粒治疗后,上述因子的血清含量明显减少了。因此,fa-cs-g-oa@dox载药纳米颗粒在降低乳腺癌小鼠dox给药后的副作用方面,具有极大的潜在应用。
对比例1
根据之前的报道(chawanmanaspon,等.journalofnanomaterials2012),muhammadchawanmanaspon课题组首先,在十二烷基苯磺酸钠存在的情况下,以自组装的方法将dox装载在普朗尼克胶束核心中。并将叶酸修饰的壳聚糖沉积在多离子胶束上形成壳层。得到纳米载体的dox装载效率大约是58.1±4.7%。纳米药物的平均粒径大小为37.4±2.0nm纳米,而zeta电势为12.9±2.3mv,说明该纳米载体具有一个较为稳定的壳核结构。但该纳米载药系统对系统毒副作用较大(在浓度为10mg/ml时,正常细胞存活率接近60%),粒径偏小(37.4±2.0nm),极易在体内被代谢掉,药物血循环时间较短,不能最大程度发挥药效。而本发明得到的纳米共载药系统fa-cs-g-oa@dox,由于齐墩果酸的存在,其对系统毒副作用大大减少(在浓度为10mg/ml时,正常细胞存活率接近90%,且荷瘤小鼠肝肾功能全都明显升高);另外该纳米载药系统的粒径合适(160nm左右)能够最大程度发挥epr效应,且还可以减少肿瘤的dox耐药性。
- 还没有人留言评论。精彩留言会获得点赞!