一种包含灵芝孢子油和灵芝多糖的口服乳剂及其制备方法和用途与流程
本发明属于中药领域,涉及一种包含灵芝孢子油和灵芝多糖的口服乳剂及其制备方法和用途。本发明所述的口服乳剂可促进灵芝活性成分的口服吸收,发挥灵芝孢子油和灵芝多糖二者的协同作用,提高疗效。
背景技术:
免疫是人体识别和消灭外来侵入的异物(病毒、细菌等),处理衰老、损伤、死亡的自身细胞,以及识别和处理体内突变细胞和病毒感染细胞的能力。机体免疫力低下易于受到细菌、病毒等感染或罹患癌症,免疫力超常也会引发过敏以及自身免疫系统疾病。另外,近年来研究表明,疲劳以及慢性疲劳综合症与免疫力低下或免疫失调相关。因此,调节机体免疫至正常水平是维持人体健康和缓解疲劳的基础。
灵芝在古代被誉为“仙草”,在我国已有2000多年的历史,被历代医药家视为滋补强壮、扶正固本的神奇珍品。灵芝具有双向调节人体免疫的作用,可在整体上平衡人体机能,快速恢复免疫系统,使机体内脏和细胞达到标准化。灵芝含有多糖、三萜、氨基酸、微量元素、腺苷、蛋白质、麦角甾醇、生物碱等多种成份,可发挥良好的免疫调节作用。
灵芝多糖一般是由灵芝子实体中获得的提取物,具有良好的水溶性。研究表明,灵芝多糖可通过增强
灵芝孢子是多孔菌科灵芝属赤芝或紫芝的种子,其含有丰富的脂溶性化合物灵芝的三萜和麦角甾醇等。目前市售的破壁灵芝孢子粉,其三萜化合物的总含量为1-5%,且破壁后的灵芝孢子粉由于直接与空气接触,放置时其活性成分非常容易氧化变质,导致有效成分含量降低;而灵芝孢子油为灵芝孢子中脂溶性成分的总和,经破壁技术和超临界流体co2萃取得到的灵芝孢子油富含灵芝三萜类化合物,其三萜化合物的总含量可达15~30%,显著高于破壁灵芝孢子粉和灵芝子实体中的三萜化合物的含量。
结构式1灵芝酸a和麦角甾醇的结构
目前,市场的灵芝类产品主要有灵芝孢子粉,破壁灵芝孢子粉,灵芝孢子多糖胶囊,灵芝孢子油软胶囊等。然而这些产品往往有效成分单一,并且不易被人体消化和吸收,无法充分发挥灵芝主要成分的疗效。
灵芝孢子油与灵芝多糖的功效具协同和互补作用。灵芝孢子油中的三萜类化合物和麦角甾醇可直接抑制炎症因子或肿瘤细胞的生长,对中性粒细胞等释放的炎症介质有抑制作用。在哮喘的鼠模型中,富含灵芝三萜的提取物显著减弱了气道高反应性,减少了总体粒细胞和嗜酸性粒细胞的浸润,降低了il-4、il-5和嗜酸细胞活化趋化因子等炎性介质的水平,从而发挥抗炎症反应作用。在脂多糖(lps)刺激巨噬细胞的体外炎症模型中,灵芝三萜类化合物和麦角甾醇可对多种炎症介质,如no、peg2、tnf-α、il-6、il-1β等有明显抑制作用,说明其具有抗炎效果。而灵芝多糖可提高机体的免疫防御作用,不仅能增强正常小鼠的体液免疫和细胞免疫反应,具有免疫增强作用,而且还能拮抗免疫抑制药、抗肿瘤药、应激和衰老所致免疫功能抑制,使之回复正常或接近正常水平。其作用机制显示,灵芝多糖对免疫细胞具有广泛的作用,如激活t细胞、b细胞、巨噬细胞、nk细胞等免疫细胞;促进未分化的脾细胞在体外增殖,显著提高机体的体液免疫功能和网状内皮系统的吞噬功能;增强t淋巴细胞dna多聚酶的活性,促进淋巴细胞dna合成、促进t细胞增殖;促进白细胞介素等细胞因子的分泌、表达等,从而实现灵芝多糖的免疫增强作用和免疫恢复作用。总而言之,灵芝多糖可以通过对免疫系统的直接和间接影响,维持机体的免疫调节作用,提高机体的抗病能力。灵芝孢子油与灵芝多糖同时使用可以在提高机体免疫力的基础上发挥抗炎及抗肿瘤效果,具有协同和互补作用。有研究表明,灵芝的三萜化合物和灵芝多糖配伍使用可增强对小鼠体内lewis肿瘤生长的抑制,且肝指数、胸腺指数、脾指数等动物免疫指标在给药后均有提高。因此,采用一定配比组合的灵芝孢子油和灵芝多糖对于灵芝提取物完整功效的发挥具有重要意义。
目前,临床使用的很多验方(如灵薏方、益元康方等)中均采用了灵芝多组份配伍使用以达到协同增效的目的。然而,复方多采用传统水煎煮的方法,由于灵芝中的三萜化合物和麦角甾醇等成份的水溶性差,口服难以吸收,影响其药效的发挥。此外,市售的破壁灵芝孢子粉产品中虽然同时含有灵芝三萜和灵芝多糖,但是灵芝三萜等脂溶性成分口服吸收差,灵芝酸和麦角甾醇的口服生物利用度低,仅为10-20%,影响二者协同发挥疗效,导致药效降低。目前已有的验方或灵芝孢子粉产品等仍无法良好发挥灵芝脂溶性成份和水溶性成份的协同作用。
中药的多成分决定了其治疗作用的多靶点与多层次,由于其具有在有效部位或有效成分层次上多种药理活性物质的特定组合、以及每种活性成分最佳的组分构成比例,才能多系统、多靶点和多层次发挥全方面的药效作用。不同产地的灵芝药材中灵芝三萜与灵芝多糖的比例范围在1:2.84-2.91:1之间,在该比例范围内,灵芝三萜和灵芝多糖可以协同发挥最优疗效,然而由于口服吸收受限,导致直接服用灵芝疗效不佳。因此,本发明旨在通过制剂手段,以灵芝中两种成分的天然比例为优化的比例范围,开发一种包含灵芝孢子油和灵芝多糖的口服乳剂,最大程度地提高其生物利用度,促进其口服吸收,协同发挥免疫调节作用。
技术实现要素:
为了解决现有技术中存在的问题,本发明的目的是提供一种包含灵芝孢子油和灵芝多糖的口服乳剂,其可以有效地促进灵芝孢子油中的灵芝三萜等脂溶性化合物和灵芝多糖共同吸收,发挥协同作用。
本发明的发明人经过研究发现,将灵芝孢子油和灵芝多糖制备成纳米尺度的口服乳剂,可提高有效成分经由肠上皮细胞膜的吸收。另外,灵芝多糖具有降低肠细胞膜的外排蛋白(p-gp等)表达的作用,抑制外排蛋白对灵芝孢子油的外排作用,进一步提高了活性成分的生物利用度,使灵芝孢子油和灵芝多糖的组合物协同促吸收,并协同发挥免疫调节作用。
本发明以对体内免疫功能的调节作用为指标筛选优化了对口服乳剂中的灵芝孢子油和灵芝多糖的比例,灵芝孢子油:灵芝多糖的质量比例范围为:1:3-6:1,更优选为1:2-5:1。
根据本发明的一个方面,提供了一种包含灵芝孢子油和灵芝多糖的口服乳剂,其包含:相对于所述口服乳剂的总质量,1-50%的灵芝孢子油,1-50%的灵芝多糖,0.2-10%的乳化剂,0-40%的其他药品和食品中可接受的原辅料和1-97.8%的无菌水。更优选地,所述口服乳剂包含:相对于所述口服乳剂的总质量,1-30%的灵芝孢子油,1-30%的灵芝多糖,0.3-6%的乳化剂为,0-30%的其他药品和食品中可接受的原辅料和20-97.7%的无菌水。
本发明的口服乳剂中,优选地,灵芝孢子油:灵芝多糖的质量比例范围为1:3-6:1,更优选为1:2-5:1。
更优选地,所述口服乳剂中的乳滴的粒径为小于500nm。
其中,所述灵芝孢子油可来自于选自灵芝菌丝体、灵芝孢子粉和破壁灵芝孢子粉中的一种或多种组合。所述灵芝孢子油的主要成分含有三萜化合物,甾体和不饱和脂肪酸等,一般地,三萜化合物的总含量为10-30%,不饱和脂肪酸含量为30-80%,麦角甾醇含量为0.05-10%。
其中,所述灵芝孢子油中含有的三萜类化合物包括灵芝酸、灵芝酸甲酯、灵芝内酯、灵芝孢子酸、灵芝醇和灵芝甾酮等,是一类高度氧化的羊毛甾烷衍生物。
所述灵芝多糖可来自于灵芝子实体、灵芝孢子和/或灵芝菌丝体,所述灵芝多糖分子量范围为4~20kda,更进一步地,其中,相对于所述灵芝多糖的总质量,分子量范围为5~8kda的灵芝多糖的含量为30-80%,分子量范围18~20kda的灵芝多糖的含量为10-35%;其余多糖的含量5-50%。
所述灵芝多糖中单糖组成有d-葡萄糖、木糖、甘露糖、半乳糖、阿拉伯糖、鼠李糖和岩藻糖。组成灵芝多糖的单糖以β-(l→3)(l→6)连接或以β-(1→4)(1→6)连接的糖苷键形式链接。灵芝多糖的主要活性成分为三螺旋体结构多糖,即主链结构为β-(l→3)连接的d-吡喃型葡萄糖残基,侧链是在主链的6位c原子上连接有单糖、双糖及寡糖。
所述乳化剂选自磷脂、柠檬酸脂肪酸甘油酯、脂肪酸甘油酯、聚山梨酯、脂肪酸山梨坦、环糊精、聚氧乙烯脂肪酸酯、聚氧乙烯聚氧丙烯共聚物、聚氧乙烯脂肪醇醚、聚乙二醇、泊洛沙姆、甲壳质、甲壳胺、胆酸及其盐等中的一种或多种。
根据需要,所述口服乳剂可选择性包含其他药品和食品中可接受的原辅料,其可选自植物提取物、油脂、界面膜稳定剂、抗氧化剂、ph调节剂、金属离子络合剂、调味剂和防腐剂中的一种或多种。
其中,所述植物提取物可选自人参、西洋参、阿胶、三七、红花、黄芪、党参和枸杞中的一种或多种。
其中,所述油脂可选自下述中的一种或多种:天然植物油,如大豆油、蓖麻油、花生油、玉米油、菜籽油、红花油、亚麻籽油、橄榄油中的一种或多种;链长在c8-c10之间的脂肪酸甘油酯(如中链三酸甘油酯);鱼油;油酸;亚油酸;肉豆蔻酸异丙酯。
其中,所述界面膜稳定剂的作用是形成稳定的乳化界面膜,其可选自丙三醇、丙二醇、甘露醇、油酸、油酸钠和胆固醇中的一种或多种。
所述抗氧化剂可以选自亚硫酸钠、亚硫酸氢钠、焦亚硫酸钠、维生素c及其酯类和维生素e及其酯类中的一种或多种。
所述ph调节剂可以为各类缓冲盐体系,例如柠檬酸-柠檬酸钠、醋酸-醋酸钠、磷酸盐剂等,以及naoh溶液,hcl等碱和酸。
所述金属离子络合剂可以选自如edta或乙二胺四乙酸二钠盐等中的一种或多种。
所述调味剂可以为,如水果口味香精、天然植物香料、甜味剂等。
根据本发明的另一方面,提供了一种制备所述包含灵芝孢子油和灵芝多糖的口服乳剂的方法,其包括如下步骤:
a)在惰性气体保护下,将乳化剂加入至灵芝孢子油中,加入药品和食品中可接受的脂溶性原辅料,搅拌混合,直至形成均一的油溶液;
b)将灵芝多糖加入至无菌水中,加入药品和食品中可接受的水溶性原辅料,搅拌溶解直至形成均一的水溶液;
c)将步骤a)所得含有灵芝孢子油的油溶液和b)中得到的含有灵芝多糖的水溶液混合,通过剪切搅拌或高压均质形成水包油的乳剂;
其中,相对于所述口服乳剂的总质量,所述灵芝孢子油的含量为1-50%,所述灵芝多糖的含量为1-50%,所述乳化剂的含量为0.2-10%,所述其他药品和食品中可接受的原辅料的含量为0-40%,以及所述无菌水的含量为1-97.8%。
本发明所述方法,优选地,相对于所述口服乳剂的总质量,所述灵芝孢子油的含量为1-30%,所述灵芝多糖的含量为1-30%,所述乳化剂的含量为0.3-6%,所述其他药品和食品中可接受的原辅料的含量为0-30%,以及所述无菌水的含量为20-97.7%。
优选地,所述方法进一步包括:
d)将步骤c)制备得到的口服乳剂进行过滤、灭菌和包装。
根据本发明的再一方面,提供一种所述口服乳剂在制备调节免疫功能和/或抗疲劳作用的药物中的用途。
本发明所述包含灵芝孢子油和灵芝多糖的口服乳剂可显著提高活性成分的口服生物利用度,灵芝酸a的口服生物利用度可达30-70%;麦角甾醇的生物利用度可达35-80%。
另外,本发明的发明人经过研究发现,通过优化配比制备的包含灵芝孢子油和灵芝多糖的口服乳剂粒径小于500nm,可以极大地增加肠细胞的吸收作用;且灵芝多糖可以降低肠细胞膜的外排蛋白表达,显著抑制外排蛋白对灵芝孢子油的外排作用。灵芝孢子油和灵芝多糖的组合物不仅可以协同促吸收,而且可以协同发挥免疫调节和抗疲劳作用。
附图说明
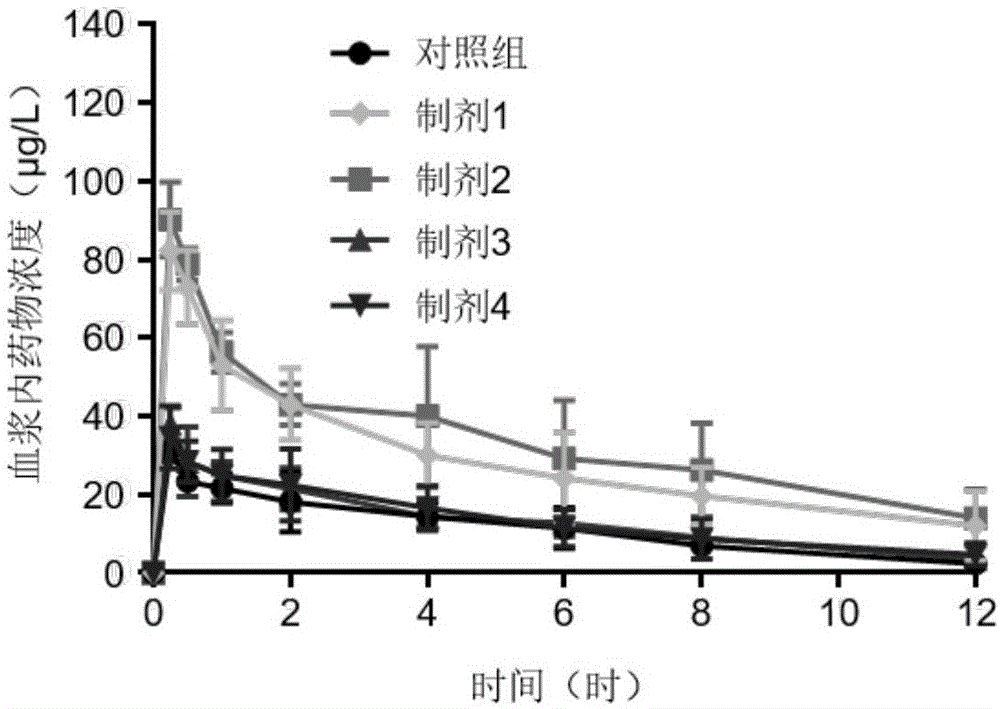
图1为在实施例3中制备的包含灵芝孢子油和灵芝多糖的口服乳剂中灵芝酸a的体内促吸收效果线形图。
图2为在实施例3中制备的包含灵芝孢子油和灵芝多糖的口服乳剂中麦角甾醇的体内促吸收效果线形图。
图3为在实施例4中制备的包含灵芝孢子油和灵芝多糖的口服乳剂中灵芝酸a的体内促吸收效果线形图。
图4为在实施例4中制备的包含灵芝孢子油和灵芝多糖的口服乳剂中麦角甾醇的体内促吸收效果线形图。
图5为显示在实施例5中进行的增强免疫力功能的评价结果的图表。
具体实施方式
下面结合具体的实施例,并参照数据进一步详述本发明。这些实施例只是为了举例说明本发明,旨在说明本发明的具体配方组成、制备方法及其功能和效果,而非以任何方式限制本发明的范围。在以下实施例中,未详细描述的各种过程和方法是本领域中公知的常规方法。
制剂实施例
实施例1:考察包含灵芝孢子油和灵芝多糖的口服乳剂的处方量
包含灵芝孢子油和灵芝多糖的口服乳剂的制备方法如下:
1、制备油相:将灵芝孢子油,大豆油,磷脂,丙二醇油相成分,在氮气保护下混合均匀,备用。
2、制备水相:将灵芝多糖溶于适量的无菌水中,形成均一的水溶液,备用。
3、制备乳剂:在氮气保护下,将含有灵芝多糖的水相通过搅拌涡旋加入油相,剧烈搅拌形成水包油的乳剂,并进行高剪切制备乳剂;
4、均质乳化:通过高压均质机反复均质乳化,制得粒径小于500nm的口服乳剂;
5、过滤封装:将纳米乳经过0.5μm的滤膜过滤后,灌装,充氮,密封;
6、高压灭菌:将灌装纳米乳在高压灭菌器中灭菌,115℃,30min后即得包含灵芝孢子油和灵芝多糖的口服乳剂。
表1
按照表1中的粒径结果可看出,固定量的灵芝孢子油和灵芝多糖,加入0.2-10%的乳化剂,0-40%的其他原辅料(油脂、界面膜稳定剂等),可形成稳定性良好、且粒径在500nm以下的口服乳剂。因此,发明的包含灵芝孢子油和灵芝多糖的口服乳剂,乳化剂用量应为0.2-10%,优选为0.3-6%。
实施例2:制备包含不同比例的灵芝孢子油和灵芝多糖的口服乳剂
采用实施例1的制备方法,根据以下表2中各成分的量制备包含灵芝孢子油和灵芝多糖的口服乳剂。
表2
按照表2中处方组分制备的口服液稳定性良好,乳品的液滴大小均值小于0.5μm。
实施例3:采用药动学实验筛选灵芝孢子油和灵芝多糖的比例
1、实验动物
实验动物:雄性wistar大鼠,体重260-280g。
2、本实施例分为5个实验组:各组给药剂量以及给药途径具体如下所示:
(1)灵芝孢子油口服乳剂组(对照组):取100g灵芝孢子油、200g大豆油、60g磷脂、50g丙二醇和6g柠檬酸脂肪酸甘油酯,在氮气保护下混合均匀,加入1000ml空白水相进行乳化,通过高压均质机反复均质乳化,制得粒径小于500nm的口服乳剂;灵芝孢子油给药剂量为300mg/kg。
(2)包含灵芝孢子油和灵芝多糖的口服乳剂组(制剂1-4):使用实施例2表2中制备的口服乳剂1-4;乳品的液滴大小均值小于0.5μm;灵芝孢子油的给药剂量为300mg/kg。
3、将wistar大鼠随机分为5组,每组6只,实验前禁食12h,不禁水。给大鼠分别灌胃五组制剂,在给药0.25h,0.5h,1h,2h,4h,6h,8h和12h后,眼眶静脉丛采血0.5ml,收集于肝素化试管中,37℃水浴保温30min后,低温离心10min(5000r/min),分离血浆取上清液,于-20℃保存待测定其药物浓度。
4、灵芝酸a、麦角甾醇是灵芝中的脂溶性成分,且已有报道两种成分的生物利用度较低,故本研究中以灵芝酸a和麦角甾醇为灵芝孢子油的指标成分,采用hplc检测血浆中两种成分的含量。
5、实验结果
wistar大鼠灌胃不同制剂的灵芝口服乳液,其血药浓度-时间曲线测定数据经“das”药动学计算(表3—灵芝酸a;表4—麦角甾醇),根据灵芝酸a和麦角甾醇的药动学参数,可以看出,制剂3和4的药动学参数与对照组相近,且生物利用度较低;而制剂1和2的生物利用度明显较高。根据药动学结果可筛选出,灵芝孢子油和灵芝多糖的质量比在1:3-6:1的范围内,生物利用度可以得到提高。后续实施例选用生物利用度较高的制剂2。
表3
表4
体内实施例
实施例4:提高生物利用度的功能实验
1、实验动物
实验动物:雄性wistar大鼠,体重260-280g。
2、本实施例分为6个实验组:各组给药剂量以及给药途径具体如下所示:
(1)对照组1:市售灵芝孢子油胶囊(南京中科药业有限公司),给药剂量为300mg/kg。
(2)对照组2:市售破壁灵芝孢子粉胶囊(北京同仁堂股份有限公司),给药剂量为300mg/kg。
(3)对照组3:灵芝孢子油和灵芝多糖联合给药组:使用市售的灵芝孢子油胶囊;将灵芝多糖提取物溶于无菌水中,制成质量百分比为10%的灵芝多糖口服液;灵芝孢子油、灵芝多糖给药剂量分别为300mg/kg。
(4)灵芝孢子油口服乳剂组(制剂1):取100g灵芝孢子油、200g大豆油、60g磷脂、50g丙二醇和6g柠檬酸脂肪酸甘油酯,在氮气保护下混合均匀,加入1000ml空白水相进行乳化,通过高压均质机反复均质乳化,制得粒径小于500nm的口服乳剂;灵芝孢子油给药剂量为300mg/kg。
(5)包含灵芝孢子油和灵芝多糖的口服乳剂组(制剂2):使用实施例2中2号制剂处方制备的口服乳剂;乳品的液滴大小均值小于500nm;灵芝孢子油、灵芝多糖给药剂量分别为300mg/kg。
(6)包含灵芝孢子油和灵芝多糖的口服乳剂组(制剂3):使用实施例2中2号制剂的处方,不采用高压均质机均质乳化,制备得到粒径大于500nm的口服乳剂;灵芝孢子油、灵芝多糖给药剂量分别为300mg/kg。
3、将wistar大鼠随机分为6组,每组6只,实验前禁食12h,不禁水。给大鼠分别灌胃六组制剂,在给药0.25h,0.5h,1h,2h,4h,6h,8h和12h后,眼眶静脉丛采血0.5ml,收集于肝素化试管中,37℃水浴保温30min后,低温离心10min(5000r/min),分离血浆取上清液,于-20℃保存待测定其药物浓度。
4、灵芝酸a、麦角甾醇是灵芝中的脂溶性成分,且已有报道两种成分的生物利用度较低,故本研究中以灵芝酸a和麦角甾醇为灵芝孢子油的指标成分,采用hplc检测血浆中两种成分的含量。
5、实验结果
wistar大鼠灌胃不同制剂的灵芝口服乳液,其血药浓度-时间曲线测定数据经“das”药动学计算(表5—灵芝酸a;表6—麦角甾醇),结果表明,制剂组的生物利用度均高于市售的两种对照产品,并且包含灵芝孢子油和灵芝多糖的口服乳剂(制剂2),其生物利用度明显提高,灵芝酸a、麦角甾醇的生物利用度分别是制剂1的2.77倍和3.01倍,可促进包含灵芝孢子油和灵芝多糖的口服乳剂发挥协同作用,显著提高疗效。制剂3的生物利用度与两个市售对照组的生物利用度无明显差异,tmax与cmax也相近,而制剂3的生物利用度明显低于制剂2,表明口服乳剂的乳滴大小对口服吸收影响较大,本发明中制备得到的口服乳剂粒径在500nm以下,可以极大地增加肠细胞的吸收并且显著地抑制肠细胞膜的外排蛋白对灵芝三萜的外排作用。
对照组中采用灵芝孢子油和灵芝多糖联合给药,其生物利用度明显低于相同剂量的包含灵芝孢子油和灵芝多糖的口服乳剂组,表明仅仅同时服用灵芝孢子油和灵芝多糖,其生物利用度仍较低。
表5
表6
实施例5:包含灵芝孢子油和灵芝多糖口服乳剂的调节免疫能力实验
1、实验细胞及动物
实验细胞:绵羊红细胞(srbc),鸡红细胞(crbc)。
实验动物:spf级雄性balb/c小鼠,体重18g~22g。
2、本实施例分为11个实验组:各组给药剂量以及给药途径具体如下所示:
(a1)对照组1:市售的灵芝孢子油胶囊,给药剂量为300mg/kg,每天灌胃1次给小鼠。
(a2)对照组2:市售的破壁灵芝孢子粉胶囊,给药剂量为300mg/kg,每天灌胃1次给小鼠。
(b1)灵芝孢子油口服乳剂组:使用实施例4中制剂1制备的口服乳剂,灵芝孢子油给药剂量300mg/kg,每天灌胃1次给小鼠。
(b2)灵芝多糖口服液组:将灵芝多糖溶解于无菌水中,灵芝多糖给药剂量300mg/kg,每天灌胃1次给小鼠。
(c1)包含灵芝孢子油和灵芝多糖的口服乳剂组(低浓度):使用实施例2中2号制剂的处方制备的口服乳剂,灵芝孢子油、灵芝多糖的给药剂量分别为300mg/kg,每天灌胃1次给小鼠。
(c2)包含灵芝孢子油和灵芝多糖的口服乳剂组(中浓度):使用实施例2中2号制剂的处方制备的口服乳剂,灵芝孢子油、灵芝多糖的给药剂量分别为600mg/kg,每天灌胃1次给小鼠。
(c3)包含灵芝孢子油和灵芝多糖的口服乳剂组(高浓度):使用实施例2中2号制剂的处方制备的口服乳剂,灵芝孢子油、灵芝多糖的给药剂量分别为1000mg/kg,每天灌胃1次给小鼠。
(d1)包含灵芝孢子油和灵芝多糖的口服乳剂组:使用实施例2中3号制剂的处方制备的口服乳剂,灵芝孢子油和灵芝多糖的给药剂量分别为300mg/kg和15mg/kg,每天灌胃1次给小鼠。
(d2)包含灵芝孢子油和灵芝多糖的口服乳剂组:使用实施例2中4号制剂的处方制备的口服乳剂,灵芝孢子油和灵芝多糖的给药剂量分别为15mg/kg和300mg/kg,每天灌胃1次给小鼠。
(e1)低剂量灵芝孢子油和灵芝多糖联合给药组:使用市售的灵芝孢子油胶囊;将灵芝多糖提取物溶于无菌水中,制成灵芝多糖口服液;灵芝孢子油和灵芝多糖的给药剂量分别为300mg/kg,每天灌胃1次给小鼠。
(e2)高剂量灵芝孢子油和灵芝多糖联合给药组:使用市售的灵芝孢子油胶囊,灵芝孢子油给药剂量为1000mg/kg;将灵芝多糖提取物溶于无菌水中,制成灵芝多糖口服液,灵芝多糖的给药剂量为300mg/kg·;每天灌胃1次给小鼠。
3、增强免疫力功能评价方法
迟发型变态反应(足跖增厚法),cona诱导的小鼠脾淋巴细胞转化试验(mtt法),抗体生成细胞检测(jerne改良玻片法),nk细胞活性测定(乳酸脱氢酶测定法)。
4、增强免疫力功能评价结果
各制剂组给予小鼠连续灌胃30天,均能提高cona诱导的小鼠脾淋巴细胞的增殖能力(图5),促进小鼠的迟发型变态反应(表7),在相同浓度下,口服乳剂对小鼠细胞免疫功能有促进作用,并且同时包含灵芝孢子油和灵芝多糖的口服乳剂疗效更优。包含灵芝孢子油和灵芝多糖的中剂量组和高剂量口服乳剂组能提高抗体细胞生成数(表8),表明灵芝孢子油与多糖具有促进抗体生成细胞增殖的作用,从而有助于增强小鼠体液免疫功能。制剂组分别与对照组小鼠相比,其nk细胞活性率均有显著性差异(表9),并且包含灵芝多糖与灵芝孢子油的口服乳剂效果更优于单独药物的口服乳剂,浓度越大,效果更优。
将c1组和d1,d2组进行比较,可以发现,经过优化配比的包含灵芝孢子油和灵芝多糖的口服乳剂比优化配比范围外的口服乳剂,具有更好的疗效。
将e1、e2组与c1组进行比较,发现相同甚至更高剂量的灵芝孢子油并没有显著的调节免疫能力的作用,表明低生物利用度的灵芝孢子油不能与灵芝多糖发挥协同作用,提高灵芝孢子油的生物利用度后,免疫调节能力显著提高。
表7
表8
表9
- 还没有人留言评论。精彩留言会获得点赞!