矿化水凝胶及仿生矿化骨修复材料的制备方法与流程
本发明属于生物医学材料和生物医学工程技术领域,涉及矿化水凝胶及仿生矿化骨修复材料的制备。
背景技术:
骨组织是一种高度分化的结缔组织,具有微观到宏观的分级结构,其中矿化胶原纤维是天然骨组织的基本组成单元。
碱性磷酸酶是骨组织细胞外基质中的重要成分,参与磷灰石矿物相的成核、生长及结构调节;碱性磷酸酶参与基质矿化主要是通过酶解基质中的焦磷酸盐产生磷酸根离子,从而调节基质中无机磷酸根离子与焦磷酸盐之间的平衡,促进细胞外基质与钙离子结合产生矿化微环境,进而促进胶原矿化形成规则排列的骨组织。碱性磷酸酶还可直接与胶原结合,形成促进胶原基质矿化传播的支架。除了碱性磷酸酶外,一些磷酸化蛋白(如骨桥蛋白、骨唾液蛋白、牙本质蛋白等蛋白在细胞内或细胞外经过磷酸化修饰得到高度磷酸化的骨桥蛋白、骨唾液蛋白、牙本质磷蛋白等磷酸化修饰上具有大量带负电的磷酸根基团)在骨、软骨、牙本质和其他脊椎动物间充质组织矿化过程中起着非常重要的作用,其可以与胶原结合,使得胶原分子周围富集带负电性磷酸根基团,促进磷酸钙成核及与胶原的结合。因此,胶原纤维矿化是一个酶(如碱性磷酸酶)以及其他基质成分(如磷酸化骨桥蛋白)参与诱导的磷灰石沿胶原纤维沉积的过程。受细胞外基质矿化过程的启发,通过模拟胶原纤维的矿化过程设计出仿生骨修复材料,这对于骨组织再生具有重要的意义。
gkioni,k等报道了一篇关于矿化水凝胶在骨组织修复中应用的综述,分析表明矿化水凝胶作为骨修复材料具有很好的应用前景(gkioni,k;leeuwenburgh,s.c.;douglas,t.e.;mikos,a.g.;jansen,j.a.,mineralizationofhydrogelsforboneregeneration.tissueengineeringpartb:reviews2010,16(6),577-585)。由于天然骨组织矿化过程是磷酸钙沿胶原纤维沉积的过程,因此能实现磷酸钙在水凝胶中沿着分子网络均匀矿化的可注射型生物大分子材料水凝胶尤为值得期待。其中通过模拟骨组织的生理矿化过程,利用碱性磷酸酶和磷蛋白仿生矿化得到均匀矿化的水凝胶是非常自然的选择。yamauchi,k等报道了一篇利用酶诱导矿化法制备胶原/磷酸钙多层复合物的研究,通过将碱性磷酸酶直接于胶原膜表面风干,实现碱性磷酸酶的物理包裹,此复合物在矿化液中通过酶诱导矿化得到胶原/磷酸钙复合物,再层层叠加的方式得到碱性磷酸酶诱导的多层胶原/磷酸钙多层复合物,实现了酶诱导的胶原矿化(yamauchi,k;goda,t.;takeuchi,n.;einaga,h.;tanabe,t.,preparationofcollagen/calciumphosphatemultilayersheetusingenzymaticmineralization.biomaterials2004,25(24),5481-9);然而这种通过将碱性磷酸酶物理结合在多层胶原中膜的方式,过程复杂繁琐,且会导致胶原中碱性磷酸酶的快速释放,使得胶原基质外发生矿化,矿化度降低。y,doi等报道了一篇关于磷灰石-胶原复合物的制备研究,将胶原和碱性磷酸酶在edc/nhs溶液中交联,实现碱性磷酸酶与生物大分子材料的共价交联,从而抑制胶原基质外矿化的发生(y,doi;t,
horiguchi;y,moriwaki;h,kitago;t,kajimoto;y,iwayama,formationofapatite-collagencomplexes.journalofbiomedicalmaterialsresearch1996,31(1):43-49);然而这种共价交联的方式与细胞不相容,不能实现细胞原位包裹,不能很好的模拟骨组织中细胞参与的生理矿化过程。
技术实现要素:
本发明的目的旨在针对上述现有技术中的不足,提供一种矿化水凝胶的制备方法,该制备方法得到的矿化水凝胶理化性能稳定、力学强度高、生物活性好、可实现细胞的原位包裹,从而能够模拟骨生理矿化形成过程。
本发明的另一目的在于提供一种含有磷酸蛋白样材料的矿化水凝胶的制备方法。
本发明的第三个目的在于提供一种仿生矿化骨修复材料的制备方法。
本发明的第四个目的在于提供另外一种仿生矿化骨修复材料的制备方法。
本发明提供的矿化水凝胶的制备方法,包括以下步骤:
(a1)制备活化生物大分子材料
在0~10℃、搅拌条件下,将医用生物大分子材料与活化试剂在ph为7.5~8.5的水相体系中反应2~72h,反应产物经透析、真空干燥得到活化生物大分子材料;所述医用生物大分子材料与活化试剂的重量比为100:(3~1000);
(a2)制备活化磷酸酶
在0~10℃、搅拌条件下,将磷酸酶与活化试剂在ph为7.5~8.5的水相体系中反应2~24h,反应产物经透析、真空干燥得到活化磷酸酶;所述磷酸酶与活化试剂的重量比为100:(1~20);
(a3)制备水凝胶
将活化生物大分子材料、活化磷酸酶和光引发剂在ph为7~7.5的水相体系中混合均匀形成反应体系,于光照条件下反应至该反应体系呈凝胶状得到水凝胶;所述活化生物大分子材料、活化磷酸酶和光引发剂的重量比为(5~20):(1~10):(1~10);
或者将活化生物大分子材料、活化磷酸酶和自由基引发剂在ph为7~7.5的水相体系中混合均匀形成反应体系,静置反应至该反应体系呈凝胶状得到水凝胶;所述活化生物大分子材料、活化磷酸酶和自由基引发剂的重量比为(5~20):(1~10):(1~45);
(a4)制备矿化水凝胶
将水凝胶于矿物质质量浓度为0.05~5%的矿化液中矿化4h(小时)~14d(天)形成矿化水凝胶,然后从矿化液中取出得到均匀矿化的矿化水凝胶;所述水凝胶与矿化液的体积比为1:(10~1000)。
上述矿化水凝胶的制备方法,首先分别将医用生物大分子材料和磷酸酶与活化试剂反应获得活化生物大分子材料和活化磷酸酶,接枝上具有双键的活性基团;然后将活化生物大分子材料和活化磷酸酶经光引发剂或自由基引发剂的作用下交联形成凝胶,得到包含医用生物大分子材料和磷酸酶的水凝胶;进一步将水凝胶于矿化液中矿化得到矿化水凝胶。通过这种方法得到的矿化水凝胶,具有矿化均匀,生物相容好,可实现细胞原位包裹的优点。
上述矿化水凝胶的制备方法,步骤(1)和步骤(2)的目的是制备得到活化生物大分子材料和活化磷酸酶。主要是将医用生物大分子材料或磷酸酶与活化试剂在水相体系中反应得到。活化生物大分子材料的具体制备方式有以下两种:(1)先将医用生物大分子材料和活化试剂分别利用ph为7.5~8.5的水相体系配置成医用生物大分子材料的水相分散液和活化试剂的水相溶液,然后再将两者混合,在0~10℃、搅拌条件下反应2~72h,反应所得产物经透析、真空干燥得到活化生物大分子材料;(2)将医用生物大分子材料和活化试剂按重量比加入到0~10℃、处于搅拌状态的水相体系(ph为7.5~8.5)中,继续搅拌反应2~72h,反应所得产物经透析、真空干燥得到活化生物大分子材料。水相体系主要是提供反应环境,水相体系可以为ph在7.5~8.5范围内的pbs、醋酸钠缓冲液、tris-hcl(三羟甲基氨基甲烷盐酸盐)缓冲液等。本发明中,医用生物大分子材料在形成的反应体系中的终浓度约为0.1~2%浓度(w/w),用于活化医用生物大分子材料的试剂在形成的反应体系中的终浓度约为0.003~10%。光活化磷酸酶的制备过程与光活化生物大分子材料的制备过程相似,这里不再赘述。本发明中,磷酸酶在形成的反应体系中的终浓度约为0.1~20%(w/w),用于活化磷酸酶的试剂在形成的反应体系中的终浓度约为0.001~2%。制备活化生物大分子材料和活化磷酸酶过程中,为了去除未反应的试剂及其他副产物,医用生物大分子材料或磷酸酶与活化试剂反应所得产物放入常规透析袋(截留分子量为8000-14000)于去离子水中透析3~7天即可,对透析产物进一步进行真空干燥即可得到相应的活化生物大分子材料和活化磷酸酶。
上述矿化水凝胶的制备方法,所述生物大分子材料为蛋白或/和多糖;所述蛋白为胶原蛋白、丝素、明胶中的至少一种;所述多糖为海藻酸钠、透明质酸、纤维素、葡聚糖中的至少一种。所述磷酸酶为碱性磷酸酶或/和酸性磷酸酶。所述活化试剂为甲基丙烯酸酐、甲基丙烯酸缩水甘油酯、丙烯酸酐、环氧丁烯中的至少一种。
上述矿化水凝胶的制备方法,步骤(3)的目的是通过光引发剂光照射交联或自由引发聚合交联下,引发活化生物大分子材料和活化磷酸酶发生化学交联反应得到水凝胶。当采用光照射交联法制备水凝胶时,具体实现方式为:活化生物大分子材料、活化磷酸酶和光引发剂在水相体系中混合均匀并于光照射条件下反应至体系呈凝胶状得到水凝胶。本发明采用的光照射条件为:光波长为320~500nm的紫外可见光等,功率为5~8w/cm2,照射时间为20~120s。当采用自由引发化学交联法制备水凝胶时,具体实现方式为:活化生物大分子材料、活化磷酸酶和自由基引发剂在水相体系中混合均匀,静置反应10~60min至体系呈凝胶状得到水凝胶。不管哪种方式制备水凝胶,在制备过程中,首先要将活化生物大分子材料、活化磷酸酶和光引发剂/自由基引发剂在水相中混合均匀,可以采取以下两种方式:(1)先分别将活化生物大分子材料、活化磷酸酶分别均匀分散到水相体系中,得到活化生物大分子材料的水相分散液和活化磷酸酶的水相分散液,将光引发剂或自由基引发剂溶解到水相体系中得到光引发剂或自由基引发剂的水相溶液,然后再将活化生物大分子材料的水相分散液、活化磷酸酶的水相分散液、光引发剂或自由基引发剂的水相溶液混合均匀即可;(2)将活化生物大分子材料、活化磷酸酶、光引发剂或自由基引发剂按重量比加入到水相体系混合均匀即可。反应所得产物经透析、真空干燥得到活化生物大分子材料。水相体系主要是提供反应环境,水相体系可以为ph在7.0~7.5范围内的去离子水、生理盐水、pbs缓冲液,醋酸钠缓冲液、tris-hcl缓冲液等。本发明中,活化生物大分子材料在形成的反应体系中的终浓度约为0.2~15%浓度(w/w),活化磷酸酶在形成的反应体系中的终浓度约为0.1~2%(w/w),光引发剂在形成的反应体系中的终浓度约为0.05~1%(w/w),自由基引发剂在形成的反应体系中的终浓度约为0.1~2%(w/w)。
上述矿化水凝胶的制备方法,所述光引发剂为2-羟基-4-(2-羟乙氧基)-2-甲基苯丙酮(i2959)、2,4,6-三甲基苯甲酰基苯基亚膦酸锂(lap)或2,4,6-三甲基苯甲酰基-二苯基氧化膦(tpo)。所述自由基引发剂由过硫酸铵和四甲基乙二胺按照重量比1:1~4:1组成。
上述矿化水凝胶的制备方法,步骤(4)中,水凝胶中的磷酸酶能够促使矿化液中的磷酸盐在凝胶中均匀沉积,得到均匀矿化的矿化水凝胶。所述矿化液为有机磷酸钙盐溶液、有机磷酸镁盐溶液、有机磷酸铁盐溶液中至少一种,或者有机磷酸与无机钙盐、镁盐、铁盐溶液中的一种混合而成的溶液;在优先地实施方式中,矿化液为甘油磷酸钙,甘油磷酸和氯化钙的混合溶液,甘油磷酸和硝酸钙的混合溶液,甘油磷酸和氯化铁的混合溶液等。
本发明进一步提供了一种含有磷酸蛋白样材料的矿化水凝胶的制备方法,在前面所述矿化水凝胶制备方法的制备水凝胶步骤中加入含有磷酸蛋白样材料的水相分散液或纯的磷酸蛋白样材料,得到含有磷酸蛋白样材料的水凝胶,再将含有磷酸蛋白样材料的水凝胶于矿化液中矿化,得到含有磷酸蛋白样材料的矿化水凝胶;所述磷酸蛋白样材料与活化生物大分子材料的重量比为(1~10):(1~4)。通过这种方法制备的含有磷酸蛋白样材料的矿化水凝胶的,在矿化过程中,磷酸蛋白样材料的po43-基团作为核化位点,使得形成的ca等金属离子和磷酸根离子团簇与凝胶基质分子发生键合而显著提高材料的力学性能,得到均匀矿化的高强度水凝胶。
上述含有磷酸蛋白样材料的矿化水凝胶的制备方法,包括以下步骤:
(b1)制备活化生物大分子材料
在0~10℃、搅拌条件下,将医用生物大分子材料与活化试剂在ph为7.5~8.5的水相体系中反应2~72h,反应产物经透析、真空干燥得到活化生物大分子材料;所述医用生物大分子材料与活化试剂的重量比为100:(3~1000);
(b2)制备活化磷酸酶
在0~10℃、搅拌条件下,将磷酸酶与活化试剂在ph为7.5~8.5的水相体系中反应2~24h,反应产物经透析、真空干燥得到活化磷酸酶;所述磷酸酶与活化试剂的重量比为100:(1~20);
(b3)制备含有磷酸蛋白样材料的水凝胶
将活化生物大分子材料、活化磷酸酶、磷酸蛋白样材料和光引发剂在ph为7~7.5的水相体系中混合均匀形成反应体系,于光照射条件下反应至该反应体系呈凝胶状得到含有磷酸蛋白样材料的水凝胶;所述活化生物大分子材料、活化磷酸酶、磷酸蛋白样材料和光引发剂的重量比为(5~20):(1~10):(5~50):(1~10);
或者将活化生物大分子材料、活化磷酸酶、磷酸蛋白样材料和自由基引发剂在ph为7~7.5的水相体系中混合均匀形成反应体系,静置反应至该反应体系呈凝胶状得到水凝胶;所述活化生物大分子材料、活化磷酸酶、磷酸蛋白样材料和自由基引发剂的重量比为(5~20):(1~10):(5~50):(1~45);
(b4)含有磷酸蛋白样材料的矿化水凝胶
将含有磷酸蛋白样材料的水凝胶于矿物质质量浓度为0.05~5%的矿化液中矿化4h~14d形成矿化水凝胶,然后从矿化液中取出含有磷酸蛋白样材料的矿化水凝胶;所述含有磷酸蛋白样材料的水凝胶与矿化液的体积比为1:(10~1000)。
上述含有磷酸蛋白样材料的矿化水凝胶的制备方法,正如前面描述中提到的活化生物大分子材料、活化磷酸酶等的添加方式一样,可以直接采用磷酸蛋白样材料,也可以采用含有磷酸蛋白样材料的水相分散液,不管采用哪种添加方式,只要满足磷酸蛋白样材料在形成的反应体系中的终浓度约为0.5~10%(w/w)即可。
上述含有磷酸蛋白样材料的矿化水凝胶的制备方法,所述磷酸蛋白样材料为乙烯基磷酸或丙烯基磷酸等。
本发明进一步提供了一种简单高效的细胞装载的仿生矿化骨支架材料,可模拟骨组织中磷酸钙逐渐沉积、基质逐渐硬化的生理矿化过程,同时矿化过程有助于诱导细胞成骨分化,从而利于骨缺损修复。该仿生矿化骨修复材料的制备方法包括以下步骤:
(c1)制备活化生物大分子材料
在0~10℃、搅拌条件下,将医用生物大分子材料与活化试剂在ph为7.5~8.5的水相体系中反应2~72h,反应产物经透析、真空干燥得到活化生物大分子材料;所述医用生物大分子材料与活化试剂的重量比为100:(3~1000);
(c2)制备活化磷酸酶
在0~10℃、搅拌条件下,将磷酸酶与活化试剂在ph为7.5~8.5的水相体系中反应2~24h,反应产物经透析、真空干燥得到活化磷酸酶;所述磷酸酶与活化试剂的重量比为100:(1~20);
(c3)制备细胞装载的生物大分子材料支架材料
将活化生物大分子材料、活化磷酸酶、磷酸蛋白样材料和光引发剂在ph为7~7.5的水相体系中混合均匀得到混合液,该混合液与含有细胞(5×107~2×108个/ml)的培养基按照体积比10:1的比例混合均匀形成反应体系,于光照射条件下反应至该反应体系呈凝胶状,得到细胞装载的生物大分子材料支架材料;所述活化生物大分子材料、活化磷酸酶、磷酸蛋白样材料和光引发剂的重量比为(5~20):(1~10):(5~50):(1~10);
或者将活化生物大分子材料、活化磷酸酶和光引发剂在ph为7~7.5的水相体系中混合均匀得到混合液,该混合液与含有细胞(5×107~2×108个/ml)的培养基按照体积比10:1的比例混合均匀形成反应体系,于光照射条件下反应至该反应体系呈凝胶状,得到细胞装载的生物大分子材料支架材料;所述活化生物大分子材料、活化磷酸酶和光引发剂的重量比为(5~20):(1~10):(1~10);
(c4)制备仿生矿化骨修复材料
将细胞装载的生物大分子材料支架材料于矿物质质量浓度为0.05~5%的矿化液中矿化4h~14d形成仿生矿化骨修复材料,然后从矿化液中取出仿生矿化骨修复材料;所述细胞装载的生物大分子材料支架材料与矿化液的体积比为1:(10~1000)。
上述仿生矿化骨修复材料的制备方法,与前面给出的矿化水凝胶的制备过程大致相同,其主要不同在于步骤(c3),通过在反应体系中添加细胞获得了细胞装载的生物大分子材料支架材料的制备,进一步将细胞装载的生物大分子材料支架材料进行矿化,模拟细胞参与的生理矿化过程,便得到了细胞装载的仿生矿化骨修复材料。作为组织工程材料,细胞包裹及随后细胞活性维持非常重要。作为组织工程材料,细胞包裹及随后细胞活性维持非常重要。该细胞装载的仿生矿化骨修复材料,具有良好的生物相容性,同时可以模拟细胞参与的天然骨组织生理硬化过程及基质硬化过程对间充质干细胞或成骨细胞行为调控的影响。
本发明进一步提供了一种可以实现个性化订制仿生矿化骨修复材料的生物墨水,将生物墨水注入3d打印机中,可打印出满足个性化订制需求的仿生矿化骨修复材料。该仿生矿化骨修复材料的制备方法包括以下步骤:
(d1)制备活化生物大分子材料
在0~10℃、搅拌条件下,将医用生物大分子材料与活化试剂在ph为7.5~8.5的水相体系中反应2~72h,反应产物经透析、真空干燥得到活化生物大分子材料;所述医用生物大分子材料与活化试剂的重量比为100:(3~1000);
(d2)制备活化磷酸酶
在0~10℃、搅拌条件下,将磷酸酶与活化试剂在ph为7.5~8.5的水相体系中反应2~24h,反应产物经透析、真空干燥得到活化磷酸酶;所述磷酸酶于具有活化的试剂的重量比为100:(1~20);
(d3)制备水凝胶支架材料
将活化生物大分子材料、活化磷酸酶、磷酸蛋白样材料和光引发剂在ph为7~7.5的水相体系中混合均匀得到混合液,该混合液与含有细胞(5×107~2×108个/ml)的培养基按照体积比10:1的比例混合均匀形成生物墨水,将所述生物墨水装入具有光控的3d打印机中,用3d打印机在光照射条件下打印出满足设定要求的水凝胶支架材料;所述活化生物大分子材料、活化磷酸酶、磷酸蛋白样材料和光引发剂的重量比为(5~20):(1~10):(5~50):(1~10);
或者将活化生物大分子材料、活化磷酸酶和光引发剂在ph为7~7.5的水相体系中混合均匀得到混合液,该混合液与含有细胞(5×107~2×108个/ml)的培养基按照体积比10:1的比例混合均匀形成生物墨水,将所述生物墨水装入具有光控的3d打印机中,用3d打印机在光照射条件下打印出满足设定要求的水凝胶支架材料;所述活化生物大分子材料、活化磷酸酶和光引发剂的重量比为(5~20):(1~10):(1~10);
(d4)制备仿生矿化骨修复材料
将水凝胶支架材料于矿物质质量浓度为0.05~5%的矿化液中矿化4h~14d形成仿生矿化骨修复材料,然后从矿化液中取出仿生矿化骨修复材料;所述水凝胶支架材料与矿化液的体积比为1:(10~1000)。
上述仿生矿化骨修复材料的制备方法与前面给出的细胞装载的仿生矿化骨修复材料制备方法大致相同,主要不同在于采用了3d打印机。当采用具有光控的3d打印机时,需要确保打印过程中施加于生物墨水的光照射条件满足要求,本发明中采用的光照射条件为:光波长为320~500nm的紫外可见光,功率为5~8w/cm2,照射时间为20~120s。
上述两种仿生矿化骨修复材料的制备方法中所述细胞可以为间充质干细胞或成骨细胞。
与现有技术相比,本发明具有以下有益效果:
1、本发明提供的矿化水凝胶及其制备方法,以光活化生物大分子材料和光活化磷酸酶为原料,通过光照射引发交联或通过自由基引发剂引发聚合交联形成水凝胶,水凝胶在矿化液中,磷酸酶能够促使磷酸盐在凝胶中均匀沉积,即得到均匀矿化的矿化水凝胶;所得矿化水凝胶,具有良好的生物相容性、光交联成胶性和酶促矿化活性,水凝胶可以在矿化液中酶促矿化模拟基质逐渐硬化的天然骨形成过程,成胶和矿化过程生物相容性良好,可以实现细胞的原位包裹和细胞相容的3d打印,从而显示出良好的骨组织工程的应用前景。
2、本发明提供的含有磷酸蛋白样材料的矿化水凝胶及其制备方法,在水凝胶制备过程中加入磷酸蛋白样材料,该磷酸蛋白样材料能够促使磷酸盐沿生物大分子材料的分子网络均匀沉积,进一步提高矿化水凝胶的强度。
3、本发明提供的仿生矿化骨修复材料及其制备方法,在水凝胶制备过程中加入细胞,可实现细胞的原位装载,能够模拟骨生理矿化过程中的酶促使磷酸盐沉积的矿化过程,从而得到具有高强度的仿生矿化骨修复材料;此外,该制备方法不需加热、无需强酸强碱,操作简单,成本低廉,可实现批量化生产,适于在生物医药领域推广使用。
4、本发明提供的另外一种仿生矿化骨修复材料及其制备方法,采用3d打印机可以得到个性化订制的仿生矿化骨修复材料,不仅能够实现细胞的原位装载,模拟骨生理矿化过程中的酶促使磷酸盐沉积的矿化过程,且其矿化性能及力学性能可调,实现个性化订制,在骨组织工程领域具有广阔的应用前景。
附图说明
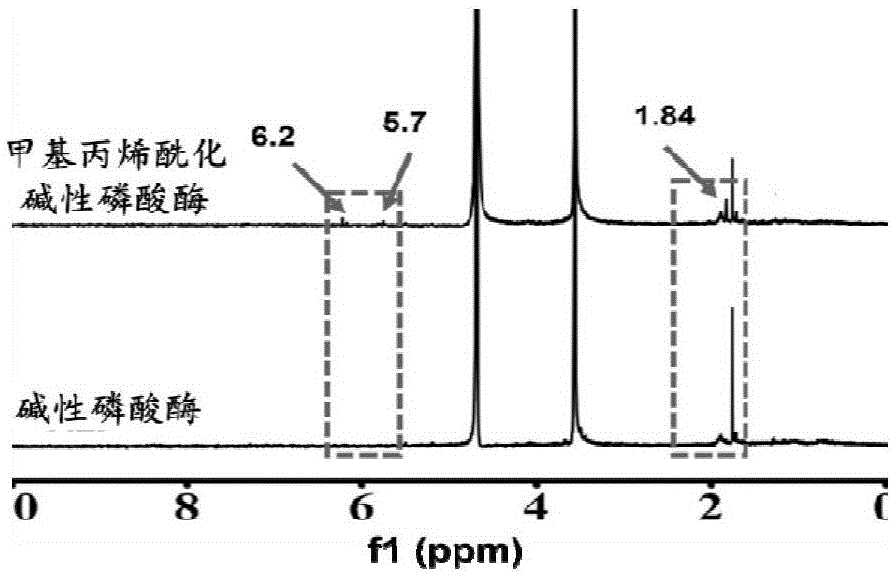
图1为本发明实施例2制备的甲基丙烯酰化碱性磷酸酶的核磁氢图谱,其中以碱性磷酸酶的核磁氢图谱为参考。
图2为本发明实施例2制备的甲基丙烯酰化碱性磷酸酶的酶活性测试结果,其中以碱性磷酸酶的酶活性为参考。
图3为本发明实施例2制备的水凝胶矿化前后力学性能测试结果。
图4为本发明实施例2制备的水凝胶矿化前后红外图谱。
图5为本发明实施例2制备的矿化水凝胶sem图谱。
图6为本发明实施例10制备的3d打印水凝胶矿化前后激光共聚焦图谱,其中(a)表示3d打印水凝胶矿化前激光共聚焦图谱,(b)表示3d打印水凝胶矿化后激光共聚焦图谱。
具体实施方式
以下将结合附图对本发明各实施例的技术方案进行清楚、完整的描述,显然,所描述实施例仅仅是本发明的一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动的前提下所得到的所有其它实施例,都属于本发明所保护的范围。
以下实施例中除特殊说明外,所用原料份数均为重量份数。
实施例1矿化胶原蛋白水凝胶
本实施例制备矿化胶原蛋白水凝胶的步骤如下:
(a1)制备甲基丙烯酰化胶原蛋白(col-ma)
将医用胶原蛋白的pbs分散液(ph为7.5)与甲基丙烯酸酐混合形成的反应体系在0℃、搅拌条件下反应4h,所得产物于去离子水中透析3天后经真空干燥得到甲基丙烯酰化胶原蛋白;100份反应体系中医用胶原蛋白终浓度为0.1%;甲基丙烯酸酐终浓度为0.003%。
(a2)制备甲基丙烯酰化碱性磷酸酶(alp-ma)
将碱性磷酸酶的pbs分散液(ph为7.5)与甲基丙烯酸酐混合形成的反应体系在0℃、搅拌条件下反应24h,所得产物于去离子水中透析3天后经真空干燥得到甲基丙烯酰化碱性磷酸酶;100份反应体系中碱性磷酸酶终浓度为0.1%(w/w),甲基丙烯酸酐终浓度为0.001%(w/w)。
(a3)制备胶原蛋白基水凝胶(ca凝胶)
利用去离子水分别配制甲基丙烯酰化胶原蛋白和甲基丙烯酰化碱性磷酸酶的去离子水分散液;将甲基丙烯酰化胶原蛋白的去离子水分散液、甲基丙烯酰化碱性磷酸酶的去离子水分散液和i2959的去离子水溶液混合均匀形成的反应体系置于uv光(320~400nm,5w/cm2)照射条件下反应20s得到胶原蛋白基水凝胶(ca凝胶);100份反应体系中甲基丙烯酰化胶原蛋白的终浓度为0.7%(w/w),甲基丙烯酰化碱性磷酸酶的终浓度为0.1%(w/w),i2959的终浓度为0.05%(w/w)。
(a4)制备矿化的胶原蛋白基水凝胶
将1体积份胶原蛋白基水凝胶加入到10体积份矿化液(0.07%(w/w)甘油磷酸和0.03%(w/w)的氯化钙的混合水溶液组成)中矿化7d得到均匀矿化的胶原基水凝胶,然后从矿化液中取出。
实施例2矿化胶原蛋白水凝胶
本实施例制备矿化胶原蛋白水凝胶的步骤如下:
(b1)制备甲基丙烯酰化胶原蛋白(col-ma)
将医用胶原蛋白的pbs分散液(ph为7.5)与甲基丙烯酸酐混合形成的反应体系在4℃、搅拌条件下反应2h,所得产物于去离子水中透析5天后经真空干燥得到甲基丙烯酰化胶原蛋白;100份反应体系中医用胶原蛋白终浓度为0.1%;甲基丙烯酸酐终浓度为0.01%。
(b2)制备甲基丙烯酰化碱性磷酸酶(alp-ma)
将碱性磷酸酶的pbs分散液(ph为7.5)与甲基丙烯酸酐混合形成的反应体系在4℃、搅拌条件下反应4h,所得产物于去离子水中透析4天后经真空干燥得到甲基丙烯酰化碱性磷酸酶;100份反应体系中碱性磷酸酶终浓度为0.1%(w/w),甲基丙烯酸酐终浓度为0.01%(w/w)。
(b3)制备含有乙烯基磷酸的胶原蛋白基水凝胶(cav凝胶)
利用去离子水分别配制甲基丙烯酰化胶原蛋白和甲基丙烯酰化碱性磷酸酶的去离子水分散液;将甲基丙烯酰化胶原蛋白的去离子水分散液、甲基丙烯酰化碱性磷酸酶的去离子水分散液、乙烯基磷酸的去离子水分散液和i2959的去离子水溶液混合均匀形成的反应体系置于uv光(365nm,8w/cm2)照射条件下反应20s得到含有乙烯基磷酸的胶原蛋白基水凝胶(cav凝胶);100份反应体系中甲基丙烯酰化胶原蛋白的终浓度为0.7%(w/w),甲基丙烯酰化碱性磷酸酶的终浓度为0.5%(w/w),乙烯基磷酸的终浓度为1%,i2959的终浓度为0.05%(w/w)。
(b4)制备矿化胶原蛋白基水凝胶
将1体积份胶原蛋白基水凝胶加入到1000体积份矿化液(1%(w/w)甘油磷酸钙的水溶液)中矿化1d得到均匀矿化胶原蛋白基水凝胶,然后从矿化液中取出。
实施例3矿化明胶水凝胶
本实施例制备矿化明胶水凝胶的步骤如下:
(b1)制备丙烯酰化明胶
将医用明胶的醋酸钠缓冲液分散液(ph为8.0)与丙烯酸酐混合形成的反应体系在5℃、搅拌条件下反应12h,所得产物于去离子水中透析7天后经真空干燥得到丙烯酰化明胶;100份反应体系中医用明胶终浓度为2%;丙烯酸酐终浓度为2%。
(b2)制备甲基丙烯酰化碱性磷酸酶
将碱性磷酸酶的醋酸钠缓冲液分散液(ph为8.0)与甲基丙烯酸酐混合形成的反应体系在5℃、搅拌条件下反应2h,所得产物于去离子水中透析5天后经真空干燥得到甲基丙烯酰化碱性磷酸酶;100份反应体系中碱性磷酸酶终浓度为10%(w/w),甲基丙烯酸酐终浓度为2%(w/w)。
(b3)制备明胶基水凝胶
利用生理盐水(ph为7.5)分别配制丙烯酰化明胶和甲基丙烯酰化碱性磷酸酶的生理盐水分散液;将丙烯酰化明胶的生理盐水分散液、甲基丙烯酰化碱性磷酸酶的生理盐水分散液、乙烯基磷酸的生理盐水分散液和i2959的生理盐水溶液混合均匀形成的反应体系置于uv光(320~500nm,6w/cm2)照射条件下反应120s得到含有乙烯基磷酸的明胶基水凝胶;100份反应体系中丙烯酰化明胶的终浓度为6%(w/w),甲基丙烯酰化碱性磷酸酶的终浓度为1%(w/w),乙烯基磷酸的终浓度为2%,i2959的终浓度为0.5%(w/w)。
(b4)制备矿化胶原基水凝胶
将1体积份胶原基水凝胶加入到100体积份矿化液(0.5%(w/w)甘油磷酸钙的水溶液)中矿化1d得到均匀矿化明胶基水凝胶,然后从矿化液中取出。
实施例4矿化胶原蛋白水凝胶
本实施例制备矿化胶原蛋白水凝胶的步骤如下:
(b1)制备丙烯酰化胶原蛋白
将医用胶原蛋白的tris-hcl分散液(ph为8.5)与丙烯酸酐混合形成的反应体系在10℃、搅拌条件下反应12h,所得产物于去离子水中透析3天后经真空干燥得到甲基丙烯酰化胶原蛋白;100份反应体系中医用胶原蛋白终浓度为0.2%;丙烯酸酐终浓度为0.2%。
(b2)制备甲基丙烯酰化碱性磷酸酶
将碱性磷酸酶的tris-hcl分散液(ph为8.5)与甲基丙烯酸酐的tris-hcl溶液(ph为8.5)混合形成的反应体系在10℃、搅拌条件下反应12h,所得产物于去离子水中透析3天后经真空干燥得到甲基丙烯酰化碱性磷酸酶;100份反应体系中碱性磷酸酶终浓度为20%(w/w),甲基丙烯酸酐终浓度为2%(w/w)。
(b3)制备胶原蛋白基水凝胶
利用去离子水分别配制丙烯酰化胶原蛋白pbs分散液和甲基丙烯酰化碱性磷酸酶的去离子水分散液;将甲基丙烯酰化胶原蛋白的pbs分散液、甲基丙烯酰化碱性磷酸酶的去离子水分散液、乙烯基磷酸的生理盐水分散液和aps/temed(由过硫酸铵和四甲基乙二胺按照重量比2:1组成)的去离子水溶液混合均匀形成的反应体系静置反应60min得到胶原蛋白基水凝胶;100份反应体系中甲基丙烯酰化胶原蛋白的终浓度为1%(w/w),甲基丙烯酰化碱性磷酸酶的终浓度为1%(w/w),乙烯基磷酸的终浓度为5%,aps/temed的终浓度为0.1%(w/w)。
(b4)制备矿化的胶原蛋白基水凝胶
将1体积份胶原蛋白基水凝胶加入到100体积份矿化液(1%(w/w)甘油磷酸钙的水溶液)中矿化3d得到均匀矿化胶原蛋白基水凝胶,然后从矿化液中取出。
实施例5矿化海藻酸钠/胶原蛋白水凝胶
本实施例制备矿化海藻酸钠/胶原蛋白水凝胶的步骤如下:
(b1)制备丙烯酰化海藻酸钠
将海藻酸钠的pbs分散液(ph为7.5)与丙烯酸酐混合形成的反应体系在5℃、搅拌条件下反应72h,所得产物于去离子水中透析5天后经真空干燥得到丙烯酰化海藻酸钠;100份反应体系中海藻酸钠终浓度为1%;丙烯酸酐终浓度为10%。
制备丙烯酰化胶原蛋白
将医用胶原蛋白的pbs分散液(ph为7.5)与丙烯酸酐混合形成的反应体系在5℃、搅拌条件下反应8h,所得产物于去离子水中透析4天后经真空干燥得到丙烯酰化胶原蛋白;100份反应体系中医用胶原蛋白终浓度为0.3%;丙烯酸酐终浓度为0.5%。
(b2)制备甲基丙烯酰化碱性磷酸酶
将碱性磷酸酶的pbs分散液(ph为7.5)与甲基丙烯酸酐混合形成的反应体系在5℃、搅拌条件下反应6h,所得产物于去离子水中透析3天后经真空干燥得到甲基丙烯酰化碱性磷酸酶;100份反应体系中碱性磷酸酶终浓度为3%(w/w),甲基丙烯酸酐终浓度为0.5%(w/w)。
(b3)制备海藻酸钠/胶原蛋白基水凝胶
利用去离子水分别配制丙烯酰化海藻酸钠、丙烯酰化胶原蛋白和甲基丙烯酰化碱性磷酸酶的去离子水分散液;将丙烯酰化海藻酸钠的去离子水分散液、丙烯酰化胶原蛋白的去离子水分散液、甲基丙烯酰化碱性磷酸酶的去离子水分散液、丙烯基磷酸的去离子水分散液和lap的去离子水溶液混合均匀形成的反应体系置于uv光(320~400nm,8w/cm2)照射条件下反应120s得到海藻酸钠/胶原蛋白基水凝胶;100份反应体系中丙烯酰化海藻酸钠的终浓度为2%、丙烯酰化胶原蛋白的终浓度为0.2%(w/w),甲基丙烯酰化碱性磷酸酶的终浓度为2%(w/w),丙烯基磷酸的终浓度为5%,lap的终浓度为1%(w/w)。
(b4)制备矿化海藻酸钠/胶原蛋白基水凝胶
将1体积份海藻酸钠/胶原蛋白基水凝胶加入到1000体积份矿化液(0.05%(w/w)甘油磷酸钙的水溶液)中矿化14d得到均匀矿化的海藻酸钠/胶原基水凝胶,然后从矿化液中取出。
实施例6矿化海藻酸钠/胶原蛋白水凝胶
本实施例制备矿化海藻酸钠/胶原蛋白水凝胶的步骤如下:
(b1)制备丙烯酰化海藻酸钠
将海藻酸钠的pbs分散液(ph为7.5)与丙烯酸酐混合形成的反应体系在5℃、搅拌条件下反应48h,所得产物于去离子水中透析6天后经真空干燥得到丙烯酰化海藻酸钠;100份反应体系中海藻酸钠终浓度为1%;丙烯酸酐终浓度为5%。
制备丙烯酰化胶原
将医用胶原蛋白的pbs分散液(ph为7.5)与丙烯酸酐混合形成的反应体系在5℃、搅拌条件下反应6h,所得产物于去离子水中透析4天后经真空干燥得到丙烯酰化胶原蛋白;100份反应体系中医用胶原蛋白终浓度为1%;丙烯酸酐终浓度为0.2%。
(b2)制备甲基丙烯酰化碱性磷酸酶
将碱性磷酸酶的pbs分散液(ph7.5)与甲基丙烯酸酐混合形成的反应体系在5℃、搅拌条件下反应6h,所得产物于去离子水中透析3天后经真空干燥得到甲基丙烯酰化碱性磷酸酶;100份反应体系中碱性磷酸酶终浓度为5%(w/w),甲基丙烯酸酐终浓度为0.2%(w/w)。
(b3)制备海藻酸钠/胶原蛋白基水凝胶
利用生理盐水分别配制丙烯酰化海藻酸钠、丙烯酰化胶原蛋白和甲基丙烯酰化碱性磷酸酶的生理盐水(ph为7.5)分散液;将丙烯酰化海藻酸钠的生理盐水分散液、丙烯酰化胶原蛋白的生理盐水分散液、甲基丙烯酰化碱性磷酸酶的生理盐水分散液、丙烯基磷酸的生理盐水分散液和aps/temed(由过硫酸铵和四甲基乙二胺按照重量比1:1组成)的生理盐水溶液混合均匀形成的反应体系静置反应10min得到海藻酸钠/胶原蛋白基水凝胶;100份反应体系中丙烯酰化海藻酸钠的终浓度为3%、丙烯酰化胶原蛋白的终浓度为1%(w/w),甲基丙烯酰化碱性磷酸酶的终浓度为2%(w/w),丙烯基磷酸的终浓度为10%,aps/temed的终浓度为2%(w/w)。
(b4)制备矿化海藻酸钠/胶原蛋白基水凝胶
将1体积份海藻酸钠/胶原蛋白基水凝胶加入到1000体积份矿化液(0.05%(w/w)甘油磷酸镁的水溶液)中矿化14d得到均匀矿化的海藻酸钠/胶原蛋白基水凝胶,然后从矿化液中取出。
实施例7矿化透明质酸/葡萄糖水凝胶
本实施例制备矿化透明质酸/葡聚糖水凝胶的步骤如下:
(b1)制备甲基丙烯酰化透明质酸
将透明质酸的pbs分散液(ph为7.5)与甲基丙烯酸酐混合形成的反应体系在5℃、搅拌条件下反应60h,所得产物于去离子水中透析7天后经真空干燥得到甲基丙烯酰化透明质酸;100份反应体系中透明质酸终浓度为1%;甲基丙烯酸酐终浓度为10%。
制备丙烯酰化葡聚糖
将葡聚糖的pbs分散液(ph为7.5)与丙烯酸酐混合形成的反应体系在5℃、搅拌条件下反应36h,所得产物于去离子水中透析5天后经真空干燥得到丙烯酰化葡萄糖;100份反应体系中葡聚糖终浓度为1%(w/w),丙烯酸酐终浓度为5%(w/w)。
(b2)制备甲基丙烯酰化酸性磷酸酶
将酸性磷酸酶的pbs分散液(ph为7.5)与甲基丙烯酸酐混合形成的反应体系在5℃、搅拌条件下反应6h,所得产物于去离子水中透析3天后经真空干燥得到甲基丙烯酰化碱性磷酸酶;100份反应体系中酸性磷酸酶终浓度为2%(w/w),甲基丙烯酸酐终浓度为0.2%(w/w)。
(b3)制备透明质酸/葡聚糖水凝胶
利用生理盐水(ph为7.5)分别配制甲基丙烯酰化透明质酸、丙烯酰化葡聚糖和甲基丙烯酰化酸性磷酸酶的生理盐水水分散液;将甲基丙烯酰化透明质酸的生理盐水分散液、丙烯酰化葡聚糖的生理盐水分散液、甲基丙烯酰化酸性磷酸酶的生理盐水分散液、丙烯基磷酸的生理盐水分散液和aps/temed(由过硫酸铵和四甲基乙二胺按照重量比4:1组成)的生理盐水溶液混合均匀形成的反应体系静置反应30min,得到透明质酸/葡聚糖水凝胶;100份反应体系中甲基丙烯酰化透明质酸的终浓度为1.5%(w/w),丙烯酰化葡聚糖的终浓度为10%(w/w),甲基丙烯酰化酸性磷酸酶的终浓度为1%(w/w),丙烯基磷酸的终浓度为5%,aps/temed的终浓度为1%(w/w)。
(b4)制备矿化透明质酸/葡聚糖水凝胶
将1体积份透明质酸/葡聚糖水凝胶加入到1000体积份矿化液(由3.5%(w/w)甘油磷酸、1.2%的(w/w)氯化铁和0.3%(w/w)氯化钙的水溶液,组成分别为3.5%甘油磷酸,1.2%氯化钙,0.3%氯化铁)中矿化14d得到均匀矿化的矿化透明质酸/葡聚糖水凝胶,然后从矿化液中取出。
实施例8仿生矿化骨修复材料
本实施例制备仿生矿化骨修复材料的步骤如下:
(c1)制备甲基丙烯酰化胶原蛋白
将医用胶原蛋白的pbs分散液(ph为7.5)与甲基丙烯酸酐混合形成的反应体系在5℃、搅拌条件下反应4h,所得产物于去离子水中透析5天后经真空干燥得到甲基丙烯酰化胶原蛋白;100份反应体系中医用胶原蛋白终浓度为0.2%;甲基丙烯酸酐终浓度为0.02%。
(c2)制备甲基丙烯酰化碱性磷酸酶
将碱性磷酸酶的pbs分散液(ph为7.5)与甲基丙烯酸酐混合形成的反应体系在5℃、搅拌条件下反应6h,所得产物于去离子水中透析5天后经真空干燥得到甲基丙烯酰化碱性磷酸酶;100份反应体系中碱性磷酸酶终浓度为1%(w/w),甲基丙烯酸酐终浓度为0.05%(w/w)。
(c3)制备细胞装载的生物大分子材料支架材料
利用去离子水分别配制甲基丙烯酰化胶原蛋白和甲基丙烯酰化碱性磷酸酶的去离子水分散液;将甲基丙烯酰化胶原蛋白的去离子水分散液、甲基丙烯酰化碱性磷酸酶的去离子水分散液和i2959的去离子水溶液混合均匀形成混合液;该混合液与含有间充质干细胞(5×107~2×108个/ml)的α-mem培养基按照体积比10:1的比例混合均匀形成的反应体系置于uv光(320~500nm,8w/cm2)照射条件下反应30s,发生分子间交联成胶,得到细胞装载的生物大分子材料支架材料;100份反应体系中甲基丙烯酰化胶原蛋白的终浓度为2%(w/w),甲基丙烯酰化碱性磷酸酶的终浓度为1%(w/w),i2959的终浓度为0.2%(w/w)。
(c4)制备仿生矿化骨修复材料
将1体积份细胞装载的生物大分子材料支架材料加入到100体积份矿化液(1%(w/w)甘油磷酸钙的培养基(胎牛血清质量浓度为10%的α-mem培养基))中矿化4h得到均匀矿化的仿生矿化骨修复材料,然后从矿化液中取出。
实施例9仿生矿化骨修复材料
本实施例制备仿生矿化骨修复材料的步骤如下:
(c1)制备甲基丙烯酰化丝素
将医用丝素的pbs分散液(ph为7.5)与甲基丙烯酸缩水甘油酯混合形成的反应体系在5℃、搅拌条件下反应12h,所得产物于去离子水中透析5天后经真空干燥得到甲基丙烯酰化丝素;100份反应体系中医用丝素终浓度为1%;甲基丙烯酸缩水甘油酯终浓度为2%。
(c2)制备甲基丙烯酰化碱性磷酸酶
将碱性磷酸酶的pbs分散液(ph为7.5)与甲基丙烯酸酐混合形成的反应体系在5℃、搅拌条件下反应6h,所得产物于去离子水中透析5天后经真空干燥得到甲基丙烯酰化碱性磷酸酶;100份反应体系中碱性磷酸酶终浓度为1%(w/w),甲基丙烯酸酐终浓度为0.05%(w/w)。
(c3)制备细胞装载的生物大分子材料支架材料
利用生理盐水(ph为7.5)分别配制甲基丙烯酰化丝素和甲基丙烯酰化碱性磷酸酶的生理盐水分散液;将甲基丙烯酰化丝素的生理盐水分散液、甲基丙烯酰化碱性磷酸酶的生理盐水分散液和tpo的生理盐水溶液混合均匀形成混合液;该混合液与含有间充质干细胞(5×107~2×108个/ml)的的培养基按照按照体积比10:1的比例混合均匀形成的反应体系置于uv光(420nm,5w/cm2)照射条件下反应120s,发生分子间交联成胶,得到细胞装载的生物大分子材料支架材料;100份反应体系中甲基丙烯酰化丝素的终浓度为15%(w/w),甲基丙烯酰化碱性磷酸酶的终浓度为1%(w/w),tpo的终浓度为1%(w/w)。
(c4)制备仿生矿化骨修复材料
将1体积份细胞装载的生物大分子材料支架材料加入到100体积份矿化液(含3.5%(w/w)的甘油磷酸和1.5%(w/w)的氯化钙的培养基(胎牛血清质量浓度为10%的α-mem培养基))中矿化2d得到均匀矿化的仿生矿化骨修复材料,然后从矿化液中取出。
实施例10仿生矿化骨修复材料
本实施例制备仿生矿化骨修复材料的步骤如下:
(d1)制备甲基丙烯酰化胶原
将医用胶原蛋白的pbs分散液(ph为7.5)与甲基丙烯酸酐混合形成的反应体系在5℃、搅拌条件下反应0.5h,所得产物于去离子水中透析7天后经真空干燥得到甲基丙烯酰化胶原蛋白;100份反应体系中医用胶原蛋白终浓度为0.2%;甲基丙烯酸酐终浓度为1%。
(d2)制备甲基丙烯酰化碱性磷酸酶
将碱性磷酸酶的pbs分散液(ph为7.5)与甲基丙烯酸酐混合形成的反应体系在5℃、搅拌条件下反应6h,所得产物于去离子水中透析7天后经真空干燥得到甲基丙烯酰化碱性磷酸酶;100份反应体系中碱性磷酸酶终浓度为5%(w/w),甲基丙烯酸酐终浓度为0.1%(w/w)。
(d3)制备水凝胶支架材料
将利用pbs分别配制甲基丙烯酰化胶原蛋白和甲基丙烯酰化碱性磷酸酶的水相分散液;将甲基丙烯酰化胶原蛋白的pbs分散液、甲基丙烯酰化碱性磷酸酶的pbs分散液、乙烯基磷酸和i2959的去离子水溶液混合均匀形成混合液;该混合液与含有间充质干细胞(5×107~2×108个/ml)的α-mem培养基按照体积比10:1的比例混合均匀形成生物墨水,将生物墨水装入3d打印机(杭州捷诺飞生物有限公司的bio-architect,喷嘴内径为450μm,流速为150μl/min,温度控制在4℃,并调节光照射条件为uv光(365nm,8w/cm2)),打印得到3d水凝胶支架材料;100份反应体系中甲基丙烯酰化胶原蛋白的终浓度为0.7%(w/w),甲基丙烯酰化碱性磷酸酶的终浓度为0.5%(w/w),乙烯基磷酸终浓度为1%(w/w),i2959的终浓度为0.05%(w/w)。
(d4)制备仿生矿化骨修复材料
将1体积水凝胶支架材料加入到40体积矿化液(0.1%(w/w)甘油磷酸钙的培养基(胎牛血清质量浓度为10%的α-mem培养基))中矿化4h得到均匀矿化的仿生矿化骨修复材料,然后从矿化液中取出。
对上述部分实施例制备的样品进行结构、性能表征如下:
对实施例2制备的甲基丙烯酰化碱性磷酸酶进行核磁氢谱分析,分析结果如图1所示,从图中可以看出,对碱性磷酸酶进行活化后得到的样品氢谱6.2、5.7、1.84ppm上出现了新的甲基丙烯基团峰,表明甲基丙烯基团已经成功接枝上,得到了甲基丙烯酰化碱性磷酸酶。
利用碱性磷酸酶活性检测试剂盒对实施例2制备的甲基丙烯酰化碱性磷酸酶的酶活性进行检测,测试结果如图2所示,虽然相比于碱性磷酸酶,甲基丙烯酰化碱性磷酸酶的酶活性有所降低,但是其仍表现出良好的酶活性,可有效促使生物大分子材料水凝胶矿化,得到矿化水凝胶。
采用动态力学分析(dma,ta-q800)对实施例2制备含有乙烯基磷酸的胶原基水凝胶(cav凝胶)在矿化液中矿化1d后的矿化水凝胶进行力学性能测试,测试结果如图3所示。从图中可以看出,矿化一天后,cav凝胶的弹性模量显著提高,表明碱性磷酸酶和乙烯基磷酸的加入可促使cav凝胶矿化,显著提高了凝胶的机械性能。
对实施例2制备含有乙烯基磷酸的胶原基水凝胶(cav凝胶)在矿化液中矿化1d后的矿化水凝胶进行红外测试,得到如图4所示的傅里叶变换红外图谱。从图中可以看出,出现了明显的磷酸根基团峰,表明水凝胶中沉积了大量磷酸钙矿物。
对实施例2制备含有乙烯基磷酸的胶原基水凝胶(cav凝胶)在矿化液中矿化1d后的矿化水凝胶进行sem分析,分析结果如图5所示。从图中可以看出,有大量磷酸钙沿着胶原分子网络沉积,这是由于乙烯基磷酸能够促使磷酸钙沿生物大分子材料的分子网络均匀沉积,从而进一步提高矿化水凝胶的机械强度。
按照实施例10给出的步骤制备水凝胶支架材料,并对制备的水凝胶支架材料矿化前和矿化后凝胶中装载的间充质干细胞进行pi/fda染色,进行激光共聚焦显微镜分析,得到如图6所示的激光共聚焦图谱。从图中可以看出,3d打印的水凝胶支架材料经矿化后4h后,细胞铺展良好,表明细胞在矿化凝胶中具有良好的生物活性。
- 还没有人留言评论。精彩留言会获得点赞!