一种肝素阿伦磷酸钠偶联物的合成方法及其药物与流程
本发明涉及医药领域,特别涉及一种肝素阿伦磷酸钠偶联物的合成方法。
背景技术:
癌症是威胁人体健康和生命的重要因素之一。据美国癌症学会2017癌症统计的年度报告,2017年,美国新增癌症病例1688780例,预计将有600920人死于癌症。虽然原发性骨肿瘤发生率较低,但由于骨特殊的环境,实体肿瘤容易转移到骨组织(尤其是前列腺癌、乳腺癌、肺癌和肾癌)。例如,在所有被诊断为乳腺癌的患者中,高达70%的患者将会发生骨转移。在那些转移性疾病仅限于骨骼的患者中,生活质量的下降和最终死亡几乎完全是由骨痛、高钙血症、病理性骨折和硬膜压迫等并发症引起的。
阿仑膦酸钠是一种双磷酸盐(bps),是目前防止骨质疏松症应用极为广泛的药物,能显著减轻疼痛,增加腰椎、股骨密度、减少骨折,而且阿仑膦酸钠对骨质疏松症具有明显的预防作用。阿仑膦酸钠也广泛运用于治疗恶性肿瘤诱发的高血钙症,还应用于治疗肿瘤诱发的骨病、骨损伤、骨痛,尤其是用于治疗多发性骨髓病及乳腺癌(samueld.vasikaran,“bisphosphonates:anoverviewwithspecialreferencetoalendronate”,ann.clin.biochem,2001,38,608-623)。
阿仑膦酸钠结构式
阿仑膦酸钠一般为口服用药,双磷酸盐类为水溶性药物,在人体内很难通过脂质膜。在人体内通过血液循环进入骨内毛细血管到达药物作用靶点的浓度低。为了使药物达到有效治疗浓度,需要大剂量服用,会产生胃部不适、胃炎或溃疡。
肝素是粘多糖硫酸酯类抗凝血药,是一种生物高分子,具有很好的生物相容性。一般是由猪或牛的肠黏膜中提取,可以用于治疗血栓栓塞疾病,尤其是深部静脉血栓、肺和系统栓塞症。也可以用于肿瘤病人的抗凝治疗、溶栓治疗、血管形成术后再狭窄的治疗等。
公开号为cn105085717a的专利说明书提供了一种肝素的双膦酸盐衍生物,通过酰胺键将阿仑膦酸钠与肝素结合在一起,提高了生物利用度,降低了其对正常细胞的毒副作用,与其相比,本专利制备了一种新的缩合剂,提高了催化效率,以及偶联物的产率,而且制备得到的产物对癌细胞的药效更强,靶向性更强,生物利用度更高。公开号为cn106821984a的专利说明书,制备了阿仑膦酸钠固体脂质纳米粒,此药物具有良好的缓控释作用,提高了阿仑膦酸钠生物利用度,并降低了阿仑膦酸钠的毒副作用。但由于这些现有技术存在制备成本高,工艺复杂,操作繁琐等问题,因而无法大规模生产。
技术实现要素:
本发明的目的是提供一种方法简单,对工艺要求低,可以大规模生产的肝素阿伦磷酸钠偶联物的合成方法,通过肝素修饰阿仑膦酸钠,增加药物的溶解性,提高生物利用度,减少药物对黏膜的刺激性,有效抑制了破骨细胞的生成,减小细胞毒性。
本发明的目的是这样实现的,一种肝素阿伦磷酸钠偶联物的合成方法,包括如下步骤:
步骤1:首先合成dmt-mm缩合剂:将2-氯-4,6-二甲氧基-1,3,5-三嗪溶于四氢呋喃中,并加入4-甲基吗啉,室温下搅拌1~2h,通过过滤收集并用thf洗涤沉淀五次,真空干燥48h后即得到dmt-mm缩合剂;
步骤2:将肝素和缩合剂加入超纯水中,搅拌1h,然后将阿仑膦酸钠溶液加入肝素与缩合剂的混合溶液中,反应24~48h后,将溶液倒入透析袋中透析48~72h,并且每4h换一次水,最后将透析得到的产物冻干,即得到肝素阿仑膦酸钠偶联药物;反应过程如下:
进一步地,步骤1中,所述dmt-mm缩合剂合成的方法:将8~12g的2-氯-4,6-二甲氧基-1,3,5-三嗪溶于100ml的四氢呋喃中,再加入4~6ml的4-甲基吗啉,室温下搅拌1~2h,通过过滤收集并用四氢呋喃溶剂洗涤沉淀五次,真空干燥48h后即得到dmt-mm缩合剂。
进一步地,步骤2中,所述肝素、dmt-mm缩合剂和阿仑膦酸钠的摩尔用量比为1:1.1~1.5:1~1.2。
进一步地,步骤2中,所述肝素、dmt-mm缩合剂和阿仑膦酸钠的摩尔用量比为1:1.2:1。
进一步地,所述肝素为低分子肝素、肝素钠或肝素钙。
进一步地,所述透析袋的分子量为300~1000。
进一步地,所述述透析袋的分子量为500~800。
本发明的合成方法首先合成dmt-mm缩合剂,再以缩合剂作为催化剂,以活化肝素中的羧基,然后再加入阿仑膦酸钠,使其与肝素更快更多的结合在一起,此方法提高了肝素与阿仑膦酸钠在水溶液中的合成效率,因此本发明的肝素阿仑膦酸钠合成工艺简单,合成效率高,便于大规模生产。
另外,本发明还提供一种采用上述方法合成的肝素阿伦磷酸钠偶联,作为用于治疗骨质疏松症、防治、阻止恶性肿瘤引起的溶骨性病变、高血钙症和减少骨吸收的药物。
本发明的合成方法制备的肝素阿仑膦酸钠的偶合物,通过肝素修饰阿仑膦酸钠,增加药物的溶解性,提高生物利用度,减少药物对黏膜的刺激性,有效抑制了破骨细胞的生成,减小细胞毒性有效抑制了破骨细胞的生成,并且不会影响活化部分凝血活酶时间,可以防止出血等副作用,同时提高了其生物利用度,保留了阿仑膦酸钠组分在体内抗再吸收和体外破骨细胞形成抑制的最重要能力,也就是说肝素可以作为阿仑膦酸钠的有效抗再吸收药物。可用于治疗骨质疏松症、防治、阻止恶性肿瘤引起的溶骨性病变、高血钙症和减少骨吸收的药物系统中。
附图说明
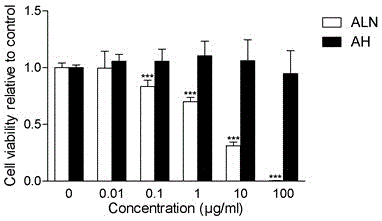
图1是实施例1制备的肝素阿仑膦酸钠耦合物与鼠巨噬细胞共培养后的cck8增殖测试图。
图2实施例1制备的肝素阿仑膦酸钠耦合物加上30ng/ml的m-csf和50ng/ml的rankl与鼠巨噬细胞共培养5天,然后用4%多聚甲醛固定并用抗酒石酸酸性磷酸酶染色(trap)的图片。
图3是实施例1制备的肝素阿仑膦酸钠耦合物与鼠巨噬细胞共培养后的破骨细胞面积与数量图。
图4是实施例2制备的肝素阿仑膦酸钠耦合物与鼠巨噬细胞用30ng/ml的m-csf和50ng/ml的rankl培养,同时在第0,2,或4天时加入40μg/ml的ah,在第5天时的trap染色图。
图5是实施例2制备的肝素阿仑膦酸钠耦合物计算trap阳性的多核细胞(核≥3)的面积图和数量图。
图6是实施例1制备的肝素阿仑膦酸钠耦合物用于治疗钛引起的骨缺损后的micro-ct以及组织形态切片图。
图7实施例3制备的肝素阿仑膦酸钠耦合物与部分活化凝血酶原时间(aptt)之间的关系图。
图8是实施例1制备的肝素阿仑膦酸钠耦合物用于治疗注射乳腺癌细胞后引起骨缺损的x光片图。
图9是实施例1的肝素阿仑膦酸钠耦合物用于治疗注射乳腺癌细胞后引起骨缺损的3dmicroct图。
图10是实施例2制备的肝素阿仑膦酸钠耦合物用于治疗注射乳腺癌细胞后引起骨缺损的骨变化图。
图11是实施例制备的的肝素阿仑膦酸钠耦合物用于治疗注射乳腺癌细胞后引起骨缺损的苏木精-伊红染色(h&e)图。
具体实施方式
实施例1:
本实施例首先通过如下过程合成肝素阿伦磷酸钠偶联物:
1)将23g2-氯-4,6-二甲氧基-1,3,5-三嗪(cdmt)溶于300ml四氢呋喃(thf)中;
2)将13.2ml的4-甲基吗啉(nmm)加入步骤1)中溶液,强烈搅拌1h;通过过滤收集固体并用thf洗涤固体5次,真空干燥48h即得到dmt-mm缩合剂;
3)将1g肝素,0.874g步骤2)制得的dmt-mm缩合剂溶于50ml超纯水中,搅拌1h;
4)将2g阿仑膦酸钠溶于100ml超纯水;
5)将阿仑膦酸钠溶液加入步骤3)中肝素与缩合剂的混合溶液中,反应24h,将溶液通过分子量为300的透析袋透析48h,并且每4h换一次水,过滤掉缩合剂以及过量的反应物,最后将得到的产物冻干,即得到肝素阿仑膦酸钠的偶联物ah。
实施例2
本实施例中合成肝素阿仑膦酸钠偶联物:
1)将40g2-氯-4,6-二甲氧基-1,3,5-三嗪(cdmt)溶于400ml四氢呋喃(thf)中;
2)将22ml的4-甲基吗啉(nmm)加入步骤1)中溶液,强烈搅拌1.5h;通过过滤收集固体并用thf洗涤固体5次,真空干燥48h即得到本实施例的dmt-mm缩合剂;
3)将1.5g肝素,1.4g步骤2)得到的dmt-mm缩合剂溶于50ml超纯水中,搅拌1.5h;
4)将3g阿仑膦酸钠溶于200ml超纯水;
5)将步骤4)中的阿仑膦酸钠溶液加入步骤3)中的肝素与dmt-mm缩合剂的混合溶液中,反应24~48h,将溶液通过分子量为800的透析袋透析60h,并且每4h换一次水,过滤掉缩合剂以及过量的反应物,最后将得到的产物冻干,即得到本实施例的肝素阿仑膦酸钠偶联物ah。
实施例3
本实施例中首先合成肝素阿仑膦酸钠偶联物
1)将55g2-氯-4,6-二甲氧基-1,3,5-三嗪(cdmt)溶于500ml四氢呋喃(thf)中;
2)将30ml的4-甲基吗啉(nmm)加入步骤1)中溶液,强烈搅拌2h;通过过滤收集固体并用thf洗涤固体5次,真空干燥48h即得到dmt-mm缩合剂;
3)将2g肝素,2g步骤2)中的dmt-mm缩合剂溶于50ml超纯水中,搅拌2h;
4)将5g阿仑膦酸钠溶于300ml超纯水;
5)将步骤4)中的阿仑膦酸钠溶液加入步骤3)中的肝素与缩合剂的混合溶液中,反应48h,将溶液通过分子量为1000的透析袋透析72h,并且每4h换一次水,过滤掉缩合剂以及过量的反应物,最后将得到的产物冻干,即得到本实施例的肝素阿仑膦酸钠偶联物ah。
如图1所示,为鼠的离体骨髓巨噬细胞(bmms)用30ng/ml的m-csf加上横作标所述的不同图示浓度的实施例1中的肝素阿仑膦酸钠(ah)和阿仑膦酸钠(aln)培养72小时.用cck-8细胞增值及细胞毒性检测试剂盒测定的细胞存活量(***p<0.001vscontrol).从图1中的细胞活性比较结果可以看出ah到100μg/ml也没有毒性,而aln从0.1μg/ml开始就有毒性,说明ah显著减小了aln的细胞毒性。
图2,为鼠的离体骨髓巨噬细胞(bmms)用实施例1中不同浓度的ah(0,2.5,10,40μg/ml)加上30ng/ml的m-csf和50ng/ml的rankl培养5天,然后用4%多聚甲醛固定并用trap染色。图3为计算trap阳性的多核细胞(核≥3)的数量和面积。从图2图3的结果显示随着ah浓度越高破骨细胞面积越少,且破骨细胞数量各组间无显著性差异,说明ah能抑制破骨细胞的生成。
图4为鼠的离体骨髓巨噬细胞(bmms)用30ng/ml的m-csf和50ng/ml的rankl培养,同时在第0,2,或4天时加入40μg/ml实施例2合成的ah。在第5天时进行trap染色。图5为图4染色图计算trap阳性的多核细胞(核≥3)的数量和面积且破骨细胞数量各组间无显著性差异,从图中可以看出,ah加入越早破骨细胞面积越少,说明ah能够有效抑制破骨细胞的生长。
图6为实施例1备的肝素阿仑膦酸钠耦合物用于治疗小鼠颅骨钛引起的骨缺损后的micro-ct以及组织形态切片图,从图中看出:a组小鼠颅骨的micro-ct3d重建图像:假手术组(sham),空白药物组(vehicle)和ah治疗组:低剂量low-75μg/kg;高剂量high-300μg/kg从中看出ah组可显著减少骨溶解。b组图离体小鼠颅骨的h&e切片。每组至少三个层面的切片,图中表明空白药物组炎性浸润和骨溶解最严重,而ah治疗组炎症和骨溶解显著减轻。c组图micro-ct数量分析:骨体积/组织体积(bv/tv)(*p<0.05;**p<0.01;***p<0.001vsvehicle).(d)组织形态学分析:骨面积/组织面积(ba/ta)从图中可以看出ah可以明显恢复骨量。
图7为施例3制备的肝素阿仑膦酸钠耦合物ah注入动物体内3h后取血观察其与部分活化凝血酶原时间(aptt)之间的关系图。从图中可以看出ah在实验中并不延长部分活化凝血酶原时间(aptt)。ah(30mg/kg)或依诺肝素(30mg/kg)对大鼠皮下给药。3小时后取血测量aptt。依诺肝素较空白对照组显著延长aptt约3倍。(***p<0.001vsvehicle),而相同剂量的ah几乎不延长aptt。
图8为实施例1合成的肝素阿仑膦酸钠耦合物ah用于治疗注射20000个乳腺癌细胞到小鼠体内引起的骨缺损,按每周每只注射给药1000ug/kg,治疗4周后的x光片图。其中图8a表示在用ah或空白组治疗4周结束时裸鼠后肢的x射线图像。图8b和图8c分别表示与对照组相比ah减少肿瘤诱导的骨溶解和裸鼠胫骨中的肿瘤负荷后,通过x射线照片的图像分析量化后肢的骨溶解病变图和肿瘤体积分数图(**p<0.01)。
从图8各图中可以看出用ah治疗后的肿瘤老鼠去骨质溶解以及肿瘤面积均小于空白药物组,表明ah对肿瘤具有显著的疗效。
图9是实施例1制备的肝素阿仑膦酸钠耦合物用于治疗注射20000个乳腺癌细胞到小鼠体内引起的骨缺损,按每周每只注射给药1000ug/kg,治疗4周后的3dmicroct图。其中图9d为给药后各组老鼠后肢的微ct图,图9e为给药后各组老鼠后肢骨头的骨体积分数图。从图9各图中可以看出,ah治疗后的肿瘤老鼠的新骨生成量远高于空白组,这说明ah能够促进新骨生成,同样,如图10所示,为实施例2制备的肝素阿仑膦酸钠耦合物用于治疗注射20000个乳腺癌细胞到小鼠体内引起的骨缺损,按每周每只注射给药1000ug/kg,治疗4周后的骨变化图。与图9的结果基本一致。
如图11为实施例2制备的肝素阿仑膦酸钠耦合物用于治疗注射20000个乳腺癌细胞到小鼠体内引起的骨缺损,按每周每只注射给药1000ug/kg,治疗4周后的苏木精-伊红染色(h&e)图。其中,图11i代表给药后各组老鼠后肢的h&e染色切片图,11j代表给药后各组老鼠后肢的肿瘤体积分数图。从图11中可以看出,h&e染色切片显示空白处理和ah处理的小鼠在胫骨近端具有显着的皮质和松质骨破坏。在用载体治疗的小鼠中,肿瘤填充整个骨髓空间并且远离皮质扩展,由于肿瘤的大尺寸并具有显著的缺氧坏死。相反,在用ah治疗的小鼠中观察到较小的肿瘤和较少的坏死(图11i)。与基于x射线图像的定量结果一致,组织形态学分析显示用ah处理的小鼠中肿瘤负荷减少,且差异无统计学意义(图11j)。这说明ah是一种有效的抗肿瘤药物。
- 还没有人留言评论。精彩留言会获得点赞!