基于壳聚糖的两亲性自组装纳米载体及其制备方法和应用与流程
本发明涉及一种壳聚糖改性的纳米材料,具体涉及一种基于壳聚糖的两亲性自组装纳米载体,属于生物材料制备领域。
背景技术:
壳聚糖是自然界中存在的唯一一种碱性多糖,1859年由法国人c.rouget发现,并被讨论为是几丁质的脱乙酰化形式。近几十年来,壳聚糖由于其优越的生物相容性、可降解性、抑菌性、粘膜粘附性、无毒环保等特性而被广泛应用于生物制药领域,但是壳聚糖不理想的溶解性又极大地限制了它的应用。对壳聚糖进行化学改性是人们开发壳聚糖应用前景的一种方式。壳聚糖上含有大量的氨基、羟基等活泼基团,可将各种侧链基团引入到大分子链上,以适应人们不同的需求。比如可以在c2位的氨基上引入长链烷基、酰基等疏水基,在c6位羟基上可以引入羧甲基、羟乙基等亲水基,还可引入不同的脂肪链。
通过疏水改性的壳聚糖,其在水中的溶解性改善有限,因而人们在壳聚糖疏水改性后再偶联亲水基团,这样制备出的两亲性壳聚糖水溶性更好,对疏水药物的载药量也更高,同时在亲疏水改性的同时我们可以选择具备一定功能的基团,使壳聚糖在与这些基团化学结合后成为具有靶向性、环境敏感性等特定功能的药物载体,为壳聚糖的应用提供了新的思路。师忠根将壳聚糖利用脱氧胆酸进行疏水改性得到壳聚糖-脱氧胆酸,再利用聚乙二醇修饰进行亲水改性,得到壳聚糖-脱氧胆酸-聚乙二醇,最后在两亲性聚合物主链上接枝靶向基团叶酸分子,通过超声透析结合法得到纳米粒,该纳米粒对阿霉素的载药量达到30.1%,包封率达62.7%。体外累积释放实验结果表明载药纳米粒具有一定缓释功能,细胞吞噬实验较好的证明了壳聚糖在改性后由于新增叶酸基团而具有的靶向功能,和由于新增聚乙二醇基团而具有的隐身性能(一定程度上避免被巨噬细胞吞噬)。
维生素e是琥珀酸酯(vitaminesuccinate,ves)是维生素e家族中抗肿瘤效果最好的化合物之一,具有良好的亲脂性。ves已被证明是对恶性细胞具有高度选择性,而对其正常细胞无毒害作用,ves对至少有50种癌细胞系显示出细胞凋亡,包括不同的起源(人类,小鼠,禽类)和组织类型(乳腺癌,前列腺癌,肺癌,胃癌,卵巢癌,单核细胞癌,结肠,间皮)。ves可以通过抑制肿瘤细胞增殖、诱导肿瘤细胞凋亡以及抑制肿瘤细胞转移来起到抗肿瘤的作用。
ves抑制肿瘤细胞增殖主要通过抑制dna合成、阻滞细胞周期、调节控制细胞周期的蛋白来实现。ves还对导致肿瘤细胞持续增殖的致癌基因ras具有抑制作用,这种ras下调效应在人类结肠癌(hct116)和人乳腺癌(mda-mb)细胞系中均有体现。ves也可以调节转录因子,如抑制转录因子nf-κb和增强这些因子的激活蛋白1(ap-1),进而抑制细胞增殖。
专利号cn201710777484.4,一种羧甲基壳聚糖衍生物及其制备方法和应用,合成了新材料o-羧甲基壳聚糖-维生素e琥珀酸酯(o-cmcts-ves),o-羧甲基壳聚糖的部分游离氨基上接枝了维生素e琥珀酸酯,二者通过形成酰胺键的方式结合在一起,ves取代度在3%~5%;其载药量为13.0%,包封率为74.5%;载药纳米粒的sem结果表明制备的载药纳米粒粒径在100-200nm之间,形态大小均一、分散均匀,制得的o-cmcts-ves/dox能够有效包覆疏水性药物,是一种良好的药物载体。
由上述可得,利用壳聚糖作为载药载体是当前研究热点,而如何提高载体载药量是我们重点关注的。
技术实现要素:
本发明的目的是提供一种基于壳聚糖的两亲性自组装纳米载体,另一目的是提供该纳米载体的制备方法,并研究该纳米载体的载药应用。
为达到上述目的,本发明采取的具体技术方案为:
一种基于壳聚糖的两亲性自组装纳米载体,该纳米载体以壳聚糖为主体,壳聚糖的氨基分别接有组氨酸(his)和维生素e琥珀酸酯(ves)。
进一步的,上述纳米载体的ves取代度为1~20%,his的取代度为1~20%。
进一步的,上述纳米载体呈球形或椭球形,平均粒径为172.1±44.17nm,pdi=0.349。
进一步的,上述纳米载体表面zeta电位为+49.5±5.96mv。
上述纳米载体的制备方法,包括以下步骤:
(1)将壳聚糖溶于稀酸溶液;
(2)制备ves溶液,并加入活化剂;
(3)将(1)得到的壳聚糖液滴加至(2)ves溶液中,反应;
(4)将(3)反应完的混合液进行醇沉、透析和冻干,即得到海绵状维生素e琥珀酸酯-壳聚糖(vc);
(5)将(4)得到的vc溶于酸液,制备his溶液并进行活化,再将vc溶液滴加至his溶液中进行反应;
(6)(5)反应结束后,透析、冻干,得到终产物维生素e琥珀酸酯-壳聚糖-组氨酸(vch)。
所述基于壳聚糖的两亲性自组装纳米载体能够用于疏水性药物载体的制备。
进一步的,将疏水性药物分散于二甲亚砜中,将维生素e琥珀酸酯-壳聚糖-组氨酸(vch)溶解于水中,二者混合均匀,超声处理,通过离心除去未包载的疏水性药物,冷冻干燥即得。
进一步的,所述疏水性药物为疏水阿霉素。
本发明的优点和技术效果:
1、本发明制得的vch纳米粒子的平均粒径为172.1±44.17nm,pdi=0.349,表面zeta电位为+49.5±5.96mv,粒径大小较为均一,分散性良好,且纳米粒之间存在较强的静电作用,有利于纳米胶束保持稳定。并且所述vch纳米粒子具有良好的生物安全性。
2、本发明制备的纳米载体载药纳米粒dox/vch药物阿霉素的包封率为66.64%,载药量高达21.04%。
3、本发明制备的纳米载体载药纳米粒dox/vch具有一定的ph敏感性,在体内外功能性实验中展现了良好的抗肿瘤效果:体外抑瘤率为56.27%,体内抑瘤率为45.81%。
附图说明
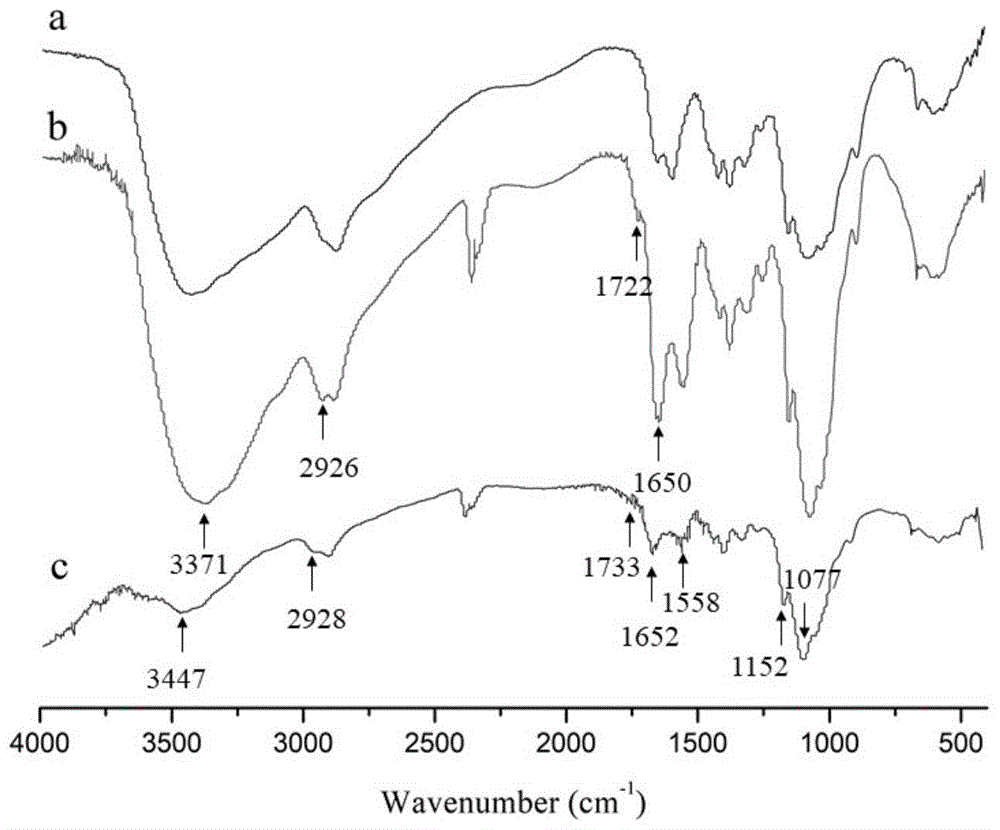
图1为cts(a)、vc(b)及vch(c)的红外光谱图。
图2为vc的1hnrm图。
图3为vch的1hnrm图。
图4为vch纳米粒的粒径分布图。
图5为vch纳米粒表面zeta电位图。
图6为vch纳米粒扫描电镜图。
图7为不同浓度vch纳米粒处理的l929细胞在24h(a)和48h(b)时生长状态观察图。1:对照2:10μg/ml。3:50μg/ml。4:100μg/ml。5:200μg/ml;(100×)。
图8为不同浓度vch纳米粒处理的l929细胞相对增殖率结果图。
图9为小鼠的相对体重变化图。
图10为组织切片的h&e染色图(100×)。
图11为载药纳米粒dox/vch的粒径分布图。
图12为载药纳米粒dox/vch表面zeta电位图。
图13为载药纳米粒dox/vch扫描电镜图。
图14为载药纳米粒dox/vch在ph=5.7和ph7.4的pbs缓冲液中的释放曲线(n=3,**p<0.01)。
图15为dox·hcl及dox/vch载药纳米粒ic50结果图。
图16为dox·hcl和dox/vch与hepg2细胞共培养1h、3h和5h后的激光共聚焦照片;阿霉素浓度为10μg/ml,标尺为100μm。
图17为hepg2细胞相对增殖率结果图。
图18为相对肿瘤体积变化图(n=10,*p<0.05,**p<0.01)。
图19为荷瘤小鼠在治疗期间的相对体重变化图(n=10,*p<0.05,**p<0.01)。
图20为各组小鼠的脏器指数(n=10,*p<0.05,**p<0.01)。
图21为生理盐组、dox·hcl组及dox/vch组各个脏器组织切片的h&e染色图(100×)。
图22为在第12天切除肿瘤后的肿瘤图片以及抑瘤率结果图。
具体实施方式
以下通过具体实施例并结合附图对本发明进一步解释和说明。
实施例1:
准确称取0.24g低分子量壳聚糖溶于30ml1%盐酸溶液中,室温下先用玻璃棒快速搅拌10min,再通过磁力搅拌使其完全溶解,备用。准确称取0.79gves置于三口瓶中,用量筒量取40mldmf倒入三口瓶中,搅拌使其完全溶解,再准确称取0.32gedc和0.19gnhs加入到上述溶液中,磁力搅拌2h,通过恒压滴定漏斗将溶解好的壳聚糖溶液逐滴加入到三口瓶中,滴加速度为1滴/秒,室温下机械搅拌48h。将反应后的混合液倒入5倍体积无水乙醇中沉淀,搅拌8h后在8000rpm转速下室温离心20分钟,弃掉上清,收集沉淀,再用无水乙醇清洗沉淀3次,用100ml蒸馏水溶解沉淀,置于透析袋(截留率8000-14000k)中,在10倍体积透析液中透析三天,每隔4小时更换一次透析液。透析过后,采用冷冻干燥,得到海绵状维生素e琥珀酸酯-壳聚糖(vc)。
准确称取0.4gves-cts并溶解于80ml1%的盐酸中备用。准确称取0.19g组氨酸(his)溶解于40ml去离子水中,并加入0.29gnhs和0.48gedc·hcl,磁力搅拌2小时后,将上述ves-cts溶液缓慢逐滴加入到混合液中,滴加速度为1滴/秒,滴加完毕后混合液在室温下机械搅拌24h。反应结束后将混合液置于透析袋(截留率8000-14000k)中,在10倍体积去离子水中透析三天,每隔4小时更换一次去离子水。透析过后,通过冷冻干燥的方法得到终产物维生素e琥珀酸酯-壳聚糖-组氨酸(vch)。
根据元素分析法测得ves的取代度为3.20%,his的取代度为9.01%。采用红外光谱和核磁氢谱表征合成的终产物维生素e琥珀酸酯-壳聚糖-组氨酸(vch),结果如图1、图2和图3所示,结合红外和核磁的结果可判断维生素e琥珀酸酯和组氨酸成功接枝到了壳聚糖上;采用激光粒度分析仪测定vch纳米粒子的尺寸和表面zeta电位,结果如图4和图5所示,vch纳米粒子的平均粒径为172.1±44.17nm,pdi=0.349,表面zeta电位为+49.5±5.96mv。以上结果表明vch纳米粒的粒径大小较为均一,分散性良好,且纳米粒之间存在较强的静电作用,有利于纳米胶束保持稳定。vch纳米粒通过扫描电子显微镜观察,结果如图6所示,从图中可以观察到vch纳米粒形状为球形或椭球形,粒径大小在100-200nm,分布均匀,没有明显的团聚现象,与dls检测结果一致。
实施例2
将处于对数生长期的l929细胞用0.25%胰蛋白酶消化,加入含有10%fbs的dmem培养基终止消化,重悬细胞,离心后用dmem培养基将浓度稀释至2×104个/ml,将稀释后的细胞种植于96孔板中,每孔200μl细胞悬液。将96孔板置于细胞培养箱培养24h后,吸弃细胞板中的培养基,加入200μl新鲜的含有不同浓度vch空白纳米粒子的培养基,vch空白纳米粒子浓度设置为10、50、100、200μg/ml,另设置正常dmem培养基培养的细胞为对照组,只含有dmem培养基未种植细胞为空白对照组,每组均设置6个重复。轻轻振荡,于细胞培养箱中培养24、48h后,于倒置显微镜下观察细胞形态并拍照,随后每孔加入20μlmtt溶液,在细胞培养箱中避光孵育4h,吸弃培养基,加入150μl二甲亚砜,于酶标仪中37℃振荡孵育10min,在492nm波长下检测每孔的吸光值,计算细胞相对增殖率。细胞相对增殖率按照以下公式计算:
细胞相对增殖率%=(实验组平均吸光值-空白组平均吸光值)/(对照组平均吸光值-空白组平均吸光值)×100%
细胞毒性评级标准如下:
rgr≥100%细胞评级为0级;100%>rgr≥75%细胞评级为1级;75%>rgr≥50%细胞评级为2级;50%>rgr≥25%细胞评级为3级;25%>rgr≥1%细胞评级为4级;rgr=100%细胞评级为5级。其中,0级或1级为合格,2级应结合细胞形态,3-5级不合格。
图7为l929细胞在含有不同浓度vch纳米粒的培养基中的生长状态图。从图中可以看出,l929细胞在培养了24h和48h之后生长状态良好,与对照组无明显区别,细胞数目基本一致,具有正常的细胞形态,呈梭形,没有因中毒而产生的细胞变形或凋亡现象。图8为mtt法测得l929细胞在不同浓度纳米粒子处理24h和48h后的细胞相对增殖率。从图中可以看出,培养24h和48h以后细胞相对增殖率都在80%以上,且培养48h以后的细胞相对于培养24h后的细胞均有所生长,根据细胞毒性评级分级可知各组的细胞毒性评级为0级或1级,说明制备的双亲性纳米胶束vch具有良好的细胞相容性。
实施例3
将24只km雄性小鼠随机分成2组,分别为实验组和对照组,每组12只,实验组按照10mg/kg的剂量每天给小鼠通过尾静脉注射的方法注射0.2mlvch纳米粒子生理盐溶解液,对照组每天给小鼠尾静脉注射0.2ml生理盐注射液,连续注射七天,观察小鼠每天的活动状态及有无中毒反应症状。结束给药后,第八天通过眼眶取血的方式给每只小鼠取血,取出的血分别收集到含有枸橼酸钠和edtak2的取血管中,进行凝血四项和血常规检测;取血完成后处死小鼠,取出心肝脾肺肾,剥离筋膜,用生理盐水冲洗干净,称重后放入包埋盒中,在4%中性甲醛溶液中固定48h,组织固定之后进行石蜡包埋,切片,h&e染色处理。
通过km小鼠评价vch纳米粒子的体内相容性,以生理盐组为对照组,在连续七天的尾静脉给药后,体重变化如图9所示,从图中可以看出,生理盐组给药七天后体重是初始体重w0的0.95倍,vch组给药七天后体重是初始体重w0的0.94倍,vch组与生理盐组相比,体重变化趋势几乎一致,没有显著性差异。7天的给药结束后,将小鼠的血液进行血常规和凝血检测,相关血液学指标如表1所示:
表1生理盐组和vch组的血液学指标检测
从表1中可以看出,生理盐组的血红蛋白含量、纤维蛋白原含量分别为156.4g/l、2.396g/l,vch组血红蛋白含量、纤维蛋白原含量分别为42.8g/l、3.257g/l,vch组小鼠的血红蛋白含量和纤维蛋白原与生理盐相比具有显著性差异,但数值在正常范围内。
图10为小鼠的心、肝、脾、肺、肾组织切片的h&e染色图,对比对照组的心、肝、脾、肺、肾切片,在vch组各个脏器切片并未发现有明显的组织学损伤。
实施例4
称取10mgvch溶解于10ml去离子水中,配制成1mg/mlvch水溶液,逐滴加入1mldox二甲亚砜溶液,4℃避光搅拌,挥发12h,冰浴条件下超声处理2min(超声条件:功率120w,超声4s,停止2s),重复三次,之后将超声处理过的溶液在3000rpm转速下4℃离心20min,上清液过0.22μm滤膜,得到的溶液即为载药纳米粒dox/vch溶液,4℃避光保存。
根据上述配制不同药质比(药质比dox:vch分别为1:5、2:5、3:5)的载药纳米粒溶液,取1ml载药纳米粒,加入到25ml棕色容量瓶中,补加dmso至刻度线,超声处理使dox充分释放,于荧光酶标仪中测其相对荧光强度,根据dox标准曲线分别求出dox含量,再根据公式分别计算出载药纳米粒的包封率(ee%)和载药量(lc%)。包封率和载药量计算公式如下:
包封率(ee%)=(纳米粒包封的药物质量)/(投药质量)×100%
载药量(lc%)=(纳米粒包封的药物质量)/(载药纳米粒总质量)×100%
药物载体质量比对包封率和载药量的影响如下表2所示:
表2不同药物载质比对包封率和载药量的影响
从表2中可以看出随着药物载体质量比的提高,阿霉素载药量不断上升,包封率却在下降,说明随着投药量的增加,虽然包封进纳米粒疏水核心的药物增多,但却有更多的药物没有被包封进去,因此我们选择药质比为2:5来制备载药纳米粒进行后续的研究,在保证有高载药量的同时,又能避免过低的包封率造成药物的浪费。
采用激光粒度分析仪测定vch纳米粒子的尺寸和表面zeta电位,结果如图11和图12所示,vch纳米粒子的平均粒径为172.1±44.17nm,pdi=0.349,表面zeta电位为+49.5±5.96mv。以上结果表明vch纳米粒的粒径大小较为均一,分散性良好,且纳米粒之间存在较强的静电作用,有利于纳米胶束保持稳定。通过扫描电子显微镜对载药纳米粒cox/vch进行微观形貌的观察,结果如图13所示,从图中可以看出载药纳米粒的粒径在200nm左右,比空白纳米粒的粒径稍大一些,形态呈球形,比起未包封阿霉素的形态有明显的充实感,没有明显的团聚现象,与dls结果一致。
实施例5
按药质比dox:vch=2:5制备,取1mldox/vch溶液置于透析袋(截留分子量为8k-14k)中并扎紧透析袋,将透析袋分别浸于ph=5.7和ph=7.4的pbs缓冲液中,在37℃、100rpm搅拌下孵育,在预先设定的时间点取出200μlpbs缓冲液,测定相对荧光强度,同时补加相同体积新鲜的pbs缓冲液,每组实验测三次取平均值,根据阿霉素标准曲线,计算阿霉素释放量,绘制释放曲线。
通过透析法研究了了载药胶束dox/vch在正常组织(ph=7.4)和肿瘤组织(ph=5.7)生理环境下的药物释放行为。如图14所示,无论是在ph=5.7还是ph=7.4的pbs缓冲液中,药物都存在阶段性释放,在前0.5h,载药胶束dox/vch表现出了较快的释放行为,在随后的0.5-48h,载药胶束的释放行为非常缓慢,最终在两种不同的ph环境中药物的累计释放量不同。在48h时,在ph=5.7的pbs缓冲液中,载药纳米粒的阿霉素累计释放量为26.6%,而在ph=7.4的pbs缓冲液中,载药纳米粒的阿霉素累计释放量仅为18.6%,因此载药纳米粒的药物释放行为具有一定的ph敏感性。
实施例6
将处于对数生长期的hepg2细胞用0.25%胰蛋白酶消化,加入含有10%fbs的rpmi1640培养基终止消化,重悬细胞,离心后用rpmi1640培养基将浓度稀释至2×104个/ml,将稀释后的细胞种植于96孔板中,每孔200μl细胞悬液。将96孔板置于细胞培养箱培养24h后,吸弃细胞板中的培养基,加入200μl新鲜的含有dox·hcl或者dox/vch的培养基(dox在培养基的终浓度由0.1到100μg/ml不等),另设置正常dmem培养基培养的细胞为对照组,只含有dmem培养基未种植细胞为空白对照组,每组均设置6个重复。置于细胞培养箱中培养24h后,每孔加入20μlmtt溶液,在细胞培养箱中避光孵育4h,吸弃培养基,用pbs(0.01m,ph7.4)缓冲液润洗后加入150μl二甲亚砜,于酶标仪中37℃振荡孵育10min,在492nm波长下检测每孔的吸光值,计算细胞相对增殖率。细胞相对增殖率按照以下公式计算:
细胞相对增殖率%=(实验组平均吸光值-空白组平均吸光值)/(对照组平均吸光值-空白组平均吸光值)×100%
图15为dox·hcl及dox/vch载药纳米粒对hepg2细胞的ic50测试结果,从图中可以计算出dox·hcl对hepg2细胞在24h的ic50为1.52μg/ml,载药纳米粒dox/vch对hepg2细胞的ic50为10.59μg/ml。
实施例7
将处于对数生长期的hepg2细胞种植于直径35mm的细胞培养皿中,每孔大约2×104个,孵育24h使细胞贴壁,移除原培养基,分别加入含有dox·hcl和载药胶束dox/vch的培养基,阿霉素在培养基中的终浓度均为10μg/ml。分别培养1h、3h和5h后,除去原培养液,加入hoechst33258染色液染色10min,弃去染色液,并用pbs(0.01m,ph7.4)缓冲液洗涤3次,最后加入1mlpbs缓冲液浸没细胞,在激光共聚焦扫描显微镜下观察细胞内荧光并拍照(dox激发波长为485nm,发射波长为595nm;hoechst33258激发波长为352nm,发射波长为461nm)。
图16为不同时间点hepg2细胞对盐酸阿霉素和载药纳米粒摄取结果图,经hoechst33258染液染色后的细胞核呈蓝色,阿霉素具有荧光性质呈红色。从图中可以看出,孵育1h时,盐酸阿霉素组和载药纳米粒组的阿霉素荧光强度都比较弱,随着孵育时间的增加,两组的荧光强度均有所增加,孵育3h后,盐酸阿霉素组的荧光强度开始超过载药纳米粒组,直到5h时两组荧光强度均达到最强,且盐酸阿霉素组的荧光强度要明显强于载药纳米粒组。从图中还可以看出盐酸阿霉素组的红色荧光主要集中在细胞核,而载药纳米粒组的细胞在1h和3h时主要分布在细胞质,在5h时才开始向细胞核中聚集。说明载药纳米粒子dox/vch能够有效的被hepg2细胞摄取,并使药物在细胞内释放。
实施例8
取对数生长期的hepg2细胞,加培养基重悬,以4000个/孔的密度接种于96孔细胞培养板中,在细胞培养箱中培养24h后,吸弃培养基,分别加入含有dox·hcl和dox/vch纳米粒子的培养基共培养,dox在培养基中终浓度分别为1μg/ml、5μg/ml、10μg/ml和15μg/ml,培养24h后,加入20μlmtt溶液,孵育4h后,吸弃培养基,用pbs(0.01m,ph7.4)缓冲液润洗一遍,加入150μldmso溶解甲瓒晶体,于酶标仪492nm处测其吸光值,计算细胞相对增殖率。细胞相对增殖率按照以下公式计算:
细胞相对增殖率%=(实验组平均吸光值-空白组平均吸光值)/(对照组平均吸光值-空白组平均吸光值)×100%
体外抗肿瘤结果如图17所示,从图中可以看出随着药物浓度的增加,盐酸阿霉素和载药纳米粒对hepg2细胞生长的抑制率明显提高,在阿霉素浓度为15μg/ml时,盐酸阿霉素的细胞生长抑制率为76.57%,载药纳米粒的细胞生长抑制率为56.27%。
实施例9
将冻存的h22鼠肝癌细胞复苏后,离心(1000rpm,5min)弃去培养基,用pbs(0.01m,ph7.4)缓冲液重悬洗涤三次,收集h22细胞加1mlpbs缓冲液分散,并注入km小鼠腹腔,腹水培养,待km小鼠腹部涨圆,用无菌注射器抽取腹水,稀释三倍,注入健康的km小鼠腹腔中以此传代,传至第三代即可进行荷瘤小鼠模型的建立。
将处于对数生长期的h22鼠肝癌细胞从传至第三代的km小鼠腹腔取出,用生理盐注射液稀释至1×107个/ml的浓度,分别接种于km小鼠右侧腋下,每只注入0.1ml细胞悬液,待小鼠在注射部位长出100mm3左右大小的即成功建立肿瘤模型。
选取30只肿瘤建立情况良好,肿瘤体积约100-200mm3的荷瘤小鼠,随机分成三组,组间组内分别标号,分别为生理盐组,dox·hcl组,载药胶束dox/vch组,通过尾静脉注射的方式,以每针剂5mg/kg的药剂量给药,每隔72h给药一次,连续给药4次。对荷瘤小鼠开始给药的第一天标记为第0天,开始给药后,持续观察小鼠的身体状态、活力状态,每隔三天记录一次肿瘤大小以及体重变化。肿瘤体积的大小按照以下公式计算:
v肿瘤=(l×w2)/2
v肿瘤为肿瘤体积,l为肿瘤的长,w为肿瘤的宽。
观察完荷瘤小鼠的治疗过程后,将小鼠断颈处死,取出心肝脾肺肾及肿瘤组织,用生理盐水清洗干净后称重,再用4%中性甲醛溶液固定,经过石蜡包埋、组织切片和h&e染色后,通过光学显微镜观察并拍照。
脏器指数(visceralindex)按照以下公式计算:
visceralindex=(wv/wb)×100%
wv为小鼠的心/肝/脾/肺/肾等脏器的重量,wb为小鼠的平均体重。
肿瘤抑制率(tir)按照以下公式计算:
tir=(1-wt/wc)×100%
wt为实验组平均肿瘤重量,wc为对照组平均肿瘤重量。
荷瘤小鼠在肿瘤治疗过程中的相对肿瘤体积变化如图18所示,从图中可以看出生理盐水组的肿瘤体积在治疗结束后急剧增长到最初肿瘤体积(v0)的21.17倍(21.17v0),盐酸阿霉素组小鼠肿瘤体积由v0增长到8.37v0,dox/vch组的小鼠肿瘤体积由v0增大到9.35v0,在第9天盐酸阿霉素组以及载药纳米粒组的小鼠相对肿瘤体积变化与生理盐组相比均具有极显著性差异;第12天,盐酸阿霉素组小鼠相对肿瘤体积变化与生理盐组相比具有极显著性差异,载药纳米粒组的小鼠相对肿瘤体积变化与生理盐组相比具有显著性差异;在这12天中,盐酸阿霉素组小鼠相对中瘤体积变化与载药纳米粒组相比没有显著性差异。上述结果说明dox/vch载药纳米粒能够有效抑制肿瘤体积的增大。
荷瘤小鼠的体重变化如图19所示,从图中可以看出生理盐组的小鼠体重一直呈上升的趋势,载药纳米粒dox/vch组的小鼠体重也是一直呈上升的趋势,并且载药纳米粒组的小鼠体重相对变化与生理盐组没有显著性差异,而盐酸阿霉素组的小鼠体重几乎和初始体重一致;在第9天,盐酸阿霉素组小鼠体重相对变化与生理盐组有极显著差异,与载药纳米粒组有显著性差异;在第12天,盐酸阿霉素组小鼠体重相对变化与生理盐组以及载药纳米粒组均有极显著性差异。在治疗期间体重的变化可以从侧面反映出药物的系统毒性,生理盐作为阴性对照小鼠体重不受阿霉素系统毒性的影响,所以一直处于明显的上升趋势,而阿霉素组的小鼠体重一直没有明显的上升,说明小鼠通过尾静脉注射盐酸阿霉素,受其毒副作用的影响,不能健康的生长,载药纳米粒组的小鼠,在尾静脉注射药物后依然能保持上升的趋势,虽然没有生理盐组那么大的上升幅度,但与盐酸阿霉素组相比具有显著性差异,说明vch纳米载体作为阿霉素的递送载体能够显著降低阿霉素的毒副作用。
脏器指数是判断药物毒性试验的一项较为敏感的指标。在荷瘤小鼠治疗过程结束后,处死小鼠,取出心肝脾肺肾计算脏器指数,结果如图20所示。从图中可以看出,载药纳米粒组的各个脏器指数与生理盐组均无显著性差异,而盐酸阿霉素组的肺与生理盐组相比有显著性差异,盐酸阿霉素组的脾与生理盐组相比差异性极显著。以上结果说明盐酸阿霉素对正常脏器组织有明显的毒害作用,而载药纳米粒具有明显的降低阿霉素毒副作用的特点。
通过倒置显微镜观察小鼠的心、肝、脾、肺、肾及肿瘤组织h&e染色切片,结果如图21所示。从图中可以看出,盐酸阿霉素组和载药纳米粒dox/vch组的心脏横纹肌与生理盐组相比没有明显的差别,但盐酸阿霉素的肝脏组织变得松散,肝细胞之间的间距变大,并伴有空泡状变性,在肾脏组织中可以观察到肾小球肿胀,有炎性细胞的浸润,肾小管纹理不明显,脾脏也受到了不同程度的损伤。而载药纳米粒dox/vch组和生理盐组相比,没有发现明显的肝脾肺肾等脏器受到阿霉素不良副作用的损伤现象。对于肿瘤组织,生理盐组的肿瘤细胞生长旺盛,可以观察到排列密集的蓝色细胞核,而盐酸阿霉素组和载药纳米粒组在肿瘤组织中能明显看到肿瘤细胞的生长受到抑制,细胞核萎缩甚至消失,部分肿瘤细胞已经凋亡。肿瘤实体照片及肿瘤抑制率结果如图22所示,肿瘤实体照片所显示的肿瘤抑制趋势与相对肿瘤体积变化的趋势一致,都说明盐酸阿霉素和载药纳米粒均具有非常好的肿瘤抑制效果,且二者抑制效果相近。经计算,盐酸阿霉素组的肿瘤抑制率为52.74%,载药纳米粒组的肿瘤抑制率为45.81%。
目前,抗肿瘤药物大部分是疏水性药物,一般的药物载体靶向性差,载药量低,有些还会对机体产生毒性。因此,本申请所制备的vch载体具有良好的生物相容性,具有靶向性(被动靶向),能够作为一种机体友好型、且载药效果良好的药物载体进行临床应用。
- 还没有人留言评论。精彩留言会获得点赞!