使用甲氨蝶呤诱导免疫耐受性的制作方法
发明领域
本发明一般涉及免疫学,且更具体地,涉及甲氨蝶呤降低患者中不想要的免疫应答的用途。
发明背景
目前,美国食品和药品管理局(fda)已经批准超过130种蛋白质治疗剂用于临床使用(leader等,natrevdrugdiscov,7(1):21-39(2008))。这些治疗剂包括肽、重组人蛋白、蛋白质疫苗、自多种动物物种衍生的多克隆抗体制剂、和单克隆抗体。根据其与内源自身抗原的序列和构象同源性,糖基化状态、剂量水平、施用路径、局部化、和制造方法相关特征,治疗性蛋白质可能在患者中引发抗体应答(schellekens,natrevdrugdiscov,1(6):457-62(2002);zinkernagel,seminimmunol,12(3):163-71(2000),discussion257-344;thorland等,haemophilia,5(2):101-5(1999);goodeve,bloodcoagulfibrinolysis,14suppl1:s17-21(2003))。这些应答(称为抗药物抗体(ada)应答)有时会影响患者安全性和药物效力。
在溶酶体贮积病症,即蓬佩(pompe)病的情况中,在酶替换疗法(ert)中会形成针对重组人酸性α-的ada。在不表达可测量量的内源酶的患者中,持续的高抗体滴度水平与患者衰退(crim-蓬佩患者)相关联(kishnani等,molgenetmetab.,99(1):26-33(2010);hunley等,pediatrics,114(4):e532-5(2004);amalfitano等,genetmed,3(2):132-8(2001))。已经在形成针对因子ix的ada的血友病患者中观察到对药物安全性和效力的类似危害(thorland等,haemophilia,5(2):101-5(1999);ewenstein等,blood,89(3):1115-6(1997))。在罕见的情况中,ada还会诱导自身免疫性疾病,如在重组人促红细胞生成素的情况中(schellekens,clinther,24(11):1720-40(2002),discussion1719;locatelli等,peritdialint,27suppl2:s303-7(2007))。
不管治疗剂是非人衍生的、人源化的或甚至是完全人的,抗体治疗剂也会发生ada应答。单克隆和多克隆抗体治疗剂两者的免疫原性会影响患者安全性和药物效力。针对治疗性单克隆抗体诸如英夫利昔单抗(infliximab)、阿达木单抗(adalimumab)、利妥昔单抗(rituximab)和那他珠单抗(natalizumab)形成的抗体已经与治疗性抗体的降低的血清水平和效力联系起来(bendtzen等,arthritisrheum,54(12):3782-9(2006);schmidt等,clinimmunol,132(3):334-41(2009);bartelds等,annrheumdis,66(7):921-6(2007);baert等,nengljmed,348(7):601-8(2003);tahir等,rheumatology(oxford),44(4):561-2(2005);maini等,arthritisrheum,41(9):1552-63(1998))。变应性反应已经与抗英夫利昔单抗抗体联系起来(baert等,nengljmed,348(7):601-8(2003))。已经在小百分比的用那他珠单抗治疗的复发-缓解性多发性硬化患者中观察到输注相关超敏感性反应(phillips等,neurology,67(9):1717-8(2006))。
阿仑单抗是另一种会在复发-缓解性多发性硬化患者中产生ada的抗体治疗剂(coles等,nengljmed,2008.359(17):1786-801(2008))。阿仑单抗是一种与cd52(一种在免疫细胞上表达的细胞表面抗原)相互作用的淋巴细胞消减性单克隆抗体。阿仑单抗处于治疗复发-缓解性多发性硬化的晚期临床试验,并且还已经在类风湿性关节炎中评估。一组研究人员已经显示了在一项单剂增加研究中治疗的类风湿性关节炎患者中63%形成抗阿仑单抗抗体(weinblatt等,arthritisrheum,1995.38(11):1589-94(1995))。在所述研究中,阿仑单抗的效力表现为受到ada的存在而改变(同上)。
多克隆抗体治疗剂
研究已经尝试寻找使ada的有害效应最小化的方式。已经对多种工具测试其诱导免疫耐受性及降低蛋白质疗法中的ada的能力,包括例如非消减性抗cd4抗体(cobbold等,seminimmunol,2(6):377-87(1990);winsor-hines等,jimmunol,173(7):4715-23(2004))、阿仑单抗的非细胞结合最小突变体(gilliland等,jimmunol,162(6):3663-71(1999);somerfield等,jimmunol.,185(1):763-8(2010))、免疫抑制性疗法(bennett等,blood,106(10):3343-7(2005);dickson等,jclininvest,118(8):2868-76(2008))、含有磷脂酰肌醇的结合因子viii的脂质性颗粒(peng等,aaps.j.,12(3):473-81(2010))、和重组酸性α-葡糖苷酶经由腺伴随病毒感染的肝特异性施用(sun等,amjhumangenet,81(5):1042-9(2007);sun等,molther18(2):353-60(2009);ziegler等,humgenether,19(6):609-21(2008))。然而,仍然需要开发用于降低蛋白质疗法和其它背景中不想要的抗体应答的改善的方法。
发明概述
本发明提供了一种在需要用治疗剂治疗的受试者中诱导免疫耐受性的方法。在此方法中,在单个周期中对所述受试者施用有效量的甲氨蝶呤,由此在所述受试者中诱导针对所述治疗剂的免疫耐受性。
本发明还提供了一种在需要用治疗剂治疗的受试者中抑制针对所述治疗剂的抗体应答的方法。在此方法中,在单个周期中对所述受试者施用有效量的甲氨蝶呤,由此在所述受试者中抑制针对所述治疗剂的抗体应答。
本发明还提供了一种在需要用治疗剂治疗的受试者中减轻针对所述治疗剂的输注反应的方法。在此方法中,对所述受试者施用有效量的甲氨蝶呤,由此在所述受试者中减轻针对蛋白质治疗剂的输注反应。
本发明还提供了一种在需要用治疗剂治疗的自身免疫受试者中降低继发性自身免疫的方法。在此方法中,对所述受试者施用有效量的甲氨蝶呤,由此在所述受试者中降低继发性自身免疫。
本发明还提供了一种在需要用治疗剂治疗的受试者中提高治疗剂的效力的方法。在此方法中,对所述受试者施用有效量的甲氨蝶呤,由此在所述受试者中提高所述蛋白质治疗剂的效力。
本发明还提供了一种在用淋巴细胞消减性疗法(例如阿仑单抗疗法或
本发明还提供了一种在需要用蛋白质治疗剂(诸如抗体治疗剂)治疗的受试者中增加b细胞群体中b调节细胞百分比的方法。在此方法中,对所述受试者施用有效量的甲氨蝶呤,由此增加所述受试者中的所述百分比。在一些实施方案中,在单个周期中施用所述有效量的甲氨蝶呤。在相关实施方案中,本发明提供了一种在需要用蛋白质治疗剂治疗的受试者中增加tgf-β、il-10、和/或foxp3表达b细胞的方法,其包括在单个周期中施用有效量的甲氨蝶呤。
本发明还提供了一种延长治疗剂在受试者中的药动学的方法。在此方法中,在施用所述治疗剂之前或期间或之后以有效延长所述治疗剂的药动学的量对所述受试者施用甲氨蝶呤。
本发明进一步提供了一种在有此需要的人患者中消减淋巴细胞的方法。在此方法中,用淋巴细胞消减剂治疗患者,并在用淋巴细胞消减剂治疗之前或期间或之后以有效诱导患者中针对淋巴细胞消减剂的免疫耐受性或降低继发性自身免疫的量对患者施用甲氨蝶呤。在一些实施方案中,在单个周期中施用所述有效量的甲氨蝶呤。在一些实施方案中,淋巴细胞消减剂可以是单克隆抗体治疗剂(例如阿仑单抗或利妥昔单抗)。在这些中的某些实施方案中,患者可以是多发性硬化患者(例如缓解-复发性多发性硬化患者)。在一些实施方案中,淋巴细胞消减剂可以是多克隆抗体治疗剂(例如抗胸腺细胞球蛋白多克隆抗体)。
本发明还提供了一种在需要组织移植的受试者中诱导免疫耐受性的方法。在此方法中,对所述受试者施用有效量的甲氨蝶呤,由此在所述受试者中诱导针对移植的组织的免疫耐受性。在一些实施方案中,在单个周期中施用所述有效量的甲氨蝶呤。在一些实施方案中,移植的组织是肾组织或心脏组织。在一些实施方案中,所述受试者还接受用于免疫调控的药剂(例如免疫抑制剂),诸如多克隆抗胸腺细胞球蛋白抗体。
本发明还提供了一种在需要治疗剂或组织移植的受试者中抑制t细胞应答的方法。在此方法中,在用所述治疗剂或组织移植治疗所述受试者之前、同时、或之后对所述受试者施用有效量的甲氨蝶呤,由此在所述受试者中抑制t细胞应答。
在本发明方法的一些实施方案中,治疗剂是蛋白质治疗剂。
在本发明方法的一些实施方案中,治疗剂是抗体治疗剂。例如,抗体治疗剂可以是单克隆抗体治疗剂和/或淋巴细胞消减剂(例如阿仑单抗),或多克隆抗体治疗剂(例如多克隆家兔抗胸腺细胞球蛋白抗体)。在抗体治疗剂是阿仑单抗的别的实施方案中,受试者可以是多发性硬化患者。在抗体治疗剂是多克隆家兔抗胸腺细胞球蛋白抗体的别的实施方案中,受试者可以是需要器官移植,具有再生障碍性贫血,和/或具有或有风险具有移植物抗宿主病的人患者。在本发明方法的其它实施方案中,治疗剂是酶。例如,酶可以是人α-半乳糖苷酶a或人酸性α-葡糖苷酶。
在本发明方法的一些实施方案中,受试者是人。
在本发明方法的一些实施方案中,甲氨蝶呤的有效量可以是0.1mg/kg至5mg/kg。在一些实施方案中,单个周期的甲氨蝶呤可以由甲氨蝶呤施用1天或甲氨蝶呤施用连续2、3、4、5、6、7、8、9、10、或11天组成。在一些实施方案中,可以在治疗性处理开始之前48小时和之后48小时之间施用单个周期的甲氨蝶呤。
本发明还涉及以下各项:
1.一种在需要用治疗剂治疗的受试者中诱导免疫耐受性的方法,其包括在单个周期中对所述受试者施用有效量的甲氨蝶呤,由此在所述受试者中诱导针对所述治疗剂的免疫耐受性。
2.一种在需要用治疗剂治疗的受试者中抑制针对蛋白质治疗剂的抗体应答的方法,其包括在单个周期中对所述受试者施用有效量的甲氨蝶呤,由此在所述受试者中抑制针对所述治疗剂的抗体应答。
3.一种在需要用治疗剂治疗的受试者中减轻针对治疗剂的输注反应的方法,其包括对所述受试者施用有效量的甲氨蝶呤,由此在所述受试者中减轻针对蛋白质治疗剂的输注反应。
4.一种在需要用治疗剂治疗的自身免疫受试者中降低继发性自身免疫的方法,其包括对所述受试者施用有效量的甲氨蝶呤,由此在所述受试者中降低继发性自身免疫。
5.一种在需要用治疗剂治疗的受试者中提高治疗剂的效力的方法,其包括对所述受试者施用有效量的甲氨蝶呤,由此在所述受试者中提高所述蛋白质治疗剂的效力。
6.一种在需要用治疗剂治疗的受试者中增加t细胞群体中t调节细胞百分比的方法,其包括对所述受试者施用有效量的甲氨蝶呤,由此增加所述受试者中的所述百分比。
7.项1-6中任一项的方法,其中所述治疗剂是蛋白质治疗剂。
8.一种在需要用抗体治疗剂治疗的受试者中增加b细胞群体中b调节细胞百分比的方法,其包括对所述受试者施用有效量的甲氨蝶呤,由此增加所述受试者中的所述百分比。
9.项3-8中任一项的方法,其中在单个周期中施用所述有效量的甲氨蝶呤。
10.一种延长治疗剂在受试者中的药动学的方法,其包括在施用所述治疗剂之前或期间或之后以有效延长所述治疗剂的药动学的量对所述受试者施用甲氨蝶呤。
11.项1-10中任一项的方法,其中所述受试者是人。
12.项1-10中任一项的方法,其中所述治疗剂是抗体治疗剂。
13.项12的方法,其中所述抗体治疗剂是单克隆抗体治疗剂。
14.项12或13中任一项的方法,其中所述抗体治疗剂是淋巴细胞消减剂。
15.项14的方法,其中所述抗体治疗剂是阿仑单抗(alemtuzumab)。
16.项15的方法,其中所述受试者是多发性硬化患者。
17.项12的方法,其中所述抗体治疗剂是多克隆抗体治疗剂。
18.项17的方法,其中所述抗体治疗剂是多克隆家兔抗胸腺细胞球蛋白抗体。
19.项18的方法,其中所述受试者是需要器官移植,具有再生障碍性贫血,和/或具有或有风险具有移植物抗宿主病的人患者。
20.项1-11中任一项的方法,其中所述治疗剂是酶。
21.项21的方法,其中所述酶是人α-半乳糖苷酶a。
22.项22的方法,其中所述酶是人酸性α-葡糖苷酶。
23.项1-22中任一项的方法,其中所述有效量是0.1mg/kg至5mg/kg。
24.项1-22中任一项的方法,其中所述单个周期的甲氨蝶呤由甲氨蝶呤施用1天或甲氨蝶呤施用连续2、3、4、5、6、7、8、9、10、或11天组成。
25.项1-22中任一项的方法,其中在治疗性处理开始之前48小时和之后48小时之间施用所述单个周期的甲氨蝶呤。
26.一种在有此需要的人患者中消减淋巴细胞的方法,其包括:用淋巴细胞消减剂治疗所述患者,并在用所述淋巴细胞消减剂治疗之前或期间或之后以有效诱导所述患者中针对所述淋巴细胞消减剂的免疫耐受性的量对所述患者施用甲氨蝶呤。
27.项26的方法,其中在单个周期中施用所述有效量的甲氨蝶呤。
28.项26或27中任一项的方法,其中所述淋巴细胞消减剂是单克隆抗体治疗剂。
29.项26或27中任一项的方法,其中所述淋巴细胞消减剂是多克隆抗体治疗剂。
30.项28的方法,其中所述单克隆抗体治疗剂是阿仑单抗。
31.项28的方法,其中所述单克隆抗体治疗剂是利妥昔单抗(rituximab)。
32.项26-31中任一项的方法,其中所述患者是多发性硬化患者。
33.项32的方法,其中所述患者具有缓解-复发性多发性硬化。
34.项29的方法,其中所述多克隆抗体治疗剂是抗胸腺细胞球蛋白多克隆抗体。
35.一种在需要组织移植的受试者中诱导免疫耐受性的方法,其包括对所述受试者施用有效量的甲氨蝶呤,由此在所述受试者中诱导针对移植的组织的免疫耐受性。
36.项35的方法,其中在单个周期中施用所述有效量的甲氨蝶呤。
37.项35或36中任一项的方法,其中所述移植的组织是肾组织或心脏组织。
38.项37的方法,其中所述受试者还接受另一种用于免疫调控的药剂。
39.项38的方法,其中所述用于免疫调控的药剂是免疫抑制剂。
40.项38的方法,其中所述用于免疫调控的药剂是多克隆抗胸腺细胞球蛋白抗体。
41.一种在需要治疗剂或组织移植的受试者中抑制t细胞应答的方法,其包括在用所述治疗剂或组织移植治疗所述受试者之前、同时、或之后对所述受试者施用有效量的甲氨蝶呤,由此在所述受试者中抑制t细胞应答。
42.项41的方法,其中在单个周期中施用所述有效量的甲氨蝶呤。
43.项41或42中任一项的方法,其中所述治疗剂是蛋白质治疗剂。
44.项43的方法,其中所述蛋白质治疗剂是抗体治疗剂。
45.项44的方法,其中所述抗体治疗剂是单克隆抗体治疗剂。
46.项44或45中任一项的方法,其中所述抗体治疗剂是淋巴细胞消减剂。
47.项46的方法,其中所述抗体治疗剂是阿仑单抗。
48.项47的方法,其中所述受试者是多发性硬化患者。
49.项44的方法,其中所述抗体治疗剂是多克隆抗体治疗剂。
50.项49的方法,其中所述多克隆抗体治疗剂是多克隆家兔抗胸腺细胞球蛋白抗体。
51.项43的方法,其中所述移植的组织是肾组织或心脏组织。
52.项51的方法,其中所述受试者还接受另一种用于免疫调控的药剂。
53.项52的方法,其中所述用于免疫调控的药剂是免疫抑制剂。
附图简述
在下文描述的每幅图中,星号或星形标示具有统计学显著差异的测量(*,p<0.05;**,p≤0.001;***,p≤0.0001)。
图1a-b显示了针对单个和多个疗程matg(一种家兔抗鼠胸腺细胞球蛋白多克隆抗体)的抗家兔igg响应。测量平均抗家兔igg滴度,并使用仅用家兔igg(rbigg)处理的小鼠作为对照。图1a显示了在8周时期里针对单个疗程matg的响应。图1b显示了在20周时期里针对多个疗程matg的响应。箭标示施用matg或rbigg的时间点。
图2显示了用阿仑单抗的5次每月处理后的平均阿仑单抗特异性igg滴度。箭标示施用阿仑单抗的时间点。
图3显示了单个疗程matg后甲氨蝶呤(mtx)对抗matgigg应答的抑制。用仅matg、仅rbigg、或matg和甲氨蝶呤处理小鼠。
图4a-c显示了贯穿用matg的5次每月处理的过程,甲氨蝶呤对抗家兔igg应答的影响。箭标示施用matg或甲氨蝶呤的时间点。图4a显示了三个周期的甲氨蝶呤显著降低平均抗家兔igg滴度。图4b显示了单个疗程的甲氨蝶呤显著降低平均抗家兔igg滴度。图4c比较用仅matg、matg和单个周期的甲氨蝶呤、或matg和三个周期的甲氨蝶呤处理的小鼠的平均抗家兔igg滴度。单个周期的甲氨蝶呤比三个周期的甲氨蝶呤更显著降低抗家兔igg滴度。
图5显示了与用matg但不用甲氨蝶呤处理的小鼠相比,平均抗家兔igg滴度在经甲氨蝶呤处理的小鼠(单个和多个甲氨蝶呤周期)中在matg再攻击后降低。箭标示施用matg或甲氨蝶呤的时间点。
图6显示了用matg和单个周期的甲氨蝶呤处理的小鼠中的平均抗家兔igg滴度比仅用matg处理的小鼠中的平均抗家兔igg滴度小100倍。箭标示施用matg或甲氨蝶呤的时间点。
图7a-c显示了甲氨蝶呤能降低hucd52tg小鼠中的平均抗阿仑单抗igg滴度。图7a:抗阿仑单抗滴度在用单个周期的1mg/kg或5mg/kg甲氨蝶呤处理的小鼠中比在用0.5mg/kg或无甲氨蝶呤处理的小鼠中低。用仅阿仑单抗,或阿仑单抗和单个周期的0.5mg/kg、1mg/kg、或5mg/kg甲氨蝶呤处理小鼠。图7b:测试抗阿仑单抗滴度的研究设计。在第5剂阿仑单抗后24小时时测定滴度数据,如由星形标示的。图7c:在第5剂阿仑单抗后24小时,与仅接受阿仑单抗的小鼠相比,甲氨蝶呤在接受阿仑单抗和甲氨蝶呤的小鼠中降低抗阿仑单抗抗体滴度。
图8a-d显示了用5剂每日0.5mg/kg阿仑单抗或磷酸盐缓冲盐水(pbs)处理的小鼠中循环t细胞的绝对细胞数目/μl全血。图8a显示了总t细胞(cd3+)在处理后2、3和4周降低。图8b显示了总b细胞(cd19+)在处理后3周降低。图8c显示了t辅助细胞(cd4+)在处理后2、3和4周时降低,且图8d显示了细胞毒性t细胞(cd8+)在处理后2、3和4周时降低。
图9a-b显示了阿仑单抗特异性igg应答。图9a显示了以0.5mg/kg用阿仑单抗处理的三个周期,及以0.5mg/kg、1mg/kg、或2mg/kg用甲氨蝶呤处理的一个周期后的应答。阿仑单抗处理的第一个周期由剂量给药的连续5天组成,并且第二个和第三个周期各由剂量给药的连续3天组成。图9b显示了在第14周时每组的每只动物的抗阿仑单抗igg滴度。
图10显示了单个周期的5mg/kg甲氨蝶呤恢复用5剂每月matg处理的小鼠中的循环matg水平。
图11显示了用matg的5次每月处理和单个周期的甲氨蝶呤处理的小鼠在第5剂matg后具有血液中增强的matg介导的cd4+和cd8+t细胞消减。从两个实验合并这些数据。
图12a-b显示了用单个周期的甲氨蝶呤处理的小鼠在第5次每月matg处理后展现出增加的t调节(cd25+foxp3+)细胞百分比。用仅matg的5次每月处理,或matg的5次每月处理和单个周期的甲氨蝶呤,或matg的5次每月处理和三个周期的甲氨蝶呤处理小鼠。图12a显示了脾中的t调节细胞水平。图12b显示了血液中的t调节细胞水平。
图13a显示了大于10,000的抗家兔igg滴度能干扰matg的药动学。图13b显示了大于100,000的抗家兔滴度能干扰cd4和cd8细胞消减。%处理前对照指cd4和cd8滴度相对于其在matg处理前的相应水平的百分比。
图14显示了用5mg/kg甲氨蝶呤处理的小鼠在第5剂每月阿仑单抗后展现出增强的阿仑单抗对循环cd3+t细胞和cd19+b细胞的消减。对于研究的头三天,用仅阿仑单抗,或阿仑单抗和单个周期的甲氨蝶呤处理小鼠。星号标示具有统计学显著差异的测量(*,p<0.05;***,p≤0.0001)。
图15a显示了单个周期的甲氨蝶呤能在16周研究中贯穿处理,且甚至在最后一次rhgaa处理后4周降低重组人酸性α-葡糖苷酶(rhgaa)特异性igg滴度。箭标示施用rhgaa和甲氨蝶呤的时间点。用仅rhgaa,或rhgaa和单个周期的甲氨蝶呤,或rhgaa和三个周期的甲氨蝶呤处理小鼠。图15b显示了在6周研究中,单个周期的甲氨蝶呤降低rhgaa特异性igg滴度。图15c显示了单个周期的甲氨蝶呤在18周研究中降低rhgaa特异性igg滴度。
图16a显示了与仅matg相比,甲氨蝶呤在与matg一起施用时降低鼠异基因心脏移植物模型中的抗家兔igg滴度。图16b显示了甲氨蝶呤提高鼠异基因心脏移植物模型中的matg的循环水平。用盐水、仅matg、或matg和单个周期的甲氨蝶呤处理小鼠。在研究的第0天和第4天以20mg/kg施用matg,而在研究的第0-6天施用2mg/kg甲氨蝶呤。
图17显示了kaplan-meier图,其指示matg和甲氨蝶呤的组合处理延长移植入接受小鼠中的异基因心脏的存活。将小鼠保持未处理,或者在研究的第0天和第4天仅用20mg/kgmatg,或在研究的第0-6天仅用2mg/kg甲氨蝶呤,或在第0-6天用matg和2mg/kg甲氨蝶呤两者,或在第0-6天或第0-11天用matg和0.5mg/kg甲氨蝶呤两者处理。
图18显示了用单独的甲氨蝶呤或与matg组合的甲氨蝶呤处理的具有移植的异基因心脏的小鼠经历抗同种移植物抗体应答的降低。图18a显示了第21天结合异基因成纤维细胞的接受者igg。图18b显示了在指定处理的情况中给予同基因移植物(syntx)或异基因移植物(allotx)的小鼠中第21天的同种抗体水平。显示了个别接受小鼠血清igg对异基因成纤维细胞的结合,并且以均值荧光强度(mfi)与未染色的成纤维细胞的比率表示。图18c显示了给予无处理、matg、甲氨蝶呤、或matg和甲氨蝶呤的小鼠中第21天的同种抗体水平。同种抗体水平在用甲氨蝶呤或matg和甲氨蝶呤处理的小鼠中显著较低(分别为p=0.0008和p<0.0001)。
图19显示了b10调节b细胞在甲氨蝶呤处理后显著增加。用单独的rhgaa或rhgaa和甲氨蝶呤的单个3天周期或盐水处理小鼠。在研究的第7天和第8天计数细胞数目。
图20显示了与仅用rhgaa处理相比,活化的b细胞亚群在用rhgaa和甲氨蝶呤的单个3天周期处理后第6天显著增加。在研究的第6天计数cd86+移行2b细胞、cd86+移行3b细胞、cd86+滤泡b细胞、和cd86+边缘区b细胞的绝对细胞数目。星号标示具有统计学显著差异的测量(*,p<0.05;**,p≤0.001)。
图21显示了对于活化的脾b细胞亚群,诸如活化的边缘区b细胞、活化的滤泡b细胞、和活化的移行3b细胞,与仅用rhgaa处理相比,细胞数目即使在用rhgaa和甲氨蝶呤处理后保持增加。箭代表用rhgaa和甲氨蝶呤处理。在第1天和第8天施用rhgaa。在第1天、第2天、和第3天,以及第8天、第9天、和第10天施用甲氨蝶呤。显著性差异由星形(*,p<0.05)表示。没有对第8天和第9天(以垂直的点线标示)显示数据。
图22显示了与仅用rhgaa处理相比,活化的脾t细胞群体,诸如活化的t辅助细胞、活化的t细胞毒性细胞、和活化的t调节细胞在用rhgaa和甲氨蝶呤处理后在很大程度上保持不变。箭代表用rhgaa和甲氨蝶呤处理。在第1天和第8天施用rhgaa。在第1天、第2天、和第3天,以及第8天、第9天、和第10天施用甲氨蝶呤。显著性差异由星形(*,p<0.05)表示。没有对第8天和第9天(以垂直的点线标示)显示数据。
图23显示了用于检查与matg组合的甲氨蝶呤处理的长6个月的研究设计。实心箭代表5mg/kgmatg注射,虚线箭代表5mg/kg甲氨蝶呤注射,而点线箭代表末期处死。
图24a-b显示了与单独的matg或三个周期的甲氨蝶呤相比,与matg结合的单个周期的甲氨蝶呤富集脾b细胞。图24a:活化的滤泡b细胞;图24b:活化的移行3b细胞。
图25a-b显示了甲氨蝶呤对阿仑单抗在血液中的药效学的影响。在有或没有与阿仑单抗的第一次施用结合的3剂每日5mg/kg/天甲氨蝶呤的情况中,用0.5mg/kg阿仑单抗处理小鼠5个月。图25a:甲氨蝶呤增强阿仑单抗(azm)对总t细胞(cd3+)、t辅助细胞(cd4+)、和t调节细胞(cd4+cd25+foxp3+)的消减。黑色柱形代表仅用阿仑单抗处理的小鼠中的测量,而白色柱形代表用阿仑单抗和甲氨蝶呤处理的小鼠中的测量。图25b:甲氨蝶呤增强阿仑单抗对b细胞的消减。星形标示具有统计学显著差异的测量(*,p<0.05)。
图26显示了甲氨蝶呤对阿仑单抗在脾中的药效学的影响。在有或没有与阿仑单抗的第一次施用结合的3剂每日5mg/kg/天甲氨蝶呤的情况中,用0.5mg/kg阿仑单抗处理小鼠5个月。t细胞在用阿仑单抗的第5次处理后消减。cd8cen:cd8+中央记忆t细胞;cd8effmem:cd8+效应记忆t细胞;cd4cenmem:cd4+中央记忆t细胞;cd4effmem:cd4+效应记忆t细胞。星形标示具有统计学显著差异的测量(*,p<0.05)。
图27a-b显示了甲氨蝶呤对脾中b细胞数目的影响。在有或没有与阿仑单抗的第一次施用结合的3剂每日5mg/kg/天甲氨蝶呤的情况中,用0.5mg/kg阿仑单抗处理小鼠5个月。星形标示具有统计学显著差异的测量(*,p<0.05)。
图28a-b显示了在单剂阿仑单抗后3天的脾淋巴细胞消减。图28a:t细胞和b细胞是显著消减的。小方格图案代表用pbs处理的对照小鼠,而大方格图案代表用阿仑单抗处理的小鼠。图28b:b细胞(cd19+)在处理后24小时时是92%消减的,并且在处理后3天仍然是36%消减的。三幅图代表不同组的动物,将每只动物在不同时间点时取血。星形标示具有统计学显著差异的测量(*,p<0.05;**,p≤0.001;***,p≤0.0001)。
图29a-b显示了甲氨蝶呤对细胞因子水平的影响。图29a显示了6个月研究的研究设计以评估脾和淋巴结中的细胞因子水平。星形标示在用阿仑单抗的第5次处理后24小时收集数据。箭标示施用阿仑单抗或甲氨蝶呤或者实施末期处死的时间点,如标示的。图29b显示了仅用阿仑单抗或用阿仑单抗和甲氨蝶呤处理的小鼠中属于tnf家族(baff)的b细胞活化因子的水平。
图30a-b显示了在用阿仑单抗和甲氨蝶呤处理后的细胞因子水平。图30a显示了4个月研究的研究设计。星形标示在甲氨蝶呤的第二个周期后1周收集数据。箭标示施用阿仑单抗或甲氨蝶呤或者实施末期处死的时间点,如标示的。图30b显示了仅用阿仑单抗(azm)或用0.5mg/kg、1.0mg/kg、或2.0mg/kg甲氨蝶呤处理的小鼠中各种细胞因子的水平。
图31显示了甲氨蝶呤对il10-/-(敲除)和c57bl/6小鼠中抗rhgaa滴度的影响。在rhgaa的头三次每周处理后0、24和48小时时,在用或不用5mg/kg/天甲氨蝶呤的情况中,在il10-/-敲除小鼠和c57bl/6野生型小鼠中每周施用20mg/kgrhgaa达9周。
图32显示了一些但不是所有脾b细胞群体在用阿仑单抗处理后的1和/或2周时消减。小阴影线柱形代表用磷酸盐缓冲盐水(pbs)处理的hucd52转基因对照小鼠;大阴影线柱形描绘了用0.5mg/kg阿仑单抗处理连续5天的hucd52转基因小鼠。星号标示具有统计学显著差异的测量(*,p<0.05;**,p≤0.001;***,p≤0.0001)。
图33显示了用于在用阿仑单抗处理的背景中检查甲氨蝶呤对b细胞群体的影响的研究设计。使用甲状腺和淋巴结(ln)进行病理学评估。箭标示施用阿仑单抗或甲氨蝶呤或者实施末期处死的时间点,如标示的。
图34显示了三剂每日单独的5mg/kg/天甲氨蝶呤、单独的0.5mg/kg阿仑单抗、和组合的0.5mg/kg阿仑单抗和5mg/kg/天甲氨蝶呤对消减b细胞群体的影响。星号标示具有统计学显著差异的测量(*,p<0.05;**,p≤0.001;***,p≤0.0001;ns,不显著)。
图35显示了在用单独的0.5mg/kg阿仑单抗或三剂每日单独的5mg/kg/天甲氨蝶呤或组合的0.5mg/kg阿仑单抗和5mg/kg/天甲氨蝶呤的5个处理周期后甲氨蝶呤对b细胞消减的影响。星号标示具有统计学显著差异的测量(*,p<0.05)。
图36显示了细胞因子mcp-1、il-13、il-6、和il-12的水平在用阿仑单抗处理的第一天施用的5mg/kg甲氨蝶呤的3天单个周期处理的小鼠中降低。在用甲氨蝶呤处理后4个月,在第5剂阿仑单抗后24小时收集数据。
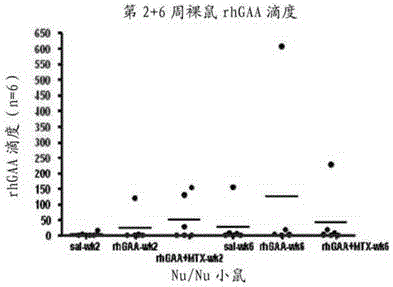
图37a-b显示了nu/nu裸鼠中第2周、第6周、和第12周的rhgaa滴度。图37a显示了第2周和第6周的rhgaa滴度。从左至右,用盐水处理的对照小鼠、用rhgaa处理的小鼠、和用rhgaa和甲氨蝶呤处理的小鼠中的第2周测量,接着是用盐水处理的对照小鼠、用rhgaa处理的小鼠、和用rhgaa和甲氨蝶呤处理的小鼠中的第6周测量。图37b显示了(从左至右)仅用rhgaa(myo)处理的nu/nu小鼠、用甲氨蝶呤和rhgaa处理的nu/nu小鼠、仅用rhgaa处理的bl6小鼠、和用甲氨蝶呤和rhgaa处理的bl6中的第12周测量。
图38a-b显示了il-10表达b10b细胞的数目和百分比在用甲氨蝶呤实现针对rhgaa耐受的小鼠中增加。通过流式细胞术对自用rhgaa或rhgaa和甲氨蝶呤处理的动物分离的b10b细胞评估il-10蛋白质表达。
图39a-b显示了il-10在活化的(cd86+)和非活化的(cd86-)b10b细胞两者中表达。图39a描绘了用cd86染色的b10b细胞的facs图,而图39b描绘了响应用rhgaa或rhgaa和甲氨蝶呤处理的cd86+il10+b10b细胞和cd86-il10+b10b细胞的数目。
图40a-b显示了与rhgaa一起的甲氨蝶呤处理诱导b10b细胞提高其tgf-β表达。图40a的第二幅和第三幅小图是facs图,其显示了来自用rhgaa或rhgaa和甲氨蝶呤处理的动物的用tgf-β和cd86染色的b10b细胞。图40a的第一幅小图描绘了用rhgaa或rhgaa和甲氨蝶呤处理的动物中tgf-β+b10b细胞的数目。图40b描绘了cd86+tgf-β+b10b细胞和cd86-tgf-β+b10b细胞计数。
图41a描绘了b10b细胞表现为在用rhgaa处理的动物中表达foxp3(图41a)。图41b描绘了foxp3+b细胞数目在甲氨蝶呤和rhgaa两者处理的情况中增加。图41c描绘了活化的(cd86+)和非活化的(cd86-)b10b细胞表达foxp3。
图42a-c显示了滤泡、移行2、和移行3b细胞(顶部至底部)表达il-10,并且与仅用rhgaa处理的小鼠相比,il-10表达b细胞子集的细胞数目在甲氨蝶呤的情况中增加。
图43a-c显示了滤泡、移行2、和移行3b细胞(顶部至底部)表达tgf-β,并且与仅用rhgaa处理的小鼠相比,tgf-β表达b细胞子集的细胞数目在甲氨蝶呤的情况中增加。
图44a-c显示了显示了滤泡、移行2、和移行3b细胞(顶部至底部)表达foxp3,并且与仅用rhgaa处理的小鼠相比,foxp3表达b细胞子集的细胞数目在甲氨蝶呤的情况中增加。
图45显示了在存在或缺乏5mg/kg抗tgf-β抗体(1d11,genzyme)或同种型对照(13c4)的情况中用rhgaa或rhgaa和甲氨蝶呤处理的动物中在第6周的抗rhgaa滴度。在不同的四组动物中两周一次评估抗体滴度。
图46a-c显示了1d11处理干扰甲氨蝶呤诱导的表达tgf-β、il-10、或foxp3的b10b细胞扩充。从用rhgaa或rhgaa和甲氨蝶呤处理,并在单次rhgaa处理或单次rhgaa和甲氨蝶呤处理后7天还共施用1d11或13c4的动物分离脾。然后,将每组中的细胞合并,并培养2天,然后使用流式细胞术计数。
图47a-c显示了1d11处理干扰甲氨蝶呤诱导的表达tgf-β或il-10的滤泡b细胞扩充,尽管foxp3+滤泡b细胞不表现为经历1d11效应。从用rhgaa或rhgaa和甲氨蝶呤处理的动物分离脾,所述动物在单次rhgaa处理或单次rhgaa和甲氨蝶呤处理后7天还共施用1d11或13c4。然后,将每组中的细胞合并,并培养2天,然后使用流式细胞术计数。
图48a-c显示了在移行2b细胞中,虽然1d11处理干扰甲氨蝶呤诱导的tgf-β表达移行2b细胞扩充,但是没有对il-10+移行2b细胞看到效应。从用rhgaa或rhgaa和甲氨蝶呤处理,并在单次rhgaa处理或单次rhgaa和甲氨蝶呤处理后7天还共施用1d11或13c4的动物分离脾。然后,将每组中的细胞合并,并培养2天,然后使用流式细胞术计数。
图49a-c显示了在移行3b细胞中,存在有可检测的tgf-β、il-10和foxp3,但是1d11处理对细胞没有明显影响。从用rhgaa或rhgaa和甲氨蝶呤处理,并在单次rhgaa处理或单次rhgaa和甲氨蝶呤处理后7天还共施用1d11或13c4的动物分离脾,并使用流式细胞术对细胞计数。
图50a-c显示了1d11处理不影响滤泡b细胞、移行2b细胞和移行3b细胞(顶部至底部)中的il-10、tgf-β、和foxp3的基础水平。
图51a是一幅示意图,其显示了将来自对rhgaa(
图51b显示了滴度分析,其证明了自用rhgaa和单个周期的甲氨蝶呤处理的动物分离的总脾b细胞可以在未接触
图52描绘了来自用家兔igg(rbigg)、单独的matg、rbigg和甲氨蝶呤、或matg和甲氨蝶呤处理的正常小鼠的血液或脾的细胞计数。甲氨蝶呤在正常动物中没有消减cd4+、cd8+、t调节(cd4+cd25+foxp3+)t细胞、或总cd19+b细胞。
图53描绘了来自在移植后14天用rbigg、单独的matg、rbigg和甲氨蝶呤、或matg和甲氨蝶呤处理的移植小鼠的血液或脾的细胞计数。甲氨蝶呤在移植动物中没有消减cd4+、cd8+、t调节(cd4+cd25+foxp3+)t细胞、和总cd19+b细胞。
图54显示了甲氨蝶呤处理诱导多个细胞子集中il-10的统计学显著增加,如通过在用rhgaa或rhgaa和甲氨蝶呤处理的动物中这些蛋白质的均值荧光强度(mfi)的变换观察到的。
图55显示了甲氨蝶呤处理诱导多个细胞子集中tgf-β的统计学显著增加,如通过在用rhgaa或rhgaa和甲氨蝶呤处理的动物中这些蛋白质的均值荧光强度(mfi)的变换观察到的。
图56显示了甲氨蝶呤处理诱导多个细胞子集中foxp3的统计学显著增加,如通过在用rhgaa或rhgaa和甲氨蝶呤处理的动物中这些蛋白质的均值荧光强度(mfi)的变换观察到的。
发明详述
本发明基于我们的令人惊讶的发现,即单个周期或短疗程的甲氨蝶呤施用降低接受蛋白质治疗剂(诸如替换酶或治疗性抗体)的患者中不想要的免疫应答(诸如ada应答,和其它不想要的t和/或b细胞介导的免疫应答),和组织移植中的抗移植物抗体应答。此发现导致用于提高蛋白质疗法和器官移植的安全性和效力两者的新方法。
更具体地,我们的研究已经显示了单个周期的甲氨蝶呤降低针对抗体治疗剂的ada。如下文详述的,用一种鼠型式的多克隆抗体治疗剂即
我们已经发现了甲氨蝶呤的此单个周期方案还降低蛋白质治疗剂是酶的情况中的ada。在我们的两项研究中,我们证明了单个周期的甲氨蝶呤可以有效控制抗
我们已经发现了甲氨蝶呤也可用于器官移植。在我们的研究中,我们发现了单个周期的甲氨蝶呤可以控制心脏异基因移植物移植中的抗异基因移植物抗体应答。在与matg组合时,心脏异基因移植物的存活显著更长。
我们的研究显示了蛋白质疗法的第一周内给予单个周期的甲氨蝶呤可以提供多个月的剂量给药里ada长时间的大于95%的降低。此抗体滴度降低是长时间的,尽管贯穿大部分研究缺乏甲氨蝶呤。此外,我们已经发现了单个周期的甲氨蝶呤可以控制抗异基因移植物应答(例如在鼠异基因心脏移植物模型中),显示了同时控制针对多种抗原的抗体应答。
经典地,已知甲氨蝶呤是二氢叶酸还原酶拮抗剂,认为其通过抑制嘌呤代谢并且干扰重新dna合成来杀死增殖细胞(kremer,arthritisrheum,50(5):1370-82(2004))。可以容易假设,经由此充分描述的机制,甲氨蝶呤仅可以杀死反应性细胞,但是这在我们已经发现的单个周期方案的情况中似乎不太可能。甲氨蝶呤具有较短的半衰期,并且在细胞或循环中不太可能长得足以在处理后3至4个月仍活跃杀死细胞(walling,investnewdrugs,24(1):37-77(2006);slavikova等,neoplasma,25(2):211-6(1978))。此外,我们没有发现甲氨蝶呤处理后淋巴细胞消减的证据。更确切地,令人惊讶地,我们已经发现了甲氨蝶呤的单个周期方案通过诱导免疫控制的活性机制,不是通过无差别消减淋巴细胞来降低不想要的抗体应答。
我们的研究显示了单个周期的甲氨蝶呤增加b10调节b细胞及活化的边缘区b细胞、活化的滤泡b细胞和活化的移行3b细胞。我们的研究还显示了单个周期的甲氨蝶呤增加il-10表达、tgf-β表达、和foxp3表达b10、滤泡、移行2和移行b细胞的数目,且此扩充是由tgf-β介导的。这些研究还显示了甲氨蝶呤提高il-10、tgf-β、和foxp3的表达水平。鉴于目前对甲氨蝶呤的作用机制的了解,脾b细胞群体的扩充是令人惊讶的,并且提示了在此剂量给药示例中,甲氨蝶呤以独特的、先前未知的方式起作用。已经显示了在经英夫利昔单抗治疗的类风湿性关节炎患者中较低连续剂量的甲氨蝶呤降低抗英夫利昔单抗抗体应答;但因为暴露是连续的,此方案较有可能牵涉持续的免疫抑制,而不是耐受性诱导。已经显示了单独的甲氨蝶呤处理在以低剂量每周给予时在类风湿性关节炎中降低疾病活性。最近的出版物提示了连续施用低剂量甲氨蝶呤(每隔一天)后,出现自身抗原特异性t调节细胞,其可以帮助解释甲氨蝶呤处理在类风湿性关节炎中的效力(xinqiang等,biomedpharmacother,64(7):463-471(2010))。比较而言,本文中对甲氨蝶呤描述的剂量给药示例是真正独特的,因为它牵涉较短疗程的甲氨蝶呤处理,其可以提供对不想要的免疫学应答的长期控制。
总之,我们已经鉴定出独特的甲氨蝶呤剂量给药方案,其可以对几种不同类型的ada应答和组织移植中的抗异基因移植物抗体应答,及t细胞和b细胞应答产生长期控制。我们已经发现了可以将由甲氨蝶呤形成的免疫耐受性从一只动物转移至另一只,例如通过将来自耐受化动物的b细胞移植至非耐受化动物进行。我们的数据提示了甲氨蝶呤经由独特的作用机制起作用,该作用机制牵涉扩充活化的b细胞子集,该活化的b细胞子集可以代表在抑制免疫应答中有活性的调节b细胞。此外,甲氨蝶呤也可以经由t调节细胞扩充机制起作用。
生物疗法中不想要的免疫应答
本发明的方法可以控制多种生物学疗法(例如使用生物制剂,诸如蛋白质、核酸、碳水化合物、脂质和代谢物的疗法)中不想要的免疫学应答(例如ada应答,和其它不想要的t和/或b细胞介导的免疫应答)。蛋白质疗法指治疗剂是蛋白质性物质(包括肽和蛋白质)的疗法。例如,蛋白质治疗剂可以是酶、细胞因子、生长因子、免疫调节剂、溶血栓药、抗体(包括多克隆和单克隆抗体)、抗体片段或经修饰的抗体(例如fab、f(ab’)2、fv、fd、scfv、和dab)。例如,已经针对具有某些遗传疾病的患者开发出许多酶替换疗法,包括用于法布里(fabry)病的
在许多情况中,在患者中可以产生不想要的针对蛋白质治疗剂的免疫应答,这对患者结果引起可变的影响。此类应答由于生物制剂治疗剂经常含有对于人患者而言外来的序列和构象而发生。例如,ada干扰治疗剂效力和/或增加安全性风险。ada可以引起超敏感性反应、过敏反应、血清病、免疫复合物病(immunecomplexdisease)、急性肾衰竭。临床医生可以使用完善确立的方法(包括elisa和免疫组织化学)在接受蛋白质疗法的患者中监测ada。
在一些情况中,如本文中使用的,“蛋白质疗法”指病毒疗法,其中使用病毒载体来投递核酸治疗剂。此类疗法中使用的例示性病毒包括但不限于腺病毒、腺伴随病毒、和逆转录病毒。可以形成针对病毒的壳体蛋白的抗体,这降低此类疗法的效力并且增加安全性风险。本发明的方法也可用于控制病毒疗法中不想要的免疫学应答(例如ada应答,和其它不想要的t和/或b细胞介导的免疫应答)。
本发明的方法也可以控制非蛋白质生物学疗法中不想要的免疫学应答。例示性的非蛋白质生物疗法包括但不限于核酸疗法(例如反义疗法、sirna疗法、和mirna疗法)。
移植中的抗移植物应答
也可以使用本发明的方法在接受组织移植(诸如肾移植、肝移植、心脏移植、和干细胞移植)的患者中诱导免疫耐受性。宿主抗移植物和移植物抗宿主排斥经常在组织移植(尤其是异基因移植物和异种移植物移植)中发生。可以单独或与另一种免疫调控剂(例如免疫抑制剂诸如
用甲氨蝶呤管理不想要的免疫学应答
我们已经发现了单个短周期的甲氨蝶呤可以显著降低接受生物制剂治疗剂(例如蛋白质治疗剂)的受试者中不想要的免疫学应答诸如ada和接受组织移植的患者中的抗异基因移植物应答。降低不想要的ada不仅可以改善患者安全性,而且还可以经由改善蛋白质治疗剂的药效学和/或药动学改善蛋白质治疗剂的效力。
甲氨蝶呤(一种小分子化合物)已经用于治疗患有重度活动性类风湿性关节炎、重度银屑病、和某些类型的癌症,包括在子宫中受精卵周围形成的组织中开始的癌症、乳腺癌、肺癌、某些头和颈癌、某些类型的淋巴瘤、和白血病(在白细胞中开始的癌症)的患者。甲氨蝶呤通过减缓癌细胞生长来治疗癌症。甲氨蝶呤通过减缓皮肤细胞生长以停止鳞屑形成来治疗银屑病。甲氨蝶呤可以通过降低免疫系统的活性来治疗类风湿性关节炎。
已经在控制针对α-半乳糖苷酶a和α-葡糖苷酶引发的ada应答的背景中研究甲氨蝶呤。然而,那些研究是用多个周期的甲氨蝶呤处理(garman等,clinexpimmunol,137(3):496-502(2004);joseph等,clinexpimmunol,152(1):138-46(2008);mendelsohn等,nengljmed,360(2):194-5(2009)),而不是单个周期的甲氨蝶呤完成的。
令人惊讶地,我们的研究显示了单个周期的甲氨蝶呤足以显著降低ada和抗异基因移植物抗体。实际上,在牵涉抗体治疗剂(例如matg)的研究中,我们显示了单个周期的甲氨蝶呤处理比多个周期的甲氨蝶呤处理在降低ada上更有效。使用甲氨蝶呤的先前研究没有给出如下的指示,即单个周期的甲氨蝶呤会足以诱导降低ada,更不用说,它比多个周期处理更有效。已知甲氨蝶呤是细胞毒性的。因此,若假设通过甲氨蝶呤降低ada的机制依赖于此特性,则预测降低治疗周期数目实际上会降低甲氨蝶呤的有益效果。此外,那些先前发表的研究没有证明甲氨蝶呤处理对药动学、药效学、效力、或安全性的益处,如本文中已经用单个疗程的甲氨蝶呤令人惊讶地证明的。它们也确实没有披露甲氨蝶呤可以降低抗体疗法中的ada。
如本文中使用的,单个周期方案指连续或非连续几天的治疗方案或治疗单元,并且优选地,在主要蛋白质治疗剂的剂量给药或移植后不超过5(例如不超过3)天时开始。若将主要蛋白质治疗剂在多个时期中剂量给药,则优选地,单个周期的甲氨蝶呤处理不延伸过蛋白质治疗剂剂量给药的第一个时期。举例而言,在每周、每月或每年蛋白质疗法中,单个周期的甲氨蝶呤由在第0天,即第一次对患者给予主要蛋白质治疗剂,或患者接受组织移植的日期开始连续三天的甲氨蝶呤摄取(例如口服)组成。然后,患者在第1天(24小时后)和第2天(48小时后)接受一剂甲氨蝶呤。例如,单个周期的甲氨蝶呤也可以由在第0天开始的2、3、4、5、6、7、或8个连续每日剂量的甲氨蝶呤组成。甲氨蝶呤也可以在认为适当的其它时间时施用,例如在例如淋巴细胞消减疗法中管理继发性自身免疫时。优选地,单个周期的甲氨蝶呤不持续长于8天。在一些实施方案中,单个周期的甲氨蝶呤在主要治疗性处理(即,用生物制剂治疗剂处理)开始之前48小时和之后48小时之间开始。例如,单个周期的甲氨蝶呤可以在主要治疗性处理开始之前48小时,之前36小时,之前24小时,之前12小时,同时,之后12小时,之后24小时,之后36小时,或之后48小时开始。
令人惊讶地,我们的研究还显示了低剂量的甲氨蝶呤足以管理蛋白质疗法和移植中不想要的免疫学应答(例如ada应答,和其它不想要的t和/或b细胞介导的免疫应答)。因而,在本发明的实施方案中,可以在超过一个周期中,但是以较低的总剂量施用甲氨蝶呤。例如,可以在患者中在两个或更多个(例如3、4、5、6,等等)周期中,但是以不超过5mg/kg的总组合剂量施用甲氨蝶呤。
甲氨蝶呤的剂量会是甲氨蝶呤在单个周期中给予时在降低不想要的免疫学应答(诸如抗体或细胞应答)中的有效量。甲氨蝶呤在人患者中的有效量可以在0.05mg/kg至5mg/kg的范围中。在一些实施方案中,有效量是0.1mg/kg至1.5mg/kg。在一些实施方案中,有效量是0.12mg/kg至1.28mg/kg。在某些实施方案中,有效量是0.12mg/kg。在某些实施方案中,有效量是1.28mg/kg。推荐剂量的甲氨蝶呤可以引起最小限度的安全性风险,因为剂量给药方案仅牵涉短暂疗程的甲氨蝶呤,其的剂量水平比低新生物剂量更类似于用于类风湿性关节炎的剂量。在我们的研究中,在小鼠中在每个周期中测试的甲氨蝶呤的总量是14或15mg/kg。小鼠中的14mg/kg甲氨蝶呤大致等于重量为60kg的平均成年人中的68mg或5.92mg/m2。类风湿性关节炎患者可以在不遭受相当多毒性的情况中每周接受多至25mg甲氨蝶呤。认为甲氨蝶呤的低新生物剂量是30mg/m2,其显著高于5.92mg/m2。如此,与此甲氨蝶呤方案的短暂性质组合,上文推荐的剂量在成年人中可能是耐受良好的。考虑患者的身体状况、年龄、重量、性别、他/她在服用的其它药物及其已知的副作用和任何其它相关因素,甲氨蝶呤的确切剂量和方案当然应当由临床医生建立。可以通过公知的方法监测甲氨蝶呤在管理患者中不想要的抗体应答方面的效果,所述公知的方法包括患者的临床检查、症状、测定ada或抗异基因移植物抗体滴度的血液测试、免疫组织化学测定法(例如c4沉积测定法和其它固相抗体检测方法诸如酶联免疫吸附测定法(elisa)和基于珠的荧光测量测定法)。也可以通过测量生物标志物诸如mcp-1、il-13、il-6、和il-12(我们已经显示了它们的水平因甲氨蝶呤处理而降低),和移行2b细胞、移行3b细胞、滤泡b细胞、边缘区b细胞、b10b细胞、和b1b细胞(我们已经显示了它们的数目因甲氨蝶呤处理而增加)的水平监测效果。另外,在需要时,可以使用tgf-β、foxp3、il-5、il-10、il-15、和gm-csf作为生物标志物来监测甲氨蝶呤对不想要的免疫应答的影响。也可以使用生物标志物的水平来监测甲氨蝶呤对t细胞对治疗剂(例如蛋白质治疗剂)的响应性的影响。也可以监测t细胞活化的生物标志物诸如il-2、干扰素-γ、和tnf-α作为甲氨蝶呤对t细胞应答的影响的读出。
由于其控制不想要的免疫应答的能力,本发明的单个周期甲氨蝶呤方案可以扩展许多蛋白质治疗剂的用途,所述蛋白质治疗剂在给定患者中的重复使用过去由于安全性和效力忧虑而受到限制。例如,甲氨蝶呤与
用甲氨蝶呤改善淋巴细胞消减疗法
本发明的一项例示性应用是在治疗多发性硬化(ms)(诸如复发-缓解性ms)中使用甲氨蝶呤来改善淋巴细胞消减疗法(诸如阿仑单抗疗法)。“淋巴细胞消减”是一类通过减少循环淋巴细胞(例如t细胞和/或b细胞),导致淋巴细胞减少的免疫抑制。在治疗上,可以通过蛋白质治疗剂诸如
淋巴细胞消减疗法可以引起继发性自身免疫。自身免疫当其在第一(“原发性”)疾病(例如“原发性”自身免疫性疾病)的发作后出现时在本文中称为“继发性自身免疫”。继发性自身免疫有时在例如淋巴细胞消减疗法后具有或已经具有淋巴细胞减少的ms患者中出现。在一些个体中,继发性自身免疫在淋巴细胞消减疗法(例如用阿仑单抗治疗)后不久出现。在其他个体中,继发性自身免疫可以直到淋巴细胞消减疗法后几个月或几年才出现;在那些个体中的一些中,到他们形成继发性免疫时,可以已经发生实质性淋巴细胞恢复(总淋巴细胞计数),使得他们可能不再是淋巴细胞减少的。在用抗体治疗剂或小分子治疗剂治疗的背景中可以发生淋巴细胞消减。
在淋巴细胞减少性ms患者中出现的继发性自身免疫可以是与ms不同的任何类型的自身免疫性状况,包括但不限于甲状腺自身免疫(例如格雷夫斯(graves)氏病)、血小板减少性紫癜(thrombocytopenicpurpura)、免疫性血小板减少症(immunethrombocytopenia,itp)、古德帕斯彻(goodpasture)氏病、自身免疫性嗜中性白血球减少症(autoimmuneneutropenia)、自身免疫性溶血性贫血(autoimmunehemolyticanemia)、和自身免疫性淋巴细胞减少(autoimmunelymphopenia)。在一些实施方案中,继发性自身免疫是b细胞介导的,即b细胞应答和自身抗体与疾病形成和病理学直接联系。
用于诊断和监测这些自身免疫性疾病的技术是本领域技术人员公知的,包括评估症状和医学检查诸如血液分析。本发明涵盖任何已知方法的使用。例如,可以测定患者体液(例如血液)中的自身抗体水平作为检测自身免疫体征的手段。具体地,可以测量抗核抗体、抗平滑肌抗体、和抗线粒体抗体。如果检测抗核抗体,那么可以实施别的测定法以测量抗双链dna抗体、抗核糖核蛋白抗体、和抗la抗体。可以测量抗甲状腺过氧化物酶(tpo)和抗促甲状腺激素(tsh)受体抗体以检测自身免疫性甲状腺疾病;若检测抗tpo或抗tsh受体抗体,则可以通过测量游离的t3、游离的t4和tsh水平测量甲状腺功能是否受到影响。可以测量抗血小板抗体以检测自身免疫性血小板减少,并且血液血小板水平的测量可以用来测定抗血小板抗体的存在是否引起血小板数目减少。还可见wo2010/041149。
可以使用本发明的单个周期甲氨蝶呤方案通过降低ada以及使继发性自身免疫最小化来改善淋巴细胞消减疗法的安全性和效力。不希望限于理论,我们认为甲氨蝶呤可以通过同时耐受多种自身抗原来降低继发性自身免疫。
除非另有定义,本文中使用的所有技术和科学术语与本发明所属领域的普通技术人员的通常理解具有相同的意义。虽然与本文中描述的那些方法和材料相似或等同的方法和材料也可以用于实施或测试本发明,下文描述了例示性的方法和材料。通过提及将本文中提及的所有出版物和其它参考文献完整收录。在冲突的情况中,应当以本说明书(包括定义)为准。虽然本文中引用许多文件,但是此引用不构成承认,任何这些文件形成本领域的公知常识的一部分。贯穿本说明书和权利要求书,词语“包含”或变型应当理解为暗示包括陈述的整数或整数组,但不排除任何其它整数或整数组。材料、方法和例子仅是例示性的,而并不意图为限制性。
实施例
本发明的更多详情会在以下非限制性实施例中描述。应当理解,虽然指示本发明的优选实施方案,这些实施例仅作为例示给出,而不应解释为限制所附实施方案。从本公开内容和这些实施例看,本领域技术人员可以确定本发明的某些特征,且在不偏离其精神和范围的前提下,可以对本发明做出各种变化和修饰以使其适合于各种用途和条件。这些工作例中使用的材料和方法如下描述。
小鼠
6和12周龄之间的正常雌性c57bl/6小鼠用于家兔抗鼠胸腺细胞球蛋白多克隆抗体(matg)的体内研究,并且获自jacksonlaboratories(barharbor,me)或taconiclaboratories(hudson,ny)。阿仑单抗相关研究采用6-12周龄的人cd52(hucd52)转基因(tg)小鼠,其获自charlesriverlaboratories/genzymecorp。依照实验室动物护理和使用指南(guideforcareanduseoflaboratoryanimals)且在美国实验室动物护理认可协会i认可下将小鼠收容并维持,并且这些研究中使用的所有动物方案得到机构动物护理和使用委员会批准。
用于非临床药理学研究的hucd52tg小鼠由xenogen(cranbury,nj,usa)生成。为了生成所述小鼠,将含有来自人染色体1的约145个千碱基的基因组dna的杆粒构建体随机整合入cd-1胚胎干细胞的小鼠基因组中。依靠此杆粒含有的人基因组dna跨距,在人cd52外,构建体包含总共5个未知功能的部分或完整基因。杆粒中含有的5个部分或完整基因区段如下:人cd52基因、新基因(dkfzp434l0117)的3’端、sh3bgrl3基因(sh3域结合富含脯氨酸的蛋白样3)、伙伴(socius)基因(soc)、aim1l(黑素瘤缺乏1样)基因、和锌指蛋白683基因。生成3种建立者系,并且系107在genzyme建立。
抗体施用
如ruzek等,transplantation,88(2):170-9(2009)中描述的那样制备多克隆抗体matg和rbigg,并根据实验在多个方案中通过腹膜内注射施用。以0.5mg/kg的单次注射或者在0.5mg/kg/天的3或5天周期中静脉内施用单克隆抗体阿仑单抗。
作为配制的药物产品,使用重组人阿葡糖苷酶α(rhgaa,由genzymecorp.以
甲氨蝶呤处理
通过腹膜内注射以0.5、1.0、2.0或5mg/kg施用甲氨蝶呤(calbiochem产品目录编号#454125)1-3个周期,其中根据实验,每个周期等于注射连续3、6或7天。在牵涉每月matg处理的研究中,在初始matg处理或头三次matg处理后0、24、和48小时时以5mg/kg腹膜内施用甲氨蝶呤。在第0天和第4天服用matg的移植物研究中,每日以2mg/kg从第0天至第6天,每日以0.5mg/kg从第0天至第6天,或每日以0.5mg/kg从第0天至第11天给予甲氨蝶呤。
matg处理
以每四周的5mg/kg腹膜内注射或者以在用移植物当天(第0天)给予的第一剂的移植物背景中时以相隔4天给予的两剂20mg/kg施用多克隆抗体matg。
来自各种组织的细胞制备物
对于脾细胞和淋巴结细胞制备物,通过磨砂玻璃载玻片间均质化入含有2%fcs的pbs中,从收获的小鼠脾或腹股沟和肠系膜淋巴结生成单细胞悬浮液。对于脾细胞制备物,通过与红细胞裂解溶液(bdbiosciences,sandiego,ca)一起温育1-2分钟裂解红细胞。通过眶后取血分离血液,并通过用红细胞裂解溶液(bdbiosciences)将红细胞裂解20-30分钟实施细胞制备。对于所有组织制备物,使用vicell自动化计数器(beckmancoulter,fullerton,ca)计数活细胞。在分离后,在下文描述的测定法中使用前,用pbs/2%fcs清洗所有细胞制备物。
流式细胞术
为了评估不同组织内的细胞群体,将组织的单细胞悬浮液与缀合有荧光染料的抗体一起温育,所述抗体包括抗小鼠cd4、cd8、cd25、cd44、cd62l(所有抗体来自bdbiosciences或ebioscience,sandiego,ca)。依照抗foxp3制造商的方案(ebiosciences,sandiego,ca)实施胞内foxp3表达分析。在与抗体一起温育后,将细胞清洗,并通过流式细胞术(facscanto,bdbiosciences和fcsexpress软件,denovo软件,losangeles,ca)分析。
如下定义评估的细胞群体:
总cd4t细胞:cd4+cd8-,
总cd8t细胞:cd8+cd4-,
cd4未免疫细胞:cd4+cd25-cd62l+cd44-,
cd4记忆细胞:cd4+cd25-cd62l-cd44+,
未免疫cd8t细胞:cd8+cd44-cd62l+,
cd8记忆细胞:cd8+cd44+cd62l-,
调节t细胞:cd4+cd25+foxp3+,
总b细胞:cd19+,
b2/滤泡b细胞:cd19+cd21intcd23高,
b1b细胞:cd19+cd43+cd11b+,
移行1b细胞:cd19+cd93+cd23-igm高,
移行2b细胞:cd19+cd93+cd23+igm高,
移行3b细胞:cd19+cd93+cd23+igm低,
边缘区b细胞:cd19+cd21高cd23低,和
b10b细胞:cd19+cd5+cd1d+。
体外阻断研究测定多至100μg/mlmatg没有阻止这些群体的检测。
抗matgiggelisa
通过酶联免疫吸附测定法(elisa)分析小鼠血清中抗matgigg的水平。简言之,用磷酸盐缓冲盐水(pbs)中1μg/ml家兔igg包被96孔板(corninginc.,corning,ny,usa)过夜。在用superblock封闭缓冲液(thermoscientific,rockford,il,usa)封闭后,将血清的连续稀释液一式两份添加至经家兔igg包被的板,并于37℃温育1小时。将板清洗,并添加缀合有辣根过氧化物酶的山羊抗小鼠igg二抗(southernbiotechnologyassociates,birmingham,al,usa),并容许于37℃温育1小时。在最终清洗后,添加3,3’,5,5’-四甲基联苯胺底物(biofx,owingsmills,md,usa),并容许于室温显现15分钟。通过添加1nhcl停止反应,并在elisa读板仪(moleculardevices,sunnyvale,ca,usa)上于450/650nm阅读吸光度数值。终点滴度定义为使用softmax软件(moleculardevices,sunnyvale,ca,usa)得到的平均值为高于0.100吸光度的最低稀释度。
matg特异性iggelisa
通过elisa测定小鼠血清。简言之,用1μg/ml山羊抗家兔igg-fc片段抗体(bethyllaboratories,tx,usa)将96孔板(corninginc.,corning,ny,usa)包被过夜。用0.5%bsa(高纯度)封闭后,在必要时稀释标准对照和血清样品,并将其一式两份添加至经包被板的孔,并于36-38℃在温和摇动的情况中温育1小时。将板清洗,并在适当时添加缀合有辣根过氧化物酶的山羊抗家兔igg-fc片段抗体(bethyllaboratories,tx,usa),并于36-38℃在温和摇动的情况中温育1小时。在最终清洗后,添加3,3’,5,5’-四甲基联苯胺底物(biofx,owingsmills,md,usa),并容许于23-25℃显现15分钟。通过添加1nhcl停止反应,并在elisa读板仪(moleculardevices,sunnyvale,ca,usa)上于450/650nm阅读吸光度数值。对标准曲线内推最终浓度。预先确定的是,通过此方法测量matg特异性igg仅受到大于218,000的抗matgigg滴度中度影响。
抗阿仑单抗iggelisa
在阿仑单抗处理后4-6天对小鼠取血,并通过elisa测量特异性抗阿仑单抗igg。简言之,用pbs(ph7.2)中的3μg/ml阿仑单抗将96孔板(corninginc.,corning,ny,usa)包被过夜。在用pbs中的0.1%bsa封闭后,将血清的连续稀释液一式两份添加至经阿仑单抗包被的板,并于37℃温育1小时。将板清洗,并添加缀合有辣根过氧化物酶的山羊抗小鼠igg二抗(southernbiotechnologyassociates,birmingham,al,usa),并容许于37℃温育1小时。在最终清洗后,添加tmb底物(biofx,owingsmills,md,usa),并容许于室温显现15分钟。通过添加1nhcl停止反应,并在elisa读板仪(moleculardevices,sunnyvale,ca,usa)上于450/650nm阅读吸光度数值。终点滴度定义为使用excel软件(microsoft,redmond,wa,usa)得到的经对数换算的在吸光度数值0.2处插入的样品稀释度的逆对数。
抗rhgaaiggelisa
在rhgaa处理后4-6天对小鼠取血,并通过elisa测量特异性igg。简言之,用乙酸钠缓冲液(ph5.0)中的5μg/mlrhgaa将96孔板(corninginc.,corning,ny,usa)包被过夜。在用pbs中的0.1%bsa封闭后,将血清的连续稀释液一式两份添加至经rhgaa包被的板,并于37℃温育1小时。将板清洗,并添加缀合有hrp的山羊抗小鼠igg二抗(southernbiotechnologyassociates,birmingham,al,usa),并容许于37℃温育1小时。在最终清洗后,添加3,3’,5,5’-四甲基联苯胺底物(tmb,kpl,gaithersburg,md),并容许于室温显现15分钟。通过添加1nhcl停止反应,并在elisa读板仪(moleculardevices,sunnyvale,ca)上于450/650nm阅读吸光度数值。终点滴度定义为使用softmax软件(moleculardevices,sunnyvale,ca)得到的产生吸光度数值0.2的样品稀释度的倒数。
离体研究
通过腹膜内注射1-3个周期对8-12周龄的c57bl/6(jacksonlaboratories)或e4gaako(charlesriver)小鼠给予5mg/kg甲氨蝶呤(calbiochem产品目录编号#454125),其中1个周期等于连续注射3天。以第一剂甲氨蝶呤开始,通过尾静脉注射给予20mg/kg
体外和细胞因子分析
以用20mg/kgrhgaa处理开始,通过腹膜内注射对8-12周龄的c57bl/6(jacksonlaboratories)或e4gaako(charlesriver)小鼠给予5mg/kg甲氨蝶呤(calbiochem产品目录编号#454125)达1个周期(连续3个每日剂量)。对于1d11研究,以rhgaa和甲氨蝶呤处理开始,每周3次(每隔一天)用5mg/kg1d11或13c4(genzymecorporation)的腹膜内注射处理动物。根据小鼠品系,在rhgaa启动后第6天或第7天处死动物。将脾制备为单细胞悬浮液,并依照制造商的用法说明书加载至robosep(stemcelltechnologies)仪上,并进行b细胞负选择。将纯化的b细胞在96孔圆底板(costar产品目录编号#3799)中以每孔500,000个细胞接种,并于37℃在无刺激的情况中或与10μg/mllps(sigma产品目录编号#l5014)一起温育48小时。依照制造商的用法说明书,所有孔接受莫能菌素(monensin)(bdbioscience产品目录编号#554724)。容许细胞于37℃温育至少4小时。将样品转移至v底孔(usascientific产品目录编号#651201),并于4℃以1200rpm旋转5分钟。将细胞在200μl含有4%胎牛血清和25μg/ml总小鼠igg的pbs中重悬,并于4℃封闭30分钟。将板再次旋转,并在添加10μl上文描述的抗体混合物的情况中在90μlpbs/2%fcs中重悬,并于4℃温育20分钟,对于最后10分钟的染色规程,添加5μl7aad。将100μl缓冲液添加至样品及随后的旋转用作清洗。可以将样品在缓冲液中重悬以进行蛋白质表面分析和立即获取或者在fix/perm(ebioscience产品目录编号#11-5773)中重悬以依照制造商的用法说明书进行il-10(biolegend产品目录编号#505008)、tgf-β(biolegend产品目录编号#141404)和foxp3(ebioscience产品目录编号#11-5773-82)的胞内染色。别的表面染色包括tgf-β和tim-1(biolegend产品目录编号#119506)抗体。如上文描述的那样获得并分析所有样品。
动物和心脏异基因移植物模型
c57bl/6和balb/c小鼠获自charlesriver(kingston,ny或raleigh,nc),并在8和13周龄之间在这些实验中使用。首先用氯胺酮(fortdodgeanimalhealth/pfizer,fortdodge,ia)和甲苯噻嗪(lloyd,shenandoah,ia)的腹膜内注射麻醉供体异体c57bl/6小鼠,并实施正中胸骨切开术。经由下腔静脉给供体心脏缓慢原位输注1ml冷肝素化林格(ringer)氏乳酸盐溶液(baxterhealthcare,deerfield,il),并将上腔静脉前的主动脉和肺静脉结扎并分开。然后,横切升主动脉和肺动脉,从供体取出移植物,并将心脏在冰冷的盐水中贮存,直至嫁接。将接受小鼠(balb/c)类似麻醉并准备,如上文对供体小鼠描述的,只是打开腹腔。使用手术显微镜观察打开的腹腔,分离腹主动脉(aa)和下腔静脉(ivc)。将供体心脏放入接受者腹部中(颠倒),并在供体肺动脉和接收者下腔静脉,以及供体主动脉和接受者腹部主动脉之间用端-侧吻合术对移植物血运重建。在确认止血后,用连续5-ovicryl缝线(ethicon,johnson&johnson,somerville,nj)闭合腹肌,并用连续5-0ethilon缝线(ethicon)闭合皮肤。实施标准的术后疼痛评估和管理。通过对于头30天,每周触诊5-7次,然后每周3-4次,直到研究结束来评估移植物。
用1剂20mg/kg静脉内rhgaa(genzymecorporation)、连续3剂腹膜内5mg/kg甲氨蝶呤(apppharmaceuticals,llc)、和每隔一天3剂5mg/kg1d11或13c4(genzymecorporation)处理c57bl/6小鼠。甲氨蝶呤、1d11、和13c4处理以rhgaa注射开始。处理启动后7天收集脾,并加工,如上文对b细胞、培养和流动分析描述的。另外,通过如上文描述的那样处理动物获得rhgaa滴度数据,在12周里每周给药rhgaa,将甲氨蝶呤给药1或3个周期,并每隔一天一周3次将1d11或13c4给药12周。每2周收集血清样品进行elisa分析。
组织病理学和免疫组织化学
将心脏移植物在10%中性缓冲福尔马林中固定,沿着纵轴两分以暴露右和左心室和流出道,并常规加工以进行石蜡包埋。以5微米切出切片,并用苏木精和曙红(h&e)或马森(masson)氏三色染色。还对连续切片免疫染色,如下文描述的。使用组织学分级方案对每个经h&e染色的切片定性评估异基因移植物排斥病理学的各种特征(例如血管炎、心肌变性和坏死、心肌炎)。
使用bond-max自动化免疫染色系统(leicamicrosystemsinc.,buffalogrove,il)实施免疫组织化学。为了检测cd3和foxp3双重免疫阳性细胞,使用bond聚合物精制检测试剂盒(polymerrefinedetectionkit)和bond聚合物ap红色试剂盒(leica,buffalogrove,il)遵循制造商的指南将移植物组织切片用抗cd3和抗foxp3抗体进行双重免疫染色。简言之,将脱石蜡的石蜡包埋移植物切片进行热诱导的表位修复(于99℃为25分钟),与无血清蛋白质封闭剂(serumfreeproteinblock)(dako,carpentaria,ca)、家兔单克隆抗cd3抗体(labvision/neomarker)、缀合有过氧化物酶的聚合物、过氧化物酶封闭剂(peroxidaseblock)、和二氨基联苯检测试剂,接着是大鼠抗小鼠foxp3抗体(ebioscienceinc.,sandiego,ca),然后是家兔抗大鼠抗体(vectorlaboratories,inc.,burlingame,ca)一起温育。然后,将载玻片与bond聚合物ap和混合的红色检测试剂一起温育,最终用苏木精复染色。在阴性对照载玻片中,分别用chromepure全家兔igg(jacksonimmunoresearchlaboratories,inc.,westgrove,pa)和大鼠igg2a(abdserotec,raleigh,nc)替换抗cd3和抗foxp3一抗。
血清同种抗体水平
通过将以1:50稀释的来自经心脏移植的或正常的小鼠的血清与经sv40转化的c57bl/6成纤维细胞系(svb6)一起温育,接着使用fitc家兔抗小鼠igg(dako,carpinteria,ca)及通过流式细胞术分析检测成纤维细胞结合的抗体(同种抗体)来测定血清同种抗体水平。用血清染色的成纤维细胞的几何均值荧光强度除以经同种型对照染色的成纤维细胞以在实验间标准化同种抗体水平。特别地,血清抗体对同种成纤维细胞的结合是同种抗体,因为相同血清样品不结合经sv40转化的balb/c成纤维细胞系(svbalb)(数据未显示)。
过继转移小鼠模型
c57bl/6小鼠获自jacksonlaboratories,并且在无特定病原体条件下收容。以20mg/kg对对照小鼠给予rhgaa的单次静脉内注射。在三次连续的每日0.5mg甲氨蝶呤腹膜内注射外,以20mg/kg对耐受化小鼠给予rhgaa的单次静脉内注射。在初始rhgaa注射后第6天从两个供体组收获脾,并加工成合并的单细胞悬浮液。将细胞清洗,并过滤流过0.22μm滤器。然后,使用stemcelltechnologiesrobosep细胞分离系统对细胞富集b细胞,并重悬以容许200μl静脉内注射。耐受化的和非耐受化的接受者组经由静脉内注射接受较高的细胞10x106或较低的细胞5x106浓度。对对照组给予仅rhgaa,或rhgaa和甲氨蝶呤(单个周期的三次连续每日mtx注射)。所有组接受每周静脉内rhgaa20mg/kg注射,并每两周眶后取血16周,放入bdvacutainer血清分离管。将血清取出,并在-20℃下贮存,直至用于elisa。使用elisa测定抗rhgaa抗体滴度,在spectramaxm2上读出,并使用softmax计算以推断滴度数值。将含有对照和滴度信息的原始数据softmax文件和excel扩展页存储在网络服务器上。使用graphpadprism软件产生所有图和统计学。
实施例1:响应抗体治疗剂生成抗药物抗体
多克隆抗体matg结合多种免疫细胞类型,包括抗原呈递细胞。我们的数据显示了单个疗程的matg(相隔三天给予的两剂25mg/kg,腹膜内施用)可以在小鼠中产生高达100,000的抗matgigg滴度(图1a)。在以连续每月注射(5mg/kg,每4周)给予时,抗matg滴度进一步升高,滴度在5次每月注射后高达5x106(图1b)。对于单个疗程和每月注射两者,使用家兔igg(rbigg)作为对照。
由于阿仑单抗不与鼠cd52起交叉反应,必须在hucd52tg小鼠(其中转基因表达样式与人中的cd52表达相似)中完成用阿仑单抗的临床前研究。与matg类似,阿仑单抗(0.5mg/kg)的静脉内施用在hucd52tg小鼠中引发显著的ada应答。这些应答在头四次处理中升高,然后降低,使得在第五剂阿仑单抗后,hucd52tg小鼠不再生成抗阿仑单抗抗体(图2)。此非响应性提示了已经发生天然耐受性(rosenberg等,blood,93(6):2081-8(1999))。
数据显示了c57bl/6小鼠中针对matg的ada滴度和hucd52tgcd1小鼠中针对阿仑单抗的ada滴度较高(>100,000)。此高水平的免疫原性可以归因于matg和阿仑单抗结合抗原呈递细胞的能力,由此增强抗原加工和呈递以诱导针对它们的免疫应答。
实施例2:甲氨蝶呤在单个周期施用的情况中控制抗matgigg应答
已经在
接着,评估以5mg/kg/注射5次每月注射matg后甲氨蝶呤对抗matg滴度的影响。实施matg处理的每月注射,因为淋巴细胞再增殖在matg处理后1个月几乎完成(ruzek,见上文)。然后,在每月处理的20周里每周量化抗药物抗体应答。在此时段期间,尽管matg消减cd4+t细胞,抗体滴度达到高达500万(图1b)。令人感兴趣地,以与matg相同的剂量水平和日程表接受非特异性家兔igg的动物显示较低的抗家兔igg应答(图1b)。一种关于增强的matg免疫原性的可能性可以是matg对抗原呈递细胞(apc)诸如滤泡树突细胞(其在存在补体的情况中时可以显著增强b细胞应答)的特异性结合。还评估两种甲氨蝶呤处理方案。在用酶替换疗法(ert)的先前工作中,在头三剂酸性α-葡糖苷酶期间给予的三个周期的甲氨蝶呤在每周ert剂量给药的至少8个月里提供抗体滴度的持续降低(joseph等,clinexpimmunol,152(1):138-46(2008))。在matg的背景中评估相似疗程的甲氨蝶呤,其中在matg施用15分钟内及头三次每月matg处理之每次后24和48个小时给予5mg/kg甲氨蝶呤。比较效应曲线下面积,此方案将抗matg抗体应答从约400万的滴度成功降低至816,000的滴度,这产生79%降低(图4a)。
另外,评估仅5次每月matg处理的第一次左右给予的单个疗程甲氨蝶呤对抗matgigg应答的影响,并与三周期方案直接比较。令人惊讶地,此单个周期方案比三周期方案甚至进一步降低抗matgigg滴度至约50,000的滴度(图4b)。比较效应曲线下面积,单个周期方案将抗matgigg滴度降低98%,而三周期方案将滴度降低69%(图4c)。单个周期对三周期方案的升高的效果提示提高甲氨蝶呤暴露可以实际上拮抗其耐受化效应,其可能通过杀死介导对抗体滴度的控制的细胞进行。
实施例3:甲氨蝶呤诱导免疫耐受性的活性机制
如上文显示的,非常短暂疗程的甲氨蝶呤可以在多轮抗原攻击里显著控制抗体应答。在此背景中,短暂的周期是单个周期的甲氨蝶呤,其在测试数月的过程里(对抗体滴度和细胞因子两者)产生持久的影响。对抗体应答的此长时间控制提示了甲氨蝶呤可以成功诱导免疫耐受性。至此已经在连续5剂每月matg的背景中评估了甲氨蝶呤。为了进一步评估是否已经活化免疫耐受性机制,从处理扣留最初接受5次每月matg注射的动物达8周。在此休息期后,对动物给予最终的matg注射。若采用免疫耐受性的机制,则抗matgigg滴度在第6次matg处理后不应显著升高。
我们的数据显示了没有用甲氨蝶呤剂量给药的动物经历抗matgigg滴度的升高,如预期的(图5)。相反,在第一次matg注射时仅接受一个周期的甲氨蝶呤的动物不生成显著较大的抗matgigg滴度(图5)。在用三个周期的甲氨蝶呤处理的动物中观察到类似的趋势,尽管效果不是一样显著的(图5)。在比较效应曲线下面积时,单个疗程的甲氨蝶呤将滴度降低99%,而三周期方案将滴度降低85%。这些数据指示甲氨蝶呤可以维持对回忆应答的控制,这提示了小鼠已经形成针对此抗原的耐受性。
虽然经甲氨蝶呤处理的动物在连续matg处理的情况中生成升高的可测量滴度,但是总体上,经甲氨蝶呤处理的动物中的滴度水平比仅用matg处理的动物中观察到的那些滴度水平一致地低100倍(图6)。较低的抗体滴度水平应当显著降低安全性风险和效力影响的潜力。虽然不希望受限于理论,但是这些数据提示已经导出控制的活性机制,其可以显著降低抗matgigg应答,并且在甲氨蝶呤处理后长期维持。
实施例4:单个周期的甲氨蝶呤可以显著控制抗阿仑单抗应答
在缓解-复发性多发性硬化中,在每年周期中剂量给药阿仑单抗,并且患者可以产生ada(coles等,nengljmed,359(17):1786-801(2008))。由于免疫原性和药动学测试在多项iii期研究中正在进行,不清楚抗阿仑单抗抗体在患者子集中是否会影响暴露、效力、和/或安全性。如此,我们评估单个周期的甲氨蝶呤是否可以控制5个每月单次注射周期的阿仑单抗后的ada滴度。对hucd52tg小鼠每月静脉内给予阿仑单抗(0.5g/kg)达连续5个月。在第一剂每月阿仑单抗给药前15分钟及给药后24和48小时以0.5、1或5mg/kg给予甲氨蝶呤。1mg/kg甲氨蝶呤提供一些益处,因为它将抗阿仑单抗应答降低88%(图7a)。5mg/kg甲氨蝶呤将抗阿仑单抗igg应答成功降低99%(图7a)。甲氨蝶呤表现为对天然耐受性没有影响。
第二项研究确认上述发现。如上文,用5剂每月0.5mg/kg阿仑单抗处理hucd52转基因小鼠。与第一次阿仑单抗施用结合,还用或不用3剂每日5mg/kg/天甲氨蝶呤处理小鼠(图7b)。贯穿整个研究收集血清样品以评估抗阿仑单抗滴度并确认耐受性。在第5剂每月给药后24小时时获得滴度数据。数据证明了甲氨蝶呤降低抗阿仑单抗抗体滴度(图7c)。
实施例5:甲氨蝶呤在临床相关阿仑单抗剂量给药方案的背景中可以控制抗阿仑单抗抗体应答
进行一系列实验以评估甲氨蝶呤是否可以成功控制hucd52tg小鼠中在阿仑单抗的临床相关剂量给药方案的背景中的ada。在临床中,以12mg/天的5次每日处理的初始周期剂量给药阿仑单抗。患者中初始处理周期后12个月,施用额外周期三剂每日12mg阿仑单抗。在第二个处理周期时,循环cd19+b细胞的水平已经恢复到基线数值;然而,循环cd4+t辅助细胞和cd8+t细胞毒性细胞的水平尚未完全再生(coles等,nengljmed,359(17):1786-801(2008))。
最初,在hucd52tg小鼠中调查5次阿仑单抗每日处理后循环t和b细胞子集的消减和再生动力学。在经由静脉内注射以0.5mg/kg(等同于12mg/kg人剂量)用阿仑单抗连续5天处理的hucd52tg小鼠的外周血中,总cd3+t细胞、cd4+t辅助细胞、和cd8+t细胞毒性细胞在处理后4周没有恢复到处理前水平,而cd19+b细胞数目回到对照水平(图8a-d)。
为了模拟再次处理时患者经历的细胞环境,在第一个周期后4和5周之间在hucd52tg小鼠中再施用阿仑单抗。由于阿仑单抗的初始疗程是5天周期,在每次每日阿仑单抗处理前15分钟施用甲氨蝶呤,然后施用2天。此方案中给予的甲氨蝶呤的最大累积循环剂量是14mg/kg(2mg/kg/天),其非常类似于在以5mg/kg/天的三天疗程给予甲氨蝶呤时15mg/kg的积累剂量。我们评估2、1和0.5mg/kg/天甲氨蝶呤施用在三个阿仑单抗处理周期里对抗阿仑单抗抗体的影响。在1mg/kg,甲氨蝶呤表现为控制测试的8只小鼠之7只中的滴度,并且总体上将滴度降低79%(图9b)。在2mg/kg,在比较效应曲线下面积时,甲氨蝶呤将ada成功降低98%(图9a)。
实施例6:甲氨蝶呤可以改善matg的药动学和药效学
ada可以干扰蛋白质治疗剂的药动学和药效学。我们评估了抗matgiggada应答是否干扰matg药动学。用单独的matg或与单个周期的甲氨蝶呤一起的matg的每月注射处理小鼠5个月。以5mg/kg每日施用甲氨蝶呤达三剂。在第1个月、第3个月、和第5个月后的多个时间点时对血液取样以测定循环matg的水平(图10)。
在第1个月时,循环matg的水平在两个处理组间是相似的,但是在第3个月和第5个月时,仅经甲氨蝶呤处理的组具有可测量的循环matg水平。在不施用甲氨蝶呤的情况中,第三和第五剂matg后测量的matg水平显著低于第一剂后测量的那些水平(图10)。先前的研究已经显示了甲氨蝶呤显著降低抗matgigg应答。如此,表现为针对matg的抗体干扰matg暴露和药动学。
由于针对matg的抗体表现为在重复剂量给药后显著降低循环matg的水平,可以预期在再次剂量给药时matg的药效学也受到负面影响。在第五次每月matg处理(此时滴度为其最高)时评估血液、脾和淋巴结中的淋巴细胞消减。如上文描述的,对用甲氨蝶呤处理的动物给予单个周期的处理。
循环cd4+和cd8+t细胞的水平在用matg而非甲氨蝶呤处理的动物中在第五次matg处理后不变。然而,在用matg和一个周期的甲氨蝶呤处理的动物中,循环cd4+和cd8+t细胞是显著消减的(图11)。在脾和淋巴结中也类似地观察到此效果。甲氨蝶呤处理增强matg增加脾和血液中t调节细胞的百分比的能力(图12a-b)。在血液和淋巴结中观察到类似的效果。已经假定matg和
至此,药动学和效力研究提示了抗matg抗体干扰matg的暴露和效力。抗matgigg滴度和matg暴露之间的直接比较揭示了在终点滴度大于10,000时,循环matg的水平显著降低(图13a)。然而,在抗matgigg滴度大于100,000时,matg介导的细胞消减受到抑制(图13b)。滴度和细胞消减之间的r2关联>0.7。
实施例7:甲氨蝶呤可以改善阿仑单抗的药效学
甲氨蝶呤不仅增强matg的药效学,而且在抗阿仑单抗应答表现为中和一些消减活性时还恢复阿仑单抗介导的对循环t和b细胞的消减。在此实施例中描述的研究中,在有和无甲氨蝶呤的情况中对hucd52tg小鼠给予5次每月静脉内阿仑单抗注射。对于6个月研究的头三天,每日施用5mg/kg甲氨蝶呤。在第五剂前2天和第五剂阿仑单抗后1天从两个处理组的动物收获血液。通过流式细胞术评估细胞群体,如实施例6中描述的。
我们的数据显示了第五剂每月阿仑单抗表现为不再消减t细胞,因为循环t细胞的绝对数目在处理之前和之后似乎是相似的(图14(每个时间点代表不同组的动物))。相反,甲氨蝶呤表现为已经恢复阿仑单抗消减t细胞的能力(p=0.012)。在阿仑单抗剂量给药前2天或后1天比较仅用阿仑单抗处理的动物和用阿仑单抗和甲氨蝶呤两者处理的动物中的循环t细胞的绝对数目时,循环t细胞的数目在经甲氨蝶呤处理的动物中显著更低(p=0.034和0.02;图14)。类似地,甲氨蝶呤处理似乎增强阿仑单抗对b细胞的消减(分别为p=1.2x10-5,p=0.02),并且循环b细胞的数目在经甲氨蝶呤处理的动物中在处理后1天进一步减少(图14)。
实施例8:单个周期的甲氨蝶呤可以显著控制抗rhgaa抗体应答
我们还研究了甲氨蝶呤在rhgaa酶替换疗法中的效果。在此研究中,将动物每周注射rhgaa达连续12天,然后休息4周,然后在第16周时用rhgaa再攻击。还对动物给予第1周时单个周期的连续三剂每日5mg/kg甲氨蝶呤,或者在第1周、第2周和第3周之每周给予一个周期(总共三个周期)。在第0周(任何处理前)、第6周、第8周、第12周、第16周、第18周、和第20周时在动物中测量rhgaa特异性igg滴度。我们的数据显示了单个周期的甲氨蝶呤与三周期方案一样好地控制至少20周里的抗rhgaa应答(图15)。
还已经在t细胞缺陷型nu/nu小鼠中进行研究以评估t细胞在产生抗rhgaa滴度中的作用。在这些实验中,我们已经重复观察到在这些t细胞缺陷型小鼠中很少至不形成针对rhgaa的ada(图37a-b)。这些数据支持如下的观念,即t细胞促成抗rhgaa滴度。如此,由于甲氨蝶呤可以控制针对rhgaa的ada,它也可能影响针对rhgaa的t细胞应答。
实施例9:甲氨蝶呤增强matg介导的心脏异基因移植物存活
在评估甲氨蝶呤是否可以增强matg在正常小鼠中的效力外,我们还调查了在移植背景中是否可以通过甲氨蝶呤提升matg功能。由于
另外,我们调查了在相同方案下或在连续12天的延长方案的情况中给予的低4倍剂量的甲氨蝶呤(0.5mg/kg)。各组小鼠接受无处理(盐水对照)、单独的matg、或matg和甲氨蝶呤组合方案。与正常小鼠中的研究相似,与matg共施用的甲氨蝶呤降低针对matg的抗药物抗体滴度,不管使用的方案如何(图16a和表1)。此外,与抗体滴度降低一致的是此移植物背景中观察到的matg暴露延长(图16)。鉴于针对移植的组织的有力的、一致的免疫应答的条件下可能的辅助效应,抗药物抗体滴度甚至比在正常小鼠背景中更快升高,并且导致第一次matg施用的7天内几乎检测不到的matg水平(图16b)。相反,到移植后7天,抗家兔igg抗体滴度在用甲氨蝶呤处理的小鼠中显著较低,并且循环matg水平在那些小鼠中显著较高。这强调在正在进行的炎性应答的条件下,抗药物抗体应答可以被加速,并且可能对药效学和效力具有甚至更大的影响。重要地,即使在这些条件下,甲氨蝶呤对matg抗药物抗体具有深远的抑制影响,并且增强matg暴露。然而,由于循环matg水平在matg和甲氨蝶呤组合处理的情况中到21天仍然低得检测不到,鉴于>100天移植物存活,别的耐受性机制可能发挥作用。这些结果证明了matg和甲氨蝶呤处理之间对同种移植物存活的明显协同作用,并且显示了类似水平的matg抗药物抗体降低和matg暴露增强,如在正常小鼠中观察到的。
表1:甲氨蝶呤方案降低心脏异基因移植物移植小鼠中的抗matg抗体滴度
*n/a=不可得到
其它数据确认在降低抗异基因移植物应答外,matg和甲氨蝶呤的组合处理还显著延长心脏异基因移植物的存活(图17和18)。实际上,虽然单独的matg或甲氨蝶呤处理两者都分别提供平均延长存活至15和20天的适度益处,matg和评估的任何甲氨蝶呤方案的共施用展示心脏移植物存活的显著益处,大多数小鼠保持其移植物直到超过100天(图17)。由于在matg和甲氨蝶呤的早期、短暂诱导处理后长期继续心脏移植物存活,此方案表现为致耐受性而不是免疫抑制性的。效果对于matg和甲氨蝶呤的组合是独特的,因为其它免疫抑制剂(例如霉酚酸酯(mycophenolatemofetil)、地塞米松(dexamethasone)、雷帕霉素(rapamycin)和环磷酰胺)在与matg共施用时不能显著延长移植物存活。显著地,单独的甲氨蝶呤处理能够显著降低抗异基因移植物抗体,这进一步证实甲氨蝶呤一般性控制抗体应答的效果(图18)。在此情况中,甲氨蝶呤表现为能够同时控制针对心脏异基因移植物的多种抗原的抗体应答。通过组合matg与甲氨蝶呤处理诱导进一步降低(图18c)。
实施例10:甲氨蝶呤诱导耐受性的机制与目前已知且公认的甲氨蝶呤功能相比是独特的。
上述实施例中描述的甲氨蝶呤的剂量给药方案表现为援引与先前描述的机制相比独特的机制。甲氨蝶呤是一种叶酸拮抗剂,认为其通过诱导增殖细胞的死亡来介导其抑制效应。上文呈现的matg数据证明了抗体应答得到诱导,但是在经甲氨蝶呤处理的动物中在每次连续matg处理的情况中保持显著降低。这些数据提示了b细胞应答受到积极管理。不希望受限于理论,我们假设甲氨蝶呤可以诱导调节细胞群体,其在这些应答发生时控制它们。我们调查了与仅用
另外,活化的b细胞子集的数目在甲氨蝶呤处理后显著增加(图20)。这些群体包括活化的边缘区b细胞、活化的滤泡b细胞和活化的移行2和3b细胞。如下定义细胞群体:b2/滤泡b细胞:cd19+cd21intcd23高;移行2b细胞:cd19+cd93+cd23+igm高;和移行3b细胞:cd19+cd93+cd23+igm低;边缘区b细胞:cd19+cd21高cd23低。给予两个周期的
实施例11:甲氨蝶呤与matg组合增加选择的b细胞群体
在上述实施例中,在每次matg处理后,仅用matg处理的小鼠和用matg和甲氨蝶呤处理的小鼠两者中的ada滴度升高,这提示了两组动物都含有能够促成抗体应答的b细胞(图6)。若情况正是如此,可以得到至少两种假设。第一种假设是甲氨蝶呤可以杀伤大多数能够响应
将动物每月用matg处理5个月,并且接受研究的头三天的单个周期的5mg/kg甲氨蝶呤,三个周期的5mg/kg甲氨蝶呤,或无甲氨蝶呤(图23)。然后,通过在第五剂matg前1天和第五剂matg后2天比较动物中的群体来评估三个处理组间的细胞群体差异。
令人惊讶地,用单个周期的甲氨蝶呤处理后5个月,在接受单个周期的甲氨蝶呤和matg的小鼠和接受单独的matg或matg及三个周期的甲氨蝶呤的小鼠之间观察到差异。出乎意料地展示效果的两个细胞群体是活化的滤泡b细胞和活化的移行3b细胞(分别为图24a-b)。在用单独的或与三个周期的甲氨蝶呤组合的matg处理的小鼠中,在这些细胞群体的绝对细胞数目方面观察到降低。然而,在仅接受单个周期的甲氨蝶呤的小鼠中,没有观察到这些群体的统计学显著降低,这提示了甲氨蝶呤的此剂量给药方案诱导这些群体的有些富集。令人感兴趣地,也显示了这两个细胞群体在与myozyme组合的甲氨蝶呤处理后直接富集(图21)。在耐受性移植患者中也已经鉴定出类似的子集。有可能的是,单个周期的甲氨蝶呤处理可以诱导这些b细胞子集,其在抗原暴露后变为活化的和抑制性的。
实施例12:甲氨蝶呤与阿仑单抗组合增加选择的b细胞群体
如实施例4中描述的,与第一次阿仑单抗施用结合,在有或无三剂每日5mg/kg/天甲氨蝶呤的情况中,将hucd52转基因小鼠用单剂每月0.5mg/kg阿仑单抗处理5个月。在第五剂阿仑单抗之前2天,和之后1、7和/或28天通过流式细胞术在小鼠的血液和脾中评估细胞群体。
在血液中,阿仑单抗的药效学效果在第五剂阿仑单抗后24小时在经甲氨蝶呤处理的动物中增强。在第5剂后1天在t细胞和b细胞子集两者中观察到统计学显著的细胞消减,这与先前的数据一致,所述先前的数据指示抗阿仑单抗滴度在这些动物中较低,并且不会有可能干扰阿仑单抗介导的消减。比较而言,仅用阿仑单抗处理的小鼠可以具有较多的阿仑单抗中和性抗体,其干扰阿仑单抗药效学。如图25a中显示的,在经阿仑单抗处理的小鼠中没有t细胞子集的显著消减,但是用阿仑单抗和甲氨蝶呤处理的小鼠在阿仑单抗剂量给药后1天在总t细胞、t辅助细胞和t调节细胞中展现出显著的阿仑单抗介导的消减。在循环b细胞子集中观察到类似的发现(图25b),尽管在仅用阿仑单抗处理的动物中也观察到降低细胞数目的趋势。与循环t细胞群体一样,脾t细胞群体在第5次阿仑单抗处理后1天在经甲氨蝶呤处理的动物中显著消减(图26)。
与用阿仑单抗和甲氨蝶呤处理的小鼠中的t细胞消减形成对比,除了滤泡b细胞外,分析的每种脾b细胞群体没有显著消减(图27)。此评估包括调节b细胞群体,即b10b细胞。不希望受限于理论,我们假设甲氨蝶呤可以富集这些b细胞群体中的一些或全部,这与阿仑单抗介导的其消减相反。预期此富集不在血液的快速的、流体环境中发生,因为免疫细胞不在血液中分化。取而代之,免疫应答在脾和其它外周淋巴样组织中发生,其中细胞/细胞相互作用和细胞因子/趋化因子启动的应答可以在组织的多种多样的环境中发生。这可以解释血液和脾中观察到的阿仑单抗介导的b细胞消减的差别效应。这些数据与用matg产生的数据相似,其中脾b细胞表现为在与matg组合用单个周期的甲氨蝶呤处理的小鼠中富集(图24a-b)。取而代之,在本文中描述的所有研究中,已经在评估活化细胞的特定群体时观察到甲氨蝶呤处理后的富集。然而,在评估包括活化的和非活化的细胞(诸如总滤泡b细胞)两者的细胞群体的总数时,没有观察到经甲氨蝶呤处理的动物中显著的富集。
与阿仑单抗处理后24小时的脾细胞群体形成对比,用单剂阿仑单抗(而不是甲氨蝶呤)处理后3天,脾细胞子集显著消减(图28a)。有可能的是,在24小时时,b细胞消减在经阿仑单抗处理的动物中可以比在阿仑单抗处理后3天时大,因为b细胞增殖到3天标志可以已经开始。这已经在评估外周血中的这些群体的几项研究中证明。在外周血中在剂量给药后早到3小时观察到消减。到处理后3天,循环的b细胞集合在经阿仑单抗处理的小鼠中比在用磷酸盐缓冲盐水(pbs)处理的对照小鼠中仍然显著更低,尽管百分比消减不如24小时时的百分比消减一样大。24小时时的百分比消减是92%,而3天时的消减是36%(图28b)。b细胞重建似乎在单剂后快速发生。
总之,在动物接受甲氨蝶呤后5个月且直接在抗原暴露后,表现为甲氨蝶呤可以富集b细胞群体,其潜在地帮助介导耐受性诱导。表现为富集的群体与那些直接在甲氨蝶呤处理后增加的群体类似(图21)。总之,这提示了甲氨蝶呤可以诱导如下的环境,该环境容许免疫应答在抗原暴露时受到积极控制,即使在用甲氨蝶呤处理后长时间。
实施例13:甲氨蝶呤对细胞因子水平的影响
细胞因子在b细胞应答中发挥双重作用。例如,b细胞活化性细胞因子il-6和baff也是b细胞分化需要的。由于甲氨蝶呤似乎增加b细胞群体,因此可以预期这些细胞因子增加。然而,il-6也是促炎的,并且因此,升高的水平可以干扰甲氨蝶呤诱导的效应。与il-6一样,il-10也牵涉b细胞分化成浆细胞和免疫抑制。
从第5剂阿仑单抗后24小时采集的血清样品产生baff数据(图29a)。这是来自上文呈现的此研究的细胞数据的继续。在此时间点时,没有观察到baff水平的差异(图29b)。
表2:用阿仑单抗和/或甲氨蝶呤处理的小鼠中的研究设计
在第二个周期的阿仑单抗后1周评估细胞因子水平(图29b)。一般地,在第二个周期的阿仑单抗后1周,细胞因子水平表现为较低。在此时间点时,在用2mg/kg甲氨蝶呤处理的动物中对tnf-α水平观察到统计学显著升高。此升高可以反映与甲氨蝶呤诱导的耐受性相关的或者作为炎性应答体征的变化。还注意到其它细胞因子中观察到的趋势,诸如il-6的显著增加和il-7的潜在略微减少(图30)。
调节b细胞已经与il-10分泌联系起来。一种评估il-10分泌性调节b细胞是否在甲氨蝶呤诱导的耐受性中发挥作用的方式是评估甲氨蝶呤是否可以控制il-10缺陷型动物中的抗体应答。此类评估可以是挑战性的,因为如上文提及的,il-10对于浆细胞分化是必需的,并且因此抗体应答在这些动物中可以是较低的。铭记此告诫,我们观察到令人感兴趣的趋势,其提示了il-10可以在甲氨蝶呤诱导的耐受性中发挥作用。
在此研究中,动物每周接受20mg/kg静脉内
实施例14:甲氨蝶呤在治疗阿仑单抗关联继发性自身免疫中的作用
经阿仑单抗治疗的多发性硬化患者可以形成继发性自身免疫。阿仑单抗治疗后形成的最常见的自身免疫性病症是那些与甲状腺自身免疫相关的。另外,还已经在用阿仑单抗治疗的多发性硬化患者中观察到免疫性血小板减少性紫癜(immunethrombocytopenicpurpura)和古德帕斯丘(goodpasture)氏综合征。所有三种类型的自身免疫是b细胞介导的,因为b细胞应答和自身抗体与疾病形成和病理学直接联系。阿仑单抗治疗与这些继发性疾病的形成的关联是不完全了解的。
阿仑单抗治疗后,t细胞和b细胞是消减的。较大百分比的这些消减的t和b细胞可能是自身反应性细胞,其与中枢神经系统中表达的抗原相互作用。因此,认为其随后被阿仑单抗消减促成此单克隆抗体疗法的治疗性益处。已经描述了患有自身免疫性疾病的患者含有针对与多种自身免疫性疾病有关的多种抗原的自身反应性(即,自身反应性b细胞和自身反应性抗体)。环境、生理学、和遗传因素都促成决定是否可能继以自身免疫性疾病及影响患者中会存在哪种自身免疫性疾病。患有一类自身免疫性疾病的患者还形成另一种不是不常见的。
在阿仑单抗的背景中,一种假设是容许不如与多发性硬化相关的那些自身反应性一样突出的固有自身反应性在阿仑单抗治疗后在淋巴细胞消减的环境中扩充。形成自身免疫性疾病的人通常具有针对多种不同抗原的自身反应性,并且因此具有形成其它自身免疫性的素因(即,“固有自身反应性”)。支持此想法的是hucd52tg小鼠中的数据,其显示了阿仑单抗不同等消减所有b细胞群体(图27)。实际上,b细胞全集中表现为具有有助于低亲和力免疫反应性b细胞,特别是边缘区b细胞的支持者的不平衡。重要地,边缘区b细胞已经与甲状腺自身免疫联系起来(segundo等,thyroid,11(6):525-530(2001)。另外,调节b细胞子集b10b细胞(已经显示了其帮助消除多发性硬化的鼠模型eae中的自身免疫(matsushita等,j.clin.investigation,118:3420-3430(2008)),并且已经显示为存在于人中(iwata等,blood,117:530-541(2011)))比边缘区b细胞消减更长的时间段。第一个周期的阿仑单抗期间短疗程的甲氨蝶呤处理可以帮助提高调节b10b细胞的呈现,并且恢复b细胞平衡,使得边缘区b细胞在阿仑单抗处理后在b细胞全集中较相等呈现和/或将边缘区b细胞分化成调节边缘区b细胞(cd1d+边缘区细胞)。
研究脾b细胞群体以测定阿仑单抗对b细胞消减的影响(图32)。将0.5mg/kg阿仑单抗在hucd52小鼠中静脉内施用连续5天。特别地,检查滤泡b细胞(其通常不是自身反应性的)、b1b细胞和边缘区b细胞(这两者是自身反应性的)、b10b细胞(其是调节性的)、和移行b细胞和边缘区b细胞(认为它们能够分化成b调节细胞)群体。
虽然滤泡、b1、和调节b细胞在用阿仑单抗处理后1和/或2周时消减,但是边缘区b细胞及移行1(t1)和移行2(t2)b细胞在任何时间点时不消减(图32)。移行3b细胞(t3)仅在一周处理后消减,并且调节b细胞的数目一般表现为在经阿仑单抗处理的小鼠中低于在经对照处理的动物中,尽管在第2周和第4周时没有观察到统计学显著性。
为了检查在用阿仑单抗治疗的背景中甲氨蝶呤对b细胞群体的影响,实施第二项研究,如表3和图33中指示的。令人惊讶地,甲氨蝶呤与阿仑单抗的共处理可以容许阿仑单抗处理后不久比仅用阿仑单抗观察到的消减更强的边缘区b细胞消减(图34),由此促进平衡的免疫环境,其具有对于对感染的正确早期响应必需的合适水平的天然存在的低亲和力自身反应性b细胞。
仅用阿仑单抗处理的一组小鼠包括在此研究中,并且揭示了此短周期方案中仅用甲氨蝶呤处理的小鼠在缺乏抗原刺激的情况中展现出细胞效应,其可以不同于在仅用甲氨蝶呤处理的对照小鼠中观察到的效应(图34)。此研究中产生的数据(其中在甲氨蝶呤处理的最后一天后2天评估脾b细胞群体)提示了甲氨蝶呤可以增强边缘区b细胞的消减。这支持如下的假设,即甲氨蝶呤在与阿仑单抗一起投递时可以导致如下的细胞环境,其中天然存在的b细胞子集与非自身反应性b细胞子集适当平衡。
表3:用阿仑单抗和/或甲氨蝶呤处理的小鼠中的研究设计
基于直接在与
甲氨蝶呤诱导针对蛋白质疗法和移植的心脏组织抗原的耐受性,由此消除b细胞免疫应答,其涉及ada和抗异基因移植物抗体的生成和分泌。因此,我们假设甲氨蝶呤不仅可以帮助控制阿仑单抗处理后的细胞环境,而且它还可以诱导针对自身蛋白的耐受性,并减轻b细胞免疫应答,其涉及促成b细胞介导的自身免疫性疾病的形成和病理学的自身抗体的生成。
为了测试此假设,用阿仑单抗对动物每月给药5个月。在仅第一次阿仑单抗处理后,以5mg/kg将甲氨蝶呤给予一组动物达连续三天。在第五剂阿仑单抗处理前2天和后1天,处死动物以进行分析。在阿仑单抗处理之前和之后评估血清细胞因子水平。令人惊讶地,这些结果提示了在用任何甲氨蝶呤给药后5个月,促炎性细胞因子mcp-1、il-13、il-6、和il-12的水平在第五剂阿仑单抗后24小时在用甲氨蝶呤处理的动物中降低(图36)。这些细胞因子不仅促进b细胞应答和免疫细胞募集,而且它们还可以在超敏感性反应中发挥作用。这些数据提示了甲氨蝶呤可以帮助阻止输注关联反应。
实施例15:甲氨蝶呤经由特异性诱导调节b细胞群体来诱导免疫耐受性
令人惊讶地,我们的数据显示了甲氨蝶呤诱导免疫耐受性,其不通过杀死增殖细胞的预期手段进行,如其他人提出的(messinger等,geneticsinmedicine14:135-142(2012)及lacaná等,amjmedgenetpartcseminmedgenet160c:30-39(2012)),而是经由特异性诱导表达tgf-β、il-10和foxp3的调节b细胞群体进行。来自通过单个周期甲氨蝶呤对
如上文描述的,几种b细胞子集在甲氨蝶呤与蛋白质治疗剂共施用后不久在细胞百分比和/或细胞数目上显著增加。此外,这些子集在单个周期甲氨蝶呤处理后长期在经甲氨蝶呤耐受化的小鼠中表现为增加(见例如图24、27和35)。总之,这些数据提示了这些细胞群体可以活跃介导免疫耐受性诱导的诱导和维持两者。为了进一步证实此假设,我们调查这些细胞群体表达的细胞因子和其它蛋白质是否经常与免疫调节有关。
一种与免疫调节有关的细胞类型是b10b细胞。人和小鼠两者中的b10b细胞以其表达il-10为特征(matsushita等,j.clin.invest.118:3420-3430(2008);iwata等,blood117:530-541(2011)),并且仅可以抑制有il-10能力的小鼠中的免疫应答。b10b细胞在经甲氨蝶呤耐受化的小鼠中增加(图19),并且il-10敲除动物对甲氨蝶呤诱导的免疫耐受性不响应(图31)。通过流式细胞术对从用
tgf-β表达与t调节细胞中免疫调节有关,并且经常与t调节细胞中的il-10表达关联。此外,一些报告似乎指示调节b细胞可以表达tgf-β。虽然从未报告b10b细胞表达tgf-β,但是我们决定使用流式细胞术评估在仅用
foxp3是另一种与免疫调节有关的蛋白质。foxp3是一种t调节细胞标志物。尚未报告foxp3在小鼠中的b10b细胞中表达。我们通过使用流式细胞术在存在和缺乏甲氨蝶呤诱导的免疫耐受性的情况中调查b10b细胞中的foxp3表达。b10b细胞表现为表达foxp3,如仅用
由于别的b细胞类型在单个周期甲氨蝶呤诱导的免疫耐受性的情况中显著增加,因此我们评估这些细胞类型中的一些是否表达il-10、tgf-β和foxp3。发现移行2、移行3和滤泡b细胞表达il-10(图42)、tgf-β(图43)和foxp3(图44),其对于每种那些b细胞子集是新颖且出乎意料的。如用b10细胞观察到的,与仅用
为了进一步调查通过用甲氨蝶呤和
另外,从用
相当出乎意料地,1d11处理不仅干扰甲氨蝶呤诱导的表达tgf-β的细胞的扩充,而且还干扰表达il-10和foxp3的一些子集的扩充。特别地,b10b细胞(图46)和滤泡b细胞(图47)就是如此,尽管foxp3+滤泡b细胞不表现为经历1d11效应。在移行2b细胞(其中1d11处理干扰tgf-β表达移行2b细胞)中,在il-10+移行2b细胞(包括活化的移行2b细胞;图48)的情况中没有看到效应。此外,通过1d11在foxp3+移行2b细胞中得到的效应在此小的处理组中似乎不明显,除非查看活化的、cd86+移行2b细胞。重要地,这些数据提示了甲氨蝶呤诱导的tgf-β与仅一些细胞类型中的il-10和foxp3有关。对于移行3b细胞,即使移行3子集中有可检测的tgf-β(图49),1d11处理对这些细胞没有明显影响(p<0.05;图49)。值得注意地,在活化的cd86+移行3b细胞中,经1d11处理的小鼠中表现为有较高的il-10+移行3b细胞数目。这可以提示此群体可能在扩充以努力帮助补充由于1d11处理所致的其它细胞类型数目的损失。还值得注意的是,1d11处理不影响这些细胞中il-10、tgf-β、和foxp3的基础水平(分别为图50a-c),但是它表现为影响甲氨蝶呤对表达那些细胞因子的细胞的影响。
总之,与用同种型对照处理的动物相比,在甲氨蝶呤诱导的免疫耐受性期间通过注射tgf-β抗体干扰tgf-β减少表达tgf-β的细胞的数目。此外,在甲氨蝶呤诱导的耐受性的情况中在il-10和foxp3表达b10b细胞方面观察到的典型增加受到1d11处理抑制。1d11处理表现为影响甲氨蝶呤对某些b细胞类型,而非全部b细胞类型中tgf-β、il-10、和/或foxp3的影响。这些观察结果是令人惊讶的,并且提示了甲氨蝶呤诱导tgf-β,其继而在某些细胞诸如b10b细胞中诱导il-10和潜在地foxp3。虽然tgf-β与il-10和foxp3的关联表现为先前已经报告过,但是它尚未在这些细胞类型中显示。此外,甲氨蝶呤尚未同时与此复杂的信号传导级联联系起来。
至此,我们已经证明了某些b细胞在甲氨蝶呤诱导的耐受性的情况中显著增加,并且那些b细胞表达与免疫调节(抑制)有关的蛋白质。为了更直接评估b细胞自身是否在介导甲氨蝶呤诱导的耐受性,我们实施过继转移实验,其评估来自经甲氨蝶呤耐受化的小鼠的总脾b细胞是否可以将免疫耐受性转移至未免疫的宿主。我们使用
实施例16:甲氨蝶呤改善移植物病理学
我们还已经产生鼠抗胸腺细胞球蛋白背景中的别的数据,其证明了甲氨蝶呤不消减正常动物(图52)和移植动物(图53)中的cd4+、cd8+、t调节(cd4+cd25+foxp3+)t细胞、和总cd19+b细胞。在比较用单独的或与甲氨蝶呤组合的非特异性家兔igg处理的正常动物时,血液和脾中的细胞群体没有显著变化(图52)。此外,在比较自用单独的matg或用matg和甲氨蝶呤处理的动物分离的那些群体时,没有增强的消减。更确切地,我们仅观察到matg介导的cd4+、cd8+、和t调节细胞效应的延长,其最可能是由于通过甲氨蝶呤实现的延长的matg暴露(图52)。另外,接受异基因移植物的动物中单独的甲氨蝶呤处理没有消减那些特定的细胞子集(图53)。与仅用matg处理的动物相比用matg和甲氨蝶呤处理的动物中更低的cd4+和cd8+t细胞数目可以通过在甲氨蝶呤处理的背景中时matg的延长效应解释。重要地,甲氨蝶呤没有诱导b细胞减少,如若甲氨蝶呤杀死活化的b细胞以降低正常或移植动物中的抗体应答会预期的(图52和53)。这些数据提示了甲氨蝶呤对抗药物抗体的影响可以不通过抗叶酸诱导的对活化的b细胞的消减介导。如预期的,matg处理也没有影响此异位心脏异基因移植物模型中总b细胞数目。总体上,matg和甲氨蝶呤的组合处理减弱移植物排斥病理学的严重性,并且与移植物中减少的t细胞浸润物有关,而不与具有调节t细胞表型的细胞增加有关。这与在
为了评估长期存活的移植物中的组织学变化及了解matg和甲氨蝶呤组合对移植物存活的机制,收集心脏移植物,并评估病理学及细胞组成。特别地,由于调节t细胞已经与移植中长期移植物存活联系起来,由
由于matg和甲氨蝶呤组合处理的效果有可能越接近移植时间越活跃发生,我们还在移植后7天(对于未处理的小鼠)或14天(对于所有处理组)评估病理学,并表征移植的心脏异基因移植物的细胞浸润物。未处理的异基因移植物展现出移植物排斥病理学,包括心肌炎、心肌变性和坏死(冠状动脉的心外膜和心肌内分支两者中)。比较而言,从用matg和甲氨蝶呤两者处理的动物分离的异基因移植物揭示了不太严重的cav。这与来自未处理的动物及来自用matg或甲氨蝶呤处理的动物的异基因移植物比较。如预期的,来自未处理小鼠的同基因移植物在这些时间点时揭示很少或无病理学。在来自未处理的小鼠和仅用matg或甲氨蝶呤处理的那些小鼠的异基因移植物中的心肌膜和心外膜中观察到cd3+t细胞浸润。少数cd3+t细胞也存在于与这些移植物中的cav损伤有关的炎性细胞浸润物中。相反,来自用matg和甲氨蝶呤的组合处理的动物的异基因移植物展现出心肌膜中实质性较低的cd3+t细胞浸润和心外膜中仅最小限度的cd3+t细胞浸润。同基因心脏移植物仅在心外膜中显示最小限度的cd3+t细胞浸润。心外膜中炎性细胞浸润物内小比例的t细胞表现为具有t调节细胞表型,如由双重cd3和foxp3免疫反应性指示的,但是此频率表现为在炎性浸润物内不比在其它组中大。因此,降低的病理学也在用matg和甲氨蝶呤处理后早期观察到,并且与降低的和心外膜约束的t细胞浸润有关。
- 还没有人留言评论。精彩留言会获得点赞!