基于活细胞3D打印的组织工程仿生肝叶结构及制备方法与流程
本发明属于生物医学工程,特别涉及一种基于活细胞3d打印的组织工程仿生肝叶结构及制备方法,即采用生物3d打印的方式,制备出能长期存活和具有生物功能的人工血管化含胆管肝叶。
背景技术:
现有的人工组织通常采用细胞的体外三维培养来制备,只能制备出小体积人工组织。当人工组织的厚度超过2毫米时就会造成组织深部供养障碍,导致人工组织难以长期存活。为解决深部供养障碍的问题,国内外研究者进行了多种不同的探索。例如将细胞接种在多孔支架上并浸泡在培养基中进行培养,使得营养物质能够通过孔道到达细胞处,但是该方法存在一定的局限性:随着细胞的生长,支架中的孔道会被细胞填满而阻塞营养物质的流通,并且该方法所形成的大体积人工组织由于有支架材料的阻隔难以形成如正常组织中的细胞功能集成;另外也有研究者采用能诱导血管长入的水凝胶材料来包裹细胞培养形成大体积人工组织并植入体内,让逐步长入的血管来供养,但是该方法任然存在深部供养障碍的问题,在血管还没有长入深部的时候,深部的细胞就已经因为缺少养分而死亡,难以实现真正的大体积人工组织的长期存活。
随着能够打印活细胞的生物3d打印技术的发展,人们开始利用生物3d打印技术来制备各种人工组织,其中就包括人工血管与人工肝组织。生物3d打印人工血管的出现,使得大体积人工组织的深部供养成为可能。现有最先进的生物3d打印人工肝组织主要是:1、杭州捷诺飞公司应用生物3d打印技术,以肝组织解剖学和生理学数据为基础,模拟肝小叶构建三维模型,用人肝干细胞打印具有功能结构的肝单元产品regenovo3dliver。打印的肝单元体积为人体肝小叶(高2mm,宽1mm)的10倍,并且可以在实验室条件下存活超过3个月,具有一定的肝叶功能;2、美国organovo公司生产的微型肝叶产品exvive3d,其只有0.5mm厚、4mm见方。为制造这种结构,打印机叠加了约20层肝组织细胞和肝星状细胞,这是两种主要的肝细胞,另外还同时打印了血管内皮细胞,这些细胞形成管道网向肝细胞供应养分和氧气,使组织得以存活五天以上并具有一定的肝叶功能。
其中第一个产品存在使用细胞单一导致的功能不全问题和无血管系统导致的供养距离不足问题。由于血管网构建不完善,导致供养距离太短,所以打印的肝组织都较小(最厚处不超过5mm)。第二个产品存在存活时间较短、力学强度差和血管结构简单(构成细胞单一、网状结构简单)的问题。这两个产品受到血管系统系统和体外供养系统不全的限制,都存在打印的人工肝组织尺寸受限的问题,尺寸受限后就没有办法仿生大体积肝组织所具有的一些功能,比如缺少胆管这一结构,缺少胆汁运输功能。有些公司的产品通过打印时掺入内皮细胞,可能会形成一些管道,但是并不会形成具有血管完全功能(渗透、运输、联通循环)的血管网,这些形成的管道与真正的血管网的功能大相径庭。
技术实现要素:
本发明的目的在于针对现有技术的不足,提供一种基于活细胞3d打印的组织工程仿生肝叶结构及制备方法,采用生物3d打印技术来制备人工含胆管肝叶,使之模拟人体肝叶的结构与生物功能,以实现人工含胆管肝叶在体内外的长期存活和生物功能。
本发明的目的是这样实现的:
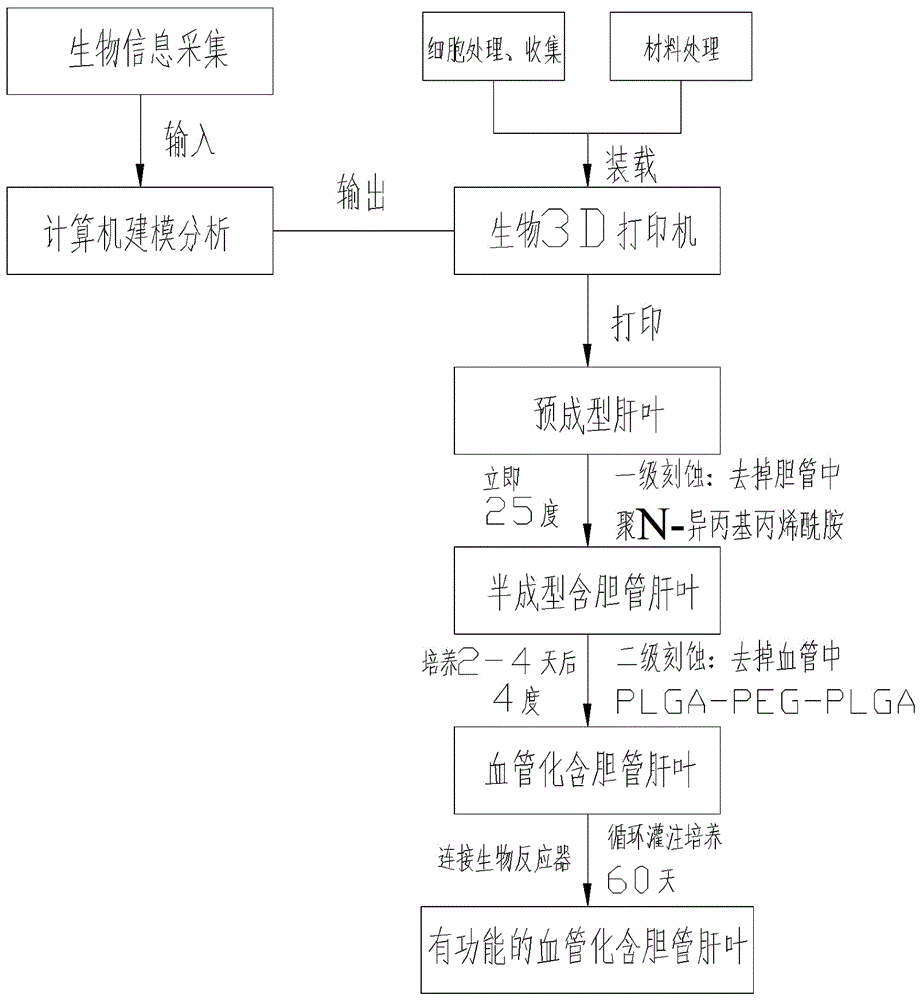
一种基于活细胞3d打印的组织工程仿生肝叶的制备方法,包括如下步骤:
1)建模:
采集人体肝叶的生物信息(包括其中血管系统的信息和胆管系统的信息),输入计算机进行仿生建模,模仿肝叶实际组织外观与微环境,表达为多材料、多尺度的肝叶的几何模型;
2)配料:
准备构建人体肝叶所需的多种细胞,配制适用构建人体肝叶所需的多种细胞的液态可固化水凝胶材料载体,将构建人体肝叶所需的多种细胞按设定的密度分别与相应的液态可固化水凝胶材料载体混合,配制成含细胞的多种生物墨水,每种生物墨水中只包含一种细胞,同时,配制弹力纤维打印材料,以及配制用于胆管管腔成型的第二铸型剂,配制用于血管管腔成型的第一铸型剂;
3)3d打印制备肝叶坯体:
在组织工程仿生培养器中进行3d打印,将步骤1)建好的模型数据输入生物3d打印机的配套设备中,设置打印程序,将步骤2)中配制的铸型剂、弹力纤维打印材料以及生物墨水分别装载到生物3d打印机,生物3d打印机的多个喷头按照设定的打印程序轮流喷出液滴进行3d打印,其中喷出的各种液滴分别在相应的条件下自动固化,其中,用步骤2)配制的含肝细胞的生物墨水打印肝叶的肝组织,用步骤2)配制的第一铸型剂打印肝叶的血管管腔区域,形成血管管腔成型支撑体,用步骤2)配制的弹力纤维打印材料打印肝叶的血管管壁的弹力纤维层,用步骤2)配制的多种生物墨水分别打印肝叶的血管管壁对应的细胞层,实现肝叶的血管管壁的多层结构打印,形成成纤维细胞-平滑肌细胞-弹力纤维-内皮细胞的血管管壁结构;用步骤2)配制的第二铸型剂打印肝叶的胆管管腔区域,形成胆管管腔成型支撑体,用步骤2)配制的弹力纤维打印材料打印肝叶的胆管管壁的弹力纤维层,用步骤2)配制的多种生物墨水分别打印肝叶的胆管管壁对应的细胞层,实现肝叶的胆管管壁的多层结构打印,形成成纤维细胞-平滑肌细胞-弹力纤维-胆管上皮细胞的胆管管壁结构;打印完成后形成肝叶坯体;
4)刻蚀成型:
将固化成型的肝叶坯体进行分级刻蚀,根据组织发育的规律,在不同阶段采用不同的手段分别去除肝叶坯体中用于胆管管腔成型的第二铸型剂以及用于血管管腔成型的第一铸型剂,得到成型有胆管系统和血管系统的仿生肝叶。本发明采用分级刻蚀,先通过胆管系统早期供养,再通过完善的血管系统后期供养。同时刻蚀较早会造成供养系统没有完全长好,同时刻蚀较晚会造成早期的中心供养不足。
5)体外培养:
将成型有胆管系统和血管系统的仿生肝叶的主血管与培养液输送管连接进行组织工程培养,实现仿生肝叶的血管系统循环供养与气体交换,完成仿生肝叶的存活与功能化。
由于打印组织可能刚打印完强度比较差,需要一定的塑性时间,故可在肝叶外部用第三铸型剂打印辅助塑性区域,形成辅助塑性部,形成辅助塑性体后再采用刻蚀手段去除辅助塑性部,即可得到肝叶坯体。如步骤1)建立的几何模型还包括肝叶外的辅助塑性部,辅助塑性部由第三铸型剂通过3d打印成型后再经刻蚀手段去除,得到肝叶坯体。得到肝叶坯体或即可通过两级刻蚀分别去除血管和胆管中的铸型剂,构造出人工含胆管肝叶中的血管系统和胆管系统。铸型剂去除顺序为第三铸型剂、第二铸型剂、第一铸型剂。即0级刻蚀去除的是第三铸型剂,一级刻蚀去除的是第二铸型剂,二级刻蚀去除的是第一铸型剂。去除第一铸型剂、第二铸型剂、第三铸型剂采用的手段均不相同。铸型剂的去除手段有酶或螯合反应或温控或光照等。
打印过程中,用含肝细胞的生物墨水打印肝组织,用含胆管上皮细胞的生物墨水、含平滑肌细胞的生物墨水、含成纤维细胞的生物墨水以及弹力纤维打印材料分别打印胆管管壁的四层环状结构。用含血管内皮细胞的生物墨水、含平滑肌细胞的生物墨水、含成纤维细胞的生物墨水以及弹力纤维打印材料分别打印血管管壁的四层环状结构。用铸型剂打印胆管管腔、血管管腔,使铸型剂作为胆管管腔、血管管腔的成型支撑体。在铸型剂固化后,通过特异性酶、螯合反应、温控或光照等手段去除血管和胆管中的铸型剂,构造出人工含胆管肝叶中的血管系统和胆管系统。
本发明实现肝叶坯体中含细胞部分的打印可以采用单细胞打印,也可以采用多细胞打印,喷头一次可喷一个或多个细胞。当采用单细胞打印时,通过控制喷头的口径与液滴的体积与单细胞的尺寸一致,使得生物3d打印机的各个喷头喷出的每滴液滴只含一个细胞。当采用多细胞打印时,通过控制喷头的口径与液滴的体积变化,使得生物3d打印机的各个喷头喷出的每滴液滴含有不同的细胞数量。根据肝叶坯体中不同结构的精细程度,采用相应的单细胞打印或多细胞打印手段,其中墨水打印体积平均速度≥0.015ml/s,墨水打印体积平均速度指平均一秒钟内从喷头中喷到打印对象上的墨水体积,墨水打印体积平均速度用于控制打印的总时间。墨水打印细胞平均速度≥10000个/s,墨水打印细胞平均速度指平均一秒钟内从喷头中喷到打印对象上的细胞数量,这个参数用于控制打印的肝叶坯体中细胞的密度。并且要求打印的细胞间的间距(细胞间的间距包括同一种细胞的间距以及不同细胞间的间距)≤0.2mm,这个参数用于控制打印的精度和打印的肝叶坯体中细胞的密度。
优选地,3d打印过程中所有材料包括液态可固化水凝胶材料载体、弹力纤维打印材料以及铸型剂都采用都是水凝胶材料。所述水凝胶材料为胶原、明胶、聚乙二醇、琼脂糖、丝素蛋白、葡聚糖、壳聚糖、普朗尼克f127、聚n-异丙基丙烯酰胺、聚丙交酯乙交酯-聚乙二醇-聚丙交酯乙交酯、纤维蛋白原、甲基丙烯酸、丙烯酸酯明胶、海藻酸钠等材料的一种。
优选地,所述铸型剂采用可控降解水凝胶。可控降解水凝胶是一种能够通过光或酶或温度或螯合反应等手段将其在固体状态下去除掉的水凝胶。所述可控降解水凝胶为壳聚糖、普朗尼克f127、聚n-异丙基丙烯酰胺、聚丙交酯乙交酯-聚乙二醇-聚丙交酯乙交酯、纤维蛋白原、甲基丙烯酸、丙烯酸酯明胶、海藻酸钠等材料中的一种。可控降解水凝胶材料还可以用于组织外周塑形。
所述液态可固化水凝胶材料载体采用能固化成型的水凝胶材料。含细胞的生物墨水中加入促生长细胞因子,不同的细胞加入相应的促生长细胞因子。生物墨水细胞密度≥700000个/ml。
所述弹力纤维打印材料采用能固化的且具有弹性的蛋白质或其他生物相容性物质,使血管管壁有弹性,可舒张或收缩。如弹力纤维打印材料可以为丝素蛋白和胶原的混合液。
打印过程中,组织工程仿生培养器中承载打印组织的打印平台根据打印的速度缓缓下降,使已固化成型的打印组织浸入培养器的培养液中,以保持组织中细胞的活性。
本发明还公开了一种基于活细胞3d打印的组织工程仿生肝叶结构,采用上述方法构建,包括由只含肝细胞的生物墨水通过3d打印成型的肝组织,以及位于肝组织内通过3d打印成型的血管系统和胆管系统,所述血管系统的血管管壁由弹力纤维层和多个细胞层构成多层环状结构,该血管管壁的弹力纤维层由弹力纤维打印材料通过3d打印成型,该血管管壁的各个细胞层分别由对应的含细胞的生物墨水通过3d打印成型,该血管管壁的一个细胞层内只包含一种细胞,所述血管管壁内由第一铸型剂通过3d打印成型有血管管腔成型支撑体,所述血管管壁内的血管管腔成型支撑体经刻蚀后形成血管管腔,所述胆管系统的胆管管壁由弹力纤维层和多个细胞层构成多层环状结构,该胆管管壁的弹力纤维层由弹力纤维打印材料通过3d打印成型,该胆管管壁的各个细胞层分别由对应的含细胞的生物墨水通过3d打印成型,该胆管管壁的一个细胞层内只包含一种细胞,所述胆管管壁内由第二铸型剂通过3d打印成型有胆管管腔成型支撑体,所述胆管管壁内的胆管管腔成型支撑体经刻蚀后形成胆管管腔。本发明的血管管壁、胆管管壁分层打印,结构清楚,能够形成血管、胆管功能。
所述血管管壁为四层环状结构,从内向外分别为第一血管细胞层、弹力纤维层、第二血管细胞层、第三血管细胞层,血管管壁的第一血管细胞层由只含血管内皮细胞的生物墨水通过3d打印成型,血管管壁的弹力纤维层由弹力纤维打印材料通过3d打印成型,血管管壁的第二血管细胞层由只含平滑肌细胞的生物墨水通过3d打印成型,血管管壁的第三血管细胞层由只含成纤维细胞的生物墨水通过3d打印成型。
所述胆管管壁为四层环状结构,从内向外分别为第一胆管细胞层、弹力纤维层、第二胆管细胞层、第三胆管细胞层,胆管管壁的第一胆管细胞层由只含胆管上皮细胞的生物墨水通过3d打印成型,胆管管壁的弹力纤维层由弹力纤维打印材料通过3d打印成型,胆管管壁的第二胆管细胞层由只含平滑肌细胞的生物墨水通过3d打印成型,胆管管壁的第三胆管细胞层由只含成纤维细胞的生物墨水通过3d打印成型。
血管网在仿生肝叶结构的进、出口处汇集成主血管。胆管网在仿生肝叶结构的出口处汇集成主胆管。血管系统两端的主血管与生物反应器连接。
本发明的有益效果为:本发明首先采集人体肝叶组织的生物信息,并输入计算机进行高仿生建模;然后通过高精度生物3d打印机,利用水凝胶材料和用于构建人肝叶组织所需的肝、胆管上皮、血管内皮、平滑肌和成纤维等细胞进行材料单独打印与材料-细胞混合打印输出,其中血管和胆管中的空洞部分用铸型剂打印;在所有水凝胶材料固化后,通过特异性酶或螯合反应或温控或光照等手段去除血管和胆管中的铸型剂,构造出人工含胆管肝叶中的血管系统和胆管系统,血管系统两端的主血管用于连接培养液输送管,实现人工含胆管肝叶的血管系统循环供养与气体交换。
本发明通过多层结构精确打印,高度还原与优化了血管(成纤维细胞-平滑肌细胞-弹力纤维-内皮细胞血管结构)、胆管(成纤维细胞-平滑肌细胞-弹力纤维-胆管上皮细胞胆管结构)的结构与生物功能,解决了之前生物3d打印人工血管管壁过厚、组成细胞单一、不具有生物功能与血管口径过大的问题。本发明提出了多层结构打印血管组织和胆管组织,形成具有血管完全功能(渗透、运输、联通循环)的血管网以及具有胆管完全功能的胆管系统。本发明通过具有完全功能的血管系统的构建与循环供养解决了供养距离受限与大体积人工肝组织在体外长期存活的问题。
本发明通过血管系统和胆管系统内可控降解材料的打印后去除技术解决了直接打印管道系统导致的结构不稳定问题。
本发明通过人体肝叶组织的生物信息采集、计算机建模和多喷头、单细胞精确打印,高度还原了肝叶组织的血、胆管结构与生物功能,解决了之前生物3d打印人工肝叶组织组成细胞单一、结构简单和生物功能简单的问题。
当本发明可采用购买的用于构建人体肝叶所需的多种细胞,也可采用自体来源的肝组织细胞分离、扩增得到的生物3d打印细胞“墨水”时,采用自体来源的肝组织细胞可以解决使用异体细胞植入导致的排异反应问题。
附图说明
图1为本发明的基于活细胞3d打印技术制备人工含胆管肝叶的方法的流程图;
图2为本发明的基于活细胞3d打印的组织工程仿生肝叶结构的血管截面图;
图3为本发明的基于活细胞3d打印的组织工程仿生肝叶结构的胆管截面图。
具体实施方式
实施例1(温控双级刻蚀)
参见图1,本实施例公开了一种基于活细胞3d打印的组织工程仿生肝叶的制备方法,包括如下步骤:
1、生物信息采集与建模:
1)通过ct、核磁共振和微三维扫描技术个性化采集正常人含胆管肝叶的内外部结构和血循环管网的三维数据;
2)将采集的生物信息输入计算机软件,模仿实际组织外观与微环境表达为多材料、多尺度的几何模型,可以将肝叶的血管网两端设计成两条进出的主血管,用于与培养液输送管相连可以形成循环的血管网;将胆管网络设计成分散的小胆管逐渐汇聚增大,最终形成一条大的主胆管可向外排出胆汁。
2、配制含细胞的生物墨水:
1)购买用于构建人体肝叶所需的多种活细胞,如肝细胞、胆管上皮细胞、血管内皮细胞、平滑肌细胞和成纤维细胞。所述活细胞也可从患者人体获得,经过体外培养扩增,作为3d打印的原料,这样可以解决使用异体细胞植入导致的排异反应问题。
2)准备10%的丙烯酸酯明胶,用移液枪将丙烯酸酯明胶和多种细胞分别混合均匀,配制含细胞的多种生物墨水。每种含细胞的生物墨水中只包含一种细胞。含细胞的生物墨水中加入促生长细胞因子,不同的细胞加入相应的促生长细胞因子。
3、配制不含细胞的材料:
分别配制第一铸型剂、第二铸型剂、第三铸型剂以及弹力纤维打印材料。
本实施例第一铸型剂为聚丙交酯乙交酯-聚乙二醇-聚丙交酯乙交酯溶液。本实施例第二铸型剂为聚n-异丙基丙烯酰胺溶液。配制的聚n-异丙基丙烯酰胺溶液和聚丙交酯乙交酯-聚乙二醇-聚丙交酯乙交酯溶液的浓度均为100mg/ml,在打印前将其储存在4℃冰箱中,使其保持液体状态。本实施例第三铸型剂为聚(乙烯醇)/环氧丙氧基香豆素水凝胶,固含量10%。本实施例弹力纤维打印材料为丝素蛋白和胶原的混合物,作为内皮细胞和平滑肌细胞间弹力纤维的替代物。
4、3d打印:
在组织工程仿生培养器中进行3d打印,3d打印机置于37℃无菌环境中并装置有多个喷头。多个喷头中,有五个喷头用于分别喷出含有肝细胞的生物墨水、含有胆管上皮细胞的生物墨水、含有血管内皮细胞的生物墨水、含有平滑肌细胞的生物墨水以及含有成纤维细胞的生物墨水,这五个喷头保持常温且带有紫外光源;有两个喷头用于分别喷出第一铸型剂、第二铸型剂,这两个喷头保持4℃且不带紫外光源;有一个喷头用于喷出第三铸型剂,本实施例该喷头带有365nm紫外光源。365nm的紫外光源是固化的作用。还有一个喷头用于喷出丝素蛋白和胶原的混合物,这一个喷头保持常温且不带紫外光源,打印前打开控制3d打印机的软件,载入之前建立的几何模型,设置打印程序;
装载:将含有肝细胞的生物墨水、含有胆管上皮细胞的生物墨水、含有血管内皮细胞的生物墨水、含有平滑肌细胞的生物墨水以及含有成纤维细胞的生物墨水分别加入到五个喷头各自对应的料仓中,将不含细胞的聚n-异丙基丙烯酰胺和聚丙交酯乙交酯-聚乙二醇-聚丙交酯乙交酯(plga-peg-plga)分别加入到两个喷头各自对应的料仓中,将聚(乙烯醇)/环氧丙氧基香豆素水凝胶加入到一个喷头对应的料仓中,将丝素蛋白和胶原的混合物加入到另一个喷头对应料仓中。
喷出:生物3d打印机的多个喷头按照设定的打印程序轮流喷出液滴进行3d打印,喷头喷出的聚n-异丙基丙烯酰胺、聚丙交酯乙交酯-聚乙二醇-聚丙交酯乙交酯(plga-peg-plga)及丝素蛋白和胶原混合物的液滴在37℃的环境中会自动固化,聚n-异丙基丙烯酰胺和聚丙交酯乙交酯-聚乙二醇-聚丙交酯乙交酯(plga-peg-plga)作为后面要去除的辅助成型材料分别填充胆管和血管中的空洞,丝素蛋白和胶原混合物作为内皮细胞和平滑肌细胞间弹力纤维的替代物。喷头喷出的聚(乙烯醇)/环氧丙氧基香豆素水凝胶在365nm波长紫外光作用下固化。喷头喷出的含细胞丙烯酸酯明胶的喷头会同时用365nm波长紫外光照射喷出的液滴使其固化。
其中,用配制的第三铸型剂打印几何模型中肝叶外辅助塑性区域;用配制的含肝细胞的生物墨水打印几何模型中肝叶的肝组织区域;用配制的第一铸型剂打印几何模型中肝叶的血管管腔区域,用配制的弹力纤维打印材料打印几何模型中肝叶的血管管壁的弹力纤维层区域,用配制的多种生物墨水分别打印几何模型中肝叶的血管管壁对应的细胞层区域,实现几何模型中肝叶的血管管壁的多层结构打印,形成成纤维细胞-平滑肌细胞-弹力纤维-内皮细胞的血管管壁结构;用配制的第二铸型剂打印几何模型中肝叶的胆管管腔区域,用配制的弹力纤维打印材料打印几何模型中肝叶的胆管管壁的弹力纤维层区域,用配制的多种生物墨水分别打印几何模型中肝叶的胆管管壁对应的细胞层区域,实现几何模型中肝叶的胆管管壁的多层结构打印,形成成纤维细胞-平滑肌细胞-弹力纤维-胆管上皮细胞的胆管管壁结构,打印完成后形成肝叶坯体。
打印时,墨水打印体积平均速度≥0.015ml/s,墨水打印细胞平均速度≥10000个/s,打印的细胞间距≤0.2mm。打印过程中,组织工程仿生培养器中的承载打印组织的平台会根据打印的速速缓缓下降,使已固化成型的组织浸入37℃的培养液中,以保持组织中细胞的活性。打印完第二层后,第一层开始缓慢浸入培养液中,同时开始打印第三层,打印增高的速度与下降速度一样,始终保持液滴不会滴入培养液中。下降和打印是同时进行的。
5、刻蚀成型:
打印完成后,进行分级刻蚀,具体步骤为:
打印完成后2小时,通过照射254nm的紫外光降解去除几何模型中肝叶外辅助塑性区域的第三铸型剂,如聚(乙烯醇)/环氧丙氧基香豆素水凝胶铸型剂。当然,第三铸型剂还可以为含香豆素基团的四臂聚乙二醇水凝胶、含胸腺嘧啶的聚丙烯酰胺水凝胶、含o-nb基团的单丙烯酸聚乙二醇水凝胶等光刻蚀材料等。
通过降温到25℃去除胆管中的聚n-异丙基丙烯酰胺完成一级刻蚀,以形成胆管系统,并通过胆管系统进行初步灌注供养。经过2-4天细胞生长与融合的过程,通过降低温度到4℃去除血管中的聚丙交酯乙交酯-聚乙二醇-聚丙交酯乙交酯(plga-peg-plga)完成二级刻蚀,以形成血管系统,最终完成血管化含胆管肝叶的制备。
本实施例中一级刻蚀所选用的材料可以替换为壳聚糖、普朗尼克f127、聚n-异丙基丙烯酰胺、聚丙交酯乙交酯-聚乙二醇-聚丙交酯乙交酯、甲基丙烯酸等温敏水凝胶中相变温度较高的一种;二级刻蚀所选用的材料可以替换为壳聚糖、普朗尼克f127、聚n-异丙基丙烯酰胺、聚丙交酯乙交酯-聚乙二醇-聚丙交酯乙交酯、甲基丙烯酸等温敏水凝胶中相变温度较低的一种。所选择的一、二级刻蚀温度可以根据选择的一、二级辅助成型材料而变化,其范围在0℃至37℃之间,且一级刻蚀温度一定高于二级刻蚀温度,其与辅助成型材料相变温度的关系为:0℃<二级刻蚀温度<二级辅助成型材料相变温度<一级刻蚀温度<一级辅助成型材料相变温度<37℃。
6、体外培养:
成型的打印肝叶组织浸泡在组织工程仿生培养器的培养液中,并将培养液输送管连接含胆管肝叶的血管系统两端主血管,在智能化仿生组织培育系统内连续循环灌注培养60天,通过循环供养与气体交换,完成含胆管肝叶以及血管的长期存活与功能化,同时检测细胞存活率、组织生成效果和生物功能,还可进行后续的药物试验。另外通过将培育好的含胆管肝叶主血管两端和动物体内的动静脉吻合与将主胆管的两端和动物体内的胆管吻合,进行动物体内的试验,测试该含胆管肝叶是否具有正常肝叶的所有生物功能。比如在60天体外培养之后,取血管网中的细胞做细胞活性检测,并对血管网进行功能测试:物质的渗透、运输功能测试,测试表明,采用本发明的方法构建的血管网具有血管完全功能(渗透、运输、联通循环),细胞活性好,采用本发明的方法构建好的打印组织可以实现移植物长期体内存活与生物功能。
实施例2(温控、酶双级刻蚀)
本实施例的第一铸型剂为纤维蛋白原与凝血酶。分别配制纤维蛋白原、凝血酶、纤维蛋白酶溶液。配制的纤维蛋白原溶液浓度为100mg/ml,凝血酶和纤维蛋白酶溶液浓度为1u/ml,在打印前将其储存在4℃冰箱中。喷出不含细胞的纤维蛋白原与凝血酶的喷头保持4℃且不带紫外光源。其中喷出纤维蛋白原与凝血酶的喷头分为两层将纤维蛋白原与凝血酶分开,在喷出之后纤维蛋白原与凝血酶才混合在一起。
本实施例的第二铸型剂为聚n-异丙基丙烯酰胺。配制的聚n-异丙基丙烯酰胺溶液浓度为100mg/ml,在打印前将其储存在4℃冰箱中,使其保持液体状态。喷出不含细胞的聚n-异丙基丙烯酰胺的喷头保持4℃且不带紫外光源。
其中喷出的聚n-异丙基丙烯酰胺、纤维蛋白原与凝血酶的液滴在37℃的环境中会自动固化,聚n-异丙基丙烯酰胺和纤维蛋白原与凝血酶作为后面要去除的辅助成型材料分别填充胆管和血管中的空洞。
通过降温到25℃去除胆管中的聚n-异丙基丙烯酰胺完成一级刻蚀,以形成胆管系统,并通过胆管系统进行初步灌注供养。经过2-4天细胞生长与融合的过程,通过从血管系统的两端持续灌注纤维蛋白酶去除血管中的纤维蛋白原与凝血酶完成二级刻蚀,以形成血管系统,最终完成血管化含胆管肝叶的制备。
本实施例中一级刻蚀所选用的材料可以替换为壳聚糖、普朗尼克f127、聚n-异丙基丙烯酰胺、聚丙交酯乙交酯-聚乙二醇-聚丙交酯乙交酯、甲基丙烯酸等温敏水凝胶中的一种;二级刻蚀所选用的材料可以替换为其他的能够被酶消化并变成液体的材料。除上述特征本实施例的其他特征与实施例1相同。
实施例3(温控、螯合反应双级刻蚀)
本实施例的第一铸型剂为不含细胞的海藻酸钠与cacl2。配制海藻酸钠、cacl2、乙二胺四乙酸(edta)溶液。配制的海藻酸钠质量分数为10%,cacl2的质量分数为0.5%。edta溶解在naoh中,浓度为100mg/ml。喷出不含细胞的海藻酸钠与cacl2的喷头保持4℃且不带紫外光源。其中喷出海藻酸钠与cacl2的喷头分为两层将海藻酸钠与cacl2分开,在喷出之后海藻酸钠与cacl2才混合在一起。
本实施例第二铸型剂为聚n-异丙基丙烯酰胺。配制的聚n-异丙基丙烯酰胺溶液浓度为100mg/ml,在打印前将其储存在4℃冰箱中,使其保持液体状态。喷出不含细胞的聚n-异丙基丙烯酰胺的喷头保持4℃且不带紫外光源。
其中喷出的聚n-异丙基丙烯酰胺、海藻酸钠与cacl2的液滴在37℃的环境中会自动固化,聚n-异丙基丙烯酰胺和海藻酸钠与cacl2作为后面要去除的辅助成型材料分别填充胆管和血管中的空洞。
通过降温到25℃去除胆管中的聚n-异丙基丙烯酰胺完成一级刻蚀,以形成胆管系统,并通过胆管系统进行初步灌注供养。经过2-4天细胞生长与融合的过程,通过从血管系统的两端持续灌注edta溶液去除血管中的海藻酸钠与cacl2完成二级刻蚀,以形成血管系统,最终完成血管化含胆管肝叶的制备。
本实施例中一级刻蚀所选用的材料可以替换为壳聚糖、普朗尼克f127、聚n-异丙基丙烯酰胺、聚丙交酯乙交酯-聚乙二醇-聚丙交酯乙交酯、甲基丙烯酸等温敏水凝胶中的一种;二级刻蚀所选用的材料可以替换为其他的能够被螯合反应变成液体的材料。除上述特征本实施例的其他特征与实施例1相同。
以上三个实施例中的温控、酶、螯合反应刻蚀方法可以灵活地两两组合用于胆管和血管的双级刻蚀,形成更多的实施例。本发明用购买的构建人体肝叶所需的多种细胞,如肝细胞、胆管上皮细胞、血管内皮细胞、平滑肌细胞和成纤维细胞配制含细胞的多种生物墨水,采用生物3d打印技术来制备人工含胆管肝叶,使之模拟人体肝叶的结构与生物功能,以实现人工含胆管肝叶在体内外的长期存活和生物功能。
本发明的方法也同样适用于使用自体来源的肝细胞、血管细胞和胆管细胞分离、扩增得到的用于生物3d打印的细胞,这样可以解决使用异体细胞植入导致的排异反应问题。
实施例4
参见图2和图3,本实施例公开了一种采用上述方法制备的基于活细胞3d打印的组织工程仿生肝叶结构,包括由只含肝细胞的生物墨水通过3d打印成型的肝组织,以及位于肝组织内通过3d打印成型的血管系统和胆管系统,所述血管系统的血管管壁由弹力纤维层和多个细胞层构成多层环状结构,该血管管壁的弹力纤维层由弹力纤维打印材料通过3d打印成型,该血管管壁的各个细胞层分别由对应的含细胞的生物墨水通过3d打印成型,该血管管壁的一个细胞层内只包含一种细胞,所述血管管壁内由第一铸型剂通过3d打印成型有血管管腔成型支撑体15,所述血管管壁内的血管管腔成型支撑体15经刻蚀后形成血管管腔,所述胆管系统的胆管管壁由弹力纤维层和多个细胞层构成多层环状结构,该胆管管壁的弹力纤维层由弹力纤维打印材料通过3d打印成型,该胆管管壁的各个细胞层分别由对应的含细胞的生物墨水通过3d打印成型,该胆管管壁的一个细胞层内只包含一种细胞,所述胆管管壁内由第二铸型剂通过3d打印成型有胆管管腔成型支撑体25,所述胆管管壁内的胆管管腔成型支撑体25经刻蚀后形成胆管管腔。本发明的血管管壁、胆管管壁分层打印,结构清楚,能够形成血管、胆管功能。
所述血管管壁为四层环状结构,从内向外分别为第一血管细胞层11、弹力纤维层12、第二血管细胞层13、第三血管细胞层14,血管管壁的第一血管细胞层11由只含血管内皮细胞的生物墨水通过3d打印成型,血管管壁的弹力纤维层12由弹力纤维打印材料通过3d打印成型,血管管壁的第二血管细胞层13由只含平滑肌细胞的生物墨水通过3d打印成型,血管管壁的第三血管细胞层14由只含成纤维细胞的生物墨水通过3d打印成型。
所述胆管管壁为四层环状结构,从内向外分别为第一胆管细胞层21、弹力纤维层22、第二胆管细胞层23、第三胆管细胞层24,胆管管壁的第一胆管细胞层21由只含胆管上皮细胞的生物墨水通过3d打印成型,胆管管壁的弹力纤维层22由弹力纤维打印材料通过3d打印成型,胆管管壁的第二胆管细胞层23由只含平滑肌细胞的生物墨水通过3d打印成型,胆管管壁的第三胆管细胞层24由只含成纤维细胞的生物墨水通过3d打印成型。
血管网在仿生肝叶结构的进、出口处汇集成主血管。胆管网在仿生肝叶结构的出口处汇集成主胆管。血管系统两端的主血管与培养液输送管连接。
本发明不仅仅局限于上述实施例,在不背离本发明技术方案原则精神的情况下进行些许改动的技术方案,应落入本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!