用于治疗增殖性障碍的给药方案的制作方法
用于治疗增殖性障碍的给药方案
[0001]
发明的技术领域
[0002]
本发明总体上涉及用于增殖性疾病的治疗方案的领域,更具体地涉及对局部晚期或转移癌患者使用姜黄素脂质体的给药方案。
[0003]
发明背景
[0004]
在不限制本发明的范围的情况下,结合姜黄素、姜黄素类化合物及其活性代谢物的用途和剂型描述其背景。
[0005]
已报道姜黄素在肿瘤组织和正常组织中用作抗氧化剂,并有助于维持细胞的氧化还原电位。姜黄植物提取物口服给药已在传统医学中使用了2000多年,据报道其无毒且没有伴随的全身性治疗活性,主要是由于水不溶性,肠和肝失活导致胃肠道以外组织的生物利用度可忽略不计。为了克服这些限制,正在开发具有脂质体、聚合物(n-异丙基丙烯酰胺、n-乙烯基吡咯烷酮和丙烯酸)和聚乳酸乙醇酸共聚物的肠胃外静脉内姜黄素制剂。
[0006]
kurzrock等人提交的第20060067998号美国专利申请提供了用于治疗人患者的癌症的组合物和方法,所述癌症包括胰腺癌、乳腺癌和黑色素瘤。该发明的方法和组合物采用包封在胶体药物递送系统,优选脂质体药物递送系统中的姜黄素或姜黄素类似物。合适的胶体药物递送系统还包括纳米颗粒、纳米胶囊、微粒或嵌段共聚物胶束。包封姜黄素或姜黄素类似物的胶体药物递送系统以药学上可接受的载体肠胃外给药。
[0007]
但是,需要使姜黄素和/或姜黄素类化合物的抗增殖活性最大化同时使负面副作用最小化的制剂和给药方案。
[0008]
发明概述
[0009]
在一个实施方案中,本发明包括一种治疗增殖性障碍的方法,该方法包括根据给药方案给予有其需要的人受试者治疗有效量的姜黄素或姜黄素类化合物静脉内脂质体,所述给药方案包括:至少一个治疗周期,所述治疗周期为在8小时或更短的时间内给予至少100mg/m2的治疗有效量的姜黄素或姜黄素类化合物脂质体。一方面,在所述治疗周期之后是4、5、6或7天的休息期,在所述休息期期间不给予脂质体或活性剂。另一方面,所述治疗周期为2、3、4、5、6、7、8、9、10、11或12个连续周。另一方面,所述姜黄素或姜黄素类化合物脂质体以125、150、200、250、300、350、400、450、500或600mg/m2的剂量给予。另一方面,所述姜黄素或姜黄素类化合物脂质体以100至600mg/m2的剂量,在2至6小时内给予。另一方面,所述姜黄素或姜黄素类化合物脂质体以300至600mg/m2的剂量,在2至4小时内给予。另一方面,所述姜黄素或姜黄素类化合物脂质体以300至600mg/m2的剂量,在2小时或更短的时间内给予。另一方面,给予所述姜黄素或姜黄素类化合物脂质体2、3、4、5、6或7小时。另一方面,所述姜黄素或姜黄素类化合物脂质体以至少300mg/m2的剂量,在2、3、4、5、6、7或8小时内给予。另一方面,所述姜黄素或姜黄素类化合物是合成的姜黄素或姜黄素类化合物。另一方面,所述方法进一步包括提供有效剂量的以下中的至少一种:伊立替康、5-氟尿嘧啶、亚叶酸、卡培他滨、蒽环类、阿霉素、达沙替尼、甲磺酸伊马替尼、拉帕替尼、尼洛替尼、索拉非尼、舒尼替尼、曲妥珠单抗、阿仑单抗、贝伐单抗、西妥昔单抗、吉妥珠单抗、帕尼单抗、利妥昔单抗、托西莫单抗、曲妥珠单抗及其组合。另一方面,所述增殖性疾病是转移癌。另一方面,所
述增殖性疾病选自乳腺癌、子宫癌、宫颈癌、脑癌、结肠癌、白血病、子宫颈癌、前列腺癌、胃肠道癌、肝癌、黑色素瘤或胰腺癌。另一方面,所述脂质体是包括以下的至少一种:1-肉豆蔻酰基-2-羟基-sn-甘油-3-磷酸胆碱(dmpc)、12-肉豆蔻酰基-2-羟基-sn-甘油-3-[磷酸-rac-(甘油)](dmpg)或dmpc/dmpg脂质体。一方面,溶血磷脂酰甘油包括以下中的至少一种:溶血磷脂酰胆碱、月桂酰基溶血磷脂酰胆碱、肉豆蔻酰基溶血磷脂酰胆碱、棕榈酰基溶血磷脂酰胆碱、硬脂酰基溶血磷脂酰胆碱、花生酰基溶血磷脂酰胆碱、油酰基溶血磷脂酰胆碱、亚油酰基溶血磷脂酰胆碱、亚麻酰基溶血磷脂酰胆碱或芥酰基溶血磷脂酰胆碱。另一方面,所述脂质体预防心包纤维化、心内膜心肌纤维化、心力衰竭、出血性心肌坏死、心肌病、心肌炎、左心室射血分数(lvef)降低、充血性心力衰竭(chf)、急性冠心病、高血压、心肌梗塞、qt延长、或由活性剂引起的心包炎。另一方面,所述脂质体不包封活性剂。另一方面,所述姜黄素或姜黄素类化合物脂质体是姜黄素/姜黄素类化合物:脂质体复合物,其中姜黄素占姜黄素/姜黄素类化合物:脂质体复合物的2至9重量%,其中姜黄素是天然或合成的姜黄素中的至少一种,并且其中姜黄素/姜黄素类化合物:脂质体复合物的姜黄素与脂质的比值(重量比重量)为1:7.5至1:10,其中脂质组合选自:dmpc、dmpc:chol 9:1、dmpc:dmpg 9:1、dmpc:chol:dmpg 8:1:1、dppc:dmpg 9:1、dppc:chol:dmpg 8:1:1、dmpc:dspe-peg-2000 95:5、dmpc:chol:dspe-peg-2000 90:10:05、dmpc/dmpg 7:3、dppc/dmpg 7:3、dppc/dmpg 9:1。
[0010]
在另一个实施方案中,本发明包括一种治疗增殖性障碍的方法,其包括根据给药方案给予有其需要的人受试者治疗有效量的姜黄素或其类似物静脉内脂质体,所述给药方案包括:至少一个治疗周期,所述治疗周期为每周一次在8小时内给予至少100mg/m2的治疗有效量的姜黄素静脉内脂质体。一方面,在所述治疗周期之后是4、5、6或7天的休息期,在所述休息期期间不给予姜黄素或其类似物静脉内脂质体。另一方面,所述治疗周期为2、3、4、5、6、7、8、9、10、11或12个连续周。另一方面,所述姜黄素或姜黄素类化合物脂质体以125、150、200、250、300、350、400、450、500或600mg/m2的剂量给予。另一方面,所述姜黄素或姜黄素类化合物脂质体以100至600mg/m2的剂量,在2至6小时内给予。另一方面,所述姜黄素或姜黄素类化合物脂质体以300至600mg/m2的剂量,在2至4小时内给予。另一方面,所述姜黄素或姜黄素类化合物脂质体以300至600mg/m2的剂量,在2小时或更短的时间内给予。另一方面,给予所述姜黄素或其类似物静脉内脂质体2、3、4、5、6或7小时。另一方面,所述姜黄素或其类似物静脉内脂质体以至少300mg/m2的剂量,在2、3、4、5、6、7或8小时内给予。另一方面,所述方法进一步包括提供有效剂量的以下中的至少一种:伊立替康、5-氟尿嘧啶、亚叶酸、卡培他滨、蒽环类、阿霉素、达沙替尼、甲磺酸伊马替尼、拉帕替尼、尼洛替尼、索拉非尼、舒尼替尼、曲妥珠单抗、阿仑单抗、贝伐单抗、西妥昔单抗、吉妥珠单抗、帕尼单抗、利妥昔单抗、托西莫单抗、曲妥珠单抗及其组合。另一方面,所述增殖性疾病是转移癌。另一方面,所述增殖性疾病选自乳腺癌、子宫癌、宫颈癌、脑癌、结肠癌、白血病、子宫颈癌、前列腺癌、胃肠道癌、肝癌、黑色素瘤或胰腺癌。另一方面,所述脂质体包括以下中的至少一种:1-肉豆蔻酰基-2-羟基-sn-甘油-3-磷酸胆碱(dmpc)、12-肉豆蔻酰基-2-羟基-sn-甘油-3-[磷酸-rac-(甘油)](dmpg)或dmpc/dmpg脂质体。一方面,溶血磷脂酰甘油包括以下中的至少一种:溶血磷脂酰胆碱、月桂酰基溶血磷脂酰胆碱、肉豆蔻酰基溶血磷脂酰胆碱、棕榈酰基溶血磷脂酰胆碱、硬脂酰基溶血磷脂酰胆碱、花生酰基溶血磷脂酰胆碱、油酰基溶血磷脂酰胆碱、亚油酰基溶血磷脂酰胆碱、亚麻酰基溶血磷脂酰胆碱或芥酰基溶血磷脂酰胆碱。另一方面,
所述姜黄素或其类似物静脉内脂质体不引起心包纤维化、心内膜心肌纤维化、心力衰竭、出血性心肌坏死、心肌病、心肌炎、左心室射血分数(lvef)降低、充血性心力衰竭(chf)、急性冠心病、高血压、心肌梗塞或心包炎。另一方面,所述脂质体不包封姜黄素或其类似物。另一方面,所述姜黄素或姜黄素类化合物脂质体是姜黄素/姜黄素类化合物:脂质体复合物,其中姜黄素占姜黄素/姜黄素类化合物:脂质体复合物的2至9重量%,其中姜黄素是分离的或合成的姜黄素中的至少一种,并且其中姜黄素/姜黄素类化合物:脂质体复合物的姜黄素与脂质的比值(重量比重量)为1:7.5至1:10,其中脂质组合选自:dmpc、dmpc:chol 9:1、dmpc:dmpg 9:1、dmpc:chol:dmpg8:1:1、dppc:dmpg 9:1、dppc:chol:dmpg 8:1:1、dmpc:dspe-peg-2000 95:5、dmpc:chol:dspe-peg-2000 90:10:05、dmpc/dmpg 7:3、dppc/dmpg 7:3、dppc/dmpg 9:1。
[0011]
在又一个实施方案中,本发明包括一种用于治疗增殖性疾病的方法,其包括:给予有其需要的患者足以减少或消除所述增殖性疾病的有效量的抗增殖性姜黄素或姜黄素类化合物脂质体,其以在8小时或更短的时间内至少100mg/m2的有效预防、减少或消除所述增殖性疾病的量给予。一方面,所述给予包括在8小时内至少100mg/m2。另一方面,在所述治疗周期之后是4、5、6或7天的休息期,在所述休息期期间不给予脂质体或活性剂。另一方面,所述治疗周期为2、3、4、5、6、7、8、9、10、11或12个连续周。另一方面,所述姜黄素或姜黄素类化合物脂质体以125、150、200、250、300、350、400、450、500或600mg/m2的剂量给予。另一方面,所述姜黄素或姜黄素类化合物脂质体以100至600mg/m2的剂量,在2至6小时内给予。另一方面,所述姜黄素或姜黄素类化合物脂质体以300至600mg/m2的剂量,在2至4小时内给予。另一方面,所述姜黄素或姜黄素类化合物脂质体以300至600mg/m2的剂量,在2小时或更短的时间内给予。另一方面,给予所述活性剂2、3、4、5、6或7小时。另一方面,所述活性剂以至少300mg/m2的剂量,在2、3、4、5、6、7或8小时内给予。另一方面,所述方法进一步包括提供有效剂量的以下中的至少一种:伊立替康、5-氟尿嘧啶、亚叶酸、卡培他滨、蒽环类、阿霉素、达沙替尼、甲磺酸伊马替尼、拉帕替尼、尼洛替尼、索拉非尼、舒尼替尼、曲妥珠单抗、阿仑单抗、贝伐单抗、西妥昔单抗、吉妥珠单抗、帕尼单抗、利妥昔单抗、托西莫单抗、曲妥珠单抗及其组合。另一方面,所述增殖性疾病是转移癌。另一方面,所述增殖性疾病选自乳腺癌、子宫癌、宫颈癌、脑癌、结肠癌、白血病、子宫颈癌、前列腺癌、胃肠道癌、肝癌、黑色素瘤或胰腺癌。另一方面,所述脂质体是空的脂质体,其是包括以下的至少一种:1-肉豆蔻酰基-2-羟基-sn-甘油-3-磷酸胆碱(dmpc)、12-肉豆蔻酰基-2-羟基-sn-甘油-3-[磷酸-rac-(甘油)](dmpg)或dmpc/dmpg脂质体。一方面,溶血磷脂酰甘油包括以下中的至少一种:溶血磷脂酰胆碱、月桂酰基溶血磷脂酰胆碱、肉豆蔻酰基溶血磷脂酰胆碱、棕榈酰基溶血磷脂酰胆碱、硬脂酰基溶血磷脂酰胆碱、花生酰基溶血磷脂酰胆碱、油酰基溶血磷脂酰胆碱、亚油酰基溶血磷脂酰胆碱、亚麻酰基溶血磷脂酰胆碱或芥酰基溶血磷脂酰胆碱。另一方面,所述脂质体预防心包纤维化、心内膜心肌纤维化、心力衰竭、出血性心肌坏死、心肌病、心肌炎、左心室射血分数(lvef)降低、充血性心力衰竭(chf)、急性冠心病、高血压、心肌梗塞、qt延长、或由活性剂引起的心包炎。另一方面,所述脂质体不包封活性剂。另一方面,所述姜黄素或姜黄素类化合物脂质体是姜黄素/姜黄素类化合物:脂质体复合物,其中姜黄素占姜黄素/姜黄素类化合物:脂质体复合物的2至9重量%,其中姜黄素是天然或合成的姜黄素中的至少一种,并且其中姜黄素/姜黄素类化合物:脂质体复合物的姜黄素与脂质的比值(重量比重量)
为1:7.5至1:10,其中脂质组合选自:dmpc、dmpc:chol 9:1、dmpc:dmpg 9:1、dmpc:chol:dmpg 8:1:1、dppc:dmpg 9:1、dppc:chol:dmpg 8:1:1、dmpc:dspe-peg-2000 95:5、dmpc:chol:dspe-peg-2000 90:10:05、dmpc/dmpg 7:3、dppc/dmpg 7:3、dppc/dmpg 9:1。
[0012]
在另一个实施方案中,本发明包括一种药盒,其包含:包含根据给药方案给予有其需要的人受试者治疗有效量的姜黄素或姜黄素类化合物静脉内脂质体的剂量,该给药方案包括:至少一个治疗周期,所述治疗周期为在8小时或更短的时间内给予至少100mg/m2的治疗有效量的姜黄素或姜黄素类化合物脂质体。一方面,所述姜黄素或姜黄素类化合物脂质体以125、150、200、250、300、350、400、450、500或600mg/m2的剂量给予。另一方面,所述姜黄素或姜黄素类化合物脂质体以100至600mg/m2的剂量,在2至6小时内给予。另一方面,所述姜黄素或姜黄素类化合物脂质体以300至600mg/m2的剂量,在2至4小时内给予。另一方面,所述姜黄素或姜黄素类化合物脂质体以300至600mg/m2的剂量,在2小时或更短的时间内给予。另一方面,第一剂量和第二剂量包装在同一容器中,并提供2、3、4、5、6或7小时的剂量。另一方面,第一剂量和第二剂量包装在同一容器中,并在2、3、4、5、6、7或8小时内提供至少300mg/m2的剂量。另一方面,所述姜黄素或姜黄素类化合物脂质体是姜黄素/姜黄素类化合物:脂质体复合物,其中姜黄素占姜黄素/姜黄素类化合物:脂质体复合物的2至9重量%,其中姜黄素是天然或合成的姜黄素中的至少一种,并且其中姜黄素/姜黄素类化合物:脂质体复合物的姜黄素与脂质的比值(重量比重量)为1:7.5至1:10,其中脂质组合选自:dmpc、dmpc:chol 9:1、dmpc:dmpg 9:1、dmpc:chol:dmpg 8:1:1、dppc:dmpg 9:1、dppc:chol:dmpg 8:1:1、dmpc:dspe-peg-2000 95:5、dmpc:chol:dspe-peg-2000 90:10:05、dmpc/dmpg 7:3、dppc/dmpg 7:3、dppc/dmpg 9:1。
[0013]
附图简述
[0014]
为了更全面地理解本发明的特征和优点,现在参考本发明的详细描述以及附图,并且其中:
[0015]
图1a和1b显示用姜黄素输注期间姜黄素血浆浓度曲线的结果。显示了个体受试者的姜黄素血浆水平。时间(h)代表实际采样时间。时间“0”代表开始输注。图1a显示了在8小时内接受姜黄素脂质体的#17-#27患者的结果。图1b显示了在6小时内接受姜黄素脂质体的#28-#33患者的结果。
[0016]
图2a至2c显示与输注速率相比输注期间2小时的姜黄素血浆水平。图2a是除了由于输注中断的#21患者以外的所有患者的图。图2b是排除#3、#21和#24患者的患者的图。图2c是显示2b中所示的数据在每个输注速率下的平均值
±
sd的图。输注速率归一化的2h姜黄素水平分别为7.0、7.6、9.3、7.3、14.5、15.6和24.0,输注速率分别为12.5、15.0、18.75、23.75、30.0、37.5和50mg/m2/h。
[0017]
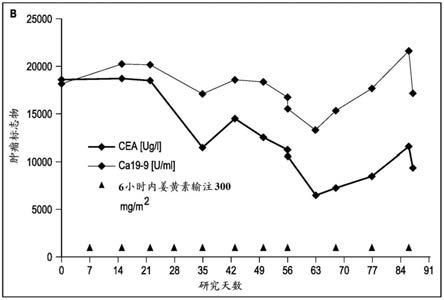
图3a和3b是显示肿瘤标志物的时间进程的图。图3a是#27患者中psa[ng/ml]的时间进程,图3b是#30患者中cea[ug/l]和ca19-9[u/ml]的时间进程。
[0018]
发明详述
[0019]
虽然以下详细讨论了本发明的各种实施方案的形成和使用,但是应当理解,本发明提供了许多可应用的发明构思,这些构思可以在各种各样的具体环境下体现。本文讨论的具体实施方案仅是形成和使用本发明的具体方式的说明,并不限制本发明的范围。
[0020]
为了便于理解本发明,以下定义了许多术语。本文所定义的术语具有与本发明有
关的领域的普通技术人员通常理解的含义。术语诸如“一(a)”,“一(an)”和“该(the)”不旨在仅指代单数实体,而是包括其可以使用具体实例说明的通用类别。本文中的术语用于描述本发明的具体实施方案,但是它们的使用不限制本发明,除非在权利要求中概述。
[0021]
本发明提供了用于治疗或预防任意多种类型的癌症的组合物和给药方案,所述癌症包括实体瘤和非实体瘤,如白血病和淋巴瘤。已经发现本发明的给药方案可以用于治疗恶性或良性癌症。在某些实例中,本发明的给药方案可以在某些参数方面变化。通常,用于治疗增殖性障碍的给药方案包括根据给药方案给予有其需要的人受试者治疗有效量的从姜黄植物分离或合成的高纯度水平的姜黄素或其类似物(姜黄素类化合物)静脉内脂质体,所述给药方案包括:至少一个治疗周期,所述治疗周期为每周一次在8小时内给予至少100mg/m2的治疗有效量的姜黄素静脉内脂质体。在所述治疗周期之后是1周的休息期,在所述休息期期间不给予所述姜黄素或其类似物静脉内脂质体。经常并且取决于对制剂效果的监测,治疗周期可以重复例如2、3、4、5、6、7、8、9、10、11或12个连续周。给予的姜黄素或其类似物静脉内脂质体的剂量可以是例如150、200、250、300、350、400、450或460mg/m2的剂量。给予的姜黄素或其类似物静脉内脂质体的剂量可以是例如在2至6小时内100至460mg/m2的剂量。给予的姜黄素或其类似物静脉内脂质体的剂量可以是例如在2至4小时内200至500mg/m2的剂量。给予的姜黄素或其类似物静脉内脂质体的剂量可以是给予姜黄素或其类似物静脉内脂质体例如2、3、4、5、6或7小时,或其部分(例如,+/-15、20、30、45或50分钟)的剂量。给予的姜黄素或其类似物静脉内脂质体的剂量可以是在例如2、3、4、5、6、7或8小时内至少300mg/m2的剂量。在某些实施方案中,剂量是300mg、400mg、460mg、500mg或600mg。在某些实施方案中,输注时间为6小时或更短,4小时或更短或2小时或更短。在某些实施方案中,输注频率是每6天1次,每5天1次或每4天1次。
[0022]
使用本发明治疗的靶增殖性疾病的非限制性实例包括癌、肉瘤、骨髓瘤、神经胶质瘤、淋巴瘤和白血病,其都可以使用本发明进行治疗,包括那些具有混合类型的癌症。也可以治疗的具体类型的癌症包括但不限于:乳腺或前列腺腺癌;各种形式的肺的支气管癌;骨髓癌;黑色素瘤;肝癌;成神经细胞瘤;乳头状瘤;胺前体摄取与脱羧细胞瘤;迷芽瘤;鳃原瘤;恶性类癌综合征;类癌性心脏病;癌(例如,walker癌、基底细胞癌、基底鳞状细胞癌、brown-pearce癌、导管癌、ehrlich肿瘤、原位癌、krebs 2癌、merkel细胞癌、粘液癌、非小细胞肺癌、燕麦细胞癌、乳头状癌、硬癌、细支气管癌、支气管原癌、鳞状细胞癌和移行细胞癌);组织细胞障碍;白血病(例如,b细胞白血病、混合细胞白血病、裸细胞白血病、t细胞白血病、慢性t细胞白血病、htlv-ii相关白血病、淋巴细胞急性白血病、淋巴细胞慢性白血病、肥大细胞白血病和髓细胞性白血病);恶性组织细胞增生症;霍奇金氏病;小免疫增殖;非霍奇金淋巴瘤;浆细胞瘤;网状内皮组织增生;黑色素瘤;软骨母细胞瘤;软骨瘤;软骨肉瘤;纤维瘤;纤维肉瘤;巨细胞瘤;组织细胞瘤;脂肪瘤;脂肪肉瘤;间皮瘤;粘液瘤;粘液肉瘤;骨瘤;骨肉瘤;尤因氏肉瘤;滑膜瘤;腺纤维瘤;腺淋巴瘤;癌肉瘤;脊索瘤;颅咽管瘤;无性细胞瘤(dysgermiinoma);错构瘤;间质瘤;中肾瘤;肌肉瘤;成釉细胞瘤;牙骨质瘤;牙瘤;畸胎瘤;胸腺瘤;滋养叶瘤;腺癌;腺瘤;胆管瘤;胆脂瘤;圆柱瘤;囊腺癌;囊腺瘤;粒层细胞瘤;男性细胞瘤;肝细胞瘤;汗腺腺瘤;胰岛细胞瘤;莱迪希细胞瘤;乳头状瘤;支持细胞瘤;卵泡膜细胞瘤;平滑肌瘤;平滑肌肉瘤;成肌细胞瘤;肌瘤;肌肉瘤;横纹肌瘤;横纹肌肉瘤;室管膜瘤;神经节瘤;胶质瘤;成神经管细胞瘤;脑膜瘤;多发性骨髓瘤;神经鞘瘤;成神经细胞瘤;
神经上皮瘤;神经纤维瘤;神经瘤;副神经节瘤;非嗜铬性副神经节瘤;血管角质瘤;伴随嗜酸性粒细胞增多的血管淋巴样增生;硬化性血管瘤;血管瘤病;血管球瘤;血管内皮瘤;血管瘤;血管外皮细胞瘤;血管肉瘤;淋巴管瘤;淋巴管肌瘤;淋巴管肉瘤;松果体瘤;癌肉瘤;软骨肉瘤;叶状囊肉瘤;纤维肉瘤;血管肉瘤;平滑肌肉瘤;白血病肉瘤;脂肪肉瘤;淋巴管肉瘤;肌肉瘤;粘液肉瘤;卵巢癌;横纹肌肉瘤;肉瘤(例如,尤因氏肉瘤、实验肉瘤、卡波西肉瘤和肥大细胞肉瘤);肿瘤(例如,骨肿瘤、乳腺肿瘤、消化系统肿瘤、结直肠肿瘤、肝脏肿瘤、胰腺肿瘤、垂体肿瘤、睾丸肿瘤、眼眶肿瘤、头颈肿瘤、中枢神经系统肿瘤、听觉系统肿瘤(acoustic neoplasms)、骨盆肿瘤、呼吸道肿瘤和泌尿生殖肿瘤);神经纤维瘤病和宫颈异型增生)等。
[0023]
本发明的给药方案也用于所有哺乳动物受试者例如人患者的癌症的治疗或预防。如本文所用,患者是人患者。同样如本文所用,治疗是指癌症的任何改善。
[0024]
如本文所用,“给药方案”是指具体剂量,给药时机,给药重复时间,以及使用组合物或药物治疗患有癌症的患者和其他哺乳动物受试者,以至少减轻癌症的症状或阻止、抑制或逆转疾病的进展。技术人员将认识到,相同的组合物和给药方案(多种给药方案)可能对不同的患者具有不同的作用,甚至在不同的时间对相同的患者具有不同的作用。如本文所用,“预防”是指预防性治疗患者以预防或抑制易于发展疾病的患者或哺乳动物受试者的癌症的发作。
[0025]
如本文所用,“姜黄素”和“姜黄素类似物”是指由于它们与姜黄素的结构相似性而表现出与姜黄素相似的对癌细胞的抗增殖或促凋亡作用的那些化合物。姜黄素是在植物姜黄中发现的天然产物,化学名称二阿魏酰甲烷。分子式为c
21
h
20
o6,摩尔质量为368.38g/mol。姜黄素通过促进肿瘤细胞中的死亡通路和限制存活通路来充当抗癌治疗剂。尽管姜黄素具有对成熟癌细胞和癌症干细胞的活性,但已知其甚至长期使用,对正常细胞的毒性也很小。这可能是因为癌细胞中姜黄素的摄取比正常细胞中的摄取多得多。姜黄素对癌干细胞和正常干细胞也有不同的作用。姜黄素通过其抗炎作用将癌细胞周围的微环境改变为不利于癌干细胞增殖但有利于正常干细胞的微环境。实际上,多项研究已显示姜黄素对正常干细胞功能具有刺激和保护作用。姜黄素治疗用途的限制因素是其水溶性差以及口服后相应的不良生物利用度。为了克服口服给药的药代动力学和生物利用度限制,已开发了姜黄素脂质体制剂用于静脉内给药,并且代表了有希望的药物递送系统。
[0026]
可能具有类似于姜黄素的抗癌作用的姜黄素类似物包括芳姜黄酮、甲基姜黄素、去甲氧基姜黄素、双去甲氧基姜黄素、姜黄酸钠、二苯甲酰甲烷、乙酰姜黄素、阿魏酰甲烷、四氢姜黄素、1,7-双(4-羟基-3-甲氧基苯基)-1,6-庚二烯-3,5-二酮(姜黄素1)、1,7-双(胡椒基)-1,6-庚二烯-3,5-二酮(胡椒基姜黄素)、1,7-双(2-羟基萘基)-1,6-庚二烯-2,5-二酮(2-羟基萘基姜黄素)、1,1-双(苯基)-1,3,8,10-十一碳四烯(undecatetraene)-5,7-二酮(肉桂基姜黄素)等(araujo和leon,2001;lin等人,2001;john等人,2002;另参见ishida等人,2002)。姜黄素类似物还可包括姜黄素的异构体,如姜黄素的(z,e)和(z,z)异构体。在一个相关的实施方案中,具有类似于姜黄素的抗癌作用的姜黄素代谢物也可以用于本发明。已知的姜黄素代谢物包括四氢姜黄素和六氢姜黄素的葡萄糖醛酸苷,以及二氢阿魏酸。在某些实施方案中,姜黄素类似物或代谢物可以配制成金属螯合物,特别是铜螯合物。适用于本发明的姜黄素、姜黄素类似物和姜黄素代谢物的其他合适的衍生物对本领域技术人员
将是显而易见的。
[0027]
如本文所用,术语“脂质”是指具有任选向其添加的甾醇,特别是胆固醇的脂质,例如磷脂。脂质可以单独提供或与其他脂质组合提供,可以是饱和和不饱和的,支链的或直链的,可以是脂质三甘油分子的形式。用于本发明的磷脂的非限制性实例包括但不限于例如,1,2-二肉豆蔻酰基-sn-甘油-3-磷酸胆碱(dmpc)、1,2-二肉豆蔻酰基-sn-甘油-3-磷酸甘油(dmpg)、dmpc/dmpg、1-肉豆蔻酰基-2-羟基-sn-甘油-3-磷酸-(1'-rac-甘油)(lysopg)、1-肉豆蔻酰基-2-羟基-sn-甘油-3-磷酸-(1'-rac-甘油)(lysopg)、1-肉豆蔻基-2-羟基-sn-甘油-3-磷酸胆碱(lysopc)、溶血磷脂酰胆碱、月桂酰基溶血磷脂酰胆碱、肉豆蔻酰基溶血磷脂酰胆碱、棕榈酰基溶血磷脂酰胆碱、硬脂酰基溶血磷脂酰胆碱、花生酰基溶血磷脂酰胆碱、油酰基溶血磷脂酰胆碱、亚油酰基溶血磷脂酰胆碱、亚麻酰基溶血磷脂酰胆碱或芥酰基溶血磷脂酰胆碱。用于本发明的其他非限制性示例性脂质包括例如,磷脂酰胆碱、磷脂酰乙醇胺、磷脂酰丝氨酸、磷脂酰甘油、心磷脂、磷脂酰肌醇或其脂质、脂质体或溶血(lyso)形式的前体。脂质的非限制性实例包括用于本发明的溶血磷脂酰甘油,包括溶血磷脂酰胆碱、月桂酰基溶血磷脂酰胆碱、肉豆蔻酰基溶血磷脂酰胆碱、棕榈酰基溶血磷脂酰胆碱、硬脂酰基溶血磷脂酰胆碱、花生酰基溶血磷脂酰胆碱、油酰基溶血磷脂酰胆碱、亚油酰基溶血磷脂酰胆碱、亚麻酰基溶血磷脂酰胆碱或芥酰基溶血磷脂酰胆碱。不对称的磷脂酰胆碱被称为1-酰基,2-酰基-sn-甘油-3-磷酸胆碱,其中所述酰基彼此不同。对称的磷脂酰胆碱被称为1,2-二酰基-sn-甘油-3-磷酸胆碱。如本文所用,缩写“pc”是指磷脂酰胆碱。磷脂酰胆碱1,2-二肉豆蔻酰基-sn-甘油-3-磷酸胆碱在本文中缩写为“dmpc”。磷脂酰胆碱1,2-二油酰基-sn-甘油-3-磷酸胆碱在本文中缩写为“dopc”。磷脂酰胆碱1,2-二棕榈酰-sn-甘油-3-磷酸胆碱在本文中缩写为“dppc”。当仅单个脂肪酸链连接至甘油骨架时,这些短链或长链脂肪酸的单个脂肪酸链形式称为“溶血”形式。遵循本发明的指导,无需过度实验即可鉴定具有本文教导的所要求的功能的其他脂质。一方面,所述姜黄素或姜黄素类化合物脂质体(姜黄素脂质体)包含姜黄素/姜黄素类化合物:脂质体复合物,其中姜黄素占姜黄素/姜黄素类化合物:脂质体复合物的2至9重量%,其中姜黄素是天然或合成的姜黄素中的至少一种,并且其中姜黄素/姜黄素类化合物:脂质体复合物的姜黄素与脂质的比值(重量比重量)为1:7.5至1:10,其中脂质组合选自:dmpc、dmpc:chol 9:1、dmpc:dmpg 9:1、dmpc:chol:dmpg 8:1:1、dppc:dmpg 9:1、dppc:chol:dmpg 8:1:1、dmpc:dspe-peg-2000 95:5;dmpc:chol:dspe-peg-2000 90:10:05、dmpc/dmpg 7:3、dppc/dmpg 7:3、dppc/dmpg 9:1。
[0028]
术语“脂质体”是指其中其壁或膜由具有任选向其添加的甾醇,特别是胆固醇的脂质,特别是磷脂形成的囊。在一个具体的非限制性实例中,脂质体是空脂质体,并且可以由单一类型的磷脂或磷脂的组合配制。空脂质体可进一步包括一种或多种表面修饰,如蛋白质,碳水化合物,糖脂或糖蛋白,甚至核酸,如适体,硫代修饰的核酸,蛋白质核酸模拟物,蛋白质模拟物,隐形剂(stealthingagent)等。用于本发明的空脂质体的非限制性实例包括但不限于例如,1,2-二肉豆蔻酰基-sn-甘油-3-磷酸胆碱(dmpc)、1,2-二肉豆蔻酰基-sn-甘油-3-磷酸甘油(dmpg)、dmpc/dmpg、1-肉豆蔻酰基-2-羟基-sn-甘油-3-磷酸-(1'-rac-甘油)(lysopg)和1-肉豆蔻酰基-2-羟基-sn-甘油-3-磷酸-(1'-rac-甘油)(lysopg)。在一个实施方案中,脂质体是脂质体或脂质体前体,其包含例如lysopg、肉豆蔻酸单甘油酯和肉豆蔻酸。在一个具体的非限制性实例中,该组合物还包含在脂质体内或脂质体周围的活性剂,
of liposomes,d.d.lasic和d.papahadjopoulos编辑,elsevier press;greg t.hermanson的bioconjugate techniques,academic press;和specialized drug delivery systems(praveen tyle编辑)中francis j.martin的pharmaceutical manufacturing of liposomes,marcel dekker,inc中描述的。形成脂质体通常涉及首先将磷脂悬浮在有机溶剂中,然后蒸发至干,直到形成干燥的脂质饼或膜。添加适量的水性介质,脂质自发形成多层同心双层囊泡(也称为多层囊泡(mlv)。然后可以机械分散这些mlv。mlv通常具有25纳米至4微米的直径。mlv的超声处理导致形成直径在200至500埃范围内的核心中包含水溶液的小单层囊泡(suv)。suv比mlv和单层小。
[0038]
本发明首次证明了在局部晚期或转移癌患者中,在8小时或6小时内静脉内输注给予姜黄素脂质体的安全性和耐受性,在研究入组时,对于这些患者没有被证明有益的抗肿瘤治疗可用。根据recist v1.1(8周后达到完全响应(cr)/部分响应(pr)/病情稳定(sd)的患者比例),还可以在首次输注期间和之后评估姜黄素和thc的p
k
值,并评估姜黄素脂质体的抗肿瘤活性。
[0039]
患者。在24、8或6个小时内,采用剂量为100至300mg/m2的姜黄素脂质体输注对32名转移癌患者进行治疗。研究开始时患者的中位年龄为62.7岁(范围为42.6-84.5岁),大多数为男性(71.9%)。患者的主要诊断为葡萄膜黑色素瘤-1;鳞状细胞癌,原发灶不明-1;头颈部鳞状细胞癌-2;腮腺癌-1;乳腺癌-1;肺癌-1;食道鳞状细胞癌-2;食道或胃腺癌-5;肝细胞癌-2;胆管癌-3;胰腺腺癌-3;小肠腺癌-1;结肠癌-1;肛门表皮样癌-2;尿路上皮癌-3;子宫癌-1;前列腺癌-2。采用中位值为5次(范围2-10)在先癌症治疗对患者进行大量预治疗(表1)。患者接受1至11次姜黄素脂质体输注,中位治疗时间为38.5天(范围为1至82天)(表1)。17名患者(53.1%)接受了至少5次研究药物输注,而8名患者(25.0%)接受了所有计划的8次输注。在疾病发展(23名)、总体身体状况恶化(6名)、提早退出(2名)或研究中断(1名)后停止治疗。对于大多数患者,研究结束的原因是死亡,而在最后一次研究治疗后的4周内只有10名患者死亡。
[0040]
表1:患者特征
[0041][0042][0043]
不良事件(ae)。30名患者(93.8%)经历了总共143件ae。在这些ae中,只有34件ae(在14名患者中)被认为是明确的、很可能的或可能与研究治疗有关,而其他大多数则被认为与根本疾病有关。出人意料的是,在dl 1-6(100-300mg/m2)8小时内姜黄素脂质体的输注
通常被很好地耐受,在dl 6a(6小时内300mg/m2)下,观察到的被认为与研究药物相关的血液学ae数量显著增加(表2)。
[0044]
表2:与研究治疗具有明确的或很可能的因果关系的不良事件。
[0045][0046][0047]
在23名患者(71.9%)中报告的40件sae中,2件与研究治疗相关(#31患者面部浮肿,#32患者贫血)。两名患者均在dl 6a中治疗。在dl 1(100mg/m2)的一名患者(#2)中观察到棘红细胞。未观察到与研究药物相关的心脏、肺、肝或肾毒性,仅观察到了3件可能与研究药物相关的1级胃肠道ae。
[0048]
研究者将总共4件ae评为3级(#29、#32患者的贫血,#28患者的溶血,#3患者的低钠血症)。在dl 6a中观察到溶血和贫血,并导致剂量升高的停止(参见dlt)。具有肝硬化、腹水、全身性水肿病史和早先存在低钠血症的#3患者发展为3级低钠血症,血清钠从第一次输注前的133mmol/l降至第六次输注前的126mmol/l的低点。
[0049]
dlt和推荐的2阶段剂量。dl 6a中包括6名患者。一名患者(#28)显示出明确的溶血迹象。在第2周期中,患者的血红蛋白(hb)从11.5g/dl(开始输注)降至9.5g/dl(输注结束-eoi),降至9.1g/dl(在eoi后3小时),触珠蛋白略有下降。在第4周期中,hb从8g/dl(开始)降至6.4g/dl(eoi),降至5.5g/dl(在eoi后2.5小时),触珠蛋白从130mg/dl(开始)明显降至89mg/dl(eoi),降至15mg/dl(eoi后2.5小时),降至<10mg/dl(eoi后15小时)(正常范围30-200mg/dl)。在两个治疗周期中,患者还表现出胆红素、网织红细胞(%)和ldh的升高。与研究治疗有关的溶血被记录为第4周期的不良事件。在第1周期和第2周期之间,患者患有静脉导管(port-a-cath)感染(sae)并接受了红细胞输注。在第3和第4周期之间,患者患有2级贫血,很可能与并发感染有关,并接受了另一次红细胞输注。血液涂片显示无碎片细胞或棘红细胞。
[0050]
仅在其他三名患者(#29,#32,#33)中观察到与输注姜黄素脂质体相关的hb临床显著下降(>2g/dl),然而,由于触珠蛋白和mcv不变,这些患者中溶血的存在是不明确的。血液涂片显示无碎片细胞或棘红细胞。另外,患者没有显示出血迹象。在#32患者中,第2周期后hb降至5.5,并且经历的贫血被记录为sae,其与研究治疗(susar)有明确的关系。#30和#31患者的hb没有经历临床显著下降。
[0051]
第一次输注后的夜间,一名患者(#31)出现了面部浮肿(g2),其用地塞米松和盐酸苯海拉明(dibondrin)治疗,并需要延长住院治疗以进一步观察。该患者在一天之内恢复,继续进行研究治疗而没有进一步发生面部浮肿。
[0052]
姜黄素和thc的药代动力学。收集用于姜黄素和thc的pk评估的血样,并从所有在8或6小时内接受首次输注姜黄素脂质体的患者中分离血浆。由于输注中断了1.5小时,因此将#21患者排除在pk分析之外。对于以剂量水平dl 1
–
dl 3(100至150mg/m2)治疗的患者,在输注过程中(修正3之前)仅进行了一次血液采集,由于大多数血浆样品的姜黄素和thc低于定量限(bloq),因此未评估pk参数。在表3中给出了#17-#33患者的pk参数。这些患者的个体姜黄素血浆浓度-时间曲线在图1a和1b中描绘。姜黄素的平均t
max
在输注期间达到,在190-300mg/m2的剂量范围内为3.6-4.0小时,而在6h输注时为4.2小时。尽管大多数患者均达到了姜黄素的稳态水平,但#19患者并未达到姜黄素的稳态水平,其血浆水平在输注2至6小时之间从413.81至3885.14ng/ml(图1),导致与190mg/m2剂量组(表3)的其他患者相比,auc
0-tlast
值明显更高。但是,一般而言,auc
0-tlast
值随着姜黄素输注剂量的增加而增加。在eoi下,血浆水平在10分钟内迅速降至bloq。为了比较不同输注剂量和输注时间后达到的姜黄素血浆水平,并包括尽可能多的数据点,将输注2小时后患者的姜黄素血浆水平与输注速率进行了比较。图2a描绘了在输注期间2小时输注速率与患者的姜黄素血浆水平之间的关系,在8小时内的剂量水平分别为100、120、150、190、240和300mg/m2,在6小时内的剂量水平为300mg/m2,分别对应于输注速率为12.5、15、18.75、23.75、37.5和50mg/m2/h。显然,与所有其他患者相比,#3和#24患者的2h血浆浓度非常高。为了理解其余患者的输注速率和血浆浓度之间的关系,去除了#3和#24患者的数据(图2b)。其余29名患者的姜黄素平均血浆浓度与输注速率呈明显的线性相关性(r2=0.9303)。但是,在最高为23.75mg/m2/h的输注速率下,输注速率归一化的姜黄素平均血浆浓度范围为7.0
–
9.3,而介于30
–
50mg/m2/h的输注速率之间其范围为14.5
–
24.0,表明在更高的输注速率下大于血浆姜黄素浓度的剂量成比例增加(图2c)。
[0053]
表3:姜黄素的pk参数
[0054]
[0055][0056]
a)#19患者的数据未包括在平均值、sd、se和%cv的计算中。
[0057]
thc的血浆浓度形式与姜黄素的血浆浓度形式相似,但在输注过程中,每位患者在2至4小时内的以thc的auc
0-tlast
相对于姜黄素的百分比表示的thc血浆水平明显低于姜黄素血浆水平的2.1%-21.8%(平均值8.5%)。thc的pk参数显示在表4中。
[0058]
表4显示四氢姜黄素的药代动力学参数。
[0059]
[0060]
[0061][0062]
(*)#19患者的数据未包括在平均值、sd、se和%cv的计算中。
[0063]
功效。主要功效终点是8周后根据recist v1.1的响应率(完全响应/部分响应/病情稳定/疾病进展)。23名患者接受了肿瘤响应评估,但只有8名患者在治疗8周后达到了肿瘤评估。他们全部显示pd。在第4周到第8周之间进行肿瘤评估的15名患者中,有14名显示pd,并且1名(#27患者)显示sd。5名患者在1到4次药物输注后,他们的总体状况经历了恶化,并且在未进行肿瘤评估的情况下停止了治疗。2名患者撤回了其ic。
[0064]
评估了相关的肿瘤标志物cea、ca19-9、psa和ca15-3。在两名患者中,暂时观察到肿瘤标志物明显减少。在患有前列腺癌、骨和淋巴结转移以及肺部淋巴管扩张的#27患者中,第四次输注后psa水平从649ng/ml降至355ng/ml。在第4次输注之后,由于怀疑有肺部感染治疗中断了3周,并且psa水平再次增加至547ng/ml(图3a)。治疗中断期间的肿瘤响应评估显示sd。由于疾病的进展,该患者在研究终止之前又接受了两次姜黄素输注。在治疗的前四个星期中,研究者报告了改善的总体状况(who2至who 1),并且观察到ldh暂时从435u/l降至202u/l(正常范围135-225u/l)。在患有结肠癌并且肝和肺转移的#30患者中,cea水平从筛查时的18542μg/l降低至6441μg/l,8周后ca19-9从筛查时的18105u/ml降低至13238u/ml(图3b),同时肿瘤分期显示进行性疾病。由于临床获益和肿瘤标志物反应,该患者又接受了三次输注。在此期间,肿瘤标志物再次增加,并且由于总体状况降低,在第11次输注后停止治疗。在最后一次给予研究药物后13天患者死亡。两名具有肿瘤标志物响应的患者均以姜黄素剂量300mg/m2进行治疗(#27患者在8小时内治疗,#30患者在6小时内治疗)。
[0065]
参与该研究的患者通常患有晚期癌症,用尽已经确立的抗癌治疗方案,并且被认为不适合进行后期临床研究。姜黄素脂质体的剂量持续增加直至dl 6a(6小时内300mg/2)。以100至300mg/m2(dl 1-6)的剂量在8小时内输注姜黄素脂质体一般耐受良好,对于经过大量预治疗的患者人群,报道的ae和sae的数量并不意外。
[0066]
在dl 6a(6小时内300mg/m2)下,观察到的与研究药物有关的ae数量显著增加。在此dl下,观察到在6名患者中有4名在输注过程中hb明显降低。在一名患者(#28)中观察到符合dlt定义的明确溶血,其他3名患者经历贫血(#29,#31,#32)。虽然在这些患者中观察到的hb降低是停止剂量递增的原因,但必须谨慎比较不同患者中hb的变化。这些患者具有不同的治疗史以及由不同的先前化学疗法和在某些患者中由先前的rt继发的不同程度的先前
的骨髓破坏。所有患者均接受多种同时用药,其中一些可能使红细胞容易发生源自姜黄素的溶血。已知引起溶血的四种最常见的药物是左氧氟沙星,头孢菌素,青霉素和布洛芬
25-28
。#28患者接受左氧氟沙星(tavanic)、阿莫西林和布洛芬(brufen)。#32患者接受头孢菌素(zinnat),并且在开始姜黄素脂质体治疗前不久已经接受了青霉素和布洛芬。
[0067]
认为在输注开始时可能有hb阈值,低于此阈值hb的下降变得更加明显。在经过大量预治疗的患者人群中,观察到的不良事件预计在更高的剂量水平下增加。尽管可以在医院中轻松控制它们,但这在任何外部环境下都将是不可能的。因此,在6小时内300mg/m2的姜黄素脂质体单药治疗的剂量被批准为抗癌治疗的推荐起始剂量,因为该剂量耐受良好。此外,可以使用更高的剂量,例如325、350、375、400、425、450或475mg/m2姜黄素脂质体。尤其在具有与1a期相当的auc和c
max
的较高dl时,预计会形成棘红细胞。但是,只有一名患者(#2)在dl 1(100mg/m2)观察到棘红细胞。
[0068]
pk分析显示输注期间姜黄素和thc的血浆浓度稳定,输注结束后迅速下降。在dl 300mg/m2下,6小时和8小时输注的姜黄素平均c
max
血浆水平相似,处于1428
–
1641ng/ml。尽管大多数患者的姜黄素和thc的血浆水平在eoi后10分钟内降至无法量化的水平,但在#19患者中有一个明显例外,其在eoi后45分钟,姜黄素的血浆浓度为251ng/ml。该患者中姜黄素的c
max
和auc也非常高,与#24患者中观察到的值相当。有趣的是,#3、#19和#24患者中的高姜黄素血浆浓度与输注期间的不良事件或hb降低没有关系,所述输注期间的不良事件或hb降低与针对dl6a的患者报道的输注期间的不良事件或hb降低相当。
[0069]
在其余29名患者中,观察到血浆浓度随输注速率明显线性增加。但是,对于输注速率的四倍变化(12.5mg/m2/h至50mg/m2/h),输注过程中姜黄素的平均2小时血浆水平变化了24.0倍,这表明随着剂量的增加,与剂量比例存在偏差。如果将姜黄素剂量范围为190
–
300mg/m2的c
max
和auc
0-tlast
值进行比较,这一点甚至更加明显。因此,在较高的姜黄素输注速率下,即使适当地采用了强大的血浆消除机制,输注过程中姜黄素的消除也可能达到饱和。尽管在#3、#19和#24患者中发现了高水平的姜黄素,但其余患者的姜黄素和thc的血浆水平和药代动力学显然是剂量依赖性的,并且对于这种多样化的患者人群,显示出中等至较高但并非过量的可变性。
[0070]
抗肿瘤活性的评估仅是次要研究目标,并且在该经过大量预治疗的患者人群中,尤其是低剂量下,8周后的根据recist v1.1的肿瘤响应是出乎意料的。在前列腺癌、骨和淋巴结转移和肺部淋巴管瘤的#27患者中和在结肠癌并且肝和肺转移的#30患者中观察到肿瘤标志物响应,这是功效的客观标志。此外,研究者还报道了这两名患者的短暂临床获益。#27患者的先前治疗是放射疗法和六个先前的化学疗法组合。#30患者之前已经接受了7种化学疗法组合。有趣的是,与在此剂量水平下在输注过程中显示出更多的hb降低的其他患者相比,这两名患者的hb相当恒定。
[0071]
一般而言,招募进入本研究的患者以前的抗癌治疗均已失败,并且通常表现出侵袭性病程。不希望受到理论的束缚,可能由于治疗时间有限和免疫功能受损,姜黄素杀死癌症干细胞的能力未转化为肿瘤缩小。姜黄素脂质体作为抗癌药的理想作用可能应在早期治疗方案中与其他化学疗法组合。姜黄素作为鞘氨醇激酶抑制剂的活性也表明,它可能有助于减少对其他抗肿瘤药物产生响应的患者的复发机会
30
。
[0072]
研究药物。姜黄素,(1e6e)-1,7-双(4羟基-3-甲氧基苯基)-1,6-庚二烯-3,5二酮,
分子量368.38g/mol,是在sami labs limited(印度班加罗尔)在良好生产规范(gmp)下合成的,纯度为99.2%。姜黄素脂质体是由奥地利polymun scientific按照针对先前的第一阶段研究
23
描述的gmp进行生产、测试、包装和标记的。最终批次的发布是由polymun的qp完成的。将姜黄素脂质体置于含有20ml脂质体悬浮液的20ml玻璃小瓶中,姜黄素浓度为6.0
±
1.5mg/ml。
[0073]
患者。符合本研究条件的是≥18岁的经组织学/细胞学确诊为局部晚期或转移癌的男性和女性患者,在研究入组时,对于这些患者没有被证明有益的抗肿瘤治疗可用。其他关键入选标准是ecog 0-2,预期寿命至少3个月,根据recist v1.1至少一个可衡量的病变,中性粒细胞绝对计数≥1500细胞/μl,hb>9.5g/dl和血小板计数>100,000μl,肾功能>50ml/min,使用cockcroft-gault公式估计的肌酐清除率(eccr)或血清肌酐<1.5mg/dl,血清总胆红素<3.0mg/dl,ast和alt低于正常上限(uln)的5倍,并签署了知情同意。具有淋巴癌、血液癌或多形性胶质母细胞瘤的患者被排除在本研究之外。其他关键排除标准是活动性的感染,或在研究药物给予的第一天之前的三天内发烧>38.5℃,可能通过给予姜黄素脂质体而加剧的疾病的证据(溶血性体质,血色沉着病),目前服用任何归类为细胞色素p450抑制剂或诱导剂的药物,在首次研究治疗之日前不到三周的全身性治疗,除症状性运动或感觉神经毒性nci-ctc等级≤2之外的来自之前的全身抗癌疗法的未解决的毒性,根据研究者的判断临床上显著的ecg异常,左心室射血分数(lvef)<50%,nyha 2级或充血性心力衰竭,不受控制的高血压或心律不齐,已知的hiv血清学阳性或活动性肝炎的证据。怀孕,哺乳且未采取避孕措施的女性也被排除在研究参与之外。
[0074]
该研究在萨尔茨堡的the paracelsus medical university第三医学系和the salzburg cancer research institute进行。该研究方案已获萨尔茨堡州伦理委员会批准(clinicaltrials.gov标识nct02138955,欧洲临床试验数据库[eudract]编号2013-001594-24)。该研究是根据赫尔辛基宣言、良好临床实践指南(good clinical practice guidelines)以及所有地方和联邦法规进行的。所有患者均提供书面知情同意。
[0075]
研究设计和剂量递增。这是一项开放标签,单中心、剂量递增研究。每周一次(+/-1天)给予研究药物。在治疗的每一天,患者均接受50mg苯海拉明的预先用药,并接受姜黄素脂质体的静脉内输注。单个患者接受研究治疗,直至完成8个周期(8周),直至肿瘤进展或无法耐受的毒性,以先到者为准。如果在第8周患者表现出客观的临床益处,则可以向他们提供其他姜黄素脂质体的选择,剂量和时间表与他们以前接受的相同。
[0076]
24小时内120mg/m2的起始剂量基于健康受试者1a期安全性研究的结果。在第一位患者中输注2次后,由于输注管中形成沉淀,研究被暂时中断。患者没有经历与此事件相关的任何不良事件。经过大量的使用稳定性测试后,已向监管机构和有关ec提交了实质性修改,并且在第一队三名患者中重新开始了研究,以dl为100mg/m2输注姜黄素脂质体八小时。如果三名可评估患者在前三周内未发生dlt,则允许将剂量上调至下一个dl,并且dsmb建议剂量上调。
[0077]
安全性评估。安全性评估包括监测和记录所有ae、严重不良事件(sae),定期监测血液学、血液化学,定期身体检查和生命体征测量。
[0078]
dlt被定义为溶血(nci-ctc 2级:溶血的证据,输注结束后120分钟内连续2次测量hb降低≥2克,根据研究者确定与研究药物的因果关系),nci-ctc 3级或4级毒性,不包括对
止吐剂治疗有反应的恶心和呕吐和脱发,延长的(>2周)nci-ctc 2级毒性(神经-小脑:意向性震颤,言语不清,眼球震颤,辨距不良),nci-ctc 4级血小板毒性,nci-ctc 4级粒细胞毒性≥7天和发热性中性粒细胞减少症:定义为中性粒细胞绝对计数<500/mm3,发烧为间隔1小时的两次口腔温度升高>38℃,或单次口腔温度>38.5℃,前提是该单次发作与其他事件没有明显关系。
[0079]
药代动力学评估。将血样收集到含有k
3-edta的试管中,用于通过液相色谱-串联质谱法使用nucro technics(加拿大)的一种经过验证的方法测定姜黄素和thc血浆浓度,如先前针对使用姜黄素脂质体的研究所报道的
23
。在基线(bl)、开始输注后2小时和输注结束后0分钟=eoi、10分钟、20分钟、30分钟、45分钟、60分钟和120分钟收集#1输注样品,以及在eoi收集#2、#3、#5和#8输注样品。从安全数据监控委员会要求的以2级剂量治疗的患者获得的样品的初步pk分析显示姜黄素血浆水平仅在输注期间(2小时时)可检测到,而输注结束后则检测不到。为了实现更好地表征姜黄素在血浆中的药代动力学,将样本采集时间点(修改3,从17患者#开始)修改为bl、在输注2小时、4小时和6小时,以及eoi、eoi后10分钟、20分钟、30分钟和45分钟。血液采集数量保持不变。
[0080]
pk分析的重点是修改3之后纳入研究且具有足够的高于定量限(loq=10ng/ml)的姜黄素血浆浓度值的患者。这些患者在8小时的输注中接受了150、190、240或300mg/m2剂量的姜黄素,或在6小时的输注中接受了300mg/m2剂量的姜黄素。由于大多数患者在输注后缺乏浓度数据,因此使用经过验证的phoenix winnonlin professional软件(v6.3)确定的药代动力学参数为c
max
,t
max
,auc
0-tlast
和c
last
。
[0081]
使用输注期间2小时测定的姜黄素血浆浓度对比输注速率,和输注速率对比2小时姜黄素血浆浓度的图的线性回归,评估剂量比例和线性。使用输注速率代替姜黄素剂量来比较不同输注时间的数据。
[0082]
功效评估。功效终点是在8周后根据recist v1.1监测血清癌症标志物以及癌症的临床体征和症状的响应率(完全响应/部分响应/疾病稳定/疾病进展)。
[0083]
预期可以以本发明的任何方法、试剂盒、试剂或组合物实施本说明书中讨论的任何实施方案,反之亦然。此外,本发明的组合物可用于实现本发明的方法。
[0084]
将理解的是,本文中描述的具体实施方案是通过举例说明的方式显示的,而不是对本发明的限制。在不脱离本发明范围的情况下,可以在各种实施方案中采用本发明的主要特征。本领域技术人员将认识到或仅使用常规实验就能够确定本文所述的具体方法的许多等同方案。这样的等同方案被认为在本发明的范围内,并被权利要求所覆盖。
[0085]
说明书中提到的所有出版物和专利申请表明了本发明所属领域的技术人员的技术水平。所有出版物和专利申请通过引用并入本文,其程度如同具体且单独地表明每个单独的出版物或专利申请通过引用并入一样。
[0086]
当在权利要求书和/或说明书中与术语“包含”结合使用时,词语“一(a)”或“一(an)”的使用可以表示“一个”,但也与“一个或多个”、“至少一个”和“一个或多于一个”的含义一致。除非明确指出仅指代供选择的方案或供选择的方案是互斥的,否则权利要求中的术语“或”的使用是指“和/或”,尽管本发明支持仅指代供选择的方案和“和/或”的定义。在整个申请中,术语“约”用于表示包括设备、用于确定值的方法的误差的固有变化或研究对象中存在的变化的值。
two-and eight-hour infusions in beagle dogs.anticancer res 2012;32:4359-4364.
[0118]
manrique-moreno m,villena f,sotomayor cp,edwards am,ma,garidel p等人.human cells and cell membrane molecular models are affected in vitro by the nonsteroidal anti-inflammatory drug ibuprofen.biochim biophys acta-biomembranes 2011;1808:2656-2664.
[0119]
pierce a,nester t.pathology consultation on drug-induced hemolytic anemia.am j clin pathol 2011;136:7-12.
[0120]
perkins j.fatal drug-induced immune hemolytic anemia due to cefotetan;a case study.asian j transfu sci 2008;2:20-23.
[0121]
barbaryan a,iyinagoro c,nwankwo n,ali am,saba r,kwatra sg,等人.ibuprofen-induced hemolytic anemia.case rep hematol 2013;142865:1-3.
[0122]
storka a,vcelar b,klickovic u,gouya g,weisshaar s,aschauer s,等人.effect of liposomal curcumin on red blood cells in vitro.anticancer res 2013;33:3629-3634.
[0123]
sordillo la,sordillo pp,helson l.sphingosine kinase inhibitors as maintenance therapy of glioblastoma after ceramide-induced response.anticancer res 2016;36:2085-2095.
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1