消融病变装置
本发明涉及一种消融病变装置(ablationlesiondevice,消融病灶器),特别涉及一种用于将微波能量传递到组织的选定区域的装置。
背景技术:
每年有近似1700万人死于心血管疾病,其中高达四分之一是由于室性心律失常而突然死亡。室性心律失常是异常快速的心律,其可能发生在心脏的主要泵室(心室)受伤之后,最常见于心脏病发作后。
植入式心脏除颤器(icd)用于通过监测心律并提供一种在发生室性心律失常时将其终止的方法来预防高危患者的死亡。然而,icd不能预防心律失常,并且许多患者会经历反复的室性心动过速(vt)和装置电击(deviceshock),这两者都会降低生活质量并增加死亡率。抗心律失常药物预防vt的疗效通常令人失望。
使用经由脉管系统引入心脏的导管以识别和靶向(target,标靶)vt电路的关键部分的射频消融(radiofrequencyablation,射频消融术)可能是有效的。然而,导致vt的心室瘢痕(scar)的形态在解剖学上是可变的,通常向深处延伸到心肌,并且对于传统射频导管消融而言是无法达到的。射频能量沉积在心脏表面处,并通过热传导加热到更深的层。使用接触力感测导管的射频消融可以用于在心肌中形成热病变,最大深度约为7mm。然而,这不足以靶向在心室肌深处的心律失常的基质(substrate),其正常厚度为10-12mm。心外膜消融方法已尝试通过从心脏外部靶向同一基质来克服病变深度的限制。然而,心外膜脂肪显著减弱了射频消融的电阻性加热,并且心外膜中冠状动脉的存在限制了可安全地执行消融的部位。
此外,试图以更高的接触力传递更多的射频能量而产生更大的病变,频繁导致导管组织界面区域下方的组织过热,这可能导致蒸汽爆裂,并且这可能引起心室穿孔和全身性栓塞。如上所述,射频消融仅对导管组织界面下方的少量心肌提供直接(电阻性)加热,而病变生长是由来自该热区(hotzone)的热传导驱动的。因此,加热区(heatedzone)中的高组织温度限制了可以达到的病变尺寸。由于这些问题,在心脏电生理领域中,实现深层室性消融病变仍然是一项重大挑战。
本发明人已经确定,心内微波导管加热可通过以安全地形成更深层病变的方式提供直接加热较大体积的心肌的能力来克服这些限制。以正确的方式施加的微波能量还可以穿透心外膜脂肪,保留(spare,不伤害)冠状动脉(由于动脉血流),因此将动脉受损的可能性降至最低。
微波心室消融的另一种应用是肥厚性梗阻型心肌病患者左心室流出道(ventricularoutflowtract)的消减(debulking),从而使主动脉下瓣膜中隔心肌(subaorticvalveseptalmyocardium)肥大并阻碍血流。目前针对这种情况的治疗选择仅限于开放(open)心脏手术和肌切开术或酒精室间隔消融。后者涉及经由冠状动脉左前降支的中隔(septal)分支而输注酒精以产生中隔梗塞区,目的是减少该部位处的肌肉体积。该方法的局限性包括由血管范围(territory)控制(govern,管理)的不可预测的梗塞区,需要起搏器植入的高度房室传导阻滞的风险,以及产生可能导致室性心律失常的组织病变的粗糙(ragged)区。
用于中隔减少的微波心内膜消融可以潜在地消除对手术的需要,并产生更可预测和更安全的中隔病变,因此使潜在的流出道阻塞(obstruction)最小化。使用微波消融的心内膜下保留现象可潜在地使心肌传导系统免于受损,并减少需要植入起搏器的可能性。
包括电感测功能的已知血管内微波心脏消融导管采用消融电极作为感测电极(或使用电耦合至消融电极的感测电极)。由于需要维持微波天线与目标组织之间的物理接触和电接触,因此提供的微波发射效果不佳,并且可能导致导管尖部(cathetertip)过热,从而减少了导管尖部的散热并增加了电阻性加热。至少部分由于这个原因,在过去的20年左右的时间里,微波心脏消融导管在取代rf消融导管方面几乎没有进展。
对本申请的申请人而言,已公开的专利申请wo2016/197206(该专利申请的全部内容通过援引并入本文)描述了一种用于肾动脉去神经手术的微波消融装置。该装置允许消融肾神经而不会严重损害肌肉动脉壁和内皮层。该装置的特征在于,微波辐射器封装在外部护套(sheath)内,该辐射器通过诸如同轴电缆的屏蔽线与微波能量源联接。护套允许诸如盐水溶液(salinesolution)的冲洗流体流动,这有助于去除由微波能量辐射导致的局部热量。外部护套包括诸如径向扩展部分的定位结构(formation),以帮助装置居中。尽管已证明该装置在血管内去神经中是有效的,但是它并不理想地适于形成深部病变,也不适用于心脏消融手术。
在说明书中引用任何现有技术,都不表示承认或暗示该现有技术在任何权限范围(jurisdiction)中构成公知常识的一部分,或者可以合理地期望该现有技术被理解,视为相关和/或由本领域技术人员与其他现有技术组合。
技术实现要素:
在第一方案中,本发明提供了一种消融病变装置,用于将微波能量传递到组织的选定区域,所述装置包括微波辐射天线,所述微波辐射天线能经由微波馈线电连接到电微波系统,微波天线被构造为产生能够在所述组织的选定区域中消融组织的微波场,所述天线被定位在细长(elongated)导管的天线接收部分内,所述细长导管被构造为允许流体沿着导管流动以通过导管壁中的一个或多个孔口离开,所述导管设置有电感测系统,所述电感测系统包括一个或多个金属电极并独立于所述电微波系统,所述装置被构造为使得在使用中,所述电感测系统包括电路,所述电路结合有离子电导桥(ionicconductivitybridge),所述离子电导桥形成在所述一个或多个金属电极与离开所述一个或多个孔口的流体之间,离子电导桥横穿所述导管天线接收部分。
在另一方案中,本发明提供了一种消融病变装置,用于将微波能量传递到组织的选定区域,所述装置包括:
微波辐射天线,能经由微波馈线电连接到微波能量源,微波天线被构造为产生能够在所述组织的选定区域中消融组织的微波场;
细长型的中空导管,从近端部分延伸到包括尖部的远端部分,导管具有外壁以将导管的内部和外部分开;
导管在所述远端部分中包括天线接收部分,导管被构造为提供用于所述天线馈线到所述天线接收部分的通路;
导管具有包括第一腔(lumen)和第二腔的分隔形式(septatedform),第一腔和第二腔被布置为使流体流动到导管远端部分;
所述第一腔和所述第二腔通过所述导管远端部分中的导管外壁分别与第一孔口和第二孔口连接,以提供从每个腔到导管外部的流体流出路径,第一孔口和第二孔口在所述天线接收部分中分开;
所述第一腔和所述第二腔中的至少一个包括电极,所述电极位于基本接近(proximal)所述天线接收部分的导管远端部分中。
因此,导管装置提供一细长护套,以从近端容纳微波馈线,并到达在导管远端部分的尖端处的天线接收部分中的天线,冲洗导电流体流(诸如盐水流)沿着第一腔和第二腔穿过导管并经由第一孔口和第二孔口流出导管。电极经由电线电连接到感测系统,以形成具有返回电极的电路,以便感测在组织的所述选定区域中或附近的电学性质或活性,从而允许在微波消融手术期间监视所述电学性质或活性,电路经由从腔通过将该腔与导管外部连接的孔口的冲洗流体而形成。以这种方式,电极和电线都基本上不定位在微波场内。
将理解的是,以上使用的术语“电极”通常是指金属电极,将本发明与合适的流体一起使用,在由流体流出路径和应用该装置的局部组织所确定的位置处产生“虚拟感测电极”。换言之,通过流体流产生与导管外部的电连接。
优选地,第一孔口和第二孔口沿着所述天线接收部分在纵向上分开,替代地或附加地,第一孔口和第二孔口可以在天线接收部分中沿横向于导管的纵向方向的方向分开。
优选地,第一腔和第二腔分别包括第一电极和第二电极,每个电极都位于基本上在所述天线接收部分附近的导管远端部分中。
以这种方式,所述电极和所述返回电极由所述第一电极和第二电极提供,每个电极都经由相应的电线连接到感测系统,形成所述电路的一部分,电路经由冲洗流体从第一腔和第二腔并穿过将相应的腔与导管外部连接的第一孔口和第二孔口而形成。
第一腔和第二腔在导管远端部分中没有流体互连,因此由于导管内部的流体流动而避免了它们之间的导电。
换言之,导管的分隔形式在导管内部的第一电极与第二电极之间提供的阻抗电路径要比在导管外部的第一孔口与第二孔口之间提供的阻抗电路径高得多,这导致经由第一孔口和第二孔口形成电路。这导致感测到的电势近似于将从第一孔口与第二孔口之间进行直接感测电极测量所得出的电势。
在优选的形式中,导管远端部分设置有:
至少一个尖部孔口,在尖部处或靠近尖部的导管壁中,以及
腔孔口,位于导管尖部附近的导管壁中;
所述第一腔连接到导管的所述天线接收部分以向其提供流体,所述流体经由所述至少一个尖部孔口离开导管;
所述第二腔而终止于经由腔孔口与导管外部连接的流体;
其中,所述至少一个尖部孔口和腔孔口沿着导管的天线接收部分的主要(substantial)部分在纵向上分开;
其中,第一绝缘电线沿着所述第一腔布置而终止于所述第一电极,第二绝缘电线沿着所述第二腔布置而终止于所述第二电极。
在该实施例中,所述至少一个尖部孔口提供所述第一孔口,腔孔口提供所述第二孔口。因此,在第一电极与第二电极之间通过冲洗流体并经由所述至少一个尖部孔口和腔孔口形成电路。
优选地,所述装置包括多个第二腔,每个第二腔都具有一电极并且都具有一腔孔口,这些腔孔口基本纵向地重合。优选地,这些腔孔口与最大微波场强度的区域基本纵向地重合。
优选地,所述装置包括多个第一腔,所述多个第一腔中的至少一个设置有一电极,所述多个第一腔都连接到导管的天线接收部分。
在一个实施例中,存在至少三个所述第一腔和至少三个所述第二腔,其在所述微波馈线与所述导管壁之间的体积中以交替布局(alternatingdisposition)的方式布置在导管内。
优选地,天线被构造为在所述导管的外部产生微波场,所述微波场具有包括腔孔口的场纵向范围。优选地,腔孔口被定位在所述场纵向范围的近似中心处。在消融手术期间,这有助于用户基于感测到的心脏电激励信息将导管定位在目标区域上。
在一个实施例中,第一腔和第二腔被连接以使公共流体在所述远端部分附近的所述导管中流动。
在这样的实施例中,互连(interconnection)距离第一电极和第二电极的位置足够远,使得当供应有冲洗流体时,在它们之间形成高阻抗电路。优选地,该互连距离第一电极和/或第二电极的纵向位置至少300mm,例如在导管的近端处。
在本发明的装置的使用中,导管近端部分连接到冲洗流体系统,以将流体提供到所述第一腔和第二腔。
优选地,所述微波馈线沿着馈线通路在导管内与所述第一腔和第二腔分开地布置。
优选地,例如通过以合适的聚合物封装,微波辐射天线与所述导管天线接收部分中流动的流体绝缘。
因此,本发明涉及一种方法和设备,其使用适于插入目标组织结构的局部的冲洗尖部消融导管,将微波能量施加到组织,特别地施加到心脏组织,以在特定区域(诸如患病组织的区域)中产生病变。本发明包括在导管中使用腔结构,以提供冲洗流体通路而提供用于冷却诸如盐水溶液的流体的流动路径,以及通过在电导体与盐水流动路径中的点之间的盐桥提供的一个或多个虚拟感测电极的系统,这些点由导管外壁(诸如外部护套)中的孔口提供。
如上所述,本发明源于发明人的认识(realisation),其中可能需要心外膜室性消融才能到达心内膜无法进入的致心律失常基质,已知的射频能量传递技术受到心外膜脂肪和冠状动脉解剖结构的限制,使得这种解决方案通常不切实际。确实,心脏电生理学家之间目前的共识是避免冠状动脉的5mm内的射频消融,因为这可能导致冠状动脉损伤。相反,使用特别设计的微波导管装置可产生显著增强的结果,微波消融能够通过心外膜脂肪形成深层病变,而不会对附近的冠状血管和肺组织造成急性损伤。
然后,在一种形式中,本发明由绝缘的发射微波的不平衡单极导管组成。尽管除了对中机构之外在某些特征上与wo2016/197206中所述的装置具有某些相似之处,其采用了封装辐射元件的外部护套,并在导管的远端处包括穿孔以能够实现(1)开放式冲洗(包括冷却功能)和(2)电感测功能。
为了用于室性心律失常消融,本发明的装置的导管具有通过穿孔提供的盐水电极,因此穿孔既起到使冷却流体流向导管尖部的作用,又能够感测局部心脏电活动。利用本发明的装置,提供了完全绝缘的天线和单独的电感测系统,而在感测电路与局部微波场之间没有实质的相互作用。消融的隔离和传感功能使作为加热局灶性点(focalpointsofheating)的电极对邻近心肌的风险最小化,并减少微波天线处或任何电连续组织中的欧姆加热,并防止电极以任何方式屏蔽天线。
如上所述,先前用于或建议用于心脏消融的微波导管装置涉及罩(cap)扼流导管的使用,其中天线罩也用作感测电极(因此没有与心内膜环境绝缘)。这导致一种这样的系统,即天线罩将迅速加热局部组织,并且不会传递可能的比射频消融导管更深的病变。相反,本发明不使用与辐射元件电连续的导管的一部分来感测心脏电信号。通过采用一组电学上分开的电极来感测心脏电信号,这可以使绝缘天线能够提供显著更好的辐射心肌加热,同时避免欧姆天线加热。
本发明既适用于心内膜消融又适用于心外膜消融,例如它可用于(心内膜或心外膜的)室性心律失常消融或肥厚性心肌病中隔缩小手术(心内膜手术)。
因此,本发明提供了产生深层室性消融病变的临床经导管方法。如前所述,与通常仍是唯一公认的室性消融方法(尽管其形成病变的能力有限)的经皮射频消融相比,微波能量的使用明显更适合于深层室性消融,并且可能更安全地用于心外膜消融。
本发明的至少一些实施例的特定方案包括以下内容:
1、与周围环境绝缘的不平衡单极天线。
2、与天线元件独立且电绝缘的感测电极的单独的系统。
3、感测电极由沿着同轴护套延伸的绝缘线形成,终止于靠近天线部段和同轴电缆馈线的接合处的电极,并与连接到穿孔的盐水腔电连续。冲洗流体被引导通过这些盐水腔而从穿孔离开,这些点处的流体起到感测电极的作用(经过适当的过滤以消除微波噪声)。以这种方式,不会将任何金属引入微波场,从而能够在消融期间同时感测心脏电势,同时保持期望的消融加热模式。
因此,本发明提供了形成深层心内膜或心外膜室性消融的能力,包括通过心外膜脂肪和冠状动脉附近的消融。
优选地,特别是当被提供用于心脏消融手术时,导管是可偏转的,并且包括热反馈机构(诸如热电偶),例如定位在微波馈线的远端的1mm内的热电偶。
附图说明
本发明的其他方案以及在前面的段落中描述的各方案的其他实施例将从以下描述中变得显而易见,所述描述是通过示例的方式并且参考附图给出的。
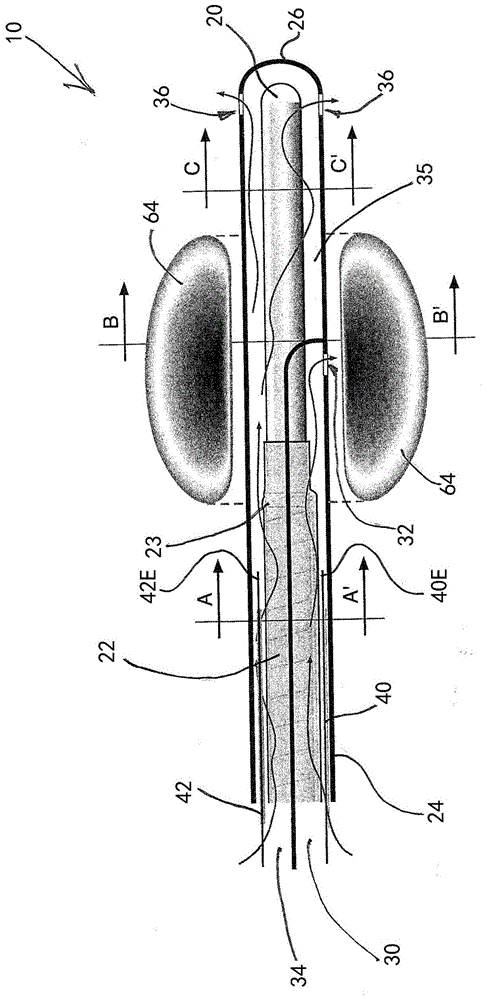
图1示出了根据本发明的消融病变装置的远端部分的纵向截面图;
图2示出了图1的装置的三个截面图a-a、b-b、c-c;
图3示出了图1的装置的侧视图;
图4、图5a至图5c示出了在医疗系统中和在使用中的图1的装置;以及
图6a和图6b示出了本发明的实施例的试验结果。
具体实施方式
将理解,在本说明书中公开和定义的本发明扩展到所提到的或者从文本或附图中显然的两个或更多个单独特征的所有替代组合。所有这些不同的组合构成了本发明的各种替代方案。
图1提供的示意图示出了微波消融导管10,所述微波消融导管具有细长的、绝缘的微波天线20(下面进一步讨论),所述微波天线被构造为向周围环境辐射微波能量。天线20通过屏蔽导体(即,同轴电缆22)电耦合到微波能量源(参见图4),优选地电耦合到调谐微波发生器,所述同轴电缆22具有导电中心芯,所述导电中心芯被管状绝缘层包围,转而被编织的(braided)外部导体包围,该同轴电缆被包裹在绝缘外层23中。在发明人测试的形式中,天线20由同轴电缆22的中心芯的选定端子长度提供,在该长度上剥去了外部绝缘和编织物(braid)。在公布文本wo2016/197206中讨论了微波天线和导体馈线的其他部件(包括可选的部件)。
要注意的是,附图未按比例显示。例如,在图1中,竖直(宽度)尺寸以近似水平(长度)尺寸的两倍的比例示出。
天线20和电缆22被包含在外部管状绝缘护套24中,外部管状绝缘护套24在其远端处的尖部26处闭合。如图2的截面图a-a’和b-b’中最清楚地示出的,导管10包括内部分界壁(dividingwall),所述内部分界壁连接到护套24以将内部分成六个细长的腔。这些腔中的三个腔30、30’、30”形成流体通道,这些流体通道沿着护套24延伸,分别通过孔口32、32’、32”(图1中仅示出孔口32)终止于与护套24外部的连接。在截面图中观察,这三个流体腔在电缆芯与护套24的内表面之间的环形体积周围规则地、成角度地间隔开,每个流体腔都占据近似60°的扇形。将理解的是,这三个腔因此提供了互相分开的流体通道。
在该实施例中,天线20相对于导管护套24的纵向轴线基本居中地对准。然而,如果需要定向(directional,方向性的),则天线可以偏离中心对准,比相对的第二侧更靠近第一侧。在这种情况下,导管10的远端的第一侧被定位成邻近目标组织区域62,通过天线与第二侧之间的导管内部的更大体积的流体进行微波能量吸收。
导管10是柔性的,但是沿着其长度基本不可压缩,以有助于插入并最小化由外部压缩导致的阻抗或流体流动的变化。另外,导管10形成为具有相对高的扭转刚度,使得近端部分的旋转将转化为远端部分的相应旋转。此外,为了有助于将导管尖部引导到所需位置及其在适当位置时的取向,导管10可以包括一根或多根引导线或拉线,以提供定向能力。
孔口32、32’、32”在近似与消融区域的中心相对应的位置处轴向地重合,如下面进一步讨论的。为了清楚起见,图3的侧视图省略了通道30’、31’和孔口32’、32”、以及天线组件。
其他三个腔34、34’、34”占据了电缆芯与护套24的内表面之间的环形体积的剩余部分,并且是端部敞开的,以在腔30、30’、30”的远端终端处合并为一公共腔室(commonchamber)35。因此,腔室35提供了天线接收区域以及流体流动体积,流体能够在天线20周围的环形体积中自由流动。因此,腔34、34’、34”可以被视为“公共腔”。在护套24中靠近远端26处形成有多个穿孔36(理想地,三个或四个),从而提供从内部到外部(即,从腔室35到外部)的流体传输路径。
金属线导体设置在这些通道的四个通道中,三根线(40、40’、40’)分别设置在单独的腔30、30’、30”中,一根线42设置在公共腔34、34’、34”中的一个中。如图1和图3所示,每根线沿着其长度绝缘,除了其形成电极(分别为40e和42e)的远端的未绝缘部分之外。电极40e和42e可以形成在线导体的端部上或附接到线导体的端部,或者可以通过剥去绝缘(层)来暴露每根线的较短长度而简单地提供。
如图1和图3所示,四根线在它们相应的通道内沿着导管延伸,终止于接近编织端(屏蔽的馈线电缆22与天线20之间的过渡)近似20mm处。如下所述,这避免了线的任何部分处于由天线20产生的微波场内。
由于形成通道的导管的分隔结构,使e2盐桥(salinebridge)起始于公共线是不切实际的,因此线沿着三个通道的每个通道向下延伸。
为了感测附近(nearby)心肌的局部电描记图(electrogram),已知的消融导管在尖部处结合有感测电极(e1,远端电极),以及在沿着导管的相对近端位置、柄处包括感测电极(e2,第二电极),这些感测电极共同被设置为环形电极。这些e1和e2电极通常间隔2mm-10mm的纵向距离,并共同提供双极性信号的感测,以监测消融手术的有效性。随着消融区域的增加,导管尖部周围的组织变得越来越不电活跃,局部电描记图的这种降低(diminution)提供了指示消融进展的关键指标。
然而,与这种传统的消融导管相反,所描述的装置产生微波消融场,所述微波消融场辐射到导管尖部附近。由于该微波场,感测线不能延伸至尖部电极,因为线将需要穿过微波场区域。这将具有使辐射场成形的效果(因此不期望地影响消融模式),而该场将干扰心电图系统的导体。因此,该场使得使用金属电极来感测场区域内或靠近场区域的任何地方的心肌电描记图是不切实际的。取而代之的是,本发明的装置使用用于这些电极的盐桥(salinebridge),从而在流体与心肌相遇的最接近的一个或多个流体流出点处、在护套24中的一个或多个孔口处或附近有效地提供一个或多个虚拟电极。以这种方式,在护套充满盐水溶液的情况下,线与出口孔口电连续,从而在线电极40e与来自孔口32、32’、32”的流体流出点(或者,更准确地说,是流体流出与心肌相遇的点)之间形成盐桥。类似地,在线电极42e与来自一个或多个孔口36的流体流出点之间形成盐桥。
将理解的是,这些盐桥穿过微波场区域,但是不受该场影响。盐流(由图1中的流向箭头表示)是操作中冷却导管所必需的,并提供靠近微波辐射器的区域,该区域中的介电常数较高(以帮助设置辐射器的有效长度)。因此,由来自孔口32、32’、32”的流体流出点提供的虚拟电极在功能上可以被视为等同于传统导管的e2感测电极,而由来自一个或多个孔口36的流体流出点提供的虚拟电极在功能上可以被视为等同于传统导管的e1尖部感测电极。为了方便起见,下面使用e1/e2术语来指示本发明的相应的虚拟电极。
将理解的是,与传统导管不同,消融发生在e2感测电极(微波场最高的区域)周围,而不是在e1远端电极周围。远端电极充当局部“接地”,从e2信号中减去,从而消除场噪声或其他常见的电激励(activation)。
如上所述,除了其冷却功能之外,盐水流体还因此在从相应孔口流出的流体进入血液中并到达局部心肌的点处充当盐水虚拟电极,从而在电描记图感测电路与组织之间产生有效的接触点。发明人的试验表明,即使直接放置在场的中心,这种“虚拟”盐水电极也能很好地执行。
如将理解的,尽管在该实施例中,电感测系统仅使用单根线42(以提供e1电极),但是两根或三根线可以穿过公共腔34、34’、34”中的相应公共腔延伸。
此外,虽然预期在单个腔30中仅采用单根线40,但是发明人已经确定在许多情况下这是不切实际的,因为接着会需要对导管尖部进行定位和取向,使得从该腔的流出孔口与心肌充分地紧密接触。发明人已经确定,因此使用具有多根线的多个腔是非常有利的,其中三个(如图所示)或四个腔/线被认为是理想的。
如本领域技术人员将理解的,通过本发明的设计,感测电极电气地独立于辐射天线,由高损耗导电材料(优选为盐水)构成,因此使与微波场的相互作用最小化。此外,该设计提供了微波天线的有效的周向冷却,并确保其不与心脏组织接触。因此,本发明的装置能够进行心脏电描记图感测以及消融,而没有与现有方法相关联的局部组织发热的风险。
如将理解的,虽然腔30、30’、30”在导管尖部的上游终止并离开导管,但是孔口36被定位得非常靠近尖端,以避免可能妨碍有效散热的流体相对停滞(stagnant)的区域。在所示的设计中,流体完全循环通过包括邻近导管尖部的区域的腔室35,从而阻止任何停滞区的形成。
此外,如图1所示,在导管的纵向方向上,近端虚拟电极大约位于微波场中心处,从而允许医生将导管排成行并在该点处使用感测到的心电图信号以监测消融操作。如将理解的,虚拟电极之间的间隔(近似于孔口之间的纵向间隔)优选地至少是要形成的病变的长度的一半,使得远端虚拟电极处于未受影响的组织中,因此最好地监测消融期间的心电图功能变化。与使用电感测电极的已知消融导管的共同之处在于,对于虚拟电极的合适间隔在2mm-15mm的范围内,具体取决于特定的应用(根据所需的天线尺寸和场图案进行选择)。
在一种变型中,可以将微波辐射图案聚焦在更靠近导管尖部的位置(通过使用合适的天线的设计和定位),在这种情况下,电极的布置可以颠倒。因此,消融病变将形成为基本与导管尖部成一条线,在与该消融区对应的位置处具有一个或多个尖部流动孔口,且在其近端的位置处具有其他流动孔口(对应于返回虚拟感测电极)。
导管天线周围的流体通路和感测电极的布置具有以下效果:
1)由于减少进入周围介质的能量损失而改善了微波辐射;
2)通过消除电阻性加热并使用盐水的移动柱来吸收和消散导管天线周围的电介加热,从而限制导管-组织界面的加热;
3)能够在进行(deliver,传递)消融的同时感测心肌的电活动。
还应注意,紧邻天线附近需要存在盐水,以将天线构造为根据其长度进行辐射。换言之,如果流体离天线较远,则需要更长的天线。
天线20通过合适的封装(诸如具有环氧端盖的特氟龙(teflon)管)与其周围的冲洗流体绝缘。类似地,同轴电缆22通过一层薄的热收缩层(shrink)(诸如palladiumtm热塑性弹性体)绝缘。如将理解的,允许微波电极或馈线编织物接触冲洗流体会影响消融场图案,并可能通过电耦合而对心电图系统造成干扰。
通过改变天线长度和天线平衡度,可以修改由本发明的装置传递的病变的形状。对于vt消融,长的病变可能是有利的,特别是如果以选定的方式进行取向的话。对于肥厚型心肌病,理想的病变形状可以是宽且长的,因为医生将致力于收缩基质隔膜中相对大面积的肌肉。然而,对于许多应用而言,优选通常局部球形的病变成形。
电极的布置允许以双极方式(在每个功能e1电极与每个功能e2电极之间)或以单极方式(从每个功能e2电极到普通患者返回电极)进行电信号感测。在后一种技术中,可以将患者电极放置在心脏外部但在血液系统中的任何合适位置(例如,在单独的导管上,或在定位在心脏外部的导管护套24外部的单独的位置处),也可以根据需要选择将患者电极设置在放置在患者大腿、臀部或背部上的患者返回贴片(patientreturnpatch)中。尽管单极方法有一些应用,但是对于大多数消融应用而言,它不是优选的,因为信号通常不能提供足够的信息来监测手术的成功。双极方法能够实现局部心电图监测,同时排除远场信号。
如上所述,在分别由一个或多个近端孔口32和一个或多个远端孔口36提供的虚拟电极之间实现感测电路。附加地或替代地,可以在孔口32中的两个孔口之间(例如,在线40与40’之间)实现双极电描记图监测。例如,心电图监测可以涉及生成代表两个不同感测电路的矢量和的信号。因此,在该变型中,可以使用沿着导管径向分开(但不一定在纵向上隔开)的虚拟电极来实现本发明。这样的布置将提供紧密间隔的双极,由此感测到的电信号从基本在电极之间的心肌的小区域得到,不包括代表心脏内所有去极化的远场复合(far-fieldcomposite)的大得多的信号。这种布置的有效性将取决于电极孔口周围的组织的取向,并因此取决于导管的特定布局(placement,位置)。
作为使用多个感测电路的示例,具有6个腔的所示实施例可以采用在最大辐射的地点(site)处用于双极电描记图的紧密横向间隔开的盐水电极对的三种组合,以及沿着导管的纵向轴线的一个或多个间隔较宽的电极对,因此为进行正交阻抗测量提供了可能。尽管(如上所述)紧密间隔的双极电描记图可在临床上用于检测病变中非常细微和局部的活动,但是感测的正交特性可以用于产生一信号,该信号的特征对于心肌激励的波前方向更具不变性。
如图4所示,导管10在手柄12处连接到患者电缆14,在患者电缆的近端28处,微波同轴馈线22经由合适的连接器23连接到微波产生源50,电线40、40’、40”、42经由合适的连接器52(诸如一个或多个redel1p插入式连接器)连接到心电图处理/显示模块54。ecg模块54可以包括信号处理器以及合适的监视器、显示器和反馈装置,以辅助在消融手术期间使用微波导管。腔30、30’、30”和34、34’、34”经由合适的连接器56(诸如一个或多个鲁尔(luer)锁)连接到流体控制系统58,所述流体控制系统包括合适的泵、控制和流量测量装置,从而允许选择性地调整流量参数。流体控制系统58还可以用于将诸如药物的其他流体引入流体流腔中,以传递至导管尖部。
如将理解的,导管系统可以包括其他部件和子系统,诸如在导管远端处使用温度感测装置的测温(thermometry)感测系统,以辅助在消融手术期间监测操作。为此,导管包括用于温度监测的热电偶(thermcouple),该热电偶定位在微波馈线的远端(即,同轴电缆屏蔽编织物的端部)约1mm(的范围)内。这可以涉及使用沿着导管系统的长度延伸的附加的腔,例如,该附加的腔也通过连接器52连接。
可以看到,导管系统沿着其长度包括两个部分,即,尖部26与手柄12之间的远端部分(导管10)、以及手柄12与近端28之间的近端部分(包括患者电缆14,在该示例中,长度约为2m)。
在该示例中,导管10的长度约为1100mm,长度为30mm的笔直的远端部分(容纳天线和热电偶)经由柔性部分连接,以提供最小30mm弯曲半径,其屈曲(flexion)高达180°(90°,如虚线所示)。因此,用于屈曲机构的远端锚定环远离微波场。
如前所述,导管系统可以包括本领域所需和已知的附加设计特征,诸如辅助转向或以其他方式引导导管尖部或增强对导管尖部的跟踪的特征。
图5a至图5c示出了消融导管10的使用,在这种情况下,将消融导管引入在目标区域的位置(诸如患病或受损的组织,或者以其他方式确定为导致心律失常的组织区域)附近的心脏60的心室中。
图5a示出了布置(deploy,部署)在心脏60中的导管,图5b更详细地示出了左顶(leftsummit)上方(左前降支动脉与回旋支(circumflex)之间的心脏肌部分、心律失常的源)的导管10的平面图。
图5c描绘了在心包空间中就位的导管10的远端,以截面显示的组织,即,血池70、心室壁72、心包膜74和肺野76。在导管护套内可以看到涂有聚四氟乙烯的天线20,以及其中一些冲洗/虚拟电极端口32、36。
除了消融区域64之外,图5c还描绘了小的肺部加热区域65,将在下面进一步讨论。
本发明的导管可以用于心内膜或心外膜。对于心内膜使用,通常首先插入引导护套,然后将导管10插入穿过引导件。对于心外膜使用,通常将短的、可转向的护套插入心包空间中,并通过该引导件插入导管10。由于存在填塞的可能性,并且冲洗流体会吸收微波能量,因此在消融手术期间应不断吸入(aspirate)心包流体。
在上述装置中,远端部分中的导管护套由合适的生物相容性塑料材料(即,ensingerplasticspeek)制成,该材料耐微波并且可以被挤压或3d打印到薄壁部件中。优选不含碳纤维的变型,以排除碳纤维组分与微波场之间可能的相互作用。
优选地,该装置使用合适的挤压技术(诸如传统的共挤压(coextrusion)或组合挤压)来制造。
可以提供外部护套的选定部分的增强。例如,近端部分的约450mm可以包括编织的薄壁管。
微波馈线(同轴电缆22)由合适的高功率/低损耗微波电缆提供。在测试中,使用了molextemp-flex086sc-2401,其是双编织/箔屏蔽同轴电缆,其中,编织屏蔽(层)为40awg镀银铜,镀银铜芯的直径为0.51mm。为了增强柔性,需要多股镀银铜芯。对于微波天线,在选定的尖部长度上去除了馈线的外部fep套(jacket)和编织层,并用iridium热收缩材料(钴聚合物)包裹箔同轴层。
导线40、40’、40”、42由适当的生物相容性材料制成,诸如直径约为0.2mm的钛、铂/铱或不锈钢线,并具有合适的绝缘层。
如上所述,导管的分隔性质(和护套材料的绝缘性质)提供在不同的流体柱之间的电分离,从而在电极之间提供高阻抗电路并在孔口32处产生虚拟电极(同时允许公共冲洗流体向所有腔供应流体)。因此,该布置提供了独立于微波天线元件并与微波天线元件电隔离的感测电极系统。
然而,如本领域技术人员将理解的,不必在导管的整个长度上继续分隔,例如,腔可以从导管尖部向中间区域延伸约300m(足以在线40、40’、40”和线42的电极端之间提供足够高阻抗的长度),而导管的其余部分(近端部分)由外部护套24限定的单个腔提供,该单个腔提供了充分的流体流动以供给所有腔30、30’、30”、34、34’、34”。例如,腔可以在手柄12处组合,该手柄提供上述的中间区域。另外,电线40、40’、40”可以互连到单根绝缘电线,所述单根绝缘电线与线42平行地沿着导管的近端部分延伸到心电图处理/显示模块54。以这种形式,中间区域提供电和流体流动歧管。
发明人已经通过广泛的体外和体内试验证明了使用微波能量在心外膜中形成深层室性消融的经导管系统的可能性,其已经确定了在冠状动脉附近进行手术的安全性。这些试验得出的结论是:
(1)与可能的使用接触力冲洗射频消融术(rf导管的最新发展)相比,使用该装置的冲洗微波消融可产生更深且更大的病变;
(2)通过心外膜脂肪可形成深层微波消融;
(3)在冠状动脉的5mm内进行微波消融可产生深层病变,而不会对冠状动脉造成急性损伤(否则会因急性冠状动脉痉挛或阻塞而表现出来)。
(4)尽管心脏病变较大,但并未发现对肺的附带损害,这可能是由于与心肌相比,充气的肺的微波介电常数存在显著差异。换言之,肺不被调谐到微波场,导致几乎所有的微波能量传递到心肌。图5c示出了小的肺部加热区域65,但是下面讨论的试验证实这不会对肺部造成任何损害。
特别地,在发明人进行的初步试验中,在体外模型中优化了根据本发明的冲洗微波消融导管(结合全波长微波天线20),该体外模型由嵌入有热致变色(thermochromic)液晶片的心肌凝胶体模组成。图6a示出了截面中冠状动脉的心肌体模上的微波导管的位置,在生理血流和37℃的温度下灌注0.9%的盐水。由于直接在冠状动脉上进行深层微波消融期间的动脉血流的冷却作用,因此可以看到邻近冠状动脉腔的组织的稀疏(spacing)。
然后于绵羊中在全身麻醉的情况下经由标准的经皮剑突下穿刺通路用优化的导管执行心外膜消融。将微波导管定位在冠状血管附近的左心室顶部、前室间沟和后外侧左心室上方。以20ml/min(的速度)进行90-100w的消融,持续4min(在2450mhz微波场下),在5只绵羊中进行了12次消融。在消融之后执行冠状动脉造影。
从术后分析,测得上覆的(overlying)心外膜脂肪厚度为2±3mm。测量的微波病变深度为10±4mm,宽度为18±10mm,长度为29±8mm。发现12次消融中有10次位于冠状动脉的5mm以内,平均间隔为2.4±1.6mm。邻近的冠状动脉保持开放(patent),而在血管造影上没有局灶性变窄。这可能是由于体外模型中冠状动脉血流对动脉壁的冷却作用所致。
图6b示出了界限分明且深层的消融病变,尽管存在明显的上覆心外膜脂肪。
这些初步试验还包括使用不同长度的微波天线形成的病变,这证实了可以通过改变天线的天线长度来改变病变的长度。
这些试验提供了初步指示,即经导管心外膜微波消融可以是一种有效、安全的方法,该方法用于消融由左心室顶部引起的室性心动过速或先前使用传统消融方法无法接近的其他区域。
将理解的是,在本说明书中公开和定义的本发明扩展到所提到的或者从文本或附图中显然的两个或更多个单独特征的所有替代组合。所有这些不同的组合构成了本发明的各种替代方案。
如本文所用的,除非上下文另有要求,否则术语“包括”和术语的变型(诸如“包含”、“含有”和“具有”)并不旨在排除其他添加物、部件、整数或步骤。
- 还没有人留言评论。精彩留言会获得点赞!