造血干细胞和造血祖细胞扩增系统的制作方法
造血干细胞和造血祖细胞扩增系统
1.相关申请的交叉引用
2.本申请要求于2019年5月29日提交的美国临时申请第62/854,250号和于2018年10月12日提交的美国临时申请第62/745,208号的优先权和权益。前述申请中的每个申请的内容通过引用整体并入本文。
背景技术:
3.细胞培养基提供了在受控、人工和体外环境中维持和生长细胞所需的营养素。细胞培养基的特性和调配物根据特定的细胞要求而变化。重要参数包含渗透压、ph和营养组合物。
4.细胞培养基调配物在文献中已经有充分记载,并且大量培养基是可商购获得的。细胞培养基的典型组分包含氨基酸、有机盐和无机盐、维生素、痕量金属、糖、脂质和核酸,其类型和量可以根据给定物种、细胞或组织类型的特定要求而变化。
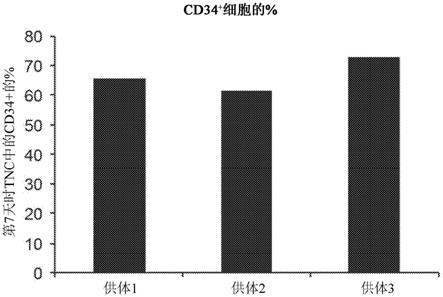
5.多能人造血干细胞/祖细胞(hspc,也被称为hsc)是实验移植、移植物研究的各种应用所需的,并且需要将其进一步分化为所有血谱系,包含髓样细胞(红细胞、巨噬细胞、血小板)和淋巴样细胞(例如,t细胞和b细胞)。cd34是通常用于鉴定和分离hsc的hsc的标志物。使用原代hsc的主要限制是通常用于分离hsc的组织,如脐带血和外周血中存在的低cd34
+
细胞数量。参见例如,bhattacharya等人,(2008),《欧洲免疫学杂志(european journal of immunology)》38(8):2060
‑
2067;notta等人,(2011),《科学(science)》333(6039):218
‑
221;doulatov等人,(2012),《细胞干细胞(cell stem cell)》10(2):120
‑
136,所述文献中的每个文献通过引用整体并入本文。
6.仍然需要可用于扩增hsc和其它原代细胞的化学限定的细胞培养基,特别是用于获得具有高比例的被认为是长期再增殖hsc的谱系
‑
cd34
+
cd90
+
cd45ra
‑
cd49f
+
(cd34
+
cd90
+
cd45ra
‑
)细胞的hsc群。
技术实现要素:
7.目前,存在离体扩增cd34
+
细胞的数量的培养基体系。然而,使用可商购获得的培养基体系,造血干细胞(hsc)的扩增不成比例地发生,因为大多数的所得细胞是短期hsc,其中存在有限的长期hsc。本文所述的一些实施例涉及一种可以有效地离体扩增长期和短期人hsc两者的培养基体系。另外,本公开的一些实施例可以使得能够扩增来自不同组织来源(如脐带血、动员外周血和骨髓)的人hsc。调配物实施例是完全开发的,并且用各种具体化培养基衍生或扩增的hsc可以用于例如生物化学、转录组学、表观遗传学和移植研究中的一种或多种。
8.一方面,提供了一种用于培养造血干细胞(hsc)的生长培养基,所述生长培养基包含基础培养基和补充剂,其中所述培养基和/或所述补充剂包含组蛋白乙酰转移酶(hat)抑制剂、组蛋白脱乙酰酶(hdac)抑制剂以及以下中的两种或更多种:脂质、氨基酸或氨基酸衍生物、抗氧化剂和无机盐。
9.在实施例中,所述基础培养基选自optmizer
tm cts
tm t细胞扩增无血清培养基(optmizer
tm cts
tm t
‑
cell expansion serum
‑
free medium)、达尔伯克氏改良伊格尔培养基(dulbecco's modified eagle media,dmem)、伊斯科夫氏改良达尔伯克氏培养基(iscove's modified dulbecco's medium,imdm)、dmem/f12、高级dmem/f12(advanced dmem/f12)和knockout
tm dmem/f12。
10.在实施例中,所述hat抑制剂选自2,6
‑
双[(3
‑
溴
‑4‑
羟苯基)亚甲基]环己酮、mg149、c646、cpth2、姜黄素、a
‑
485、漆树酸、mb
‑
3和查尔酮,如藤黄酚(garcinol)、异藤黄酚(isogarcinol)、黄腐酚(xanthohumol)、异黄腐酚(isoxanthohumol)、2
‑
羟基查尔酮、4
‑
羟基查尔酮、益智酮甲(yakuchinone a)和异甘草素。在某些实施例中,所述hat抑制剂以介于0.001克/升(g/l)与1g/l之间的浓度存在。在某些实施例中,可以独立地从本文所述的培养基和/或补充剂中排除先前提及的hat抑制剂中的每种hat抑制剂。
[0011]
在实施例中,所述hdac抑制剂选自阿匹西定(apicidin)、贝利司他(belinostat)、ci
‑
994、cra
‑
024781、帕比司他(panobinostat)、丁酸钠、苯丁酸钠、辛二酰苯胺异羟肟酸(伏立诺他(vorinostat))、曲古霉素a(trichostatin a)、丙戊酸钠(丙戊酸;vpa)、吉诺司他(givinostat)、ms
‑
275、mgcd0103和斯克瑞泰(scriptaid)。在某些实施例中,所述hdac抑制剂以介于0.0005g/l与10g/l之间的浓度存在。在某些实施例中,可以独立地从本文所述的培养基和/或补充剂中排除先前提及的hdac抑制剂中的每种hdac抑制剂。
[0012]
在实施例中,所述hdac抑制剂和所述hat抑制剂的重量比为1:1到1:30hdac抑制剂:hat抑制剂。
[0013]
在实施例中,所述无机盐选自铜盐、镁盐、亚硒酸盐、钾盐、钙盐、锌盐、铁盐、钠盐或其组合。在某些实施例中,可以独立地从本文所述的培养基和/或补充剂中排除先前提及的无机盐中的每种无机盐。
[0014]
在实施例中,所述脂质选自胆固醇、亚油酸、亚麻酸、油酸、棕榈酸、花生四烯酸、棕榈油酸、肉豆蔻酸和其组合。在某些实施例中,可以独立地从本文所述的培养基和/或补充剂中排除先前提及的脂质中的每种脂质。
[0015]
在实施例中,所述生长培养基还包含白蛋白、胰岛素、转铁蛋白、白介素3(il
‑
3)、白介素6(il
‑
6)、干细胞因子、fms相关酪氨酸激酶3配体、血小板生成素、粒细胞集落刺激因子、粒细胞
‑
巨噬细胞集落刺激因子和/或其组合。在某些实施例中,可以独立地从本文所述的培养基和/或补充剂中排除先前提及的另外成分中的每种成分。
[0016]
在实施例中,所述抗氧化剂选自多酚、抗坏血酸盐和类胡萝卜素。在实施例中,所述多酚选自在水果、酒和茶中天然存在的那些多酚。在实施例中,所述抗坏血酸盐选自抗坏血酸盐或抗坏血酸。在实施例中,所述类胡萝卜素选自β
‑
胡萝卜素、α
‑
胡萝卜素和番茄红素。在实施例中,所述抗氧化剂选自dl硫辛酸、dl生育酚乙酸酯和抗坏血酸。
[0017]
在实施例中,所述培养基不包含源自动物的成分。在实施例中,所述培养基不包含血清。在实施例中,所述培养基是无外源物质培养基(xeno
‑
free medium)。
[0018]
一方面,提供了一种试剂盒,所述试剂盒包含基础培养基和补充剂,所述培养基和/或所述补充剂包含组蛋白乙酰转移酶(hat)抑制剂、组蛋白脱乙酰酶(hdac)抑制剂以及以下中的两种或更多种:脂质、氨基酸或氨基酸衍生物、抗氧化剂和无机盐。在实施例中,所述补充剂包含hat抑制剂。在实施例中,所述补充剂包含hdac抑制剂。在实施例中,所述基础
培养基包含hat抑制剂。在实施例中,所述基础培养基包含hdac抑制剂。
[0019]
一方面,提供了一种试剂盒,所述试剂盒包含组蛋白乙酰转移酶(hat)抑制剂、组蛋白脱乙酰酶(hdac)抑制剂、基础培养基和补充剂,所述培养基和/或所述补充剂包含以下中的两种或更多种:脂质、氨基酸或氨基酸衍生物、抗氧化剂和无机盐。在实施例中,试剂盒的每种组分(hat抑制剂、hdac抑制剂、补充剂和基础培养基)均在单独的容器中存在于试剂盒中。在实施例中,所述组分中的任何两种或更多种组分均在同一容器中存在于试剂盒中。
[0020]
在实施例中,试剂盒中的补充剂的浓度大于1x。如本文所使用的,术语“1x”是指处于工作浓度的组合物。也就是说,组合物处于推荐使用的浓度(例如,使hsc生长)。在实施例中,试剂盒中的补充剂的浓度为2倍到100倍。
[0021]
一方面,提供了一种用于培养造血干细胞(hsc)的生长培养基补充剂,所述生长培养基补充剂包含组蛋白乙酰转移酶(hat)抑制剂和组蛋白脱乙酰酶(hdac)抑制剂。在实施例中,生长培养基补充剂进一步包含脂质、氨基酸或氨基酸衍生物、抗氧化剂和无机盐。在实施例中,生长培养基补充剂包含hdac抑制剂和hat抑制剂,所述hdac抑制剂和所述hat抑制剂的重量比为1:1到1:30hdac抑制剂:hat抑制剂。
[0022]
一方面,提供了一种扩增干细胞的方法,所述方法包含使干细胞在本文所述的生长培养基中生长。
[0023]
在实施例中,所述干细胞是造血干细胞(hsc)。在实施例中,在培养4到14天之后,cd34表达性hsc扩增20倍到350倍。在实施例中,在培养4到14天之后,cd34表达性hsc扩增50倍到350倍。在实施例中,在培养4到14天之后,cd34表达性hsc扩增80倍到350倍。在实施例中,在培养4到14天之后,cd34表达性hsc扩增100倍到350倍。在实施例中,在培养7天之后,cd34表达性hsc为总有核细胞的至少50%。在实施例中,在培养7天之后,cd34表达性hsc介于总有核细胞的60%与90%之间。在实施例中,在培养7天之后,cd34
+
cd90
+
cd45ra
‑
hsc富集到总有核细胞的至少5%。在实施例中,在培养7天之后,cd34
+
cd90
+
cd45ra
‑
hsc富集到总有核细胞的至少10%。
[0024]
一方面,提供了一种扩增干细胞的方法,所述方法包含(i)向基础培养基中添加包含组蛋白乙酰转移酶(hat)抑制剂和组蛋白脱乙酰酶(hdac)抑制剂的补充剂以形成生长培养基,以及(ii)使所述干细胞在所述生长培养基中生长,由此扩增所述干细胞。在实施例中,所述生长培养基进一步包括以下中的两种或更多种:脂质、氨基酸或氨基酸衍生物、抗氧化剂和无机盐。在实施例中,所述生长培养基包括脂质、氨基酸或氨基酸衍生物、抗氧化剂和无机盐。
[0025]
一方面,提供了一种扩增来自受试者的原代细胞的方法,所述方法包含使所述原代细胞在包含以下的生长培养基中生长:基础培养基、组蛋白乙酰转移酶(hat)抑制剂和组蛋白脱乙酰酶(hdac)抑制剂以及以下中的两种或更多种:脂质、氨基酸或氨基酸衍生物、抗氧化剂和无机盐。在实施例中,所述生长培养基包括脂质、氨基酸或氨基酸衍生物、抗氧化剂和无机盐。在实施例中,所述原代细胞是hsc。在实施例中,所述原代细胞是免疫细胞。在实施例中,所述免疫细胞是t细胞、b细胞、巨噬细胞、nk细胞、树突细胞、单核细胞和/或粒细胞。在实施例中,将经过扩增的原代细胞用于治疗有需要的患者的方法中,所述方法包括施用所述经过扩增的原代细胞。在实施例中,在扩增之前或之后对原代细胞进行基因修饰。
[0026]
一方面,提供了一种治疗需要疗法的受试者的方法,所述方法包含(a)获得造血干
细胞(hsc);(b)在如本文所述的包括hat抑制剂和hdac抑制剂的生长培养基中扩增所述hsc;以及(c)将所述hsc转移到所述受试者,由此治疗所述受试者。在实施例中,所述hsc源自所述受试者。在实施例中,所述方法进一步包含在将所述hsc转移到所述受试者之前对所述hsc进行基因修饰。在实施例中,所述受试者患有造血系统恶性肿瘤和/或已经经历化疗。在实施例中,所述受试者是人。在实施例中,所述疗法是对癌症、自身免疫性疾病或基于血液的疾病的治疗。
[0027]
一方面,提供了一种用于编辑干细胞(sc)的基因组的方法,所述方法包含:(a)获得在如本文所述的包括hat抑制剂和hdac抑制剂的生长培养基中扩增的sc;以及(b)编辑所述干细胞的所述基因组。在实施例中,所述基因组是使用选自以下的一种或多种基因组编辑试剂来编辑的:锌指核酸酶(zfn)、转录激活因子样效应物核酸酶(talen)、大范围核酸酶和常间回文重复序列丛集(clustered regularly interspaced short palindromic repeat,crispr)相关蛋白。
[0028]
一方面,根据本文提供的方法扩增的hsc用于制备用于治疗受试者的药物。在一些实施例中,使用包括以下的生长培养基扩增的hsc用于制备用于治疗有需要的受试者的药物:基础培养基、组蛋白乙酰转移酶(hat)抑制剂和组蛋白脱乙酰酶(hdac)抑制剂以及以下中的至少两种:脂质、氨基酸或氨基酸衍生物、抗氧化剂和无机盐。在一些实施例中,hsc在体外扩增之前源自待治疗受试者。
[0029]
一方面,提供了一种用于改善造血干细胞(hsc)群的植活潜力的方法,所述方法包含:(a)获得hsc群;以及(b)使用在如本文所述的包括hat抑制剂和hdac抑制剂的生长培养基中扩增所述hsc群,由此改善所述hsc群的植活潜力。
[0030]
一方面,提供了一种治疗需要疗法的受试者的方法,所述方法包括:(a)获得造血干细胞(hsc),所述造血干细胞使用在如本文所述的包括hat抑制剂和hdac抑制剂的生长培养基中进行扩增;以及(b)将所述hsc转移到所述受试者,由此治疗所述受试者。
附图说明
[0031]
图1.用于扩增cd34
+
细胞的过程工作流。将cd34
+
细胞用hsc扩增培养基扩增并且表征以确定总有核细胞(tnc)、活力%、表型和功能。
[0032]
图2a
‑
2f.脐带血cd34
+
细胞扩增中现有溶液的分析。当前溶液的代表性结果表明,在扩增后7天可观察到hsc的最高增加。在第7天时,细胞的活力最高(图2a)。虽然总有核细胞(tnc)的数量随时间而增加(图2b),但是由于hsc的分化,在经过扩增的细胞的群体中cd34
+
的百分比降低(图2c)。然而,cd34
+
的扩增倍数在扩增后第7天时最高(图2d)。尽管在第5天时观察到cd34
+
cd90
+
cd45ra
‑
细胞的最高频率(作为tnc的百分比;图2e),但是在第7天时观察到cd34
+
cd90
+
cd45ra
‑
细胞数量的最高倍数增加(图2f)。
[0033]
图3示出了与所指示的生长培养基相比,当在hsc扩增培养基中在培养基
±
藤黄酚和/或vpa中扩增细胞时,cd34
+
hsc(作为cd34
+
倍数)的增加。
[0034]
图4示出了使用hsc扩增培养基或所指示的生长培养基在基础培养基
±
藤黄酚和/或vpa中扩增的hsc的facs图。
[0035]
图5示出了基于图4的facs分析,在基础培养基
±
藤黄酚和/或vpa中扩增后为cd34
+
cd90
+
cd45ra
‑
的tnc的百分比的条形图。
[0036]
图6a
‑
6b.图6a示出了与所指示的生长培养基相比,当使用hsc扩增培养基在基础培养基
±
藤黄酚和/或vpa中扩增hsc时tnc的倍数增加。图6b示出了与所指示的生长培养基相比,当使用hsc扩增培养基在基础培养基
±
藤黄酚和/或vpa中生长时为cd34
+
的总有核细胞的百分比。
[0037]
图7a
‑
7e.表型性能数据的竞争性比较。在hsc培养基中来自人动员外周血(mpb)的hsc的扩增提供了cd34
+
细胞的大约100倍的增加。cd34
+
mpb在hsc培养基中的扩增导致显著更高水平的cd34
+
细胞(图7a)扩增和tnc(图7b)扩增,其中细胞显示出>80%的活力(图7c)。经过扩增的细胞是>60%cd34
+
(图7d),其中cd34
+
cd90
+
cd45ra
‑
长期hsc的水平显著更高(图7e)。所示出的cd34
+
和cd34
+
cd90
+
cd45ra
‑
的百分比来自总活tnc群。将三个人单供体纯化的cd34
+
mpb在hsc培养基(hsc基础培养基和50x补充剂)或三种商业培养基中进行培养,所有培养基均补充有生长因子(scf、flt3l、tpo、il
‑
3和il
‑
6)。将细胞培养7天,随后使用countess ii确定总有核细胞(tnc)和活力%,并且如所述评估表型。误差条表示标准偏差。
[0038]
图8a
‑
8e.批次间的表型性能数据。hsc培养基表现出一致的批次间性能。在三个不同批次的hsc培养基中扩增的cd34
+
mpb表现出等同水平的cd34
+
细胞扩增(图8a)、tnc扩增(图8b)、活力%(图8c)、cd34
+
%(图8d)和cd34
+
cd90
+
cd45ra
‑
%长期hsc(图8e)。将三个人单供体纯化的cd34
+
mpb在三个不同批次的hsc培养基(hsc基础培养基和50x补充剂)中进行培养,所有培养基补充有生长因子。将细胞培养7天,随后使用countess ii确定总有核细胞(tnc)和活力%,并且如图9所述评估表型。误差条表示标准偏差。
[0039]
图9.表型分析门控策略。在hsc培养基中培养的经过扩增的hsc的表型表征。将来自mpb的纯化的cd34
+
在含有生长因子的hsc培养基中进行培养。将细胞培养7天,然后通过流式细胞术评估cd34、cd90和cd45ra的表达。从分析中排除双联体和死细胞,并且基于荧光减一(fmo)对照来划分鉴定cd34
+
细胞和cd90
+
cd45ra
‑
细胞的门。
[0040]
图10.集落形成单位(cfu)测定数据。在hsc培养基中扩增的cd34
+
细胞维持体外分化能力。在14天的培养期期间,在hsc培养基中扩增的cd34
+
mpb能够分化成粒细胞/红细胞/单核细胞/巨核细胞(gemm)、红细胞(e)以及粒细胞/单核细胞(gm)集落形成细胞。将两个人单供体纯化的cd34
+
mpb在补充有生长因子的hsc培养基中培养7天。随后,将经过扩增的tnc在半固体培养基中培养另外14天,以评估集落形成细胞(cfc)。图像示出了所鉴定的集落的实例。
[0041]
图11a
‑
11e.hsc培养基扩增单供体人cd34
+
mpb细胞。在hsc培养基中扩增的所有三种人单供体cd34
+
mpb表现出等同水平的cd34
+
细胞扩增(图11a)、tnc扩增(图11b)、活力%(图11c)、cd34+的%(图11d)。值得注意的是,cd34
+
cd90
+
cd45ra
‑
长期hsc的扩增水平(图11e)因供体而异。将三个人单供体纯化的cd34
+
mpb在补充有生长因子的hsc培养基中进行培养。将细胞培养7天,随后使用countess ii确定总有核细胞(tnc)和活力%,并且如图9所述评估表型。误差条表示样品重复内的标准偏差。
[0042]
图12a
‑
12d.在hsc培养基中扩增的cd34
+
细胞表达最高的aldh水平。评估在hsc培养基中扩增的cd34
+
mpb的醛脱氢酶(aldh)的表达。显示的是,与(图12b)aldefluor
tm
阳性细胞群相比,门控鉴定了在没有aldh表达的(图12a)对照deab中温育的细胞。cd34
+
在hsc培养基中的扩增证明(图12c)在每个细胞的基础上的最高aldh表达(几何平均荧光强度)以及(图12d)cd34
+
细胞染色对aldh呈阳性的最高%。在hsc培养基批次之间观察到经过扩增的
细胞的aldh表达的一致性。将三个人单供体纯化的cd34
+
mpb在三个批次的hsc培养基或三个商业培养基中进行培养,所有培养基均补充有生长因子。将细胞培养7天,然后根据制造商的说明书,将总有核细胞(tnc)在deab或aldefluor
tm
中进行温育。将细胞用抗体染色以鉴定cd34
+
细胞,并且分析aldh表达。从三个单供体mpb细胞中汇集所显示的数据。误差条表示标准误差。
[0043]
图13a
‑
d.在hsc培养基中扩增的cd34+细胞可以是经过基因工程化的。图13a是条形图,其示出了来自三个单供体(p2、p8和p23)的动员外周血(mpb)的cd34+细胞的转染效率。如指示的,如在实例4中所述,用cas9、引导rna和gfp供体dna(100ng/ml、200ng/ml或500ng/ml)对在hsc培养基中扩增的cd34+细胞进行电穿孔。计算每种样品的gfp
+
细胞%(图13a)。误差条表示标准误差。对经过转染的细胞进行分选(gfp+或gfp
‑
)。将分选的细胞用抗体染色以鉴定cd34+cd90+细胞。通过cas9成功修饰的cd34+cd90+细胞的百分比(gfp+)与未经过基因修饰的cd34+cd90+细胞的百分比(gfp
‑
)类似(图13b),这证明基因修饰不影响这些hsc群的表型。此外,这些数据证明了cd34+cd90+细胞和cd34+cd90
‑
细胞的成功的crispr介导的修饰。使gfp+和gfp
‑
细胞经受如实例4中所述的体外集落形成测定。图13c是示出了在methocult
tm
培养基(干细胞技术有限公司(stem cell technologies,inc))中培养14天后红细胞(红色)和粒细胞/单核细胞(白色)集落形成单位/1000个细胞的数量的条形图。对于所分析的两组(未分选的,gfp+分选的),集落形成细胞数/1000个细胞是类似的。图13d是使用荧光显微镜和亮场显微镜从gfp+群鉴定的集落的照片。
[0044]
图14a和14b.stempro
tm hsc培养基使得能够用cts cytotune 2.1将cd34+细胞重编程为ipsc。图14a是示出了在如本文实例5中所述的optmizer
tm
或stempro
tm hsc培养基中扩增的cd34+细胞的重编程效率百分比的条形图。图14b是用碱性磷酸酶染色并成像的重编程的ipsc集落的照片,以观察在本文实例5中所述的optmizer
tm
或stempro
tm hsc扩增培养基中培养的集落数量。在如本文所述的hsc扩增培养基中扩增的cd34+细胞的重编程效率优于(大约10倍)在optmizer
tm
培养基中扩增的cd34+细胞的重编程效率。
[0045]
图15.stempro
tm hsc扩增培养基使得能够用cts
tm cytotune 2.1和cytotune 2.0ipsc重编程试剂盒将pbmc重编程到ipsc中。图15是示出了在如本文实例6中所述的stempro34
tm
或stempro
tm hsc扩增培养基中扩增的pbmc的重编程效率百分比的条形图。与在stempro
‑
34培养基中扩增的pbmc相比,在stempro
tm hsc扩增培养基(如本文所述)中扩增的pbmc表现出优良的重编程效率。
具体实施方式
[0046]
在阅读本说明书之后,对于本领域的技术人员而言,如何在各个替代性实施例和替代性应用中实施本发明将变得显而易见。然而,本发明将不描述本发明的所有各个实施例。将理解的是,此处所呈现的实施例仅通过举例而非限制的方式进行呈现。如此,各个替代性实施例的这种详细描述不应被解释为限制如下文所阐述的本发明的范围或广度。
[0047]
在公开和描述本发明之前,应当理解,以下描述的方面并不限于具体组合物、制备此类组合物的方法或其用途,因而这些方面当然可以变化。还应当理解,本文所使用的术语仅出于描述特定方面的目的,而不旨在是限制性的。
[0048]
本发明的详细描述仅出于读者的方便而被分成各个部分,并且在任何部分中发现
的公开内容可以与在另一个部分中的公开内容组合。为了方便读者,可以在说明书中使用标题或子标题,其并不旨在影响本发明的范围。
[0049]
i.定义
[0050]
除非另有定义,否则本文所使用的全部技术术语和科学术语的含义与本发明所属领域的普通技术人员通常所理解的含义相同。在本说明书和以下权利要求书中,将参考多个术语,所述多个术语应被定义为具有以下含义:
[0051]
如本文中所使用的术语“一个(a)”或“一种(an)”意指一个或多个。
[0052]
当在数值指定(例如,温度、时间、量、浓度以及此类其它,包含范围)之前使用时,术语“约”指示可以变化(+)或(
‑
)10%、5%、1%或在其之间的任何子范围或子值的近似值。优选地,当关于剂量使用时,术语“约”意指剂量可以变化+/
‑
10%。
[0053]“任选的(optional)”或“任选地(optionally)”是指随后描述的事件或情况可能发生或不发生,并且所述描述包含事件或情况发生的实例以及事件或情况不发生的实例。
[0054]“包括(comprising)”或“包括(comprises)”旨在意味着组合物和方法包含所叙述的要素,但不排除其它要素。当用于定义组合物和方法时,“基本上由
……
组成(consisting essentially of)”应当意味着排除对于所述目的的组合具有任何重要意义的其它要素。因此,基本上由如本文所定义的要素组成的组合物将不排除对所要求保护的发明的一个或多个基本和新颖特性不具有实质影响的其它材料或步骤。“由
……
组成(consisting of)”应当意味着排除超过痕量要素的其它成分和大量方法步骤。由这些过渡术语中的每一个限定的实施例处于本发明的范围内。
[0055]“接触”根据其普通一般含义使用,并且是指使至少两个不同的物种(例如,包含生物分子或细胞的化学化合物)变得足够接近以进行反应、相互作用或物理触摸的过程。然而,应当理解,所得反应产物可以由所添加的试剂之间的反应或由来自所添加的试剂中的一种或多种的可以在反应混合物中产生的中间体来直接产生。
[0056]
术语“接触”可以包含允许两种物种反应、相互作用或物理触摸,其中所述两种物种可以是如本文所述的化合物和蛋白质或酶。在一些实施例中,接触包含允许本文所述的化合物与信号传导路径中涉及的蛋白质或酶相互作用。
[0057]
术语“表达”包含涉及多肽产生的任何步骤,包含但不限于转录、转录后修饰、翻译、翻译后修饰和分泌。可以使用用于检测蛋白质的常规技术(例如,elisa、蛋白印迹、流式细胞术、免疫荧光、免疫组织化学等)来检测表达。
[0058]
当应用于核酸或蛋白质时,术语“分离的”表示所述核酸或蛋白质基本上不含在天然状态下与其缔合的其它细胞组分。例如,其可以处于均匀状态并且可以处于干燥或水溶液中。纯度和均匀性通常使用分析化学技术,如聚丙烯酰胺凝胶电泳或高效液相色谱法确定。作为制剂中存在的主要物种的蛋白质是基本上纯化的。
[0059]
术语“氨基酸”是指天然存在的和合成的氨基酸,以及以与天然存在的氨基酸类似的方式起作用的氨基酸类似物和氨基酸模拟物。天然存在的氨基酸是由基因密码编码的氨基酸以及之后被修饰的那些氨基酸,例如,羟基脯氨酸、γ
‑
羧基谷氨酸和o
‑
磷酸丝氨酸。氨基酸类似物是指具有与天然存在的氨基酸相同的基本化学结构的化合物,即与氢、羧基、氨基和r基团结合的α碳,例如高丝氨酸、正亮氨酸、甲硫氨酸亚砜、甲硫氨酸甲基锍。此类类似物具有经过修饰的r基团(例如,正亮氨酸)或经过修饰的肽主链,但是保留与天然存在的氨
基酸相同的基本化学结构。氨基酸模拟物是指具有与氨基酸的通式化学结构不同的结构但以与天然存在的氨基酸类似的方式起作用的化学化合物。术语“非天然存在的氨基酸”和“非天然氨基酸”是指自然界中未发现的氨基酸类似物、合成氨基酸和氨基酸模拟物。
[0060]
氨基酸在本文中可以通过其通常已知的三字母符号或通过iupac
‑
iub生物化学命名法委员会(the iupac
‑
iub biochemical nomenclature commission)推荐的单字母符号提及。同样,核苷酸可以通过其普遍接受的单字母代码来表示。
[0061]
术语“疾病”或“病状”是指能够用本文所提供的化合物或方法治疗的患者或受试者存在的状况或健康状态。所述疾病可以是癌症。所述疾病可以是自身免疫性疾病。所述疾病可以是炎性疾病。所述疾病可以是感染性疾病。
[0062]
如本文所使用的,术语“炎性疾病”是指表征为异常炎症的疾病或病状(例如,与对照相比,如没有患病的健康人,炎症水平增加)。炎性疾病的实例包含自身免疫性疾病、关节炎、类风湿性关节炎、银屑病关节炎、青少年特发性关节炎、多发性硬化症、全身性红斑狼疮(sle)、重症肌无力、青少年发作的糖尿病、1型糖尿病、格林
‑
巴利氏综合征(guillain
‑
barre syndrome)、桥本氏脑炎(hashimoto's encephalitis)、桥本氏甲状腺炎(hashimoto's thyroiditis)、强直性脊柱炎、牛皮癣、干燥综合征(sjogren's syndrome)、血管炎、肾小球肾炎、自身免疫性甲状腺炎、白塞氏病(behcet's disease)、克罗恩氏病(crohn's disease)、溃疡性结肠炎、大疱性类天疱疮、结节病、鱼鳞癣、格雷夫氏眼病(graves ophthalmopathy)、炎性肠病、艾迪生氏病(addison's disease)、白癜风、哮喘、变应性哮喘、寻常痤疮、乳糜泻、慢性前列腺炎、炎性肠病、盆腔炎性疾病、再灌注损伤、局部缺血灌注损伤、中风、结节病、移植排斥、间质性膀胱炎、动脉粥样硬化、硬皮病和特应性皮炎。
[0063]
如本文所使用的,术语“癌症”是指在哺乳动物(例如,人)中发现的所有类型的癌症、肿瘤或恶性肿瘤,包含白血病、淋巴瘤、癌和肉瘤。可以用本文所提供的化合物或方法治疗的示例性癌症包含脑癌、神经胶质瘤、成胶质细胞瘤、成神经细胞瘤、前列腺癌、结肠直肠癌、胰腺癌、成神经管细胞瘤、黑色素瘤、宫颈癌、胃癌、卵巢癌、肺癌、头部癌症、霍奇金氏病(hodgkin's disease)和非霍奇金氏淋巴瘤(non
‑
hodgkin's lymphomas)。可以用本文所提供的化合物或方法治疗的示例性癌症包含甲状腺癌、内分泌系统癌、脑癌、乳腺癌、子宫颈癌、结肠癌、头颈癌、肝癌、肾癌、肺癌、卵巢癌、胰腺癌、直肠癌、胃癌和子宫癌。另外的实例包含甲状腺癌、胆管癌、胰腺癌、皮肤恶性黑色素瘤、结肠腺癌、直肠腺癌、胃腺癌、食管癌、头颈部鳞状细胞癌、浸润性乳腺癌、肺腺癌、肺鳞状细胞癌、非小细胞肺癌、间皮瘤、多发性骨髓瘤、成神经细胞瘤、神经胶质瘤、多形性成胶质细胞瘤、卵巢癌、横纹肌肉瘤、原发性血小板增多症、原发性巨球蛋白血症、原发性脑肿瘤、恶性胰腺岛瘤、恶性类癌、尿膀胱癌、癌变前皮肤损伤、睾丸癌、甲状腺癌、成神经细胞瘤、食管癌、泌尿生殖道癌、恶性高钙血症、子宫内膜癌、肾上腺皮质癌、内分泌或外分泌胰腺肿瘤、甲状腺髓样癌(medullary thyroid cancer)、甲状腺髓样癌(medullary thyroid carcinoma)、黑色素瘤、结肠直肠癌、乳头状甲状腺癌、肝细胞癌或前列腺癌。
[0064]
术语“白血病”广义上是指血液形成器官的渐进性恶性疾病,并且通常特征在于白细胞及其前体在血液和骨髓中的增殖和发育畸变。白血病通常在临床上基于以下进行分类:(1)急性病或慢性病的持续时间和特性;(2)所涉及的细胞的类型;髓样(骨髓性的)、淋巴样(淋巴性的)或单核细胞的;以及(3)异常细胞在血液
‑
白血病性或非白血病性(亚白血
病性)中的数量的增加或非增加。可以用本文所提供的化合物或方法治疗的示例性白血病包含例如急性非淋巴细胞白血病、慢性淋巴细胞白血病、急性粒细胞白血病、慢性粒细胞白血病、急性早幼粒细胞白血病、成人t细胞白血病、非白血性白血病(aleukemic leukemia)、白血病性白血病(a leukocythemic leukemia)、嗜碱细胞性白血病、母细胞白血病、牛白血病、慢性髓细胞性白血病、皮肤白血病、胚胎性白血病、嗜酸性粒细胞白血病、格罗氏白血病(gross'leukemia)、毛细胞白血病、成血细胞性白血病(hemoblastic leukemia)、成血细胞性白血病(hemocytoblastic leukemia)、组织细胞性白血病、干细胞白血病、急性单核细胞白血病、白细胞减少性白血病、淋巴性白血病、成淋巴细胞性白血病、淋巴细胞性白血病、淋巴球性白血病(lymphogenous leukemia)、淋巴样白血病、淋巴肉瘤细胞白血病、肥大细胞白血病、巨核细胞性白血病、微成髓细胞性白血病(micromyeloblastic leukemia)、单核细胞性白血病、成髓细胞性白血病、髓细胞性白血病、髓样粒细胞性白血病、髓单核细胞白血病、内格利氏白血病(naegeli leukemia)、浆细胞白血病、多发性骨髓瘤、浆细胞性白血病、早幼粒细胞白血病、里德尔氏细胞白血病(rieder cell leukemia)、希林氏白血病(schilling's leukemia)、干细胞白血病、亚白血病性白血病和未分化细胞白血病。
[0065]
如本文所使用的,术语“淋巴瘤”是指影响造血组织和淋巴组织的一组癌症。其在淋巴细胞(主要在淋巴结、脾脏、胸腺和骨髓中发现的血细胞)中开始。淋巴瘤的两种主要类型是非霍奇金氏淋巴瘤和霍奇金氏病。霍奇金氏病占所有诊断出的淋巴瘤的大约15%。这是与里德
‑
斯泰伯格氏(reed
‑
sternberg)恶性b淋巴细胞相关的癌症。非霍奇金氏淋巴瘤(nhl)可以基于癌症的生长速率和所涉及的细胞类型进行分类。存在侵略性(高等级)和惰性(低等级)类型的nhl。基于所涉及的细胞类型,存在b细胞和t细胞nhl。可以用本文所提供的化合物或方法治疗的示例性b细胞淋巴瘤包含但不限于小淋巴细胞淋巴瘤、套细胞淋巴瘤、滤泡性淋巴瘤、边缘区淋巴瘤、淋巴结外(malt)淋巴瘤、结节性(单核细胞样b细胞)淋巴瘤、脾脏淋巴瘤、弥漫性大细胞b淋巴瘤、伯基特氏淋巴瘤(burkitt's lymphoma)、淋巴母细胞淋巴瘤、免疫母细胞性大细胞淋巴瘤或前体b淋巴母细胞淋巴瘤。可以用本文所提供的化合物或方法治疗的示例性t细胞淋巴瘤包含但不限于原发性皮肤t细胞淋巴瘤(cunateous t
‑
cell lymphoma)、外周t细胞淋巴瘤、间变性大细胞淋巴瘤、蕈样真菌病和前体t淋巴母细胞淋巴瘤。
[0066]
术语“肉瘤”通常是指由类似于胚胎结缔组织的物质组成并且通常由包埋在纤丝状或均质物质中的紧密压积细胞构成的肿瘤。可以用本文所提供的化合物或方法治疗的肉瘤包含软骨肉瘤、纤维肉瘤、淋巴肉瘤、黑色素肉瘤、粘液肉瘤、骨肉瘤、阿贝西氏肉瘤(abemethy's sarcoma)、脂肉瘤、脂肪肉瘤、腺泡状软组织肉瘤、成釉细胞肉瘤、葡萄样肉瘤、绿色癌肉瘤、绒毛膜癌、胚胎肉瘤、威尔姆斯氏肿瘤肉瘤(wilms'tumor sarcoma)、子宫内膜肉瘤、间质肉瘤、尤因氏肉瘤(ewing's sarcoma)、筋膜肉瘤、成纤维细胞肉瘤、巨细胞肉瘤、粒细胞肉瘤、霍奇金氏肉瘤、特发性多发性色素沉着出血性肉瘤、b细胞的免疫母细胞肉瘤、淋巴瘤、t细胞的免疫母细胞肉瘤、詹恩逊氏肉瘤(jensen's sarcoma)、卡波西氏肉瘤(kaposi's sarcoma)、库普弗细胞肉瘤(kupffer cell sarcoma)、血管肉瘤、白血病性肉瘤、恶性间质瘤肉瘤、骨膜外肉瘤、网状细胞肉瘤、劳斯氏肉瘤(rous sarcoma)、浆液性囊肿肉瘤(serocystic sarcoma)、滑膜肉瘤或毛细血管扩张性肉瘤。
[0067]
术语“黑色素瘤”意指由皮肤和其它器官的黑色素细胞体系引起的肿瘤。可以用本
文所提供的化合物或方法治疗的黑色素瘤包含例如肢端雀斑样痣黑色素瘤、无黑色素性黑色素瘤、良性幼年黑色素瘤、克劳德曼黑色素瘤(cloudman's melanoma)、s91黑色素瘤、哈丁
‑
帕西黑色素瘤(harding
‑
passey melanoma)、青少年黑色素瘤、恶性雀斑样痣、恶性黑色素瘤、结节性黑色素瘤、甲下黑色素瘤或浅表扩散性黑色素瘤。
[0068]
术语“癌”是指由上皮细胞组成的恶性新生长,所述上皮细胞倾向于浸润周围组织并且引起转移。可以用本文所提供的化合物或方法治疗的示例性癌包含例如甲状腺髓样癌、家族性甲状腺髓样癌、腺泡癌、腺泡状癌、腺性囊性癌、腺样囊性癌、腺癌、肾上腺皮质癌、肺泡癌、肺泡细胞癌、基底细胞癌、基底样细胞瘤、基底细胞样癌、基底鳞状细胞癌、细支气管肺泡癌、细支气管癌、支气管癌、脑状癌、胆管细胞癌、绒毛膜癌、胶样癌、粉刺癌、子宫体癌、筛状癌、铠甲状癌、癌疮(carcinoma cutaneum)、柱状癌、柱状细胞癌、管癌、硬癌、胚胎性癌、髓样癌、表皮样癌、腺样上皮细胞癌、外植癌、溃疡性癌(carcinoma ex ulcere)、纤维癌、胶状癌(gelatiniforni carcinoma)、胶样癌(gelatinous carcinoma)、巨大细胞癌、巨细胞癌、腺癌、粒层细胞癌、发母质癌(hair
‑
matrix carcinoma)、多血癌(hematoid carcinoma)、肝细胞癌、许特尔氏细胞癌(hurthle cell carcinoma)、玻质状癌(hyaline carcinoma)、肾上腺样癌、幼稚型胚胎性癌、原位癌、表皮内癌、上皮内癌、克龙派切尔氏癌(krompecher'scarcinoma)、库尔奇茨基细胞癌(kulchitzky
‑
cell carcinoma)、大细胞癌、豆状癌(lenticular carcinoma)、豆状癌(carcinoma lenticulare)、脂肪瘤癌(lipomatous carcinoma)、淋巴上皮癌、髓样癌(carcinoma medullare)、髓样癌(medullary carcinoma)、黑色素癌、软癌、粘液癌、粘液性癌、粘液细胞癌(carcinoma mucocellulare)、粘液表皮样癌、粘液质癌(carcinoma mucosum)、粘液样癌、粘液瘤样癌、鼻咽癌、燕麦细胞癌、骨化性癌(carcinoma ossificans)、骨样癌(osteoid carcinoma)、乳头状癌、门静脉周癌、浸润前癌、棘细胞癌、软糊状癌(pultaceous carcinoma)、肾脏肾细胞癌、储备细胞癌、肉瘤样癌、施奈德癌(schneiderian carcinoma)、硬癌、阴囊癌(carcinoma scroti)、印戒细胞癌、单纯癌、小细胞癌、马铃薯状癌、球状细胞癌、梭形细胞癌、髓状癌(carcinoma spongiosum)、鳞状癌、鳞状细胞癌、绳捆癌、血管扩张性癌(carcinoma telangiectaticum)、毛细管扩张癌(carcinoma telangiectodes)、移行细胞癌、块状癌(carcinoma tuberosum)、结节性皮癌(tuberous carcinoma)、疣状癌或绒毛状癌。
[0069]
如本文所使用的,术语“自身免疫性疾病”是指其中受试者的免疫系统具有针对通常在健康受试者体内不引发免疫应答的物质的异常免疫应答的疾病或病状。可以用在此描述的化合物、药物组合物或方法治疗的自身免疫性疾病的实例包含急性播散性脑脊髓炎(adem)、急性坏死性出血性脑白质炎、艾迪生氏病(addison's disease)、血中丙球蛋白贫乏、斑秃、淀粉样变性、强直性脊柱炎、抗gbm/抗tbm肾炎、抗磷脂综合征(aps)、自身免疫性血管性水肿、自身免疫性再生障碍性贫血、自身免疫性家族性自主神经异常(autoimmune dysautonomia)、自身免疫性肝炎、自身免疫性高脂血症、自身免疫性免疫缺陷、自身免疫性内耳病(aied)、自身免疫性心肌炎、自身免疫性卵巢炎、自身免疫性胰腺炎、自身免疫性视网膜病变、自身免疫性血小板减少性紫癜(atp)、自身免疫性甲状腺疾病、自身免疫性荨麻疹、轴突或神经元神经病变(axonal or neuronal neuropathies)、巴洛氏病(balo disease)、白塞氏病(behcet's disease)、大疱性类天疱疮、心肌症、巨大淋巴结增生症、乳糜泻、恰加斯氏病(chagas disease)、慢性疲劳综合征、慢性炎性脱髓鞘多发性神经病
(cidp)、慢性复发性多病灶性骨髓炎(crmo)、变应性肉芽肿性血管炎(churg
‑
strauss syndrome)、瘢痕性类天疱疮/良性黏膜类天疱疮、克罗恩氏病(crohn's disease)、柯根氏综合征(cogans syndrome)、冷凝集素疾病(cold agglutinin disease)、先天性心脏传导阻滞、柯赛基病毒性心肌炎、crest疾病、混合性冷凝球蛋白血症(essential mixed cryoglobulinemia)、脱髓鞘神经病、疱疹样皮炎、皮肌炎、德维克氏病(devic's disease)(视神经脊髓炎)、盘状红斑狼疮、德雷斯勒氏综合征(dressler's syndrome)、子宫内膜异位、嗜酸细胞性食管炎、嗜酸性筋膜炎、结节性红斑、实验性变应性脑脊髓炎、埃文斯氏综合征(evans syndrome)、纤维组织肌痛、纤维性肺泡炎、巨细胞动脉炎(颞动脉炎)、巨细胞心肌炎、肾小球性肾炎、古德帕斯彻氏综合征(goodpasture's syndrome)、肉芽肿性多血管炎(gpa)(之前被称为韦格纳氏肉芽肿病(wegener's granulomatosis))、格雷夫氏病(graves'disease)、格林
‑
巴利氏综合征、桥本氏脑炎、桥本氏甲状腺炎、溶血性贫血、过敏性紫瘢(henoch
‑
schonlein purpura)、妊娠疱疹、低丙球蛋白血症、特发性血小板减少性紫癜(itp)、iga肾病、igg4相关硬化性疾病、免疫调节脂蛋白、包涵体肌炎、间质性膀胱炎、青少年型关节炎、青少年糖尿病(1型糖尿病)、青少年型肌炎、川崎氏综合征(kawasaki syndrome)、朗伯
‑
伊顿氏综合征(lambert
‑
eaton syndrome)、白细胞破碎性血管炎、扁平苔癣、硬化性苔癣、木样结膜炎、线性iga疾病(lad)、狼疮(sle)、莱姆病(lyme disease)、慢性病、梅尼尔氏病(meniere's disease)、显微镜下多血管炎、混合性结蒂组织病(mctd)、莫伦氏溃疡(mooren's ulcer)、穆哈
‑
赫伯曼病(mucha
‑
habermann disease)、多发性硬化症、重症肌无力、肌炎、发作性睡病、视神经脊髓炎(德维克氏病(devic's))、嗜中性白血球减少症、眼部疤痕性类天疱疮、视神经炎、复发性风湿病、pandas(与链球菌相关的儿童自身免疫神经精神病症)、副肿瘤性小脑变性、阵发性睡眠性血红蛋白尿症(pnh)、帕罗氏综合征(parry romberg syndrome)、帕桑那格
‑
特纳氏综合征(parsonnage
‑
turner syndrome)、睫状体扁平部炎(pars planitis)(周边葡萄膜炎)、天疱疮、周围神经病、静脉性脑脊髓炎(perivenous encephalomyelitis)、恶性贫血、poems综合征、结节性多动脉炎、i型、ii型和iii型自身免疫性多腺综合征、风湿性多肌痛、多肌炎、心肌梗死后综合征、心包切开术后综合征(postpericardiotomy syndrome)、自身免疫性孕酮性皮炎、原发性胆汁性肝硬化、原发性硬化性胆管炎、牛皮癣、银屑病性关节炎、特发性肺纤维化、坏疽性脓皮病、纯红细胞再生障碍、雷诺氏现象(raynauds phenomenon)、反应性关节炎、反射交感性营养不良、莱特尔氏综合征(reiter's syndrome)、复发性多软骨炎、多动腿综合征、腹膜后纤维化、风湿热、类风湿性关节炎、结节病、施密特氏综合征(schmidt syndrome)、巩膜炎、硬皮病、干燥综合征(sjogren's syndrome)、精子和睾丸自身免疫、僵人综合征、亚急性细菌性心内膜炎(sbe)、苏塞克综合征(susac's syndrome)、交感性眼炎、大动脉炎(takayasu's arteritis)、颞动脉炎/巨细胞动脉炎、血小板减少性紫癜(ttp)、托洛萨
‑
亨特综合征(tolosa
‑
hunt syndrome)、横贯性脊髓炎、1型糖尿病、溃疡性结肠炎、未分化结缔组织病(uctd)、葡萄膜炎、血管炎、血管大泡性皮肤病、白癜风或韦格纳氏肉芽肿病(wegener's granulomatosis)(即,肉芽肿性多血管炎(gpa)。
[0070]
如本文所使用的,术语“炎性疾病”是指表征为异常炎症的疾病或病状(例如,与对照相比,如没有患病的健康人,炎症水平增加)。炎性疾病的实例包含创伤性脑损伤、关节炎、类风湿性关节炎、银屑病关节炎、青少年特发性关节炎、多发性硬化症、全身性红斑狼疮
(sle)、重症肌无力、青少年发作的糖尿病、1型糖尿病、格林
‑
巴利氏综合征、桥本氏脑炎、桥本氏甲状腺炎、强直性脊柱炎、牛皮癣、干燥综合征、血管炎、肾小球性肾炎、自身免疫性甲状腺炎、白塞氏病、克罗恩氏病、溃疡性结肠炎、大疱性类天疱疮、结节病、鱼鳞癣、格雷夫氏眼病、炎性肠病、艾迪生氏病、白癜风、哮喘、哮喘、变应性哮喘、寻常痤疮、乳糜泻、慢性前列腺炎、炎性肠病、盆腔炎性疾病、再灌注损伤、结节病、移植排斥、间质性膀胱炎、动脉粥样硬化和特应性皮炎。
[0071]
术语“治疗(treating)”或“治疗(treatment)”是指成功治疗或改善损伤、疾病、病理或病状的任何指标,包含任何客观或主观参数,如减轻;缓解;症状消失或使得损伤、病理或病状对患者而言更易忍受;减缓退化或衰退的速度;或使退化的最终点较少衰退;改善患者的身体或精神健康。症状的治疗或改善可以基于客观或主观参数;包含身体检查、神经精神病学检查和/或精神病学评估的结果。术语“治疗”及其缀合可以包含预防损伤、病理、病状或疾病。在实施例中,治疗是预防。在实施例中,治疗不包含预防。
[0072]
如本文中所使用的(并且在本领域中被充分理解的)“治疗”或“治疗”还广泛地包含用于在受试者的病状中获得有益的或期望结果(包含临床结果)的任何方法。有益的或期望的临床结果可以包含但不限于:减轻或改善一种或多种症状或病状、减轻疾病程度、稳定(即,不恶化)疾病状态、预防疾病传播或扩散、延迟或减缓疾病进展、改善或缓解疾病状态、减少疾病复发以及缓解,无论是部分的还是全部的,以及无论是可检测的还是不可检测的。换句话说,如本文所使用的“治疗”包含对疾病的任何治愈、改善或预防。治疗可以预防疾病发生;抑制疾病扩散;缓解疾病的症状(例如,眼痛、看到光晕、红眼、极高的眼内压),完全或部分去除疾病的根本原因,缩短疾病的持续时间或这些事物的组合。
[0073]
如本文所使用的“治疗”和“治疗”包含预防性治疗。治疗方法包含向受试者施用治疗有效量的活性剂。施用步骤可以由单次施用组成,或者可以包含一系列施用。治疗期的长度取决于多种因素,如病状的严重程度、患者的年龄、活性剂的浓度、在治疗中所使用的组合物的活性或其组合。还应当理解,用于治疗或预防的药剂的有效剂量可以在特定治疗或预防方案的过程中增加或减少。通过本领域中已知的标准诊断测定,剂量的变化可以产生并且变得显而易见。在一些情况下,可能需要慢性施用。例如,以足以治疗患者的量向受试者施用组合物并且持续足够的持续时间。在实施例中,治疗或治疗不是预防性治疗。
[0074]
术语“预防”是指减少患者的疾病症状的发生。如上所述,预防可以是完全的(没有可检测的症状)或部分的,使得观察到比不存在治疗时可能发生的症状更少的症状。
[0075]“患者”或“有需要的受试者”是指患有或易于患有可以通过施用如本文所提供的药物组合物治疗的疾病或病状的活生物体。非限制性实例包含人、其它哺乳动物、牛科动物、大鼠、小鼠、狗、猴、山羊、绵羊、牛、鹿和其它非哺乳动物。在一些实施例中,患者是人。
[0076]“有效量”是相对于不存在化合物,足以使化合物实现所陈述目的的量(例如,实现其所施用的效果、治疗疾病、降低酶活性、增加酶活性、降低信号传导路径或降低疾病或病状的一种或多种症状)。“有效量”的实例是足以促成治疗、预防或减少疾病的一种或多种症状的量,所述量也可以被称为“治疗有效量”。一种或多种症状(和此短语的语法等同物)的“减少”意指降低一种或多种症状的严重程度或频率,或消除一种或多种症状。药物的“预防有效量”是当向受试者施用时,将具有预期的预防效果的药物的量,例如预防或延迟损伤、疾病、病理或病状的发作(或复发)或降低损伤、疾病、病理或病状或其症状发作(或复发)的
可能性。完全预防效果不一定通过施用一次剂量发生,并且可以在仅施用一系列剂量之后发生。因此,预防有效量可以以一次或多次施用形式来施用。精确量将取决于治疗的目的,并且将可由本领域的技术人员使用已知的技术确定(参见例如,lieberman,《医药剂型(pharmaceutical dosage forms)》(第1
‑
3卷,1992);lloyd,《医药学配混的艺术、科学和技术(the art,science and technology of pharmaceutical compounding)》(1999);pickar,《剂量计算(dosage calculations)》(1999);以及《雷明顿:医药科学和实践(remington:the science and practice of pharmacy)》,第20版,2003,gennaro编辑,利平科特
·
威廉斯
·
威尔金斯出版公司(lippincott,williams&wilkins))。
[0077]
对于本文所述的任何化合物,治疗有效量可以最初由细胞培养测定来确定。靶浓度将是能够实现本文所述的方法的,如使用本文所述或本领域已知的方法测量的一种或多种活性化合物的浓度。
[0078]
如本领域所熟知的,用于人的治疗有效量也可以从动物模型中确定。例如,可以调配针对人的剂量以实现已发现对动物有效的浓度。人体内的剂量可以通过监测化合物有效性以及如上文所述的上调或下调剂量来调整。基于上文所述的方法和其它方法调整剂量以实现在人中的最大功效完全处于普通技术人员的能力内。
[0079]
如本文所使用的,术语“治疗有效量”是指足以改善如上文所述的病症的治疗剂的量。例如,对于给定参数,治疗有效量将显示增加或降低至少5%、10%、15%、20%、25%、40%、50%、60%、75%、80%、90%或至少100%。治疗功效也可以表示为“倍数”增加或减少。例如,治疗有效量可以相对于对照具有至少1.2倍、1.5倍、2倍、5倍或更多的效果。
[0080]
剂量可以根据患者和正在使用的化合物的要求而变化。在本公开的背景中,向患者施用的剂量应足以随时间推移而在患者体内产生有益治疗应答。剂量的大小也将通过任何不良副作用的存在、性质和程度确定。针对特定情形的适当剂量的确定在执业医师的技术之内。通常,治疗开始于比化合物的最优剂量小的较小剂量。其后,剂量以小增量增加直到达到在这些情况下的最优效果。剂量和间隔可以单独调整以提供所施用化合物的对所治疗的特定临床适应症有效的水平。这将提供与个体疾病状态的严重程度相称的治疗方案。
[0081]
如本文所使用的,术语“施用”意指向受试者口服施用、以栓剂形式施用、局部接触、静脉内、肠胃外、腹膜内、肌肉内、病灶内、鞘内、鼻内或皮下施用,或植入缓慢释放装置(例如,微型渗透泵)。通过任何途径进行施用,包含肠胃外和经粘膜(例如,颊、舌下、腭、牙龈、鼻、阴道、直肠或经皮)。肠胃外施用包含例如,静脉内、肌肉内、动脉内、皮内、皮下、腹膜内、心室内和颅内施用。其它递送模式包含但不限于使用脂质体调配物、静脉内输注、经皮贴剂等。在实施例中,施用不包含施用除了所叙述的活性剂之外的任何活性剂。
[0082]
如本文所使用的“细胞”是指执行足以保持或复制其基因组dna的代谢功能或其它功能的细胞。细胞可以通过本领域熟知的方法来鉴定,包含例如完整膜的存在、通过特定染料染色、产生子代的能力或在配子的情况下与第二配子组合以产生活的后代的能力。细胞可以包含原核细胞和真核细胞。原核细胞包含但不限于细菌。真核细胞包含但不限于酵母细胞和源自植物和动物的细胞,例如哺乳动物细胞、昆虫(例如,夜蛾)细胞和人细胞。细胞在其为天然地非粘附性的或已经例如通过胰蛋白酶消化进行处理以不粘附于表面时,可能是有用的。
[0083]“干细胞”是特征在于通过有丝分裂的自我更新的能力和分化成组织或器官的潜
力的细胞。在哺乳动物干细胞之中,可以区分胚胎干细胞(es细胞)和体干细胞(例如,hsc)。胚胎干细胞存留在胚泡中并产生胚胎组织,而体干细胞存留在成体组织中以用于组织再生和修复的目的。
[0084]
在实施例中,hsc可以用于治疗疾病,包含但不限于:再生障碍性贫血、范科尼氏贫血(fanconi anemia)、戴
‑
布二氏综合征(diamond
‑
blackfan syndrome)、镰状细胞疾病、地中海贫血、阵发性睡眠性血红蛋白尿症、薛迪克
‑
东氏综合征(chediak
‑
higashi syndrome)、慢性肉芽肿性疾病、血小板无力症(glanzmann thrombasthenia)、骨硬化病、溶酶体贮积症、高雪氏病(gaucher disease)、尼曼
‑
匹克症(niemann
‑
pick)、黏多糖病、糖蛋白酶(glycoproteinoses)、免疫缺陷、共济失调毛细血管扩张症、迪格奥尔格氏综合症(digeorge syndrome)、严重联合免疫缺陷(scid)、维斯科特
‑
奥尔德里奇综合症(wiscott
‑
aldrich)、科斯特曼氏综合征(kostmann syndrome)、舒
‑
戴二氏综合征(shwachman
–
diamond syndrome)、白血病、急性骨髓性白血病、急性成淋巴细胞性白血病、毛细胞白血病、慢性淋巴细胞白血病、骨髓发育不良、淋巴瘤、霍奇金氏病、非霍奇金氏淋巴瘤、多发性骨髓瘤、骨髓增生性肿瘤(myeloproliferative neoplasms)、骨髓纤维化、真性红细胞增多、骨髓纤维化、慢性骨髓性白血病、实体瘤、成神经细胞瘤、促结缔织增生性小圆细胞瘤、尤文氏肉瘤和绒毛膜癌。
[0085]
本文所使用的术语“无血清”是指不含或基本上不含血清的培养基。本文所使用的“基本上不含血清”是指含有少于约1重量%的血清,仅含有痕量的血清或含有不可检测量的血清的培养基。
[0086]
本文所使用的术语“化学限定的培养基”是指适用于细胞,特别是真核细胞的体外培养的培养基,其中所有化学组分及其浓度都是已知的。
[0087]
短语“无蛋白质”培养基是指不含有蛋白质(例如,无血清蛋白(如血清白蛋白或贴附因子)、营养蛋白(如生长因子)或金属离子载体蛋白(如转铁蛋白、血浆铜蓝蛋白等))的培养基。优选地,如果存在肽,则肽是较小的肽,例如二肽或三肽。优选地,十肽长度或更大的肽少于无蛋白培养基中存在的氨基酸的约1%,更优选地少于约0.1%并且甚至更优选地少于约0.01%。
[0088]
本文所使用的术语“动物衍生的”材料是指全部或部分源自动物来源的材料,包含重组动物dna或重组动物蛋白dna。
[0089]“细胞培养”或“培养”意指在人工体外环境中维持细胞。
[0090]“培养”意指在有利于生长和/或分化和/或持续活力的条件下体外维持细胞。“培养”可以与“细胞培养”互换使用。通过活细胞数/毫升培养基评估培养。
[0091]“扩增”意指培养中细胞的生长,以在培养之后将细胞的数量从初始细胞数增加到更大细胞数。细胞数可以包含但不限于总细胞、总活细胞、总有核细胞或其任何组合。
[0092]
本文所使用的术语“装满、替换或补充培养基”是指向已经存在于培养物中的培养基中添加一定体积的新鲜细胞培养基,和/或用新鲜培养基替换已经存在于培养物中的培养基,和/或用新的培养基补充已经存在于培养物中的培养基。新鲜培养基是不含有要引入到至少一种细胞中的一种或多种大分子或化合物的培养基或尚未与细胞接触以支持其在培养中生长的培养基。技术人员可以通过本领域已知的技术通过监测细胞生长和/或活力来确定去除和/或装满、替换或补充培养基是否存在优点或需要,如细胞计数(手动或自
动)、台盼蓝排除法、蛋白质或其它物质的产生、阿尔玛蓝测定(alamar blue assay)、一种或多种代谢产物的存在或浓度、细胞粘附、形态外观、用过的培养基分析等。可以使用监测技术中的一种监测技术或组合来确定培养基是否需要支持生长、引入至少一种大分子和/或在引入至少一种大分子之后进行培养。
[0093]“重组蛋白”是指由引入到宿主细胞中的核酸编码的蛋白质。宿主细胞表达核酸。本文所使用的“蛋白质”广义上是指聚合的氨基酸,例如肽、多肽、蛋白质、脂蛋白、糖蛋白等。
[0094]
本发明的培养基、方法、试剂盒和组合物适用于细胞的单层(贴壁)或悬浮培养、转染和培养,并且适用于在单层或悬浮培养的细胞中表达蛋白质。优选地,本发明的培养基、方法、试剂盒和组合物用于细胞的悬浮培养、转染和培养,并且用于在悬浮培养的细胞中表达蛋白质产物。
[0095]“培养器皿”意指可以提供用于培养细胞的无菌环境的任何容器,例如玻璃、塑料或金属容器。
[0096]
短语“细胞培养基”、“组织培养基”、“生长培养基”、“培养基”(在每种情况下为复数“培养基”)和“培养基调配物”是指用于培养细胞或组织的营养溶液。这些短语可以互换使用。
[0097]
术语“组合”是指成分的混合或掺和。
[0098]“抑制剂”是指当与对照相比,如化合物或已知无活性的化合物不存在时,降低活性的化合物(例如,本文所述的化合物)。
[0099]
如本文所定义的,关于蛋白质
‑
抑制剂相互作用的术语“抑制(inhibition)”“抑制(inhibit)”、“抑制(inhibiting)”等意指,相对于在不存在抑制剂的情况下蛋白质的活性或功能,负面影响(例如,降低)蛋白质的活性或功能。在实施例中,抑制意指相对于在不存在抑制剂的情况下蛋白质的浓度或水平,负面影响(例如,降低)蛋白质的浓度或水平。在实施例中,抑制是指疾病或疾病的症状减少。在实施例中,抑制是指特定蛋白质靶标的活性降低。因此,抑制至少部分地包含部分或完全阻断刺激、降低、预防或延迟活化,或对信号转导或酶促活性或一定量的蛋白质进行失活、降敏或下调。在实施例中,抑制是指由直接相互作用(例如,抑制剂与靶蛋白结合)造成的靶蛋白的活性降低。在实施例中,抑制是指由间接相互作用引起的靶蛋白的活性降低(例如,抑制剂与活化靶蛋白的蛋白质结合,从而防止靶蛋白活化)。
[0100]
术语“抑制剂(inhibitor)”、“阻遏物(repressor)”或“拮抗剂(antagonist)”或“下调节剂(down
‑
regulator)”可互换地指能够可检测地降低给定基因或蛋白质的表达或活性的物质。与在不存在拮抗剂的情况下的对照相比,拮抗剂可以使表达或活性降低10%、20%、30%、40%、50%、60%、70%、80%、90%或更多。在某些情况下,表达或活性比在不存在拮抗剂的情况下的表达或活性低1.5倍、2倍、3倍、4倍、5倍、10倍或更低。
[0101]
ii.培养基
[0102]
用于造血干细胞(hsc)的扩增的当前体系的主要限制可以是离体培养导致细胞的扩增和分化,代价是最原始的多能性长期干细胞(cd34
+
cd90
+
cd45ra
‑
)。这可能限制离体扩增的hsc的临床应用,因为短期祖细胞仅提供瞬时保护。本文所述的培养基在培养期间将cd34
+
细胞和cd34
+
cd90
+
cd45ra
‑
细胞两者的数量增加到在其它培养基体系中未见到的水
平。
[0103]
一方面,提供了一种用于培养hsc的生长培养基,所述生长培养基包含基础培养基和补充剂,其中所述培养基和/或所述补充剂包含组蛋白乙酰转移酶(hat)抑制剂、组蛋白脱乙酰酶(hdac)抑制剂以及以下中的两种或更多种:脂质、氨基酸或氨基酸衍生物、抗氧化剂和无机盐。
[0104]
在一些方面,本公开涉及一种用于造血干细胞(hsc)生长的培养基。本公开部分地涉及用于细胞培养的培养基,所述培养基包括选自以下的无机盐:钡盐、镉盐、铜盐、镁盐、亚硒酸盐、锰盐、镍盐、钾盐、钙盐、银盐、锡盐、锆盐、钠盐或其组合;以及维生素。在一些实施例中,所述培养基是化学限定的培养基。在一些实施例中,所述培养基不包括蛋白质。在一些实施例中,所述培养基不包括血清。在一些实施例中,所述培养基不包括源自动物的成分。
[0105]
在一些实施例中,提供了一种补充剂并且与用于hsc生长的培养基一起使用。在实施例中,补充剂被提供为储备溶液,例如2x、5x、10x、20x、25x、30x、40x、50x、60x、70x、75x、80x、90x、100x储备溶液(其中“50x”表示储备溶液是50倍溶液,即在使用之前应该以1:50进行稀释)。在一些实施例中,所述补充剂是化学限定的培养基。在一些实施例中,所述补充剂不包括蛋白质。在一些实施例中,所述补充剂不包括血清。在一些实施例中,所述补充剂不包括源自动物的成分。
[0106]
在一些方面,本公开涉及一种具有基础培养基加上补充剂的试剂盒。在一些实施例中,基础培养基选自达尔伯克氏改良伊格尔培养基(dmem);dmem/f12或其改良调配物。dmem和dmem/f12的改良调配物包含但不限于具有或不具有hepes的基础培养基、具有或不具有酚红的基础培养基以及具有或不具有l
‑
谷氨酰胺或谷氨酰胺类似物的基础培养基。在实施例中,基础培养基可以选自:optmizer
tm
(赛默飞世尔科技公司(thermo fisher scientific));达尔伯克氏改良伊格尔培养基(dmem);伊斯科夫氏改良达尔伯克氏培养基(imdm);不含酚红的dmem/f12,无hepes;具有酚红的dmem/f12,无hepes;具有hepes和酚红的dmem/f12;具有hepes的dmem/f12,无hepes;具有或不具有glutamax
tm
(赛默飞世尔科技公司)的dmem/f12;高级dmem(赛默飞世尔科技公司);knockout
tm dmem/f12(赛默飞世尔科技公司);或其组合。在某些实施例中,可以独立地从本文所述的培养基和/或补充剂中排除先前提及的基础培养基中的每种基础培养基。
[0107]
在实施例中,所述试剂盒仅包含基础培养基。在实施例中,所述试剂盒仅包含补充剂。在实施例中,所述试剂盒包含基础培养基和补充剂两者。在实施例中,试剂盒包含作为储备溶液的补充剂,例如2x、5x、10x、20x、25x、30x、40x、50x、60x、70x、75x、80x、90x、100x储备溶液。当在本文中叙述了不同组分的浓度或浓度范围时,应当理解,浓度被提供为1x浓度,即当扩增hsc时待在生长培养基中使用的浓度。因此,本文叙述的组分的量在补充剂中可以高2倍到100倍,其中补充剂被提供为储备溶液。
[0108]
在一些实施例中,培养基和/或补充剂包括选自以下的有机盐或无机盐:铝盐、钡盐、镉盐、铜盐、镁盐、锰盐、镍盐、钾盐、钙盐、银盐、锡盐、锆盐、钠盐或其组合。盐包含由有机阴离子或无机阴离子制备的盐,包含但不限于:agno3、alcl3、ba(c2h3o2)2、cacl2、cdso4、cdcl2、cocl2、cr2(so4)3、cucl2、cuso4、feso4、fecl2、fecl3、fe(no3)3、geo2、na2seo3、h2seo3、kbr、kcl、ki、mgcl2、mgso4、mnc12、nacl、naf、na2sio3、navo3、na3vo4、(nh4)6mo7o
24
、na2hpo4、
nah2po4、nahco3、niso4、nicl2、ni(no3)2、rbcl、sncl2、zncl2、znso4、zrocl2、edta四钠。在某些实施例中,可以独立地从本文所述的培养基和/或补充剂中排除先前提及的盐中的每种盐。
[0109]
在实施例中,培养基和/或补充剂包括范围为约1
×
10
‑7g/l到约8.0g/l的无机盐。在实施例中,培养基和/或补充剂包括范围为约5
×
10
‑7g/l到约8.0g/l、约1.5
×
10
‑6g/l到约8.0g/l、约1.4
×
10
‑6g/l到约8.0g/l或约1.3
×
10
‑6g/l到约8.0g/l的无机盐。在实施例中,培养基和/或补充剂包括范围为约1
×
10
‑7g/l到约7.8g/l、约1
×
10
‑7g/l到约7.6g/l、约1
×
10
‑7g/l到约7.4g/l、约1
×
10
‑7g/l到约7.2g/l或约1
×
10
‑7g/l到约6.9g/l的无机盐。浓度可以是所叙述范围内的任何值或子范围,包含端点。
[0110]
在实施例中,培养基和/或补充剂包括范围为约1
×
10
‑6g/l到约5
×
10
‑3g/l的铁盐(例如,feso4、fecl2、fecl3和/或fe(no3)3)。在实施例中,培养基包括范围为约5
×
10
‑6g/l到约5
×
10
‑3g/l、约1
×
10
‑5g/l到约5
×
10
‑3g/l、约5
×
10
‑5g/l到约5
×
10
‑3g/l或约1
×
10
‑4g/l到约5
×
10
‑3g/l的铁盐(例如,feso4、fecl2、fecl3和/或fe(no3)3)。在实施例中,培养基包括范围为约5
×
10
‑6g/l到约1
×
10
‑3g/l、约5
×
10
‑5g/l到约5
×
10
‑4g/l或约5
×
10
‑5g/l到约1
×
10
‑4g/l的铁盐(例如,feso4、fecl2、fecl3和/或fe(no3)3)。在实施例中,培养基包括范围为约1
×
10
‑5g/l到约5
×
10
‑4g/l、5
×
10
‑5g/l到约1
×
10
‑3g/l、1
×
10
‑5g/l到约5
×
10
‑3g/l、5
×
10
‑4g/l到约1
×
10
‑2g/l或1
×
10
‑4g/l到约5
×
10
‑2g/l的铁盐(例如,feso4、fecl2、fecl3和/或fe(no3)3)。浓度可以是所叙述范围内的任何值或子范围,包含端点。
[0111]
在实施例中,培养基和/或补充剂包括范围为约1
×
10
‑3g/l到约10g/l的钾盐(例如,kbr、kcl和/或ki)。在实施例中,培养基包括范围为约5
×
10
‑3g/l到约10g/l、约1
×
10
‑2g/l到约10g/l、约5
×
10
‑2g/l到约10g/l或约0.1g/l到约10g/l的钾盐(例如,kbr、kcl和/或ki)。在实施例中,培养基包括范围为约5
×
10
‑3g/l到约5g/l、约5
×
10
‑3g/l到约1g/l或约5
×
10
‑3g/l到约0.5g/l的钾盐(例如,kbr、kcl和/或ki)。浓度可以是所叙述范围内的任何值或子范围,包含端点。
[0112]
在实施例中,培养基和/或补充剂包括范围为约1
×
10
‑5g/l到约5
×
10
‑2g/l的锌盐(zncl2和/或znso4)。在实施例中,培养基包括范围为约1
×
10
‑4g/l到约5
×
10
‑2g/l、约1
×
10
‑3g/l到约5
×
10
‑2g/l、约5
×
10
‑3g/l到约5
×
10
‑2g/l或约1
×
10
‑2g/l到约5
×
10
‑2g/l的锌盐(zncl2和/或znso4)。在实施例中,培养基包括范围为约5
×
10
‑5g/l到约1
×
10
‑2g/l、约5
×
10
‑5g/l到约5
×
10
‑3g/l或约5
×
10
‑5g/l到约1
×
10
‑3g/l的锌盐(zncl2和/或znso4)。在实施例中,培养基包括范围为约1
×
10
‑5g/l到约5
×
10
‑4g/l、约5
×
10
‑5g/l到约1
×
10
‑3g/l、约1
×
10
‑4g/l到约5
×
10
‑3g/l、约5
×
10
‑4g/l到约1
×
10
‑2g/l或约1
×
10
‑3g/l到约5
×
10
‑2g/l的锌盐(zncl2和/或znso4)。浓度可以是所叙述范围内的任何值或子范围,包含端点。
[0113]
在实施例中,培养基和/或补充剂包括范围为约0.001g/l到约1g/l的镁盐(例如,mgcl2和/或mgso4)。在实施例中,培养基和/或补充剂包括范围为约0.005g/l到约1g/l、约0.01g/l到约1g/l、约0.05g/l到约1g/l或约0.1g/l到约1g/l的镁盐(例如,mgcl2和/或mgso4)。在实施例中,培养基和/或补充剂包括范围为约0.001g/l到约0.5g/l、约0.01g/l到约0.1g/l或约0.01g/l到约0.05g/l的镁盐(例如,mgcl2和/或mgso4)。在实施例中,培养基和/或补充剂包括范围为约0.001g/l到约0.005g/l、约0.005g/l到约0.01g/l、约0.01g/l到约0.05g/l、约0.05g/l到约0.1g/l、约0.1g/l到约0.5g/l或约0.5g/l到约1g/l的镁盐(例如,mgcl2和/或mgso4)。浓度可以是所叙述范围内的任何值或子范围,包含端点。
[0114]
在一些实施例中,培养基和/或补充剂包括选自以下的维生素:对氨基苯甲酸、维生素b12、生物素、胆碱(例如,氯化胆碱)、生育酚(例如,乙酸生育酚)、叶酸、抗坏血酸、肌醇、烟酸、烟酰胺、泛酸、泛酸钙、吡哆醇、吡咯烷酮、核黄素、硫胺素或其组合。在某些实施例中,可以独立地从本文所述的培养基和/或补充剂中排除先前提及的维生素中的每种维生素。每种维生素可以以约1
×
10
‑6g/l到约5g/l的范围存在于培养基和/或补充剂中。在实施例中,培养基和/或补充剂包括范围为约5
×
10
‑6g/l到约5g/l、约1
×
10
‑5g/l到约5g/l、约5
×
10
‑5g/l到约5g/l、约1
×
10
‑4g/l到约5g/l、约5
×
10
‑4g/l到约5g/l、约1
×
10
‑3g/l到约5g/l、约5
×
10
‑3g/l到约5g/l、约1
×
10
‑2g/l到约5g/l、约5
×
10
‑2g/l到约5g/l、约0.1g/l到约5g/l或约1g/l到约5g/l的维生素。在实施例中,培养基和/或补充剂包括范围为约1
×
10
‑6g/l到约5
×
10
‑6g/l、约5
×
10
‑6g/l到约1
×
10
‑5g/l、约1
×
10
‑5g/l到约5
×
10
‑5g/l、约5
×
10
‑5g/l到约1
×
10
‑4g/l、约1
×
10
‑4g/l到约5
×
10
‑3g/l、约5
×
10
‑3g/l到约1
×
10
‑2g/l、约1
×
10
‑2g/l到约5
×
10
‑2g/l、约5
×
10
‑2g/l到约0.1g/l、约0.1g/l到约0.5g/l、约0.5g/l到约1g/l或约1g/l到约5g/l的维生素。浓度可以是所叙述范围内的任何值或子范围,包含端点。
[0115]
在一些实施例中,培养基和/或补充剂包括脂质,例如脂肪酸,所述脂质选自胆固醇、亚油酸、亚麻酸、油酸、棕榈酸、花生四烯酸、棕榈油酸、肉豆蔻酸和其组合。在某些实施例中,可以独立地从本文所述的培养基和/或补充剂中排除先前提及的脂质中的每种脂质。每种脂质可以以约1
×
10
‑6g/l到约1
×
10
‑3g/l的范围存在于培养基和/或补充剂中。在实施例中,培养基和/或补充剂包括范围为约5
×
10
‑6g/l到约1
×
10
‑3g/l、约1
×
10
‑5g/l到约1
×
10
‑3g/l、约5
×
10
‑5g/l到约1
×
10
‑3g/l、约1
×
10
‑4g/l到约1
×
10
‑3g/l或约5
×
10
‑4g/l到约1
×
10
‑3g/l的脂质(例如,脂肪酸)。在实施例中,培养基和/或补充剂包括范围为约1
×
10
‑6g/l到约5
×
10
‑4g/l、约1
×
10
‑6g/l到约1
×
10
‑4g/l、约1
×
10
‑6g/l到约5
×
10
‑5g/l、约1
×
10
‑6g/l到约1
×
10
‑5g/l或约1
×
10
‑6g/l到约5
×
10
‑6g/l的脂质。浓度可以是所叙述范围内的任何值或子范围,包含端点。
[0116]
在一些实施例中,培养基和/或补充剂包括选自以下的能量源:葡萄糖、蔗糖、丙酮酸(例如,丙酮酸钠)、麦芽糖、海藻糖或其组合。在某些实施例中,可以独立地从本文所述的培养基和/或补充剂中排除先前提及的能量源中的每种能量源。在实施例中,培养基和/或补充剂包括范围介于约1
×
10
‑3g/l与约10g/l之间的能量源。在实施例中,培养基和/或补充剂包括范围介于约5
×
10
‑3g/l与约10g/l之间、约1
×
10
‑2g/l与约10g/l之间、约5
×
10
‑2g/l与约10g/l之间、约0.1g/l与约10g/l之间、约0.5g/l与约10g/l之间、约1g/l与约10g/l之间或约5g/l与约10g/l之间的能量源。在实施例中,培养基和/或补充剂包括范围介于约1
×
10
‑3g/l与约5g/l之间、约1
×
10
‑3g/l与约1g/l之间、约1
×
10
‑3g/l与约0.5g/l之间、约1
×
10
‑3g/l与约0.1g/l之间、约1
×
10
‑3g/l与约5
×
10
‑2g/l之间或约1
×
10
‑3g/l与约1
×
10
‑2g/l之间的能量源。浓度可以是所叙述范围内的任何值或子范围,包含端点。
[0117]
在一些实施例中,培养基和/或补充剂包括选自以下的氨基酸:l
‑
丙氨酸、l
‑
半胱氨酸、l
‑
天冬氨酸、l
‑
谷氨酸、l
‑
苯丙氨酸、甘氨酸、l
‑
组氨酸、l
‑
异亮氨酸、l
‑
赖氨酸、l
‑
亮氨酸、l
‑
甲硫氨酸、l
‑
天冬酰胺、吡咯赖氨酸、l
‑
脯氨酸、l
‑
谷氨酰胺、l
‑
精氨酸、l
‑
丝氨酸、l
‑
苏氨酸、硒代半胱氨酸、l
‑
缬氨酸、l
‑
色氨酸、l
‑
酪氨酸、胱氨酸、肉毒碱、左旋甲状腺素、羟脯氨酸、硒代甲硫氨酸、牛磺酸、瓜氨酸、鸟氨酸或其组合。在一些实施例中,氨基酸是氨基酸的稳定类似物(例如,可从赛默飞世尔科技公司获得的glutamax
tm
)。在一些实施例中,
培养基和/或补充剂包括氨基酸衍生物,例如n
‑
乙酰基
‑
l
‑
半胱氨酸。在某些实施例中,可以独立地从本文所述的培养基和/或补充剂中排除先前提及的氨基酸、类似物和/或衍生物中的每种氨基酸、类似物和/或衍生物。每种氨基酸或氨基酸衍生物可以以约1
×
10
‑4g/l到约10g/l的范围存在于培养基和/或补充剂中。在实施例中,培养基和/或补充剂包括范围为约5
×
10
‑4g/l到约10g/l、约1
×
10
‑3g/l到约10g/l、约5
×
10
‑3g/l到约10g/l、约1
×
10
‑2g/l到约10g/l、约5
×
10
‑2g/l到约10g/l、约0.1g/l到约10g/l、约1g/l到约10g/l或约5g/l到约10g/l的氨基酸或氨基酸衍生物。在实施例中,培养基和/或补充剂包括范围为约1
×
10
‑4g/l到约5g/l、约1
×
10
‑4g/l到约1g/l、约1
×
10
‑4g/l到约0.01g/l、约1
×
10
‑4g/l到约0.05g/l、约1
×
10
‑4g/l到约0.01g/l、约1
×
10
‑4g/l到约5
×
10
‑3g/l或约1
×
10
‑4g/l到约1
×
10
‑3g/l的氨基酸或氨基酸衍生物。在实施例中,培养基和/或补充剂包括范围为约1
×
10
‑4g/l到约5
×
10
‑4g/l、约5
×
10
‑4g/l到约1
×
10
‑3g/l、约1
×
10
‑3g/l到约5
×
10
‑3g/l、约5
×
10
‑3g/l到约0.01g/l、约0.01g/l到约0.05g/l、约0.05g/l到约0.1g/l、约0.1g/l到约0.5g/l、约0.5g/l到约1g/l或约1g/l到约5g/l的氨基酸或氨基酸衍生物。浓度可以是所叙述范围内的任何值或子范围,包含端点。
[0118]
在一些实施例中,培养基和/或补充剂包括血清白蛋白。在一些实施例中,所述血清白蛋白是人血清白蛋白。在一些实施例中,所述血清白蛋白是重组血清白蛋白(例如,重组人血清白蛋白)。在实施例中,培养基和/或补充剂包括范围介于约1ml/l到约900ml/l之间的血清白蛋白。在实施例中,培养基和/或补充剂包括范围介于约1ml/l到约50ml/l之间、约5ml/l到约50ml/l之间、约10ml/l到约50ml/l之间或约10ml/l到约20ml/l之间的血清白蛋白。在实施例中,培养基和/或补充剂包括范围介于约1ml/l到约25ml/l之间或约1ml/l到约20ml/l之间的血清白蛋白。浓度可以是所叙述范围内的任何值或子范围,包含端点。在某些实施例中,可以从本文所述的培养基和/或补充剂中排除血清白蛋白。
[0119]
在一些实施例中,培养基和/或补充剂包括胰岛素。在一些实施例中,所述胰岛素是人胰岛素。在一些实施例中,所述胰岛素是重组胰岛素(例如,重组人胰岛素)。在实施例中,培养基和/或补充剂包括范围介于约0.005g/l到约5g/l之间的胰岛素。在实施例中,培养基和/或补充剂包括范围介于约0.01g/l到约0.5g/l之间、约0.05g/l到约0.5g/l之间、约0.1g/l到约0.5g/l之间或约1g/l到约5g/l之间的胰岛素。在实施例中,培养基和/或补充剂包括范围介于约0.005g/l到约0.1g/l之间、约0.005g/l到约0.05g/l之间或约0.005g/l到约0.01g/l之间的胰岛素。浓度可以是所叙述范围内的任何值或子范围,包含端点。在某些实施例中,可以从本文所述的培养基和/或补充剂中排除胰岛素。
[0120]
在一些实施例中,培养基和/或补充剂包括转铁蛋白。在一些实施例中,所述转铁蛋白是人转铁蛋白。在一些实施例中,所述转铁蛋白是重组转铁蛋白(例如,重组人转铁蛋白)。在实施例中,培养基和/或补充剂包括范围介于约0.005g/l到约10g/l之间的转铁蛋白。在实施例中,培养基和/或补充剂包括范围介于约0.01g/l到约0.5g/l之间、约0.05g/l到约0.5g/l之间、约0.1g/l到约0.5g/l之间、约1g/l到约5g/l之间、约5g/l到约10g/l之间的转铁蛋白。在实施例中,培养基和/或补充剂包括范围介于约0.005g/l到约0.1g/l之间、约0.005g/l到约0.05g/l之间或约0.005g/l到约0.01g/l之间的转铁蛋白。浓度可以是所叙述范围内的任何值或子范围,包含端点。在某些实施例中,可以从本文所述的培养基和/或补充剂中排除转铁蛋白。
[0121]
在实施例中,所述抗氧化剂选自多酚、抗坏血酸盐和类胡萝卜素。在实施例中,所述多酚选自在水果、酒和茶中天然存在的那些多酚。在实施例中,所述抗坏血酸盐选自抗坏血酸盐或抗坏血酸。在实施例中,所述类胡萝卜素选自β
‑
胡萝卜素、α
‑
胡萝卜素和番茄红素。在实施例中,所述抗氧化剂选自dl硫辛酸、dl生育酚乙酸酯和抗坏血酸。
[0122]
在一些实施例中,培养基和/或补充剂包括选自以下的另外成分:乳化剂、表面活性剂、抗氧化剂、缓冲液、泊洛沙姆(poloxamer)、金属结合化合物或其组合。在一些实施例中,所述抗氧化剂选自多酚、抗坏血酸盐和类胡萝卜素。在实施例中,所述多酚选自在水果、酒和茶中天然存在的那些多酚。在实施例中,所述抗坏血酸盐选自抗坏血酸盐或抗坏血酸。在实施例中,所述类胡萝卜素选自β
‑
胡萝卜素、α
‑
胡萝卜素和番茄红素。在实施例中,所述抗氧化剂选自dl硫辛酸、dl生育酚乙酸酯和抗坏血酸。在一些实施例中,培养基和/或补充剂包括选自以下的另外成分:次黄嘌呤或其盐、胸苷、聚山梨醇酯、乙醇胺、腐胺、精胺、亚精胺、edta、2
‑
巯基乙醇、b
‑
甘油磷酸酯和氢化可的松。在某些实施例中,可以单独地从本文所述的培养基和/或补充剂中排除每种另外成分。每种另外成分可以以任何量,例如介于约5
×
10
‑6g/l与约1g/l之间的量存在于培养基和/或补充剂中。在实施例中,培养基和/或补充剂包括范围介于约1
×
10
‑5g/l与约1g/l之间、约5
×
10
‑5g/l与约1g/l之间、约1
×
10
‑4g/l与约1g/l之间、约5
×
10
‑4g/l与约1g/l之间、约1
×
10
‑3g/l与约1g/l之间、约5
×
10
‑3g/l与约1g/l之间、约1
×
10
‑2与约1g/l之间、约5
×
10
‑2与约1g/l之间、约0.1与约1g/l之间或约0.5与约1g/l之间的另外成分。在实施例中,培养基和/或补充剂包括范围介于约5
×
10
‑6g/l与约1
×
10
‑5g/l之间、约1
×
10
‑5g/l与约5
×
10
‑5g/l之间、约5
×
10
‑5g/l与约1
×
10
‑4g/l之间、约1
×
10
‑4g/l与约5
×
10
‑4g/l之间、约5
×
10
‑4g/l与约1
×
10
‑3g/l之间、约1
×
10
‑3g/l与约5
×
10
‑3g/l之间、约5
×
10
‑3g/l与约0.01g/l之间、约0.01g/l与约0.05g/l之间、约0.05g/l与约0.1g/l之间、约0.1g/l与约0.5g/l之间或约0.5g/l与约1g/l之间的另外成分。浓度可以是所叙述范围内的任何值或子范围,包含端点。
[0123]
在一些实施例中,培养基和/或补充剂包括组蛋白脱乙酰酶(hdac)抑制剂。在一些实施例中,所述hdac抑制剂选自阿匹西定、贝利司他、ci
‑
994、cra
‑
024781、姜黄素、帕比司他、丁酸钠、苯丁酸钠、辛二酰苯胺异羟肟酸、曲古霉素a、丙戊酸钠(丙戊酸;vpa)、吉诺司他、ms
‑
275、mgcd0103和斯克瑞泰。在一些实施例中,所述hdac抑制剂是丁酸钠、苯丁酸钠、曲古霉素a或丙戊酸。在某些实施例中,可以独立地从本文所述的培养基和/或补充剂中排除先前提及的hdac抑制剂中的每种hdac抑制剂。
[0124]
术语“hdac抑制剂”是指能够可检测地降低组蛋白脱乙酰酶的表达或活性的物质。与在不存在抑制剂的情况下的对照相比,抑制剂可以使表达或活性降低10%、20%、30%、40%、50%、60%、70%、80%、90%或更多。在某些情况下,表达或活性比在不存在抑制剂的情况下的表达或活性低1.5倍、2倍、3倍、4倍、5倍、10倍或更低。
[0125]
在某些实施例中,hdac抑制剂以任何量,例如介于约5
×
10
‑4g/l与约0.5g/l之间的浓度存在于培养基和/或补充剂中。在实施例中,hdac抑制剂以介于约1
×
10
‑3g/l与约10g/l之间、约5
×
10
‑3g/l与约0.1g/l之间、约0.01g/l与约0.1g/l之间、约0.05g/l与约0.1g/l之间、约0.1g/l与约0.5g/l之间、约0.5g/l与约1g/l之间、约1g/l与约5g/l之间或约5g/l与约10g/l之间的浓度存在。在实施例中,hdac抑制剂以介于约5
×
10
‑4g/l与约0.1g/l之间、约5
×
10
‑4g/l与约0.05g/l之间、约5
×
10
‑4g/l与约0.01g/l之间、约5
×
10
‑4g/l与约5
×
10
‑3g/l
之间或约5
×
10
‑4g/l与约1
×
10
‑3g/l之间的浓度存在。在实施例中,hdac抑制剂以介于约5
×
10
‑4g/l与约1
×
10
‑3g/l之间、约1
×
10
‑3g/l与约5
×
10
‑3g/l之间、约5
×
10
‑3g/l与约0.01g/l之间、约0.01g/l与约0.05g/l之间、约0.05g/l与约0.1g/l之间或约0.1g/l与约0.5g/l之间、约0.5g/l与约1g/l之间、约1g/l与约5g/l之间或约5g/l与约10g/l之间的浓度存在。浓度可以是所叙述范围内的任何值或子范围,包含端点。
[0126]
在一些实施例中,培养基和/或补充剂包括组蛋白乙酰转移酶(hat)抑制剂。在实施例中,所述hat抑制剂选自2,6
‑
双[(3
‑
溴
‑4‑
羟苯基)亚甲基]环己酮、mg149、c646、cpth2、姜黄素、a
‑
485、漆树酸、mb
‑
3和查尔酮,如藤黄酚、异藤黄酚、黄腐酚、异黄腐酚、2
‑
羟基查尔酮、4
‑
羟基查尔酮、益智酮甲和异甘草素。在某些实施例中,可以独立地从本文所述的培养基和/或补充剂中排除先前提及的hat抑制剂中的每种hat抑制剂。
[0127]
术语“hat抑制剂”是指能够可检测地降低组蛋白乙酰转移酶的表达或活性的物质。与在不存在抑制剂的情况下的对照相比,抑制剂可以使表达或活性降低10%、20%、30%、40%、50%、60%、70%、80%、90%或更多。在某些情况下,表达或活性比在不存在抑制剂的情况下的表达或活性低1.5倍、2倍、3倍、4倍、5倍、10倍或更低。
[0128]
在某些实施例中,hat抑制剂以任何量,例如介于1
×
10
‑4g/l与1g/l之间的浓度存在于培养基和/或补充剂中。在实施例中,hat抑制剂以介于约5
×
10
‑4g/l与约1g/l之间、约0.001g/l与约1g/l之间、约0.005g/l与约1g/l之间、约0.01g/l与约1g/l之间、约0.05g/l与约1g/l之间、约0.1g/l与约1g/l之间或约0.5g/l与约1g/l之间的浓度存在。在实施例中,hat抑制剂以介于约1
×
10
‑4g/l与约0.5g/l之间、约1
×
10
‑4g/l与约0.1g/l之间、约1
×
10
‑4g/l与约0.05g/l之间、约1
×
10
‑4g/l与约0.01g/l之间、约1
×
10
‑4g/l与约0.005g/l之间、约1
×
10
‑4g/l与约0.001g/l之间的浓度存在。在实施例中,hat抑制剂以介于约1
×
10
‑4g/l与约5
×
10
‑4g/l之间、约5
×
10
‑4g/l与约0.001g/l之间、约0.001g/l与约0.005g/l之间、约0.005g/l与约0.01g/l之间、约0.01g/l与约0.05g/l之间、约0.05g/l与约0.01g/l之间、约0.01g/l与约0.05g/l之间、约0.05g/l与约0.1g/l之间或约0.1g/l与约0.5g/l之间的浓度存在。浓度可以是所叙述范围内的任何值或子范围,包含端点。
[0129]
在某些实施例中,培养基包括生长因子。各种细胞类型的生长因子均是本领域熟知的。可以包含在本文所述的生长培养基中的生长因子包含但不限于白介素3(il
‑
3)、白介素6(il
‑
6)、干细胞因子(scf)、fms相关酪氨酸激酶3配体(flt3l)、血小板生成素(tpo)、粒细胞集落刺激因子和粒细胞
‑
巨噬细胞集落刺激因子。在某些实施例中,可以独立地从本文所述的培养基和/或补充剂中排除先前提及的生长因子中的每种生长因子。
[0130]
在实施例中,scf以介于约0.0005毫克每毫升(mg/ml)与约1mg/ml之间的浓度存在于培养基和/或补充剂中。在实施例中,scf以介于约0.0001mg/ml与约1mg/ml之间、介于约0.005mg/ml与约1mg/ml之间、约0.01mg/ml与约1mg/ml之间、约0.05mg/ml与约1mg/ml之间;约0.1mg/ml与约1mg/ml之间或约0.5mg/ml与约1mg/ml之间的浓度存在于培养基和/或补充剂中。在实施例中,scf以介于约0.0005mg/ml与约0.5mg/ml之间、约0.0005mg/ml与约0.1mg/ml之间、约0.0005mg/ml与约0.05mg/ml之间;约0.0005mg/ml与约0.01mg/ml之间、约0.0005mg/ml与约0.005mg/ml之间或约0.0005mg/ml与约0.001mg/ml之间的浓度存在于培养基和/或补充剂中。在实施例中,scf以介于约0.0005mg/ml与约0.005mg/ml之间、约0.005mg/ml与约0.05mg/ml之间、约0.05mg/ml与约0.5mg/ml之间;约0.5mg/ml与约1mg/ml
之间的浓度存在于培养基和/或补充剂中。
[0131]
在实施例中,flt3l以介于约0.0005mg/ml与约1mg/ml之间的浓度存在。在实施例中,flt3l以介于约0.0001mg/ml与约1mg/ml之间、介于约0.005mg/ml与约1mg/ml之间、约0.01mg/ml与约1mg/ml之间、约0.05mg/ml与约1mg/ml之间;约0.1mg/ml与约1mg/ml之间或约0.5mg/ml与约1mg/ml之间的浓度存在于培养基和/或补充剂中。在实施例中,flt3l以介于约0.0005mg/ml与约0.5mg/ml之间、约0.0005mg/ml与约0.1mg/ml之间、约0.0005mg/ml与约0.05mg/ml之间;约0.0005mg/ml与约0.01mg/ml之间、约0.0005mg/ml与约0.005mg/ml之间或约0.0005mg/ml与约0.001mg/ml之间的浓度存在于培养基和/或补充剂中。在实施例中,flt3l以介于约0.0005mg/ml与约0.005mg/ml之间、约0.005mg/ml与约0.05mg/ml之间、约0.05mg/ml与约0.5mg/ml之间;约0.5mg/ml与约1mg/ml之间的浓度存在于培养基和/或补充剂中。
[0132]
在实施例中,tpo以介于约0.0005mg/ml与约1mg/ml之间的浓度存在。在实施例中,tpo以介于约0.0001mg/ml与约1mg/ml之间、介于约0.005mg/ml与约1mg/ml之间、约0.01mg/ml与约1mg/ml之间、约0.05mg/ml与约1mg/ml之间;约0.1mg/ml与约1mg/ml之间或约0.5mg/ml与约1mg/ml之间的浓度存在于培养基和/或补充剂中。在实施例中,tpo以介于约0.0005mg/ml与约0.5mg/ml之间、约0.0005mg/ml与约0.1mg/ml之间、约0.0005mg/ml与约0.05mg/ml之间;约0.0005mg/ml与约0.01mg/ml之间、约0.0005mg/ml与约0.005mg/ml之间或约0.0005mg/ml与约0.001mg/ml之间的浓度存在于培养基和/或补充剂中。在实施例中,tpo以介于约0.0005mg/ml与约0.005mg/ml之间、约0.005mg/ml与约0.05mg/ml之间、约0.05mg/ml与约0.5mg/ml之间;约0.5mg/ml与约1mg/ml之间的浓度存在于培养基和/或补充剂中。
[0133]
在实施例中,il
‑
6以介于约0.00005mg/ml与约0.1mg/ml之间的浓度存在。在实施例中,il
‑
6以介于约0.0001mg/ml与约0.1mg/ml之间、介于约0.0005mg/ml与约0.1mg/ml之间、约0.001mg/ml与约0.1mg/ml之间、约0.005mg/ml与约0.1mg/ml之间;约0.01mg/ml与约0.1mg/ml之间或约0.5mg/ml与约0.1mg/ml之间的浓度存在于培养基和/或补充剂中。在实施例中,il
‑
6以介于约0.00005mg/ml与约0.05mg/ml之间、约0.00005mg/ml与约0.01mg/ml之间、约0.00005mg/ml与约0.005mg/ml之间;约0.00005mg/ml与约0.001mg/ml之间、约0.00005mg/ml与约0.0005mg/ml之间或约0.00005mg/ml与约0.0001mg/ml之间的浓度存在于培养基和/或补充剂中。在实施例中,il
‑
6以介于约0.00005mg/ml与约0.0005mg/ml之间、约0.0005mg/ml与约0.005mg/ml之间、约0.005mg/ml与约0.05mg/ml之间;约0.05mg/ml和约0.1mg/ml之间的浓度存在于培养基和/或补充剂中。
[0134]
在实施例中,il
‑
3以介于约0.00005mg/ml与约0.1mg/ml之间的浓度存在。在实施例中,il
‑
3以介于约0.0001mg/ml与约0.1mg/ml之间、介于约0.0005mg/ml与约0.1mg/ml之间、约0.001mg/ml与约0.1mg/ml之间、约0.005mg/ml与约0.1mg/ml之间;约0.01mg/ml与约0.1mg/ml之间或约0.5mg/ml与约0.1mg/ml之间的浓度存在于培养基和/或补充剂中。在实施例中,il
‑
3以介于约0.00005mg/ml与约0.05mg/ml之间、约0.00005mg/ml与约0.01mg/ml之间、约0.00005mg/ml与约0.005mg/ml之间;约0.00005mg/ml与约0.001mg/ml之间、约0.00005mg/ml与约0.0005mg/ml之间或约0.00005mg/ml与约0.0001mg/ml之间的浓度存在于培养基和/或补充剂中。在实施例中,il
‑
3以介于约0.00005mg/ml与约0.0005mg/ml之间、
约0.0005mg/ml与约0.005mg/ml之间、约0.005mg/ml与约0.05mg/ml之间;约0.05mg/ml和约0.1mg/ml之间的浓度存在于培养基和/或补充剂中。
[0135]
在实施例中,粒细胞集落刺激因子(g
‑
csf)以介于约0.0005mg/ml与约1mg/ml之间的浓度存在。在实施例中,g
‑
csf以介于约0.0001mg/ml与约1mg/ml之间、介于约0.005mg/ml与约1mg/ml之间、约0.01mg/ml与约1mg/ml之间、约0.05mg/ml与约1mg/ml之间;约0.1mg/ml与约1mg/ml之间或约0.5mg/ml与约1mg/ml之间的浓度存在于培养基和/或补充剂中。在实施例中,g
‑
csf以介于约0.0005mg/ml与约0.5mg/ml之间、约0.0005mg/ml与约0.1mg/ml之间、约0.0005mg/ml与约0.05mg/ml之间;约0.0005mg/ml与约0.01mg/ml之间、约0.0005mg/ml与约0.005mg/ml之间或约0.0005mg/ml与约0.001mg/ml之间的浓度存在于培养基和/或补充剂中。在实施例中,g
‑
csf以介于约0.0005mg/ml与约0.005mg/ml之间、约0.005mg/ml与约0.05mg/ml之间、约0.05mg/ml与约0.5mg/ml之间;约0.5mg/ml与约1mg/ml之间的浓度存在于培养基和/或补充剂中。
[0136]
在实施例中,粒细胞
‑
巨噬细胞集落刺激因子(gm
‑
csf)以介于约0.00005mg/ml与约0.1mg/ml之间的浓度存在。在实施例中,il
‑
6以介于约0.0001mg/ml与约0.1mg/ml之间、介于约0.0005mg/ml与约0.1mg/ml之间、约0.001mg/ml与约0.1mg/ml之间、约0.005mg/ml与约0.1mg/ml之间;约0.01mg/ml与约0.1mg/ml之间或约0.5mg/ml与约0.1mg/ml之间的浓度存在于培养基和/或补充剂中。在实施例中,gm
‑
csf以介于约0.00005mg/ml与约0.05mg/ml之间、约0.00005mg/ml与约0.01mg/ml之间、约0.00005mg/ml与约0.005mg/ml之间;约0.00005mg/ml与约0.001mg/ml之间、约0.00005mg/ml与约0.0005mg/ml之间或约0.00005mg/ml与约0.0001mg/ml之间的浓度存在于培养基和/或补充剂中。在实施例中,gm
‑
csf以介于约0.00005mg/ml与约0.0005mg/ml之间、约0.0005mg/ml与约0.005mg/ml之间、约0.005mg/ml与约0.05mg/ml之间;约0.05mg/ml和约0.1mg/ml之间的浓度存在于培养基和/或补充剂中。
[0137]
在一些实施例中,提供了一种用于培养hsc的生长培养基,所述生长培养基包含基础培养基和补充剂,其中所述培养基和/或所述补充剂包含hat抑制剂、hdac抑制剂以及以下中的两种或更多种:脂质、氨基酸或氨基酸衍生物、抗氧化剂和无机盐,其中所述hat抑制剂以介于约0.001g/l与约1g/l之间的浓度存在于所述培养基和/或所述补充剂中,并且所述hdac抑制剂以介于约0.0005g/l与约10g/l之间的浓度存在于所述培养基和/或所述补充剂中。在一些实施例中,hat抑制剂以介于约0.001g/l与约0.005g/l之间的浓度存在于培养基或补充剂中,并且hdac抑制剂以介于约0.01g/l与约0.1g/l之间的浓度存在于培养基或补充剂中。在一些实施例中,hat抑制剂以介于约0.0001g/l与约0.01g/l的浓度存在于培养基或补充剂中,并且hdac抑制剂以约0.0005g/l与约0.1g/l的浓度存在于培养基或补充剂中。在一些实施例中,hat抑制剂以介于约0.001g/l与约1g/l之间的浓度存在于培养基和/或补充剂中,并且hdac抑制剂以介于约1g/l与约5g/l之间的浓度存在于培养基和/或补充剂中。
[0138]
在一些实施例中,培养基和/或补充剂包含hat抑制剂、hdac抑制剂以及以下中的两种或更多种:脂质、氨基酸或氨基酸衍生物、抗氧化剂和无机盐,其中所述hat抑制剂选自2,6
‑
双[(3
‑
溴
‑4‑
羟苯基)亚甲基]环己酮、mg149、c646、cpth2、姜黄素、a
‑
485、漆树酸、mb
‑
3和查尔酮,如藤黄酚、异藤黄酚、黄腐酚、异黄腐酚、2
‑
羟基查尔酮、4
‑
羟基查尔酮、益智酮甲
和异甘草素,并且其中所述hdac抑制剂选自阿匹西定、贝利司他、ci
‑
994、cra
‑
024781、姜黄素、帕比司他、丁酸钠、苯丁酸钠、辛二酰苯胺异羟肟酸、曲古霉素a、丙戊酸钠(丙戊酸;vpa)、吉诺司他、ms
‑
275、mgcd0103和斯克瑞泰。在一些实施例中,培养基和/或补充剂包括查尔酮hat抑制剂和hdac抑制剂,所述hdac抑制剂选自丁酸钠、苯丁酸钠、曲古霉素a和丙戊酸钠(vpa)。在某些实施例中,培养基和/或补充剂包括hat抑制剂和hdac抑制剂,所述hat抑制剂选自藤黄酚、异藤黄酚、黄腐酚、异黄腐酚、2
‑
羟基查尔酮、4
‑
羟基查尔酮、益智酮甲和异甘草素,所述hdac抑制剂选自丁酸钠、苯丁酸钠、曲古霉素a和丙戊酸钠(vpa)。
[0139]
在一些实施例中,培养基和/或补充剂包含hat抑制剂、hdac抑制剂以及以下中的两种或更多种:脂质、氨基酸或氨基酸衍生物、抗氧化剂和无机盐,其中所述hat抑制剂选自2,6
‑
双[(3
‑
溴
‑4‑
羟苯基)亚甲基]环己酮、mg149、c646、cpth2、姜黄素、a
‑
485、漆树酸、mb
‑
3和查尔酮,如藤黄酚、异藤黄酚、黄腐酚、异黄腐酚、2
‑
羟基查尔酮、4
‑
羟基查尔酮、益智酮甲和异甘草素;其中所述hdac抑制剂选自阿匹西定、贝利司他、ci
‑
994、cra
‑
024781、姜黄素、帕比司他、丁酸钠、苯丁酸钠、辛二酰苯胺异羟肟酸、曲古霉素a、丙戊酸钠(丙戊酸;vpa)、吉诺司他、ms
‑
275、mgcd0103和斯克瑞泰;并且其中所述脂质选自胆固醇、亚油酸、亚麻酸、油酸、棕榈酸、花生四烯酸、棕榈油酸、肉豆蔻酸和其组合。在一些实施例中,培养基和/或补充剂包含hat抑制剂、hdac抑制剂以及以下中的两种或更多种:脂质、氨基酸或氨基酸衍生物、抗氧化剂和无机盐,其中所述hat抑制剂选自2,6
‑
双[(3
‑
溴
‑4‑
羟苯基)亚甲基]环己酮、mg149、c646、cpth2、姜黄素、a
‑
485、漆树酸、mb
‑
3和查尔酮,如藤黄酚、异藤黄酚、黄腐酚、异黄腐酚、2
‑
羟基查尔酮、4
‑
羟基查尔酮、益智酮甲和异甘草素;其中所述hdac抑制剂选自阿匹西定、贝利司他、ci
‑
994、cra
‑
024781、姜黄素、帕比司他、丁酸钠、苯丁酸钠、辛二酰苯胺异羟肟酸、曲古霉素a、丙戊酸钠(丙戊酸;vpa)、吉诺司他、ms
‑
275、mgcd0103和斯克瑞泰;并且其中所述抗氧化剂选自多酚、抗坏血酸盐、类胡萝卜素和其组合。在一些实施例中,培养基和/或补充剂包含hat抑制剂、hdac抑制剂以及以下中的两种或更多种:脂质、氨基酸或氨基酸衍生物、抗氧化剂和无机盐,其中所述hat抑制剂选自2,6
‑
双[(3
‑
溴
‑4‑
羟苯基)亚甲基]环己酮、mg149、c646、cpth2、姜黄素、a
‑
485、漆树酸、mb
‑
3和查尔酮,如藤黄酚、异藤黄酚、黄腐酚、异黄腐酚、2
‑
羟基查尔酮、4
‑
羟基查尔酮、益智酮甲和异甘草素;其中所述hdac抑制剂选自阿匹西定、贝利司他、ci
‑
994、cra
‑
024781、姜黄素、帕比司他、丁酸钠、苯丁酸钠、辛二酰苯胺异羟肟酸、曲古霉素a、丙戊酸钠(丙戊酸;vpa)、吉诺司他、ms
‑
275、mgcd0103和斯克瑞泰;并且其中所述无机盐选自铜盐、镁盐、亚硒酸盐、钾盐、钙盐、锌盐、铁盐、钠盐或其组合。
[0140]
在一些实施例中,培养基和/或补充剂包含hat抑制剂、hdac抑制剂以及以下中的三种或更多种:脂质、氨基酸或氨基酸衍生物、抗氧化剂和无机盐,其中所述hat抑制剂选自2,6
‑
双[(3
‑
溴
‑4‑
羟苯基)亚甲基]环己酮、mg149、c646、cpth2、姜黄素、a
‑
485、漆树酸、mb
‑
3和查尔酮,如藤黄酚、异藤黄酚、黄腐酚、异黄腐酚、2
‑
羟基查尔酮、4
‑
羟基查尔酮、益智酮甲和异甘草素;其中所述hdac抑制剂选自阿匹西定、贝利司他、ci
‑
994、cra
‑
024781、姜黄素、帕比司他、丁酸钠、苯丁酸钠、辛二酰苯胺异羟肟酸、曲古霉素a、丙戊酸钠(丙戊酸;vpa)、吉诺司他、ms
‑
275、mgcd0103和斯克瑞泰;并且其中所述脂质选自胆固醇、亚油酸、亚麻酸、油酸、棕榈酸、花生四烯酸、棕榈油酸、肉豆蔻酸和其组合。在一些实施例中,培养基和/或补充剂包含hat抑制剂、hdac抑制剂以及以下中的三种或更多种:脂质、氨基酸或氨基酸衍生物、
和查尔酮,如藤黄酚、异藤黄酚、黄腐酚、异黄腐酚、2
‑
羟基查尔酮、4
‑
羟基查尔酮、益智酮甲和异甘草素;其中所述hdac抑制剂选自阿匹西定、贝利司他、ci
‑
994、cra
‑
024781、姜黄素、帕比司他、丁酸钠、苯丁酸钠、辛二酰苯胺异羟肟酸、曲古霉素a、丙戊酸钠(丙戊酸;vpa)、吉诺司他、ms
‑
275、mgcd0103和斯克瑞泰;其中所述脂质选自胆固醇、亚油酸、亚麻酸、油酸、棕榈酸、花生四烯酸、棕榈油酸、肉豆蔻酸和其组合;其中所述抗氧化剂选自多酚、抗坏血酸盐、类胡萝卜素和其组合;并且其中所述无机盐选自铜盐、镁盐、亚硒酸盐、钾盐、钙盐、锌盐、铁盐、钠盐或其组合。
[0143]
在一些实施例中,培养基和/或补充剂包括hat抑制剂、hdac抑制剂以及以下中的两种或更多种:脂质、氨基酸或氨基酸衍生物、抗氧化剂和无机盐,其中所述hat抑制剂选自查尔酮,如藤黄酚、异藤黄酚、黄腐酚、异黄腐酚、2
‑
羟基查尔酮、4
‑
羟基查尔酮、益智酮甲和异甘草素;其中所述hdac抑制剂选自丁酸钠、苯丁酸钠、曲古霉素a和丙戊酸钠(vpa);其中所述脂质选自胆固醇、亚油酸、亚麻酸、油酸、棕榈酸、花生四烯酸、棕榈油酸、肉豆蔻酸和其组合;其中所述抗氧化剂选自dl硫辛酸、dl生育酚乙酸酯和抗坏血酸;和其组合;并且其中所述无机盐选自铜盐、镁盐、亚硒酸盐、钾盐、钙盐、锌盐、铁盐、钠盐或其组合。在一些实施例中,所述hdac抑制剂和所述hat抑制剂的重量比为1:1到1:30hdac抑制剂:hat抑制剂。
[0144]
在一些实施例中,培养基和/或补充剂包括查尔酮hat抑制剂和hdac抑制剂,所述hdac抑制剂选自丁酸钠、苯丁酸钠、曲古霉素a和丙戊酸钠(vpa)。在某些实施例中,培养基和/或补充剂包括hat抑制剂和hdac抑制剂,所述hat抑制剂选自藤黄酚、异藤黄酚、黄腐酚、异黄腐酚、2
‑
羟基查尔酮、4
‑
羟基查尔酮、益智酮甲和异甘草素,所述hdac抑制剂选自丁酸钠、苯丁酸钠、曲古霉素a和丙戊酸钠(vpa)。
[0145]
iii.方法
[0146]
一方面,本公开涉及一种扩增干细胞的方法,所述方法包含使所述干细胞在包含以下的生长培养基中生长:基础培养基、组蛋白乙酰转移酶(hat)抑制剂、组蛋白脱乙酰酶(hdac)抑制剂以及以下中的两种或更多种:脂质、氨基酸或氨基酸衍生物、抗氧化剂和无机盐。
[0147]
一方面,本公开涉及一种扩增干细胞的方法,所述方法包含(i)向基础培养基中添加包含组蛋白乙酰转移酶(hat)抑制剂和组蛋白脱乙酰酶(hdac)抑制剂的补充剂以形成生长培养基,以及(ii)使所述干细胞在所述生长培养基中生长,由此扩增所述干细胞。
[0148]
一方面,本公开涉及一种扩增来自受试者的原代细胞的方法,所述方法包含使所述原代细胞在包含以下的生长培养基中生长:基础培养基、组蛋白乙酰转移酶(hat)抑制剂和组蛋白脱乙酰酶(hdac)抑制剂以及以下中的两种或更多种:脂质、氨基酸或氨基酸衍生物、抗氧化剂和无机盐。
[0149]
一方面,本公开涉及一种治疗需要疗法的受试者的方法,所述方法包含:(a)获得造血干细胞(hsc);(b)在包含以下的生长培养基中扩增所述hsc:基础培养基、组蛋白乙酰转移酶(hat)抑制剂和组蛋白脱乙酰酶(hdac)抑制剂以及以下中的至少两种:脂质、氨基酸或氨基酸衍生物、抗氧化剂和无机盐;以及(c)将所述hsc转移到所述受试者,由此治疗所述受试者。
[0150]
根据本公开的任何方面在体外扩增的造血干细胞(hsc)可以用作药物。例如,在包括以下的生长培养基扩增的hsc可以用作用于治疗受试者的药物:基础培养基、组蛋白乙酰
转移酶(hat)抑制剂和组蛋白脱乙酰酶(hdac)抑制剂以及以下中的至少两种:脂质、氨基酸或氨基酸衍生物、抗氧化剂和无机盐。hsc可以源自待治疗的同一受试者和/或可以在将hsc转移到受试者之前对其进行基因修饰。扩增的hsc可以用于治疗造血系统恶性肿瘤、癌症、自身免疫性疾病或基于血液的疾病和/或在受试者已经经历化疗之后。受试者可以是人。
[0151]
一方面,本公开涉及一种用于编辑干细胞(sc)的基因组的方法,所述方法包含:(a)获得使用本文所提供的扩增方法扩增的sc(例如,根据权利要求47到80中任一项所述的方法);以及(b)编辑所述干细胞的所述基因组。在实施例中,所述基因组是使用选自以下的一种或多种基因组编辑试剂来编辑的:锌指核酸酶(zfn)、转录激活因子样效应物核酸酶(talen)、大范围核酸酶和常间回文重复序列丛集(crispr)相关蛋白,以及(c)任选地在如本文所述的hsc扩增培养基中扩增经过编辑的细胞持续一段时间(例如,1天、2天、3天、4天、5天、6天、1周、2周或更长,或之间的任何时间量)。
[0152]
一方面,本公开涉及一种用于改善造血干细胞(hsc)群的植活潜力的方法,所述方法包含:(a)获得hsc群;以及(b)使用如本文所述的培养基扩增所述hsc群,由此改善所述hsc群的植活潜力。
[0153]
一方面,本公开涉及一种治疗需要疗法的受试者的方法,所述方法包含:(a)获得使用如本文所述的培养基扩增的造血干细胞(hsc);以及(b)将所述hsc转移到所述受试者,由此治疗所述受试者。
[0154]
一方面,本公开涉及一种将细胞(例如,cd34+细胞、pbmc)重编程为ipsc的方法,所述方法包含:(a)获得待重编程为ipsc细胞的细胞;(b)在如本文所述的hsc扩增培养基中扩增所述细胞;(c)将yamanaka因子引入到所述细胞中(参见例如,takahashi等人(2007),《细胞(cell)》131:861
‑
872);(d)将来自(c)的所述细胞在hsc扩增培养基中的基质上培养持续第一时间段;以及(e)用ipsc培养基替换所述hsc扩增培养基,由此重编程所述细胞。在一些实施例中,(e)包含将细胞从hsc扩增培养基转移到ipsc培养基。在一些实施例中,立刻用ipsc培养基完全替换hsc扩增培养基。在一些实施例中,以逐步的方式用ipsc培养基替换hsc扩增培养基,直到替换所有的hsc扩增培养基。在一些实施例中,使用cytotune
tm ips重编程试剂盒(赛默飞世尔科技公司),如cytotune
tm
‑
ips 2.0仙台重编程试剂盒或cts
tm cytotune
tm
‑
ips 2.1仙台重编程试剂盒,将重编程因子引入经过扩增的cd34+细胞。
[0155]
iv.试剂盒
[0156]
一方面,本公开涉及一种试剂盒,所述试剂盒包含基础培养基和补充剂,所述培养基和/或所述补充剂包含组蛋白乙酰转移酶(hat)抑制剂、组蛋白脱乙酰酶(hdac)抑制剂以及以下中的两种或更多种:脂质、氨基酸或氨基酸衍生物、抗氧化剂和无机盐。在一些实施例中,培养基和/或补充剂包含hat抑制剂、hdac抑制剂、脂质、氨基酸或氨基酸衍生物、抗氧化剂和无机盐。
[0157]
应当理解,本文所描述的实例和实施例仅是出于说明性目的,并且根据其进行的各种修改或改变将启发本领域的技术人员并且将被包含在本申请的精神与权限范围内和所附权利要求书的范围内。本文引用的所有出版物、专利和专利申请出于所有目的特此通过引用整体并入。
[0158]
实例
[0159]
实例1:造血干细胞和造血祖细胞扩增系统
[0160]
描述了一种有效地离体扩增长期和短期人hsc两者的培养基体系。还可以扩增来自不同组织来源,如脐带血、外周血(例如,mpb)和骨髓的人hsc。用这种培养基衍生或扩增的hsc可以用于任何合适的用途,包含例如生物化学、转录组学、表观遗传学和移植研究。
[0161]
使用补充剂与如本文所述的并且在本文中被称为“hsc培养基”的基础培养基的组合来扩增hsc导致在经过扩增的细胞群中更高比例的cd34
+
cd90
+
cd45ra
‑
细胞。cd34
+
cd90
+
cd45ra
‑
细胞群在hsc移植的背景中是相关的,因为据信这个群体在建立长期植活中更加重要。此外,向竞争物培养基中添加hat抑制剂和hdac抑制剂未导致cd34
+
cd90
+
cd45ra
‑
亚群的对应增加—这表明作用不仅仅是由于vpa/藤黄酚的存在,而是更一般地由于补充剂的存在。
[0162]
因为这种培养基扩增短期和长期hsc两者,因此移植有这些经过扩增的细胞的患者将不仅在恢复早期阶段期间具有免疫保护(由短期cd34
+
hsc驱动),而且长期细胞(cd34
+
cd90
+
cd45ra
‑
)将为输血非依赖性造血提供合适的溶液。最终,这预期会增加积极的健康结果,从而减少住院治疗的持续时间和每位患者的健康护理费用。可以被靶向的疾病的主要类型可以包含:癌症、自身免疫性病症和血液病症。
[0163]
这种培养基体系的其它潜在用途可以包含:基因疗法(例如,crispr
‑
cas9)、ipsc重编程(例如,hsc重编程为ipsc、pbmc重编程为ipsc等)、转导、分化(ipsc分化为hsc、hsc分化为免疫细胞类型、hsc分化为红细胞、hsc分化为巨核细胞)、反式分化(hsc反式分化为心肌细胞)、用于药物发现的小分子筛选和疾病建模。
[0164]
在以下实例中所使用的基础培养基被制造为1x调配物并且在4℃下储存,而补充剂是在
‑
20℃下储存的50x调配物。对于细胞扩增/培养,向基础培养基中添加解冻的补充剂,并且向完全培养基中添加特异性生长因子以促进hsc扩增。如下所示,将来自脐带血、骨髓或动员外周血的cd34
+
细胞在这种培养基体系的存在下在37℃温育箱中培养长达14天。在第7天(或所指示时间点),对细胞进行计数并且通过流式细胞术评估表型。基础培养基加上补充剂(在1x下)和生长因子(scf、flt3l、tpo、il
‑
6和il
‑
3)使得能够扩增hsc。参见例如,图1。
[0165]
体外扩增。将来自人动员外周血(mpb,allcells)的三个供体的富集cd34
+
细胞在以下无血清培养基中进行培养:hsc培养基(如本文提供的)和可商购获得的干细胞生长培养基(scgm,cellgenix gmbh)、无stemspan
tm
动物组分(acf,干细胞技术公司(stemcell technologies))和stempro
tm 34(赛默飞世尔科技公司)。所有培养基均补充有100ng/ml的scf、100ng/ml的flt
‑
3l、100ng/ml的tpo、50ng/ml的il
‑
3和20ng/ml的il
‑
6(全部由赛默飞世尔科技公司提供)。通过在加湿的37℃、5%co2温育箱中在48孔板中培养5
×
103个cd34
+
细胞/毫升持续7天来启动hsc扩增。在第7天,使用countess ii细胞计数器(赛默飞世尔科技公司)评估总有核细胞(tnc)数量和活力%,并且通过流式细胞术进行细胞表型。
[0166]
流式细胞术分析。将tnc在磷酸盐缓冲盐水(pbs)中洗涤,并且在室温下与在pbs中的可固定黄色染色剂温育20分钟。将细胞在流式细胞术染色缓冲液中洗涤,并且与抗人细胞表面抗原的单克隆抗体的混合物(cocktail):cd34 pe
‑
cy7、cd90 apc、cd45ra太平洋蓝在4℃下温育30分钟。将细胞在attune nxt流式细胞仪(赛默飞世尔科技公司)和软件(7.6.5版,贝迪公司(becton dickinson))上进行分析。
[0167]
醛脱氢酶(aldh)表达。根据制造商的说明书(干细胞技术公司),将扩增7天的细胞
(如上文所述)与或与deab和在37℃下温育45分钟。然后将细胞与如上文所述的抗体一起温育,洗涤,并且如上文所述通过流式细胞术评估经过扩增的细胞的aldh表达。使用deab对照来确定aldh表达的门控。
[0168]
实例2:藤黄酚和vpa协同地增加了hsc培养基调配物中hsc扩增的量级
[0169]
小分子对培养基性能的影响。为了评估丙戊酸(vpa)和藤黄酚对竞争物培养基的贡献,将小分子以组合或单独的方式在hsc培养基中存在的最终浓度下添加到scgm和stemspan
tm acf中。为了解决当从调配物中排除小分子时hsc培养基的性能是否存在降低的问题,在制造期间去除vpa或藤黄酚。将来自三个供体的cd34
+
mpb细胞如上述(实例1)在培养基
±
vpa或藤黄酚中进行培养,并且与hsc培养基、stemspan
tm acf、scgm或具有stemspan
tm cd34
+
扩增补充剂(10x)的stemspan
tm acf进行比较。在第7天,如上文所述,评估细胞的tnc、活力%、cd34
+
、cd34
+
cd90
+
cd45ra
‑
细胞。为了汇集来自三个供体的数据点(cd34
+
扩增,tnc扩增),将所有条件相对于scgm培养基归一化,并计算标准误差。对于在三个供体中的cd34
+
的%和cd34
+
cd90
+
cd45ra
‑
的%数据点的汇集,对所述值进行求取平均值并且计算标准误差。
[0170]
表1.实验概述。关键词:(+)是基线,(++)或更大的改善,(*)表示没有数据(当向acf中添加藤黄酚时细胞死亡)。
[0171][0172]
与竞争物培养基相比,藤黄酚和vpa组合对hsc培养基中的cd34
+
和cd34
+
cd90
+
hsc扩增具有更大影响。向竞争物培养基中仅添加vpa改善了hsc在那些培养基中的扩增。在acf中,仅添加vpa增强了hsc培养基(具有藤黄酚和vpa)水平的性能。在hsc培养基中,藤黄酚和
vpa组合用于改善性能。参见图3。
[0173]
向竞争物培养基中仅添加vpa提高了hsc培养基中的cd34
+
cd90
+
cd45ra
‑
的%,藤黄酚和vpa组合提高了cd34
+
cd90
+
cd45ra
‑
的%,使其大于竞争物培养基。参见图4到6b。
[0174]
结论。藤黄酚和vpa在添加到竞争物培养基中时不会组合起作用。在acf中,添加vpa增强了hsc培养基水平的性能。在hsc培养基中,藤黄酚和vpa组合提高了跨tnc、cd34
+
、cd34
+
cd90
+
群的性能。
[0175]
实例3:hsc培养基
[0176]
在此实例中所使用的hsc培养基是特异性调配成支持造血干细胞(hsc)的扩增的无外源物质培养基、无血清培养基。靶向扩增的表型是总cd34
+
细胞群,重点在于cd34
+
cd90
+
cd45ra
‑
细胞亚群的富集。
[0177]
优良的扩增和富集。cd34
+
细胞和cd34
+
cd90
+
cd45ra
‑
亚群以低比例发现于动员外周血、骨髓以及脐带血中。其对于适当的造血和免疫功能是重要的,并且出于多种原因对其进行研究,包含移植生物学、干细胞生物学和造血发育。hsc培养基使得不仅总cd34
+
区室能够优良扩增,而且富集cd34
+
cd90
+
cd45ra
‑
干细胞,从而为研究人员提供更多细胞以供使用(参见图7
‑
9)。
[0178]
功能的维护。经过扩增的hsc的功能至关重要。一种常用于hsc的功能性测试的体外测定是集落形成单位(cfu)或集落形成细胞(cfc)测定。cfu测定用于通过hsc在接种于半固体培养基中时形成集落的能力来评估其增殖和分化潜力。hsc培养基维持对粒细胞、单核细胞、红细胞(erythroid)和巨核细胞谱系的体外分化能力(参见图10)。
[0179]
总有核细胞计数和活力%。通过利用countess ii,列举了总有核细胞(tnc)和扩增后细胞的活力%。tnc表示培养物中的所有不同类型的细胞(hsc和分化细胞两者)。活力%是重要的,因为一些培养基条件可能不利地影响细胞的存活。
[0180]
集落形成细胞(cfc)测定。经过扩增的hsc必须维持其分化成各种血细胞谱系的能力。在体内,这一点通过将hsc植活到免疫缺陷小鼠中来评估。由于这些实验通常需要花费数月才能完成,用于确定分化潜力的替代测定是集落形成细胞(cfc)测定。在此测定中,将细胞接种到半固体methocult
tm
培养基中,所述培养基含有生长因子,如促红细胞生成素、gm
‑
csf、g
‑
csf、il
‑
3、il
‑
6、scf,所述生长因子支持祖细胞,如红细胞、粒细胞和巨噬细胞祖细胞的生长。14天的培养期之后,观察不同的集落。
[0181]
表型性能数据的竞争性比较。在hsc培养基中来自人动员外周血(mpb)的hsc的扩增提供了cd34
+
细胞的大约100倍的增加。cd34
+
mpb在hsc培养基中的扩增导致显著更高水平的cd34
+
细胞(图7a)扩增和tnc(图7b)扩增,其中细胞显示出>80%的活力(图7c)。经过扩增的细胞是>60%cd34
+
(图7d),其中cd34
+
cd90
+
cd45ra
‑
长期hsc的水平显著更高(图7e)。所示出的cd34+和cd34
+
cd90
+
cd45ra
‑
的百分比来自总活tnc群。将三个人单供体纯化的cd34
+
mpb在hsc培养基(hsc基础培养基和50x补充剂)或三种商业培养基中进行培养,所有培养基均补充有生长因子(scf、flt3l、tpo、il
‑
3和il
‑
6)。将细胞培养7天,随后使用countess ii确定总有核细胞(tnc)和活力%,并且如下文和图9中所述通过流式细胞术评估表型。误差条表示标准偏差。
[0182]
批次间的表型性能数据。hsc培养基表现出一致的批次间性能。在三个不同批次的hsc培养基中扩增的cd34
+
mpb表现出等同水平的cd34
+
细胞扩增(图8a)、tnc扩增(图8b)、活
力%(图8c)、cd34
+
的%(图8d)和cd34
+
cd90
+
cd45ra
‑
长期hsc的%(图8e)。将三个人单供体纯化的cd34
+
mpb在三个不同批次的hsc培养基(hsc基础培养基和50x补充剂)中进行培养,所有培养基补充有生长因子。将细胞培养7天,随后使用countess ii确定总有核细胞(tnc)和活力%,并且如图9所述评估表型。误差条表示标准偏差。
[0183]
表型分析门控策略:在hsc培养基中培养的经过扩增的hsc的表型表征。将来自mpb的纯化的cd34
+
在含有生长因子的hsc培养基中进行培养。将细胞培养7天,然后通过流式细胞术评估cd34、cd90和cd45ra的表达。从分析中排除双联体和死细胞,并且基于荧光减一(fmo)对照来划分鉴定cd34
+
细胞和cd90
+
cd45ra
‑
细胞的门。
[0184]
cfu测定数据。在hsc培养基中扩增的cd34
+
细胞维持体外分化能力。在14天的培养期期间,在hsc培养基中扩增的cd34
+
mpb能够分化成粒细胞/红细胞/单核细胞/巨核细胞(gemm)、红细胞(e)以及粒细胞/单核细胞(gm)集落形成细胞。将两个人单供体纯化的cd34
+
mpb在补充有生长因子的hsc培养基中培养7天。随后,将经过扩增的tnc在半固体培养基中培养另外14天,以评估集落形成细胞(cfc)。图像示出了所鉴定的集落的实例。
[0185]
hsc培养基扩增单供体人cd34
+
mpb细胞。在hsc培养基中扩增的所有三种人单供体cd34
+
mpb表现出等同水平的cd34
+
细胞扩增(图11a)、tnc扩增(图11b)、活力%(图11c)、cd34+的%(图11d)。值得注意的是,cd34
+
cd90
+
cd45ra
‑
长期hsc的扩增水平(图11e)因供体而异。将三个人单供体纯化的cd34
+
mpb在补充有生长因子的hsc培养基中进行培养。将细胞培养7天,随后使用countess ii确定总有核细胞(tnc)和活力%,并且如图9所述评估表型。误差条表示样品重复内的标准偏差。
[0186]
在hsc培养基中扩增的cd34
+
细胞表达最高的aldh水平。评估在hsc培养基中扩增的cd34
+
mpb的醛脱氢酶(aldh)的表达。与(图12b)aldefluor
tm
阳性细胞群相比,使用门控鉴定了在没有aldh表达的(图12a)对照deab中温育的细胞。cd34
+
在hsc培养基中的扩增证明(图12c)在每个细胞的基础上的最高aldh表达(几何平均荧光强度)以及(图12d)cd34
+
细胞染色对aldh呈阳性的最高%。在hsc培养基批次之间观察到经过扩增的细胞的aldh表达的一致性。将三个人单供体纯化的cd34
+
mpb在三个批次的hsc培养基或三个商业培养基中进行培养,所有培养基均补充有生长因子。将细胞培养7天,然后根据制造商的说明书,将总有核细胞(tnc)在deab或aldefluor
tm
中进行温育。将细胞用抗体染色以鉴定cd34
+
细胞,并且分析aldh表达。从三个单供体mpb细胞中汇集所显示的数据。误差条表示标准误差。
[0187]
实例4:在hsc扩增培养基中扩增的hsc的基因工程化
[0188]
在hsc培养基中扩增的cd34+细胞能够使用crispr/cas9进行基因工程化。将来自单供体的动员外周血(mpb)的1
×
106个纯化的cd34+细胞单独地培养于本文所述的hsc培养基中,所述培养基补充有100ng/ml的scf、100ng/ml的flt
‑
3l、100ng/ml的tpo、50ng/ml的il
‑
3和20ng/ml的il
‑
6(全部由赛默飞世尔科技公司提供)。将细胞在37℃温育箱、5%co2中培养2天。在第2天,根据制造商的说明书,使用neon
tm
细胞转染装置(赛默飞世尔科技公司)转染来自每个供体的5
×
104个细胞。具体地,将细胞用1.2μg truecut
tm cas9蛋白v2(赛默飞世尔科技公司)、300ng引导rna和100ng/ml、200ng/ml或500ng/ml1.4kb gfp供体dna进行转染。转染后,将细胞在具有scf、flt3l、tpo、il
‑
3和il
‑
6的stempro
tm hsc扩增培养基中培养3天。在转染后72小时,通过attune
tm nxt声聚焦细胞仪(赛默飞世尔科技公司)测量gfp供体dna的插入效率。使用未经过转染的细胞设置门,确定gfp+细胞的百分比。为了测量hsc的
8
tm
培养基饲喂细胞。转导十六天后,通过使用载体红色碱性磷酸酶底物试剂盒对细胞进行碱性磷酸酶染色来确定重编程效率。对ap阳性集落的数量进行计数,并且相对于在转导后第3天铺板的细胞的数量确定重编程效率。示出了三个供体的平均效率(图15)。
[0194]
实例7:在hsc扩增培养基中扩增的cd34+细胞的植活。
[0195]
获得人cd34+细胞并且在本文所述的hsc扩增培养基中扩增7天。将各个浓度的经过扩增的细胞、未经过扩增的细胞(对照)移植到被致命地照射的免疫缺陷小鼠中。在不同的时间点(2个月、6个月),使小鼠安乐死并且收获其骨髓细胞和脾脏细胞。将骨髓和脾脏细胞用抗人cd34、cd33、cd45、谱系、cd3和cd19细胞表面标志物的抗体染色,并且使用流式细胞仪进行分析。与移植有未经过扩增的细胞的小鼠相比,移植有在如本文所述的hsc扩增培养基中扩增的cd34+细胞的小鼠具有增加数量的移植细胞,这证明了植活能力增强。在2个月(短期植活)和6个月(长期植活)均观察到植活。
[0196]
为了证明移植细胞具有自我更新的能力,将如上所述在6个月时安乐死的小鼠的骨髓细胞移植到被致死地照射的免疫缺陷小鼠中(继发性移植)。在两个月时,使小鼠安乐死并且收获其骨髓细胞和脾脏细胞。将骨髓和脾脏细胞用抗人cd34、cd33、cd45、谱系、cd3和cd19细胞表面标志物的抗体染色,并且使用流式细胞仪进行分析。观察到在骨髓和脾脏中存在移植细胞,这指示经过扩增的细胞的自我更新能力。
[0197]
实例8:另外的hdac抑制剂和hat抑制剂
[0198]
评估了另外的hdac抑制剂和/或hat抑制剂增加hsc扩增的能力。单独或组合地测试一种或多种hdac抑制剂和/或hat抑制剂。预期另外的hdac抑制剂和hat抑制剂将对hsc的扩增具有类似的作用。
[0199]
实例9:hsc培养基对原代细胞扩增的影响
[0200]
评估hsc培养基促进源自人供体的原代细胞的扩增的能力。不同类型的原代细胞(例如,巨噬细胞、t细胞)在如本文所述的hsc培养基中扩增。预期hsc培养基将增加一些另外的原代细胞类型(例如t,细胞)的扩增。
[0201]
实例10:具有在hsc培养基中扩增的hsc的患者的治疗
[0202]
确定如本文所述扩增的hsc治疗患有可通过hsc治疗的疾病的患者的能力。hsc源自对于待治疗的患者是异基因的hsc来源。hsc在hsc培养基中离体扩增。以有效促进细胞的植活和病状的治疗的量向患者施用经过扩增的hsc。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1