治疗高尿酸相关性疾病的药物的制作方法
本发明涉及生物医药领域,具体地,本发明涉及药物、药物组合物及药物用途。
背景技术:
随着人们生活质量的提高以及饮食和生活习惯的改变,高蛋白和高嘌呤食物摄取增加,痛风患者的数量呈逐年增加的趋势。在欧洲,痛风患者的数量在过去的20年中增长了约一倍。我国目前的高尿酸血症及痛风发病率提升至约2~3%。如果高尿酸血症没有出现临床症状,控制饮食即可;当出现了由其引起的临床症状时,则需要进行药物治疗。
因此,仍需要科研工作者进一步开发治疗痛风的药物。
技术实现要素:
本发明旨在至少在一定程度上解决相关技术中的技术问题之一。为此,本发明提出了一种具有能够治疗顽固性痛风的尿酸氧化酶药物。
在本发明的第一方面,本发明提出了一种药物。根据本发明的实施例,所述药物包括尿酸氧化酶,所述尿酸氧化酶中的下列氨基酸位点的至少7个连接有peg基团,k4、k17、k30、k35、k97、k112、k116、k152、k179、k190、k222、k266、k272、k285、k291、k298。
根据本发明实施例的尿酸氧化酶相比于没有peg修饰的尿酸氧化酶,免疫原性大幅降低,包含该尿酸氧化酶的药物可实现高尿酸相关性疾病的治疗。
根据本发明的实施例,上述药物还可以进一步包括如下附加技术特征至少之一:
根据本发明的实施例,所述尿酸氧化酶中的下列氨基酸位点的至少9个连接有peg基团,k4、k17、k30、k35、k97、k112、k116、k152、k179、k190、k222、k266、k272、k285、k291、k298。
根据本发明的实施例,所述尿酸氧化酶中的下列氨基酸位点的至少一个、至少两个、至少三个、至少四个、至少五个、至少六个、至少七个、至少八个、至少九个连接有peg基团,k4、k17、k97、k179、k190、k222、k266、k272、k285。
根据本发明的实施例,所述peg基团的分子量为9~11kd。
根据本发明的实施例,所述尿酸氧化酶具有seqidno:1所示的氨基酸序列。
tykkndevefvrtgygkdmikvlhiqrdgkyhsikevattvqltlsskkdylhgdnsdviptdtikntvnvlakfkgiksietfavticehflssfkhviraqvyveevpwkrfekngvkhvhafiytptgthfceveqirngppvihsgikdlkvlkttqsgfegfikdqfttlpevkdrcfatqvyckwryhqgrdvdfeatwdtvrsivlqkfagpydkgeyspsvqktlydiqvltlgqvpeiedmeislpnihylnidmskmglinkeevllpldnpygkitgtvkrklssrl(seqidno:1)。
根据本发明的实施例,所述尿酸氧化酶的肽图与未连接peg的尿酸氧化酶的肽图相比,具有至少7个预定肽段的峰面积减少的相对比例不低于75%,优选不低于80%,更优选不低于90%。根据本发明的实施例的尿酸氧化酶相比于未连接peg的尿酸氧化酶,免疫原性低,可实现高尿酸相关性疾病的有效治疗。
根据本发明的实施例,所述尿酸氧化酶的肽图与未连接peg的尿酸氧化酶的肽图相比,具有至少9个预定肽段的峰面积减少的相对比例不低于75%,优选不低于80%,更优选不低于90%。
根据本发明的实施例,所述尿酸氧化酶的肽图如图4所示。
在本发明的第二方面,本发明提出了一种药物组合物。根据本发明的实施例,所述药物组合物包括前面所述的药物或前面所述的尿酸氧化酶。根据本发明实施例的药物组合物可用于高尿酸相关性疾病的治疗或预防。
根据本发明的实施例,所述药物组合物进一步包括如下附加技术特征至少之一:
根据本发明的实施例,所述药物组合物进一步包括其它治疗或预防高尿酸相关性疾病的药物。
在本发明的第三方面,本发明提出了前面所述的药物或前面所述的尿酸氧化酶或前面所述的药物组合物在制备药物中的用途,所述药物用于治疗高尿酸相关性疾病。
根据本发明的实施例,上述用途还可以进一步包括如下附加技术特征至少之一:
根据本发明的实施例,所述高尿酸相关性疾病包括选自慢性高尿酸血症、痛风、肾脏疾病、高尿酸性关节炎、肾结石、痛风结节、高血压、糖尿病、高甘油三酯血症、代谢综合征、冠心病、动脉粥样硬化、癌症化疗引起的高尿酸血症。
附图说明
图1是根据本发明实施例的phcsds-page纯度检测图;
图2是根据本发明实施例的phcrp-hplc纯度检测图;
图3是根据本发明实施例的phc的lys-c酶切图;
图4是根据本发明实施例的phalys-c酶切图;
图5是根据本发明实施例的phc和pha的lys-c酶切比对图;
图6是根据本发明实施例的大鼠单次给药后血清中尿酸(μmol/l)和尿囊素(μmol/l)水平变化水平结果图。
具体实施方式
下面详细描述本发明的实施例,所述实施例的示例在附图中示出。下面通过参考附图描述的实施例是示例性的,旨在用于解释本发明,而不能理解为对本发明的限制。
本申请所述的“尿酸氧化酶”应作广义理解,它是指在实际生产实践中,在同一批次中所产出的尿酸氧化酶的混合物的总称。
对尿酸氧化酶的蛋白结构序列进行部分氨基酸的取代、缺失或添加等结构改造,进而实现本实例的包括但不限于降低免疫原性等。
尿酸氧化酶没有特别的限制,可以是任何来源的尿酸氧化酶及其尿酸氧化酶类似物,代表的例子包括但并不限于哺乳动物来源、微生物、植物等。
本发明所述的不同种属来源尿酸氧化酶,可通过多种途径获得,包括但不限于天然提取、化学合成、基因工程重组表达等。
在另一优选例中,尿酸氧化酶通过重组技术,将尿酸氧化酶蛋白序列(seqidno:1)的编码序列在宿主细胞进行重组表达。
在另一优选例中,以大肠杆菌或酵母作为宿主,构建重组表达菌株的方法制备而得,更优选大肠杆菌作为宿主菌进行重组表达。
如本文所用,所述聚乙二醇(peg),指环氧乙烷缩聚物和水的混合物,由通式h(och2ch2)noh表示,这是一种ph中性,无毒、水溶性较高的亲水聚合物,呈线性或支化状结构。peg要和蛋白结合需要对peg的一端或多端进行活化,可根据所修饰的目标蛋白上如氨基、巯基、羧基或羟基等选择相应的修饰基团进行活化。
在另一优选例中,本发明用于氧化尿酸酶进行peg修饰的位点为赖氨酸残基的ε氨基,但也有少量的n末端赖氨酸残基的α氨基的修饰。尿酸氧化酶通过氨脂键、仲氨键或酰胺键与peg的修饰基团进行共价连接,优选聚乙二醇分子与尿酸氧化酶偶联形成为酰胺键,其聚乙二醇的修饰基团包括但不限于n羟基琥珀酰亚胺类、硝基苯类,包括但不限于n羟基琥珀酰亚胺(nhs)、n羟基琥珀酰亚胺碳酸酯(sc)、n羟基琥珀酰亚胺乙酸酯(scm)、n羟基琥珀酰亚胺丙酸酯(spa)、n羟基琥珀酰亚胺丁酸酯(sba)、n羟基琥珀酰亚胺琥珀酸酯(ss)、硝基苯基碳酸酯(npc)等,其中聚乙二醇的封闭基团包括但不限于单甲氧基、乙氧基、葡萄糖或半乳糖糖,优选单甲氧基。
在另一优选例中,聚乙二醇可以是直链或支链。
在另一优选例中,聚乙二醇尿酸氧化酶所采用的聚乙二醇分子量为9~11kd,优选10kd。
在另一优选例中,修饰样品的纯化采用包括但不限于分子筛层析、离子交换层析、疏水层析、切向流超滤、或组合。更优选分子筛层析、切向流超滤。
在本发明的另一方面,提供了一种上述聚乙二醇修饰的尿酸氧化酶及其应用。该偶联物可以实现体内显著降低血液尿酸水平的功效,可用于高尿酸血症及通风的治疗。
所述的聚乙二醇尿酸氧化酶更适用于作为一种治疗慢性高尿酸血症或通风的药物及其组合物。所述高尿酸血症及通风的主要症状包括但不限于尿酸性肾病和通风性关节炎。
所述的聚乙二醇尿酸氧化酶的给药途径包括但不局限于静脉注射、皮下注射、肌肉注射和腹腔注射等。
所述的聚乙二醇尿酸氧化酶相对于没有连接peg的尿酸氧化酶,具有更低的体内免疫原性。
所述的聚乙二醇尿酸氧化酶具有低免疫原性是指在人或动物体内经肌肉注射聚乙二醇尿酸氧化酶后,不产生针对尿酸氧化酶的抗体,且机体不产生抗聚乙二醇分子的抗体或产生低滴度的抗聚乙二醇抗体。
根据本发明的实施例,本发明的聚乙二醇修饰的尿酸氧化酶能够在保证酶活力的前提下,降低免疫原性。因而,本发明的聚乙二醇修饰的尿酸氧化酶以及包含该聚乙二醇修饰的尿酸氧化酶的药物组合物可以在治疗或预防高尿酸相关性疾病时被给药。
在本文中所使用的术语“给药”指将预定量的物质通过某种适合的方式引入病人。本发明的聚乙二醇修饰的尿酸氧化酶可以通过任何常见的途径被给药,只要它可以到达预期的组织。给药的各种方式是可以预期的,包括腹膜,静脉,肌肉,皮下,皮层,口服,局部,鼻腔,肺部和直肠,但是本发明不限于这些已举例的给药方式。此外,本发明的药物组合物可以使用将活性成分传送到靶细胞的特定器械来给药。
本发明的药物组合物的给药频率和剂量可以通过多个相关因素被确定,该因素包括要被治疗的疾病类型,给药途径,病人年龄,性别,体重和疾病的严重程度以及作为活性成分的药物类型。
术语“治疗有效量”是指化合物足以显著改善某些与疾病或病症相关的症状的量,也即为给定病症和给药方案提供治疗效果的量。例如,在慢性高尿酸血症或痛风治疗中,减少、预防、延缓、抑制或阻滞疾病或病症的任何症状的药物或化合物应当是治疗有效的。治疗有效量的药物或化合物不需要治愈疾病或病症,但将为疾病或病症提供治疗,使得个体的疾病或病症的发作被延缓、阻止或预防,或者疾病或病症的症状得以缓解,或者疾病或病症的期限被改变,或者例如疾病或病症变得不严重,或者加速康复。
术语“治疗”用于指获得期望的药理学和/或生理学效果。所述效果就完全或部分预防疾病或其症状而言可以是预防性的,和/或就部分或完全治愈疾病和/或疾病导致的不良作用而言可以是治疗性的。本文使用的“治疗”涵盖哺乳动物、特别是人的疾病(主要指高尿酸相关性疾病)的治疗,包括:(a)在容易患病但是尚未确诊得病的个体中预防疾病;(b)抑制疾病,例如阻滞疾病发展;或(c)缓解疾病,例如减轻与疾病相关的症状。本文使用的“治疗”涵盖将药物或化合物给予个体以治疗、治愈、缓解、改善、减轻或抑制个体的疾病的任何用药,包括但不限于将含本文所述聚乙二醇修饰的尿酸氧化酶给予有需要的个体。
根据本发明的实施例,本发明的聚乙二醇修饰的尿酸氧化酶或药物组合物可与常规治疗方法和/或疗法相结合使用,或者可与常规治疗方法和/或疗法分开使用。当本发明的聚乙二醇修饰的尿酸氧化酶或药物组合物在采用与其它药物的联合疗法中给药时,它们可序贯地或同时地给予个体。或者,本发明的药物组合物可包含本发明的聚乙二醇修饰的尿酸氧化酶、药学上可接受的载体或药学上可接受的赋形剂以及本领域已知的其它治疗药或预防药的组合。
术语“平均修饰度”是指每一个尿酸氧化酶单体上结合的peg个数。
本领域技术人员能够理解的是,本领域技术人员可以通过常规的技术手段确定特定的氨基酸位点是否连接有peg,例如可以参考本申请实施例3“聚乙二醇修饰位点检测”部分中所列出的方法进行鉴定。简言之,该方法包括:1)将非聚乙二醇化和聚乙二醇化尿酸氧化酶采用一种或多种酶进行酶切,如可以采用lys-c或trypsin进行单酶切,也可以采用lys-c和trypsin进行双酶切;2)通过高效液相色谱方法分离酶切片段,产生非聚乙二醇化和聚乙二醇化尿酸氧化酶的色谱图,即肽图;3)比较非聚乙二醇化和聚乙二醇化尿酸氧化酶肽图的差异,确定聚乙二醇化尿酸氧化酶中特定的氨基酸位点所在肽段峰的减少或消失的相对比例,进而判定肽段上该特定的氨基酸位点是否被peg修饰。具体地,在本申请实施例3中,特定的氨基酸位点所在肽段的峰面积的减少或消失的相对比例可通过如下公式计算获得:
p(%)=(a2-a1)/a2×100%,
p(%)表示特定的氨基酸位点所在肽段的峰面积的减少或消失的相对比例,a2为特定的氨基酸位点所在肽段在phc肽图中的肽段峰面积,a1为特定的氨基酸位点所在肽段在待测修饰蛋白肽图中的峰面积。
应理解,在本发明范围内,本发明的上述各技术特征和在下文(如实施例)中的具体描述的各种技术特征之间都可以相互组合,从而构成新的或优选的技术方案,参照以下实例能够对之有更清楚的理解。限于篇幅,所述实例仅为说明目的而并不旨在对本发明进行限制。
下面将进一步详细描述本发明的实施例,所述实施例的示例在附图中示出。下面通过参考附图描述的实施例是示例性的,旨在用于解释本发明,而不能理解为对本发明的限制。
实施例1尿酸氧化酶(phc)的制备
1.1尿酸氧化酶重组表达构建
采用全基因合成方式合成获得尿酸氧化酶蛋白(代号:phc)(seqidno:1)的cdna,以ndei和bamhi作为目的基因插入位点,采用pet-30a质粒作为表达载体并引入转化至大肠杆菌bl21(de3)中,用kanamycin抗性筛选获得尿酸氧化酶高表达宿主菌工程菌。
将转化的工程菌种采用发酵罐进行发酵培养,1mmol/liptg诱导表达4h,离心收集细胞。发酵离心菌体重悬浮于20mmol/ltris,5mmol/ledta缓冲液中,600bar左右高压均浆破菌获得尿酸氧化酶沉淀,沉淀分别洗涤缓冲一:20mmol/ltris,0.1%tritonx-100,ph8.0~8.5和洗涤缓冲二:50mmol/lnahco3洗涤一次后,将富集的尿酸氧化酶沉淀悬浮于100mmol/lna2hco3(ph9.7~10.3)缓冲液中,悬浮比例1:50(w/v),室温搅拌过夜溶解,随后离心收集上清。
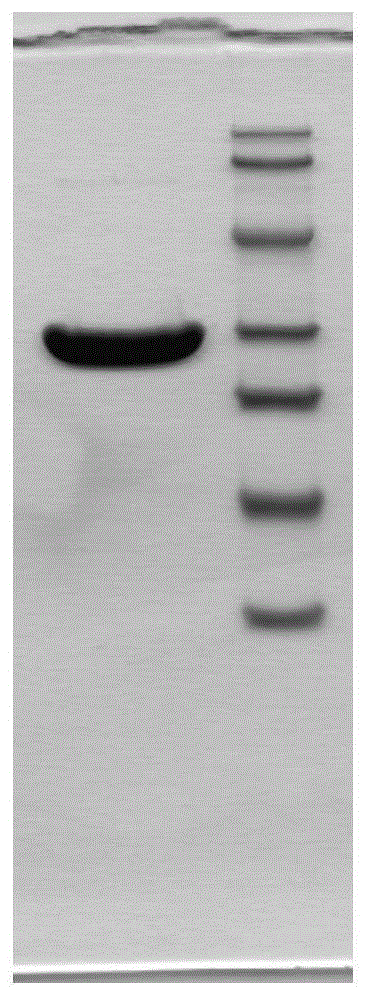
取尿酸氧化酶溶解上清样品,首先用deae-sepharoseff柱捕获。用含50mmol/lna2hco3(ph9.7~10.3)缓冲平衡,用含0.3mnacl的碳酸盐缓冲洗脱尿酸氧化酶。然后,用source30q除去尿酸氧化酶中的高分子。用50mmol/lna2hco3(ph9.7~10.3)缓冲平衡,用含0~0.5mnacl的碳酸盐缓冲进行线性梯度洗脱,获得高纯度的尿酸氧化酶phc。经过纯化最终获得的尿酸氧化酶phc纯度,如图1所示:sds-page检测纯度大于95%以上,如图2所示:用rp-hplc检测纯度大于95%以上,无聚集体形式。
实施例2聚乙二醇化尿酸氧化酶(pha)的制备
将实施例1中纯化获得的尿酸氧化酶用洗脱缓冲稀释至8mg/ml,以1:80~120摩尔比(尿酸氧化酶:10k-peg-spa)投入10k-peg-spa干粉,室温搅拌反应1小时以上,直到peg偶联程度不再随时间而变化。反应结束后,通过分子筛层析除去修饰副产物,然后超滤浓缩后无菌过滤即得10k修饰的聚乙二醇化尿酸氧化酶(代号为pha)。
实施例3聚乙二醇化尿酸氧化尿酸氧化酶的特性分析
3.1平均修饰度及酶活检测
采用lowry法测定蛋白浓度,聚乙二醇尿酸氧化酶活性测定在分光光度计下进行。尿酸氧化酶底物尿酸最大紫外吸收波长为293nm,而产物尿囊素的最大紫外吸收波长为224nm,在一定浓度范围内,尿酸在293nm的吸收值与其浓度成正比,可用分光光度计法进行尿酸的定量测定。具体过程如下:打开紫外可见分光光度计,将波长调至293nm,并打开该仪器水浴循环系统使温度保持为37℃。以四硼酸钠缓冲液作空白对照,校零点;取2.95ml底物反应液(0.1mol/l四硼酸钠、100μmol/l尿酸,ph9.5,37℃预热)置石英比色杯中,然后加入50μl的供试品迅速混匀后于293nm处测定吸收值。连续测定293nm处吸收度变化;根据c=a/εl(其中a为特定浓度尿酸在293nm处吸光值,ε为尿酸摩尔消光系数,l为比色杯光程,c为尿酸摩尔浓度)计算尿酸降解浓度,并计算酶活;酶活定义:在最适反应温度37℃,最适反应ph9.5时,每分钟转化1μmol尿酸为尿囊素所需的酶量定义为一个活性单位(u)。
采用sec-hplc串联uv/ri(紫外和折光指数检测器联合)进行聚乙二醇尿酸氧化酶的平均修饰度检测。根据蛋白在紫外280nm处有最大吸收峰,而该波长下peg没有吸收,同时示差折光检测器对蛋白和peg在一定范围内吸收值与其各种浓度成正比。因此可通过peg参照品和phc理化对照品外标方式得到聚乙二醇化尿酸氧化酶中peg和蛋白部分各自的含量,进而可通过以下计算方式获得每一个尿酸氧化酶单体上peg分子数,即平均修饰度。
peg尿酸氧化酶平均修饰度=(尿酸氧化酶亚基相对分子量×样品中peg的量)/(peg相对分子量×样品中蛋白质的量)。
测得实施例2所获得的聚乙二醇化尿酸氧化尿酸氧化酶(pha)的平均修饰度为9.4,酶活为10.7u/mg,与未修饰尿酸氧化酶酶活11.4u/mg相比,修饰后的聚乙二醇化尿酸氧化尿酸氧化酶酶活保留率在90%以上。
3.2聚乙二醇修饰位点检测
在以下步骤中,发明人对实施例2所获得的尿酸氧化酶进行修饰位点的检测。
聚乙二醇修饰的尿酸氧化酶的peg修饰位点可通过对非聚乙二醇化和聚乙二醇化尿酸氧化酶采用一种或多种酶进行酶切,然后经过色谱检测,获得色谱图,即肽图确认。非聚乙二醇化和聚乙二醇化尿酸氧化酶可以采用单酶切(lys-c或trypsin)和/或双酶切(lys-c和trypsin联用)进行酶切。反相柱分离酶切片段,通过比较肽段消失或降低比例判断聚乙二醇尿酸氧化酶的修饰位点。
胰蛋白酶和lys-c双酶切质量肽图中修饰位点分析原理:lys-c可对赖氨酸(k)c端进行特异性酶切,胰蛋白酶以碱性氨基酸-精氨酸(r)和赖氨酸(k)作为酶切位点,对其c端肽键进行特异性酶切。比较phc和pha中酶切后对应各肽段变化情况,可分析确认peg修饰肽段减小或消失的相对比例。通过肽段的减小或消失相对比例,可判定肽段上该赖氨酸位点是否被peg修饰以及修饰的比例。需要指出的是,peg修饰是一种非均一的修饰,某位点修饰比例高则可以认为该位点被修饰。
以lys-c单酶切为例,具体如下:
(1)样品处理:取尿酸氧化酶和聚乙二醇化尿酸氧化酶分别用酶切缓冲液(25mmol/ltris-hcl,20%乙腈,ph9.0)溶解稀释为1mg/ml,各取100μl,加入2μllys-c,于37℃酶切4小时,再加入10μl1mol/l盐酸溶液终止反应。
(2)分析条件:
仪器:thermoultimate3000hplc和msqplus;
色谱柱:月旭welchmaterials
分析条件:a液(含0.1%tfa的水溶液),b液(含0.1%tfa的乙腈溶液);
梯度:0-70min,b从3-70%;
lc检测波长:214nm。
离子源:esi;
离子类型:正离子;
锥孔电压:50v;
扫描范围:300-2000da;
扫描时间:1s;
柱后分流约0.3ml/min。
样品量进样100μl,记录色谱图。
(3)结果处理:
比较尿酸氧化酶和聚乙二醇化尿酸氧化酶的色谱图(肽图),利用以下公式可计算pha与phc相同浓度下对应的pha肽段峰面积:
p(%)=(a2-a1)/a2×100%
其中,a2为某肽段在phc肽图中肽段峰面积,a1为该肽段在pha肽段峰面积。
根据本实施例的蛋白序列(seqidno:1)分析可知,尿酸氧化酶被修饰的潜在位点有t1、k3、k4、k17、k21、k30、k35、k48、k49、k66、k74、k76、k79、k97、k112、k116、k120、k152、k155、k158、k169、k179、k190、k215、k222、k231、k266、k272、k285、k291、k293等31个位点。
如图3,图4和图5所示,其中,图3为phc的lys-c酶切肽图,图4为pha的lys-c酶切肽图,图5为phc和pha的lys-c酶切比对图。通过对实施例3中所获得聚乙二醇修饰的尿酸氧化酶酶切肽图进行分析可知,pha酶切后肽段与phc酶切后对应片段峰面积有降低的对应位点有k4、k17、k30、k35、k97、k112、k116、k152、k179、k190、k222、k266、k272、k285、k291、k298。其中,pha酶切后肽段消失在75%以上的位点有k4、k17、k97、k179、k190、k222、k266、k272、k285等9个位点。
实施例4聚乙二醇尿酸氧化酶体内药效学研究
在这项实验中,大鼠单次接受1mg/kg的聚乙二醇尿酸氧化酶尾静脉注射,不同时间点眼眶取血,采用定量质谱法测定尿囊素含量,采用荧光法测定尿酸含量。图6显示了大鼠单次给药后血清中尿酸(μmol/l)和尿囊素(μmol/l)水平变化水平。实验结果表明,在给药后,血药可维持至少10天,表现为持续的尿酸降低同时其降解产物尿囊素相应增加。
实施例5聚乙二醇尿酸氧化酶体内体内免疫原性测定
将聚乙二醇尿酸氧化酶(pha)每周一次,连续静脉给药4次,每次1mg/kg,每次给药后7天采血,采用elisa法检测抗体,结果证实,未检出抗药抗体,同时检测重复给药后血清中聚乙二醇尿酸氧化酶(pha)仍具有酶活,和对照组(生理盐水组)相比,血清中一直维持低水平血尿酸。
在本说明书的描述中,参考术语“一个实施例”、“一些实施例”、“示例”、“具体示例”、或“一些示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不必须针对的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任一个或多个实施例或示例中以合适的方式结合。此外,在不相互矛盾的情况下,本领域的技术人员可以将本说明书中描述的不同实施例或示例以及不同实施例或示例的特征进行结合和组合。
尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在本发明的范围内可以对上述实施例进行变化、修改、替换和变型。
sequencelisting
<110>济南瑞冉企业管理咨询有限公司
路伟
<120>治疗高尿酸相关性疾病的药物
<130>pidc3192662
<160>1
<170>patentinversion3.3
<210>1
<211>298
<212>prt
<213>artificial
<220>
<223>尿酸氧化酶的氨基酸序列
<400>1
thrtyrlyslysasnaspgluvalgluphevalargthrglytyrgly
151015
lysaspmetilelysvalleuhisileglnargaspglylystyrhis
202530
serilelysgluvalalathrthrvalglnleuthrleuserserlys
354045
lysasptyrleuhisglyaspasnseraspvalileprothraspthr
505560
ilelysasnthrvalasnvalleualalysphelysglyilelysser
65707580
ilegluthrphealavalthrilecysgluhispheleuserserphe
859095
lyshisvalileargalaglnvaltyrvalglugluvalprotrplys
100105110
argpheglulysasnglyvallyshisvalhisalapheiletyrthr
115120125
prothrglythrhisphecysgluvalgluglnileargasnglypro
130135140
provalilehisserglyilelysaspleulysvalleulysthrthr
145150155160
glnserglyphegluglypheilelysaspglnphethrthrleupro
165170175
gluvallysaspargcysphealathrglnvaltyrcyslystrparg
180185190
tyrhisglnglyargaspvalasppheglualathrtrpaspthrval
195200205
argserilevalleuglnlysphealaglyprotyrasplysglyglu
210215220
tyrserproservalglnlysthrleutyraspileglnvalleuthr
225230235240
leuglyglnvalprogluilegluaspmetgluileserleuproasn
245250255
ilehistyrleuasnileaspmetserlysmetglyleuileasnlys
260265270
glugluvalleuleuproleuaspasnprotyrglylysilethrgly
275280285
thrvallysarglysleuserserargleu
290295
- 还没有人留言评论。精彩留言会获得点赞!