9-氨基吖啶的应用的制作方法
本发明涉及9-氨基吖啶的应用,尤其涉及9-氨基吖啶在制备治疗缺血性脑卒中药物的用途,属于医药技术领域。
背景技术:
缺血性脑卒中是一种脑血管疾病,具有高发病率、高复发率和高死亡率的特点,严重危害人类健康1。美国食品药品监督管理局(fda)仅批准了重组人组织型纤溶酶原激活剂(tpa)这一款药物,用于缺血性脑卒中的溶栓治疗。tpa必须在患者发病3-4.5h内给药,且伴有颅内出血的风险,因此很少有患者可从中受益2。对于缺血性脑卒中的治疗,开发新的药物或新的制剂迫在眉睫。缺血性脑损伤会激活脑部驻留的小胶质细胞和浸润的巨噬细胞3。活化的小胶质细胞/巨噬细胞在损伤区可以通过在促炎和抗炎激活状态之间进行切换4。促炎激活状态的小胶质细胞/巨噬细胞会产生多种促炎因子,包括肿瘤坏死因子-α(tnf-α),白介素-1β(il-1β),il-6和环氧合酶2(cox-2),它们会进一步加重缺血后损伤区域的神经炎症。而它们的抗炎激活状态可以产生抗炎因子,例如il-4和il-10,防止神经炎症和神经细胞死亡,促进组织重塑和修复,因此,在亚急性期将小胶质细胞/巨噬细胞调节为抗炎激活状态是一种非常有希望的治疗方法。研究指出,多种信号通路参与了缺血后小胶质细胞/巨噬细胞的活化。孤核受体是指没有配体或者尚未发现配体的核受体,其中,孤核受体nr4a1(核受体亚家族4,a组成员1)在多种炎症疾病中调节小胶质和巨噬细胞的活化5。nr4a1的激动剂可以减少促炎因子的产生,从而保护神经元细胞6。老药新用是近年来比较热门的研究方向,在老药的原适应症以外开发新用途,减少药物研发的成本和时间,使患者尽早受益。随着科学技术的进步和研究的深入,目前对于缺血性脑卒中的发病机制有了更深的了解。但是,目前临床上获批的药物还是仅有tpa一种。如果治疗不及时,极易留下后遗症或是造成死亡。缺血性脑卒中依然威胁着人类的健康。随着对脑缺血损伤机制的逐步深入,神经炎症因其持续时间长,作用范围广,同时具有促修复的双面功能,被新药研发者重点关注,新型神经炎症调控药物的发现,有望为缺血性脑卒中的治疗带来更多的可能。孤核受体nr4a1是一类尚未发现内源性配体的受体。有研究指出nr4a1可以转移至线粒体,与bcl-2结合促进细胞凋亡;也有研究发现nr4a1可以在细胞核内充当转录因子,调节下游基因的表达;此外,还能对其他转录因子产生影响,起到共激活因子或共抑制因子的作用。所以,目前药物调控nr4a1的策略主要以影响它的表达水平为主,有多项研究指出提高nr4a1的表达可以抑制免疫细胞的炎症反应。因此,如何在已上市的药物中筛选出nr4a1的激动剂,并制备出合适的制剂用于缺血性脑卒中的治疗或成为新的研究方向。
参考文献:
1.hankeygj.stroke.lancet.2017;389:641-54.
2.vidales,agostonie.thrombolysisinacuteischaemicstroke.brain.2014;137:1-2.
3.hux,lip,guoy,wangh,leakrk,chens,etal.microglia/macrophagepolarizationdynamicsrevealnovelmechanismofinjuryexpansionafterfocalcerebralischemia.stroke.2012;43:3063-70.
4.huxm,leakrk,shiyj,suenagaj,gaoyq,zhengp,etal.microglialandmacrophagepolarization—newprospectsforbrainrepair.natrevneurol.2015;11:56-64.
5.hannarn,shakedi,hubbelinghg,puntja,wurp,herrleye,etal.nr4a1(nur77)deletionpolarizesmacrophagestowardaninflammatoryphenotypeandincreasesatherosclerosis.circres.2012;110:416-27.
6.liuty,yangxy,zhenglt,wanggh,zhenxc.activationofnur77inmicrogliaattenuatesproinflammatorymediatorsproductionandprotectsdopaminergicneuronsfrominflammation-inducedcelldeath.jneurochem.2017;140:589-604.
技术实现要素:
本发明的目的是针对现有技术存在的缺陷,提出一种nr4a1的激动剂,以及该激动剂在制备用于治疗缺血性脑卒中的药物的应用。
本发明的首要目的是选择合适的nr4a1激动剂,为实现该目的,首先建立筛选模型对fda上市药化合物库进行随机筛选,找寻合适的nr4a1激动剂。再对目标药物进行药剂学的改造,实现增效减毒的目的,使其成为一种潜在的用于脑卒中治疗的药物。
nr4a1激动剂的筛选基于荧光素酶报告基因筛选体系,利用nr4a1启动子的报告基因建立筛选模型,进行初筛。然后,对于筛选出的活性药物利用mtt实验进行复筛。
上述筛选的初筛化合物选自fda批准上市的一千多种活性化合物。复筛化合物选自伏立诺他、多西紫杉醇、达沙替尼、阿霉素、表阿霉素、噻苯达唑、米托蒽醌、柔红霉素、9-氨基吖啶(9-aa)。
研究发现9-氨基吖啶是上调nr4a1表达的化合物。目前9-aa只被批准用作局部抗感染和防腐剂。另有其衍生物被批准用于治疗阿尔兹海默症(商品名:他克林),而临床使用过程中发现,他克林容易造成肝毒性和消化道反应。由此推测,并不能直接将9-aa作为治疗脑卒中的药物。
本发明在筛选出潜在的用于脑卒中治疗的药物的基础上,进一步研制治疗脑卒中的药物。具体技术方案如下:
本发明先提供一种具有脑靶向和长循环两种功能的脂质体,其组成部分包括磷脂、胆固醇、peg功能化磷脂、脑靶向多肽,所述磷脂和胆固醇的摩尔比为20:1-4:1;磷脂和peg功能化磷脂的摩尔比为40:1-10:1;磷脂和脑靶向多肽的摩尔比为80:1-10:1;9-氨基吖啶和脂质的质量比为1:100-5:100。
进一步地,所述磷脂选自磷脂酰胆碱、磷脂酰乙醇胺、磷脂酰丝氨酸、磷脂酰甘油、磷脂酰肌醇、心磷脂、鞘磷脂或鞘糖脂。
进一步地,所述peg功能化磷脂选自二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000(dspe-mpeg2000)、dspe-peg5000-n3、dspe-peg2000-n3、dspe-peg5000-sh、dspe-peg2000-sh、dspe-peg5000-nh2、dspe-peg2000-nh2、dspe-peg5000-cooh、dspe-peg2000-cooh、dspe-peg5000-oh。
进一步地,所述脑靶向多肽包括中风归巢肽(clevsrknc)、狂犬病病毒糖蛋白29肽(rvg29)、促bbb转胞吞多肽(angiopep-2)、转铁蛋白靶向肽(t7)、神经激肽-1受体接合肽(substancep)、整合素靶向多肽(crgdyk)中的至少一种。
本发明再提供一种包载9-aa的脂质体,以磷脂酰胆碱和胆固醇为主体,附加dspe-mpeg2000、dspe-mpeg2000-sh两种合成磷脂和crgdyk靶向多肽。磷脂和胆固醇的摩尔比为80:10-80:20;磷脂和dspe-mpeg2000的摩尔比为80:2-80:4;磷脂和dspe-mpeg2000-sh的摩尔比为80:1-80:4;磷脂和crgdyk的摩尔比为80:1-80:4;9-氨基吖啶和脂质的质量比为2:100-5:100。
本发明进一步提供包载9-aa脂质体的制备方法,包括以下步骤:
步骤1,成膜,将1.5mg9-aa,50mg磷脂酰胆碱、5mg胆固醇、6mgdspe-mpeg2000和4mgdspe-mpeg2000-sh溶解在4ml氯仿和2ml甲醇的混合体系中,37℃水浴旋蒸,使其在茄形瓶内壁上形成均匀的脂质薄膜,置于干燥皿中,抽真空,干燥过夜;
步骤2,水合,向茄形瓶中加入3ml生理盐水,37℃缓慢摇动;
步骤3,超声,利用超声波细胞破碎仪分散脂质体,强度为40%,时间为5min;
步骤4,过膜,将脂质体依次通过800nm、450nm和220nm的滤膜;
步骤5,靶向肽的修饰,将1.2mgcrgdyk-mal溶解于0.1ml水中,与脂质体在37℃下孵育2h,完成脂质体表面靶向肽的修饰,即得。本发明的具有长循环和脑靶向双功能的脂质体,可以显著延长9-aa的体内半衰期,增加9-aa在脑损伤部位的浓度,提高药物的生物利用度。同时,脂质体减少9-aa造成的肺损伤,减轻了不良反应,使得9-aa用于缺血性脑损伤的治疗成为可能。
附图说明
图1与不同的fda批准药物孵育24h的hek-293t细胞中的相对荧光素酶活性。
图2与不同化合物孵育24h的小鼠原代小胶质细胞的活力。
图3与不同化合物孵育12h和lps孵育2h的小鼠原代小胶质细胞的tnf-α表达。
图4hek-293t细胞与不同浓度的9-aa孵育24h后的相对荧光素酶活性。
图59-aa对小鼠原代小胶质细胞nr4a1基因和蛋白表达水平的影响。
图69-aa对小鼠原代小胶质细胞促炎介质、抗炎介质和抗炎因子il-10表达的影响。
图79-aa对iri的作用及安全性。
图89-aa对大鼠心肝脾肺肾的影响。
图99-aa/l对大鼠心肝脾肺肾的影响。
图109-aa和9-aa/l的药动学测试。
图11活体成像评价不同脂质体脑靶向能力以及rho/l和rho/l-peg-crgd的药动学测试。
图12不同脂质体对iri的保护作用及促炎因子和抗炎因子水平的影响。
图13mri测试,9-aa/l-peg-crgd抗炎机制初探和长期行为学测试。
图149-aa/l-peg-crgd对tmcao大鼠的长期影响。
具体实施方式
下面结合附图和具体实施例对本发明作进一步详细说明。
实施例1针对缺血性脑卒中的药物筛选和评价
一、荧光素酶报告基因分析
在预先涂有pll的96孔板中培养hek-293t细胞。当细胞密度达到约70%时,使用lipofectamine3000试剂和nr4a1启动子荧光素酶报告基因(nr4a1-pro-luc)质粒转染细胞。转染24h后,再将细胞与fda批准的药物库中的不同化合物孵育24h。使用荧光素测定系统(promega)测定荧光素酶活性。相对荧光素酶活性计算为l/l0×100%,其中l和l0分别是经过和未经过化合物处理的细胞的荧光素酶活性。
实验结果如图1所示,9种化合物诱导了与nr4a1表达上调相关的hek293t细胞的荧光素酶活性的显著增加,它们包括伏立诺他、多西紫杉醇、达沙替尼、阿霉素、表阿霉素、噻苯达唑、米托蒽醌、柔红霉素、9-氨基吖啶(9-aa)。
二、体外细胞毒性实验进一步筛选候选化合物
1、原代小胶质细胞的提取
在出生后24h至48h内,将整个大脑从c57bl/6幼崽中分离出来,并浸入4℃的hank平衡盐溶液(hbss)中。除去脑膜和其他非皮质组织后,解剖整个皮质,并在室温下用0.25%胰蛋白酶消化大脑皮质。在上述溶液中加入含有10%fbs的dmem/f12培养基以终止胰蛋白酶消化。将细胞悬液通过70μm筛网过滤。将分离的细胞转移到预先涂有聚-l-赖氨酸(pll)的细胞培养瓶中培养。分离后
2、细胞毒性实验
将小鼠原代小胶质细胞与9种化合物分别孵育24h,然后与含有0.5mg/mlmtt的培养基孵育4h。除去培养基后,将mtt反应生成的结晶溶解在dmso中。使用酶标仪测定570nm下吸光度。细胞活力计算公式为a/a0×100%,其中a和a0分别是经过和未经过化合物处理的细胞的吸光度。
实验结果如图2所示,在9种候选化合物中,仅3种化合物对小鼠原代小胶质细胞没有明显的细胞毒性,他们是达沙替尼,噻苯达唑和9-aa。
三、体外抗炎能力试验
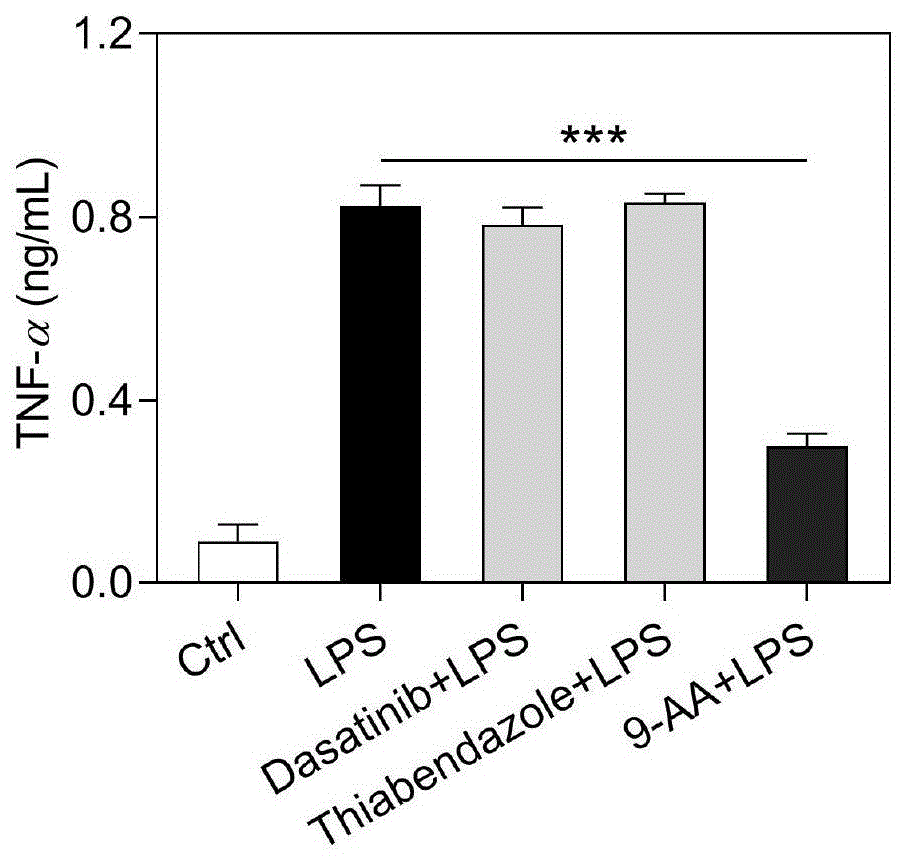
将小鼠原代小胶质细胞与达沙替尼,噻苯达唑和9-aa(5μm)分别孵育12h,再与100ng/ml脂多糖(lps)孵育2h。用elisa试剂盒测定小胶质细胞分泌的tnf-α的量。
实验结果如图3所示,经lps处理的小胶质细胞显示出tnf-α分泌量的增加,而只有9-aa可以显著减少小胶质细胞分泌的tnf-α的量。因此选定9-aa作为最优活性化合物。
四、9-aa对nr4a1激活能力的测定
在预先涂有pll的96孔板中培养hek-293t细胞。当细胞密度达到约70%时,使用lipofectamine3000试剂和nr4a1启动子荧光素酶报告基因(nr4a1-pro-luc)质粒转染细胞。转染24h后,再将细胞与不同浓度的9-aa孵育24h。使用荧光素测定系统(promega)测定荧光素酶活性。相对荧光素酶活性计算为l/l0×100%,其中l和l0分别是经过和未经过9-aa处理的细胞的荧光素酶活性。
实验结果如图4所示,根据荧光素酶活力对9-aa的浓度曲线,9-aa对nr4a1表达上调的半数有效浓度(ec50)为5.84μm。
五、9-aa对细胞nr4a1基因和蛋白水平的影响
将小鼠原代小胶质细胞与不同浓度的9-aa孵育12h,或与5μm9-aa孵育不同的时间。通过rt-pcr分析和western-blot(wb)分别检测小胶质细胞中的nr4a1基因和蛋白表达。
对于rt-pcr分析,使用trizol试剂分离总rna。用cdna合成试剂盒将分离的rna反转录为cdna。通过在steponeplustm检测系统(abi)上使用合成引物和sybrgreen进行定量pcr。
对于wb分析,使用bca试剂盒定量蛋白质样品的总浓度。在10%-12%sds-page凝胶上电泳分离等量的蛋白质,然后湿转到合适大小的pvdf膜上。在室温下,用含有5%bsa,0.1%tween20的tris缓冲盐(tbs)(ph7.4)溶液封闭2h,并与一抗,兔抗nr4a1和抗β-肌动蛋白在4℃下孵育过夜。用含有0.1%tween20的tbs洗涤后,将膜与二抗—hrp偶联的山羊抗兔igg蛋白(abclonal)在室温下孵育1h。最后,使用成像系统(bio-radchemidocxrs)通过增强的化学发光检测试剂对条带进行可视化。
实验结果如图5所示,9-aa以剂量和时间依赖性方式促进小鼠原代小胶质细胞内源性信使rna(mrna)转录和nr4a1蛋白表达。
六、9-aa的抗炎能力考察
将小鼠原代小胶质细胞与5μm的9-aa一起孵育12h,再与100ng/ml的lps孵育2或6h。lps刺激后2h,通过rt-pcr分析确定小胶质细胞中促炎基因(tnf-α,il-1β,il-6)的表达,而抗炎基因(il-10,arginase-1(arg-1),cd206)在lps刺激后6h测量。在lps刺激后2h,采用elisa试剂盒测定小胶质细胞分泌的il-10浓度。
实验结果如图6所示,9-aa预处理可以以剂量和时间依赖性地抑制lps诱导的小胶质细胞释放促炎因子tnf-α,抑制促炎基因tnf-α、il-1β和il-6的表达,同时也促进了小胶质细胞的抗炎激活状态,如增强表达抗炎介质基因,包括il-10,arg-1和cd206。同时,单独用9-aa处理可以显著增加小鼠原代小胶质细胞中抗炎细胞因子il-10的表达。这些结果表明9-aa作为nr4a1的激动剂,可以通过诱导nr4a1的表达,激活小胶质细胞的抗炎反应。
七、9-aa对大鼠短暂性脑中动脉阻塞(transientmiddlecerebralarteryocclusion,tmcao)模型的疗效和安全性评价
1、大鼠tmcao模型的构建
用异氟烷(2%,0.5l/min)麻醉大鼠(
2、9-aa的疗效评价
用表面活性剂solutolhs15辅助溶解9-aa。在iri后2、24和48h分别向tmcao大鼠腹腔内注射游离的9-aa溶液(5或10mg/kg)。记录治疗期间大鼠的存活情况。在iri后3天将大鼠安乐死。分离大脑并切片,用三苯基四唑氯化物(ttc)染色。使用image-proplus软件计算大脑的损伤体积。
3、9-aa的急性毒性实验
将小鼠随机分为不同的组,静脉注射不同浓度的9-aa。记录24h内的存活率。用spss软件计算半数致死量(ld50)。
实验结果如图7所示,与假手术组相比,tmcao大鼠的脑梗死面积显著增大。而9-aa治疗导致梗死面积呈剂量依赖性降低。但是,虽然将9-aa的给药剂量增加至10mg/kg可以增强神经保护作用,但会导致大鼠意外死亡,存活率约为50%。
实施例2包载9-aa的脂质体的制备和评价
为了解决9-aa的安全性问题,我们希望借助纳米药物递送系统,改变9-aa的体内药物分布,提高治疗效果,减少不良反应的产生。脂质体是研究的最为广泛的纳米药物递送系统,具有生物相容性高,容易改造,容易制备等优点。因此我们利用功能化的脂质体包载9-aa,延长9-aa半衰期,实现9-aa对脑损伤部位的靶向功能。
一、包载9-aa脂质体的构建
1、普通9-aa脂质体(9-aa/l)
按摩尔比50:5:10称取磷脂、胆固醇和9-aa粉末于100ml茄形瓶中,加入4ml甲醇、2ml氯仿,摇匀。37℃水浴下用旋转蒸发仪抽真空,快速旋干有机溶剂。然后将茄形瓶转移至干燥器中,真空干燥过夜。取出茄形瓶,加入3ml去离子水,37℃水合,得到脂质体粗品。将脂质体移入西林瓶,在冰水浴下借助超声细胞粉碎仪进行进一步分散。将超声后的脂质体依次通过0.8μm、0.45μm、0.22μm滤膜,得到包载9-aa的脂质体。
2、长循环9-aa脂质体(9-aa/l-peg)
与普通脂质体的制备方法相同,在成膜的过程中加入dspe-mpeg2000,得到peg修饰的9-aa长循环脂质体。
3、脑靶向9-aa脂质体(9-aa/l-crgd)
与普通脂质体的制备方法相同,在成膜的过程中加入dspe-peg2000-sh,并在过膜之后加入crgdyk(mal),37℃孵育2h,得到rgd修饰的9-aa脑靶向脂质体。
4、具有长循环和脑靶向双重功能的9-aa脂质体(9-aa/l-peg-crgd)
与普通脂质体的制备方法相同,在成膜的过程中加入dspe-mpeg2000和dspe-peg2000-sh,并在过膜之后加入crgdyk(mal),37℃孵育2h,得到具有长循环和脑靶向双重功能的9-aa脂质体。上述方法中磷脂、胆固醇、dspe-mpeg2000、dspe-mpeg2000-sh和crgdyk的摩尔比为80:15:3:2:2,9-aa和总脂质的质量比为3:100。
二、功能化9-aa脂质体的表征
1、9-aa含量测定的方法
精密称取一定量的9-aa粉末,溶解于甲醇溶液中,避光备用。利用酶标仪扫描9-aa甲醇溶液的紫外吸收光谱、获得最大紫外吸收波长。然后配制1,2,5,10,20,50,100,200μg/ml的9-aa溶液,利用酶标仪测定各溶液在最大紫外吸收波长下的吸光度值,绘制9-aa紫外吸收标准曲线。9-aa在400nm处有最大吸收。在最大吸收波长下,9-aa甲醇溶液在1-20μg/ml浓度范围内,紫外吸收和浓度成正比。
2、包封率和载药量的测定
包封率:分别将过膜前和过膜后的脂质体按体积比1:49与甲醇混合稀释,破坏脂质体的结构,利用酶标仪测定其吸光度并计算得到脂质体过膜前后9-aa的含量。过膜前脂质体中9-aa的质量记为w0,过膜后脂质体中9-aa的质量记为w。按照下列公式计算包封率:
包封率(entrapmentefficiency,ee)=w/w0×100%;
载药量:参照包封率的计算方法计算脂质体中9-aa的含量,记为w。记录脂质体中所有脂质的质量为wl。按照下列公式计算载药量:
载药量(drug-loadingefficiency,dl)=(w/w+wl)×100%。
9-aa在各组脂质体中的包封率均大于90%,载药量均大于2%。
表1脂质体的理化表征(n=3)
3、粒径、多分散系数和zeta电位的测定
取一定体积的脂质体溶液稀释一定倍数后,采用zetaplus电位粒径仪检测。
结果如表1所示,各组脂质体的粒径在70-80nm,多分散系数均小于0.25%,电位略显负电。
三、9-aa/l的安全性评价
对于未造模小鼠,静脉注射9-aa溶液(15、12.75、10.83、9.21、7.83mg/kg)或9-aa/l(25mg/kg)。记录24h后小鼠存活情况,并计算半数致死量ld50。
对于未造模大鼠,在实验的第2、24和48h分别向大鼠腹腔内注射生理盐水、游离的9-aa溶液(10mg/kg)或9-aa/l(10mg/kg)。3天后将大鼠安乐死。分离出心肝脾肺肾并拍照,将组织切片并用苏木精和伊红(h&e)染色。用光学显微镜观察h&e染色的组织切片。观察间质性水肿和炎性细胞/红细胞浸润。
9-aa和9-aa/l对小鼠的ld50如表2所示。
表2.小鼠在急性毒性研究中的存活情况
ald50=9.949mg/kg(8.735<ld50<11.015,α=0.05)
bld50>25mg/kg
9-aa和9-aa/l对大鼠的脏器毒性如图8,图9所示,相比于游离9-aa导致的肺损伤,9-aa/l不会在大鼠的正常组织中引起任何明显的病理变化。
四、9-aa/l的药动学考察
分别给大鼠静脉注射游离的9-aa溶液(2.5mg/kg)和9-aa/l(2.5mg/kg)。在注射后的不同时间,收集血液样品并离心。使用酶标仪在406nm激发下测量454nm的荧光强度。
实验结果如图10所示,静脉注射后,9-aa/l可以有效延长9-aa的循环时间,提高9-aa的半衰期。
五、不同脂质体的靶向能力考察
1、dir荧光标记脂质体的制备
与9-aa的四种脂质体制备方法相同,将9-aa替换为荧光染料dir,制备得到(1)普通dir脂质体(dir/l),(2)长循环dir脂质体(dir/l-peg),(3)脑靶向dir脂质体(dir/l-crgd)和(4)长循环和脑靶向双功能化的dir脂质体(dir/l-peg-crgd)。
2、活体成像检测脂质体的脑靶向能力
大鼠iri后24h静脉注射dir标记的脂质体制剂(1)dir/l,(2)dir/l-peg,(3)dir/l–crgd,(4)dir/l-peg-crgd。给药后1、2、4、6、24h利用活体成像仪观察大鼠体内dir荧光分布。24h拍摄完后,脱臼处死,取脑拍摄dir荧光分布。最后将大脑放入-80℃速冻3min,取出并用刀片在常温下等分切成6片,拍摄dir荧光在脑内分布。记录图像数据,根据荧光强度和分布统计4种剂型的组织分布,以梗死半脑的荧光分布,强度以及持续时间,比较4种制剂的脑靶向能力。
实验结果如图11所示,术后24h尾静脉注射4组dir标记的脂质体,其中dir/l-peg-crgd展现出了最强的脑部信号,24h脑切片信号分布显示,脂质体主要集中大脑梗死侧,符合预期。dir/l-peg信号其次,dir/l–crgd信号初始较强,后期衰退明显。证明了双功能化的脂质体具备较好的脑靶向能力和长循环能力。后续实验选用9-aa/l-peg-crgd作为制剂进行考察。
六、具有靶向和长循环两种功能的脂质体的药动学考察
1、罗丹明标记的脂质体的制备
与9-aa/l和9-aa/l-peg-crgd的制备方法相同,将9-aa替换为罗丹明pe,制备得到了罗丹明标记普通脂质体(rho/l)和罗丹明标记的长循环和脑靶向双功能化的脂质体(rho/l-peg-crgd)。
2、药动学考察
分别给大鼠静脉注射rho/l和rho/l-peg-crgd。在注射后的不同时间,收集血液样品并离心。使用酶标仪在552nm激发下测量575nm的荧光强度。
实验结果如图11所示,静脉注射后,相比于rho/l,rho/l-peg-crgd可以有效延长rho的循环时间,证明了peg化的脂质体进一步延长了半衰期。
七、9-aa/l-peg-crgd对缺血性脑卒中急性期的保护作用
将56只sd大鼠随机分为7组:(1)假手术组、(2)生理盐水组、(3)低浓度9-aa(2.5mg/kg)游离药物组、(4)高浓度9-aa(5mg/kg)游离药物组,(5)9-aa(2.5mg/kg)普通脂质体组、(6)9-aa(2.5mg/kg)长循环脂质体组、(7)9-aa(2.5mg/kg)双功能化脂质体组,每组8只。参照实施例1中的方法构建tmcao模型。造模后2、24、48h尾静脉注射不同组别药物,共给药3次。假手术组和生理盐水组在相同时间尾静脉注射生理盐水。手术72h后,颈椎脱臼法处死大鼠,剪开头皮,打开颅骨,取出脑组织。用生理盐水洗去脑组织表面血液,滤纸吸干。迅速置于-80℃冰箱冻存。取出后在冰上切片,切成2mm厚度冠状切片,共6片。将脑片近脑干面朝下,放入2%ttc溶液中,避光37℃反应10min。取出后排列整齐,滤纸吸干水分,拍照保存,使用image-proplus软件计算大脑的损伤体积。同时参照实施例1中的方法测定缺血脑组织中的促炎性介质(tnf-α,il-1β,il-6)和抗炎性介质(arg-1和cd206)的mrna水平。
实验结果如图12所示,与游离的9-aa,9-aa/l或9-aa/l-peg相比,相比于同剂量的9-aa,9-aa/l-peg-crgd处理的tmcao大鼠在iri后3天显著降低了ttc染色的梗死体积。此外,9-aa/l-peg-crgd的治疗功效显著高于两倍浓度的游离9-aa。9-aa/l-peg-crgd可显著抑制促炎介质的基因表达,同时增强缺血区抗炎介质的基因表达。这些数据表明9-aa/l-peg-crgd使得9-aa在缺血性脑中快速积累,减少神经炎症,从而减轻缺血性脑损伤。
八、磁共振(mri)检测脂质体的治疗效果
在2、24和48h向tmcao大鼠静脉注射游离的9-aa溶液(2.5mg/kg)和9-aa/l-peg-crgd(2.5mg/kg)。使用小型动物mri系统,在iri后第3天检测大鼠的大脑。使用生理监测装置检测大鼠的心电图和呼吸频率。mri的扫描参数如下:重复时间(tr)=3000.0ms,回波时间(te)=33.0ms,反转角(fa)=顺时针90度,扫描层厚度(si)=1mm,视图=3.5cm×3cm,nsl扫描25层。
实验结果如图13所示,与游离9-aa相比,9-aa/l-peg-crgd具有增强的抗脑中风功效,并且梗死面积明显减少。
九、9-aa/l-peg-crgd抗神经炎症机制初探
在2、24和48h向tmcao大鼠静脉注射游离的9-aa溶液(2.5mg/kg)和9-aa/l-peg-crgd(2.5mg/kg)。用wb分析确定nr4a1和socs3的表达。
实验结果如图13所示,在tmcao大鼠模型中,证实nr4a1/il-10/socs3途径参与9-aa/l-peg-crgd递送的9-aa的抗神经炎症。9-aa/l-peg-crgd处理可明显促进nr4a1和socs3的蛋白表达,同时增加tmcao大鼠缺血脑半球中il-10的基因表达。
十、9-aa/l-peg-crgd对tmcao大鼠行为学的影响
为了进行长期的神经行为评估,分别在造模后第2、24和48h给tmcao大鼠静脉注射游离的9-aa溶液(2.5mg/kg)和9-aa/l-peg-crgd(2.5mg/kg),然后在28天内进行rotarod测试,corner测试和改良的神经功能缺损程度评分(mnss)测试。
对于rotarod测试,将大鼠放在加速旋转的棒上,并在5分钟内将其速度从4×rpm(起始速度)增加到40×rpm(最终速度)。每天测试大鼠在旋转棒上的停留时间。
对于corner测试,将大鼠置于30°夹角的两个平板之间并面向转角。当它们的触须触碰到两侧的角落时,正常的老鼠会选择性地向左或向右转动。但是,当大鼠患有感觉障碍时,它们会选择性地转向未受损的一侧。记录大鼠在10次试验中向右转的次数。
对于mnss测试,评分等级为0到18(正常评分为0;最大缺陷评分为18)。分数13-18表示严重伤害,7-12中等伤害和1-6轻微伤害。
实验结果如图13所示,与游离9-aa相比,9-aa/l-peg-crgd处理可改善tmcao大鼠中风引起的神经功能缺损,并促进其长期功能恢复。
十一、9-aa/l-peg-crgd对tmcao大鼠的长期影响
参照实施例1中的方法构建tmcao模型。造模后2、24、48h尾静脉注射不同组别药物,共给药3次。假手术组和生理盐水组在相同时间尾静脉注射生理盐水。手术7天或14天后,颈椎脱臼法处死大鼠,剪开头皮,打开颅骨,取出脑组织。用生理盐水洗去脑组织表面血液,滤纸吸干。迅速置于-80℃冰箱冻存。取出后在冰上切片,切成2mm厚度冠状切片,共6片。将脑片近脑干面朝下,放入2%ttc溶液中,避光37℃反应10min。取出后排列整齐,滤纸吸干水分,拍照保存,使用image-proplus软件计算大脑的损伤体积。
实验结果如图14所示,9-aa/l-peg-crgd处理介导了长期的抗炎反应和功能恢复。与iri后游离9-aa处理相比,用9-aa/l-peg-crgd处理显著降低了tmcao大鼠造模后7天和14天的梗塞体积。
除上述实施外,本发明还可以有其他实施方式。凡采用等同替换或等效变换形成的技术方案,均落在本发明要求的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!