一种稳定的阿柏西普制剂及其制备方法与流程
[0001]
本发明属于生物学和制剂领域,具体涉及一种稳定的阿柏西普制剂及其制备方法。
背景技术:
[0002]
阿柏西普(aflibercept),是一种重组融合蛋白,由人体血管内皮细胞生长因子(vefg)受体1和2的胞外区与人体免疫球蛋白g1的可结晶片段融合而成。阿柏西普由美国再生元公司开发,2011年获得美国药品食品监督管理局(fda)批准上市,商品名为通过玻璃体内注射剂,用于治疗眼部病症或疾病,例如视网膜中央静脉阻塞继发黄斑水肿(crvo)、视网膜中央静脉阻塞(crvo)、视网膜分支静脉阻塞(brvo)、新生血管(湿性)年龄相关性黄斑变性(amd)、新生血管性青光眼(nvg)、近视脉络膜新生血管引起的视力损伤、糖尿病性黄斑水肿(dme)、dme患者中的糖尿病视网膜病(dr)和新生血管年龄相关性黄斑变性(amd)。
[0003]
eylea眼内注射液为无菌、清澈、无色至浅黄色溶液,ph 6.2,单剂量eylea(0.05ml)包括阿柏西普(40mg/ml),10mm磷酸钠,40mm氯化钠,0.03%聚山梨醇20和5%蔗糖。其中聚山梨醇20,又称吐温20,是一种非离子表面活性剂,具有较强的亲水性和化学上的不解离性,对药物有较好的助溶作用,在药物制剂中常添加其以增加有效成分的溶解度;另一方面,聚山梨醇20能抑制大分子蛋白药物的自动聚合,提高药物的稳定性。但是随着近年来药理学研究的深入,人们认识到聚山梨酯类表面活性剂具有一定生物和药理活性,它能够诱导细胞产生脱颗粒作用,引起过敏活性物质释放,其本身的不饱和脂肪酸也十分容易氧化降解而产生多种有毒成分,与药物临床上出现的呼吸困难、恶心、呕吐、皮疹等不良反应相关(朱文漓,等.rp-hplc-elsd法测定康柏西普眼用注射液中辅料吐温20的含量[j].药物分析杂志,2014,34(6):1073-1076)。
[0004]
但是现有技术披露的阿柏西普眼用制剂(组合物)大多数仍然含有聚山梨醇20等表面活性剂。如公开号cn109475597a(公开日2019年3月15日)的中国发明专利申请公开了一种眼用药物组合物,包含治疗有效量的阿柏西普、醋酸钠缓冲剂、蔗糖、聚氧乙烯(20)脱水山梨糖醇单月桂酸酯(即吐温20)和水性介质。再如,公开号cn109937034a(公开日2019年6月25日)的中国发明专利申请公开了一种阿柏西普制剂,包含治疗阿柏西普、磷酸盐缓冲剂、非离子表面活性剂(是聚山梨醇酯或泊洛沙姆)、张度调节剂(蔗糖或海藻糖)。公开号cn111356471a(公开日2020年6月30日)的中国发明专利申请公开了一种阿柏西普制剂,包含治疗阿柏西普、磷酸盐缓冲剂、非离子表面活性剂(是聚山梨醇酯或泊洛沙姆)、赖氨酸盐。
技术实现要素:
[0005]
为了克服现有技术的不足,本发明提供一种稳定的,不含表面活性剂,尤其是不含聚山梨醇酯的阿柏西普制剂。
[0006]
为此,本发明提供一种阿柏西普制剂,ph=5.8-6.4,由以下成分组成:
[0007]
(a)浓度为10-70mg/ml的阿柏西普;
[0008]
(b)浓度为10-300mmol/l的磷酸盐缓冲剂;
[0009]
(c)浓度为0-200mmol/l的氯化钠;
[0010]
(d)余量的水。
[0011]
优选地,所述阿柏西普的浓度为30-50mg/ml。
[0012]
更优选地,所述阿柏西普的浓度为36-44mg/ml。
[0013]
优选地,所述磷酸盐缓冲剂的浓度为10-150mmol/l。
[0014]
优选地,所述磷酸盐缓冲剂为磷酸二氢钠-磷酸氢二钠。
[0015]
优选地,所述氯化钠的浓度为0-150mmol/l。
[0016]
优选地,所述阿柏西普制剂的ph=5.8-6.2,更优选为6.2。
[0017]
作为一个替代的实施方案,本发明所述阿柏西普制剂还可以含有重量体积百分比浓度不超过10%的蔗糖,优选含有重量体积百分比浓度不超过5%的蔗糖。
[0018]
本发明还有一个目的在于提供上述阿柏西普制剂的制备方法。
[0019]
一方面,不含蔗糖的所述阿柏西普制剂的制备方法,包括如下步骤:
[0020]
1-1缓冲液a的配制:称量磷酸二氢钠和氯化钠,用注射用水溶解并稀释至磷酸二氢钠浓度为10-300mmol/l,氯化钠的浓度为0-200mmol/l,搅拌混合均匀;
[0021]
1-2缓冲液b的配制:称量磷酸氢二钠和氯化钠,用注射用水溶解并稀释至磷酸氢二钠浓度为10-300mmol/l,氯化钠的浓度为0-200mmol/l,搅拌混合均匀;
[0022]
1-3最终缓冲液的配制:将缓冲液a加入至等体积的缓冲液b中,调节ph至5.8-6.4,得到最终缓冲液;
[0023]
2.成品制备
[0024]
2-1蛋白浓缩:将纯化后的阿柏西普原料超滤浓缩,至蛋白浓度达到10-70mg/ml,测定蛋白液体积;
[0025]
2-2置换操作:加入与步骤2-1得到的浓缩后的蛋白液等体积的所述最终缓冲液,混匀并超滤浓缩至蛋白浓度为10-70mg/ml;重复上述置换操作,至超滤系统透过端流出液体与所述最终缓冲液的ph和电导率相同或相近,得到置换缓冲液后的阿柏西普;
[0026]
2-3.过滤、分装:将置换缓冲液后的阿柏西普无菌过滤,分装,即得。
[0027]
另一方面,含蔗糖的所述阿柏西普制剂的制备方法,包括如下步骤:
[0028]
1.缓冲液配制
[0029]
1-1缓冲液a的配制:称量磷酸二氢钠、氯化钠和蔗糖,用注射用水溶解并稀释至磷酸二氢钠浓度为10-300mmol/l,氯化钠的浓度为0-200mmol/l,蔗糖的重量百分比浓度不超过10%,搅拌混合均匀;
[0030]
1-2缓冲液b的配制:称量磷酸氢二钠、氯化钠和蔗糖,用注射用水溶解并稀释至磷酸氢二钠浓度为10-300mmol/l,氯化钠的浓度为0-200mmol/l,蔗糖的重量百分比浓度为不超过10%,搅拌混合均匀;
[0031]
1-3最终缓冲液的配制:将缓冲液a加入至等体积的缓冲液b中,调节ph至5.8-6.4,得到最终缓冲液;
[0032]
2.成品制备
[0033]
2-1蛋白浓缩:将纯化后的阿柏西普原料超滤浓缩,至蛋白浓度达到10-70mg/ml,测定蛋白液体积;
[0034]
2-2置换操作:加入与步骤2-1得到的浓缩后的蛋白液等体积的所述最终缓冲液,混匀并超滤浓缩至蛋白浓度为10-70mg/ml;重复上述置换操作,至超滤系统透过端流出液体与所述最终缓冲液的ph和电导率相同或相近,得到置换缓冲液后的阿柏西普;
[0035]
2-3.过滤、分装:将置换缓冲液后的阿柏西普无菌过滤,分装,即得。
[0036]
上述两种制备方法中,优选地,所述步骤1-1中,磷酸二氢钠的浓度为10-150mmol/l,氯化钠的浓度为0-150mmol/l;
[0037]
优选地,所述步骤1-2中,磷酸氢二钠的浓度为10-150mmol/l,氯化钠的浓度为0-150mmol/l;
[0038]
优选地,所述缓冲液b中,磷酸氢二钠的浓度与所述缓冲液a中的磷酸二氢钠的浓度相同,氯化钠的浓度分别与所述缓冲液a中的氯化钠的浓度相同;
[0039]
还优选地,所述步骤1-3中,调节ph至5.8-6.2;更优选地,调节ph至6.2;
[0040]
优选地,所述步骤2-1中,超滤透过速度为20-30ml/min,压力不大于20psi;
[0041]
优选地,所述步骤2-1和步骤2-2中,超滤浓缩至蛋白浓度为30-50mg/ml;
[0042]
更优选地,所述步骤2-1和步骤2-2中,超滤浓缩至蛋白浓度为36-44mg/ml。
[0043]
上述含蔗糖的阿柏西普制剂的制备方法,优选地,所述缓冲液a和缓冲液b中,蔗糖的重量体积百分比浓度各自独立地不超过5%;更优选的,所述缓冲液b中,蔗糖的浓度与所述缓冲液a中的蔗糖的浓度相同。
[0044]
作为一种替代的实施方案,上述两种制备方法中,所述步骤2的操作还可以是:
[0045]
2-1蛋白浓缩:将纯化后的阿柏西普原料超滤浓缩,至蛋白浓度达到50-72mg/ml,测定蛋白液体积;
[0046]
2-2置换操作:加入与步骤2-1得到的浓缩后的蛋白液等体积的所述最终缓冲液,混匀并超滤浓缩至蛋白浓度为50-72mg/ml;重复上述置换操作,至超滤系统透过端流出液体与所述最终缓冲液的ph和电导率相同或相近,用所述最终缓冲液冲洗超滤系统管路,收集冲洗液并加入至所述置换缓冲液后的阿柏西普中,使蛋白浓度为36-44mg/ml,得到置换缓冲液后的阿柏西普;
[0047]
2-3.过滤、分装:将置换缓冲液后的阿柏西普无菌过滤,分装,即得。
[0048]
优选地,上述制备方法中,所述步骤2-3中,所述无菌过滤的具体操作为:在无菌环境下,用0.22μm滤膜过滤。
[0049]
优选地,上述制备方法中,所述步骤2-3中,所述分装体积为0.1ml/支。
[0050]
上述制备方法中所用的阿柏西普原料可以参考现有技术已经公开的方法制备,如公开号cn101001645a中记载的方法。
[0051]
本发明还有一个目的在于提供上述阿柏西普制剂或通过上述制备方法得到的阿柏西普制剂在制备新生血管型年龄相关性黄斑病变(amd)和crvo后的视网膜水肿的药物中的应用。
[0052]
在本文中,如无特殊说明,所述“水”为注射用水。
[0053]
与现有技术中相比,本发明提供的阿柏西普制剂不含表面活性剂,因此安全性更好。但是令人意想不到的是,本发明所述阿柏西普制剂的稳定性也得到了提高,甚至好于原
研药
附图说明
[0054]
以下结合附图,对本发明做进一步说明。
[0055]
图1示出的是测试例2中,实施例1制备的阿柏西普制剂在30℃,12周的稳定性考察中0时和12周的sec-hplc色谱图,图中的主峰是阿柏西普的色谱峰;其中1a是0时的sec-hplc色谱图,1b是12周时的sec-hplc色谱图。
[0056]
图2示出的是测试例2中,对比例1制备的阿柏西普制剂在30℃,12周的稳定性考察中0时和12周的sec-hplc色谱图,图中的主峰是阿柏西普的色谱峰;其中2a是0时的sec-hplc色谱图,2b是12周时的sec-hplc色谱图。
[0057]
图3示出的是测试例2中,对比例2制备的阿柏西普制剂在30℃,12周的稳定性考察中0时和12周的sec-hplc色谱图,图中的主峰是阿柏西普的色谱峰;其中3a是0时的sec-hplc色谱图,3b是12周时的sec-hplc色谱图。
具体实施方式
[0058]
以下参照具体的实施例来说明本发明。本领域技术人员能够理解,这些实施例仅用于说明本发明,其不以任何方式限制本发明的范围。借鉴以下内容对本发明所做的所有类似的替换和改动,对本领域技术人员来说都是显而易见的,它们都被视为包括在本发明范围内。
[0059]
下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的原料、试剂材料等,如无特殊说明,均为市售购买产品。
[0060]
阿柏西普:阿柏西普原液由通化东宝药业股份有限公司生物药物研究院纯化实验室提供。该原液ph5.9-6.5,阿柏西普纯度主峰占峰总面积比例不低于98.0%,聚合物不高于2%,8-12mol唾液酸/mol阿柏西普。
[0061]
以下测试例和研究例中所用的sec-hplc检测的色谱条件为:
[0062]
色谱柱:nanochrom biocore sec-300 7.8mmol/l*300mm,5μm或等效色谱柱
[0063]
流动相:25mmol/l磷酸盐/500mmol/l氯化钾缓冲液(ph7.5);等度洗脱30min;
[0064]
流速:0.5ml/min;
[0065]
柱温:30℃;
[0066]
检测仪器:waters e2695,紫外检测器,波长:215nm;
[0067]
供试品浓度:1.0mg/ml;
[0068]
进样量:10μl。
[0069]
实施例1一种阿柏西普的制剂
[0070]
本实施例的阿柏西普制剂,ph=6.2,由以下成分组成:
[0071]
(a)浓度为40mg/ml的阿柏西普;
[0072]
(b)浓度为10mmol/l的磷酸二氢钠-磷酸氢二钠缓冲剂;
[0073]
(c)浓度为135.2mmol/l的氯化钠;
[0074]
(d)余量的水。
[0075]
通过如下方法制备:
[0076]
1.缓冲液配制:
[0077]
1-1.缓冲液a的配制:称量磷酸二氢钠和氯化钠,加入注射用水定容至总体积7000ml,使磷酸二氢钠的浓度为10mmol/l,氯化钠浓度为135.2mmol/l,搅拌混合均匀。
[0078]
1-2.缓冲液b的配制:称量磷酸氢二钠和氯化钠,加入注射用水定容至总体积7000ml,使磷酸氢二钠的浓度为10mmol/l,氯化钠浓度为135.2mmol/l,搅拌混合均匀。
[0079]
1-3.最终缓冲液的配制:将缓冲液a加入至缓冲液b中,调节ph至6.2,即得最终缓冲液。
[0080]
2.成品制备:
[0081]
2-1.蛋白浓缩:将纯化后的阿柏西普蛋白倒入超滤系统样品杯中,启动超滤系统,使透过速度在20-30ml/min,压力不大于20psi;浓缩至蛋白浓度为50-72mg/ml(用超微量分光光度计测定蛋白浓度),记录浓缩蛋白液的体积。
[0082]
2-2.置换缓冲液:将与浓缩蛋白液等体积的所述最终缓冲液加入超滤系统样品杯中,混匀并浓缩至蛋白浓度为50-72mg/ml,再加入等体积的所述最终缓冲液,重复上述置换操作8次;每次置换后检测透过端液体的ph、电导率,直至超滤系统透过端流出液体与配制的缓冲液ph和电导率相同或相近,用适量所述最终缓冲液冲洗超滤系统管路,收集冲洗液并加入置换缓冲液后的阿柏西普,使蛋白浓度为40mg/ml,得到置换缓冲液后的阿柏西普。
[0083]
2-3.过滤、分装:将所得置换缓冲液后的阿柏西普在无菌环境下用0.22μm滤膜过滤并分装至西林瓶中,分装体积为0.1ml/支,共1000支。
[0084]
实施例2一种阿柏西普的制剂
[0085]
本实施例的阿柏西普制剂,ph=6.2,由以下成分组成:
[0086]
(a)浓度为40mg/ml的阿柏西普;
[0087]
(b)浓度为10mmol/l的磷酸二氢钠-磷酸氢二钠缓冲剂;
[0088]
(c)余量的水。
[0089]
通过如下方法制备:
[0090]
1.缓冲液配制:
[0091]
1-1.缓冲液a的配制:称量磷酸二氢钠,加入注射用水定容至总体积7000ml,使磷酸二氢钠的浓度为10mmol/l,搅拌混合均匀。
[0092]
1-2.缓冲液b的配制:称量磷酸氢二钠,加入注射用水定容至总体积7000ml,使磷酸氢二钠的浓度为10mmol/l,搅拌混合均匀。
[0093]
1-3.最终缓冲液的配制:将缓冲液a加入至缓冲液b中,调节ph至6.2,即得最终缓冲液。
[0094]
2.成品制备:
[0095]
2-1.蛋白浓缩:将纯化后的阿柏西普蛋白倒入超滤系统样品杯中,启动超滤系统,使透过速度在20-30ml/min,压力不大于20psi;浓缩至蛋白浓度为50-72mg/ml(用超微量分光光度计测定蛋白浓度),记录浓缩蛋白液的体积。
[0096]
2-2.置换缓冲液:将与浓缩蛋白液等体积的所述最终缓冲液加入超滤系统样品杯中,混匀并浓缩至蛋白浓度为50-72mg/ml;再加入等体积的所述最终缓冲液,重复上述置换操作8次;每次置换后检测透过端液体的ph、电导率,直至超滤系统透过端流出液体与配制的缓冲液ph和电导率相同或相近,用适量所述最终缓冲液冲洗超滤系统管路,收集冲洗液
并加入置换缓冲液后的阿柏西普,使蛋白浓度为40mg/ml,得到置换缓冲液后的阿柏西普。
[0097]
2-3.过滤、分装:将所得置换缓冲液后的阿柏西普在无菌环境下用0.22μm滤膜过滤并分装至西林瓶中,分装体积为0.1ml/支,共1000支。
[0098]
实施例3一种阿柏西普的制剂
[0099]
本实施例的阿柏西普制剂,ph=6.2,由以下成分组成:
[0100]
(a)浓度为40mg/ml的阿柏西普;
[0101]
(b)浓度为220mmol/l的磷酸二氢钠-磷酸氢二钠缓冲剂;
[0102]
(c)余量的水。
[0103]
通过如下方法制备:
[0104]
1.缓冲液配制:
[0105]
1-1.缓冲液a的配制:称量磷酸二氢钠,加入注射用水定容至总体积7000ml,使磷酸二氢钠的浓度为220mmol/l,搅拌混合均匀。
[0106]
1-2.缓冲液b的配制:称量磷酸氢二钠,加入注射用水定容至总体积7000ml,使磷酸氢二钠的浓度为220mmol/l,搅拌混合均匀。
[0107]
1-3.最终缓冲液的配制:将缓冲液a加入至缓冲液b中,调节ph至6.2,即得最终缓冲液。
[0108]
2.成品制备:
[0109]
2-1.蛋白浓缩:将纯化后的阿柏西普蛋白倒入超滤系统样品杯中,启动超滤系统,使透过速度在20-30ml/min,压力不大于20psi;浓缩至蛋白浓度为50-72mg/ml(用超微量分光光度计测定蛋白浓度),记录浓缩蛋白液的体积。
[0110]
2-2.置换缓冲液:将与浓缩蛋白液等体积的所述最终缓冲液加入超滤系统样品杯中,混匀并浓缩至蛋白浓度为50-72mg/ml;再加入等体积的所述最终缓冲液,重复上述置换操作8次;每次置换后检测透过端液体的ph、电导率,直至超滤系统透过端流出液体与配制的缓冲液ph和电导率相同或相近,用适量所述最终缓冲液冲洗超滤系统管路,收集冲洗液并加入置换缓冲液后的阿柏西普,使蛋白浓度为40mg/ml,得到置换缓冲液后的阿柏西普。
[0111]
2-3.过滤、分装:将所得置换缓冲液后的阿柏西普在无菌环境下用0.22μm滤膜过滤并分装至西林瓶中,分装体积为0.1ml/支,共1000支。
[0112]
实施例4一种阿柏西普的制剂
[0113]
本实施例的阿柏西普制剂,ph=6.2,由以下成分组成:
[0114]
(a)浓度为40mg/ml的阿柏西普;
[0115]
(b)浓度为150mmol/l的磷酸二氢钠-磷酸氢二钠缓冲剂;
[0116]
(c)浓度为80mmol/l的氯化钠;
[0117]
(d)余量的水。
[0118]
通过如下方法制备:
[0119]
1.缓冲液配制:
[0120]
1-1.缓冲液a的配制:称量磷酸二氢钠和氯化钠,加入注射用水定容至总体积7000ml,使磷酸二氢钠的浓度为150mmol/l,氯化钠浓度为80mmol/l,搅拌混合均匀。
[0121]
1-2.缓冲液b的配制:称量磷酸氢二钠和氯化钠,加入注射用水定容至总体积7000ml,使磷酸氢二钠的浓度为150mmol/l,氯化钠浓度为80mmol/l,搅拌混合均匀。
[0122]
1-3.最终缓冲液的配制:将缓冲液a加入至缓冲液b中,调节ph至6.2,即得最终缓冲液。
[0123]
2.成品制备:
[0124]
2-1.蛋白浓缩:将纯化后的阿柏西普蛋白倒入超滤系统样品杯中,启动超滤系统,使透过速度在20-30ml/min,压力不大于20psi;浓缩至蛋白浓度为50-72mg/ml(用超微量分光光度计测定蛋白浓度),记录浓缩蛋白液的体积。
[0125]
2-2.置换缓冲液:将与浓缩蛋白液等体积的所述最终缓冲液加入超滤系统样品杯中,混匀并浓缩至蛋白浓度为50-72mg/ml;再加入等体积的所述最终缓冲液,重复上述置换操作8次;每次置换后检测透过端液体的ph、电导率,直至超滤系统透过端流出液体与配制的缓冲液ph和电导率相同或相近,用适量所述最终缓冲液冲洗超滤系统管路,收集冲洗液并加入置换缓冲液后的阿柏西普,使蛋白浓度为40mg/ml,得到置换缓冲液后的阿柏西普。
[0126]
2-3.过滤、分装:将所得置换缓冲液后的阿柏西普在无菌环境下用0.22μm滤膜过滤并分装至西林瓶中,分装体积为0.1ml/支,共1000支。
[0127]
实施例5一种阿柏西普的制剂
[0128]
本实施例的阿柏西普制剂,ph=6.2,由以下成分组成:
[0129]
(a)浓度为40mg/ml的阿柏西普;
[0130]
(b)浓度为10mmol/l的磷酸二氢钠-磷酸氢二钠缓冲剂;
[0131]
(c)浓度为40mmol/l的氯化钠;
[0132]
(d)重量体积百分比浓度为5%的蔗糖;
[0133]
(c)余量的水。
[0134]
通过如下方法制备:
[0135]
1.缓冲液配制:
[0136]
1-1.缓冲液a的配制:称量磷酸二氢钠和氯化钠,加入注射用水定容至总体积7000ml,使磷酸二氢钠的浓度为10mmol/l,氯化钠浓度为40mmol/l,蔗糖重量体积百分比浓度为5%,搅拌混合均匀。
[0137]
1-2.缓冲液b的配制:称量磷酸氢二钠和氯化钠,加入注射用水定容至总体积7000ml,使磷酸氢二钠的浓度为10mmol/l,氯化钠浓度为40mmol/l,蔗糖重量体积百分比浓度为5%,搅拌混合均匀。
[0138]
1-3.最终缓冲液的配制:将缓冲液a加入至缓冲液b中,调节ph至6.2,即得最终缓冲液。
[0139]
2.成品制备:
[0140]
2-1.蛋白浓缩:将纯化后的阿柏西普蛋白倒入超滤系统样品杯中,启动超滤系统,使透过速度在20-30ml/min,压力不大于20psi;浓缩至蛋白浓度为50-72mg/ml(用超微量分光光度计测定蛋白浓度),记录浓缩蛋白液的体积。
[0141]
2-2.置换缓冲液:将与浓缩蛋白液等体积的所述最终缓冲液加入超滤系统样品杯中,混匀并浓缩至蛋白浓度为50-72mg/ml;再加入等体积的所述最终缓冲液,重复上述置换操作8次;每次置换后检测透过端液体的ph、电导率,直至超滤系统透过端流出液体与配制的缓冲液ph和电导率相同或相近,用适量所述最终缓冲液冲洗超滤系统管路,收集冲洗液并加入置换缓冲液后的阿柏西普,使蛋白浓度为40mg/ml,得到置换缓冲液后的阿柏西普。
[0142]
2-3.过滤、分装:将所得置换缓冲液后的阿柏西普在无菌环境下用0.22μm滤膜过滤并分装至西林瓶中,分装体积为0.1ml/支,共1000支。
[0143]
实施例6一种阿柏西普的制剂
[0144]
本实施例的阿柏西普制剂,ph=6.2,由以下成分组成:
[0145]
(a)浓度为40mg/ml的阿柏西普;
[0146]
(b)浓度为110mmol/l的磷酸二氢钠-磷酸氢二钠缓冲剂;
[0147]
(c)重量体积百分比浓度为5%的蔗糖;
[0148]
(d)余量的水。
[0149]
通过如下方法制备:
[0150]
1.缓冲液配制:
[0151]
1-1.缓冲液a的配制:称量磷酸二氢钠和氯化钠,加入注射用水定容至总体积7000ml,使磷酸二氢钠的浓度为110mmol/l,蔗糖重量体积百分比浓度为5%,搅拌混合均匀。
[0152]
1-2.缓冲液b的配制:称量磷酸氢二钠和氯化钠,加入注射用水定容至总体积7000ml,使磷酸氢二钠的浓度为110mmol/l,蔗糖重量体积百分比浓度为5%,搅拌混合均匀。
[0153]
1-3.最终缓冲液的配制:将缓冲液a加入至缓冲液b中,调节ph至6.2,即得最终缓冲液。
[0154]
2.成品制备:
[0155]
2-1.蛋白浓缩:将纯化后的阿柏西普蛋白倒入超滤系统样品杯中,启动超滤系统,使透过速度在20-30ml/min,压力不大于20psi;浓缩至蛋白浓度为50-72mg/ml(用超微量分光光度计测定蛋白浓度),记录浓缩蛋白液的体积。
[0156]
2-2.置换缓冲液:将与浓缩蛋白液等体积的所述最终缓冲液加入超滤系统样品杯中,混匀并浓缩至蛋白浓度为50-72mg/ml;再加入等体积的所述最终缓冲液,重复上述置换操作8次;每次置换后检测透过端液体的ph、电导率,直至超滤系统透过端流出液体与配制的缓冲液ph和电导率相同或相近,用适量所述最终缓冲液冲洗超滤系统管路,收集冲洗液并加入置换缓冲液后的阿柏西普,使蛋白浓度为40mg/ml,得到置换缓冲液后的阿柏西普。
[0157]
2-3.过滤、分装:将所得置换缓冲液后的阿柏西普在无菌环境下用0.22μm滤膜过滤并分装至西林瓶中,分装体积为0.1ml/支,共1000支。
[0158]
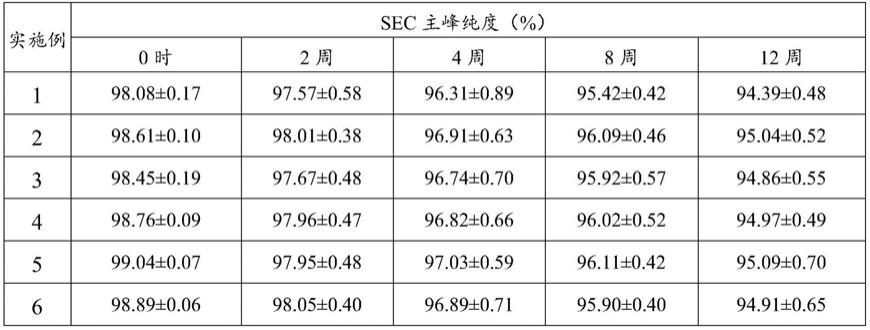
测试例1实施例1-6的阿柏西普制剂的加速稳定性
[0159]
将实施例1-6制备得到的阿柏西普制剂样品在高温条件(30℃)下储存12周,评价物理稳定性(sec-hplc测定主峰纯度(sec高分子蛋白:中国药典2015版通则)、可见异物、不溶性微粒(参考中国药典2015版通则0903))。结果见表1和表2。
[0160]
表1sec-hplc检测结果(30℃12周)
[0161][0162]
表2可见异物检测结果(30℃12周)
[0163]
实施例0时2周4周8周12周1澄明溶液澄明溶液澄明溶液澄明溶液澄明溶液2澄明溶液澄明溶液澄明溶液澄明溶液澄明溶液3澄明溶液澄明溶液澄明溶液澄明溶液澄明溶液4澄明溶液澄明溶液澄明溶液澄明溶液澄明溶液5澄明溶液澄明溶液澄明溶液澄明溶液澄明溶液6澄明溶液澄明溶液澄明溶液澄明溶液澄明溶液
[0164]
对比例1一种含表面活性剂的阿柏西普制剂
[0165]
本实施例的阿柏西普制剂,ph=6.2,由以下成分组成:
[0166]
(a)浓度为40mg/ml的阿柏西普;
[0167]
(b)浓度为10mmol/l的磷酸二氢钠-磷酸氢二钠缓冲剂;
[0168]
(c)浓度为40mmol/l的氯化钠;
[0169]
(d)重量体积百分比浓度为5%的蔗糖;
[0170]
(e)重量体积百分比浓度为0.03%的聚山梨醇酯20(吐温20)
[0171]
(d)余量的水。
[0172]
通过如下方法制备:
[0173]
1.缓冲液配制:
[0174]
1-1.缓冲液a的配制:称量磷酸二氢钠、氯化钠、蔗糖,加入注射用水定容至总体积7000ml,使磷酸二氢钠的浓度为10mmol/l,氯化钠浓度为40mmol/l,蔗糖重量体积百分比浓度为5%,搅拌混合均匀。
[0175]
1-2.缓冲液b的配制:称量磷酸氢二钠、氯化钠、蔗糖,加入注射用水定容至总体积7000ml,使磷酸氢二钠的浓度为10mmol/l,氯化钠浓度为40mmol/l,蔗糖重量体积百分比浓度为5%,搅拌混合均匀。
[0176]
1-3.最终缓冲液的配制:将缓冲液a加入至缓冲液b中,调节ph至6.2,即得最终缓冲液。
[0177]
2.成品制备:
[0178]
2-1.蛋白浓缩:将纯化后的阿柏西普蛋白倒入超滤系统样品杯中,启动超滤系统,使透过速度在20-30ml/min,压力不大于20psi;浓缩至蛋白浓度为50-72mg/ml(用超微量分光光度计测定蛋白浓度),记录浓缩蛋白液的体积。
[0179]
2-2.置换缓冲液:将与浓缩蛋白液等体积的所述最终缓冲液加入超滤系统样品杯中,混匀并浓缩至蛋白浓度为50-72mg/ml;再加入等体积的所述最终缓冲液,重复上述置换操作8次;每次置换后检测透过端液体的ph、电导率,直至超滤系统透过端流出液体与配制的缓冲液ph和电导率相同或相近,用适量所述最终缓冲液冲洗超滤系统管路,收集冲洗液并加入置换缓冲液后的阿柏西普,使蛋白浓度为40mg/ml,得到置换缓冲液后的阿柏西普。
[0180]
2-3.过滤、分装:向所得的置换缓冲液后的阿柏西普中加入聚山梨酯20,使聚山梨酯20重量体积百分比浓度为0.03%,混合均匀。将所得蛋白液在无菌环境下用0.22μm滤膜过滤并分装至西林瓶中,分装体积为0.1ml/支,共1000支。
[0181]
对比例2一种含表面活性剂的阿柏西普制剂
[0182]
本实施例的阿柏西普制剂,ph=6.2,由以下成分组成:
[0183]
(a)浓度为40mg/ml的阿柏西普;
[0184]
(b)浓度为10mmol/l的组氨酸-组氨酸盐酸盐缓冲剂;
[0185]
(c)浓度为40mmol/l的氯化钠;
[0186]
(d)重量体积百分比浓度为5%的蔗糖;
[0187]
(e)重量体积百分比浓度为0.03%的聚山梨醇酯20(吐温20)
[0188]
(d)余量的水。
[0189]
通过如下方法制备:
[0190]
1.缓冲液配制:
[0191]
1-1.缓冲液a的配制:称量组氨酸、氯化钠、蔗糖,加入注射用水定容至总体积7000ml,使组氨酸的浓度为10mmol/l,氯化钠浓度为40mmol/l,蔗糖重量体积百分比浓度为5%,搅拌混合均匀。
[0192]
1-2.缓冲液b的配制:称量组氨酸盐酸盐、氯化钠、蔗糖,加入注射用水定容至总体积7000ml,使组氨酸盐酸盐的浓度为10mmol/l,氯化钠浓度为40mmol/l,蔗糖重量体积百分比浓度为5%,搅拌混合均匀。
[0193]
1-3.最终缓冲液的配制:将缓冲液a加入至缓冲液b中,调节ph至6.2,即得最终缓冲液。
[0194]
2.成品制备:
[0195]
2-1.蛋白浓缩:将纯化后的阿柏西普蛋白倒入超滤系统样品杯中,启动超滤系统,使透过速度在20-30ml/min,压力不大于20psi;浓缩至蛋白浓度为50-72mg/ml(用超微量分光光度计测定蛋白浓度),记录浓缩蛋白液的体积。
[0196]
2-2.置换缓冲液:将与浓缩蛋白液等体积的所述最终缓冲液加入超滤系统样品杯中,混匀并浓缩至蛋白浓度为50-72mg/ml;再加入等体积的所述最终缓冲液,重复上述置换操作8次;每次置换后检测透过端液体的ph、电导率,直至超滤系统透过端流出液体与配制的缓冲液ph和电导率相同或相近,用适量所述最终缓冲液冲洗超滤系统管路,收集冲洗液并加入置换缓冲液后的阿柏西普,使蛋白浓度为40mg/ml,得到置换缓冲液后的阿柏西普。
[0197]
2-3.过滤、分装:向所得置换缓冲液后的阿柏西普中加入聚山梨酯20,使聚山梨酯20重量体积百分比浓度为0.03%,混合均匀。将所得蛋白液在无菌环境下用0.22μm滤膜过滤并分装至西林瓶中,分装体积为0.1ml/支,共1000支。
[0198]
测试例2实施例1和对比例1、对比例2的阿柏西普制剂的稳定性考察
[0199]
取实施例1、对比例1和对比例2制备的阿柏西普制剂,相同条件下平行进行稳定性考察。
[0200]
1.30℃,12周
[0201]
将各组样品(250支/组)都置于30℃恒温箱中12周,分别在0时、2周、4周、8周和12周用sec-hplc检测主峰纯度以及进行可见异物检测,各组sec-hplc检测的主峰纯度取平均值。结果见表3和表4。实施例1、对比例1和对比例2样品0时和12周的sec-hplc图谱分别见图1-图3。
[0202]
表3sec-hplc检测结果(30℃12周)
[0203][0204]
注:*结果与相同检测时间点的实施例1比较,.均值差的显著性水平p≤0.05。
[0205]
表4可见异物检测结果(30℃12周)
[0206]
样品0时2周4周8周12周实施例1澄明溶液澄明溶液澄明溶液澄明溶液澄明溶液对比例1澄明溶液澄明溶液澄明溶液澄明溶液澄明溶液对比例2澄明溶液澄明溶液澄明溶液澄明溶液澄明溶液
[0207]
2.25℃,6个月
[0208]
将各组样品(250支/组)都置于25℃恒温箱中6个月,分别在0时、1m、2m、3m和6m用sec-hplc检测主峰纯度以及进行可见异物检测,各组sec-hplc检测的主峰纯度取平均值。结果见表5和表6。
[0209]
表5sec-hplc检测结果(25℃6个月)
[0210][0211]
注:*结果与相同检测时间点的实施例1比较,.均值差的显著性水平p≤0.05。
[0212]
表6可见异物检测结果(25℃6个月)
[0213]
样品0时1m2m3m6m实施例1澄明溶液澄明溶液澄明溶液澄明溶液澄明溶液对比例1澄明溶液澄明溶液澄明溶液澄明溶液澄明溶液对比例2澄明溶液澄明溶液白色颗粒白色颗粒白色颗粒
[0214]
3.4℃,6个月
[0215]
将各组样品(250支/组)都置于4℃恒温箱中6个月,分别在0时、1m、2m、3m和6m用sec-hplc检测主峰纯度以及进行可见异物检测,各组sec-hplc检测的主峰纯度取平均值。结果见表7和表8。
[0216]
表7sec-hplc检测结果(4℃6个月)
[0217][0218]
注:*结果与相同检测时间点的实施例1比较,.均值差的显著性水平p≤0.05。
[0219]
表8可见异物检测结果(4℃6个月)
[0220]
样品0时1m2m3m6m实施例1澄明溶液澄明溶液澄明溶液澄明溶液澄明溶液对比例1澄明溶液澄明溶液澄明溶液澄明溶液澄明溶液对比例2澄明溶液澄明溶液白色颗粒白色颗粒白色颗粒
[0221]
从表3-表8的结果可以看出,本发明实施例1的阿柏西普制剂的稳定性在上述三种考察条件下均明显好于对比例1(原研制剂)和对比例2的制剂。尤其是与对比例1的制剂比较,本发明的制剂虽然省略了传统上认为可以提高蛋白溶解度和稳定性的表面活性剂聚山梨醇酯20(吐温20),但是制剂的稳定性没有降低反而提高,这样的技术效果是完全令人意想不到的。而且随着表面活性剂的免除,制剂的安全性也得到了提升,保证了临床用药的安全。
[0222]
研究例1缓冲剂的影响
[0223]
按照实施例1的制备方法,替换相应的缓冲剂,制备处方如下的阿柏西普制剂:
[0224]
处方1:阿柏西普40mg/ml,磷酸二氢钠及磷酸氢二钠10mmol/l,氯化钠135.2mmol/l,ph6.2;
[0225]
处方2:阿柏西普40mg/ml,组氨酸及组氨酸盐酸盐10mmol/l,氯化钠135.2mmol/l,ph6.2;
[0226]
处方3:阿柏西普40mg/ml,枸橼酸及枸橼酸钠10mmol/l,氯化钠135.2mmol/l,ph6.2。
[0227]
将上述三组制剂在长期(4℃,6个月)、加速(25℃,6个月)和高温(30℃,12周)下进行稳定性研究,评价物理稳定性(sec-hplc测定主峰纯度(sec高分子蛋白:中国药典2015版通则)、可见异物、不溶性微粒(参考中国药典2015版通则0903))。结果见表9-表14。
[0228]
表9sec-hplc检测结果(30℃12周)
[0229][0230]
注:*结果与相同检测时间点的处方1比较,.均值差的显著性水平p≤0.05。
[0231]
表10可见异物检测结果(30℃12周)
[0232]
处方缓冲剂0时2周4周8周12周1磷酸盐澄明溶液澄明溶液澄明溶液澄明溶液澄明溶液2组氨酸盐澄明溶液澄明溶液澄明溶液澄明溶液澄明溶液3枸橼酸盐澄明溶液澄明溶液澄明溶液澄明溶液澄明溶液
[0233]
表11sec-hplc检测结果(25℃6个月)
[0234][0235]
注:*结果与相同检测时间点的处方1比较,.均值差的显著性水平p≤0.05。
[0236]
表12可见异物检测结果(25℃6个月)
[0237]
处方缓冲液信息0时1m2m3m6m1磷酸盐澄明溶液澄明溶液澄明溶液澄明溶液澄明溶液2组氨酸盐澄明溶液澄明溶液白色颗粒白色颗粒白色颗粒3枸橼酸盐澄明溶液澄明溶液澄明溶液白色颗粒白色颗粒
[0238]
表13sec-hplc检测结果(4℃6个月)
[0239][0240]
注:*结果与相同检测时间点的处方1比较,.均值差的显著性水平p≤0.05。
[0241]
表14可见异物检测结果(4℃6个月)
[0242]
处方缓冲剂0时1m2m3m6m1磷酸盐澄明溶液澄明溶液澄明溶液澄明溶液澄明溶液2组氨酸澄明溶液澄明溶液澄明溶液白色颗粒白色颗粒3枸橼酸盐澄明溶液澄明溶液澄明溶液白色颗粒白色颗粒
[0243]
结论:
[0244]
表9-表14的数据和结果示出:在没有表面活性剂存在的情况下,以磷酸盐为缓冲剂的阿柏西普制剂的稳定性好于以组氨酸盐或枸橼酸盐为缓冲剂的阿柏西普制剂。
[0245]
研究例2制剂ph的确定
[0246]
以处方:阿柏西普40mg/ml,磷酸二氢钠10mmol/l,磷酸氢二钠10mmol/l,氯化钠132.5mmol/l,基本按照实施例1的制备方法制备10种阿柏西普制剂,不同之处在于制剂的ph分别为4.5、5.0、5.5、5.8、6.0、6.2、6.4、6.6、6.8、7.0。考察不同ph对阿柏西普稳定性的影响。将所述10种阿柏西普制剂样品在高温条件(30℃)下储存12周,通过sec-hplc、可见异物评价阿柏西普眼内稳定性。结果见表15和表16。
[0247]
表15sec-hplc检测结果(30℃12周)
[0248][0249]
注:*结果与相同检测时间点的实施例1比较,均值差的显著性水平p≤0.05。
[0250]
表16可见异物检测结果(30℃12周)
[0251][0252][0253]
结论:表15和表16的数据和结果示出:阿柏西普蛋白在ph5.8-6.4下比较稳定,在ph5.8-6.2下更稳定,在ph6.2左右稳定性最好。
[0254]
总之,本发明提供了一种新的阿柏西普制剂,该制剂不含表面活性剂,却令人意想不到地保持并提高了制剂的稳定性,且使制剂更安全。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1