SWELL1-LRRC8复合物调节剂
swell1-lrrc8复合物调节剂
技术领域
1.本发明涉及多种多环化合物和使用这些化合物来治疗多种与异常的swell1信号传导有关的疾病的方法,所述疾病包括代谢性疾病如肥胖、糖尿病、非酒精性脂肪性肝病;心血管疾病如高血压和中风;神经系统疾病;男性不育、肌肉失常和免疫缺陷。
背景技术:
2.肥胖诱发的糖尿病(2型糖尿病,t2d)正在达到流行病的比例,仅在美国就有超过三分之一的人肥胖(36%),》2900万人患有糖尿病,并且约8600万人患有前期糖尿病(在2014年,cdc)。仅在美国,肥胖和糖尿病的经济后果接近5000亿美元。从全球来看,这甚至是更加严重的问题,其中在2014年2型糖尿病的发病率估计为4.22亿,并且计划的数量预计在未来十年内将超过7亿。非酒精性脂肪性肝病(nafld)与t2d高度相关,并且在美国和全球具有24%的患病率。nafld经常进展为晚期肝病、肝硬化和肝细胞癌,并且是美国目前继丙型肝炎之后第二大最常见的肝移植适应症。
3.虽然目前存在几种治疗2型糖尿病的商业上可获得的药物,但医生在有效治疗该疾病方面仍面临挑战,因为尽管有最佳的药物疗法,但相当大比例的患者仍然具有不良控制的血糖。药物疗法的失败与多种因素有关,包括窄的作用机制(胰岛素增敏剂相对于促分泌素相对于其他)、用药的不依从性(特别是对于具有频繁给药方案的药物)以及在避免危及生命的低血糖的同时达到正常血糖。此外,目前的几种疗法都具有不期望的和危险的副作用,例如充血性心力衰竭、体重增加和水肿,包括也用于nafld的tzd。
4.体积调节型阴离子通道(vrac)被认为是细胞肿胀诱导的阴离子通道。它们调节多种器官系统的重要功能,并且与糖尿病、肥胖、非酒精性脂肪性肝病、中风、高血压和其他病症相关的病理有关。包含富含亮氨酸重复序列的蛋白质8a(lrrc8a)(也被称为swell1)与其其他四种相关同系物(lrrc8b-e)形成异聚体vrac。
5.swell1(lrrc8a)是体积敏感型离子通道分子复合物的必需组分,其在脂肪细胞肥大的情况下被激活并且通过新的swell1-pi3k-akt2-glut4信号传导轴调节脂肪细胞大小、胰岛素信号传导和全身性血糖。脂肪细胞特异性swell1消融会破坏胰岛素-pi3k-akt2信号传导,在体内诱导胰岛素抗性和葡萄糖耐受不良。因此,swell1被认为是脂肪细胞胰岛素信号传导和葡萄糖稳态的阳性调节因子,特别是在肥胖的情况下。
6.除了受损的胰岛素敏感性外,2型糖尿病还通过来自胰腺β细胞的胰岛素分泌的相对丧失来表征。β细胞兴奋性的调节是控制胰岛素分泌和全身血糖的主要机制。事实上,目前糖尿病药物疗法的基石磺酰脲受体抑制剂(即格列本脲)旨在拮抗良好表征的抑制性超极化电流i
k,atp
,以促进β细胞去极化,激活电压门控钙通道(vgcc),从而触发胰岛素分泌。然而,为了使此类药剂有效,必须存在兴奋性电流以允许膜去极化。在β细胞中对于显著的肿胀激活的氯离子电流,需要使用swell1。swell1介导的vrac由葡萄糖介导的β细胞肿胀激活,提供β细胞去极化、葡萄糖刺激的ca2+信号传导和胰岛素分泌所需的基本去极化电流。
7.正常的swell1功能是正常的人免疫系统发育所必需的。在一个实例中,由swell1
的一个等位基因中的易位引起的截短的swell1蛋白的表达抑制正常的β细胞发育,引起无丙种球蛋白血症5(agammaglobulinemia 5)(agm5)(sawada,a等人《临床研究杂志(journal of clinical investigation)》2003;kubota,k等人,《欧洲生化学会联合会快报(febs lett)》2004)。由于不同类型的免疫系统细胞(例如,b淋巴细胞和t淋巴细胞)使用相似的细胞内信号传导通路,因此其他免疫系统细胞(例如,t淋巴细胞、巨噬细胞和/或nk细胞)的发育和/或功能也可能在充分的swell1功能中受到影响。
8.目前,对男性不育的分子原因仅有部分了解。在缺乏swell1的小鼠中,晚期精子细胞在发育为精子期间未能减少其细胞质,并且具有无组织的线粒体鞘和成角度的鞭毛,导致精子能动性降低。这表明,对于正常的精子细胞发育和男性生育力也需要swell1(luck,j.c.,《生物化学杂志(journal of biological chemistry)》2018)。
9.swell1和相关的vrac信号传导也与中风诱发的神经毒性和心血管疾病有关。
10.有证据表明,可以通过使用与swell1直接结合的化合物抑制或以其他方式调节swell1来治疗多种疾病。一种此类化合物是在wo2018/027175中描述的dcpib(4-[2[丁基-6,7-二氯-2-环戊基-2,3-二氢-1-氧代-1h-茚-5-基)氧基]丁酸)(在本文中被称为smod1),其对lrrc8a具有亲和力。然而,存在对具有改善的亲和力和代谢概况并且靶向更大种类的lrrc8同系物的化合物的需求。此类化合物可用于糖尿病、肥胖、非酒精性脂肪性肝病、中风、高血压、免疫缺陷、男性不育和其他病症的改进的疗法。
技术实现要素:
[0011]
本发明的各个方面涉及式(i)的化合物及其盐:
[0012][0013]
其中:
[0014]
r1和r2各自独立地是氢、取代或未取代的烷基、取代或未取代的烯基、取代或未取代的烷氧基、取代或未取代的芳基、取代或未取代的杂芳基;
[0015]
r3为
–y–
c(o)r4、
–z–
n(r5)(r6)或
–z–
a;
[0016]
r4是氢、取代或未取代的烷基、
–
or7或
–
n(r8)(r9);
[0017]
x1和x2各自独立地为取代或未取代的烷基、卤素、
–
or
10
或
–
n(r
11
)(r
12
);
[0018]
r5、r6、r7、r8、r9、r
10
、r
11
和r
12
各自独立地是氢或取代或未取代的烷基;
[0019]
y和z各自独立地是具有至少2个碳原子的取代或未取代的含碳部分;
[0020]
a是具有至少一个氮杂原子的取代或未取代的5元或6元杂环、硼酸或并且
[0021]
n是1或2。
[0022]
另外的方面涉及使用式(i)的化合物来治疗有需要的受试者的各种病症的各种方
法,所述病症包括胰岛素敏感性、肥胖、糖尿病、非酒精性脂肪性肝病、代谢性疾病、高血压、中风、血管紧张度、全身性动脉和/或肺动脉血压、血流量、男性不育、肌肉失常和/或免疫缺陷。通常,所述方法包括向所述受试者施用治疗有效量的式(i)的化合物。
[0023]
其他目的和特征在下文中将部分地显而易见并且被部分地指出。
附图说明
[0024]
图1.如本文所述的smod1/dcpib、smod4、smod2、smod3、smod5、smod6和snot1的化学结构。
[0025]
图2.smod化合物的i
cl,swell
抑制活性的膜片钳筛选。在应用(a)snot1:一种缺乏i
cl,swell
抑制活性的smod化合物,(b)维持活性的smod2,和(c)维持活性的smod3时,i
cl,swell
随时间的外向(黑色)和内向(蓝色)电流。
[0026]
图3.smod化合物的i
cl,swell
抑制活性的膜片钳筛选。在应用(a)snot1:一种缺乏i
cl,swell
抑制活性的smod化合物,(b)维持并增强活性的smod3,(c)维持活性的smod4,(d)维持活性的smod5时,i
cl,swell
随时间的外向(黑色)和内向(蓝色)电流。
[0027]
图4.绘制电流的比例(对照%)随smod3、smod1(+)和smod1(-)的浓度增加的剂量响应曲线。用红色虚线表示smod(+)的ec
50
,并且用蓝色虚线表示smod3的ec
50
。
[0028]
图5.smod1的合成以及适应smod化合物的合成的变更的代表性符号。通过双箭头来表示可以对合成本文所述的多种化合物的合成方案进行的修改。方法:i)alcl3,dcm,5℃至室温。ii)12n hcl。iii)1)多聚甲醛,二甲胺,乙酸,85℃。iv)dmf,85℃,v)h2so4。vi)kotbu,丁基碘化物。vii)吡啶-hcl,195℃。viii)brch2co2et,k2co3,dmf,60℃。ix)10n naoh。
[0029]
图6.通过smod3和smod5在3t3-f442a脂肪细胞中诱导swell1蛋白,但是通过媒介物或snot1没有诱导swell1蛋白。
[0030]
图7.使用媒介物以及5mg/kg/天smod3或smod1治疗5天的小鼠的代表性葡萄糖耐量测试数据、曲线下面积(auc)和空腹血糖。在hfd t2d小鼠中,smod3,而非snot1,可改善葡萄糖耐量(如通过曲线下曲线auc测量)和空腹血糖。每组中n=5只。*p《0.05、**p《0.01、***p《0.001。
[0031]
图8.肥胖t2d小鼠的葡萄糖耐量(16周,hfd):smod6前(黑色圆圈),smod6后(5mg/kg腹腔内注射5天,粉红色三角形),腹腔内媒介物注射后4周(蓝色菱形),以及停用smod6后4周(褐红色正方形)。
[0032]
图9.肥胖t2d小鼠的葡萄糖耐量(16周,hfd):腹腔内媒介物注射后4周(黑色圆圈),snot1后4周(5mg/kg腹腔内注射5天,蓝色正方形),以及smod6后4周(5mg/kg腹腔内注射5天,褐红色三角形)。
[0033]
图10.在孔中含smod1/dcpib的swell1同六聚体的低温电子显微镜结构。带负电荷的羧酸盐与来自swell1/lrrc8a和/或lrrc8b的带正电荷的精氨酸(r103)在孔收缩处发生静电相互作用。图改编自kern等人《生命科学在线(elife)》(2019)。
[0034]
图11.使用结构pdb id:6nzw将smod1对接到swell1中。(a)使用分子操作环境(moe)对接生成与在低温em结构(图8)中观察到的smod1的方向一致的对接姿态。(b)使用seesar与leadit软件包对接生成高于来自低温em结构的姿态得分的结合姿态,其中smod1
翻转了180度。(c)smod1与swell1的最高得分moe(红色)和seesar(黄色)对接姿态的叠加。
[0035]
图12.uipc-03-099化合物在10μm处的i
cl,swell
抑制活性的膜片钳筛选。
[0036]
图13.uipc-03-099化合物在5μm处的i
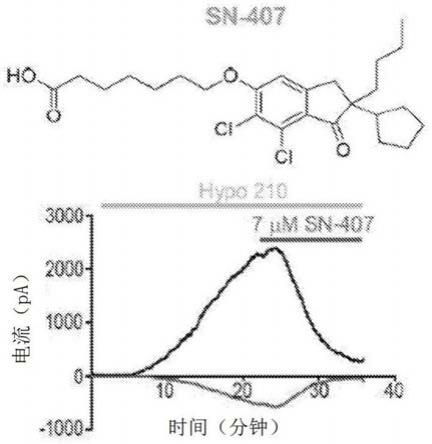
cl,swell
抑制活性的膜片钳筛选。
[0037]
图14.uipc-03-099化合物在5μm处的i
cl,swell
抑制活性的膜片钳筛选。
[0038]
图15.uipc-03-099化合物在5μm处的i
cl,swell
抑制活性的膜片钳筛选。
[0039]
图16.uipc-03-099化合物在1μm处的i
cl,swell
抑制活性的膜片钳筛选。
[0040]
图17示出了用于生成化合物sn-401、sn-403、sn-406、sn-407和sn071的反应方案。
[0041]
图18示出了用于生成sn072的反应方案。
[0042]
图19示出了用于生成sn-401的外消旋化合物的反应方案。
[0043]
图20a示出了在非t2d和t2d小鼠中在基线处测量的i
cl,swell
的电流-电压图(iso,黑色轨迹);和伴低渗(210mosm)刺激(hypo,灰色轨迹)。
[0044]
图20b示出了在非t2d和t2d人细胞中在基线处测量的i
cl,swell
的电流-电压图(iso,黑色轨迹);和伴低渗(210mosm)刺激(hypo,灰色轨迹)。
[0045]
图20c示出了来自非t2d(n=3个细胞)和t2d(n=6个细胞)小鼠细胞的+100mv和-100mv时的平均内向和外向i
cl,swell
电流密度。
[0046]
图20d示出了来自非t2d(n=6个细胞)和t2d(n=22个细胞)人细胞的+100mv和-100mv时的平均内向和外向i
cl,swell
电流密度。
[0047]
图20e显示来自从瘦#(n=7个细胞)、肥胖非t2d#(n=13个细胞)和t2d患者(n=5个细胞)的内脏脂肪分离的脂肪细胞在+100mv和-100mv时的平均内向和外向i
cl,swell
电流密度。#从zhang等人,2017先前报告的数据重新绘制的来自瘦和肥胖的非t2d脂肪细胞的数据,用于比较目的。
[0048]
图20f示出了与亲本对照品系kkaa(各n=5)相比,从多基因-t2d kkay小鼠分离的腹股沟脂肪组织中的swell1蛋白表达的蛋白质印迹。
[0049]
图20g示出了比较分别从瘦、肥胖的非t2d和肥胖的t2d患者分离的内脏脂肪组织中的swell1蛋白表达的蛋白质印迹。
[0050]
图20h示出了从非t2d和t2d供体(各n=3)的尸体胰岛中分离的swell1蛋白的蛋白质印迹。
[0051]
图21a示出了在野生型(wt,黑色)、swell1敲除(ko,浅灰色)和ko(ko+swell1 o/e,深灰色)3t3-f442a脂肪细胞(顶部图)中swell1的腺病毒过度表达中用0nm和10nm胰岛素刺激15分钟来检测swell1、pakt2、akt2和-肌动蛋白的蛋白质印迹。pakt2/-肌动蛋白的相应的密度计比率如下所示(对于每种条件n=3个独立实验)。除底部的图外,所有密度计测定值(densitometries)均被标准化为wt3t3-f442a前脂肪细胞的0nm胰岛素的值。数据被表示为平均值
±
sem。使用双尾非配对t检验,其中*、**和***分别表示p《0.05、p《0.01和p《0.001。
[0052]
图21b示出了来自wt(黑色,n=5个细胞)、ko(浅灰色,n=4个细胞)和ko+swell1o/e(深灰色,n=4个细胞)3t3-f442a前脂肪细胞在+100mv和-100mv时的平均内向和外向电流密度。数据被表示为平均值
±
sem。使用双尾非配对t检验,其中*、**和***分别表示p《0.05、p《0.01和p《0.001。
[0053]
图21c示出了比较在野生型(wt,黑色)中在0nm和10nm胰岛素刺激下的swell1、
pakt2、akt2和-肌动蛋白(c)的水平以及在wt(wt+swell1 o/e,灰色)3t3-f442a脂肪细胞中的swell1过表达的蛋白质印迹(对于每种条件n=6个独立实验)。pakt2/-肌动蛋白和总akt2的相应的密度计比率如下所示。除底部的图外,所有密度计测定值均被标准化为wt 3t3-f442a前脂肪细胞的0nm胰岛素的值。数据被表示为平均值
±
sem。使用双尾非配对t检验,其中*、**和***分别表示p《0.05、p《0.01和p《0.001。
[0054]
图21d示出了比较在野生型(wt,黑色)中在0nm和10nm胰岛素刺激下的pas160、as160和-肌动蛋白的水平以及在wt(wt+swell1 o/e,灰色)3t3-f442a脂肪细胞中的swell1过表达的蛋白质印迹(对于每种条件n=6个独立实验)。还示出了相应的密度计比率以及pas160/-肌动蛋白(右上方图)和总as160(右下方图)。除底部的图外,所有密度计测定值均被标准化为wt 3t3-f442a前脂肪细胞的0nm胰岛素的值。数据被表示为平均值
±
sem。使用双尾非配对t检验,其中*、**和***分别表示p《0.05、p《0.01和p《0.001。
[0055]
图21e示出了由低温电子显微镜(em)和x射线晶体学结构(pdb id:6g90#)获得的同聚体小鼠lrrc8a/swell1的卡通模型。结合在孔隙区域中的sn-401/dcpib源自dcpib结合的swell1低温em结构(pdb id:6nzw$;出于描述目的显示为二聚体)和sn-401化学结构(顶部图)。
[0056]
图21f示出了在hek-293细胞中,在低渗(210mosm)刺激和随后由10μm的sn-401抑制时,i
c1,swell
内向和外向电流随时间的变化。
[0057]
图21g示出了检测在wt 3t3-f442a前脂肪细胞中在0nm、3nm和10nm胰岛素刺激下的swell1、pakt2和-肌动蛋白的蛋白质印迹(对于每种条件n=2个独立实验,顶部图),以及相应的swell1/-肌动蛋白和pakt2/-肌动蛋白的密度计比率(底部图)。除底部的图外,所有密度计测定值均被标准化为wt 3t3-f442a前脂肪细胞的0nm胰岛素的值。数据被表示为平均值
±
sem。使用双尾非配对t检验,其中*、**和***分别表示p《0.05、p《0.01和p《0.001。
[0058]
图21h示出了检测在wt和ko 3t3-f442a脂肪细胞中在0nm和10nm胰岛素的情况下的swell1、pakt2、akt2和-肌动蛋白的蛋白质印迹(对于每种条件n=6个独立实验)。
[0059]
图21i示出了来自图21h中的swell1/-肌动蛋白的相应的密度计比率。除底部的图外,所有密度计测定值均被标准化为wt 3t3-f442a前脂肪细胞的0nm胰岛素的值。数据被表示为平均值
±
sem。使用双尾非配对t检验,其中*、**和***分别表示p《0.05、p《0.01和p《0.001。
[0060]
图21j示出了来自图21h的pakt/肌动蛋白(顶部图)和pakt2/akt2(底部图)的相应的密度计比率。将顶部图中的密度计测定值标准化为wt 3t3-f442a前脂肪细胞的0nm胰岛素的值。由于总akt2在wt和ko中的表达不同,底部图中的pakt2/akt2标准化分别为对于wt的0nm胰岛素和对于ko值的0nm胰岛素。#deneka等人(2018)和$kern等人(2019)。数据被表示为平均值
±
sem。使用双尾非配对t检验,其中*、**和***分别表示p《0.05、p《0.01和p《0.001。
[0061]
图21k示出了在0nm和10nm胰岛素刺激下,在wt 3t3-f442a脂肪细胞中pas160、as160和-肌动蛋白表达的蛋白质印迹(对于每种条件n=3个独立实验,左图),以及在媒介物或10μm的sn-401中孵育96小时的pas160/as160的相应的密度计比率(右图)。除底部的图外,所有密度计测定值均被标准化为wt 3t3-f442a前脂肪细胞的0nm胰岛素的值。数据被表示为平均值
±
sem。使用双尾非配对t检验,其中*、**和***分别表示p《0.05、p《0.01和p《
0.001。
[0062]
图22a示出了sn-401、sn-403、sn-406、sn-407、sn071和sn072的化学结构。
[0063]
图22b示出了在hek-293细胞中,在低渗(210mosm)刺激以及随后用7μm的sn-401/sn-406或10μm的sn071/sn072抑制时,i
c1,swell
内向和外向电流随时间的变化。
[0064]
图22c示出了在hek-293细胞中分别由sn-401(n=6)、sn-403(n=3)、sn-406(n=4)、sn071(n=3)和sn072(n=3)在10μm(左图)处以及由sn-403(n=3)、sn-406(n=5)和sn-407(n=3)在7μm(右图)处阻断的最大外向电流的百分比的平均值。平均值呈现
±
sem。使用双尾非配对t检验。*、**和***分别表示p《0.05、p《0.01和p《0.001。
[0065]
图22d示出了不具有蛋白质表面的侧视图(i)和具有占据孔的sn-401的蛋白质表面的俯视图(ii)(粉红色棒),如在改编自rcsb pdb:6nzz的低温em结构中分解的;sn-401羧酸酯基团与r103残基(青色条)的胍基团静电相互作用,sn-401环戊基和丁基基团不与任何通道残基相互作用。
[0066]
图22e示出了通过使用分子操作环境2016(moe)软件包对接到pdb 6nzz中为sn-401生成的姿态。sn-401被描绘为黄色条,并且r103、d102和l101被描绘为具有或不具有分子表面的青色条。图(i)示出了没有蛋白质表面的侧视图,并且图(ii)示出了具有sn-401的顶部结合姿态的蛋白质表面的俯视图;sn-401羧酸酯基团与r103残基胍基团相互作用,sn-401环戊基基团在由swell1 d102和l101形成的两种单体的交界处占据浅的疏水性裂缝。
[0067]
图22f示出了通过使用分子操作环境2016(moe)软件包对接到pdb 6nzz中为sn071生成的姿态。sn071被描绘为橙色条,并且r103、d102和l101被描绘为具有或不具有分子表面的青色条;图(i)示出了sn071的第一种结合姿态的俯视图,其示出了与r103的潜在静电相互作用(虚线圆圈),但无法进入并占据疏水性裂缝(黑色箭头);图(ii)示出了sn071的第二种姿态的俯视图,其中环戊基基团占据疏水性裂缝(虚线圆圈),但羧酸酯基团无法到达r103并与其相互作用(黑色箭头)。
[0068]
图22g示出了通过使用分子操作环境2016(moe)软件包对接到pdb 6nzz中为sn-406生成的姿态。sn-406被描绘为黄色条,并且r103、d102和l101被描绘为具有或不具有分子表面的青色条;图(i)示出了sn-406的最佳结合姿态的俯视图;羧酸酯基团与r103相互作用,环戊基基团占据疏水性裂缝,并且烷基侧链sn-406与r103的烷基侧链相互作用;图(ii)示出了被描绘为黄色空间填充模型的sn-406。
[0069]
图23a示出了检测在10μm下用媒介物(n=8)、sn-401(n=10)、sn-406(n=6)或sn072(n=6)(swell1-非活性sn-401同系物)治疗持续96小时的3t3-f442a脂肪细胞中的swell1和-肌动蛋白的蛋白质印迹,以及swell1/-肌动蛋白的相应的密度计比率。数据被表示为平均值
±
sem。使用了双尾非配对t检验(与媒介物相比)。*、**和***分别表示p《0.05、p《0.01和p《0.001。
[0070]
图23b示出了检测在1μm下用媒介物(n=6)、sn-401(n=6)、sn-406(n=3)、sn071(n=3)(非活性sn-401同系物)或sn072(n=4)治疗96小时的3t3-f442a脂肪细胞中的swell1和-肌动蛋白的蛋白质印迹,以及swell1/-肌动蛋白的相应的密度计比率。数据被表示为平均值
±
sem。使用了双尾非配对t检验(与媒介物相比)。*、**和***分别表示p《0.05、p《0.01和p《0.001。
[0071]
图23c示出了免疫染色图像,其证明了在1μm或10μm下用媒介物(n=19)、sn-401(n
=21)、sn-406(对于1μm和10μm,n=13)或sn071(对于1μm,n=9;并且对于10μm,n=13)治疗48小时的3t3-f442a前脂肪细胞中内源性swell1的定位(比例尺-20μm)以及swell1膜相对于细胞质定位部分(fraction)的相应定量。数据被表示为平均值
±
sem。使用单向anova(与媒介物相比)。*、**和***分别表示p《0.05、p《0.01和p《0.001。
[0072]
图23d示出了从在1μm下用媒介物、sn-401、sn-406、sn071或sn072预孵育并随后用低渗溶液刺激的hek-293细胞记录的i
c1.swell
内向和外向电流随时间的变化。
[0073]
图23e示出了在图23d中低渗刺激后7分钟时间点测得的+100mv时平均外向外向lc1,swell电流密度。数据被表示为平均值
±
sem。使用单向anova(与媒介物相比)。*、**和***分别表示p《0.05、p《0.01和p《0.001。
[0074]
图23f示出了从在250nm浓度下用媒介物、sn-401、sn-406、sn071或sn072预孵育并且随后用低渗溶液刺激的hek-293细胞记录的i
c1.swell
内向和外向电流随时间的变化。
[0075]
图23g示出了在图23f中低渗刺激后7分钟时间点测得的+100mv时平均外向外向lc1,swell电流密度。数据被表示为平均值
±
sem。使用单向anova(与媒介物相比)。*、**和***分别表示p《0.05、p《0.01和p《0.001。
[0076]
图23h示出了检测用媒介物(对于0nm胰岛素,n=3,对于10nm胰岛素,n=5)或1μm的sn-401(对于0nm胰岛素,n=3,对于10nm胰岛素,n=6)治疗的3t3-f442a脂肪细胞中的pakt2、akt2和-肌动蛋白的蛋白质印迹,以及pakt2/-肌动蛋白和pakt2/akt2的相应的密度计比率。数据被表示为平均值
±
sem。使用了双尾非配对t检验(与媒介物相比)。*、**和***分别表示p《0.05、p《0.01和p《0.001。
[0077]
图23i示出了检测用媒介物、1mm棕榈酸酯+媒介物、1mm棕榈酸酯+10μm的sn-401、1mm棕榈酸酯+10μm的sn-406、1mm棕榈酸酯+10μm的sn072(在每种条件下n=3)治疗的3t3-f442a脂肪细胞中的swell1和-肌动蛋白的蛋白质印迹,以及swell1/-肌动蛋白的相应的密度计比率。数据被表示为平均值
±
sem。使用了双尾非配对t检验(与媒介物相比)。*、**和***分别表示p《0.05、p《0.01和p《0.001。
[0078]
图24a示出了检测在高脂肪饮食(hfd)持续21周并用媒介物或sn-401(5mg/kg腹腔内注射)治疗的c57bl/6小鼠的内脏脂肪中的swell1蛋白的蛋白质印迹,以及swell1/-肌动蛋白的相应的密度计比率(右图)(在每组中n=6只小鼠)。平均值呈现
±
sem。双尾非配对t检验。*、**和***分别表示p《0.05、p《0.01和p《0.001
[0079]
图24b示出了比较用sn-401(每日5mg/kg腹腔内注射,14天)治疗的多基因t2dkkay小鼠与未治疗的对照kkaa和野生型c57bl/6小鼠相比的腹股沟脂肪组织中的swell1蛋白表达的蛋白质印迹。
[0080]
图24c示出了在hfd持续8周的用媒介物或sn-401(5mg/kg腹腔内注射)治疗10天的c57bl/6小鼠的葡萄糖耐量测试(gtt)和胰岛素耐量测试(itt)(在每组中n=7只小鼠)。平均值呈现
±
sem。使用双向anova(p值在图的底角)。*、**和***分别表示p《0.05、p《0.01和p《0.001。
[0081]
图24d示出了分别在sn-401(5mg/kg腹腔内注射)治疗前和治疗后4天比较的(t2dkkay小鼠(n=6)及其对照品系kkaa(n=3)的空腹血糖水平。平均值呈现
±
sem。配对t检验。*、**和***分别表示p《0.05、p《0.01和p《0.001
[0082]
图24e示出了分别在sn-401(5mg/kg腹腔内注射)治疗前和治疗后4天比较的
t2dkkay小鼠(n=6)及其对照品系kkaa(n=3)的空腹血糖水平(d)、gtt(e)和itt(f)。平均值呈现
±
sem。使用双向anova(p值在图的底角)。*、**和***分别表示p《0.05、p《0.01和p《0.001。
[0083]
图24f示出了分别在sn-401(5mg/kg腹腔内注射)治疗前和治疗后4天比较的t2dkkay小鼠(n=6)及其对照品系kkaa(n=3)的空腹血糖水平(d)、gtt(e)和itt(f)。使用双向anova(p值在图的底角)。*、**和***分别表示p《0.05、p《0.01和p《0.001。
[0084]
图24g示出了用媒介物或sn-401(5mg/kg腹腔内注射)治疗6天的普通饲料饮食喂养(rc)的瘦小鼠(在每组中n=6)的空腹血糖水平(g)。平均值呈现
±
sem。双尾非配对t检验。*、**和***分别表示p《0.05、p《0.01和p《0.001。
[0085]
图24h示出了用媒介物或sn-401(5mg/kg腹腔内注射)治疗6天的普通饲料饮食喂养(rc)的瘦小鼠(在每组中n=6)的与图24g中的空腹血糖水平对应的gtt。
[0086]
图24i示出了用媒介物或sn-401(5mg/kg腹腔内注射)治疗的hfd-t2d小鼠的空腹血糖水平。平均值呈现
±
sem。双尾非配对t检验。*、**和***分别表示p《0.05、p《0.01和p《0.001。
[0087]
图24j示出了用媒介物或sn-401(5mg/kg腹腔内注射)治疗的hfd-t2d小鼠的gtt(16周hfd,4天治疗)和itt(18周hfd,4天治疗)。平均值呈现
±
sem。使用双向anova(p值在图的底角)。*、**和***分别表示p《0.05、p《0.01和p《0.001。
[0088]
图24k示出了在用任一媒介物(n=3)或sn-401(n=4,5mg/kg腹腔内注射)治疗的腹腔内注射葡萄糖(0.75g/kg bw)后,hfd-t2d小鼠(18周hfd,4天治疗)的血浆中的相对胰岛素分泌。
[0089]
图24l分别示出了来自从用任一媒介物(n=3只小鼠,和3个实验重复)或sn-401(n=3只小鼠,和2个实验重复,5mg/kg腹腔内注射)治疗的hfd-t2d小鼠(21周时间点)分离的胰岛的葡萄糖刺激的胰岛素分泌(gsis)周边灌流测定,并且右图为它们相应的曲线下面积(auc)比较。平均值呈现
±
sem。双尾非配对t检验。*、**和***分别表示p《0.05、p《0.01和p《0.001
[0090]
图24m分别示出了来自从用媒介物或sn-401(5mg/kg腹腔内注射,持续6天,在每组中n=3只小鼠,3个实验重复)治疗的多基因-t2d kkay小鼠分离的胰岛的葡萄糖刺激的胰岛素分泌(gsis)周边灌流测定,并且右图为它们相应的曲线下面积(auc)比较。平均值呈现
±
sem。双尾非配对t检验。*、**和***分别表示p《0.05、p《0.01和p《0.001。
[0091]
图25a示出了在用媒介物(n=7)或sn-401(n=8)治疗4天的多基因t2d kkay小鼠的血糖正常的高胰岛素钳夹期间的平均葡萄糖输注速率。平均值呈现
±
sem。双尾非配对t检验。统计学显著性用分别代表p《0.05、p《0.01和p《0.001的*、**和***表示。
[0092]
图25b示出了用媒介物或sn-401(在每组中n=9)治疗的t2d kkay小鼠在基线处和血糖正常的高胰岛素钳夹期间的肝葡萄糖产生。平均值呈现
±
sem。双尾非配对t检验。统计学显著性用分别代表p《0.05、p《0.01和p《0.001的*、**和***表示。
[0093]
图25c示出了在用媒介物或sn-401(在每组中n=9)治疗的t2d kkay小鼠的示踪钳夹期间,从腹股沟白色脂肪组织(iwat)和性腺白色脂肪组织(gwat)和心脏中的2-脱氧葡萄糖(2-dg)摄取测定的葡萄糖摄取量。平均值呈现
±
sem。双尾非配对t检验。统计学显著性用分别代表p《0.05、p《0.01和p《0.001的*、**和***表示。
[0094]
图25d示出了在t2d kkay小鼠的钳夹期间,由肝脏(对于媒介物,n=9,并且对于sn-401,n=8)、脂肪(iwat,对于媒介物,n=7,并且对于sn-401,n=6)和腓肠肌(对于媒介物,n=7,并且对于sn-401,n=6)中的2-dg摄取量测定的到糖原中的葡萄糖摄取。平均值呈现
±
sem。双尾非配对t检验。统计学显著性用分别代表p《0.05、p《0.01和p《0.001的*、**和***表示。
[0095]
图25e示出了在hfd喂养期间用媒介物或sn-401(在每组中n=6)注射的c57bl/6小鼠的治疗方案的示意图。
[0096]
图25f示出了在用媒介物或sn-401(5mg/kg腹腔内注射)治疗后的hfd-t2d小鼠的肝脏质量(左图)和标准化体质量比率(右图)。平均值呈现
±
sem。双尾非配对t检验。统计学显著性用分别代表p《0.05、p《0.01和p《0.001的*、**和***表示。
[0097]
图25g示出了相应的苏木精染色的肝切片和伊红染色的肝切片。比例尺-100μm。
[0098]
图25h示出了肝甘油三酯(在每组中6只小鼠)。平均值呈现
±
sem。双尾非配对t检验。统计学显著性用分别代表p《0.05、p《0.01和p《0.001的*、**和***表示。
[0099]
图25i示出了脂肪变性、小叶炎症、肝细胞损伤(气球样变)和nafld活性评分(nas)的组织学评分,其整合了脂肪变性、炎症和气球样变的评分。平均值呈现
±
sem。双尾非配对t检验。统计学显著性用分别代表p《0.05、p《0.01和p《0.001的*、**和***表示。
[0100]
图26a示出了用swell1非活性sn-071或swell1活性sn-403(5mg/kg腹腔内注射)治疗4天的8周hfd喂养小鼠的空腹血糖水平、gtt及其相应的曲线下面积(auc)(在每组中n=5)。数据被表示为平均值
±
sem。双向anova用于gtt。对于fg、gtt auc、gsis auc和homa-ir使用双尾非配对t检验。统计学显著性用分别代表p《0.05、p《0.01和p《0.001的*、**和***表示。
[0101]
图26b示出了sn-406(5mg/kg腹腔内注射)治疗前和治疗后4天的12周hfd喂养的小鼠的空腹血糖水平、gtt及其相应的auc(在每组中n=5)。双向anova用于gtt。配对t检验用于fg和gttauc。统计学显著性用分别代表p《0.05、p《0.01和p《0.001的*、**和***表示。
[0102]
图26c示出了用swell1非活性sn-071或swell1活性sn-406(5mg/kg腹腔内注射)治疗4天的12周hfd喂养的小鼠的gtt和相应的auc(在每组中n=7)。数据被表示为平均值
±
sem。对于fg、gttauc、gsis auc和homa-ir使用双尾非配对t检验。对于gtt统计学显著性,a-c和f中的双向anova用分别表示p《0.05、p《0.01和p《0.001的*、**和***表示。
[0103]
图26d示出了对应于图26c所示的数据的homa-ir指数。数据被表示为平均值
±
sem。对于fg、gttauc、gsis auc和homa-ir使用双尾非配对t检验。统计学显著性用分别代表p《0.05、p《0.01和p《0.001的*、**和***表示。
[0104]
图26e示出了26c中从小鼠分离的胰岛的葡萄糖刺激的胰岛素分泌(gsis)周边灌注测试。数据被表示为平均值
±
sem。对于fg、gttauc、gsis auc和homa-ir使用双尾非配对t检验。统计学显著性用分别代表p《0.05、p《0.01和p《0.001的*、**和***表示。
[0105]
图26f示出了用swell1非活性sn-071(n=5)或swell1活性sn-407(n=6)(5mg/kg腹腔内注射)治疗4天的多基因t2d kkay小鼠的gtt和相应的auc。数据被表示为平均值
±
sem。对于fg、gttauc、gsis auc和homa-ir使用双尾非配对t检验。a-c和f中的双向anova用于gtt。统计学显著性用分别代表p《0.05、p《0.01和p《0.001的*、**和***表示。
[0106]
图26g示出了26f中从小鼠分离的胰岛的葡萄糖刺激的胰岛素分泌(gsis)周边灌
注测定。数据被表示为平均值
±
sem。对于fg、gttauc、gsis auc和homa-ir使用双尾非配对t检验。统计学显著性用分别代表p《0.05、p《0.01和p《0.001的*、**和***表示。
[0107]
图27a示出了分别在基线处(iso,黑色轨迹)和低渗(hypo,红色轨迹)刺激时在3t3-f442a前脂肪细胞wt中测量的lc1,swell的电流-电压图。
[0108]
图27b示出了分别在基线处(iso,黑色轨迹)和低渗(hypo,红色轨迹)刺激时在3t3-f442a前脂肪细胞ko中测量的lc1,swell的电流-电压图。
[0109]
图27c示出了分别基线处(iso,黑色轨迹)和低渗(hypo,红色轨迹)刺激时,在ko(ko+swell1 o/e)中swell1的腺病毒过度表达。
[0110]
图27d示出了免疫染色图像,其证明了使用抗flag或抗swell1抗体定位内源性swell1或过表达的swell1(比例尺-20μm)。
[0111]
图27e示出了与swell1 ko前脂肪细胞相比在wt 3t3-f442a中swell1抗体的验证(比例尺-20μm),其揭示了内源性swell1定位的点状模式(插图)。
[0112]
图28示出了对于在10μm下用媒介物或sn-401治疗96小时的3t3 f-442a前脂肪细胞,通过qpcr评估(每个n=3)的lrrc8家族成员对于gapdh的相对mrna表达。数据被表示为平均值
±
sem。使用双尾非配对t检验,其中*、**和***分别表示p《0.05、p《0.01和p《0.001。
[0113]
图29a示出了sn-401/dcpib的化学结构(顶部图)和在hek-293细胞中在低渗(210mosm)刺激和随后通过7μm的sn-401抑制时lc1,swell内向和外向电流随时间的变化(底部图)。
[0114]
图29b示出了sn-403的化学结构和在hek-293细胞中在低渗(210mosm)刺激和随后通过7μm的sn-403抑制时lc1,swell内向和外向电流随时间的变化(底部图)。
[0115]
图29c示出了sn-407的化学结构和在hek-293细胞中在低渗(210mosm)刺激和随后被7μm的sn-407抑制时lc1,swell内向和外向电流随时间的变化(底部图)。
[0116]
图29d示出了sn072的结合姿态,其揭示了羧酸酯基团可以到达r103并与其静电相互作用,但在不存在丁基基团的情况下羧酸酯基团不能使环戊基环定向以占据疏水性裂缝,而不会在连接核与环戊基环的碳上引入过度的结构应变。
[0117]
图29e示出了sn-406的最佳结合姿态的替代视图;羧酸酯基团与r103相互作用,环戊基基团占据疏水性裂缝,并且烷基侧链sn-406与r103的烷基侧链相互作用。
[0118]
图29f图(i)示出了没有蛋白质表面的侧视图,并且图(ii)示出了具有sn-403的顶部结合姿态的蛋白质表面的俯视图。羧酸酯基团与r103残基的胍基团相互作用(实心圆圈),环戊基基团在由d102和l101形成的两种单体的交界处占据浅的疏水性裂缝(虚线圆圈)。
[0119]
图29g示出了(i)没有蛋白质表面的侧视图和(ii)具有sn-407的顶部结合姿态的蛋白质表面的俯视图;羧酸酯基团与r103相互作用(实心圆圈),环戊基基团占据疏水性裂缝(虚线圆圈),并且烷基侧链sn-407与r103的烷基侧链相互作用。
[0120]
图29h分别示出了在wt(左图)和r103e突变体过表达的(右图)hek-293细胞中低渗刺激和随后通过7μm sn-406抑制时i
cl,swell
内向和外向电流随时间的变化。
[0121]
图29i示出了分别在hek-293细胞中过表达的wt(在10μm时n=4,并且在7μm时n=5)和r103e突变体(在10μm时n=5,并且在7μm时n=6)中在10μm(左图)和7μm(右图)时被sn-406阻断的最大外向电流的百分比平均值。数据被表示为平均值
±
sem。使用双尾非配对t检
验,其中*、**和***分别表示p《0.05、p《0.01和p《0.001。
[0122]
图30示出了免疫染色图像,其证明了在1μm和10μm下用媒介物或sn-401、sn-406和sn071治疗48小时的wt 3t3-f442a前脂肪细胞中内源性swell1的定位(比例尺-20μm)。
[0123]
图31a示出了用媒介物或sn-401(5mg/kg腹腔内)治疗10天的普通饲料饮食的c57bl/6瘦小鼠的空腹血糖水平(在每组中n=7只雄性)。对于fg和auc使用双尾非配对t检验。
[0124]
图31b示出了用媒介物或sn-401(5mg/kg腹腔内注射)治疗10天的普通饲料饮食的c57bl/6瘦小鼠的gtt(在每组中n=7只雄性)。数据被表示为平均值
±
sem。对于gtt和itt使用双向anova。统计学显著性用分别代表p《0.05、p《0.01和p《0.001的*、**和***表示,并且“ns”表示差异不显著。
[0125]
图31c示出了用媒介物或sn-401(5mg/kg腹腔内注射)治疗10天的普通饲料饮食的c57bl/6瘦小鼠的itt(在每组中n=7只雄性)。数据被表示为平均值
±
sem。对于b-d使用双向anova,对于gtt和itt使用i。统计学显著性用分别代表p《0.05、p《0.01和p《0.001的*、**和***表示,并且“ns”表示差异不显著。
[0126]
图31d示出了用媒介物(n=5只雄性)或sn-401(5mg/kg腹腔内注射,n=4只雄性)治疗8周的hfd-t2d小鼠(8周hfd)的gtt。数据被表示为平均值
±
sem。对于gtt和itt使用双向anova。统计学显著性用分别代表p《0.05、p《0.01和p《0.001的*、**和***表示,并且“ns”表示差异不显著。
[0127]
图31e示出了以5mg/kg腹膜内施用(腹腔内注射)的sn-401的体内药代动力学。
[0128]
图31f示出了以5mg/kg腹膜内施用(腹腔内注射)的sn-406的体内药代动力学。
[0129]
图31g示出了通过口服灌胃(口服)以5mg/kg施用的sn-401的体内药代动力学。
[0130]
图31h示出了通过口服灌胃(口服)以5mg/kg施用的sn-406的体内药代动力学。
[0131]
图31i示出了用媒介物(n=6只雄性)或sn-401(5mg/kg口服,n=7只雄性)治疗5天的hfd-t2d小鼠(10周hfd)的空腹血糖水平、gtt和auc。数据被表示为平均值
±
sem。对于b-d使用双向anova,并且对于gtt和itt使用i。对于fg和auc使用双尾非配对t检验。统计学显著性用分别代表p《0.05、p《0.01和p《0.001的*、**和***表示,并且“ns”表示差异不显著。
[0132]
图32a示出了对于用媒介物或sn-401(在每组中n=9,5mg/kg腹腔内注射)治疗4天的kkay小鼠,在夹钳下收获的棕色脂肪、趾长伸肌(edl)、比目鱼肌和腓肠肌中从2-dg摄取测定的葡萄糖摄取。数据被表示为平均值
±
sem。使用双尾非配对t检验用于分析。“ns”表示差异不显著。
[0133]
图32b示出了用媒介物或sn-401(5mg/kg腹腔内注射)治疗的hfd-t2d小鼠的苏木精和曙红染色的肝组织学切片的图像。比例尺-(10x:100μm和20x:50μm)。
[0134]
图33a示出了来自wt和swell1 ko c2c12(左图)和原代肌管(右图)的蛋白质印迹。
[0135]
图33b示出了来自在-100mv至+100mv+/-等渗和低渗(210mosm)溶液的电压斜坡期间测量的wt和swell1 ko c2c12成肌细胞的电流-电压曲线。
[0136]
图33c示出了与分化的wt和swell1 ko c2c12肌管(左图,中间图)和骨骼肌原代细胞(右图)的荧光图像合并的亮场。dapi将核染成蓝色(中间图)。红色是来自腺病毒转导的mcherry报告荧光。比例尺:100μm。从wt(n=21)和swell1 ko(n=21)c2c12肌管(左图)以及wt(n=22)和swell1 ko(n=15)原代骨骼肌肌管(右图)测得的平均肌管表面积。从wt(n=5
个亮场)和swell1 ko(n=5个亮场)c2c12(显示在代表性的图像下方)测量的融合指数(多核细胞%)。
[0137]
图33d示出了wt相对于源自rna测序的swell1 ko c2c12肌管的前17个差异表达基因的热图。
[0138]
图33e示出了选择的成肌分化基因(n=3,每个)的每千碱基以百万的读数。
[0139]
图33f示出了与wt相比,在swell1 ko c2c12肌管中显著调控的基因的ipa规范途径分析。对于每组n=3。对于利用ipa的分析,对于显著差异调节基因使用1.5的fpkm截止值、≥1.5的倍数变化和《0.05的错误发现率。使用双尾学生t检验来计算指示的值之间的统计学显著性。误差条表示平均值
±
s.e.m。*,p《0.05;**,p《0.01;***,p《0.001;****,p《0.0001。n=3个独立实验。
[0140]
图34a示出了在胰岛素刺激(10nm)时wt和swell1 ko c2c12肌管中的swell1、pakt2、akt2、pas160、as160、pampk、ampk、pfoxo1、foxo1和β-肌动蛋白的蛋白质印迹。
[0141]
图34b示出了在胰岛素刺激(10nm)后wt(ad-cmv-mcherry)和swell1 ko(ad-cmv-cre-mcherry)原代骨骼肌肌管中的swell1、akt2、pakt2、pas160、pakt1、akt1和gapdh的蛋白质印迹。
[0142]
图34c示出了在标准化为β-肌动蛋白的蛋白质印迹上描绘的蛋白质的密度计定量。使用双尾学生t检验来计算指示的值之间的统计学显著性。误差条表示平均值
±
s.e.m。*,p《0.05;**,p《0.01;***,p《0.001;****,p《0.0001。n=3个独立实验。
[0143]
图34d示出了在标准化为gapdh的蛋白质印迹上描绘的蛋白质的密度计定量。使用双尾学生t检验来计算指示的值之间的统计学显著性。误差条表示平均值
±
s.e.m。*,p《0.05;**,p《0.01;***,p《0.001;****,p《0.0001。n=3个独立实验。
[0144]
图34e示出了wt和swell1 ko c2c12肌管中胰岛素信号传导相关基因akt2、foxo3、foxo4、foxo6和glut4的基因表达分析。使用双尾学生t检验来计算指示的值之间的统计学显著性。误差条表示平均值
±
s.e.m。*,p《0.05;**,p《0.01;***,p《0.001;****,p《0.0001。n=3个独立实验。
[0145]
图35a示出了分化的wt、swell1 ko和swell1 ko+swell1 o/e c2c12肌管的亮场图像。比例尺:100μm。
[0146]
图35b示出了以wt(n=35)、swell1 ko c2c12(n=26)和swell1 ko+swell1o/e c2c12(n=45)细胞中的平均肌管表面积的定量。使用单向anova、tukey多重比较检验(tukey's multiple comparisons test)来计算指示的组之间的统计学显著性。误差条表示平均值
±
s.e.m。*,p《0.05;**,p《0.01;***,p《0.001;****,p《0.0001。n=3个独立实验。
[0147]
图35c示出了来自wt、swell1 ko和swell1 ko+swell1 o/e c2c12肌管的swell1、akt2、pakt2、pas160、pakt1、akt1、pp70s6k、p70s6k、ps6k、perk1/2、erk1/2、β-肌动蛋白和gapdh的蛋白质印迹。
[0148]
图35d示出了在分别标准化为β-肌动蛋白和gapdh的蛋白质印迹上描绘的蛋白质的密度计定量。使用单向anova、tukey多重比较检验来计算指示的组之间的统计学显著性。误差条表示平均值
±
s.e.m。*,p《0.05;**,p《0.01;***,p《0.001;****,p《0.0001。n=3个独立实验。
[0149]
图36a示出了响应于0%和5%静态拉伸15分钟在wt和swell1 ko肌管中的swell1、
akt2、pakt2、pakt1、pas160、perk1/2、erk1/2和β-肌动蛋白的蛋白质印迹。
[0150]
图36b示出了相对于β-肌动蛋白的每种信号传导蛋白的密度计定量。使用单向anova、tukey多重比较检验来计算指示的组之间的统计学显著性。误差条表示平均值
±
s.e.m。*,p《0.05;**,p《0.01;***,p《0.001;****,p《0.0001。n=3个独立实验。
[0151]
图37a示出了在c2c12细胞中过度表达,随后用flag抗体进行免疫沉淀(ip)的swell1-3xflag。flag、swell1、grb2和gapdh的蛋白质印迹。igg作为阴性对照。
[0152]
图37b示出了grb2的蛋白质印迹,以验证与wt c2c12(ad-shscr-gfp)和swell1 ko(ad-shscr-gfp)相比,在swell1 ko/grb2敲低(ad-shgrb2-gfp)中的grb2敲低效率。相对于gapdh的grb2敲低的密度计定量(右图)。使用单向anova、tukey多重比较检验来计算指示的组之间的统计学显著性。误差条表示平均值
±
s.e.m。*,p《0.05;**,p《0.01;***,p《0.001;****,p《0.0001。n=3个独立实验。
[0153]
图37c示出了wt c2c12/shscr-gfp、swell1 ko/shscr-gfp和swell1ko/shgrb2-gfp肌管的荧光图像。比例尺:100μm。
[0154]
图37d示出了wt c2c12/shscr-gfp(n=25)、swell1 ko/shscr-gfp(n=28)和swell1 ko/shgrb2-gfp(n=24)的平均肌管面积的定量。使用单向anova、tukey多重比较检验来计算指示的组之间的统计学显著性。误差条表示平均值
±
s.e.m。*,p《0.05;**,p《0.01;***,p《0.001;****,p《0.0001。n=3个独立实验。
[0155]
图37e示出了与wt c2c12/shscr相比,选定的成肌分化基因在swell1 ko/shscr和swell1 ko/shgrb2中的相对mrna表达(每个n=3),以及与swell1 ko/shscr相比swell1 ko/shgrb2的相对mrna表达。使用单向anova、tukey多重比较检验来计算指示的组之间的统计学显著性。误差条表示平均值
±
s.e.m。*,p《0.05;**,p《0.01;***,p《0.001;****,p《0.0001。n=3个独立实验。
[0156]
图37f示出了ko shgrb2中的mrna相对于具有保留的grb2表达的ko细胞的倍数变化。
[0157]
图38a示出了使用肌肉特异性myf5-cre小鼠对外显子3侧翼的loxp位点进行cre介导的重组以产生骨骼肌靶向的swell1 ko小鼠的示意图。
[0158]
图38b示出了从wt和myf5-cre;swell1fl/fl(myf5 ko)小鼠分离的腓肠肌蛋白的蛋白质印迹。将来自myf5 ko和c2c12细胞裂解液的肝样品用作swell1的阳性对照。下面的考马斯凝胶用作骨骼肌蛋白的上样对照。与wt(n=3;swell1fl/fl)相比,myf5 ko小鼠(n=3)的骨骼肌中的swell1缺失的密度计定量(右图)。使用双尾学生t检验来计算指示的值之间的统计学显著性。误差条表示平均值
±
s.e.m。*,p《0.05;**,p《0.01;***,p《0.001;****,p《0.0001。
[0159]
图38c示出了wt(n=11)和myf5 ko(n=7)小鼠的瘦质量(%)和绝对脂肪质量的nmr测量结果。使用双尾学生t检验来计算指示的值之间的统计学显著性。误差条表示平均值
±
s.e.m。*,p《0.05;**,p《0.01;***,p《0.001;****,p《0.0001。
[0160]
图38d示出了从wt(n=3)和myf5 ko(n=4)中新鲜分离的肌肉组的绝对肌肉质量。使用双尾学生t检验来计算指示的值之间的统计学显著性。误差条表示平均值
±
s.e.m。*,p《0.05;**,p《0.01;***,p《0.001;****;p《0.0001。
[0161]
图38e示出了普通饲料饮食喂养28周的wt和myf5 ko小鼠的胫骨肌的苏木精和曙
红染色(如上)。比例尺:100μm。下面,imagej转换的图像突出肌管的明显表面边界。插图,放大的图显示myf5 ko肌肉组织中的较小的纤维尺寸。来自10-12幅不同视野图像(右图)的wt(n=300)和myf5 ko(n=300)小鼠的肌纤维的平均横截面积的量化。使用双尾学生t检验来计算指示的值之间的统计学显著性。误差条表示平均值
±
s.e.m。*,p《0.05;**,p《0.01;***,p《0.001;****,p《0.0001。
[0162]
图39a示出了与wt同窝仔(n=15)相比,myf5 ko小鼠(n=14)的运动跑步机耐受试验。使用双尾学生t检验来计算指示的值之间的统计学显著性。误差条表示平均值
±
s.e.m。*,p《0.05;**,p《0.01;***,p《0.001;****,p《0.0001。
[0163]
图39b示出了myf5 ko(n=8)和wt(n=9)小鼠的倒置试验的暂停时间。使用双尾学生t检验来计算指示的值之间的统计学显著性。误差条表示平均值
±
s.e.m。*,p《0.05;**,p《0.01;***,p《0.001;****,p《0.0001。
[0164]
图39c示出了与wt(n=7)小鼠相比,来自myf5 ko(n=7)的分离的比目鱼肌的离体等长峰强直张力。使用双尾学生t检验来计算指示的值之间的统计学显著性。误差条表示平均值
±
s.e.m。*,p《0.05;**,p《0.01;***,p《0.001;****,p《0.0001。
[0165]
图39d示出了与wt(n=7)小鼠相比,来自myf5 ko(n=7)的分离的比目鱼肌的离体疲劳时间。使用双尾学生t检验来计算指示的值之间的统计学显著性。误差条表示平均值
±
s.e.m。*,p《0.05;**,p《0.01;***,p《0.001;****,p《0.0001。
[0166]
图39e示出了与wt(n=7)小鼠相比,来自myf5 ko(n=7)的分离的比目鱼肌的离体半松弛时间。使用双尾学生t检验来计算指示的值之间的统计学显著性。误差条表示平均值
±
s.e.m。*,p《0.05;**,p《0.01;***,p《0.001;****,p《0.0001。
[0167]
图39f示出了wt和swell1 ko原代肌管+/-胰岛素刺激(10nm)中的氧消耗率(ocr)(n=6个独立实验)以及基础ocr、寡霉素后ocr、fccp后ocr和抗霉素a后ocr的定量。使用双尾学生t检验来计算指示的值之间的统计学显著性。误差条表示平均值
±
s.e.m。*,p《0.05;**,p《0.01;***,p《0.001;****,p《0.0001。
[0168]
图39g示出了通过从基线细胞ocr中减去寡霉素后的ocr获得的atp相关呼吸。使用双尾学生t检验来计算指示的值之间的统计学显著性。误差条表示平均值
±
s.e.m。*,p《0.05;**,p《0.01;***,p《0.001;****,p《0.0001。
[0169]
图39h示出了wt和swell1 ko原代肌管+/-胰岛素刺激(10nm)中的细胞外酸化率(ecar)(n=6个独立实验)以及基础ocr、寡霉素后ocr、fccp后ocr和抗霉素a后ocr的定量。使用双尾学生t检验来计算指示的值之间的统计学显著性。误差条表示平均值
±
s.e.m。*,p《0.05;**,p《0.01;***,p《0.001;****,p《0.0001。
[0170]
图40a示出了对wt(n=11)和myf5 ko(n=10)小鼠的饲料饮食饲养的小鼠的葡萄糖和胰岛素耐量试验。使用双向anova(p值在图的底角)。
[0171]
图40b示出了wt(n=11)和myf5 ko(n=7)小鼠的脂肪质量(%)和绝对脂肪质量的nmr测量。统计学显著性检验通过使用双尾学生t检验来计算。误差条表示平均值
±
s.e.m。*,p《0.05;**,p《0.01;***,p《0.001。
[0172]
图40c示出了普通饲料饮食的wt(n=11)和myf5 ko(n=7)小鼠的体质量。统计学显著性检验通过使用双尾学生t检验来计算。误差条表示平均值
±
s.e.m。*,p《0.05;**,p《0.01;***,p《0.001。
[0173]
图40d示出了在14周龄之后喂食hfd 16周的wt(n=8)和myf5 ko(n=7)小鼠的葡萄糖耐量试验。对于图的底角中的p值使用双向anova。右图示出了wt和myf5 ko小鼠的葡萄糖耐量的相应的曲线下面积(auc)。统计学显著性检验通过使用双尾学生t检验来计算。误差条表示平均值
±
s.e.m。*,p《0.05;**,p《0.01;***,p《0.001。
[0174]
图40e示出了在14周龄之后喂食hfd 18周的wt(n=5)和myf5 ko(n=4)小鼠的胰岛素耐量试验。对于在图的底角中的p值使用双向anova。右图示出了wt和myf5ko小鼠的胰岛素耐量的相应的曲线下面积(auc)。统计学显著性检验通过使用双尾学生t检验来计算。误差条表示平均值
±
s.e.m。*,p《0.05;**,p《0.01;***,p《0.001。
[0175]
图41示出了在c2c12 wt和swell1 ko肌管(n=3,每个)的rna-seq分析之后差异表达的葡萄糖和糖原代谢相关基因。使用双尾学生t检验来计算指示的值之间的统计学显著性。误差条表示平均值
±
s.e.m。*,p《0.05;**,p《0.01;***,p《0.001;****,p《0.0001。
[0176]
图42a示出了在14周龄后以hfd(16周)饲养的wt(n=8)和myf5 ko(n=7)小鼠的脂肪质量(%)和瘦质量(%)的nmr测量。
[0177]
图42b示出了wt(n=8)和myf5 ko(n=7)小鼠的体质量。
[0178]
图43a示出了使用肌肉特异性myl1-cre小鼠对外显子3侧翼的loxp位点进行cre介导的重组以产生骨骼肌靶向的swell1 ko小鼠的示意图(myl1-cre;swell1fl/fl;myl1 ko)。
[0179]
图43b示出了来自分离的组织的myl1 ko小鼠中的swell1重组的pcr条带。
[0180]
图43c示出了以饲料食物饮食饲养14周的wt(n=6)和myl1ko(n=6)小鼠的葡萄糖耐量试验。wt和myl1ko小鼠的空腹血糖水平(右图)。使用双尾学生t检验来计算指示的值之间的统计学显著性。误差条表示平均值
±
s.e.m。*,p《0.05。
[0181]
图43d示出了与wt(n=6)同窝仔相比,myl1ko(n=6)的运动跑步机耐受试验。使用双尾学生t检验来计算指示的值之间的统计学显著性。误差条表示平均值
±
s.e.m。*,p《0.05。
[0182]
图43e示出了从myl1 ko(n=5)和wt(n=4)小鼠中分离的标准化为体质量(bm)的附睾(ewat)和腹股沟(iwat)脂肪质量。使用双尾学生t检验来计算指示的值之间的统计学显著性。误差条表示平均值
±
s.e.m。*,p《0.05。
[0183]
图43f示出了从myl1 ko(n=5)和wt(n=4)小鼠中分离的标准化为体质量(bm)的骨骼肌质量。使用双尾学生t检验来计算指示的值之间的统计学显著性。误差条表示平均值
±
s.e.m。*,p《0.05。
[0184]
图43g示出了以普通饲料饮食饲养的myl1 ko(n=5)和wt(n=4)小鼠的体质量。使用双尾学生t检验来计算指示的值之间的统计学显著性。误差条表示平均值
±
s.e.m。*,p《0.05。
具体实施方式
[0185]
本发明涉及各种多环化合物和使用这些化合物来治疗有需要的受试者的各种病症的各种方法,所述病症包括胰岛素敏感性、肥胖、糖尿病、非酒精性脂肪性肝病、代谢性疾病、高血压、中风、血管紧张度和全身性动脉和/或肺动脉血压和/或血流量。各种神经系统疾病、不育问题、肌肉失常和免疫缺陷也可以用这些化合物治疗。
[0186]
在各种实施例中,本发明的化合物包括式(i)的化合物及其盐:
[0187][0188]
其中
[0189]
r1和r2各自独立地是氢、取代或未取代的烷基、取代或未取代的烯基、取代或未取代的烷氧基、取代或未取代的芳基、取代或未取代的杂芳基;
[0190]
r3为
–y–
c(o)r4、
–z–
n(r5)(r6)或
–z–
a;
[0191]
r4是氢、取代或未取代的烷基、
–
or7或
–
n(r8)(r9);
[0192]
x1和x2各自独立地为氢、取代或未取代的烷基、卤素、
–
or
10
或
–
n(r
11
)(r
12
);
[0193]
r5、r6、r7、r8、r9、r
10
、r
11
和r
12
各自独立地是氢或取代或未取代的烷基;
[0194]
y和z各自独立地是具有至少2个碳原子的取代或未取代的含碳部分;
[0195]
a是具有至少一个氮杂原子的取代或未取代的5元或6元杂环、硼酸或并且
[0196]
n是1或2。
[0197]
在各种实施例中,r1或r2中的至少一个是具有至少2个碳原子的取代或未取代的直链或支链烷基。在另外的实施例中,r1是氢或c1至c6烷基。例如,在一些实施例中,r1是丁基。在各种实施例中,r2是环烷基(例如环戊基)。
[0198]
在各种实施例中,r1和r2选自由以下组成的群组:
[0199][0200]
在各种实施例中,r3是
–y–
c(o)r4。在一些实施例中,r3是
–z–
n(r5)(r6)。在另外的实施例中,r3是
–z–
a。
[0201]
如上所述,a可以是具有至少一个氮杂原子的取代或未取代的5元或6元杂环。在一些实施例中,a是具有至少两个、三个或四个氮杂原子的取代或未取代的5元或6元杂环。在一些实施例中,a是具有至少一个氮杂原子和至少一个选自氧或硫的其他杂原子的取代或未取代的5元或6元杂环。在各种实施例中,a可以是硼酸或
[0202]
在各种实施例中,a是:
[0203][0204]
在某些实施例中,a是a是
[0205]
在某些实施例中,r3选自由以下组成的群组:
[0206][0207][0208]
在各种实施例中,r4是
–
or7或
–
n(r8)(r9)。
[0209]
在各种实施例中,x1和x2各自独立地是氢、取代或未取代的c1至c6烷基或卤素。在一些实施例中,x1和x2各自独立地是c1至c6烷基、氟、氯、溴或碘。在某些实施例中,x1和x2各自独立地是甲基、氟或氯。
[0210]
在各种实施例中,r5、r6、r7、r8、r9、r
10
、r
11
和r
12
各自独立地是氢或烷基。例如,在一些实施例中,r5、r6、r7、r8、r9、r
10
、r
11
和r
12
各自独立地是氢或c1至c3烷基。
[0211]
在各种实施例中,y和z各自独立地是具有2至10个碳的取代或未取代的亚烷基、具有2至10个碳的取代或未取代的亚烯基、或取代或未取代的亚芳基。在一些实施例中,y和z各自独立地是具有2至10个碳的亚烷基、具有2至10个碳的亚烯基、或亚苯基。y和z也可以各自独立地是具有4至10个碳的亚环烷基。在某些实施例中,y是具有3至8个碳或3至7个碳的亚烷基或亚烯基。例如,y可以是亚烷基或具有4个碳的任何亚烯基。在另外的实施例中,z是具有2至4个碳的亚烷基。例如,z可以是具有3或4个碳的亚烷基。
[0212]
在各种实施例中,y或z可以选自由以下组成的群组:
[0213][0214]
在各种实施例中,当y是具有2至3个碳的亚烷基时,那么x1和x2都各自是氟或各自是取代或未取代的烷基(例如,甲基或乙基)。在一些实施例中,y不是具有3个碳的亚烷基。在某些实施例中,r7不是氢或c1至c6烷基。在一些实施例中,x1和/或x2不是卤素。在某些实施例中,x1和/或x2不是氯。在一些实施例中,r1和/或r2不是烷基。
[0215]
根据本文所述的实施例,式(i)的化合物可以选自由以下组成的群组:
[0216][0217][0218]
式(i)的各种化合物可以有利地调节或抑制swell1通道。在某些实施例中,式(i)的化合物比等同量的dcpib(4-[2[丁基-6,7-二氯-2-环戊基-2,3-二氢-1-氧代-1h-茚-5-基)氧基]丁酸)具有更高的调节或抑制swell1通道的效力。因此,它们可以用于治疗与受损的swell1活性相关的病症和疾病。
[0219]
本发明的各个方面包括用于增加有需要的受试者的胰岛素敏感性和/或治疗肥胖、糖尿病(例如,i型或ii型糖尿病)、非酒精性脂肪性肝病、代谢性疾病、高血压、中风、血管紧张度和全身性动脉和/或肺动脉血压和/或血流量的方法。本发明的各个方面还包括用
于治疗有需要的受试者的由不充分或不适当的swell1活性引起的免疫缺陷或不育症的方法。在各个方面中,免疫缺陷可以包括无丙种球蛋白血症。在另外的方面中,不育症可以是由例如由于不充分或不适当的swell1活性引起的异常精子发育导致的男性不育。本发明的各个方面还包括用于治疗或恢复运动能力和/或提高肌肉耐力的方法。在另外的方面中,提供了用于治疗有需要的受试者的肌肉失常的方法。肌肉失常可以包括骨骼肌萎缩。由于swell1-lrrc8复合物也调节肌生成,因此也提供了用于调节肌管中的成肌分化和胰岛素-p13k-akt-as160、erk1/2和mtor信号传导的方法。通常,这些方法包括向受试者施用治疗有效量的式(i)的化合物。
[0220]
在本文所述的各种方法中,所述化合物的施用足以上调swell1的表达或改变swell1相关蛋白的表达。在一些实施例中,所述化合物的施用足以稳定swell1-lrrc8通道复合物或swell1相关蛋白。在另外的实施例中,所述化合物的施用足以促进swell1-lrrc8通道复合物或swell1相关蛋白的膜转运和活性。在一些实施例中,swell1相关蛋白选自由lrrc8、grb2、cav1、irs1或irs2组成的群组。在本文所述的各种方法中,所述化合物的施用足以增强swell1介导的信号传导。
[0221]
根据本发明的各种方法,将包含式(i)的化合物的药物组合物施用于有需要的受试者。所述药物组合物可以通过以下途径施用,包括但不限于:口服、静脉内、肌内、动脉内、髓内、鞘内、心室内、经皮、皮下、腹膜内、鼻内、肠胃外、局部、舌下或直肠方式。在各种实施例中,施用选自由口服、鼻内、腹膜内、静脉内、肌内、直肠和经皮组成的群组。
[0222]
本文所述的任何一种或多种化合物的治疗有效剂量的确定在本领域技术人员的能力范围内。治疗有效剂量是指提供所需结果的活性成分的量。确切的剂量将由执业医师根据与需要治疗的受试者相关的因素确定。调整剂量和施用以提供足够水平的活性成分或维持所需的效果。可以考虑的因素包括疾病状态的严重程度、受试者的一般健康状况、受试者的年龄、体重和性别、饮食、施用的时间和频率、药物组合、反应敏感性以及对疗法的耐受性/应答。长效药物组合物可以每3至4天、每周或每两周施用一次,这取决于特定制剂的半衰期和清除率。
[0223]
通常,根据施用的途径,化合物的正常剂量的量可以在约0.05mg至约100mg每千克体重之间变化。关于特定剂量和递送的方法的指导在文献中提供,并且通常对于本领域中的从业者是可获得的。其通常将被施用为使得给出在例如约0.1mg至约75mg、约0.5mg至约50mg或约1mg至约25mg每千克体重的范围内的每日口服剂量。活性成分可以以每天单剂量施用,或者可替代地以分开的剂量施用(例如,每天两次、一天三次、一天四次等)。一般来说,当采用肠胃外途径时,可以施用较低的剂量。因此,例如,对于静脉内施用,可以使用在约0.05mg至约30mg、约0.1mg至约25mg或约0.1mg至约20mg每千克体重的范围内的剂量。
[0224]
用于口服施用的药物组合物可以使用本领域中已知的药学上可接受的载体以适于口服施用的剂量配制。此类载体能够将药物组合物配制成片剂、丸剂、糖衣丸、胶囊、液体、凝胶、糖浆、浆液、悬浮液等,以供受试者摄入。在某些实施例中,所述组合物被配制为用于肠胃外施用。关于配制和施用的技术的另外的细节可以在最新版的《雷明顿制药科学(remington's pharmaceutical sciences)》(宾夕法尼亚州伊斯顿麦克出版公司(mack publishing co.,easton,pa.))中找到,其通过引用并入本文)。在药物组合物已经被制备后,可以将它们放入合适的容器中,并贴上标签,用于治疗指定的病症。此类标签将包括施
用的量、频率和方法。
[0225]
除了活性成分(例如,式(i)的化合物)之外,所述药物组合物还可以包含合适的药学上可接受的载体,所述载体包括赋形剂和助剂,它们有助于将活性化合物加工成可以在药学上使用的制剂。如本文所使用的,术语“药学上可接受的载体”是指无毒的惰性固体、半固体或液体填料、稀释剂、封装材料或任何类型的制剂助剂。可以用作药学上可接受的载体的材料的一些实例是糖,例如乳糖、葡萄糖和蔗糖;淀粉,例如玉米淀粉和马铃薯淀粉;纤维素及其衍生物,例如羧甲基纤维素钠、乙基纤维素和醋酸纤维素;粉末状黄蓍胶;麦芽;明胶;滑石;赋形剂,例如可可脂和栓剂蜡;油类,例如花生油、棉籽油;红花油;芝麻油;橄榄油;玉米油;和大豆油;二醇类,例如丙二醇;酯,例如油酸乙酯和月桂酸乙酯;琼脂;清洁剂,例如吐温80;缓冲剂,例如氢氧化镁和氢氧化铝;海藻酸;无热原的水;等渗盐水;林格氏溶液;乙醇;人工脑脊液(csf)和磷酸盐缓冲溶液,以及其他无毒的相容性润滑剂例如十二烷基硫酸钠和硬脂酸镁,以及着色剂、脱模剂、包衣剂、甜味剂、调味剂和加香剂、防腐剂和抗氧化剂根据处方者基于所需施用途径的判断也可以存在于组合物中。
[0226]
除非另有说明,否则本文所述的烷基、烯基和炔基基团优选地在主链中含有1至20个碳原子。它们可以是直链或支链或环状的(例如,环烷基)。烯基基团可以包含饱和的或不饱和的碳链,只要存在至少一个碳-碳双键。炔基基团可以包含饱和的或不饱和的碳链,只要存在至少一个碳-碳三键。除非另有说明,否则本文所述的烷氧基基团包含在主链中具有1至20个碳原子的饱和或不饱和的、支链或无支链的碳链。
[0227]
除非本文另有说明,否则术语“芳基”是指含有6至14个环碳原子并且包括例如苯基的单环、双环或三环芳族基团。术语“杂芳基”是指具有5至14个环原子并且含有碳原子和至少1、2或3个氧、氮或硫杂原子的单环、双环或三环芳族基团。
[0228]
已经详细描述了本发明,将显而易见的是,在不脱离所附权利要求中限定的本发明的范围的情况下,修改和变化是可能的。
[0229]
实例
[0230]
提供以下非限制性实例以进一步说明本发明。
[0231]
实例1:合成和筛选对swell1具有改善的亲和力的化合物。
[0232]
合成了一系列化合物(smod化合物),以评估丁酸酯侧链和芳基取代基对活性的作用(参见图1和下表1)。在筛选保留或增强swell1调节活性的化合物的初步膜片钳实验中,鉴定了具有i
cl,swell
抑制活性的独特结构衍生物(smod2-6,图2、3和12-16,以及下表1)。值得注意的是,氨基丙基基团提供了活性smod2。在smod3-5的情况下还保持了体外通道抑制活性(图3)。应当注意,还鉴定了缺乏活性并且因此不是swell1调节剂的化合物(即snot1,图2a和3a)。图4总结了与smod3相比,smod1(+和-)的分离的对映异构体的三种剂量应答曲线。smod3表现出ec
50
的强烈变化,表明其更高的效力。图5总结了用于生成这些化合物的合成方案。
[0233]
表1
[0234]
[0235]
[0236][0237]
实例2:化合物对体内swell1蛋白表达和葡萄糖代谢的影响。
[0238]
将通过通道非活性的snot1的体内swell1表达与通道活性的smod3和smod5进行比较。与媒介物相比,smod3和smod5均在3t3-f442a脂肪细胞中诱导swell1蛋白,而snot1是无效的(图6)。此外,在中试研究中,在hfd饲养8周的小鼠中,smod3而不是snot1(5mg/kg腹腔内注射4天)改善了糖耐量(gtt,曲线下面积)和空腹血糖(fg)(图7)。类似地,在20周hfd后的t2d hfd喂养的小鼠中停止治疗4周后,swell1通道活性的smod6而不是swell1通道非活性的snot1,也不是媒介物在t2d hfd喂养的小鼠中维持改善的葡萄糖耐量(图8和9)。
[0239]
实例3:对smod化合物及其与swell通道相互作用的结构-功能研究。
[0240]
最近smod1与swell1同源六聚体22结合的低温em结构被用于生成结合模型,以试图解释实例1中描述的smod化合物的活性概况。如图10和图11a和11c所示,smod1的丁酸酯链通过swell1通道的颈部突出,并与r103残基相互作用。smod1结构的其余部分沿着精氨酸侧链并紧接在通道颈部上方占据疏水性结合空间。这种结合模式以及在初步工作中评估的smod和snot的类似对接解释了1)丁酸酯链和链的长度对于swell1结合的作用(即snot1相对于smod1、smod3和smod4),2)羧酸酯对活性的要求(代替smod1羧酸酯基团的酰胺提供了非活性的smod),以及3)将芳基氯改变为芳基甲基基团(smod5)并未显著改变活性。由于叔胺不太可能与r103残基相互作用,因此这种结合模式可能与调节swell1活性的阳离子smod2不一致。然而,对smod2活性的一种解释是,本质上swell1-lrrc8通道复合物不是swell1的同源六聚体(图10),并且其中l103取代一些r103亚基的f103的模式(即swell1-lrrc8c/d/e杂六聚体)可能为阳离子-π相互作用创造了环境。通过建模研究揭示了smod2结
合swell1的第二种可能解释,其中计算机对接显示smod以优选的对接姿态翻转180度(图11b)。在这种可替代的结合模式中,疏水性结合相互作用保持在通道的颈部上方,而烷氧基链上的末端阳离子或阴离子基团与通道壁的氨基酸侧链或主链酰胺相互作用。综合而言,这些结果表明,不同的smod可能在不同的swell1通道内以不同的取向结合。因此,不同组织中lrrc8亚基组成的差异(不同杂六聚体在103位的差异以及通道颈部上方的氨基酸差异)可以为鉴定对swell1-lrrc8通道复合物表现出组织选择性抑制的smod化合物提供可能性。事实上,考虑到swell1-lrrc8通道复合物的广泛组织表达,在不同组织或细胞类型中选择性调节特定swell1-lrrc8化学计量的能力可能变得非常重要。
[0241]
实例4:用于实例6至12的材料和方法。
[0242]
患者
[0243]
如前所述获得并培养人胰岛和脂肪细胞(kang等人,2018;zhang等人,2017)。研究中涉及的患者为匿名的并且诸如性别、年龄、hba1c、血糖水平和bmi的信息仅对于研究团队是可获得的。
[0244]
动物
[0245]
研究中涉及的所有c57bl/6小鼠均购自查尔斯河实验室(charles river labs)。研究中涉及的kk.cg-ay/j(kkn)和kk.cg-aa/j(kkaa)小鼠是从杰克逊实验室(jackson labs)(股票编号:002468)获得的性别和年龄匹配的小鼠,并且饲养用于实验。小鼠被随意喂食普通饲料(rc)或高脂肪饮食(研究饮食公司(research diets,inc.),60千卡%脂肪),可自由饮水,并被关在光受控的、温度受控的和湿度受控的房间中。对于高脂肪饮食(hfd)研究,仅使用雄性小鼠,并在6-9周龄时开始hfd方案。对于所有涉及kkn和kkaa小鼠的实验,雄性和雌性都以大约50/50的比例使用。在所有涉及小鼠的实验中,研究人员在实验和随后的分析期间均保持盲态。
[0246]
3t3-f442a细胞系
[0247]
将3t3-f442a(西格玛奥德里奇(sigma-aldrich))细胞保持在含有10%胎牛血清(fbs)和100iu青霉素和100μg/ml链霉素的90%dmem(25mm的d-葡萄糖和4mm的l-谷氨酰胺)中。
[0248]
hek-293细胞系
[0249]
将hek-293(crl-1573tm)细胞保持在含有10%胎牛血清(fbs)和100iu青霉素和100μg/ml链霉素的90%dmem(25mm的d-葡萄糖和4mm的l-谷氨酰胺)中。质粒dna在hek-293细胞中的过量表达是使用lipofectamine 2000(英杰公司(lnvitrogen))试剂进行的。
[0250]
小分子治疗
[0251]
所有化合物都被溶解在el(西格玛,#c5135)中。按照指示使用1cc注射器/26g x 1/2英寸针头,每天腹腔内施用媒介物(el)、sn-401(dcpib,5mg/kg体重/天,tocris,d1540)、sn-403、sn-406、sn-407或sn071,持续4-10天,并且在一个实验中,每天施用sn-401,持续8周。如上配制的sn-401也使用20g
×
1.5英寸可重复使用的金属灌胃针以5mg/kg/天通过口服灌胃施用5天。
[0252]
腺病毒
[0253]
具有ad5-rip2-gfp(4.1x10
10
pfu/ml)和ad5-cag-loxp-stop-loxp-3xflag-swell1
(1x10
10
pfu/ml)的5型腺病毒获自矢量生物实验室(vector biolabs)。具有ad5-cmv-cre-wt-lres-egfp(8x10
10
pfu/ml)的5型腺病毒获自爱荷华大学病毒载体核心(university of iowa viral vector core)。
[0254]
细胞培养
[0255]
将野生型(wt)和swell1敲除(ko)3t3-f442a(西格玛奥德里奇)细胞如前所述进行培养并分化(zhang等人,2017)。将前脂肪细胞在胶原包被的(大鼠尾i型胶原,康宁(corning))板上保持在含有10%胎牛血清(fbs)和100iu青霉素和100μg/ml链霉素的90%dmem(25mm的d-葡萄糖和4mm的l-谷氨酰胺)中。在达到汇合时,将细胞在上述补充有5μg/ml胰岛素(细胞应用(cell applications))的培养基中分化,并且每隔一天补充有分化培养基。对于有或没有swell1过表达(o/e)的wt和ko脂肪细胞的胰岛素信号传导研究,将细胞分化10天,并在第11天在含有2%fbs的分化培养基中用ad5-cag-loxp-stop-loxp-swell1-3xflag病毒(moi 12)转导。为了诱导过表达,在第13天在含2%fbs的分化培养基中加入ad5-cmv-cre-wt-lres-egfp(moi 12)。然后从第15天至第17天将细胞转入含10%fbs的分化培养基。在第18天,将细胞在无血清培养基中饥饿6小时,并用0nm和10nm胰岛素刺激5分钟或15分钟。使用单独的ad5-cag-loxp-stop-loxp-swell1-3xflag或ad5-cmv-cre-wt-lres-egfp病毒转导的细胞作为对照。基于gfp荧光,病毒转导效率为约90%。
[0256]
对于3t3-f442a前脂肪细胞中的sn-401治疗和胰岛素信号传导研究,将细胞与媒介物(dmso)或10μm的sn-401一起孵育96小时。将细胞血清饥饿6小时(+dmso或sn-401),并用pbs洗涤三次,并且用含有0nm、3nm和10nm胰岛素的培养基刺激15分钟,然后收集裂解物。在3t3-f442a脂肪细胞的情况下,在分化7-11天后,将wt和ko细胞用媒介物(dmso)、1μm或10μm的sn-40x治疗96小时,然后用含有0nm和10nm胰岛素/血清的培养基(+dmso或sn-40x)刺激15-30分钟,以用于swell1检测。对于akt和as160信号传导,将在化合物存在下的血清饥饿的细胞在低渗缓冲液(240mosm)中洗涤两次,然后在37℃下在低渗缓冲液中孵育10分钟,然后用含胰岛素/血清的培养基刺激。为了模拟糖脂毒性(gluco-lipotoxicity),在37℃下,在含有25mm葡萄糖的dmem培养基中,将棕榈酸钠溶解在18.4%不含脂肪酸的bsa中,以获得1:3的棕榈酸酯:bsa的结合比率(busch等人,2002)。如上所述,将3t3-f442a脂肪细胞与媒介物或sn-401、sn-406、sn072以10μm孵育96小时,并用1mm棕榈酸酯治疗另外16小时,收集并进一步处理裂解物。
[0257]
分子对接
[0258]
使用分子操作环境(moe)2016.08软件包[化学计算组(chemical computing group)(加拿大蒙特利尔)]将sn-401及其类似物对接到msp1e3d1纳米盘(pdb id:6nzz)中的lrrcba-sn-401同源六聚体的扩展态结构中。从pdb(pdb id:6nzz)获得的3d结构通过以下方式为对接做准备:首先使用yasara软件包中的环生成功能生成缺失的环,然后依次添加氢,调整3d质子化状态,并使用moe中的amber10力场进行能量最小化。通过调整部分电荷,然后使用amber10力场进行能量最小化,来制备待对接的配体结构。通过从共结晶的配体(sn-401)中选择5a内的蛋白残基来定义用于对接的位点。对接参数被设置为放置:三角形匹配器;评分功能:london dg;保持姿态:30;精制:刚性受体;重新评分功能:gbvi/wsadg;保持姿态:5。使用上述经验证的对接算法来预测化合物的结合姿态。
[0259]
电生理学
[0260]
β细胞和成熟脂肪细胞的膜片钳记录如前所述进行(kang等人,2018;zhang等人,2017)。按照上述细胞培养部分中所述制备3t3-f442a wt和ko前脂肪细胞。对于swell1过表达记录,首先在2%fbs培养基中用ad5-cag-loxp-stop-loxp-3xflag-swell1(moi 12)转导前脂肪细胞2天,然后通过在2%fbs培养基中加入ad5-cmv-cre wt-lres-egfp(moi 10-12)再诱导过表达2天,并更换为含10%fbs的培养基,并且根据gfp表达进行选择(约2-3天)。对于细胞记录,将胰岛用ad-rip2-gfp转导,然后在48-72小时后分散,用于膜片钳实验。gfp+细胞标记选择用于膜片钳记录的β细胞。为了测量在激活i
c1,swell
后通过sn-401同系物的i
cl,swell
抑制,使用下文所述的低渗溶液(hypo,210mosm)灌注hek-293细胞,然后在10μm和7μm下应用sn-401同系物+hypo,以评估i
c1,swell
抑制%。为了评估在将sn-401同系物应用至封闭的swell1-lrrc8通道时的i
c1,swell
抑制,在低渗刺激前将hek-293细胞与媒介物(或sn-401、sn-406、sn071和sn072)预孵育30分钟,然后用低渗溶液+sn-401同系物刺激。使用与digidata 1550数字化仪配对的axopatch 2008扩增器,使用pclamp 10.4软件测量记录。用于低渗刺激的细胞外缓冲液组合物包含90mm nacl、2mm cscl、1mm mgcl、1mm cacb、10mm hepes、10mm甘露醇,ph 7.4(含naoh)(210mosm/kg)。细胞外等渗缓冲液组合物与上述相同,除了甘露醇浓度为110mm(300mosm/kg)。细胞内缓冲液的组成为120mm的l-天冬氨酸、20mm的cscl、1mm的mgcl、5mm的egta、10mm的hepes、5mm的mgatp、120mm的csoh、0.1mm的gtp、ph 7.2(含csoh)。所有记录均在室温(rt)下进行,其中hek-293细胞、β细胞和3t3-f442a细胞以全细胞构型进行,并且人脂肪细胞以穿孔的贴片构型进行,如前所述(kang等人,2018;zhang等人,2017)。
[0261]
蛋白质印迹
[0262]
将细胞在冰冷的磷酸盐缓冲盐水中洗涤两次,并且用蛋白酶/磷酸酶抑制剂(罗氏(roche))在ripa缓冲液(150mm的nacl,20mm的hepes,1%的np-40,5mm的edta,ph 7.4)中裂解。以10秒的周期间隔对细胞裂解液进行2-3次进一步声处理,并在4℃下以14000rpm离心20分钟。收集上清液,并使用dc蛋白测定试剂盒(伯乐公司(bio-rad))进一步估计蛋白浓度。将脂肪组织匀浆,并以与如上述类似的方式悬浮在含有抑制剂的ripa缓冲液中。通过在4x laemmli缓冲液中煮沸进一步制备蛋白质样品。将约10-20μg总蛋白装入4-15%梯度凝胶(伯乐公司)中以用于分离,并且在pvdf膜(伯乐公司)上进行蛋白质转移。将膜在tbst缓冲液(0.2m的tris,1.37m的nacl,0.2%的吐温-20,ph 7.4)中的5%bsa(或5%牛奶用于swell1)中封闭1小时,并与适当的初级抗体(5%的bsa或牛奶)在4℃下孵育过夜。在室温下在tbst缓冲液中的1%的bsa(或1%牛奶用于swell1)中加入二级抗体(伯乐公司,山羊抗兔,#170-6515)持续1小时之前,在tbst缓冲液中进一步洗涤膜。信号通过化学发光(pierce)来产生,并使用chemidoc成像系统(伯乐公司)进行可视化。使用lmagej软件进一步分析图像的波段强度。使用以下初级抗体:来自细胞信号传导(cell signaling)的抗磷酸-akt2(#8599s)、抗akt2(#3063s)、抗磷酸-as160(#4288s)、抗as160(#2670s)、抗gapdh(#d16h11)和抗β-肌动蛋白(#8457s);针对表位qrtksrieqgivdrse(seq id no:13)(太平洋抗体(pacificantibodies))产生兔多克隆抗swell1抗体。
[0263]
免疫荧光
[0264]
按照在胶原包被的盖玻片上的细胞培养部分中所述来制备3t3-f442a前脂肪细胞(wt,ko)和分化的脂肪细胞(没有或有swell1过表达(wt+swell1 o/e,ko+swell1 o/e))。在
swell1膜转运的情况下,将3t3-f442a前脂肪细胞在媒介物(或sn-401、sn-406和sn071)存在下以1μm或10μm孵育48小时,然后进行进一步处理。在-20℃下将细胞固定在冰冷的丙酮中15分钟,然后用1x pbs洗涤四次,并在室温下用在1x pbs中的0.1%triton x-100透化5分钟,并且随后在室温下用5%正常山羊血清封闭1小时。向细胞中加入抗swell1(1:400)或抗flag(1:1500,西格玛#f3165)抗体,并在4℃下孵育过夜。然后,在加入1:1000 alexa flour 488/568二级抗体(抗兔,#a11034或抗小鼠,#a11004)之前和之后,在室温下洗涤细胞三次(1x pbs)持续1小时。用核to-pro-3(美国生命技术公司(life technologies),#t3605)或dapi(英杰公司,#d1306)染色(1μm)复染细胞20分钟,然后用1x pbs洗涤三次。将盖玻片进一步安装在含有prolong diamond抗衰减培养基的载玻片上。所有图像均使用具有63x物镜的zeiss lsm700/lsm510共焦显微镜(na 1.4)捕获。通过堆叠所有z图像并将其转换为二值图像来量化swell1膜定位,其中使用lmagej软件从每单位面积的总细胞强度中减去每单位面积的细胞质强度。
[0265]
代谢表型
[0266]
在葡萄糖耐量试验(gtt)之前,小鼠被禁食6小时。0分钟时间点的基线葡萄糖水平(空腹血糖,fg)是使用葡萄糖计(拜耳医药保健有限公司(bayer healthcare llc))从剪尾采集的血液样品中测量的。分别对瘦小鼠或hfd小鼠注射(腹腔内注射)1g或0.75g d-葡萄糖/kg体重,并在分别注射后7、15、30、60、90和120分钟时间点测量葡萄糖水平。对于胰岛素耐量试验(itt),小鼠被禁食4小时。与gtt相似,在胰岛素(humulinr,对于瘦小鼠为1u/kg体重,或者对于hfd小鼠为1.25u/kg体重)注射(腹腔内注射)后0分钟时间点以及15、30、60、90和120分钟时间点测量基线血糖水平。在最后一次注射后约24小时进行在媒介物(或sn-401、sn-403、sn-406、sn-407和sn071)治疗的组的情况下的gtt或itt。对于胰岛素分泌测定,将媒介物(或sn-401、sn-406和sn071)治疗的hfd小鼠禁食6小时,并注射(腹腔内注射)0.75g d-葡萄糖/kg体重,并且在0、7、15和30分钟时间点在microvette毛细管(sarstedt,#16.444)中采集血液样品,并在4℃下以2000xg离心20分钟。然后使用超灵敏小鼠胰岛素elisa试剂盒(ultra-sensitive mouse insulin elisakit)(晶体化学(crystal chem),#90080)测量采集的血浆中的胰岛素含量。在进行实验时,对所有小鼠和治疗组进行了盲法评估。
[0267]
小鼠胰岛分离及周边灌注测定
[0268]
对于涉及原代小鼠细胞的膜片钳研究,通过注射阿佛丁(avertin)(0.0125g/ml于h2o中)对小鼠进行麻醉,然后颈椎脱位。用任一媒介物(或(或sn-401、sn-406、sn-407和sn071)治疗的hfd或多基因kkay小鼠用1-4%异氟烷麻醉,然后颈椎脱位。如前所述(kang等人,2018),进一步分离胰岛。使用来自biorep技术股份有限公司(biorep technologies)的perl4-02进行胰岛的周边灌注。对于每个实验,约50个新分离的胰岛(均来自同一分离批次)被手动挑选,以匹配样品中胰岛的大小,并由同一名有经验的操作员装入两层聚丙烯酰胺-微珠浆料(生物凝胶p-4,伯乐公司)之间的聚碳酸酯周边灌注室中。周边灌注缓冲液包含(以mm计):120nacl、24nahco3、4.8kci、2.5cacl、1.2mgso4、10hepes、2.8葡萄糖、27.2甘露醇、0.25%w/v牛血清白蛋白,ph 7.4(含naoh)(300mosm/kg)。保持在37℃的周边灌注缓冲液以120μi/分钟循环。在用2.8mm葡萄糖溶液洗涤48分钟以用于稳定后,通过以下顺序刺激胰岛:16.7mm的葡萄糖16分钟,2.8mm的葡萄糖40分钟,30mm的kcl 10分钟,以及2.8mm的
药物4和preadmet软件包对sn-401和sn-406药物的性质和药物相似性进行计算机预测。
[0273]
高胰岛素正常血糖葡萄糖钳夹
[0274]
在异氟烷麻醉下将无菌硅胶导管(道康宁公司(dow-corning))放入小鼠的颈静脉中。将放置的导管用在盐水中的200u/ml肝素冲洗,并且导管的自由端通过钝的14号无菌针头被皮下引导,并连接至从动物背部穿出的小管装置。允许小鼠从手术中恢复3天,然后接受媒介物或sn-401(5mg/kg)的ip注射4天。在手术后第8天对无拘束的、清醒的小鼠进行高胰岛素正常血糖钳夹,如其他地方所述(ayala等人,2011;kim等人,2000),其中作了一些修改。小鼠被禁食6小时,此时开始胰岛素和葡萄糖输注(时间0)。在时间0前80分钟,进行基础采样,其中在引发5μci推注1分钟后,通过输注0.05μci/分钟d-[3-3h]-葡萄糖(珀金埃尔默(perkin elmer))来追踪全身葡萄糖通量。在基础期后,从时间0开始,以0.2μci/分钟的速率连续输注d-[3-3h]-葡萄糖,并以80mu/kg/分钟的推注量开始胰岛素(humulin,礼来公司(eli lilly))的输注,然后在整个测定中以8mu/kg/分钟的剂量连续输注胰岛素。从与开始胰岛素输注相同的时间开始,以可变速率输注50%右旋糖(赫士睿(hospira))(gir),以将正常血糖维持在150mg/dl(8.1mm)的目标水平。每十分钟使用contour血糖计(拜耳)通过尾静脉采样进行血糖(bg)测量。在小鼠达到稳定的bg和gir后(通常,自开始胰岛素输注后75分钟;对于一些小鼠,需要更长的时间来达到稳定状态),施用在96μi的盐水中的12μci的[1-14c]-2-脱氧-d-葡萄糖(珀金埃尔默)的单次推注。用于测定示踪剂富集、葡萄糖水平和胰岛素浓度的血浆样品(从离心的血液中采集)在时间-80、-20、-10、0和每10分钟获得,从胰岛素后80分钟开始(在施用[1-14c]-2-脱氧-d-葡萄糖推注后5分钟),直到在140分钟测定结束。然后在异氟烷麻醉下从小鼠的目标器官(例如,肝脏、心脏、肾脏、白色脂肪组织、棕色脂肪组织、腓肠肌、比目鱼肌等)中采集组织样品,用于测定1-14c]-2-脱氧-d-葡萄糖示踪剂摄取。如前所述(ayala等人,2011)处理血浆和组织样品。简而言之,将血浆样品用ba(oh)2和znso4脱蛋白,并干燥以除去氚化的水。葡萄糖周转率(mg/kg-分钟)被计算为示踪剂输注的速率(dpm/分钟)除以每千克小鼠体重的校正的血浆葡萄糖比活性(dpm/mg)。通过使用斯蒂尔模型(steele's model)解释了来自稳态的波动。使用analox gmd9系统(analox技术(analox technologies))来测量血浆葡萄糖。
[0275]
将组织样品(每份约30mg)在750μi的0.5%高氯酸中匀浆,用10m的koh中和并离心。然后使用上清液首先用于测量总[1-14c]信号(来自1-14c-2-脱氧-d-葡萄糖、1-14c-2-脱氧-d-葡萄糖6磷酸)的丰度,然后在用0.3n的ba(oh)3和0.3n的znso4的沉淀步骤后,用于测量未磷酸化的1-14c-2-脱氧-d-葡萄糖。通过乙醇沉淀从30%的koh组织裂解物中分离糖原,如所描述的(shiota,2012)。使用stellux elisa啮齿动物胰岛素试剂盒(alpco)来测量t0和t
140
时血浆中的胰岛素水平。
[0276]
定量rt-pcr
[0277]
将经媒介物(dmso)或10μm的sn-401治疗96小时的3t3-f442a前脂肪细胞溶解在trlzol中,并使用purelinkrna试剂盒(美国生命技术公司)分离总rna。cdna合成、qrt-pcr反应和定量如前所述(zhang等人,2017)进行。
[0278]
肝脏隔离、甘油三酯和组织学
[0279]
用媒介物或sn-401治疗的hfd小鼠用1-4%的异氟烷麻醉,然后颈椎脱位。测量肝脏总重,并解剖来自肝的右中叶的相同切片以用于进行进一步检查。通过在1.5ml的氯仿:
甲醇(2:1v/v)中均质化10-50mg的组织并在4℃下以12000rpm离心10分钟来测定总甘油三酯含量。在1.5ml微量离心管中蒸发20μl等分试样持续30分钟。通过向干燥的样品中加入100μi的infinity甘油三酯试剂(飞世尔科技(fisher scientific)),然后在室温下孵育30分钟,来测定甘油三酯含量。然后将样品与标准品(0-2000mg/di)一起转移至96孔板,并且在540nm下测量吸光度,并通过标准化为组织重量来测定最终浓度。对于组织学检查,将肝切片固定在10%福尔马林锌中,并石蜡包埋以用于切片。然后评估苏木精和曙红(h&e)染色切片的脂肪变性等级、小叶炎症和肝细胞气球样变,以用于非酒精性脂肪性肝病(nafld)评分,如所描述的(kleiner等人,2005;liang等人,2014;rauckhorst等人,2017)。
[0280]
量化和统计分析
[0281]
在比较两个组的同时,进行标准非配对的或配对的双尾学生t检验。对于多组比较,使用单向anova。对于gtt和itt,使用双向方差分析(anova)。小于0.05的p值被视为是统计学上显著的。*、**和***分别表示小于0.05、0.01和0.001的p值。所有数据均以平均值
±
sem表示。所有统计细节和分析均在附图的简要描述中给出。
[0282]
实例5:合成
[0283]
一般信息:除非另有说明,否则所有商业上可获得的试剂和溶剂均直接使用,而无需进一步纯化。通过薄层色谱法(在硅胶板上进行,硅胶60f2s4,默克公司(merck))监测反应,并在uv光下观察。使用硅胶60作为固定相,在正气压下进行快速色谱法。除非另有说明,否则1hnmr光谱以cdcb被记录在brukeravance光谱仪上,该光谱仪在环境温度下以300mhz操作。所有的峰在来自tms的标度低场中以ppm报告并且使用在cdcb(h 5=7.26)或tms(5=0.0)中的残留溶剂峰作为内标。1hnmr的数据被报告如下:化学位移(ppm,标度)、多重性(s=单重态,d=双重态,t=三重态,q=四重态,m=多重态和/或多重态共振,dd=双重态的两倍,dt=三重态的两倍,br=宽)、耦合常数(hz)和积分。所有高分辨率质谱(hrms)均在waters q-tof premier质谱仪上使用电喷雾电离(esi)飞行时间(tof)进行测量。
[0284]
根据方案1(图17)来制备2-环戊基-1-(2,3-二氯-4-甲氧基苯基)乙-1-酮(3)。
[0285]
(3)
[0286]
在0℃下,向在二氯甲烷(250ml)中的氯化铝(13.64g,102mmol,1.1当量)的搅拌的溶液中加入环戊基乙酰氯(15g,102mmol,1.1当量),并且允许将所得的溶液在0℃下在氮气气氛下搅拌10分钟。在0℃下,向其中加入在二氯甲烷(50ml)中的2,3-二氯苯甲醚(16.46g,92.9mmol,1当量),并且允许所得的溶液升温至室温并搅拌16小时。一旦完成,将反应物加入到冷的浓盐酸(100ml)中,随后在二氯甲烷(150ml x 3)中提取。合并有机级分,浓缩并且通过使用在己烷中的0-15%乙酸乙酯作为洗脱剂的硅胶色谱法纯化,以得到作为白色固体的化合物3(22.41g,84%)。1h nmr(300mhz,cdcl3)δ7.39(d,j=8.7hz,1h),6.89(d,j=8.7hz,1h),3.96(s,3h),2.96(d,j=7.2hz,2h),2.38
–
2.21(m,1h),1.92
–
1.75(m,2h),1.69
–
1.46(m,4h),1.28
–
1.05(m,2h)。hrms(esi),针对c
14h17
cl2o2[m+h]
+
计算的m/z为287.0605,实测值为287.0603。
[0287]
根据方案1(图17)来制备6,7-二氯-2-环戊基-5-甲氧基-2,3-二氢-1h-茚-1-酮
(4)。
[0288]
(4)
[0289]
向在圆底烧瓶中的2-环戊基-1-(2,3-二氯-4-甲氧基苯基)乙-1-酮(3)(21.5g,74.8mmol,1当量)中加入多聚甲醛(6.74g,224.5mmol,3当量)、二甲胺盐酸盐(30.52g,374mmol,5当量)和乙酸(2.15ml),并且允许所得的混合物在85℃下搅拌16小时。然后向反应中加入二甲基甲酰胺(92ml),并且允许所得的溶液在85℃下搅拌4小时。一旦完成,用乙酸乙酯稀释反应,然后用1n盐酸洗涤。收集有机级分,并且在真空下浓缩,并被用于下一步骤而无需纯化。在0℃下,向在圆底烧瓶中的浓缩产物中加入冷的浓硫酸(120ml),并允许所得的溶液在室温下搅拌18小时。一旦完成,用冷水稀释反应,并用乙酸乙酯(100ml)提取三次。合并有机级分,浓缩并且通过使用在己烷中的0-15%乙酸乙酯作为洗脱剂的硅胶色谱法纯化,以得到作为米色固体的化合物4(18.36g,82%)。1h nmr(300mhz,cdcl3)δ6.88(s,1h),4.00(s,3h),3.16(dd,j=18.1,8.7hz,1h),2.80(d,j=14.4hz,2h),2.43
–
2.22(m,1h),1.96(s,1h),1.73
–
1.48(m,5h),1.46
–
1.33(m,1h),1.17
–
1.00(m,1h)。lrms(esi),针对c
15h17
cl2o2[m+h]
+
计算的m/z为299.0605,实测值为299.0614。
[0290]
根据方案1(图17)制备2-丁基-6,7-二氯-2-环戊基-5-甲氧基-2,3-二氢-1h-茚-1-酮(5)。
[0291]
(5)
[0292]
允许在无水叔丁醇(220ml)中的4(23gm,76.8mmol,1当量)在95℃下回流30分钟。向所得的溶液中加入叔丁醇钾(1m于叔丁醇中)(84ml,84.5mmol,1.1当量),并将所得的溶液回流30分钟。然后将反应冷却至室温,然后加入碘代丁烷(44.2ml,384mmol,5当量),然后允许反应回流另外的60分钟。允许反应冷却,浓缩并且通过使用在己烷中的0-10%乙酸乙酯作为洗脱剂的硅胶色谱法纯化,以提供作为透明油的化合物5(17.75g,65%)。1hnmr(300mhz,cdcl3)δ6.89(s,1h),4.09
–
3.90(m,3h),2.98
–
2.70(m,2h),2.36
–
2.18(m,1h),1.89
–
1.71(m,2h),1.58
–
1.42(m,5h),1.33
–
1.09(m,4h),1.09
–
0.94(m,2h),0.93
–
0.73(m,4h)。hrms(esi),针对c
19h25
cl2o2[m+h]
+
计算的m/z为355.1231,实测值为355.1231。
[0293]
根据方案1(图17)制备2-丁基-6,7-二氯-2-环戊基-5-羟基-2,3-二氢-1h-茚-1-酮(6)。
[0294]
(6)
[0295]
向5(3.14g,8.87mmol,1当量)中加入氯化铝(2.36g,17mmol,2当量)和碘化钠
(2.7g,17mmol,2当量),并将所得的固体混合物捣碎并且允许在70℃下搅拌60分钟。一旦完成,反应用二氯甲烷稀释,并用饱和硫代硫酸钠水溶液洗涤。收集有机级分并浓缩,以得到米色固体,然后用己烷洗涤该米色固体多次,以提供作为白色固体的化合物6(2.87g,95%)。1h nmr(300mhz,cdcl3)δ7.03(s,1h),6.32(s,1h),2.97
–
2.73(m,2h),2.36
–
2.17(m,1h),1.88
–
1.68(m,2h),1.62
–
1.39(m,6h),1.31
–
1.11(m,3h),1.08
–
0.97(m,2h),0.97
–
0.87(m,1h),0.83(t,j=7.3hz,3h)。hrms(esi),针对c
18h23
cl2o2[m+h]
+
计算的m/z为341.1075,实测值为341.1089。
[0296]
根据方案1(图17)制备2-((2-丁基-6,7-二氯-2-环戊基-1-氧代-2,3-二氢-1h-茚-5-基)氧基)乙酸(7)(sn071)。
[0297]
(7)sn071
[0298]
向在无水二甲基甲酰胺(1ml)中的5(170mg,0.50mmol,1当量)的搅拌溶液中加入碳酸钾(76mg,0.56mmol,1.1当量)和2-溴乙酸乙酯(61μl,0.56mmol,1.1当量),并且允许反应在60℃下搅拌2小时。一旦完成,向反应中加入4n的naoh(1ml),并允许反应在100℃下搅拌60分钟。一旦完成,将反应浓缩并且通过使用在二氯甲烷中的0-10%甲醇作为洗脱剂的柱色谱纯化,以提供作为透明固体的sn071(173mg,87%)。1h nmr(300mhz,cdcl3)δ6.80(s,1h),5.88(s,1h),4.88(s,2h),2.87(q,j=17.9hz,2h),2.34
–
2.20(m,1h),1.91
–
1.69(m,2h),1.66
–
1.39(m,6h),1.32
–
1.13(m,3h),1.10
–
0.95(m,2h),0.94
–
0.86(m,1h),0.83(t,j=7.3hz,3h)。hrms(esi),针对c
20h25
cl2o4[m+h]
+
计算的m/z为399.1130,实测值为399.1132.
[0299]
根据方案1(图17)制备4-((2-丁基-6,7-二氯-2-环戊基-1-氧代-2,3-二氢-1h-茚-5-基)氧基)丁酸(8)(sn-401)。
[0300]
(8)sn-401
[0301]
向在无水二甲基甲酰胺(1ml)中的5(100mg,0.29mmol,1当量)的搅拌溶液中加入碳酸钾(45mg,0.32mmol,1.1当量)和4-溴丁酸乙酯(46μl,0.32mmol,1.1当量),并且允许反应在60℃下搅拌2小时。一旦完成,向反应中加入4n的naoh(1ml),并允许反应在100℃下搅拌60分钟。一旦完成,将反应浓缩并且通过使用在二氯甲烷中的0-10%甲醇作为洗脱剂的柱色谱法纯化,以提供作为透明固体的sn-401(111mg,89%)。1hnmr(300mhz,cdcl3)δ10.77(s,1h),6.86(s,1h),4.21(t,j=5.9hz,2h),2.88(t,j=14.4hz,2h),2.69(t,j=7.0hz,2h),2.26(dd,j=12.6,6.1hz,3h),1.87
–
1.73(m,2h),1.64
–
1.44(m,6h),1.35
–
1.10(m,4h),1.08
–
0.95(m,j=15.0,7.7hz,2h),0.82(t,j=7.3hz,3h)。hrms(esi),针对c
22h29
cl2o4[m+h]
+
计算的m/z为427.1443,实测值为427.1446。
[0302]
根据方案1(图17)来制备5-((2-丁基-6,7-二氯-2-环戊基-1-氧代-2,3-二氢-1h-茚-5-基)氧基)戊酸(9)(sn-403)。
[0303]
(9)sn-403
[0304]
向在无水二甲基甲酰胺(1ml)中的5(100mg,0.29mmol,1当量)的搅拌溶液中加入碳酸钾(45mg,0.32mmol,1.1当量)和6-溴戊酸乙酯(51μl,0.32mmol,1.1当量),并允许反应在60℃下搅拌2小时。一旦完成,向反应中加入4n的naoh(1ml),并允许反应在100℃下搅拌60分钟。一旦完成,将反应浓缩并且通过使用在二氯甲烷中的0-10%甲醇作为洗脱剂的柱色谱法纯化,以提供作为透明固体的sn-403(114mg,88%)。1h nmr(300mhz,cdcl3)δ10.95(s,1h),6.85(brs,1h),4.16(t,j=5.7hz,2h),2.96
–
2.75(m,2h),2.61
–
2.44(m,2h),2.35
–
2.17(m,1h),2.10
–
1.87(m,4h),1.86
–
1.70(m,2h),1.66
–
1.38(m,6h),1.32
–
1.13(m,3h),1.08
–
0.96(m,2h),0.94
–
0.86(m,1h),0.86
–
0.73(m,3h)。hrms(esi),针对c
23h31
cl2o4[m+h]
+
计算的m/z为441.1599,实测值为441.1601。
[0305]
根据方案1(图17)制备6-((2-丁基-6,7-二氯-2-环戊基-1-氧代-2,3-二氢-1h-茚-5-基)氧基)己酸(10)(sn-406)。
[0306]
(10)sn-406
[0307]
向在无水二甲基甲酰胺(1ml)中的5(100mg,0.29mmol,1当量)的搅拌溶液中加入碳酸钾(45mg,0.32mmol,1.1当量)和6-溴己酸乙酯(58μl,0.32mmol,1.1当量),并且允许反应在60℃下搅拌2小时。一旦完成,向反应中加入4n的naoh(1ml),并允许反应在100℃下搅拌60分钟。一旦完成,将反应浓缩并且通过使用在二氯甲烷的0-10%甲醇作为洗脱剂的柱色谱法纯化,以提供作为透明固体的sn-406(115mg,86%)。1h nmr(300mhz,cdcl3)δ11.70(s,1h),6.85(s,1h),4.13(t,j=6.2hz,2h),2.93
–
2.74(m,2h),2.43(t,j=7.3hz,2h),2.32
–
2.17(m,1h),1.98
–
1.87(m,2h),1.85
–
1.68(m,4h),1.66
–
1.40(m,8h),1.28
–
1.12(m,3h),1.07
–
0.93(m,2h),0.91
–
0.70(m,4h)。hrms(esi),针对c24h33cl2o4[m+h]+计算的m/z为455.1756,实测值为455.1756。
[0308]
根据方案1(图17)制备7-((2-丁基-6,7-二氯-2-环戊基-1-氧代-2,3-二氢-1h-茚-5-基)氧基)庚酸(11)(sn-407)。
[0309]
(11)sn-407
[0310]
向在无水二甲基甲酰胺(1ml)中的5(100mg,0.29mmol,1当量)的搅拌溶液中加入
碳酸钾(45mg,0.32mmol,1.1当量)和7-溴庚酸乙酯(63μl,0.32mmol,1.1当量),并且允许反应在60℃下搅拌2小时。一旦完成,向反应中加入4n的naoh(1ml),并且允许反应在100℃下搅拌60分钟。一旦完成,将反应浓缩并且通过使用在二氯甲烷中的0-10%甲醇作为洗脱剂的柱色谱法纯化,以提供作为透明固体的sn-407(122mg,89%)。1h nmr(300mhz,cdcl3)δ11.52(s,1h),6.85(s,1h),4.12(t,j=6.3hz,2h),2.84(q,j=18.2hz,2h),2.47
–
2.32(m,2h),2.32
–
2.18(m,1h),1.96
–
1.84(m,2h),1.83
–
1.64(m,4h),1.62
–
1.39(m,10h),1.28
–
1.14(m,3h),1.08
–
0.94(m,2h),0.91(d,j=8.5hz,1h),0.81(t,j=7.3hz,3h)。hrms(esi),针对c
25h35
cl2o4[m+h]
+
计算的m/z为469.1912,实测值为469.1896。
[0311]
根据方案2(图18)合成4-((6,7-二氯-2-环戊基-1-氧代-2,3-二氢-1h-茚-5-基)氧基)丁酸(12)(sn072):
[0312]
(12)sn072
[0313]
向4(100mg,0.36mmol,1当量)中加入氯化铝(89mg,0.67mmol,2当量)和碘化钠(101mg,0.67mmol,2当量)并将所得的固体混合物捣碎并且允许在70℃下搅拌60分钟。一旦完成,将反应用二氯甲烷稀释,并用饱和硫代硫酸钠水溶液洗涤。收集有机级分并浓缩,以得到米色固体,然后用己烷洗涤该米色固体多次,以提供作为白色固体的化合物6,其被用于下一步骤。向在无水二甲基甲酰胺(1ml)中的来自第一步的产物的搅拌溶液中加入碳酸钾(53mg,0.39mmol,1.1当量)和4-溴丁酸乙酯(55μl,0.39mmol,1.1当量)并允许反应在60℃下搅拌2小时。一旦完成,向反应中加入4n的naoh(1ml),并且允许反应在100℃下搅拌60分钟。一旦完成,将反应浓缩并通过使用在二氯甲烷中的0-10%甲醇作为洗脱剂的柱色谱法纯化,以提供作为透明固体的sn072(107mg,86%)。1h nmr(300mhz,cdcl3)δ6.87(s,1h),4.21(t,j=5.9hz,2h),3.26
–
3.02(m,1h),2.94
–
2.56(m,4h),2.40
–
2.19(m,3h),2.03
–
1.90(m,1h),1.74
–
1.50(m,5h),1.47
–
1.32(m,1h),1.19
–
1.00(m,1h)。hrms(esi),针对c
18h21
cl2o4[m+h]
+
计算的m/z为371.0817,实测值为371.0808。
[0314]
按照文献报道的程序(cragoe等人,1982)并且如方案3图19所示合成了对映体富集的sn-401异构体。简而言之,将外消旋化合物7(1当量)与辛可尼丁(1当量)一起溶解在最少量的热dmf中并且允许冷却。分离沉淀的盐(滤液用于获得相反的对映异构体),并从dmf中再重结晶5次,然后用hcl水溶液酸化盐并提取到乙醚中。在真空下蒸发乙醚,以得到产率23%的对映体富集的(+)-7a;[α]25d+16.8
°
(c 5,etoh)。将来自第一步的现在富含(-)-7b的dmf滤液浓缩并用hcl水溶液酸化,并且用乙醚提取并浓缩以得到固体。将该得到的固体(1当量)与辛可尼丁(1当量)一起溶解在最少量的热乙醇中,然后允许冷却。分离沉淀的盐,并从dmf中再重结晶5次,然后用hcl水溶液酸化盐,并提取到乙醚中。在真空下蒸发乙醚,以得到产率为19%的对映体富集的(-)-7a;[α]25d-15.6
°
(c 5,etoh)。然后使对映体富集的7a和7b经受相同的两步反应序列,包括转化为相应的酚(+)-6a和(-)-6b,然后转化为所需的对映体富集的氧丁酸(+)-8a[α]
25d
+15.9
°
(c 5,etoh)和(-)
–
8b[α]
25d-14.5
°
(c 5,etoh)。对映体富集的产物的1hnmr和hrms与外消旋化合物相同,并且因此未报告。
[0315]
实例6:i
c1,swell
和swell1蛋白在t2dβ细胞和脂肪细胞中减少
[0316]
swell1/lrrc8a消融会损害目标组织中的胰岛素信号传导和从胰腺β3细胞的胰岛素分泌,引发葡萄糖耐受不良的糖尿病前期状态。这些最新发现表明,swell1的减少可能有助于2型糖尿病(t2d)。为了确定在t2d中由swell1介导的电流是否发生改变,与非t2d对照相比,我们测量了新鲜分离自以hfd饲养5-7个月的t2d小鼠(图20a)和t2d患者(图20b,下表2和3)的胰腺β细胞中的i
c1,swell
。与非t2d对照相比,在小鼠和人类t2dβ细胞中,在用低渗肿胀刺激时的最大i
c1,swell
电流密度(在+100mv下测量)显著降低(在小鼠中为83%;在人类中为63%,图20c和20d),分别类似于在swell1敲除(ko)和敲低(ko)小鼠和人β细胞中观察到的降低(kang等人,2018)。在t2d的环境下β细胞i
c1,swell
的这些降低与在小鼠kkn t2d模型中vrac/i
c1,swell
的先前的测量结果一致,与非t2d对照相比,在分离自t2d kkn小鼠的脂肪细胞中,与i
c1,swell
相比减少》50%。同样,在来自肥胖的t2d患者(bmi=52.3,hgba1c=6.9%;空腹血糖=148-151mg/di)的分离的人脂肪细胞中测得的swell1介导的i
c1,swell
显示出与我们之前报告的肥胖的非t2d患者相比降低50%的趋势,并且与来自瘦患者的脂肪细胞中的i
c1,swell
没有区别(图20e,下表4)。由于swell1/lrrc8a是两种脂肪组织中i
c1,swell
iv rac的关键组分,因此我们询问在t2d的环境中i
c1,swell
的这些降低是否与swell1蛋白表达的降低相关。实际上,与亲本对照kkaa小鼠相比,在t2d kkn小鼠的脂肪组织中swell1蛋白减少(图20f)。类似地,与来自正常血糖肥胖患者(bmi=50.2hgba1c=5.0%;空腹血糖=84-97mg/di,图20g,下表5)的脂肪组织相比,在来自肥胖t2d患者(bmi=53.7,hgba1c=8.0%,空腹血糖=183-273mg/di)的脂肪组织中swell1蛋白较低。此外,与来自非糖尿病人类尸体的胰岛相比,糖尿病人类尸体胰岛中的总swell1蛋白显示出减少50%的趋势(图20h,下表6)。总之,这些发现表明,脂肪细胞和β细胞(以及可能的其他组织)中降低的swell1活性可能是胰岛素抵抗和与t2d相关的受损的胰岛素分泌的基础。此外,在早期正常血糖肥胖的环境下,在脂肪组织和肝脏中swell1蛋白表达均增加,并且该swell1诱导的shrna介导的抑制会加重胰岛素抵抗和葡萄糖耐受不良。因此,我们推测,在t2d的环境下,维持或诱导外周组织中的swell1表达/信号传导可能支持胰岛素敏感性和分泌,以保护全身性血糖。
[0317]
表2:从其分离β细胞以用于图20a和20c中的膜片钳研究的非t2d和t2d小鼠的特征
[0318][0319]
表3:从其获得尸体非t2d和t2d胰岛以用于图20b和20d中的β细胞膜片钳研究的患者的特征。(na:不可用)
[0320][0321]
表4:从其分离出原代脂肪细胞以用于图20e中的膜片钳研究的瘦的、非t2d和t2d减肥手术患者的特征。
[0322][0323]
表5:从其获得脂肪样品以测量图20g中的swell1蛋白表达水平的瘦的、肥胖的非t2d和肥胖的t2d患者的特征。
[0324][0325]
表6:从其获得尸体胰岛以测量图20h中的swell1蛋白表达水平的非t2d和t2d患者的特征。
[0326][0327][0328]
实例7:swell1蛋白表达调节胰岛素刺激的pl3k-akt2-as160信号传导
[0329]
为了测试swell1是否调节胰岛素信号传导,我们在wt和swell1 ko 3t3-f442a脂肪细胞中过表达了flag标记的swell1(swell1 o/e),并测量了胰岛素刺激的磷酸化akt2(pakt2)作为胰岛素敏感性的读出(图21a)。如前所述(zhang等人,2017),与wt脂肪细胞相比,swell1 ko 3t3-f442a脂肪细胞表现出显著钝化的胰岛素介导的pakt2信号传导,并且这通过swell1在swell1 ko脂肪细胞中的重新表达(ko+swell1 o/e,图21a)以及响应于低渗刺激恢复swell1介导的i
c1,swell
(图21b和图27a-图27c)来完全挽救,这与swell1-lrrc8a信号传导复合物在质膜处的恢复一致。值得注意的是,在swell1 ko脂肪细胞中观察到的总akt2蛋白表达的降低并未被swell1再表达所挽救,这表明swell1蛋白表达的瞬时变化优先调节胰岛素-pakt2信号传导,这与akt2蛋白表达相反。在wt脂肪细胞中的swell1过表达还增加了基础和胰岛素刺激的pakt2以及在wt脂肪细胞中的as160(pas160)信号传导的下游磷酸化(图21c和21d)。我们确认,当分别在使用经抗flag和swell1 ko验证的定制抗swell1抗体的免疫荧光(if)观察到的wt和swell1 ko脂肪细胞中表达时,flag标记的swell1正常转运至质膜。在wt和swell1 ko脂肪细胞中过表达的flag标记的swell1在细胞外周呈现点状模式,类似于wt脂肪细胞中的内源性swell1(图27d和27e)。总体而言,这些数据表明,在
脂肪细胞中,swell1表达水平可调节胰岛素-pl3k-akt2-as160信号传导。此外,这些数据表明,在t2d的环境下,外周组织中的药理学swell1诱导可以增强胰岛素信号传导,并且改善全身胰岛素敏感性和葡萄糖稳态。
[0330]
小分子4-[(2-丁基-6,7-二氯-2-环戊基-2,3-二氢-1-氧代-1h-茚-5-基)氧基]丁酸(dcpib,图21e)属于一系列结构多样的(酰芳氧基)乙酸衍生物,其在20世纪70年代后期被合成并研究利尿特性,并在20世纪80年代被评估为脑水肿的潜在治疗药物。dcpib(虽然来源于fda批准的利尿剂依他尼酸)具有最低的利尿活性,并且已被替代地用作选择性的vrac/i
cl,swell
抑制剂(图21f),在swell1-lrrc8六聚体内的收缩点处结合(图21e),其中ic
50
为约5μm。在证明了swell1是脂肪细胞中正常胰岛素信号传导所必需后,我们预计通过dcpib(此处我们将其重新命名为sn-401)对vrac/i
c1,swell
的药理学抑制会降低胰岛素信号传导。出乎意料的是,当应用96小时时,sn-401增加了3t3-f442a前脂肪细胞(3倍对照表达;图21g)和脂肪细胞(1.5倍对照表达;图21i)中的swell1蛋白表达,并且与增强的pakt2的胰岛素刺激的水平(图21h和21j)以及pas160的胰岛素刺激的水平(图21k)相关。这些对胰岛素-akt2-as160信号传导的sn-401介导的影响在swell1 ko 3t3-f442a脂肪细胞中不存在,这与sn-401的swell1介导的靶向作用机制一致(图21h和21j)。swell1蛋白表达的sn-401介导的增加与swell1、lrrc8b、lrrc8c、lrrc8d或lrrc8e mrna表达的增加无关,提示这些蛋白的增加的表达的转录后机制(图28)。
[0331]
实例8:结构活性关系和分子对接模拟揭示了靶向活性所需的特定sn-401-swell1相互作用。
[0332]
为了证实sn-401诱导的swell1蛋白的增加是由与swell1-lrrc8通道复合物直接结合介导的,而不是非靶效应,我们设计并合成了新的sn-401同系物,其具有维持或增强(sn-403、sn-406、sn-407;图22a),或完全消除(sn071、sn072;图22a)的i
cl,swell
的sn-401靶向抑制(图22b和22c;图29a-29c)的微妙结构变化。在这项工作的过程期间,kern d.m.等人发表了sn-401/dcpib与swell1同聚体结合的低温em结构(cryo-em structure ofsn-401/dcpib bound with the swell1 homomer)(kern等人,2019)。这种结构揭示了sn-401结合在swell1/lrrc8a同源六聚体孔中的收缩点处,其中负电性sn-401羧酸酯基团与一个或多个swell1单体中的r103残基静电相互作用(图22d)。此外,要求sn-401在脂质纳米盘中获得可分辨的低温em图像(kern等人,2019),就如同稳定swell1六聚体一样。
[0333]
为了表征负责与swell1-lrrc8结合的sn-401的结构特征,我们进行了sn-401及其类似物进入swell1同源六聚体(pdb:6nzz)的分子对接模拟,并确定了预测对sn-401-swell1-lrrc8结合至关重要的两个分子决定簇(图22e):(1)导致预测与一个或多个r103胍基团静电相互作用的阴离子羧酸酯基团的碳链的长度(在swell1/lrrc8a和lrrc8b中发现);和(2)疏水性环戊基基团的正确取向,其在lrrc8单体的界面处滑入疏水性裂缝中(在所有lrrc8亚基界面中保守)。对接模拟预测,将导致羧酸酯的碳链缩短2个碳将产生分子sn071,该分子可以通过羧酸酯基团与r103相互作用(图22f(i)),或者使环戊基环占据疏水性裂缝(图22f(ii)),但是无法同时参与两种相互作用(图22f,黑色箭头)。类似地,预测缺少丁基基团的sn-401类似物sn072无法将环戊基基团定向到有利于与疏水性裂缝相互作用而不会在分子中引入结构应变的位置(图29d,黑色箭头)。预测会消除羧酸酯-r103静电结合或环戊基-疏水性口袋结合的这两种结构修饰都足以在体外消除i
cl,swell
抑制活性(图22b
和22c)。相反,通过1-3个额外碳来延长与羧酸酯基团连接的碳链导致预测会增强r103静电相互作用的化合物(图22g;图29e-29g,黑色实心圆圈),并更好地定向环戊基基团以结合在疏水性裂缝内(图22g,图29e和图29f,黑色虚线圆圈)。
[0334]
由于较长的碳链提供了与r103残基的侧链碳的额外疏水相互作用,还预测了同系物sn-406和sn-407沿着通道的额外结合相互作用(图22g;图29e,灰色虚线)。预计这将增加sn-406/sn-407i
cl,swell
抑制活性,并且这正是所观察到的(图22b和22c;图29a-29c)。为了进一步测试这种药物-通道结合模型,我们在wt背景下过表达了r103e突变体swell1构建体,因为结合模型预测,通过用负电性谷氨酸残基(e103)替换正电性r103来降低孔收缩的正电性将降低sn-406i
cl,swell
抑制活性。与该结合模型的预测一致,表达hek细胞的r103e表现出降低的sn-406介导的i
cl,swell
抑制(图29h和29i)。
[0335]
总的来说,这些功能和分子对接实验表明,sn-401和swell1活性的同系物(sn-403/406/407)在r103(通过羧酸酯末端)处和在lrrc8单体之间的交界处(通过疏水性末端)与swell1-lrrc8六聚体结合,以稳定通道的封闭状态,从而抑制i
cl,swell
活性。在对接研究和结合模型的指导下,这些对接研究和结合模型揭示了sn-401羧酸酯基团与六聚体通道内多种lrrc8单体的r103残基相互作用,以及sn-401环戊基基团在相邻单体之间的疏水性裂缝内结合,我们假设这些sn-40x化合物起分子系绳的作用,以稳定swell1-lrrc8六聚体的组装。这减少了swell1-lrrc8复合物的分解和随后的蛋白酶体降解,从而增加了从er向质膜信号传导结构域的易位,起到药理学伴侣的作用。
[0336]
实例9:sn-401和swell1-活性的同系物sn-406在亚微摩尔浓度下起药理学伴侣的作用。
[0337]
为了验证这一假设,我们在基础培养条件下对分化的3t3-f442a脂肪细胞应用了swell1活性的sn-401和sn-406化合物,持续4天,然后在血清饥饿6小时后测量了swell1蛋白。在1μm和10μm下,sn-401和sn-406显著增加了swell1蛋白,其水平是媒介物治疗的对照的水平的1.5-2.3倍,而非活性同系物sn071和sn072不会显著增加swell1蛋白水平。(图23a和23b)。与媒介物或sn071(图23c、图30)相比,sn-401和sn-406还增强了前脂肪细胞中内源性swell1的质膜(pm)定位,与增加的内质网(er)向swell1的质膜转运和药理学伴侣活性一致。值得注意的是,sn-401和sn-406能够在低至1μm的浓度下增加swell1蛋白和转运,这表明sn-401和swell1活性同系物在封闭或静止状态下与swell1-lrrc8结合的ec
50
《1μm,或比抑制激活的swell1-lrrc8(在低渗刺激时)所需的约10μm浓度低一个数量级。实际上,在1μm(图23d和23e)和250nm(图23f和23g)低渗激活前30分钟对hek细胞应用sn-401或sn-406显著地抑制并延迟随后的低渗swell1-lrrc8激活,这与媒介物或非活性sn071和sn072化合物(图23d和23e)相反。这些数据支持这样的观点,即sn-40x化合物在封闭状态下比在开放状态下以更高的亲和力结合至swell1-lrrc8通道,并假定稳定了通道的封闭构象以抑制i
cl,swell
。此外,这些数据表明,sn-401及其swell1活性的同系物sn-40x在低于抑制激活的swell1-lrrc8通道所需的浓度十分之一的浓度下起药理学伴侣作用。实际上,与媒介物相比,用1μm的sn-401治疗3t3-f442a脂肪细胞96小时,然后进行洗脱,也稳健地增加了胰岛素-pakt2信号传导(图23h)。
[0338]
我们接下来询问了与代谢综合征中的糖脂毒性相关的内质网(er)应激是否可能损害swell1-lrrc8的组装和转运,以促进swell1蛋白降解,从而减少t2d中的i
cl,swell
和
swell1蛋白(图20a-20f)。在这种情况下,我们假设药理学伴侣(sn-401-406)可能有助于swell1-lrrc8的组装,并使swell1-lrrc8免于降解。为了在体外测试这一概念,我们首先用媒介物、sn-401、sn-406或sn072治疗3t3-f442a脂肪细胞,然后使这些细胞经受1mm棕榈酸盐+25mm葡萄糖以诱导糖脂毒性应激(图23i)。我们发现,在棕榈酸盐/葡萄糖治疗后,swell1蛋白减少了50%,与er应激介导的swell1降解一致,并且这种减少被swell1活性的sn-401和sn-406完全阻止,但未被swell1非活性的sn072完全阻止(图23i)。这些数据与以下观点一致:即在与t2d和代谢综合征相关的糖脂毒性条件下,sn-401和swell1活性的同系物起药理学伴侣作用,以稳定swell1-lrrc8的组装和信号传导。
[0339]
实例10:sn-401通过增强胰岛素敏感性和分泌来增加swell1并改善小鼠t2d模型中的全身性葡萄糖稳态。
[0340]
为了确定sn-401是否改善体内胰岛素信号传导和葡萄糖稳态,我们用sn-401(5mg/kg腹腔内注射,持续4-10天)治疗了两种t2d小鼠模型:肥胖的hfd喂养的小鼠和多基因t2d kkn小鼠模型。在体内,sn-401在hfd喂养的t2d小鼠的脂肪组织中增加了2.3倍的swell1表达(图24a)。类似地,sn-401将t2d kkn小鼠的脂肪组织中的swell1表达增加至与非t2d c57/b6小鼠和亲本kkaa亲本品系相当的水平(图24b)。在hfd诱导的t2d小鼠(图24c)和多基因t2d kkay模型(图24d-24f)中,这种swell1表达的恢复与标准化的空腹血糖(fg)、葡萄糖耐量(gtt)和显著改善的胰岛素耐量(itt)相关。值得注意的是,用相同治疗剂量(5mg/kg
×
4-10天)的sn-401治疗对照kkaa亲本品系不会引起低血糖,也不会改变葡萄糖和胰岛素耐量(图24d-24f)。类似地,与媒介物治疗的小鼠相比,用sn-401治疗的瘦的、非t2d的、葡萄糖耐受的小鼠具有相似的fg、gtt和itt(图24g和24h以及图31a-31c)。然而,当在hfd喂养16周后使其具有胰岛素抗性和糖尿病性时,与媒介物相比,用sn-401治疗的这些相同的小鼠(来自图24g和24h)显示出fg(图24i)、gtt和itt(图24j)的显著改善。这些数据表明,sn-401在t2d的环境下恢复葡萄糖稳态,但对非t2d小鼠的葡萄糖稳态几乎没有影响。重要的是,这预示着诱发低血糖的较低风险。在慢性腹腔内注射方案期间,sn-401耐受良好,其中在长达8周的每日腹腔内注射中没有明显的毒性体征,尽管对葡萄糖耐量有显著影响(图31d)。事实上,在腹腔内注射或口服施用5mg/kg的sn-401或sn-406后的小鼠中sn-401和sn-406的体内药代动力学(pk)表明,血浆浓度会短暂接近(图31e和31f,腹腔内给药),或保持远低于i
cl,swell
抑制浓度(图31g和31h,口服给药),同时超过足以维持swell1药理学伴侣活性{》约100nm)持续8-12小时的浓度。
[0341]
sn-401具有计算机、体外和体内特性,表明其可能是t2d的有效口服疗法。首先,被设计成鉴定具有口服药物样物理化学性质的候选化合物的几种算法(lipinski(lipinski等人,2001),veber(veber等人,2002),egan(egan等人,2000),mddr(oprea,2000))表明,与目前批准的口服t2d药物相比,sn-401具有口服药物样性质(下表7)。
[0342]
表7:sn-401和sn-406的计算机预测的药物相似性与常见的t2d药物相似
401治疗的hfd小鼠中,利用长期hfd(21周hfd)经典观察到的gsis损伤被显著改善,这与胰腺β细胞中swell1诱导的预测效应一致。与媒介物治疗的t2d kkn小鼠相比,在sn-401中进行的灌注测定获得了类似的结果(图24m)。总之,这些数据表明t2d中的全身性血糖的sn-401介导的改善通过外周胰岛素敏感性和β细胞胰岛素分泌的增加来实现,这是通过sn-401药理学伴侣介导的swell1-lrrc8功能获得-体内功能丧失研究的反向表型来实现的(kang等人,2018和zhang等人,2017)。
[0350]
实例11:sn-401改善了小鼠t2d模型中的全身性胰岛素敏感性、组织葡萄糖摄取和非酒精性脂肪性肝病。
[0351]
为了更严格地评估sn-401对t2d小鼠的胰岛素敏化和葡萄糖代谢的影响,我们比较了用sn-401或媒介物治疗的t2d kkn小鼠中用3h葡萄糖和14c脱氧葡萄糖示踪的正常血糖高胰岛素钳夹。与媒介物相比,sn-401治疗的t2d kkn小鼠需要较高的葡萄糖输注速率(gir)以维持正常血糖,这与增强的全身性胰岛素敏感性一致(图25a)。在基线时,在sn-401治疗的t2d kkn小鼠中,由糖异生和/或糖原分解产生的肝脏葡萄糖(ra,葡萄糖出现率)减少40%(基础,图25b),并且在葡萄糖/胰岛素输注期间进一步抑制75%(钳夹,图25b)。这些数据表明,sn-401可增加肝脏胰岛素敏感性。
[0352]
由于预计sn-401介导的swell1的增加会增强胰岛素-pakt2-pas160信号传导、glut4质膜易位和组织葡萄糖摄取,我们接下来使用2-脱氧葡萄糖(2-dg)测量了sn-401对脂肪、心肌和骨骼肌中的葡萄糖摄取的影响。sn-401增强了胰岛素刺激的2-dg摄取进入腹股沟白色脂肪组织(iwat)、性腺白色脂肪组织(gwat)和心肌(图25c),但未进入棕色脂肪或骨骼肌(图32a)。由于脂肪细胞swell1消融显著降低了胰岛素-pakt2-pgsk3调节的细胞糖原含量,我们接下来询问了在t2d的环境下,sn-401介导的swell1的增加是否会增加葡萄糖结合到组织糖原中。实际上,在sn-401治疗的小鼠中,肝脏、脂肪和骨骼肌葡萄糖整合到糖原中显著增加(图25d),这与swell1介导的胰岛素-pakt2-pgsk3-糖原合酶功能获得一致。
[0353]
与t2d一样,非酒精性脂肪性肝病(nafld)与胰岛素抵抗有关。nash是一种晚期形式的非酒精性肝病,其由三种组织学特征定义:肝脂肪变性、肝小叶炎症、肝细胞损伤(气球样变),并且可以在无或无纤维化的情况下存在。nafld和t2d可能共享至少一些病理生理学机制,因为超过三分之一(37%)的患有t2d的患者患有nash,并且几乎一半(44%)的患有nash的患者患有t2d。(为了评估sn-401对nafld发生的影响,小鼠以hfd饲养16周,随后在5周内间歇给药sn-401(图25e)。与媒介物治疗的小鼠相比,用sn-401治疗的小鼠具有非常小的肝脏,具有降低的绝对和体质量标准化的肝脏质量(图25f),和较低的肝脏甘油三酯浓度(图25h)。组织学评价显示,与媒介物治疗的小鼠相比,用sn-401治疗的小鼠具有显著降低的肝脂肪变性和肝细胞损伤(图25f和25j)。在用sn-401治疗的小鼠中,与媒介物治疗的小鼠相比,整合了肝脂肪变性、小叶炎症和肝细胞气球样变的组织学评分的nafld活性评分(nas)(kleiner等人,2005)(图25i)在sn-401治疗的小鼠中也改善了》2分。总之,这些数据揭示sn-401增强了swell1蛋白和swell1介导的信号传导,以同时增强全身性胰岛素敏感性和胰腺β细胞胰岛素分泌,从而使t2d小鼠模型中的全身性血糖正常化。这种改善的代谢状态可以减少与肥胖和t2d相关的异位脂质沉积和nafld。
[0354]
实例12:swell1活性的sn-401同系物改善小鼠t2d的全身性葡萄糖稳态。
[0355]
为了确定在t2d小鼠中体内观察到的sn-401的效应是否可归因于swell1-lrrc8结
合,而不是脱靶效应,我们接下来测量了在用swell1-活性sn-403或sn-406治疗的hfd t2d小鼠中的空腹血糖和葡萄糖耐量,并与swell1-非活性sn071(所有均为5mg/kg/天
×
4天)进行比较。在用hfd治疗8周的小鼠中,与sn071相比,sn-403显著降低了空腹血糖并改善了葡萄糖耐量(图26a)。在以hfd饲养12-18周、具有更严重的肥胖诱导的t2d的小鼠队列中,sn-406还显著降低了空腹血糖并改善了葡萄糖耐量(图26b)。类似地,在单独的实验中,与swell1-非活性sn071相比,sn-406显著改善了hfd t2d小鼠中的葡萄糖耐量(图26c),并且这与基于胰岛素抵抗的稳态模型评估(homa-ir)的胰岛素敏感性改善趋势有关(matthews等人,1985)(图26d),并且显著增加了周边灌注gsis中的胰岛素分泌(图26e)。最后,基于gttauc,与sn071相比,sn-407还改善了t2d kkn小鼠中的葡萄糖耐量(图26f)并增加了gsis(图26g)。这些数据揭示了sn-401及其生物活性同系物的体内抗高血糖作用需要swell1-lrrc8结合,因此支持swell1体内靶向活性的概念。
[0356]
实例13:对实例6至12的讨论。
[0357]
我们目前的工作模型是,从代偿性肥胖(糖尿病前期,正常血糖)向失代偿性肥胖(t2d,高血糖症)的转变反映了外周胰岛素敏感组织(和胰腺β细胞)中的swell1蛋白表达和信号传导的相对减少-代谢现象复制swell1-功能丧失模型以及其他。这有助于组合的胰岛素抵抗和受损的胰岛素分泌,其与不良控制的t2d和高血糖症相关。swell1形成一种大分子信号传导复合物,该大分子信号传导复合物包括swell1和lrrc8b-e的杂六聚体,其化学计量可能因组织而异。我们认为,swell1-lrrc8信号传导复合物本质上是不稳定的,因此一部分复合物会发生分解和降解。与t2d状态相关的糖脂毒性和随后的er应激为swell1-lrrc8复合物的组装提供了不利的环境,导致swell1降解以及在t2d中观察到的swell1蛋白和swell1介导的i
cl,swell
的减少。具有保留的swell1结合活性的小分子sn-401和sn-401同系物充当药理学伴侣,以稳定swell1-lrrc8复合物的形成。这减少了swell1的降解,并增强了swell1-lrrc8杂聚体通过er和高尔基体到达质膜的通道,从而纠正了t2d和代谢综合征的情况下多个代谢重要组织中的swell1-缺陷状态,以通过胰岛素敏化和分泌机制改善总体系统性血糖。事实上,对于niemann-pick c疾病和先天性高胰岛素血症(sur1-katp通道突变体),已经证明了小分子抑制剂充当治疗性分子伴侣以支持蛋白质(包括离子通道)的折叠、组装和转运的概念。此外,这种治疗机制类似于另一种氯离子通道cftr(vx-659/vx-445,福泰制药(vertex pharmaceuticals))的小分子校正器,其已证明是囊性纤维化的突破性治疗方法。
[0358]
通过结构活性关系(sar)和计算机分子对接研究,我们确定了在sn-401分子的相对两端上的热点,这些热点与swell1-lrrc8复合物的单独的区域相互作用:在孔中的收缩处多个lrrc8亚基中的具有r103的羧酸酯基团,以及由相邻的lrrc8单体形成的疏水性裂缝中的环戊基基团;其功能类似于分子钉或系绳,以将松散缔合的swell1同聚体(尤其是在t2d的环境中)结合和稳定为更刚性的六聚体结构。实际上,在脂质纳米盘中获得的低温em结构需要dcpib/sn-401结合,以便获得足够空间分辨率的图像(kern等人,2019),这支持了sn-401使swell1同源体稳定的概念。由sar研究提供的另一个优势是鉴定和合成了去除(sn071/sn072)或增强(sn-403/406/407)swell1结合的sn-401同系物,因为这些提供了在体外和体内直接查询swell1-靶向活性的强大工具,并且还验证了开发具有增强的功效的新型sn-401同系物的概念验证。
[0359]
swell1-lrrc8复合物在多种组织中广泛表达,并且由swell1、lrrc8b、lrrc8c、lrrc8d和lrrc8e的未知组合组成,表明swell1复合物将具有极大的异质性。然而,swell1-lrrc8稳定剂如sn-401可被设计成靶向多个(如果不是所有的话)可能的通道复合物,因为所有的通道复合物都将包含sn-401结合所必需的要素:至少一个r103(来自必需的swell1单体:羧基基团结合位点)和疏水性裂缝的性质(环戊基结合位点),其在所有lrrc8单体中是保守的。实际上,追踪的葡萄糖钳夹确实示出了在多种组织(包括脂肪、骨骼肌、肝脏和心脏)中的胰岛素敏化效应。在心脏中的增加的葡萄糖摄取尤其令人感兴趣,因为这可能对心脏能量学提供有益影响,其可能有利地影响糖尿病心肌病的收缩(hfref)和舒张(hfpef)功能,从而可能改善t2d的心脏结局,如使用sglt2抑制剂所观察到的。
[0360]
目前的研究为使用swell1调节剂(sn-40x同系物)药理学诱导swell1信号传导提供了初步的概念验证,以治疗多个稳态节点(包括脂肪、肝脏和胰腺β细胞)处的代谢疾病。因此,sn-401可以代表一种工具化合物,从该化合物可以衍生出新的药物类别以治疗t2d、nash和其他代谢疾病。
[0361]
实例14:用于实例15至22的材料和方法。
[0362]
动物。所有小鼠均被关在温度受控的、湿度受控的和光受控的房间中,并允许自由获取水和食物。在这些研究中生成并使用雄性和雌性swell1fl/fl(wt)、myl1cre;swell1
fl/fl(
myl1 ko)、myf5cre;swell1
fl/fl
(骨骼肌靶向的swell1 ko)。myl1cre(jax#24713)和myf5cre(jax#007893)小鼠均购自杰克逊实验室。对于高脂肪饮食(hfd)研究,我们从14周龄开始使用researchdiets inc.(cat#d12492)(60千卡%脂肪)方案。
[0363]
生成crispr/cas9-介导的swell1液氧(floxed)(swell1fl/fl)小鼠。如前所述(zhang等人,2017),生成swell1fl/fl小鼠。简而言之,从ensembl转录本id ensmust00000139454中获得swell1内含子序列。使用zifit targeter 4.2版来鉴定所有crispr/cas9位点。按照在cong等人.2013中详述的方案,对与所选的crispr-cas9靶位点相对应的寡核苷酸对进行设计、合成、退火并将其克隆到px330-u6-嵌合_bb-cbh-hspcas9构建体(addgene质粒#42230)中。将crispr-cas9试剂和ssodn分别以5ng/μl和75-100ng/μl的注射液浓度注射到f1混合的c57/129小鼠品系胚胎的原核中。通过跨过外显子3的任一侧上预测的loxp插入位点进行pcr,来筛选正确靶向的小鼠。然后将这些小鼠回交》8代进入c57bl/6背景。
[0364]
抗体:针对表位qrtksrieqgivdrse(seq id no:13)(太平洋抗体)产生兔多克隆抗swell1抗体。所有其他初级抗体均购自细胞信号传导:抗β-肌动蛋白(#8457s)、p-akt1(#9018s)、akt1(#2938s)、pakt2(#8599s)、akt2(#3063s)、p-as160(#4288s)、as160(#2670s)、ampkα(#5831s)、pampkα(#2535s)、foxo1(#2880s)和pfoxo1(#9464s)、p70 s6激酶(#9202s)、p-p70 s6激酶(#9205s)、ps6核糖体(#5364s)、gapdh(#5174s)、perk1/2(#9101s)、总erk1/2(#9102s)。纯化的小鼠抗grb2购自bd(610111s)。纯化的抗flag小鼠抗体购自西格玛。兔igg圣克鲁斯(sc-2027)。除了以1:2000稀释度的抗flag外,所有初级抗体均以1:1000稀释度使用。所有二级抗体(抗兔-hrp和抗小鼠-hrp)均以1:10000稀释度使用。
[0365]
腺病毒。含有ad5-cmv-mcherry(1x10
10
pfu/ml)、ad5-cmv-cre-mcherry(3x10
10
pfu/ml)的5型腺病毒是从爱荷华大学病毒载体核心实验室(university of iowa viral vector core facility)获得的。ad5-cag-loxp-stop-loxp-3xflag-swell1
(1x10
10
pfu/ml)从矢量生物实验室获得。ad5-u6-shgrb2-gfp(1x109pfu/ml)和ad5-u6-shscr-gfp(1x10
10
pfu/ml)从矢量生物实验室获得。
[0366]
电生理学。所有记录均在室温下以全细胞配置进行,如前所述(zhang等人,2017和kang等人,2018)。简而言之,使用pclamp 10.4软件,使用与digidata 1550数字化仪配对的axopatch 200b放大器或multiclamp 700b放大器(分子器件(molecular devices))测量电流。细胞内溶液包含(以mm计):120l-天冬氨酸、20cscl、1mgcl2、5egta、10hepes、5mgatp、120csoh、0.1gtp、ph 7.2(含csoh)。用于低渗刺激的细胞外溶液包含(以mm计):90nacl、2cscl、1mgcl2、1cacl2、10hepes、5葡萄糖、5甘露醇、ph 7.4(含naoh)(210mosm/kg)。等渗细胞外溶液包含与如上述相同的组成,除了甘露醇浓度为105(300mosm/kg)。通过蒸汽压渗透压计5500(wescor)检查渗透压。电流在10khz下滤波,并以100μs间隔采样。使用p-87微量移液器拔出器(萨特仪器(sutter instruments))从硼硅酸盐玻璃毛细管(wpi)中拔出贴片式移液器。当贴片式移液器填充有细胞内溶液时,移液器电阻为约4-6mω。保持电位为0mv。每隔4秒施加从100mv至+100mv(以0.4mv/ms)的电压斜坡。
[0367]
原代肌卫星细胞分离:卫星细胞分离和分化如前所述进行,做了少量修改(hindi等人,2017)。简而言之,从swell1
flfl
小鼠(8-10周龄)中切除腓肠肌和四头肌,并用补充有1%青霉素-链霉素和真菌腙(300μl/100ml)的1xpbs洗涤两次。肌肉组织在补充有胶原酶ii(2mg/ml)、1%青霉素-链霉素和真菌腙(300μl/100ml)的dmem-f12培养基中孵育,并在摇瓶中在37℃下孵育90分钟。用1x pbs洗涤组织,并再次与补充有胶原酶ii(1mg/ml)、分散酶(0.5mg/ml)、1%青霉素-链霉素和真菌腙(300ul/100ml)的dmem-f12培养基在摇床中在37℃下孵育30分钟。随后,将组织切碎并通过细胞过滤器(cell strainer)(70μm),并且在离心后,将卫星细胞置于bd matrigel包被的培养皿上。在dmem-f12、20%胎牛血清(fbs)、40ng/ml碱性成纤维细胞生长因子(bfgf,r&d系统公司(r&d systems),233-fb/cf)、1x非必需氨基酸、0.14mmβ-巯基乙醇、1x青霉素/链霉素和真菌腙中刺激细胞以分化为成肌细胞。成肌细胞用10ng/ml的bfgf维持,然后当达到80%汇合时在dmem-f12、2%fbs、1x胰岛素
–
转铁蛋白
–
硒培养基中分化。
[0368]
细胞培养:将wt c2c12和swell1 ko c2c12细胞系在37℃、5%co2杜尔贝科改良的eagle培养基(dmem;gibco)(其补充有10%胎牛血清(fbs;亚特兰大生物选择(atlanta bio selected))和抗生素1%青霉素-链霉素(gibco,美国)下培养。将细胞生长至80%汇合,然后转移至补充有抗生素和2%马血清(hs;gibco)的分化培养基dmem中以诱导分化。每两天更换一次分化培养基。允许细胞分化为肌管最多6天。随后,获取肌管图像以用于量化肌管表面积和融合指数。
[0369]
肌管形态、表面积和融合指数定量:在分化后(第7天),用olympus ix73显微镜(10x物镜,奥林巴斯(olympus),日本)对细胞成像。对于每个实验条件,从6孔板中随机捕获5-6幅亮场图像。使用imagej软件手动定量肌管表面积。由不了解实验条件的独立观察者进行形态计量量化。对于融合指数,将生长在盖玻片上的分化的肌管用1xpbs洗涤,并用2%的pfa固定。在用1xpbs洗涤3次后,在室温下用0.1%tritonx100透化细胞5分钟,然后用5%山羊血清进行封闭30分钟。用dapi(1μm)对细胞进行染色15分钟,并且在用1x pbs洗涤后,将盖玻片放置在含有prolong diamond抗衰减的载玻片上。使用olympus ix73显微镜(10x物镜,奥林巴斯,日本)利用亮场和dapi滤波对细胞进行成像。通过imagej分析融合指数(肌管
内整合的核的数目/该视野中存在的核的总数)。
[0370]
rna测序:rna质量通过安捷伦生物分析仪(agilent bioanalyzer)2100由爱荷华大学人类遗传学研究所基因组部(university of iowa institute of human genetics,genomics division)评估。大于8的rna完整性数值对于rnaseq文库制备是接受的。生成了富含150bp polya的rna的rna文库,并在hiseq 4000基因组测序平台(依诺米那(illumina))上进行测序。测序结果已被上传并使用basespace(依诺米那)进行分析。使用fastq工具包(2.2.0版)将序列修剪至125bp,并使用rna-seq比对(1.1.0版)与小家鼠mmp10基因组进行比对。使用袖扣组装(cufflinks assembly)和de(2.1.0版)来组装转录物并测定差异基因表达。匠心通路分析(ingenuity pathway analysis)(qiagen)用于分析显著调节的基因,这些基因使用每百万读数中每千碱基》1.5个片段、基因表达变化》1.5倍和错误发现率《0.05的截止值进行过滤。生成热图以可视化显著调节的基因。
[0371]
肌管信号传导研究:对于胰岛素刺激,将分化的c2c12肌管在无血清培养基中孵育6小时,并用0nm和10nm胰岛素刺激15分钟;而分化的原代肌管在无血清培养基中培养4小时,并用0nm和10nm胰岛素刺激2小时。为了检查在swell1过表达(swell1o/e)时的细胞内信号传导,我们通过在dmem(2%fbs和1%青霉素-链霉素)中用ad5-cag-loxp-stop-loxp-swell1-3xflag(moi 50-60)和ad5-cmv-cre-mcherry(moi 50-60)和聚芳烃(4μg/ml)转导c2c12肌管36小时来过表达swell1-3xflag。将ad5-cmv-cre-mcherry单独与聚芳烃(4μg/ml)(moi 50-60)一起在wt c2c12或swell1 ko c2c12中转导作为对照。通过mcherry荧光证实了病毒转导效率(60-70%)。允许细胞在分化培养基中进一步分化多达6天。在收集裂解物用于进一步的信号传导研究之前拍摄肌管图像。grb2敲低是通过在补充有聚芳烃(4μg/ml)的dmem(2%fbs和1%青霉素-链霉素)中用ad5-u6-shscr-gfp(对照,moi 50-60)或ad5-u6-shswell1-gfp(grb2 kd,moi 50-60)转导肌管24小时来实现的。允许细胞在分化培养基中进一步分化多达6天。在收集细胞以用于rna分离之前,拍摄分化的肌管图像用于肌管表面积定量。
[0372]
拉伸刺激:将c2c12肌管置于6孔bioflex培养板的每个孔中。允许细胞在分化培养基中分化多达6天,然后将其置于flexcell jr.张力系统(fx-6000t)中,并在37℃下用5%co2孵育。使柔性膜上的c2c12肌管经受无张力或5%的静态拉伸持续15分钟。裂解细胞并分离蛋白用于随后的蛋白质印迹。
[0373]
蛋白质印迹:用冰冷的1x pbs洗涤细胞,并且在加入蛋白酶/磷酸酶抑制剂(罗氏)的冰冷的裂解缓冲液(150mm nacl,20mm hepes,1%np-40,5mm edta,ph 7.5)中裂解。对细胞裂解物进行进一步声处理(20%脉冲频率,持续20秒),并在4℃下以14000rpm离心20分钟。收集上清液,并使用dc蛋白测定试剂盒(伯乐公司)估计蛋白质浓度。对于免疫印迹,向样品(10-20μg的蛋白质)中加入适量的4 x laemmli(伯乐公司)样品加载缓冲液,然后在90℃下加热5分钟,然后加载到4-20%凝胶(伯乐公司)上。使用运行缓冲液(伯乐公司)在110v下分离蛋白质2小时。将蛋白质转移到pvdf膜(伯乐公司)上,并且在tbst缓冲液(0.2m tris,1.37m nacl,0.2%吐温-20,ph 7.4)中的5%(w/v)bsa或5%(w/v)牛奶中在室温下将膜封闭1小时。将印迹与初级抗体在4℃下孵育过夜,然后在室温下将二级抗体(伯乐公司,山羊-抗小鼠#170-5047,山羊-抗兔#170-6515,均以1:10000使用)孵育1小时。将膜洗涤3次,并通过使用chemidoc成像系统(伯乐公司)通过化学发光(pierce)进行成像。使用
imagej软件进一步分析图像的波段强度。对β-肌动蛋白或gapdh水平进行定量,以用于相等的蛋白载量。
[0374]
免疫沉淀:将c2c12肌管置于位于完全培养基中的10cm培养皿上,并且生长至80%汇合。对于swell1-3xflag过表达,将ad5-cag-loxp-stop-loxp-3xflag-swell1(moi 50-60)和ad5-cmv-cre-mcherry(moi 50-60)与聚芳烃(4ug/ml)一起添加到在dmem培养基(2%fbs和1%青霉素-链霉素)中允许生长36小时的细胞中。然后将细胞转到分化培养基中持续多达6天。之后,在添加有蛋白酶/磷酸酶抑制剂(罗氏)的冰冷的裂解缓冲液(150mm nacl,20mm hepes,1%np-40,5mm edta,ph 7.5)中收获肌管,并在冰上在轻轻搅动下保持15分钟,以允许完全裂解。将裂解物与抗flag抗体(西格玛#f3165)或对照兔igg(圣克鲁斯sc-2027)在4℃下端对端旋转孵育过夜。加入蛋白g琼脂糖珠(ge)持续4小时,然后将样品以10,000g离心3分钟,并用ripa缓冲液洗涤3次,并重新悬浮在laemmli缓冲液(伯乐公司)中,煮沸5分钟,用sds-page凝胶分离,然后进行蛋白质印迹方案。
[0375]
rna分离和定量rt-pcr:将分化的细胞溶解在trizol中,并使用purelink rna试剂盒(美国生命技术公司)和柱dna酶消化试剂盒(美国生命技术公司)分离总rna。cdna合成、qrt-pcr反应和定量如前所述进行(zhang等人,2017)。所有实验均以一式三份进行,并且使用gapdh作为内标物以对数据进行标准化。用于qrt-pcr的所有引物在下表10中列出。
[0376]
表10:用于qrt-pcr的引物
[0377][0378]
肌肉组织匀浆:处死小鼠,并切除腓肠肌,并且用1x pbs洗涤。用手术刀片切碎肌肉组织,并保持在补充有蛋白酶/磷酸酶抑制剂(罗氏)的8体积的冰冷的均质化缓冲液(20mm tris,137mm nacl,2.7mm kcl,1mm mgcl2,1%triton x-100,10%(w/v)甘油,1mm edta,1mm二硫苏糖醇,ph 7.8)中。使用dounce均质机(40-50次通过)在冰上均质化组织,并在4℃下在连续旋转下孵育过夜。以20秒的周期间隔对组织裂解物进行进一步声处理持续2-3次,并在4℃下以14000rpm离心20分钟。收集上清液,用于使用dc蛋白测定试剂盒(伯乐公司)进行蛋白质浓度估计。由于该制剂中收缩性蛋白质含量较高,因此进行了考马斯凝胶染色以证明相等的蛋白质载量,并用于蛋白质印迹的定量标准化。
[0379]
组织组织学:使用异氟烷麻醉小鼠,然后进行颈椎脱位。小心地切除胫骨前肌
technologies)/海马生物科学(seahorse bioscience),美国马萨诸塞州北比勒利卡)在原代肌管中对细胞呼吸进行定量。将从swell1
flfl
小鼠分离的原代骨骼肌细胞以20
×
103/孔的密度铺在bd matrigel包被的板上。在24小时后,将细胞在dmem-f12培养基(2%fbs和1%青霉素-链霉素)中的ad5-cmv-mcherry或ad5-cmv-cre-mcherry(moi 90-100)中培养24小时。然后将细胞转到分化培养基中持续另外的3天。对于胰岛素刺激,将细胞在无血清培养基中孵育4小时,并用0nm和10nm胰岛素刺激2小时。随后,将培养基更换为xf-dmem,并在非co2培养箱中保持60分钟。在xf-dmem中测量基础氧消耗率(ocr)。随后,在加入下列化合物中的每一种后测量氧消耗:寡霉素(1μg/ml)(atp连接的ocr)、羰基氰化物4-(三氟甲氧基)苯腙(fccp;1μm)(最大容量ocr)和抗霉素a(10μm;备用容量ocr)。对于糖酵解应激测试,在实验之前,将细胞转到不含葡萄糖的xf-dmem培养基,并在非co2培养箱中保持60分钟。在xf-dmem中测定细胞外酸化率(ecar),然后测定以下附加条件:葡萄糖(10mm)、寡霉素(1μm)和2-dg(100mm)。海马实验的数据(其被标准化为蛋白质)反映了一次海马运行/条件6次重复的结果。
[0383]
代谢表型:通过核磁共振(nmr);echo-mri三合一分析仪,echomri,llc)测量小鼠身体组成(脂肪和瘦质量)。对于葡萄糖耐量测试(gtt),小鼠被禁食6小时,并腹腔内注射葡萄糖(对于瘦小鼠为1g/kg体重,而对于hfd小鼠为0.75g/kg体重)。在指定的时间使用血糖仪(拜耳医药保健有限公司)从尾尖血监测血糖水平。对于胰岛素耐量测试(itt),小鼠被禁食4小时,并在腹膜内注射胰岛素(humulinr,对于瘦小鼠为1u/kg,而对于hfd小鼠为1.25u/kg)后,在指定的时间通过血糖仪测量葡萄糖水平。
[0384]
统计学。数据以平均值
±
s.e.m表示。使用双尾配对的或未配对的学生t检验用于在两组之间进行比较。对于三个或更多个组,通过单向方差分析和tukey事后检验来分析数据。对于gtt和itt,使用了双向方差分析(anova)。p值《0.05被认为具有统计学意义。*、**和***分别表示小于0.05、0.01和0.001的p值。
[0385]
实例15:swell1在骨骼肌中表达并具有功能,并且是肌管形成所必需的。
[0386]
swell1(lrrc8a)是编码i
cl,swell
或体积调节型阴离子电流(vrac)的六聚体离子通道信号传导复合物的主要组分。虽然已经证明swell1-lrrc8复合物响应于非生理性低渗细胞外溶液的应用可调节细胞体积,但这种普遍表达的离子通道信号传导复合物的生理功能尚不清楚。为了确定骨骼肌中swell1-lrrc8通道复合物的功能,我们如前所述(zhang等人,2017和kim等人,2000)使用crispr/cas9介导的基因编辑从c2c12小鼠成肌细胞和从用腺病毒cre-mcherry(ko)转导或单独用mcherry(wt对照)转导的swell1
flfl
小鼠分离的原代骨骼肌细胞(zhang等人,2017)中遗传删除了swell1。swell1蛋白蛋白质印迹证实了swell1 ko c2c212肌管和swell1 ko原代骨骼肌肌管中均有稳健的swell1消融(图33a)。接下来,全细胞膜片钳揭示了,存在于wt c2c12成肌细胞中的低张力激活(210mosm)外向整流电流在swell1 ko c2c12成肌细胞中被消除(图33b),证实了swell1也是骨骼肌成肌细胞中i
cl,swell
或vrac所必需的。值得注意的是,swell1消融与c2c12成肌细胞和原代骨骼肌卫星细胞中受损的肌管形成相关(图33c),与wt相比,c2c12和骨骼肌肌管中的肌管面积分别减少58%和45%。作为替代的指标,与wt相比,在swell1 ko c2c12中成肌细胞融合也显著减少80%,如通过肌管融合指数(肌管内的核的数目/核的总数;图33c)所估计的。
[0387]
实例16:全局转录组分析揭示swell1消融会阻断成肌分化并对多种肌源性信号传
导通路进行失调
[0388]
为了进一步表征观察到的c2c12和原代肌细胞中的肌管形成中的swell1依赖性损伤,我们对swell1 ko c2c12相对于对照wt c2c12肌管进行了全基因组rna测序(rna-seq)。这些转录组学数据揭示了wt与swell1 ko c2c12肌管之间的全局转录概况的明显差异(图33d),大量骨骼肌分化基因受到显著抑制,包括mef2a(0.2倍)、myl2(0.008倍)、myl3(0.01倍)、myl4(0.008倍)、actc1(0.005倍)、tnnc2(0.005倍)、igf2(0.01倍)(图33e)。奇怪的是,这种成肌分化的抑制与ppargc1α(pgc1α;14倍)和(3.7倍)的显著诱导相关联。pgc1α和是骨骼肌分化的阳性调节因子,表明骨骼肌分化中的swell1依赖性缺陷位于pgc1α和的下游。为了进一步确定swell1介导的肌发生中断背后的假定通路失调,我们接下来对转录组数据进行通路分析。我们发现成肌分化所必需的多个信号传导通路被破坏,包括胰岛素(2x10-3)、map激酶(5x10-4)、pi3k-akt(1x10-4)、ampk(6x10-5)、整合素(3x10-6)、mtor(2x10-6)、整合素连接激酶(4x10-7)和il-8(1x10-7)信号传导通路(图33f)。
[0389]
实例17:swell1调节骨骼肌肌管中的多种胰岛素依赖信号传导通路
[0390]
在通路分析的结果的指导下,并且基于骨骼肌肉发生和成熟受胰岛素-pi3k-akt-mtor-mapk调节的事实,我们直接检查了wt和swell1 ko c2c12肌管中的多个胰岛素刺激的通路,包括胰岛素刺激的akt2-as160、foxo1和ampk信号传导。实际上,与wt c2c12肌管相比,在swell1 ko肌管中消除了胰岛素刺激的pakt2、pas160、pfoxo1和pampk(图34a和34c)。重要的是,与wt原代肌管相比,在swell1 ko原代骨骼肌肌管中胰岛素-akt-as160信号传导也被减弱(图34b和34d),这与观察到的分化阻断一致(图33c)。这证实了swell1依赖性胰岛素-akt和下游信号传导不是永生化c2c12肌管的特异性特征,但在原代骨骼肌肌管中也是保守的。还值得注意的是,在c2c12和原代骨骼肌细胞中,akt2总蛋白的减少与swell1消融有关,并且这与在rna测序数据中观察到的akt2 mrna表达减少3倍一致(图34e)。此外,许多关键的胰岛素信号传导和葡萄糖稳态基因的转录都受到swell1消融的抑制,包括glut4(slc2a4,51倍)、foxo3(2倍)、foxo4(2.8倍)和foxo6(18倍)(图34e)。实际上,在许多胰岛素敏感组织中,foxo信号传导被认为是将胰岛素信号传导与葡萄糖代谢整合。总之,这些数据表明,受损的swell1依赖性胰岛素-akt-as160-foxo信号传导与在培养的骨骼肌肌管中swell1消融时观察到的成肌分化的缺陷有关,并且也可预测骨骼肌葡萄糖代谢和氧化代谢中的推定损伤。
[0391]
实例18:在swell1缺失的c2c12中swell1的过度表达足以挽救成肌分化,并将细胞内信号传导增加到高于基线水平。
[0392]
为了进一步验证swell1介导的对肌肉分化和信号传导的影响,我们在swell1 ko c2c12成肌细胞(swell1 o/e)中重新表达了swell1,然后通过蛋白质印迹检查了与wt和swell1 ko c2c12肌管相比的肌管分化和多种细胞内信号传导通路的基础活性,包括pakt1、pakt2、pas160、p-p70s6k、ps6k和perk1/2。达到2.12倍wt水平的swell1 o/e完全挽救了swell1 ko肌管中的肌管发育(图35a),如通过将swell1 ko肌管面积恢复至高于wt的水平所量化的(图35b)。与wt c2c12肌管相比,在swell1 o/e(图35a和35b)时swell1 ko肌管发育的这种挽救与恢复(pas160、akt2、pakt1、akt1、p70s6k)或超正常(pakt2、p-p70s6k、ps6k、perk1/2)信号传导有关(图35c和35d)。这些数据表明,swell1蛋白表达水平强烈地调
控骨骼肌胰岛素信号传导和成肌分化。
[0393]
实例19:swell1-lrrc8介导c2c12肌管中的拉伸依赖性pi3k-pakt2-pas160-mapk信号传导。
[0394]
在细胞背景下,存在大量的报告表明vrac和功能性编码其的swell1-lrrc8复合物是机械响应的。已经良好地确认,机械拉伸是骨骼肌增殖、分化和骨骼肌肥大的重要调节因子,并且可能由pi3k-akt-mapk信号传导通路和整合素信号传导通路介导。为了确定对于在骨骼肌肌管中拉伸介导的akt和map激酶信号传导是否也需要swell1,我们使用flexcell拉伸系统对wt和swell1 ko c2c12肌管进行了0%或5%的等轴拉伸。机械拉伸(5%)足以以swell1依赖性方式刺激wt c2c12中的pi3k-akt2/akt1-pas160-mapk(erk1/2)信号传导(图36a和36b)。这些数据表明,swell1-lrrc8是胰岛素和拉伸介导的pi3k-akt-pas160-mapk信号传导的共同调节因子。
[0395]
实例20:swell1与grb2在c2c12肌管中相互作用,并且调节成肌分化。
[0396]
早先在淋巴细胞和脂肪细胞中曾有报告,swell1-lrrc8复合物与生长因子受体结合2(grb2)相互作用并调节pi3k-akt信号传导,其中grb2与irs1/2结合并负调节胰岛素信号传导。事实上,grb2敲低增强了胰岛素-pi3k-mapk信号传导,并诱导了肌生成和成肌分化基因。为了确定在c2c12肌管中swell1和grb2是否相互作用,我们在c2c12细胞中过表达c末端3xflag标记的swell1,然后用flag抗体进行免疫沉淀(ip)。我们从表达c2c12肌管的swell1-3xflag的裂解物中观察到grb2在flag ip上显著富集,这与grb2-swell1相互作用一致(图37a)。基于以下观点,即swell1滴定akt/mapk信号传导的grb2介导的抑制,并且swell1消融导致不受限制的grb2介导的akt/mapk抑制,我们接下来测试grb2敲低(kd)是否可以挽救swell1ko c2c12肌管中的成肌分化。swell1 ko c2c12成肌细胞中shrna介导的grb2 kd(swell1 ko/shgrb2;图37b)刺激肌管形成(图37c)并增加肌管面积(图37d),达到与wt/shscr相当的水平(图37c和37d)。类似地,相对于swell1 ko/shscr和wt/shscr,swell1 ko c2c12肌管中的grb2 kd诱导成肌分化标记物igf1、myohcl、myohclla和myohciib(图37e和37f)。这些数据与grb2抑制拯救了swell1ko c2c12中的肌管分化一致,并且支持swell1通过滴定grb2介导的信号传导调节成肌分化的模型。
[0397]
实例21:骨骼肌靶向的swell1敲除小鼠具有减小的骨骼肌细胞大小、肌肉耐力和离体力产生。
[0398]
为了检查体内swell1消融的生理后果,使用cre-loxp技术,通过将myf5-cre小鼠与swell1
fl/fl
小鼠杂交(myf5 ko;图38a),我们产生了骨骼肌特异性swell1 ko小鼠,并证实了myf5 ko腓肠肌中稳健的骨骼肌swell1耗竭,比wt对照低12.3倍(图38b)。值得注意的是,与在体外swell1 ko c2c12和原代骨骼肌肌管中观察到的骨骼肌发生中的严重损伤(图33、35和37)相反,基于echo/mri身体组成(图38c)和总肌肉重量(图38d),myf5 ko发育出与wt同窝仔可比的骨骼肌质量,并且以正常的孟德尔比率出生(下表11)。然而,组织学检查揭示,与wt相比,myf5 ko中的骨骼肌细胞横截面积减少了27%(图38e),这表明在体内骨骼肌细胞大小调节中需要swell1。这可能是由于肌管融合的减少引起的,如在体外c2c12和原代骨骼肌细胞中观察到的(图33),但在体内的发生程度较低。这些数据表明,在体外观察到的肌生成的严重损伤可能反映了骨骼肌发育中对swell1信号传导的非常早期的需求(在通过myf5-cre介导的swell1重组消除swell1蛋白之前),或体外相对于体内的成肌分化过程中
的其他根本差异。
[0399]
表11:来自myf5-cre x swell1
flfl
育种wt的基因型:swell1
flfl
;ko:myf5-cre xswell1
flfl
(myf5 ko)
[0400][0401]
由于胰岛素信号传导是骨骼肌氧化能力和耐力的重要调节因子,我们接下来在与myf5 ko小鼠相比的swell1
fl/fl
(wt)的跑步机测试中检查了运动耐量。与年龄和性别匹配的wt对照相比,myf5 ko小鼠表现出14%的下降的运动能力(图39a)。与对照相比,在myf5 ko中倒置测试的悬空时间也减少了29%,进一步支持了在体内骨骼肌swell1耗尽时降低的骨骼肌耐力(图39b)。为了确定这些体内肌肉功能的下降是否是由于肌肉特异性功能损伤引起的,我们接下来进行了离体实验,其中我们从小鼠中分离比目鱼肌,并进行抽动/训练测试。我们观察到,与wt对照相比,在myf5 ko比目鱼肌中产生的强直性张力峰值降低了15%(图39c),示出了骨骼肌自主机制,其中疲劳时间(ttf,图39d)或50%衰减的时间(图39e)没有差异。
[0402]
为了确定在肌肉耐力和力量方面这些依赖于swell1的差异是否是由于受损的氧化能力引起的,我们接下来测量了在基础和胰岛素刺激的条件下在wt和swell1 ko原代骨骼肌细胞中的氧消耗率(ocr)和细胞外酸化率(ecar)(图39f)。swell1 ko原代肌管的氧消耗比wt低26%,并且与wt细胞相反,对胰岛素刺激无反应(图39f),这与骨骼肌swell1耗竭时胰岛素-akt/erk1/2信号传导的消除一致。在存在复合物v和iii抑制剂、寡霉素和抗霉素a的情况下,这些相对变化持续存在(图39f和39g),表明胰岛素刺激的糖酵解途径主要在swell1耗竭时失调。相比之下,最大程度地解偶联线粒体的fccp消除了wt与swell1 ko原代肌细胞之间的氧消耗的差异,表明在swell1 ko肌肉中功能性线粒体含量可能没有差异。为了更直接地测量糖酵解,我们测量了wt和swell1 ko原代肌管中的细胞外酸化率(ecar)。与wt细胞相比,在swell1 ko中胰岛素刺激的ecar增加被消除,并且这些差异独立于电子转运链调节剂而持续存在(图39h)。这些数据表明,对骨骼肌细胞氧消耗的swell1调节发生在葡萄糖代谢水平—可能是通过swell1依赖性胰岛素-pi3k-akt-as160-glut4信号传导、葡萄糖摄取和利用发生的。在c2c12肌管中进行swell1消融后,在原代骨骼肌细胞中的这些发现得到多种糖酵解基因:aldoa、eno3、gapdh、pfkm和pgam2;以及葡萄糖和糖原代谢基因:phka1、phka2、ppp1r3c和gys1的显著转录抑制的支持(图41)。
[0403]
实例22:骨骼肌靶向的swell1消融会损害全身性葡萄糖代谢并增加肥胖症。
[0404]
在swell1 ko c2c12和原代肌管中观察到的受损的胰岛素-pi3k-akt-as160-glut4信号传导的证据的指导下,我们接下来通过测量葡萄糖和胰岛素耐量来检查wt和myf5 ko小鼠中的全身性葡萄糖稳态和胰岛素敏感性。在普通饲料饮食中,在wt与myf5 ko小鼠之间的葡萄糖耐量或胰岛素耐量(图40a)均无差异。然而,在饲料饮食myf5 ko小鼠的16-24周期间,根据身体组成测量结果(图40b),与wt相比,肥胖症增加29%,其中在瘦质量(图38c)方面或在总的体质量(图40c)方面无显著差异。当以高脂肪饮食(hfd)饲养myf5 ko小鼠16周后,与wt小鼠相比,在观察到的肥胖症方面没有差异(图42),但是葡萄糖耐量受损
(图40d),并且与wt相比,在hfd myf5 ko小鼠中存在轻度胰岛素抵抗(图40e)。
[0405]
由于myf5也在棕色脂肪中表达,因此这些代谢表型可能是由棕色脂肪中的swell1介导的效应以及随后的全身性代谢的变化引起的。为了排除这种可能性,我们在通过将myl1-cre和swell1
fl/fl
小鼠(myl1-cre;swell1
fl/fl
)或myl1 ko杂交产生的骨骼肌靶向的ko小鼠中重复了上述实验的子集(图43a),因为myl1-cre限于成熟骨骼肌(图43b),并且不包括棕色脂肪。与myf5 ko小鼠相似,myl1 ko小鼠喂食普通饲料饮食,具有正常的葡萄糖耐量(图43c),但与wt相比,在跑步机测试中表现出24%的运动能力下降(图43d)。此外,myl1 ko小鼠在普通饲料时随着时间的推移发生增加的内脏肥胖症,其基于标准化为体质量的24%的增加的附睾脂肪质量(图43e),其中在腹股沟脂肪组织、肌肉质量(图43f)或总的体质量(图43g)方面无差异。这些数据表明,myl1 ko和myf5 ko小鼠中的受损的骨骼肌葡萄糖摄取通过增加的脂肪葡萄糖摄取和从头脂肪生成被补偿,这有助于保持葡萄糖耐量,但是以普通饲料饮食饲养的骨骼肌靶向的swell1 ko小鼠的肥胖症增加为代价。然而,营养过剩诱导的肥胖,以及脂肪和肝脏葡萄糖处置中的相关损伤可能揭示了骨骼肌靶向的swell1 ko小鼠中的葡萄糖耐受不良和胰岛素抵抗。
[0406]
实例23:对实例15至22的讨论。
[0407]
我们的数据揭示,在分化的成肌细胞培养物中,swell1-lrrc8通道复合物调节胰岛素/拉伸介导的akt-as160-glut4、map激酶和mtor信号传导,从而影响成肌分化、胰岛素刺激的葡萄糖代谢和氧消耗。在体内,骨骼肌靶向的swell1 ko小鼠具有较小的骨骼肌细胞、受损的肌肉耐力和力量生成,并且易患肥胖症、葡萄糖耐受不良和胰岛素抵抗。众所周知,胰岛素/拉伸介导的pi3k-akt、mtor信号传导是成肌分化、代谢和肌肉功能的重要调节因子,这表明,受损的swell1-akt-mtor信号传导可能是成肌分化中的缺陷的基础。事实上,与我们之前在脂肪细胞中的发现和提出的模型一致,其中swell1介导grb2与irs1的相互作用以调节胰岛素-akt信号传导,swell1也与骨骼肌管中的grb2相关,并且grb2敲低拯救了swell1 ko肌肉细胞中受损的成肌分化。因此,我们的swell1介导的脂肪细胞中胰岛素-pi3k-akt和下游信号传导的调节的工作模型在骨骼肌肌管中似乎是保守的。我们在crispr/cas9介导的swell1ko c2c12肌管和swell1 ko原代肌管中观察到的体外表型与chen等人,2019的观察结果一致,chen等人使用sirna介导的swell1敲低来证明swell1-lrrc8通道复合物是成肌分化所必需的。然而,grb2 kd和swell1 o/e在swell1 ko肌管中挽救成肌分化和增强胰岛素-akt、map激酶和mtor信号传导的能力均涉及非规范的、非传导性的信号传导机制。基于我们的工作以及之前的研究,尽管在c2c12肌管中有2倍的swell1 o/e时,pakt、perk1/2和mtor水平比内源性水平升高了2倍至3倍,但swell1 o/e并未将i
cl,swell
/vrac增加至超正常水平。这些数据表明,与规范/传导性的信号传导机制相反,替代的/非规范的信号传导机制是swell1-lrrc8信号传导的基础。
[0408]
还值得注意的是,在体外的c2c12肌管和原代肌管中,在swell1消融时观察到的深度成肌分化阻断在体内明显更温和,其中在myf5 ko小鼠中,仅观察到骨骼肌细胞横截面积减少30%,总肌肉质量或瘦肉含量没有变化。表型上的这种不一致可能反映了体外相对于体内环境的骨骼肌分化的生物学上的根本差异。
[0409]
尽管在myl1 ko和myf5 ko小鼠中整体肌肉发育基本完好,但与年龄和性别匹配的对照相比,随着时间的推移,在运动能力、肌肉耐力和力量生成方面存在持续下降,并且肥
胖症倾向增加。在骨骼肌swell1 ko小鼠中观察到的运动能力的损伤与某种水平的胰岛素抵抗一致,如在db/db小鼠和人类中,并且可能是由于在swell1耗尽的骨骼肌中受损的骨骼肌糖酵解和氧消耗引起的。此外,在myl1 ko和myf5 ko小鼠中观察到的增加的性腺肥胖症以及保持的葡萄糖和胰岛素耐量复制了骨骼肌特异性胰岛素受体ko小鼠(mirko)和表达骨骼肌显性-阴性胰岛素受体突变体的转基因小鼠,其中骨骼肌特异性胰岛素抗性驱动葡萄糖从骨骼肌到脂肪组织的重新分布,以促进肥胖症。在myf5 ko小鼠的情况下,营养过剩和hfd喂养暴露了这种潜在的轻度胰岛素抵抗和葡萄糖耐受不良。来自骨骼肌特异性akt1/akt2双ko小鼠的最新发现表明,这些效果可能不仅仅归因于肌肉akt信号传导,而是潜在地涉及其他胰岛素敏感信号传导通路。
[0410]
总之,我们表明swell1-lrrc8通过grb2介导的信号传导调节肌管中的成肌分化和胰岛素-pi3k-akt-as160、erk1/2和mtor信号传导。在体内,在营养过剩的情况下,需要swell1以用于维持正常的运动能力、肌肉耐力、基础条件下的肥胖症和全身性血糖。这些发现进一步有助于我们理解系统代谢的调节中的swell1-lrrc8通道复合物。
[0411]
参考文献
[0412]
ayala,j.e.,bracy,d.p.,malabanan,c.,james,f.d.,ansari,t.,fueger,p.t.,mcguinness,o.p.,和wasserman,d.h.(2011)“清醒的、无拘束的小鼠的高胰岛素-正常血糖钳夹(hyperinsulinemic-euglycemic clamps in conscious,unrestrained mice)”《可视化实验杂志(journal ofvisualized experiments)》:jove.
[0413]
bonetto,a.,andersson,d.c.&waning,d.l.“小鼠的肌肉质量和力量的评估(assessment ofmuscle mass and strength in mice)”《博内基报道(bonekeyrep)》4,732(2015).
[0414]
busch,a.k.,cordery,d.,denyer,g.s.,和biden,t.j.(2002)“棕榈酸酯和油酸酯调节的基因的表达谱为慢性脂质暴露对胰腺β细胞功能的影响提供了新的见解(expression profiling of palmitate-and oleate-regulated genes provides novel insights into the effects of chronic lipid exposure onpancreatic beta-cell function)”,《糖尿病(diabetes)》51,977-987.
[0415]
chen,l.,becker,t.m.,koch,u.&stauber,t.“lrrc8/vrac阴离子通道通过促进膜超极化来促进小鼠成肌细胞的成肌分化(the lrrc8/vrac anion channel facilitates myogenic differentiation of murine myoblasts by promoting membrane hyperpolarization)”.《生物化学杂志(j biol chem)》(2019).
[0416]
cong,l等人“使用crispr/cas系统的多重基因组工程改造(multiplex genome engineering using crispr/cas systems)”《科学(science)》339,819-823(2013).
[0417]
cragoe,e.j.,jr.,gould,n.p.,woltersdorf,o.w.,jr.,ziegler,c.,bourke,r.s.,nelson,lr.,kimelberg,h.k.,waldman,j.b.,popp,a.j和sedransk,n.(1982)“用于治疗脑损伤的药剂.1.(芳氧基链烷酸(agents for the treatment ofbrain injury.1.(aryloxy)alkanoic acids)”.《药物化学杂志(j med chem)》25,567-579.
[0418]
dougherty,j.p.,springer,d.a.&gershengorn,m.c.“跑步机疲劳测试:一种简单、高通量的小鼠疲劳样行为测定(the treadmill fatigue test:a simple,high-throughputassay offatigue-like behavior for the mouse)”《可视化实验杂志》,jove
(2016).
[0419]
egan,w.j.,merz,k.m.,jr和baldwin,j.j.(2000)“使用多元统计方法预测药物吸收(prediction of drug absorption using multivariate statistics)”《药物化学杂志》43,3867-3877.
[0420]
hindi,l.,mcmillan,j.d.,afroze,d.,hindi,s.m.&kumar,a.“来自成年小鼠的骨骼肌的原代成肌细胞的分离、培养和分化(isolation,culturing,and differentiation ofprimary myoblasts from skeletal muscle ofadult mice)”《生物方案(bio protoc)》7(2017).
[0421]
inoue,h.,takahashi,n.,okada,y和konishi,m.(2010)“来自正常和糖尿病小鼠的白色脂肪细胞中的体积敏感的外向整流氯离子通道(volume-sensitive outwardly rectifying chloride channel in white adipocytes from normal and diabetic mice)”《美国生理学杂志-细胞生理学(am j physiol cell physiol)》298,c900-909.
[0422]
kang,c等人“swell1是一种调节β细胞兴奋性和全身性血糖的葡萄糖传感器(swell1 is a glucose sensor regulating beta-cell excitability and systemic glycaemia)”《自然通讯(nat commun)》9,367(2018).
[0423]
kern,d.m.,oh,s.,hite,r.k和brohawn,s.g.(2019)“dcpib的低温em结构抑制了脂质纳米盘中的体积调节的阴离子通道lrrc8a(cryo-em structures of the dcpib inhibited volume-regulated anion channel lrrc8a in lipid nanodiscs)”.《生命科学在线(elife)》8.
[0424]
kim,j.k等人“底物向脂肪组织的再分布促进肌肉中具有选择性胰岛素抵抗的小鼠的肥胖(redistribution ofsubstrates to adipose tissue promotes obesity in mice with selective insulin resistance in muscle)”《临床调查杂志(j clin invest)》105,1791-1797(2000).
[0425]
kleiner,d.e.,brunt,e.m.,van natta,m.,behling,c.,contos,m.j.,cummings,o.w.,ferrell,l.d.,liu,y.c.,torbenson,m.s.,unalp-arida,a等人{2005)“非酒精性脂肪性肝病的组织学评分系统的设计与验证(design and validation ofa histological scoring system for nonalcoholic fatty liver disease)”《肝脏病学(hepatology)》41,1313-1321.
[0426]
liang,w.,menke,a.l.,driessen,a.,koek,g.h.,lindeman,j.h.,stoop,r.,havekes,l.m.,kleemann,r和van den hoek,a.m.(2014)“用于啮齿动物模型的通用nafld评分系统的建立及与人类肝脏病理学的比较(establishment ofa general nafld scoring system for rodent models and comparison to human liverpathology)”《公共科学图书馆期刊(plos one)》9,e115922.
[0427]
lipinski,c.a.,lombardo,f.,dominy,b.w和feeney,p.j.{2001)“在原始文献的药物发现和开发环境lpii中估计溶解度和渗透性的实验和计算方法:s0169-409x{96)00423-1(experimental and computational approaches to estimate solubility and permeability in drug discovery and development settingslpii oforiginal article:s0169-409x{96)00423-1)”。这篇文章最初发表在《高级药物递送评论(advanced drug delivery reviews)》23(1997)3-25.1.《高级药物递送评论》46,3-26上.
[0428]
oprea,t.i.{2000).“药物相关化学数据库*的属性分布(property distribution of drug-related chemical databases*)”《计算机辅助分子设计杂志(journal ofcomputer-aided molecular design)》14,251-264.
[0429]
rauckhorst,a.j.,gray,lr.,sheldon,r.d.,fu,x.,pewa,a.o.,feddersen,c.r.,dupuy,a.j.,gibson-corley,k.n.,cox,j.e.,burgess,s.c等人(2017)“线粒体丙酮酸载体介导高脂肪饮食诱导的肝tca循环能力的增加(the mitochondrial pyruvate carrier mediates high fat diet-induced increases in hepatic tcacycle capacity)”《分子代谢(mol metab)》6,1468-1479
[0430]
shiota,m.(2012)“体内葡萄糖稳态的测量:示踪剂和钳夹技术的组合(measurement ofglucose homeostasis in vivo:combination oftracers and clamp techniques)”“在糖尿病研究的动物模型中(in animal models in diabetes research)”,h.-g.joost,h.ai-hasani和a.schurmann编辑(新泽西州托托瓦市:胡玛纳出版社(humana press)),第229-253页.
[0431]
veber,d.f.,johnson,s.r.,cheng,h.-y.,smith,b.r.,ward,k.w和kopple,k.d.(2002)“影响候选药物的口服生物利用度的分子特性(molecular properties that influence the oral bioavailability ofdrug candidates)”《药物化学杂志》45,2615-2623.
[0432]
zhang,y等人“swell1是脂肪细胞大小、胰岛素信号传导和葡萄糖稳态的调节因子(swell1 is a regulator ofadipocyte size,insulin signaling and glucose homeostasis)”《自然细胞生物学(nature cell biology)》19,504-517(2017).
[0433]
当介绍本发明的要素或其优选的实施例时,冠词“一(a)”、“一个(an)”、“该”和“所述”意在表示存在一个或多个要素。术语“包括”、“包含”和“具有”旨在是包含性的,并且意味着除了所列出的要素之外,还可以存在另外的要素。
[0434]
鉴于上述,将可以看出,本发明的几个目的已经被实现,并且获得了其他有利的结果。
[0435]
由于在不脱离本发明的范围的情况下可以对上述组合物和方法进行各种改变,因此上述描述中包含的以及附图中示出的所有内容应被解释为说明性的,而不是限制性的。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1