一种美沙拉秦灌肠液制备方法及其应用与流程
一种美沙拉秦灌肠液制备方法及其应用
1.技术领域:本发明涉及一种药物制剂,更具体的说一种包含美沙拉秦的灌肠液。
背景技术:
2.美沙拉秦为类白色结晶性粉末,无臭,无味,遇光颜色渐变深,美沙拉秦在水中极微溶解,在乙醇、丙酮或三氯甲烷中不溶。在稀氢氧化钠(2%)溶液或稀盐酸(9.5%-10.5%)溶液中略溶。
3.美沙拉嗪由赛诺菲公司研发,后来美国地区授权给meda公司,日本地区授权给杏林制药,有多种上市剂型。美沙拉秦灌肠液于1987年首次在美国上市,后来于2009年5月获得德国上市批准,日本未上市该剂型。美国地区商品名为rowasa,德国地区商品名为salofack。美沙拉嗪是一种蛋白磷酸酶(pp-2a)抑制剂,用于治疗溃疡性结肠炎。
4.美沙拉秦受肝脏首过效应的影响,生物利用度较低,然而,临床常规口服剂型如胶囊剂、片剂等,均存在给药频繁、患者顺应性差的问题。因此,迫切需要开发一种新型美沙拉秦给药剂型。
5.灌肠液因其制备方法简单、无需送服及咀嚼、而是直接作用于靶点,起效快的优点,特别适用于吞咽困难的卧床病人、老人。避免了肝脏首过效应,提高了药物的生物利用度。
6.
技术实现要素:
针对上述现有技术,本发明提供了一种包含美沙拉秦的灌肠液,可方便的应用于具有吞咽困难的患者,药物释放迅速,提高了生物利用度。
7.本发明是通过以下技术方案实现的:
8.一种包含美沙拉秦的灌肠液,是由以下重量份的原料药及辅料制成的:美沙拉秦3.0~8.0份,黄原胶1.0~2.0份,依地酸二钠20.0~44.0份,苯甲酸钠10.0~15.0份,卡波姆0.5~1.0份,ph调节剂9.0~28.0份,抗氧化剂1.0~4.0份。
9.优选的,是由以下重量份的原料药及辅料制成的:美沙拉秦4.0份,黄原胶1.0份,依地酸二钠40.0份,苯甲酸钠13份,卡波姆1.0份,ph调节剂13.0份,抗氧化剂1.0份,其余为纯化水。
10.所述黄原胶选自75,180,优选75。黄原胶作为助悬剂,提高药物的稳定性和释放。
11.所述ph调节剂选自醋酸钠,醋酸钾,优选醋酸钾。
12.优选的,所述包含美沙拉秦的灌肠液,每瓶规格4g,美沙拉秦的重量含量为:4g/瓶。
13.所述包含美沙拉秦的灌肠液的制备方法,步骤如下:
14.(1)配液:取金属螯合剂、ph调节剂、防腐剂,加入适量的纯化水中搅拌溶解;
15.(2)配置助悬液:搅拌状态下加入配方量的助悬剂,使其充分溶胀;
16.(3)分散主药:加入配方量的抗氧剂和主药,搅拌均匀;
17.(4)均质:真空状态下,使用均质机均质,加水至全量,搅拌均匀;
18.(5)灌装:将美沙拉秦溶液灌装于瓶中,即得包含美沙拉秦的灌肠液。
[0019][0020]
本发明的含有美沙拉秦的灌肠液与美沙拉秦片剂,经实验证明,在向大鼠单个剂型施药后,各相关参数见下表1。
[0021]
表1药代动力学相关参数汇总
[0022]
制剂c
max
(ng.ml-1
.mg-1
)auc
max
(ng.ml-1
.mg-1
)cl/f(l/min/kg)灌肠液3816195.87片剂26518725.6
[0023]
本发明的有益技术效果是:本发明的含有美沙拉秦的灌肠液,可方便的应用于具有吞咽困难的患者,药物释放迅速,提高了生物利用度。
附图说明:
[0024]
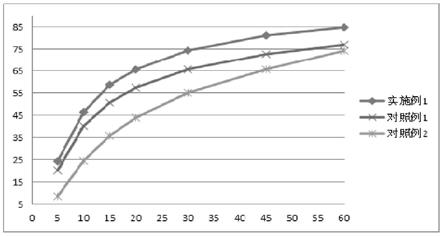
图1:按照本专利所制备的灌肠液、美沙拉秦灌肠(仿制药)与美沙拉秦口服片剂溶出曲线比较。
[0025]
图2:包含美沙拉秦的灌肠液及普通片剂在大鼠体内药代动力学比较。
具体实施方式
[0026]
下面结合实施例对本发明作进一步的说明。
[0027]
实施例1:制备含有美沙拉秦的灌肠液制备100瓶,每瓶中含美沙拉秦4g,原料及辅料用量为:美沙拉秦400g,黄原胶1.8g,依地酸二钠4.0g,苯甲酸钠1.3g,卡波姆0.1g,醋酸钾:1.9g,抗氧化剂0.1g。
[0028]
制备方法步骤如下:
[0029]
(1)配液:取金属螯合剂、ph调节剂、防腐剂,加入适量的纯化水中搅拌溶解;
[0030]
(2)配置助悬液:搅拌状态下加入配方量的助悬剂,使其充分溶胀;
[0031]
(3)分散主药:加入配方量的抗氧剂和主药,搅拌均匀;
[0032]
(4)均质:真空状态下,使用均质机均质,加水至全量,搅拌均匀;
[0033]
(5)灌装:将美沙拉秦溶液灌装于瓶中,即得包含美沙拉秦的灌肠液。
[0034]
对照例1:美沙拉秦灌肠(仿制药):国内在售的美沙拉秦灌肠液
[0035]
对照例2:美沙拉秦口服片剂:国内在售的美沙拉秦口服片剂(一)溶出实验:
[0036]
实验方法:按照中国药典2020年版四部通则进行美沙拉秦制剂的体外溶出曲线测定。以超声脱气的pbs(ph7.2)为释放介质,温度37
±
0.5℃。50r/min的转速下,5min,10min,15min,20min,30min,45min,60min取释放液5ml并补充同温等量的空白释放介质,经微孔滤膜过滤后,取续滤液进行紫外测定。
[0037]
结果:由图1可以看出按照本专利所描述制备的美沙拉秦的灌肠液具有比其他产品更好的溶出趋势。
[0038]
(二)体内药代动力学实验:
[0039]
实验方法:
[0040]
sd大鼠12只,体重250
±
20g,试验前禁食饲养1天,随机分为灌肠液组及片剂组。
[0041]
美沙拉秦灌肠液组大鼠直肠给予灌肠液(实施例1制备),片剂组给予市售品1片。分别于给药后10min,15min,30min,1h,1.5h,2h,4h,8h,12h,24h,36h和48h于大鼠静脉窦采
集血样,放入肝素化的抗凝管中,血样标本经6000rpm离心5min后,分取血浆测定血浆中美沙拉秦含量。
[0042]
实验结果:详见图2和表1。本发明的含有美沙拉秦的灌肠液,在向大鼠单个剂型施药后该剂型中每mg美沙拉秦提供374ng.ml-1
.mg-1
的平均最大血药浓度(c
max
)。而美沙拉秦片剂向大鼠单个剂量施药后该剂型中每mg美沙拉秦提供277ng.ml-1
.mg-1
(c
max
)。
[0043]
本发明的含有美沙拉秦的灌肠液,在向大鼠单个剂型施药后该剂型中每mg美沙拉秦提供725.8ng.ml-1
.mg-1
的平均生物利用度(auc
max
)。而美沙拉秦片剂向大鼠单个剂量施药后该剂型中每mg美沙拉秦提供469.6ng.ml-1
.
[0044]
mg-1
(auc
max
)。
[0045]
本发明的含有美沙拉秦的灌肠液,在向大鼠单个剂型施药后美沙拉秦提供6.92l/min/kg的清除率(cl/f)。而美沙拉秦片剂向大鼠单个剂量施药后该剂型中每mg美沙拉秦提供10.41l/min/kg(cl/f)。
[0046]
表2.大鼠体内血药浓度测定
[0047][0048][0049]
(3)稳定性试验考察
[0050]
根据2020版药典稳定性试验指导原则,考察实验样品(实施例1)的加速稳定性(考察条件:40℃
±
2℃,rh75%
±
5%),主要考察结果如下:
[0051][0052]
结果表明:实验样品在加速6个月的考察过程中,主要质量指标均符合规定,表明按本发明的处方工艺制备的样品稳定性好。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1