用于治疗癫痫持续状态的加奈索酮的制作方法
用于治疗癫痫持续状态的加奈索酮
1.本技术要求于2019年8月5日提交的美国临时申请no.62/882,648的权益,所述临时申请的全部内容以引用的方式并入本文中。
背景技术:
2.癫痫持续状态(“se”)是一种危及生命的神经系统急症,有着显著的发病率和死亡率(betjemann和lowenstein,(2015)the lancet neurology,14(6):615-624)。事实上,它是美国第二常见的神经系统急症,每年约有150,000例病例和55,000例相关死亡(moghasddasi等人,(2015)j.epilepsy res.,5(1):13-16)。
3.se表现为长时间的癫痫发作活动,通常持续超过5分钟,或者在癫痫发作之间没有恢复意识的反复癫痫发作。同上。se需要积极治疗以阻止癫痫发作并预防神经损伤,包括神经元死亡。随着se持续时间的增加,se变得更难以控制,并且长时间的se和治疗的难治性引起预后不良(cherian和thomas(2009),ann.indian.acad.neurol.,12(3):140-153)。治疗目标是快速停止癫痫发作、维持癫痫发作控制、防止进展成麻醉并避免进一步的医学并发症。同上。
4.目前针对se的治疗方案采用三阶段方法(shorvon和ferlisi(2011),brain,134(10)-2802-2818)。一线治疗通常使用苯二氮类(benzodiazepine)(例如,地西泮(diazepam)、劳拉西泮(lorazepam)和咪达唑仑(midazolam))(trinka和(2017),seizure,44:65-73;glauser等人,(2016),epilepsy curr.26(1):48-61)。然而,苯二氮类在大约35%-45%的病例中是无效的,并且引起心血管和呼吸系统的副作用。同上。如果在使用苯二氮类治疗后se继续存在,则其它抗癫痫药物(例如磷苯妥英(fosphenytoin)、左乙拉西坦(levetiracetam)和丙戊酸盐(valproate))将作为二线治疗静脉内(iv)施用。同上。在一线治疗和二线治疗后se继续存在的情况下,又称为难治性se,静脉内麻醉剂(例如,硫喷妥钠(thiopental)、丙泊酚(propofol)和咪达唑仑)用作三线治疗。同上。约31%-41%的se患者会发展成难治性se。三线药物的使用会导致医源性昏迷,这需要通过插管和机械通气来保护气道。此外,麻醉剂的使用引起高发病率和大约35%的死亡率。如果在诱发医源性昏迷后se继续存在,则称为超难治性se。表1提供了se可用疗法的总结,包括其不良反应。
5.表1.癫痫持续状态可用疗法的总结
[0006][0007]
充其量,目前的治疗仅在约50%的患者中有效控制中度严重se。在重度se中,成功率进一步降低(shorvon和ferlisi,(2011),brain,134(1):2802-2818)。此外,最近一些开发新治疗的尝试都失败了。例如,布瑞诺龙(brexanolone)(sage-547)是一种合成形式的内源性别孕烯醇酮(allopregnanolone),在一项用于治疗超难治性se的随机、双盲、安慰剂对照试验中,未能显示出优于安慰剂的疗效。(sage pharmaceuticals press release 2017年9月12日,www.businesswire.com/news/home/20170912005509/en/sage-therapeut ics-reports-top-line-results-phase-3)。因此,对于治疗se的有效疗法存在显著未满足的需求。
技术实现要素:
[0008]
本公开涉及一种治疗se的方法。se是一种极其复杂的疾患,治疗se和开发新的治疗方法具有很大的挑战性,并且基本上没有成功。如上所述,常规疗法对超过50%的患者无效。开发新se治疗的尝试通常都失败了。例如,在超难治性se患者的双盲、安慰剂对照的3期试验中,布瑞诺龙(即,别孕烯醇酮)未能显示出优于安慰剂的功效。
[0009]
如本文进一步描述和举例说明的,本发明人相信加奈索酮(ganaxolone)提供了有效的se疗法。但是,鉴于治疗se的复杂性和困难,以及先前研究未能显示功效,本发明人预计se的有效治疗将需要至少4天的高药物暴露量,然后是至少约1天的维持剂量。与这些预
期相反,本发明人意外地发现,以推注加持续输注的形式施用加奈索酮以将加奈索酮血浆浓度维持在远低于预期血清水平达至少约8小时(或在一些受试者下可能至少约4小时)会引起se的快速和持续抑制。如本文进一步描述和举例说明的,在所研究的患者中,当持续输注将加奈索酮血浆浓度维持在约500ng/ml或更高下达至少约8小时或至少约12小时(尽管在一些患者中,4小时就足够了)的目标浓度期时,实现了对se的持续抑制。
[0010]
因此,本公开涉及一种有效治疗se的方法,所述方法提供了对se的快速抑制、持续的功效(即,防止se复发并提供对se的持续抑制)和提高的安全性。
[0011]
本文公开的方法包括以静脉内推注和持续静脉内输注的形式向有需要的受试者施用治疗有效量的神经甾体,优选地加奈索酮。以抑制se的量施用静脉内推注。抑制se减少癫痫发作负担。典型地,约500ng/ml至约1000ng/ml的加奈索酮血浆浓度足以抑制se。举例来说,为了使加奈索酮血浆浓度水平达到500ng/ml至约1000ng/ml,可以在开始静脉内推注时将约5mg至约40mg加奈索酮的输注液输注到受试者中。优选地,在开始静脉内推注时或在静脉内推注期间将约30mg加奈索酮输注到受试者中。可以将静脉内推注施用(即,输注)到受试者中,持续约1分钟至约5分钟。
[0012]
加奈索酮的持续静脉内输注以足以持续抑制se的量施用持续目标浓度期。临床上,se的持续抑制是癫痫发作负担的减轻。
[0013]
加奈索酮的持续静脉内输注是与静脉内推注一起在围手术期开始。持续静脉内输注通常与静脉内推注的施用同时施用。在一些情况下,可以在静脉内推注之前或之后开始持续静脉内输注。
[0014]
当在整个目标浓度期期间持续输注维持约500ng/ml或更高的加奈索酮血浆浓度时则实现了se的持续抑制。在包括目标浓度期的整个治疗期内施用持续输注,在此期间受试者的加奈索酮血浆浓度维持在目标浓度下或高于目标浓度,例如约425ng/ml、约45ng/ml、约475ng/ml或优选地约500ng/ml。不过,认识到约425ng/ml、至少约450ng/ml或至少约475ng/ml或优选地至少约500ng/ml的血浆浓度足以维持持续se抑制。一般来说,希望加奈索酮血浆浓度不高于约1000ng/ml。这是因为高于1000ng/ml的加奈索酮血浆浓度会诱发麻醉,这不是治疗的预期效果。目标浓度期典型地是至少约8小时或至少12小时。在一些情况下,目标浓度可能为至少约4小时。典型地,在目标浓度期期间通过持续静脉内输注每小时向受试者施用的加奈索酮的量可以增加或减少以维持se的持续抑制,但足以维持至少约500ng/ml的加奈索酮血浆浓度。
[0015]
通过持续静脉内输注每小时向受试者施用的加奈索酮的量可以在从持续静脉内输注开始约24小时的时间段内减少。通过持续静脉内输注每小时向受试者施用的加奈索酮的量可以在开始持续静脉内输注后约2小时和/或约10小时至约14小时减少。通过持续静脉内输注每小时向受试者施用的加奈索酮的量优选地在开始持续静脉内输注后约2小时减少,然后在开始持续静脉内输注后约10小时至约14小时减少。相对于开始持续静脉内输注时每小时施用的量,在开始持续静脉内输注后约2小时,通过持续静脉内输注每小时向受试者施用的加奈索酮的量可以减少约50%。在开始持续静脉内输注后约10小时至约14小时,相对于开始持续静脉内输注时每小时施用的量,通过持续静脉内输注每小时向受试者施用的加奈索酮的量可以减少约75%。通过持续静脉内输注每小时向受试者施用的加奈索酮的量,在开始持续输注后约2小时,相对于开始持续静脉内输注时每小时施用的量,可以减少
约50%,然后在开始持续输注后约10小时至约14小时,相对于开始持续静脉内输注时每小时施用的量,减少约75%。
[0016]
在开始输注后2至12小时,相对于在目标浓度期期间给予的速率,通过持续静脉内输注每小时向受试者施用的加奈索酮的量可以减少约50%。在开始持续静脉内后再过12至24小时后,持续静脉内输注可再次减半,或目标浓度期输注速率的75%。
[0017]
在持续输注治疗期期间,可以将每小时约20mg加奈索酮至每小时约80mg加奈索酮输注到受试者中。一般来说,在开始持续静脉内输注时,可以将每小时约80mg加奈索酮输注到受试者中。在约2小时后,加奈索酮的量然后可以减少至每小时约40mg加奈索酮,然后在治疗期期间,减少至每小时约20mg加奈索酮。在一些情况下,从开始起可以通过持续静脉内输注向受试者施用约80mg加奈索酮并在此后持续约2小时,然后在开始后约2小时开始可以通过持续静脉内输注向受试者施用每小时约40mg加奈索酮并在此后持续约2小时至约10小时,然后在开始后约12小时开始可以通过持续静脉内输注向受试者施用每小时约20mg加奈索酮并在此后持续约12小时至约24小时。
[0018]
通过持续静脉内输注每向受试者施用的加奈索酮的量可以在从静脉内输注开始约24小时后增加。一般来说,相对于在开始持续静脉内输注后约24小时后开始每小时施用的量,通过持续静脉内输注每小时施用的加奈索酮的量可以增加至多约45%。举例来说,在开始后约24小时开始,通过持续静脉内输注而输注到受试者中的加奈索酮的量可以增加到至多每小时约45mg加奈索酮,但优选地不超过45mg,并在此后持续至多约12小时。加奈索酮的量增加至多达12小时。
[0019]
持续静脉内输注的治疗期可以在开始静脉内输注后持续约36小时、约48小时、约72小时或约96小时的时间段。优选地,治疗期在开始持续静脉内输注后持续至少约8小时至约36小时的时间段。
[0020]
持续静脉内输注之后通常是逐渐减量期。逐渐减量期一般在从开始持续静脉内输注约36小时开始。在逐渐减量期期间,典型地通过每四小时将向受试者施用的加奈索酮的量减少约三分之一,系统地减少加奈索酮的持续静脉内输注,直至受试者不再需要加奈索酮。
[0021]
本文公开的方法适合于治疗任何形式的se。例如,全身性惊厥性se、非惊厥性se、难治性se和超难治性se。所述方法特别适用于治疗难治性se。所述方法还可以用于治疗进行一线治疗(例如,苯二氮类)、二线治疗(例如,磷苯妥英、丙戊酸或左乙拉西坦)和/或三线治疗(硫喷妥钠、咪达唑仑、戊巴比妥或丙泊酚)已经失败的受试者。在治疗期间,可以监测受试者的加奈索酮血浆浓度并使用eeg监测癫痫发作活动。
[0022]
在本文公开的方法中使用的加奈索酮制剂优选地包含磺丁基醚-β-环糊精。
[0023]
总的来说,治疗se的示例性方法包括在约1至约5分钟、典型地约3分钟的时间段内向受试者施用约5至约40mg、优选地约30mg加奈索酮的静脉内推注剂量,以实现加奈索酮血浆浓度短期增加约800ng/ml至约1000ng/ml。静脉内推注抑制se。与静脉内推注同时或在静脉内推注后,向受试者施用持续静脉内输注。持续静脉内输注提供了se的持续抑制。当持续静脉内输注维持约500ng/ml或更高的加奈索酮血浆浓度持续目标浓度期时则实现了se的持续抑制。目标浓度期典型地是至少约8小时或至少约12小时的时间段。不过,在一些情况下,至少约4小时是充足的目标浓度期。在目标浓度期期间,输注的加奈索酮的量可以增加
和/或减少以维持所需的加奈索酮血浆浓度。在开始持续静脉内输注约2小时,相对于开始持续输注时每小时施用的量,每小时向受试者施用的加奈索酮的量典型地减少约50%。然后相对于在开始持续静脉内输注时施用的量,每小时向受试者施用的加奈索酮的量可以减少75%。持续静脉内输注之后通常是逐渐减量期。
[0024]
本文公开的方法包括施用在受试者中减少或消除癫痫发作活动和/或减少或消除惊厥和/或完全抑制癫痫持续状态(即,抑制eeg癫痫发作活动和惊厥)的治疗有效量的加奈索酮。在某些实施方案中,在受试者中减少或消除癫痫发作活动和/或完全抑制癫痫持续状态的加奈索酮的治疗有效量是在足以在受试者中减少或消除癫痫发作活动和/或减少或消除惊厥和/或完全抑制癫痫持续状态的时间段内提供和维持约50ng/ml至约3500ng/ml的加奈索酮血浆浓度的量。在某些实施方案中,通过以下来提供约50mg/ml至约3500ng/ml的血浆浓度:(i)在约1至约5分钟内施用加奈索酮静脉内推注(例如,约5mg至约100mg、约25mg至约60mg或约25mg至约30mg);(ii)以介于约5毫克/小时与约130毫克/小时(例如,约5毫克/小时至约85毫克/小时)之间的速率施用加奈索酮持续静脉内输注,持续约8小时至约120小时(例如,持续约10小时至约96小时),持续静脉内输注在约快速推注时或之后的短时间内(例如,约30分钟内)开始;以及(iii)在停止持续输注前的约12小时至约24小时内(例如,在12小时、约10小时、约14小时、约16小时、约18小时或约20小时内)降低静脉内输注速率的速率。在某些实施方案中,通过以下来提供约50mg/ml至约3500ng/ml的血浆浓度:(i)在约1至约5分钟内施用加奈索酮静脉内推注(例如,约5mg至约100mg、约25mg至约60mg或约25mg至约30mg);(ii)以介于约5毫克/小时与约130毫克/小时(例如,约5毫克/小时至约85毫克/小时)之间的速率施用加奈索酮持续静脉内输注,持续约24小时至约120小时(例如,持续约48小时至约96小时),持续静脉内输注在约快速推注时或之后的短时间内(例如,约30分钟内)开始;以及(iii)在停止持续输注前的约10小时至约24小时内(例如,在10小时、约12小时、约14小时、约16小时、约18小时或约20小时内)降低静脉内输注速率的速率。在一些实施方案中,治疗有效量的一部分(例如,约5mg至约100mg、约10mg至约90mg、约15mg至约80mg、约20mg至约70mg、约25mg至约60mg等)经由静脉内快速推注施用,治疗有效量的其余部分经由持续静脉内输注施用。在一些实施方案中,对于体重为40kg或更大的受试者,可以经由静脉内快速推注施用约5mg至约100mg(例如,约10mg至约90mg、约15mg至约80mg、约20mg至约70mg、约25mg至约60mg等)加奈索酮,其余剂量经由静脉内输注以大于约10毫克/小时、15毫克/小时、20毫克/小时或25毫克/小时的速率施用,持续约1小时至约120小时。在一些实施方案中,持续静脉内输注的速率为约5毫克/小时至约130mg/h、约5毫克/小时至约120毫克/小时、约5毫克/小时至约110mg/h、约5毫克/小时至约100mg/h、约5毫克/小时至约90mg/h或约5毫克/小时至约85mg/h,持续约1小时至约120小时。在一些实施方案中,持续静脉内输注的速率为约50mg/h至约130mg/h,持续至少1小时。在一些实施方案中,治疗有效剂量或其一部分以约40毫克/小时至约140毫克/小时的速率静脉内施用约1小时至约4小时;此后,以约20毫克/小时至约70毫克/小时的速率施用约1小时至约4小时;此后,以约10毫克/小时至约35毫克/小时的速率施用约1小时至约4小时;此后,以约10毫克/小时至约30毫克/小时的速率施用约1小时至约96小时;以及此后,以约15毫克/小时至约35毫克/小时的速率施用约1小时至约96小时。在一些实施方案中,在以约15毫克/小时至约35毫克/小时的速率施用约1小时至约96小时后,速率每1小时至12小时减少约10%至约50%(例如,速率可以每4小时至
8小时从约15%减少至约30%)。在这些实施方案中的一些中,加奈索酮以约18毫克/小时、约20毫克/小时、约22毫克/小时、约25毫克/小时、约28毫克/小时、约30毫克/小时、约35毫克/小时、约40毫克/小时、约45毫克/小时、约50毫克/小时、约60毫克/小时、约65毫克/小时或约70毫克/小时施用,施用至少约1小时。对于体重小于40kg的受试者,在一些实施方案中,施用约0.07mg/kg至约1.43mg/kg(例如,约0.125mg/kg至约0.4mg/kg)的推注剂量(在1至5分钟内);以及,此后,经由约0.8mg/kg/小时至约2mg/kg/小时的持续输注,输注约1至3小时;接着以约0.6mg/kg/小时至约1mg/h的速率持续输注约4至8小时;以及,此后,接着以约0.15mg/kg/小时至约0.4mg/kg/小时的速率持续输注13至19小时。在24小时持续输注结束时,输注速率可以增加至例如约0.2mg/kg/小时至约0.6小时的速率,持续24至48小时或24至96小时。
[0025]
本公开还涉及一种治疗癫痫持续状态(例如,全身性惊厥性癫痫持续状态、非惊厥性癫痫持续状态、早期癫痫持续状态、确定性癫痫持续状态、难治性癫痫持续状态或超难治性癫痫持续状态)的方法,所述方法包括以在约24小时至约120小时的时间段内提供约50ng/ml至约3500ng/ml的加奈索酮血浆浓度并且在所述24小时至约120小时期间加奈索酮血浆浓度有约2至5个峰值的方式向经历癫痫持续状态的受试者施用治疗剂量的加奈索酮。在某些实施方案中,治疗剂量的一部分经由静脉内输注以约20毫克/小时至约140毫克/小时的速率施用约4小时至约120小时,约800ng/ml至约1600ng/ml的加奈索酮血浆水平维持约1小时至约96小时,并且剂量的一部分经由快速推注施用。对于体重为40kg或更大的受试者,快速推注可以包含例如约5mg至约100mg加奈索酮,并且经由静脉内输注递送的加奈索酮的量可以是例如约450mg至约3000mg。在一些实施方案中,在所述24小时至约120小时的每24小时内施用约450mg至约1000mg加奈索酮。对于体重小于40kg的受试者,快速推注可以包含例如约0.25mg至约16mg,并且在静脉内输注的每24小时内可以施用约100mg至约600mg加奈索酮。
[0026]
本公开还涉及一种治疗癫痫持续状态(例如,全身性惊厥性癫痫持续状态、非惊厥性癫痫持续状态、早期癫痫持续状态、确定性癫痫持续状态、难治性癫痫持续状态或超难治性癫痫持续状态)的方法,所述方法包括在约1小时至约120小时、约2小时至约100小时、约3小时至约100小时、约4小时至约100小时、约4小时至约96小时的时间段内(例如,经由持续静脉内输注)静脉内施用在经历癫痫持续状态的受试者中减少或消除癫痫发作活动和/或减少或消除惊厥和/或完全抑制癫痫持续状态的治疗有效剂量的加奈索酮或其一部分,其中静脉内输注在静脉内向受试者施用约5mg至约100mg(例如,约6mg、8mg、10mg、12mg、14mg、16mg、18mg、20mg、22mg、24mg、26mg、28mg、30mg、32mg、34mg、36mg、38mg、40mg、42mg、44mg、46mg、48mg、50mg、52mg、54mg、56mg、58mg、59mg、60mg、61mg、62mg、63mg、64mg、65mg、66mg、67mg、68mg、69mg、70mg、71mg、72mg、73mg、74mg、75mg、76mg、77mg、78mg、79mg、80mg、81mg、82mg、83mg、84mg、85mg、86mg、87mg、88mg、89mg、90mg、91mg、92mg、93mg、94mg、95mg、96mg、97mg、98mg或99mg)的推注剂量后(例如,在推注剂量后约1秒至约1小时、约1秒至约45分钟、约1秒至约30分钟、约1秒至约15分钟、约1秒至约10分钟、约1秒至约5分钟或约2秒至约3分钟)开始。在这些实施方案中的一些中,推注剂量是约5mg至约90mg、约5mg至约80mg、约5mg至约70mg、约5mg至约60mg、约5mg至约50mg、约5mg至约40mg或约5mg至约30mg。
[0027]
本公开还涉及一种治疗经历癫痫持续状态(例如,全身性惊厥性癫痫持续状态、非
惊厥性癫痫持续状态、早期癫痫持续状态、确定性癫痫持续状态、难治性癫痫持续状态或超难治性癫痫持续状态)的受试者的方法,所述方法包括在约4小时至约120小时的时间段内以足以在受试者中减少或消除癫痫发作活动和/或减少或消除惊厥和/或完全抑制癫痫持续状态的速率静脉内施用约450mg至约3000mg加奈索酮。在某些实施方案中,速率大于约10毫克/小时、15毫克/小时、20毫克/小时、25毫克/小时或30毫克/小时。在一些实施方案中,约5mg至约100mg加奈索酮经由静脉内快速推注施用,其余剂量经由持续静脉内输注以大于约25毫克/小时的速率施用约1小时至约120小时的时间段。
[0028]
本公开还涉及一种治疗受试者中的癫痫持续状态(例如,全身性惊厥性癫痫持续状态、非惊厥性癫痫持续状态、早期癫痫持续状态、确定性癫痫持续状态、难治性癫痫持续状态或超难治性癫痫持续状态)的方法,所述方法包括每天向受试者施用包含加奈索酮的制剂中约1克至约100克(例如,约20克至约70克、约25克至约65克、约30克至约60克、约35克至约55克等)磺丁基醚-β-环糊精。
[0029]
本公开还涉及一种治疗经历癫痫持续状态(例如,全身性惊厥性癫痫持续状态、非惊厥性癫痫持续状态、早期癫痫持续状态、确定性癫痫持续状态、难治性癫痫持续状态或超难治性癫痫持续状态)的受试者的方法,所述方法包括向受试者静脉内施用包含重量比为约1:50至约1:75的加奈索酮和磺丁基醚-β-环糊精的制剂,其中每天施用约450mg至约1000mg加奈索酮和约1克至约100克磺丁基醚-β-环糊精。在一些实施方案中,重量比为约1:60、约1:65或约1:70。
[0030]
本公开还涉及一种治疗经历癫痫持续状态(例如,全身性惊厥性癫痫持续状态、非惊厥性癫痫持续状态、早期癫痫持续状态、确定性癫痫持续状态、难治性癫痫持续状态或超难治性癫痫持续状态)的受试者的方法,所述方法包括向受试者静脉内施用包含重量比为约1:50至约1:75的加奈索酮和磺丁基醚-β-环糊精的制剂,其速率和持续时间足以在约24小时至约120小时的时期内提供约50ng/ml至约3500ng/ml的加奈索酮血浆浓度。在这些实施方案中的一些中,加奈索酮和磺丁基醚-β-环糊精的重量比为约1:51、约1:52、约1:53、约1:54、约1:55、约1:56、约1:57、约1:58、约1:59、约1:60、约1:61、约1:62、约1:63、约1:64、约1:65、约1:66、约1:67、约1:68、约1:69、约1:70、约1:71或约1:72。
[0031]
在另一个方面,治疗癫痫持续状态(例如,全身性惊厥性癫痫持续状态、非惊厥性癫痫持续状态、早期癫痫持续状态、确定性癫痫持续状态、难治性癫痫持续状态或超难治性癫痫持续状态)的方法包括经由静脉内输注以在施用期间从约10毫克/小时至约150毫克/小时、约15毫克/小时至约150毫克/小时或约20毫克/小时至约150毫克/小时变化的速率施用加奈索酮。在一些实施方案中,治疗有效剂量或其一部分以约40毫克/小时至约140毫克/小时的速率经肠胃外施用约1小时至约4小时;然后,以约20毫克/小时至约70毫克/小时的速率施用约1小时至约4小时;然后,以约10毫克/小时至约35毫克/小时的速率施用约1小时至约4小时;然后,以约10ng/小时至约30毫克/小时的速率施用约1小时至约96小时;以及,然后,以约15毫克/小时至约35毫克/小时的速率施用约1小时至约96小时。在一些实施方案中,在以约15毫克/小时至约35毫克/小时的速率施用约1小时至约96小时后,速率每1小时至12小时减少约10%至约50%(例如,速率可以每4小时至8小时从约15%减少至约30%)。在这些实施方案中的一些中,加奈索酮以至少约18毫克/小时、约20毫克/小时、约22毫克/小时、约25毫克/小时、约28毫克/小时、约30毫克/小时、约35毫克/小时、约40毫克/小时、约
45毫克/小时、约50毫克/小时、约60毫克/小时、约65毫克/小时或约70毫克/小时的速率施用,施用至少约1小时。在某些实施方案中,在开始静脉内输注前静脉内施用推注剂量的加奈索酮。加奈索酮的推注剂量可以包含例如约5mg至约100mg加奈索酮。在某些实施方案中,在静脉内输注之前、期间或之后静脉内施用一个或多个另外的推注剂量的加奈索酮。另外的推注剂量可以包含例如约5mg至约100mg加奈索酮。
[0032]
本公开还部分涉及一种治疗癫痫持续状态(例如,全身性惊厥性癫痫持续状态、非惊厥性癫痫持续状态、早期癫痫持续状态、确定性癫痫持续状态、难治性癫痫持续状态或超难治性癫痫持续状态)的方法,所述方法包括在约2小时至约120小时、约2小时至约100小时、约3小时至约100小时、约4小时至约100小时、约4小时至约96小时、约5小时至约96小时、约6小时至约96小时、约6小时至约90小时、约6小时至约88小时或约10小时至约72小时的时间段内以足以提供约50ng/ml至约3500ng/ml、约75ng/ml至约3250ng/ml、约100ng/ml至约3000ng/ml、约125ng/ml至约2750ng/ml、约150ng/ml至约2500ng/ml、约175ng/ml至约2250ng/ml、约200ng/ml至约2200ng/nil、约250ng/ml至约2150ng/ml、约300ng/ml至约2100ng/ml、约350ng/ml至约2100ng/ml、约400ng/ml至约2100ng/ml或约450ng/ml至约2100ng/ml、约500ng/ml至约2000ng/ml、约500ng/ml至约1800ng/ml、约500ng/ml至约1600ng/ml、约500ng/ml至约1500ng/ml、约600ng/ml至约1400ng/ml、约600ng/ml至约1300ng/ml、约650ng/ml至约1200ng/ml、约700ng/ml至约1200ng/ml、约750ng/ml至约1100ng/ml、约800ng/ml至约1100ng/ml加奈索酮血浆浓度的量和速率向经历癫痫持续状态的受试者施用加奈索酮,持续约30分钟至约120小时的时间段(例如,持续约1小时、3小时、5小时、7小时、9小时、11小时、13小时、15小时、17小时、19小时、21小时、23小时、25小时、27小时、29小时、31小时、33小时、35小时、37小时、39小时、41小时、43小时、45小时、47小时、49小时、51小时、53小时、55小时、57小时、59小时、61小时、63小时、65小时、67小时、69小时、71小时、73小时、75小时、77小时、79小时、81小时、83小时、85小时、87小时、89小时、91小时、93小时或95小时)。
[0033]
本公开还部分涉及一种治疗癫痫持续状态(例如,全身性惊厥性癫痫持续状态、非惊厥性癫痫持续状态、早期癫痫持续状态、确定性癫痫持续状态、难治性癫痫持续状态或超难治性癫痫持续状态)的方法,所述方法包括以足以在投与5分钟内实现约50ng/ml至约3500ng/ml、约75ng/ml至约3250ng/ml、约100ng/ml至约3000ng/ml、约125ng/ml至约2750ng/ml、约150ng/ml至约2500ng/ml、约175ng/ml至约2250ng/ml、约200ng/ml至约2200ng/ml、约250ng/ml至约2150ng/ml、约300ng/ml至约2100ng/ml、约350ng/ml至约2100ng/ml、约400ng/ml至约2100ng/ml、约450ng/ml至约2100ng/ml或约500ng/ml至约至约2000ng/ml的加奈索酮最大血浆浓度(cmax)的量静脉内施用推注剂量的加奈索酮,并且在施用推注剂量后(即,在推注剂量后约1秒至约1小时、约1秒至约45分钟、约1秒至约30分钟、约1秒至约15分钟、约1秒至约10分钟、约1秒至约5分钟或约2秒至约3分钟),在约2小时至约120小时、约2小时至约100小时、约3小时至约100小时、约4小时至约100小时或约4小时至约96小时的时间段内(例如,在约6小时、8小时、10小时、12小时、14小时、16小时、18小时、20小时、22小时、24小时、26小时、28小时、30小时、32小时、34小时、36小时、38小时、40小时、42小时、44小时、46小时、48小时、50小时、52小时、54小时、56小时、58小时、60小时、62小时、64小时、66小时、68小时、70小时、72小时、74小时、76小时、78小时、80小时、82小时、84小时、86小
时、88小时、90小时、92小时或94小时内)经由持续静脉内输注以足以维持约50ng/ml至约3500ng/ml、约75ng/ml至约3250ng/ml、约100ng/ml至约3000ng/ml、约125ng/ml至约2750ng/ml、约150ng/ml至约2500ng/ml、约175ng/ml至约2250ng/ml、约200ng/ml至约2200ng/ml、约250ng/ml至约2150ng/ml、约300ng/ml至约2100ng/ml、约350ng/ml至约2100ng/ml、约400ng/ml至约2100ng/ml、约450ng/ml至约2100ng/ml、约500ng/ml至约1800ng/ml、约600ng/ml至约1700ng/ml、约650ng/ml至约1600ng/ml、约700ng/ml至约1500ng/ml、约750ng/ml至约1400ng/ml、约800ng/ml至约1300ng/ml的加奈索酮血浆浓度约1小时至约96小时的量和速率施用加奈索酮。对于体重为40kg或更大的受试者,加奈索酮的总日剂量可以是例如约450mg至约2000mg、约500mg至约1900mg、约500mg至约1800mg、约550mg至约1600mg、约550mg至约1400mg、约550mg至约1200mg或约600mg至约1100mg,并且推注剂量可以包含例如约5mg至约100mg。
[0034]
本公开还部分涉及一种治疗癫痫持续状态(例如,全身性惊厥性癫痫持续状态、非惊厥性癫痫持续状态、早期癫痫持续状态、确定性癫痫持续状态、难治性癫痫持续状态或超难治性癫痫持续状态)的方法,所述方法包括以足以在施用约5分钟内实现约50ng/ml至约3500ng/ml、约75ng/ml至约3250ng/ml、约100ng/ml至约3000ng/ml、约125ng/ml至约2750ng/ml、约150ng/ml至约2500ng/ml、约175ng/ml至约2250ng/ml、约200ng/ml至约2200ng/ml、约250ng/ml至约2150ng/ml、约300ng/ml至约2100ng/ml、约350ng/ml至约2100ng/ml、约400ng/ml至约2100ng/ml、约450ng/ml至约2100ng/ml或约500ng/ml至约1500ng/ml的加奈索酮最大血浆浓度(cmax)的量静脉内施用推注剂量的加奈索酮;以及,在推注剂量后(例如,在推注剂量后约1秒至约1小时、约1秒至约45分钟、约1秒至约30分钟、约1秒至约15分钟、约1秒至约10分钟、约1秒至约5分钟或约2秒至约3分钟),在约2小时至约120小时、约2小时至约100小时、约3小时至约100小时、约4小时至约100小时、约4小时至约96小时、约5小时至约96小时、约6小时至约96小时、约6小时至约90小时或约6小时至约88小时或约10小时至72小时的时间段内经由静脉内输注以维持约600ng/ml至约1500ng/ml的加奈索酮的血浆浓度超过1小时(例如,约2小时、4小时、6小时、8小时、10小时、12小时、14小时、16小时、18小时、20小时、22小时、24小时、26小时、28小时、30小时、32小时、34小时、36小时、38小时、40小时、42小时、44小时、46小时、48小时、50小时、52小时、54小时、56小时、58小时、60小时、62小时、64小时、66小时、68小时、70小时、72小时、74小时、76小时、78小时、80小时、82小时、84小时、86小时、88小时、90小时、92小时、94小时、96小时等)的量和速率静脉内施用加奈索酮。
[0035]
本公开还部分涉及一种治疗受试者中的癫痫持续状态(例如,全身性惊厥性癫痫持续状态、非惊厥性癫痫持续状态、早期癫痫持续状态、确定性癫痫持续状态、难治性癫痫持续状态或超难治性癫痫持续状态)的方法,所述方法包括经肠胃外向经历癫痫持续状态的受试者施用(例如,经由静脉内(iv)输注)约400mg至约1500mg加奈索酮至少一天。在某些实施方案中,日剂量的一部分经由快速推注施用,并且剂量的其余部分经由持续输注施用。
[0036]
此外,本公开涉及一种治疗受试者中的癫痫持续状态(例如,全身性惊厥性癫痫持续状态、非惊厥性癫痫持续状态、早期癫痫持续状态、确定性癫痫持续状态、难治性癫痫持续状态或超难治性癫痫持续状态)的方法,所述方法包括静脉内施用约700mg至约1200mg加奈索酮,其中所述施用提供约50ng/ml至约3500ng/ml、约75ng/ml至约3250ng/ml、约100ng/
ml至约3000ng/ml、约125ng/ml至约2750ng/ml、约150ng/ml至约2500ng/ml、约175ng/ml至约2250ng/ml、约200ng/ml至约2200ng/ml、约250ng/ml至约2150ng/ml、约300ng/ml至约2100ng/ml、约350ng/ml至约2100ng/ml、约400ng/ml至约2100ng/ml、约450ng/ml至约2100ng/ml、约500ng/ml至约1400ng/ml、约500ng/ml至约1300ng/ml、约500ng/ml至约1200ng/ml、约600ng ml至约1200ng/ml、约600ng/ml至约1100ng/ml、约650ng/ml至约1100ng/ml、约700ng/ml至约1100ng/ml、约750ng/ml至约1100ng/ml、约800ng/ml至约1100ng/ml的加奈索酮血浆水平,持续至少1小时(例如,2小时、3小时、4小时、5小时、6小时、7小时、8小时、9小时、10小时、11小时、12小时、13小时、14小时、15小时、16小时、17小时、18小时、19小时、20小时、21小时、22小时、24小时等),其中剂量的一部分经由静脉内快速推注施用,其余剂量经由持续静脉内输注施用。
[0037]
本公开还涉及一种治疗受试者中的癫痫持续状态(例如,全身性惊厥性癫痫持续状态、非惊厥性癫痫持续状态、早期癫痫持续状态、确定性癫痫持续状态、难治性癫痫持续状态或超难治性癫痫持续状态)的方法,所述方法包括经肠胃外以约10mg/h至约150mg/h、约15mg/h至约140mg/h或约15mg/h至约120mg/h的可变速率施用约500mg至约1200mg加奈索酮(例如,静脉内),持续约1小时至8小时(例如,2、4、5或6小时)的时间段,其中所述施用阻止受试者中的eeg癫痫发作活动(例如,持续发作期放电)。在一些实施方案中,加奈索酮以约50mg/h至约130mg/h的速率施用。
[0038]
本公开还部分涉及一种治疗经历非惊厥性eeg癫痫发作的受试者的方法,所述方法包括施用治疗有效量的加奈索酮以阻止受试者中的非惊厥性eeg癫痫发作或降低发作频率。在某些实施方案中,治疗有效量的加奈索酮是提供和维持受试者中约50ng/ml至约3500ng/ml、约75ng/ml至约3250ng/ml、约100ng/ml至约3000ng/ml、约125ng/ml至约2750ng/ml、约150ng/ml至约2500ng/ml、约175ng/ml至约2250ng/ml、约200ng/ml至约2200ng/ml、约250ng/ml至约2150ng/ml、约300ng/ml至约2100ng/ml、约350ng/ml至约2100ng/ml、约400ng/ml至约2100ng/ml、约450ng/ml至约2100ng/ml或约500ng/ml至约1900ng/ml的加奈索酮血浆浓度的量。在一些实施方案中,治疗有效量的一部分经由静脉内快速推注施用,治疗有效量的其余部分经由持续静脉内输注施用。举例来说,当受试者体重为40kg或更大时,在一些实施方案中,经由静脉内快速推注施用约5mg至约100mg加奈索酮,其余剂量经由静脉内输注以大于10毫克/小时、15毫克/小时、20毫克/小时、25毫克/小时、30毫克/小时、35毫克/小时、40毫克/小时、45毫克/小时、50毫克/小时、55毫克/小时、60毫克/小时、65毫克/小时、70毫克/小时、75毫克/小时、80毫克/小时或85毫克/小时的速率施用约1小时至约120小时的时期(例如,2小时、3小时、4小时、5小时、6小时、7小时、8小时、9小时、10小时、11小时、12小时等)。
[0039]
本公开还涉及一种治疗非惊厥性eeg癫痫发作的方法,所述方法包括在约2小时至约120小时、约2小时至约100小时、约3小时至约100小时、约4小时至约100小时、约4小时至约96小时、约5小时至约96小时、约6小时至约96小时、约6小时至约90小时、约6小时至约88小时或约10小时至72小时的时间段内经由持续静脉内输注静脉内施用治疗有效剂量的加奈索酮或其一部分,以阻止受试者中的非惊厥性eeg癫痫发作或降低发作频率,其中静脉内输注在向受试者静脉内施用约5mg至约100mg推注剂量后(例如,在推注剂量后约1秒至约1小时、约1秒至约45分钟、约1秒至约30分钟、约1秒至约15分钟、约1秒至约10分钟、约1秒至
约5分钟或约2秒至约3分钟)开始。
[0040]
本公开还涉及一种治疗经历非惊厥性eeg癫痫发作的受试者的方法,所述方法包括在约4小时至约120小时的时间段内以大于约10毫克/小时、15毫克/小时、20毫克/小时、25毫克/小时或30毫克/小时的速率静脉内施用约450mg至约3000mg加奈索酮。在一些实施方案中,约2mg至约100mg加奈索酮经由静脉内快速推注施用,其余剂量经由持续静脉内输注以大于10mg/h、15毫克/小时、20mg/h、25mg/h或30mg/h的速率施用约1小时至约120小时的时间段。
[0041]
本公开还涉及一种治疗癫痫持续状态(例如,全身性惊厥性癫痫持续状态、非惊厥性癫痫持续状态、早期癫痫持续状态、确定性癫痫持续状态、难治性癫痫持续状态或超难治性癫痫持续状态)的方法,所述方法包括向有需要的受试者静脉内施用约450mg至约1000mg加奈索酮约24小时至约120小时,和在所述24小时至约120小时期间施用一定剂量的另外的抗癫痫药。另外的抗癫痫药可以选自由以下组成的组:苯二氮类、苯妥英、磷苯妥英、丙戊酸、苯巴比妥和/或左乙拉西坦。在某些实施方案中,抗癫痫药是苯二氮类(例如,地西泮、劳拉西泮等)。在这些实施方案中的一些中,加奈索酮和另外的抗癫痫药的施用提供了协同作用。
[0042]
本公开还涉及一种治疗急性重复性癫痫发作(acute repetitive seizures,ars)的方法,所述方法包括向有需要的受试者静脉内施用治疗有效量的加奈索酮。治疗有效量可以包含例如约1mg至约1000mg加奈索酮并且以一个或多个推注剂量施用,每个推注剂量包含约1mg至约50mg、约1mg至约45mg、约1mg至约40mg、约2mg至约35mg、约3mg至约30mg或约5mg至约30mg并在约1至约5分钟内施用。在一些实施方案中,所述方法还包括在一个或多个推注剂量的加奈索酮后以介于约5毫克/小时与约130毫克/小时(例如,约5毫克/小时至约85毫克/小时)之间的速率施用加奈索酮持续静脉内输注,持续约24小时至约120小时(例如,持续约48小时至约96小时),所述持续静脉内输注在约快速推注时或之后的短时间内(例如,约30分钟内)开始;以及在停止持续输注前的约10小时至约24小时内(例如,在10小时、约12小时、约14小时、约16小时、约18小时或约20小时内)降低静脉内输注速率的速率。
[0043]
在某些实施方案中,本发明的方法还包括施用约1mg至约50mg、约1mg至约45mg、约1mg至约40mg、约2mg至约35mg、约3mg至约30mg或约5mg至约30mg的一个或多个挽救性推注剂量的加奈索酮,可以在静脉内输注期间在约1至约5分钟内静脉内施用。例如,在癫痫发作(即异常的eeg活动)和/或惊厥复发的情况下,可以施用一个或多个挽救剂量。在一些实施方案中,在静脉内输注期间施用一个、二个、三个、四个或五个挽救剂量。
[0044]
在某些实施方案中,本发明的方法包括以纳米颗粒形式施用一些或所有剂量的加奈索酮。
附图说明
[0045]
附图不一定按比例进行绘制或者详尽的。相反,重点通常放在说明这里描述的本发明的原理上。构成本说明书一部分的附图示出了本公开的一些方面,并且连同说明书用来解释本公开的原理。在附图中:
[0046]
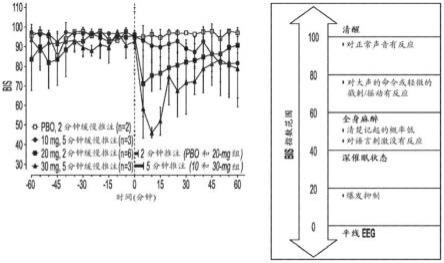
图1描绘了实施例1的1期临床研究的eeg和bis变化。这些变化与加奈索酮的镇静/麻醉作用一致。
[0047]
图2是示出预测加奈索酮血浆浓度对比时间的关系的图。
[0048]
图3是示出受试者004-101的预测和实际加奈索酮血浆浓度对比时间的关系的图。垂直线标志着癫痫复发的时间。
[0049]
图4是受试者004-101的脑电图快照。
[0050]
图5是示出受试者004-102的预测和实际加奈索酮血浆浓度对比时间的关系的图。垂直线标志着后来需要额外干预的异常eeg活动恢复的开始。
[0051]
图6是受试者004-102的脑电图快照。
[0052]
图7是示出受试者006-101的预测和实际加奈索酮血浆浓度对比时间的关系的图。垂直线标志着癫痫复发的时间。
[0053]
图8是受试者106-102的脑电图照片。垂直线标志着加奈索酮治疗开始的时间。
[0054]
图9是示出受试者006-102的预测和实际加奈索酮血浆浓度对比时间的关系的图。垂直线标志着癫痫复发的时间。
[0055]
图10是示出受试者015-101的预测和实际加奈索酮血浆浓度对比时间的关系的图。
[0056]
图11是来自eind第131,642号的受试者的脑电图快照。癫痫发作显示为暗区,如上边缘的评论所示。
[0057]
图12是示出在低剂量组、中剂量组和高剂量组中se停止时间的图。该图示出所有剂量组中se停止的中位数为5分钟。
[0058]
图13a是示出pk/pd关系和目标剂量基本原理的图。图13b-13d是示例性脑电图(eeg),示出了eeg上急性维持加奈索酮血浆浓度≥500ng/ml使癫痫发作控制得到改善。
[0059]
图14是描绘了低剂量群组、中剂量群组和高剂量群组的模型化pk曲线的图。
[0060]
图15是描绘了在低剂量群组、中剂量群组和高剂量群组中静脉内施用加奈索酮的难治性se患者的eeg癫痫发作负担变化百分比的图。
具体实施方式
[0061]
有效治疗se一直具有挑战性,传统的治疗方案对许多患者无效。约50%的受试者对一线药物治疗无反应,约50%的这类受试者对二线药物治疗也无反应,从而进展为难治性se。大约三分之一的难治性受试者死亡,另外三分之一恢复,但有神经或其它缺陷。显然需要改进的治疗se的方法。
[0062]
本公开涉及一种新的治疗se的方法。如本文所例示和描述的,根据所述方法的治疗提供了快速的se抑制,还提供了对se的持续抑制。所述方法可用于治疗任何形式的se,包括全身性惊厥性se、非惊厥性se、难治性se和超难治性se。所述方法特别适用于治疗难治性se。所述方法还可以用于治疗一线治疗、二线治疗和/或三线治疗失败的受试者。
[0063]
se表现为持续至少5分钟或更长时间的长期癫痫发作,或癫痫发作之间没有恢复意识的癫痫发作。抑制se通常会中断癫痫发作(即,抑制或减少癫痫发作活动)。临床上,抑制se可以减少癫痫发作负担(即,存在电图癫痫发作活动的时间百分比)。例如,临床医生可能认为癫痫发作负担小于20%se抑制和/或癫痫发作负担至少比治疗(即,静脉内推注加持续静脉内输注)开始前30分钟内小至少50%。
[0064]
本文所述的方法包括以静脉内推注和持续静脉内输注的形式向受试者施用治疗
有效量的神经甾体(例如,加奈索酮)。以足以抑制se的量施用加奈索酮静脉内推注。典型地,约500ng/ml至约1000ng/ml的神经甾体(例如,加奈索酮)血浆浓度足以抑制se。举例来说,为了使加奈索酮血浆浓度达到约500ng/ml至约1000ng/ml,可以施用约30mg药团的加奈索酮。根据所述方法的治疗持续治疗期,所述治疗期包括施用持续静脉内输注以维持受试者的神经甾体(例如,加奈索酮)血清浓度在或约为目标水平的时期(即,目标浓度期),以及允许或使受试者的神经甾体(例如,加奈索酮)血浆浓度降至目标浓度以下的时期,以及患者停止使用神经甾体的逐渐减量期。
[0065]
以足以持续抑制se的量施用神经甾体(例如加奈索酮)持续静脉内输注,持续目标浓度期。当在整个目标浓度期内持续输注维持约500ng/ml或更高的神经甾体(例如加奈索酮)血浆浓度时则实现了se的持续抑制。目标浓度期典型地是至少约8小时或至少约12小时,不过,目标浓度期在一些受试者中可以是至少约4小时。在目标浓度期期间,可以增加或减少向受试者施用的神经甾体(例如加奈索酮)的量(即,通过持续静脉内输注)以维持对se的持续抑制,但足以维持受试者中的加奈索酮血浆浓度为至少约500ng/ml,在静脉内推注施用后持续至少4小时,或优选地约8小时,以及任选地,在整个治疗期内。典型地,通过持续静脉内输注施用的加奈索酮的量在从静脉内输注开始约24小时的时间段内减少。举例来说,向受试者施用的加奈索酮的量可以在开始持续静脉内输注后约2小时减少,然后在输注后约10小时至约14小时减少。意外地,即使在持续静脉内输注期间施用的神经甾体(例如加奈索酮)的量在治疗期期间减少,持续静脉内输注仍继续抑制se。因此,所述方法提供了增强的安全性和有效性,并且对加奈索酮的暴露量比预期的要低。在治疗期间,可以监测受试者的神经甾体(例如加奈索酮)血浆浓度并使用eeg监测癫痫发作活动。如果受试者出现se复发的迹象,可以相应调整加奈索酮的施用量。举例来说,可以提供另外的静脉内推注或可以增加加奈索酮的输注量。在输注期间施用的神经甾体(例如加奈索酮)的量通常通过增加或降低输注速率来调整。
[0066]
持续静脉内输注通常与静脉内推注的施用同时施用。不过,在一些情况下,持续静脉内输注可以在静脉内推注之前或之后开始。
[0067]
持续静脉内输注之后通常是逐渐减量期,在此期间受试者停止使用加奈索酮。在逐渐减量期期间,典型地通过每四小时将向受试者施用的加奈索酮的量减少约三分之一(例如,通过持续静脉内输注),系统地减少加奈索酮的持续静脉内输注,直至受试者不再需要加奈索酮。
[0068]
本文提供了所述方法的附加描述和关于实践所述方法的指导。为了便于展示,提供了关于使用加奈索酮的优选方面的进一步细节和指导。进一步的细节和指导也旨在与其它神经甾体的治疗有关。
[0069]
a.静脉内推注
[0070]
治疗se的方法包括以足以抑制se的量向有需要的受试者施用加奈索酮静脉内推注,所述量典型地是足以产生至少约500ng/ml至约1000ng/ml的加奈索酮血浆浓度的量。通常,静脉内推注引起约750ng/ml至约1000ng/ml,更通常约1000ng/ml的加奈索酮血浆浓度。
[0071]
举例来说,加奈索酮的静脉内推注可以包括足以使加奈索酮血浆浓度达到至少约500ng/ml、约525ng/ml、约550ng/ml、约575ng/ml、约600ng/ml、约625ng/ml、约650ng/ml、约675ng/ml、约700ng/ml、约725ng/ml、约750ng/ml、约775ng/ml、约800ng/ml、约825ng/ml、约
850ng/ml、约875ng/ml、约900ng/ml、约925ng/ml、约950ng/ml、约975ng/ml、约1000ng/ml、约1025ng/ml、约1050ng/ml、约1075ng/ml或约1100ng/ml的加奈索酮的量。优选地,静脉内推注使加奈索酮血浆浓度达到至少约500ng/ml至约1000ng/ml。
[0072]
虽然至少约500ng/ml至约1000ng/ml的加奈索酮血浆浓度对于抑制se是优选的,但可能存在一些变化性,例如基于受试者体重、代谢、年龄、se持续时间和/或se的严重度的差异。因此,熟练的临床医生将理解,较低的加奈索酮暴露量,例如至少约425ng/ml、至少约450ng/ml、至少约475ng/ml的血浆浓度,可以在一些se患者中抑制se。然而,优选的是,推注递送的加奈索酮的量足以使加奈索酮血浆浓度达到约1000ng/ml。高于约1000ng/ml的加奈索酮血浆浓度可能在受试者中诱发麻醉,这通常不是本文所述的方法的预期效果或希望结果。优选地,加奈索酮的静脉内推注导致最小的麻醉作用或没有麻醉作用。例如,优选地,加奈索酮的施用量不导致意识丧失,不导致瘫痪,和/或不导致深度镇静。优选地,根据本文描述的方法的治疗不需要受试者进行控制通气和/或气管插管。
[0073]
在一些情况下,可以达到约1005ng/ml、约1010ng/ml、1020ng/ml、1030ng/ml、1040ng/ml、1050ng/ml、1060ng/ml、1070ng/ml、1080ng/ml的血浆浓度以抑制se而不导致麻醉。在其它情况下,超过1000ng/ml约1%、约2%、约3%、约4%、约5%、约6%、约7%、约8%、约9%、约10%、约11%、约12%、约13%、约14%或约15%的加奈索酮血浆浓度可以足以抑制se而不导致麻醉。
[0074]
加奈索酮的静脉内推注可以在约1mg、约2mg、约3mg、约4mg/h、约5mg、约6mg、约7mg、约8mg、约9mg、约10mg、约11mg、约12mg、约13mg、约14mg、约15mg、约16mg、约17mg、约18mg、约19mg、约20mg、约21mg、约22mg、约23mg、约24mg、约25mg、约26mg、约27mg、约28mg、约29mg、约30mg、约31mg、约32mg、约33mg、约34mg、约35mg、约36mg、约37mg、约38mg、约39mg、约40mg、约45mg、约50mg、约55mg、约60mg、约65mg、约70mg、约75mg、约80mg、约85mg、约90mg、约95mg或约100mg的量下施用(即,输注)到受试者中。优选地,在静脉内推注期间将约30mg加奈索酮输注到受试者中。
[0075]
在体重小于约40kg的受试者中,在静脉内推注期间可以将约0.10mg/kg、约0.11mg/kg、约0.12mg/kg、约0.13mg/kg、约0.14mg/kg、约0.15mg/kg、约0.16mg/kg、约0.17mg/kg、约0.18mg/kg、约0.19mg/kg、约0.20mg/kg、约0.21mg/kg、约0.22mg/kg、约0.23mg/kgr、约0.24mg/kg、约0.25mg/kg、约0.26mg/kg、约0.27mg/kg、约0.28mg/kg、约0.29mg/kg、约0.30mg/kg、约0.31mg/kg、约0.32mg/kg、约0.33mg/kg、约0.34mg/kg、约0.35mg/kg、约0.36mg/kg、约0.37mg/kg、约0.38mg/kg、约0.39mg/kg、约0.40mg/kg、约0.41mg/kg、约0.42mg/kg、约0.43mg/kg、约0.44mg/kg、约0.45mg/kg、约0.46mg/kg、约0.47mg/kg、约0.48mg/kg、约0.49mg/kg、约0.5mg/kg、约0.51mg/kg、约0.52mg/kg、约0.53mg/kg、约0.54mg/kg、约0.55mg/kg、约0.56mg/kg、约0.57mg/kg、约0.58mg/kg、约0.59mg/kg、约0.60mg/kg、约0.61mg/kg、约0.62mg/kg、约0.63mg/kg、约0.64mg/kg、约0.65mg/kg、约0.66mg/kg、约0.67mg/kg、约0.68mg/kg、约0.69mg/kg、约0.7mg/kg、约0.75mg/kg、约0.80mg/kg、约0.85mg/kg、约0.90mg/kg、约0.95mg/kg加奈索酮输注到受试者中。优选地,在静脉内推注期间将约0.43mg/kg加奈索酮输注到受试者中。
[0076]
可以向受试者施用静脉内推注任何所需的时间段,并且典型地施用约1分钟至约10分钟,例如约1分钟至约5分钟、约1分钟至约4分钟、约1分钟至约3分钟、约1分钟至约2分
钟、约2分钟至约5分钟、约2分钟至约4分钟、约2分钟至约3分钟、约3分钟至约5分钟或约3分钟至约4分钟。优选地可以向受试者施用静脉内推注约1分钟、约2分钟、约3分钟或约5分钟。更优选地,向受试者施用静脉内推注约3分钟。
[0077]
在静脉内推注加奈索酮后加奈索酮血浆浓度未达到至少约500ng/ml的情况下,可以向受试者施用另外的加奈索酮静脉内推注以使加奈索酮血浆浓度达到至少约500ng/ml,并且优选地约1000ng/ml。
[0078]
b.持续静脉内输注
[0079]
加奈索酮的持续静脉内输注与静脉内推注一起在围手术期施用。举例来说,持续静脉内输注可以与静脉内推注的施用同时开始。或者,持续静脉内输注可以在静脉内推注的施用之前或之后开始。通常,静脉内输注和持续静脉内输注从相同的加奈索酮源(例如,以及与静脉输液管连接的静脉袋)施用并同时开始。加奈索酮的持续静脉内输注的施用量在整个治疗期内和以后持续抑制se。加奈索酮的持续静脉内输注提供了对se的持久抑制,该抑制优选地持续到治疗期,优选地持续到逐渐减量期,优选地在逐渐减量期后,优选地在治疗后。
[0080]
在实施方案中,加奈索酮的持续静脉内输注实现对se的抑制达治疗后至少1小时、至少2小时、至少3小时、至少4小时、至少5小时、至少6小时至少7小时、至少8小时、至少9小时、至少10小时、至少11小时、至少12小时、至少1天、至少2天、至少3天、至少4天、至少5天、至少6天、至少7天或更长时间。在实施方案中,加奈索酮的持续静脉内输注实现对se的抑制达治疗后至少1周、至少2周、至少3周、至少4周、至少5周、至少6周、至少7周、至少8周、至少9周、至少10周、至少11周、至少12周或更长时间。在实施方案中,加奈索酮的持续静脉内输注实现对se的抑制达治疗后至少1个月、至少2个月、至少3个月、至少4个月、至少5个月、至少6个月、至少7个月、至少8个月、至少9个月、至少10个月、至少11个月、至少12个月或更长时间。
[0081]
通过以足以在目标浓度期产生至少约500ng/ml的加奈索酮血浆浓度的量向受试者施用持续静脉内输注,实现持续的se抑制,目标浓度期典型地是在施用静脉内推注后至少约4小时或优选地至少约8小时或至少约12小时,和任选地整个治疗期。实际上,可以监测患者的加奈索酮血浆浓度并且可以调整或滴定输注的加奈索酮的量以在整个治疗期内维持至少约500ng/ml的血浆浓度。至少约500ng/ml的加奈索酮血浆浓度持续例如约4小时、约5小时约6小时、约7小时、约8小时、约9小时、约10小时、约11小时、约12小时或更长时间的时间段可以实现持续的se抑制。
[0082]
以使加奈索酮血浆浓度达到约500ng/ml至约1000ng/ml的量向受试者施用加奈索酮的持续静脉内输注,持续至少4小时,优选地至少约8小时或至少约12小时。
[0083]
虽然至少约500ng/ml的血浆浓度对于持续se抑制是优选的,但可能存在一些变化性,例如基于受试者体重、代谢、年龄、se持续时间和/或se的严重度的差异。因此,熟练的临床医生将理解,例如至少约425ng/ml、至少约450ng/ml、至少约475ng/ml的加奈索酮血浆浓度可以足以在一些se个体中持续抑制se。小于400ng/ml或小于500ng/ml的加奈索酮血浆浓度通常不足以持续抑制se。在实施方案中,加奈索酮的持续静脉内输注使加奈索酮血浆浓度达到约425ng/ml、约450ng/ml、约475ng/ml、约500ng/ml、约525ng/ml、约550ng/ml、约575ng/ml、约600ng/ml、约625ng/ml、约650ng/ml、约675ng/ml、约700ng/ml、约725ng/ml、约
750ng/ml、约775ng/ml、约800ng/ml、约825ng/ml、约850ng/ml、约875ng/ml、约900ng/ml、约925ng/ml、约950ng/ml、约975ng/ml、约1000ng/ml、约1025ng/ml、约1050ng/ml、约1075ng/ml或约1100ng/ml。优选地,约500ng/ml至约1000ng/ml的加奈索酮血浆浓度是合乎需要的。
[0084]
高于约1000ng/ml的加奈索酮血浆浓度可能在受试者中诱发麻醉,这通常不是本文所述的方法的预期效果或希望结果。优选地,加奈索酮的持续静脉内推注导致最小的麻醉作用或没有麻醉作用。例如,优选地,加奈索酮的施用量不导致意识丧失,不导致瘫痪,和/或不导致深度镇静。优选地,根据本文描述的方法的治疗不需要受试者进行控制通气和/或气管插管。
[0085]
在一些情况下,约1005ng/ml、约1010ng/ml、1020ng/ml、1030ng/ml、1040ng/ml、1050ng/ml、1060ng/ml、1070ng/ml、1080ng/ml的加奈索酮血浆浓度可以持续抑制se而不导致麻醉。在某些情况下,低于500ng/ml约1%、小于约2%、小于约3%、小于约4%、小于约5%、小于约6%、小于约7%、小于约8%、小于约9%、小于约10%、小于约11%、小于约12%、小于约13%、小于约14%或小于约15%的加奈索酮血浆浓度可以足以抑制se。在其它情况下,超过1000ng/ml约1%、约2%、约3%、约4%、约5%、约6%、约7%、约8%、约9%、约10%、约11%、约12%、约13%、约14%或约15%的加奈索酮血浆浓度可以足以持续抑制se而不导致麻醉。
[0086]
通过持续静脉内输注每小时向受试者施用的加奈索酮的量可以在持续静脉内输注治疗期内减少。在某些情况下,可以在从静脉内输注开始约24小时的时间段内减少持续静脉内输注。举例来说,通过持续静脉内输注每小时向受试者施用的加奈索酮的量可以在开始持续静脉内输注后约1小时、约1.5小时、约2小时、约2.5小时、约3小时、约3.5小时、约4小时、约4.5小时、约5小时、约6小时、约7小时、约8小时、约9小时、约10小时、约11小时、约12小时、约14小时、约15小时、约16小时、约17小时、约18小时、约19小时、约20小时、约21小时、约22小时、约23小时或约24小时减少。
[0087]
通过持续静脉内输注每小时向受试者施用的加奈索酮的量可以在持续静脉内输注治疗期内的一个或多个时期减少或进一步减少。举例来说,通过持续静脉内输注每小时向受试者施用的加奈索酮的量可以在持续静脉内输注治疗期期间以一个间隔、两个间隔、三个间隔、四个间隔、五个间隔或更多个间隔减少。在本文提供的方法中,通过持续静脉内输注每小时向受试者施用的加奈索酮的量优选地在从持续静脉内输注开始约24小时内以两个时间间隔减少。
[0088]
通过持续静脉内输注每小时向受试者施用的加奈索酮的量可以在开始持续静脉内输注后约1小时至约5小时、约1小时至约4小时、约1小时至约3小时、约2小时至约3小时、约2小时至约4小时、约2小时至约4小时、约2小时至约5小时、约3小时至约4小时、约4小时至约5小时之间减少或进一步减少。通过持续静脉内输注每小时向受试者施用的加奈索酮的量优选地在开始持续静脉内输注后约2小时减少。
[0089]
通过持续静脉内输注每小时向受试者施用的加奈索酮的量可以在开始持续静脉内输注后约8小时至约16小时、约8小时至约15小时、约8小时至约14小时、约8小时至约13小时、约8小时至约12小时、约8小时至约11小时、约8小时至约10小时、约9小时至约16小时、约9小时至约15小时、约9小时至约14小时、约9小时至约13小时、约9小时至约12小时、约9小时至约11小时、约9小时至约10小时、约10小时至16小时、约10小时至约15小时、约10小时至约
14小时、约10小时至约13小时、约10小时至约12小时、约10小时至约11小时减少或进一步减少。通过持续静脉内输注每小时向受试者施用的加奈索酮的量优选地在开始持续静脉内输注后约10小时至约14小时减少。更具体地说,通过持续静脉内输注每小时向受试者施用的加奈索酮的量在开始持续静脉内输注后约12小时减少。
[0090]
通过持续静脉内输注每小时向受试者施用的加奈索酮的量可以在开始持续静脉内输注后约1小时至约5小时、约1小时至约4小时、约1小时至约3小时、约2小时至约3小时、约2小时至约4小时、约2小时至约4小时、约2小时至约5小时、约3小时至约4小时、约4小时至约5小时之间减少,然后在开始持续静脉内输注后约8小时至约16小时、约8小时至约15小时、约8小时至约14小时、约8小时至约13小时、约8小时至约12小时、约8小时至约11小时、约8小时至约10小时、约9小时至约16小时、约9小时至约15小时、约9小时至约14小时、约9小时至约13小时、约9小时至约12小时、约9小时至约11小时、约9小时至约10小时、约10小时至16小时、约10小时至约15小时、约10小时至约14小时、约10小时至约13小时、约10小时至约12小时、约10小时至约11小时减少。
[0091]
通过持续静脉内输注每小时向受试者施用的加奈索酮的量优选地在开始持续静脉内输注后约2小时减少,然后在开始持续静脉内输注后约10小时至约14小时减少。
[0092]
相对于开始持续静脉内输注时每小时施用的量,通过持续静脉内输注每小时向受试者施用的加奈索酮的量可以减少约40%、约45%、约50%、约55%、约65%、约75%、约80%、约85%或约90%。
[0093]
在实施方案中,相对于开始持续静脉内输注时每小时施用的量,在开始持续静脉内输注后约1小时、约1.5小时、约2小时、约2.5小时、约3小时、约3.5小时、约4小时、约4.5小时、约5小时、约6小时、约7小时、约8小时、约9小时、约10小时、约11小时、约12小时、约14小时、约15小时、约16小时、约17小时、约18小时、约19小时、约20小时、约21小时、约22小时、约23小时或约24小时,通过持续静脉内输注每小时向受试者施用的加奈索酮的量可以减少约40%、约45%、约50%、约55%、约65%、约75%、约80%、约85%或约90%。
[0094]
相对于开始持续静脉内输注时每小时施用的量,在开始持续静脉内输注后约1小时至约5小时,通过持续静脉内输注每小时向受试者施用的加奈索酮的量可以减少约40%、约45%、约50%、约55%或约60%。相对于开始持续静脉内输注时每小时施用的量,在开始持续静脉内输注后约2小时,通过持续静脉内每小时向受试者施用的加奈索酮的量优选地减少约50%。
[0095]
相对于开始持续静脉内输注时每小时施用的量,在开始持续静脉内输注后约10小时至约14小时,通过持续静脉内输注每小时向受试者施用的加奈索酮的量可以减少约50%、约55%、约60%、约65%、约70%、约75%、约80%或约85%。相对于开始持续静脉内输注时每小时施用的量,在开始持续静脉内输注后约10小时,通过持续静脉内输注每小时向受试者施用的加奈索酮的量优选地减少约75%。
[0096]
持续静脉内输注包括在持续静脉内输注期间将每小时约10mg、约15mg、约20mg、约25mg、约30mg、约35mg、约40mg、约45mg、约50mg、约60mg、约65mg、约70mg、约80mg、约85mg、约90mg、约95mg或约100mg加奈索酮输注到受试者中。优选地,持续静脉内输注包括在持续输注治疗期期间将每小时约20mg加奈索酮至每小时约80mg加奈索酮输注到受试者中。
[0097]
在实施方案中,在开始持续静脉内输注时将约70mg、约71mg、约72mg、约73mg、约
74mg、约75mg、约76mg、约77mg、约78mg、约79mg、约80mg、约81mg、约82mg、约83mg、约84mg、约85mg、约86mg、约87mg或约89mg、约90mg加奈索酮输注到受试者中。优选地在开始持续静脉内输注时将每小时约80mg加奈索酮输注到受试者中。然后加奈索酮的量可以减少至约60mg、约55mg、约40mg、约35mg、约30mg、约25mg、约20mg、约15mg或约10mg。优选地,在治疗期期间加奈索酮的量减少至约40mg加奈索酮,然后约20mg加奈索酮。
[0098]
在实施方案中,在开始持续静脉内输注后约2小时开始,通过持续静脉内输注向受试者施用每小时约40mg加奈索酮,并在此后持续约6小时至约10小时。在实施方案中,在开始持续静脉内输注后约12小时开始,通过持续静脉内输注向受试者施用每小时约20mg加奈索酮,并在此后持续约12小时至约24小时。如果需要或有医学指征,在开始后约24小时开始,通过持续静脉内输注而输注到受试者中的加奈索酮的量可以增加到至多每小时约45mg加奈索酮,并在此后持续至多约12小时。一般来说,通过持续静脉内输注向受试者施用的加奈索酮的量不超过每小时45mg加奈索酮。
[0099]
可以通过增加或降低输注速率来减少或增加通过持续静脉内输注每小时向受试者施用的加奈索酮的量。取决于临床反应和安全性,输注速率一般将在约5毫克/小时加奈索酮至约130毫克/小时加奈索酮之间变化。在某些实施方案中,施用速率为约5毫克/小时至约90毫克/小时。
[0100]
持续静脉内输注的治疗期可以在开始持续静脉内输注后持续至少4小时、至少5小时、至少6小时、至少7小时、至少8小时、至少9小时、至少10小时、至少11小时、至少12小时、至少13小时、至少14小时、至少15小时、至少16小时、至少17小时、至少18小时、至少19小时、至少20小时、至少21小时、至少22小时、至少23小时、至少24小时、至少25小时、至少26小时、至少27小时、至少28小时、至少29小时、至少30小时、至少31小时、至少32小时、至少33小时、至少34小时、至少35小时、至少36小时、至少37小时、至少38小时、至少39小时、至少40小时的时间段。优选的持续静脉内输注期是在开始持续静脉内输注后持续约8小时至约36小时的时间段。一般来说,持续静脉内输注持续约36小时的时间段,但可以更久,例如约48小时、约72小时或约96小时。
[0101]
在加奈索酮的持续静脉内输注期间,可以向表现出se复发迹象或经历se复发的受试者施用一次或多次另外的加奈索酮静脉内推注。脑电图(eeg)可用于检测se复发的迹象。加奈索酮血浆浓度可替代地或与eeg组合用于检测se复发的迹象或经历se复发的受试者。例如,加奈索酮血浆浓度低于400ng/ml可表明受试者可能复发。
[0102]
例如,如果出现癫痫发作(即,异常的eeg活动)和/或惊厥复发,可以在约1至约5分钟内静脉内施用约1mg至约100mg、约1mg至约90mg、约1mg至约80mg、约2mg至约75mg、约3mg至约70mg、约5mg至约60mg、约5mg至约50mg、约5mg至约45mg或约5mg至约35mg的一次或多次另外的加奈索酮静脉内推注。
[0103]
在癫痫复发前或检测到癫痫复发时,在约1分钟至约5分钟的时间段内,可以在每小时约1mg/h、约2mg/h、约3mg/h、约4mg/h、约5mg/h、约6mg/h、约7mg/h、约8mg/h、约9mg/h、约10mg/h、约11mg/h、约12mg/h、约13mg/h、约14mg/h、约15mg/h、约16mg/h、约17mg/h、约18mg/h、约19mg/h、约20mg/h、约21mg/h、约22mg/h、约23mg/h、约24mg/h、约25mg/h、约26mg/h、约27mg/h、约28mg/h、约29mg/h、约30mg/h、约31mg/h、约32mg/h、约33mg/h、约34mg/h、约35mg/h、约36mg/h、约37mg/h、约38mg/h、约39mg/h、约40mg/h、约45mg/h、约50mg/h、约55mg/
h、约60mg/h、约65mg/h、约70mg/h、约75mg/h、约80mg/h、约85mg/h、约90mg/h、约95mg/h或约100mg/h加奈索酮的量下将另外的加奈索酮静脉内推注输注到受试者中。
[0104]
c.逐渐减量期
[0105]
治疗se的方法还可以包括向有需要的受试者继续施用持续静脉内输注,持续逐渐减量期。逐渐减量期跟随目标浓度期。一般来说,逐渐减量期紧跟持续静脉内输注治疗期之后。不过,在一些情况下,逐渐减量期可以紧跟在目标浓度期之后。当持续静脉内具有约36小时或更长时间(即,8小时、约72小时或约96小时)的治疗期时,逐渐减量期在治疗期之后立即开始。
[0106]
在逐渐减量期期间,每小时向受试者施用的加奈索酮的量约每1小时、约2小时、约3小时、约4小时、约5小时、约6小时、约7小时、约8小时、约9小时、约10小时、约11小时或约12小时减少约5%、约10%、约15%、约20%、约25%、约30%、约35%、约40%、约50%或更多,直至受试者停止使用加奈索酮。
[0107]
在逐渐减量期期间,每小时向受试者施用的加奈索酮的量约每1小时、约2小时、约3小时、约4小时、约5小时、约6小时、约7小时、约8小时、约9小时、约10小时、约11小时或约12小时减少约三分之一。优选地,在逐渐减量期期间每小时向受试者施用的加奈索酮的量约每四小时减少约三分之一。
[0108]
逐渐减量期可以持续至少约1小时、至少约2小时、至少约3小时、至少约4小时、至少约5小时、至少约6小时、至少约7小时、至少约8小时、至少约9小时、至少约10小时、至少约11小时、至少约12小时、至少约13小时、至少约14小时、至少约15小时、至少约16小时、至少约17小时、至少约18小时、至少约19小时、至少约20小时、至少约21小时、至少约22小时、至少约23小时、至少约24小时、至少约25小时、至少约26小时、至少约27小时、至少约28小时、至少约29小时、至少约30小时、至少约32小时、至少约36小时、至少约48小时、至少约72小时、至少约96小时或更长时间的时间段,直至受试者停止使用加奈索酮。
[0109]
作为替代方案,可以停止持续静脉内输注,并且可以向受试者施用口服加奈索酮。可以使用口服加奈索酮来代替逐渐减量期以维持约200ng/ml至约400ng/ml的加奈索酮血清浓度。
[0110]
在某些实施方案中,本文公开的方法还包括在停止加奈索酮的持续静脉内输注后,向受试者经口施用加奈索酮。加奈索酮的口服日剂量可以是例如约200mg至约3000mg、约400mg至约2000mg、约600mg至约1900mg或约900mg至约1800mg,并且可以呈口服胶囊、口服悬浮液或口服片剂的形式施用。在某些实施方案中,加奈索酮的口服日剂量可以是例如约200mg至约2000mg、约400mg至约1500mg、约400mg至约1250mg或约400mg至约1000mg,并且可以呈口服胶囊、口服悬浮液或口服片剂的形式施用。口服可以持续例如约7天、14天、21天、28天或更长时间。
[0111]
在某些实施方案中,在加奈索酮的持续静脉内输注或静脉内剂量之前或之后施用一个或多个口服剂量的加奈索酮。加奈索酮的口服日剂量可以是例如约200mg至约3000mg、约400mg至约2000mg、约600mg至约1900mg或约900mg至约1800mg,并且可以呈口服胶囊、口服悬浮液或口服片剂的形式施用。在某些实施方案中,加奈索酮的口服日剂量可以是例如约200mg至约2000mg、约400mg至约1500mg、约400mg至约1250mg或约400mg至约1000mg,并且可以呈口服胶囊、口服悬浮液或口服片剂的形式施用。口服可以持续例如约7天、14天、21
天、28天或更长时间。
[0112]
本发明的方法涵盖例如施用一次或多次加奈索酮静脉内推注,接着经由持续静脉内输注施用加奈索酮;施用一次或多次加奈索酮静脉内推注,接着经由持续静脉内输注施用加奈索酮;以及接着例如呈口服胶囊、口服片剂、口服悬浮液或口服溶液,经口施用加奈索酮;例如呈口服胶囊、口服片剂、口服悬浮液或口服溶液,经口施用加奈索酮,接着经由持续静脉内输注施用加奈索酮;例如呈口服胶囊、口服片剂、口服悬浮液或口服溶液,经口施用加奈索酮,接着经由持续静脉内输注施用加奈索酮,其中在静脉内输注期间施用一次或多次加奈索酮静脉内推注;例如呈口服胶囊、口服片剂、口服悬浮液或口服溶液,经口施用加奈索酮,接着经由一次或多次加奈索酮静脉内推注,施用加奈索酮,以及接着经由持续静脉内输注施用加奈索酮;例如呈口服胶囊、口服片剂、口服悬浮液或口服溶液,经口施用加奈索酮,接着经由一次或多次静脉内推注施用加奈索酮,接着经由持续静脉内输注施用加奈索酮,以及接着例如呈口服胶囊、口服片剂、口服悬浮液或口服溶液,经口施用加奈索酮等。
[0113]
c.实践所述方法的其它细节和指导
[0114]
本发明的方法中静脉内施用的加奈索酮的量可以例如从约0.25mg变化至约3000mg(例如,约1mg、2mg、3mg、4mg、5,mg、7.5mg、10mg、15mg、20mg、25mg、30mg、35mg、40mg、45mg、50mg、55mg、60mg、65mg、70mg、75mg、80mg、85mg、90mg、95mg、100mg、110mg、120mg、130mg、140mg、150mg、160mg、170mg、180mg、190mg、200mg、220mg、240mg、250mg、260mg、270mg、280mg、290mg、300mg、325mg、350mg、375mg、400mg、425mg、450mg、475mg、500mg、525mg、550mg、575mg、600mg、625mg、650mg、675mg、700mg、725mg、725mg、750mg、775mg、800mg、850mg、900mg、950mg、1000mg等)。
[0115]
本发明的方法中施用的加奈索酮的总日剂量可以从约450mg变化至约1000mg。在某些实施方案中,加奈索酮的总日剂量是约500mg至约900mg、约500mg至约875mg、约525mg至约875mg、约525mg至约850mg、约525mg至约825mg、约525mg至约800mg、约525mg至约775mg、约525mg至约750mg或约525mg至约725mg。
[0116]
在某些实施方案中,施用的加奈索酮的量基于受试者的体重。体重小于40kg的受试者可以接受约0.07mg/kg至约1.43mg/kg(例如,约0.125mg/kg至约0.4mg/kg)的推注剂量(在1至5分钟内);以及,此后,以约0.8mg/kg/小时至约2mg/kg/小时的速率持续输注约1至3小时;以及,此后,以约0.6mg/kg/小时至约1mg/h的速率持续输注约4至8小时;以及,此后,以约0.15mg/kg/小时至约0.4mg/kg/小时的速率,持续13至19小时。在24小时持续输注结束时,输注速率可以增加至例如约0.2mg/kg/小时至约0.6小时的速率,持续24至48小时或24至96小时。然后剂量可以每6小时逐渐减量10%至25%,然后停止。在一些实施方案中,剂量每6小时减少约25%(75%、50%和25%),然后停止。在一些实施方案中,从12至24小时逐渐减量。
[0117]
体重为40kg或更大的受试者可以接受约5mg至约100mg(在约1至5分钟内)的推注剂量,然后以约60毫克/小时至约160毫克/小时持续输注1至4小时;接着约20毫克/小时至约140毫克/小时的持续输注速率,持续4至8小时;以及,此后,以约10毫克/小时至约120毫克/小时的速率,持续12至19小时。在持续输注的头24小时结束时,输注速率可以增加,持续24至48小时或24至96小时。然后剂量可以每6小时逐渐减量10%至25%,然后停止。在一些
实施方案中,剂量每6小时减少约25%(75%、50%和25%),然后停止。在一些实施方案中,从12至24小时逐渐减量。
[0118]
在某些实施方案中,本发明的方法包括以纳米颗粒形式施用一些或所有剂量的加奈索酮。示例性纳米颗粒的制备和组合物在下面的制剂部分中描述。
[0119]
在实施方案中,当受试者接受药物少于2小时或进展为iv麻醉药(3线治疗)以抑制癫痫发作时,不需要逐渐减少剂量,并且本发明的方法不包括逐渐减量步骤。
[0120]
在本发明的一些方法中,加奈索酮剂量或其一部分通过专用的(外周或中枢)iv管施用。
[0121]
治疗的持续时间可以变化,例如从约30分钟到约120小时。在某些实施方案中,治疗的持续时间为约1至约5天(例如,约24小时、约36小时、约48小时、约72小时、约96小时或约120小时)。在某些实施方案中,治疗包括约10小时至约24小时的逐渐减量期(例如,18小时逐渐减量)。在某些实施方案中,持续治疗直到受试者达到约100的癫痫发作负担改善。
[0122]
癫痫发作负担定义为在治疗开始2天内整个eeg收集过程中的癫痫发作次数。这将与给药前eeg的癫痫发作负担(研究药物开始之前最多24小时到即将施用研究药物时)进行比较。如果给药前eeg不可用,则应从eeg收集开始到开始2天结束时进行计算。
[0123]
在某些实施方案中,癫痫发作负担被评估为每小时收集的eeg记录的电图癫痫发作活动持续时间。
[0124]
在某些实施方案中,在治疗开始后约12至约60小时计算癫痫发作负担的改善。
[0125]
如果癫痫发作负担计算表明受试者不太可能从另外的施用中受益(例如,如果部分癫痫发作负担改善为约100%),则可以在12至24小时(例如,18小时)内逐渐减少剂量。相反,如果癫痫发作负担计算表明受试者可能受益(例如,如果部分癫痫发作负担改善在33-50%之间),则加奈索酮的施用将持续另外的时间段(例如,24至48小时)。在另外的时间段结束时,可以重新评估受试者和/或加奈索酮的剂量可在12至24小时(例如,18小时)内逐渐减少。
[0126]
对于接受研究药物少于2小时的受试者和/或如果在研究药物施用期间的任何时间受试者进展为iv麻醉剂(3线治疗)以抑制癫痫发作,则不需要逐渐减少剂量。
[0127]
a.治疗se的方法
[0128]
本公开涉及治疗se的方法,所述方法包括向有需要的受试者施用加奈索酮的静脉内推注和加奈索酮的持续静脉内输注。治疗se的优选方法包括向受试者施用足以抑制se的量的加奈索酮静脉内推注和持续静脉内输注以持续抑制se。se表现为持续至少5分钟时间段或癫痫发作之间没有恢复的长期癫痫发作。抑制se通常会中断癫痫发作(即,抑制或减少癫痫发作活动)。临床上,抑制se可以减少癫痫发作负担(即,存在电图癫痫发作活动的时间百分比)。例如,临床医生可能认为癫痫发作负担小于20%se抑制和/或癫痫发作负担至少比治疗(即,静脉内推注加持续静脉内输注)开始前30分钟内小至少50%。
[0129]
人受试者可能是男性、女性、成人和儿童、老年人(65岁以上)。人受试者可以是例如约1岁至约120岁、约1岁至约100岁、约2岁至约95岁、约5岁至约90岁、约7岁至约85岁、约10岁至约85岁、约12岁至约85岁、约14岁至约85岁、约16岁至约85岁、约18岁至约85岁或约20岁至约85岁。
[0130]
se可分为三种亚型:全身性惊厥性se、非惊厥性se和难治性se。全身性惊厥性癫痫
持续状态是最常见的se形式,其特征是与四肢强直-阵挛运动和精神状态障碍相关的惊厥。非惊厥性se定义为在eeg上看到但没有临床症状的se活动。难治性se发生在对一线治疗和二线治疗的标准se治疗方案没有反应的受试者中。这些亚型中的每一种都适合根据本文所述的方法进行治疗。
[0131]
适合根据本文所述的方法进行治疗的受试者已经和/或正在经历癫痫持续状态。例如但不限于全身性惊厥性癫痫持续状态、非惊厥性癫痫持续状态、早期癫痫持续状态、确定性癫痫持续状态、难治性癫痫持续状态或超难治性癫痫持续状态。患有难治性se的受试者特别适合根据本文所述的方法进行治疗。
[0132]
se的治疗通常分阶段进行,一线、二线和三线。一线标准护理治疗是肠胃外使用苯二氮类。示例性苯二氮类包括但不限于氯硝西泮(clonazepam)、劳拉西泮、咪达唑仑和地西泮。苯二氮类在约35%-45%的病例中无效。如果在使用苯二氮类治疗后se继续存在,则其它抗癫痫药物(例如磷苯妥英、左乙拉西坦和丙戊酸盐)将作为二线治疗施用。二线治疗对大约50%的病例无效。在一线治疗和二线治疗后se继续存在的情况下,全身麻醉剂(例如,硫喷妥钠、丙泊酚和咪达唑仑)用作三线治疗。约31%-41%的se受试者会发展成难治性se。三线药物的使用常常导致医源性昏迷,这需要通过插管和机械通气来保护气道。此外,全身麻醉剂的使用引起高发病率和大约35%的死亡率。
[0133]
在实施方案中,将根据本文提供的方法治疗的se受试者进行一线治疗、二线治疗或三线治疗失败。在其它实施方案中,待治疗的se受试者进行一线治疗和二线治疗均失败。在其它实施方案中,待治疗的se受试者进行一线治疗、二线治疗和三线治疗失败。患有se的受试者可以在接受其它治疗,例如标准护理一线或二线治疗之前根据本文提供的方法进行治疗。或者,可以在一线治疗(例如苯二氮类)失败后根据本文提供的方法治疗受试者。在一些情况下,在二线治疗(例如,抗癫痫药)失败后,将根据本文提供的方法治疗受试者。一种或多种抗癫痫药已经对有待根据本文提供的方法治疗的受试者无效。在其它情况下,有待根据本文提供的方法治疗的受试者进行三线治疗(例如,麻醉剂)可能已经失败。根据本文公开的方法进行治疗的受试者进行一线治疗(例如苯二氮类)和两次或更多次二线治疗可能已经失败。例如,两种或多种抗癫痫药可能已经对受试者无效。示例性抗癫痫药可包括但不限于磷苯妥英/苯妥英、丙戊酸、左乙拉西坦、拉考沙胺(lacosamide)或布立西坦(brivaracetam)。
[0134]
超难治性癫痫持续状态的特征是尽管使用一线治疗、二线治疗和全身麻醉剂治疗24小时或更长时间仍存在癫痫持续状态。这些患者病情严重,如果没有任何进一步的干预,很可能会死亡。为了治疗这些患者,人们认识到可能需要更大量的加奈索酮。为了根据本文所述的方法成功地治疗这些受试者,施用加奈索酮静脉内推注以使加奈索酮血浆浓度达到约800mg/ml至约1200mg/ml,并以使加奈索酮血浆浓度达到约800mg/ml至约1200mg/ml的量持续静脉内输注加奈索酮。
[0135]
在某些实施方案中,受试者未患选自由以下组成的组的难治性遗传病:pcdh19相关性癫痫、cdkl5缺乏症(cdd)、德拉韦综合征(dravet syndrome)、伦-格综合征(lennox-gastaut syndrome,lgs)、睡眠中的连续睡眠波(csws)、睡眠中的癫痫持续状态(eses)以及临床上类似于pcdh19相关性癫痫、cdkl5缺乏症、德拉韦综合征、lgs、csws和eses的其它难治疗和难治性遗传性癫痫疾患。在某些实施方案中,受试者未患cdkl5基因病症。在某些实
施方案中,受试者未患pcdh19相关性癫痫。
[0136]
b.加奈索酮
[0137]
加奈索酮(也称为3α-羟基-3β-甲基-5α-孕烷-20-酮、spt3162、md 9150000、ccd-1042、mepalon和1042)是研究新药申请(ind)第129,433号的主题。加奈索酮分子式是c
22h36
o2,化学结构为:
[0138]
c.
[0139]
加奈索酮(3α-羟基-3β-甲基-5α-孕烷-20-酮)是具有相似生物活性的内源性神经甾体别孕烯醇酮的3β-甲基化合成类似物(carter等人,(1997),the journal of pharmacology和experimental therapeutics,280:1284-1295),但它被设计成不激活核(经典)孕酮受体。此外,与别孕烯醇酮相比,加奈索酮是口服生物可利用的。
[0140]
加奈索酮充当cns中γ-氨基丁酸a型(gabaa)受体的正变构调节剂(carter等人1997)。加奈索酮通过与不同于其它变构gabaa受体调节剂(例如苯二氮类和巴比妥酸盐)的识别位点相互作用来影响gabaa受体。加奈索酮与突触和突触外受体结合,分别介导相位和强直调节。加奈索酮与这两种不同受体类型的独特结合不会引起在苯二氮类下见到的耐受性(mares和stehlikova(2010)neurosci.let.469:396-399)并允许加奈索酮用作一种广谱gaba能化合物,具有治疗与儿科遗传性癫痫、难治性癫痫发作、认知和行为障碍以及睡眠障碍相关的无数症状的潜力。
[0141]
加奈索酮提供了一种治疗癫痫发作的替代机制,可用作管理se的有效疗法,包括全身性惊厥性癫痫持续状态、非惊厥性癫痫持续状态、早期癫痫持续状态、确定性癫痫持续状态、难治性癫痫持续状态或超难治性癫痫持续状态。
[0142]
加奈索酮不会经由代谢转化直接或间接激活孕酮受体,这证实了加奈索酮缺乏激素活性。
[0143]
加奈索酮具有控制惊厥性和非惊厥性癫痫发作的优势。在实验动物中,加奈索酮立即停止和长期停止对苯二氮类耐药的se,这通过惊厥阻滞、eeg癫痫发作活动减少和存活率增加来证明。
[0144]
加奈索酮不溶于水。它在95%酒精、丙二醇和聚乙二醇中的溶解度分别是13mg/ml、3.5mg/ml和3.1mg/ml。加奈索酮在口服后在人血浆中具有相对较长的半衰期——约20小时(nohria,v.和giller,e.,neurotherapeutics,(2007)4(1):102-105)。此外,加奈索酮
的t
max
很短,这意味着可以快速达到治疗性血液水平。
[0145]
加奈索酮由cyp3a4/5代谢,服用强cyp诱导剂(卡马西平(carbamazepine)和苯妥英)的受试者的体外数据和人体pk数据显示,加奈索酮清除率增加,加奈索酮总体水平和暴露量降低约45%。
[0146]
在整个加奈索酮开发计划中,没有注意到心电图(ecg)间隔、生命体征或者身体或神经系统检查的临床显著趋势,也没有发现临床实验室结果与基线相比的平均变化。在已完成的安慰剂对照的1期、2期和3期研究中,0.32%的接受加奈索酮的受试者和0.46%的接受安慰剂的受试者在研究期间出现lft升高(》3x uln ast和/或alt)。一名参与加奈索酮小儿癫痫研究的受试者出现肝衰竭,认为这与加奈索酮无关。该受试者被诊断患有短肠综合征、肝脂肪变性和igg-胆管炎,这些被认为是受试者肝衰竭的致病因素。在加奈索酮开发计划中没有其它海氏定律(hy’s law)或肝衰竭病例。众所周知,加奈索酮和其代谢物会排泄到母乳中。停止给药后,血浆加奈索酮水平预计会迅速下降,但由于加奈索酮从组织中缓慢释放,低亚治疗水平可能会持续数天。
[0147]
以前对动物进行的以产前和新生儿发育为重点的毒理学研究没有证明与加奈索酮相关的毒性。早在4个月大时,就已将加奈索酮用于患有严重癫痫症的婴儿。在涉及在数周内施用加奈索酮的临床试验中,研究药物已经在1周至2周内逐渐减少。没有关于停止加奈索酮后出现戒断症状的报告。
[0148]
d.制剂
[0149]
本文考虑的是包含治疗有效量的神经甾体的制剂,用于根据本文公开的方法治疗癫痫持续状态。优选地,神经甾体是加奈索酮。可根据本文公开的方法使用的其它神经甾体包括但不限于别孕烯醇酮、3α-二氢孕酮、5α-二氢孕酮、5β-二氢孕酮、别孕二醇、二氢脱氧皮质酮、孕二醇、孕烷醇酮、四氢脱氧皮质酮、阿法多龙(alfadolone)、醋酸阿法多龙、eidd-036、羟二酮、米纳索龙(minaxolone)、21-氯-2β-吗啉-4-基-5β-孕烷-3α-醇-20-酮、甲烷磺酸2β-(2,2-二甲基-4-吗啉基)-3α-羟基-11,20-二氧代基-5α-孕烷-21-基酯或雷那诺龙(renanolone)、sge-516、sge-872、sage-217(zuranolone:3α-羟基-3β-甲基-21-(4-氰基-1h-吡唑-1'-基)-19-降-5β-孕烷-20-酮)。
[0150]
制剂优选地是加奈索酮的静脉内制剂。加奈索酮的静脉内制剂可以包含环糊精(例如,磺丁基醚β-环糊精iv溶液可以包含无菌即用型溶液,该溶液含有在中的1mg/ml加奈索酮(gnx比率60:1)。即用型溶液可以包含在磺丁基醚β-环糊精中的1mg/ml加奈索酮(60:1的captisol与加奈索酮比率)以及缓冲剂(即,磷酸盐和/或氯化钠)。在实施方案中,iv溶液是含有在(磺丁基醚-β-环糊精)(gnx比率70:1)中的3mg/ml加奈索酮或在captisol中的5mg/ml加奈索酮的无菌溶液,它们中的每一种可以或不在施用前用0.9%盐水(即,氯化钠)溶液稀释,例如产生1mg/ml加奈索酮溶液用于施用。
[0151]
在某些实施方案中,制剂(例如静脉内制剂)包含重量比为约1:50至约1:75的加奈索酮和磺丁基醚-β-环糊精(例如)。在这些实施方案中的一些中,加奈索酮与的重量比是约1:51、约1:52、约1:53、约54:1、约1:55、约1:56、约1:57、约1:58、约1:59、约1:60、约1:61、约1:62、约1:63、约1:64、约1:65、约1:66、约1:67、约1:68、约1:69、
约1:70、约1:71或约1:72。在这些实施方案中的一些中,加奈索酮与的重量比是约1:60。
[0152]
静脉内制剂可以选自例如由以下组成的组:纳米晶体制剂;乳液;莱赛尔(lyocell);溶剂或表面活性剂;脂质体;微乳液;以及含有固体脂质纳米颗粒的液体。
[0153]
在某些实施方案中,静脉内制剂是iv溶液。静脉内制剂优选是无菌液体(例如,乳液、悬浮液、溶液等形式的水性液体)。在这些实施方案的一些中,iv溶液包含加奈索酮和可溶解加奈索酮的药学上可接受的溶剂和/或油。
[0154]
在某些实施方案中,静脉内制剂是水包油乳液。
[0155]
在某些实施方案中,静脉内制剂是液体纳米颗粒制剂(例如,包含加奈索酮纳米颗粒的液体)。在一些实施方案中,纳米微粒制剂包含加奈索酮和聚合物和/或离子稳定剂,并且不含络合剂。在某些实施方案中,聚合物和离子稳定剂选自由表面活性剂组成的组。在某些实施方案中,表面活性剂选自由脱水山梨糖醇酯、聚氧乙烯脱水山梨糖醇脂肪酸酯、泊洛沙姆(poloxamer)、胆固醇盐和胆汁盐组成的组。
[0156]
在某些实施方案中,用于静脉内输注的制剂可以是如美国专利公布no.2017/0258812或美国专利公布no.2016/0228454中描述和制备的制剂。然而,可以根据本领域技术人员已知的其它方法制备用于静脉内输注的制剂。
[0157]
如美国专利公布no.2016/0228454中所述,水性可注射加奈索酮制剂可以包含a)呈包合络合物的加奈索酮和磺丁基醚-β-环糊精;以及b)水。在一些实施方案中,包含加奈索酮与磺丁基醚-β-环糊精的络合物包含1:1的加奈索酮:磺丁基醚-β-环糊精络合物;并且磺丁基醚-β-环糊精与加奈索酮的w/w比约为52:1或更高。在一些实施方案中,制剂还可以包含表面活性剂。在一些实施方案中,表面活性剂是脱水山梨糖醇酯、聚氧乙烯脱水山梨糖醇脂肪酸酯、泊洛沙姆、胆固醇盐或胆汁盐。在一些实施方案中,按重量计表面活性剂可以占制剂的约1%至约15%。在一些实施方案中,表面活性剂是聚山梨醇酯80。在一些实施方案中,制剂还包含缓冲剂并且具有约6.0至约7.6的ph。在一些实施方案中,缓冲剂是磷酸盐缓冲液。在一些实施方案中,缓冲剂是磷酸二氢盐缓冲液与磷酸氢二盐缓冲液的组合,其中每种磷酸盐缓冲液的浓度是2mm至50mm。在一些实施方案中,缓冲剂是磷酸盐缓冲液。在一些实施方案中,缓冲剂是磷酸二氢盐缓冲液与磷酸氢二盐缓冲液的组合,其中每种磷酸盐缓冲液的浓度是2mm至50mm。在一些实施方案中,加奈索酮的浓度是2mg/ml至8mg/ml,磺丁基醚-β-环糊精与加奈索酮的w/w比在约52:1至约90:1的范围内;制剂含有缓冲剂并且具有6.7至7.3的ph或6.0至7.0的ph;并且制剂含有1至15重量百分比的表面活性剂。在一些实施方案中,加奈索酮的浓度是1mg/ml至5mg/ml;磺丁基醚-β-环糊精的重量百分比是25%-35%;并且制剂含有5%至15%(重量百分比)的至少一种以下物质:表面活性剂、乙醇、甘油或丙二醇。在一些实施方案中,制剂还包含防腐剂。在一些实施方案中,防腐剂是苯甲醇、氯丁醇、2-乙氧基乙醇、对羟基苯甲酸酯(包括对羟基苯甲酸甲酯、对羟基苯甲酸乙酯、对羟基苯甲酸丙酯、对羟基苯甲酸丁酯和组合)、苯甲酸、山梨酸、氯己定(chlorhexidene)、苯酚、3-甲酚、硫柳汞或苯汞酸盐。
[0158]
如美国专利公布no.2016/0228454中进一步描述,制剂可以是包含加奈索酮和磺丁基醚-β-环糊精的冻干加奈索酮制剂,其中该加奈索酮制剂是1.0%至1.5%的加奈索酮。在一些实施方案中,制剂还可以包含填充剂。在一些实施方案中,填充剂是甘露醇、乳糖、蔗
糖、海藻糖、山梨糖醇、葡萄糖、棉子糖、甘氨酸、组氨酸、聚乙二醇(peg)或聚乙烯吡咯烷酮(pvp)。
[0159]
适合于在本发明的方法中肠胃外施用的加奈索酮制剂可以包含生理学上可接受的无菌水性或非水性溶液、分散液、悬浮液或乳液,以及用于复原成无菌可注射溶液或分散液的无菌粉末。适合的水性和非水性载体、稀释剂、溶剂或媒介物的实例包括水、乙醇、多元醇(丙二醇、聚乙二醇、甘油、克列莫佛(cremophor)等)、它们合适的混合物、植物油(例如橄榄油)以及可注射有机酯,例如油酸乙酯。此外,加奈索酮可以使用水溶性β-环糊精(例如β-磺基丁基-环糊精和2-羟丙基β-环糊精)以》1mg/ml的浓度溶解。一种特别合适的环糊精是取代的β-环糊精,例如,可以通过使用包衣(例如卵磷脂)、通过维持所需的粒度(在分散体的情况下)以及通过使用表面活性剂来维持适当的流动性。适用于皮下注射的加奈索酮制剂还可以含有添加剂,例如防腐剂、润湿剂、乳化剂和分配剂。可以通过各种抗细菌剂和抗真菌剂(例如对羟基苯甲酸酯、苯甲酸、苯甲醇、氯丁醇、苯酚、山梨酸等)来确保防止微生物生长。还需要包括等渗剂,例如糖、氯化钠等。可以通过使用延迟吸收剂,例如单硬脂酸铝和明胶,使可注射药物形式的药物吸收延长。被设计用于经由皮下或肌肉注射来延长释放的加奈索酮悬浮液可以避免首过代谢,并且维持约50ng/ml的血浆水平需要较低剂量的加奈索酮。在这类制剂中,加奈索酮颗粒的粒度和加奈索酮颗粒的粒度范围可以用于通过控制在脂肪或肌肉中的溶解速率来控制药物的释放。
[0160]
在某些实施方案中,静脉内制剂是包含络合剂的溶液。在这些实施方案中的一些中,络合剂是具有亲脂核和能够溶解加奈索酮的亲水外壳的分子
[0161]
在某些实施方案中,制剂是包含加奈索酮和磺丁基醚环糊精的iv溶液,其中加奈索酮溶解在磺丁基醚环糊精中。在一些实施方案中,溶液每1ml溶液包含3mg加奈索酮并且是无菌的。在某些实施方案中,溶液稳定至少18个月,在约4℃至约8℃的温度下冷藏储存。
[0162]
在某些实施方案中,本发明的液体制剂可以是如标题为“liquid ganaxolone formulations and methods for the making and use thereof’的美国专利no.8,022,054中描述和制备的制剂。然而,可以根据本领域技术人员已知的其它方法制备加奈索酮的口服液体(例如,悬浮液)制剂。
[0163]
如美国专利no.8,022,054中所述,液体制剂可以是稳定化的颗粒的水分散体,所述颗粒包含加奈索酮、亲水聚合物、润湿剂和有效量的在初始颗粒生长和达到终点后稳定颗粒生长的络合剂,所述络合剂选自分子量小于550的有机小分子的组并含有选自由苯酚部分、芳族酯部分和芳族酸部分组成的组的部分,其中稳定化的颗粒具有约50nm至约500nm的颗粒的体积加权中值直径(d50),络合剂以基于颗粒重量约0.05%至约5%w/w的量存在,颗粒分散在进一步含有至少两种防腐剂的水溶液中,防腐剂的量足以抑制微生物生长。基于固体颗粒的重量,亲水聚合物的量可为约3%至约50%w/w。基于固体颗粒的重量,润湿剂的量可为约0.01%至约10%w/w。基于稳定化的颗粒的重量,加奈索酮的量可为约10%至约80%(并且在某些实施方案中形成约50%至约80%)。当颗粒以0.5至1mg加奈索酮/ml的浓度分散在模拟胃液(sgf)或模拟肠液(sif)中并在36℃至38℃的加热浴中放置1小时时,与在相同条件下将颗粒分散在蒸馏水中时稳定化的颗粒的体积加权中值直径(d50)相比,稳
定化的颗粒的d50增加不超过约150%,其中分散在sgf或sif中的稳定化的颗粒的体积加权中值直径(d50)小于约750nm。当制剂以0.5至1mg加奈索酮/ml的浓度分散在15ml sgf或sif中时,与在相同条件下将颗粒分散在蒸馏水中时稳定化的颗粒的d50相比,稳定化的颗粒的体积加权中值直径(d50)增加不超过约150%,其中分散在sgf或sif中的稳定化的颗粒的体积加权中值直径(d50)小于约750nm。
[0164]
络合剂可以是任何具有亲脂核和能够溶解加奈索酮的亲水外壳的分子。在某些实施方案中,络合剂可以是含有酚部分、芳族酯部分或芳族酸部分的物质。在某些实施方案中,络合剂选自由以下组成的组:对羟基苯甲酸酯、有机酸、羧酸、芳族酸、芳族酯、氨基酸的酸性盐、邻氨基苯甲酸甲酯、偏亚硫酸氢钠、抗坏血酸和其衍生物、苹果酸、异抗坏血酸、柠檬酸、酒石酸、亚硫酸钠、硫酸氢钠、生育酚、生育酚的水溶性和脂溶性衍生物、亚硫酸盐、酸式亚硫酸盐和亚硫酸氢盐、对氨基苯甲酸和酯、2,6-二叔丁基-α-二甲氨基-对甲酚、叔丁基对苯二酚、二叔戊基对苯二酚、二叔丁基对苯二酚、丁基羟基甲苯(bht)、丁基羟基茴香醚(bha)、邻苯二酚、连苯三酚、没食子酸丙酯、去甲二氢愈创木酸、磷酸、山梨酸和苯甲酸、酯、棕榈酸抗坏血酸酯、它们的衍生物和异构体化合物、它们的药学上可接受的盐和它们的混合物。在某些实施方案中,络合剂选自由以下组成的组:对羟基苯甲酸酯、苯甲酸、苯酚、苯甲酸钠、邻氨基苯甲酸甲酯等。亲水聚合物可以是纤维素聚合物、乙烯基聚合物和它们的混合物。纤维素聚合物可以是纤维素醚,例如羟丙基甲基纤维素。乙烯基聚合物可以是聚乙烯醇,例如乙烯基吡咯烷酮/乙酸乙烯酯共聚物(s630)。润湿剂可以是月桂基硫酸钠、多库酯的药学上可接受的盐以及它们的混合物。水分散体还可以包含甜味剂,例如三氯蔗糖。在某些实施方案中,防腐剂选自由山梨酸钾、对羟基苯甲酸甲酯、对羟基苯甲酸丙酯、苯甲酸、对羟基苯甲酸丁酯、乙醇、苯甲醇、苯酚、苯扎氯铵(benzalkonium chloride)和任何前述物质的混合物组成的组。
[0165]
在一些实施方案中,提供了向受试者经口施用的液体加奈索酮制剂,其包含本文所述的加奈索酮颗粒和至少一种分散剂或悬浮剂。加奈索酮制剂可以是用于悬浮的粉末和/或颗粒,并且在与水混合后,获得基本上均匀的悬浮液。如本文所述,水分散体可以包含由多种有效粒度组成的无定形和非无定形加奈索酮颗粒,使得具有较小有效粒度的加奈索酮颗粒被较快地吸收,具有较大有效粒度的加奈索酮颗粒被较缓慢地吸收。在某些实施方案中,水分散体或悬浮液是立即释放制剂。在另一个实施方案中,配制包含无定形加奈索酮颗粒的水分散体,使得约50%的加奈索酮颗粒在施用后约3小时内被吸收,约90%的加奈索酮颗粒在施用后约10小时内被吸收。在其它实施方案中,向水分散体中加入络合剂导致更大跨度的含有加奈索酮的颗粒延长药物吸收阶段,使得50-80%的颗粒在前3小时内被吸收,约90%到约10小时被吸收。
[0166]
当悬浮液大部分是均质时,即悬浮液在整个悬浮液中的任何点由大致相同浓度的加奈索酮构成时,悬浮液是“基本均匀的”。优选的实施方案是在摇动后当在加奈索酮水性口服制剂中的不同点测量时提供基本相同的浓度(在15%以内)的实施方案。特别优选的是水悬浮液和分散体,它们在摇动后2小时测量时保持均匀性(至多15%的变化)。应通过与确定整个组合物的均质性一致的取样方法来确定均质性。在一个实施方案中,可以通过持续少于1分钟的物理搅拌将水性悬浮液重新悬浮成均质的悬浮液。在另一个实施方案中,可以通过持续少于45秒的物理搅拌将水性悬浮液重新悬浮成均质的悬浮液。在另一个实施方案
中,可以通过持续少于30秒的物理搅拌将水性悬浮液重新悬浮成均质的悬浮液。在又一个实施方案中,维持均质的水分散体不需要搅拌。
[0167]
在一些实施方案中,加奈索酮制剂是用于水分散体的粉末并且包含与按重量计有效粒度大于500nm的加奈索酮颗粒一起配制的按重量计有效粒度小于500nm的稳定的加奈索酮颗粒。在这样的实施方案中,制剂具有这样的粒度分布,其中按重量计约10%至约100%的加奈索酮颗粒在约75nm与约500nm之间,按重量计约0%至约90%的加奈索酮颗粒在约150nm与约400nm之间,以及按重量计约0%至约30%的加奈索酮颗粒大于约600nm。本文所述的加奈索酮颗粒可以是无定形的、半无定形的、结晶的、半结晶的或它们的混合物。
[0168]
在一个实施方案中,本文所述的水悬浮液或分散体包含浓度为约20mg/ml至约150mg/ml悬浮液的加奈索酮颗粒或加奈索酮络合物。在另一个实施方案中,本文所述的口服水分散体包含浓度为约25mg/ml至约75mg/ml溶液的加奈索酮颗粒或加奈索酮络合物颗粒。在又一个实施方案中,本文所述的口服水分散体包含浓度为约50mg/ml悬浮液的加奈索酮颗粒或加奈索酮络合物。本文所述的水分散体特别有利于将加奈索酮施用于婴儿(小于2岁)、10岁以下的儿童和任何不能吞咽或摄取固体口服剂型的患者组。
[0169]
用于口服的液体加奈索酮制剂可以是选自包括但不限于药学上可接受的口服水分散体、乳液、溶液和糖浆的组的水悬浮液。参见例如singh等人,encyclopedia of pharmaceutical technology,第2版,第754-757页(2002)。除了加奈索酮颗粒外,液体剂型还可以包含添加剂,例如:(a)崩解剂;(b)分散剂;(c)润湿剂;(d)至少一种防腐剂,(e)增粘剂,(f)至少一种甜味剂,(g)至少一种调味剂,(h)络合剂,以及(i)离子分散调节剂。在一些实施方案中,水分散体还可以包含结晶抑制剂。
[0170]
用于水悬浮液和分散体的崩解剂的实例包括但不限于淀粉,例如天然淀粉如玉米淀粉或马铃薯淀粉、预胶化淀粉如national 1551或或羧甲淀粉钠如或纤维素,例如木制品、微晶纤维素(例如ph101、ph102、ph105、p100、ming和solka-)、甲基纤维素、交联羧甲基纤维素或交联纤维素,例如交联羧甲基纤维素钠(ac-)、交联羧甲基纤维素或交联的交联羧甲基纤维素;交联淀粉,例如羧甲淀粉钠;交联聚合物,例如交联聚维酮;交联聚乙烯吡咯烷酮;海藻酸盐,例如海藻酸或海藻酸盐,如海藻酸钠;粘土,例如hv(硅酸铝镁);树胶,例如琼脂、瓜尔胶、刺槐豆胶、卡拉亚胶、果胶或黄蓍胶;羧甲淀粉钠;膨润土;天然海绵;表面活性剂;树脂,例如阳离子交换树脂;柑桔渣;月桂基硫酸钠;月桂基硫酸钠与淀粉组合等等。
[0171]
在一些实施方案中,适用于本文所述的水悬浮液和分散体的分散剂是本领域已知的并且包括例如亲水聚合物、电解质、60或80、peg、聚乙烯吡咯烷酮(pvp;商业上称为)以及基于碳水化合物的分散剂,例如羟丙基纤维素和羟丙基纤维素醚(例如hpc、hpc-sl和hpc-l)、羟丙基甲基纤维素和羟丙基甲基纤维素醚(例如hpmc k100、hpmc k4m、hpmc k15m和hpmc k100m)、羧甲基纤维素钠、甲基纤维素、羟乙基纤维素、邻苯二甲酸羟丙基甲基纤维素、乙酸硬脂酸羟丙基甲基纤维素、非晶纤维素、硅酸铝镁、三乙醇胺、聚乙烯醇(pva)、聚乙烯吡咯烷酮/乙酸乙烯酯共聚物(例如s-630)、4-(1,1,3,3-四甲基丁基)-苯酚与环氧乙烷和甲醛的聚合物(也称为泰洛沙泊(tyloxapol))、泊洛沙姆(例
如,pluronics和它们是环氧乙烷和环氧丙烷的嵌段共聚物);以及泊洛沙胺(poloxamine)(例如,tetronic 9080,也称为泊洛沙胺9080,它是衍生自环氧丙烷和环氧乙烷顺序加成到乙二胺的四官能嵌段共聚物(basf公司,parsippany,n.j.))。在其它实施方案中,分散剂选自不包含以下试剂之一的组:亲水聚合物;电解质;60或80;peg;聚乙烯吡咯烷酮(pvp);羟丙基纤维素和羟丙基纤维素醚(例如,hpc、hpc-sl和hpc-l);羟丙基甲基纤维素和羟丙基甲基纤维素醚(例如hpmc k100、hpmc k4m、hpmc k15m、hpmc k100m和usp 2910(shin-etsu));羧甲基纤维素钠;甲基纤维素;羟乙基纤维素;邻苯二甲酸羟丙基甲基纤维素、乙酸硬脂酸羟丙基甲基纤维素;非结晶纤维素;硅酸铝镁;三乙醇胺;聚乙烯醇(pva);4-(1,1,3,3-四甲基丁基)-苯酚与环氧乙烷和甲醛的聚合物;泊洛沙姆(例如,pluronics和它们是环氧乙烷和环氧丙烷的嵌段共聚物);或泊洛沙胺(例如,tetronic也称为泊洛沙胺908%)。
[0172]
适用于本文所述的水悬浮液和分散体的润湿剂(包括表面活性剂)是本领域已知的并且包括但不限于乙酰醇、单硬脂酸甘油酯、聚氧乙烯脱水山梨糖醇脂肪酸酯(例如,可商购的如例如tween和tween(ici specialty chemicals)),和聚乙二醇(例如carbowaxs和和carpool(union carbide))、油酸、单硬脂酸甘油酯、脱水山梨糖醇单油酸酯、脱水山梨糖醇单月桂酸酯、三乙醇胺油酸酯、聚氧乙烯脱水山梨糖醇单月桂酸酯、聚氧乙烯脱水山梨糖醇单月桂酸酯、油酸钠、月桂基硫酸钠、多库酯钠、甘油三乙酸酯、维生素e tpgs、牛磺胆酸钠、二甲硅油、磷脂酰胆碱等。
[0173]
用于本文所述的水悬浮液或分散体的合适防腐剂包括例如山梨酸钾、对羟基苯甲酸酯(例如对羟基苯甲酸甲酯和对羟基苯甲酸丙酯)和其盐、苯甲酸和其盐、对羟基苯甲酸的其它酯如对羟基苯甲酸丁酯、醇类如乙醇或苯甲醇、酚类化合物如苯酚、或季化合物如苯扎氯铵。如本文所用,防腐剂以足以抑制微生物生长的浓度掺入剂型中。在一个实施方案中,水性液体分散体可以包含浓度范围为按重量计占水分散体重量的约0.01%至约0.3%的对羟基苯甲酸甲酯和按重量计占水分散体总重量的0.005%至0.03%的对羟基苯甲酸丙酯的对羟基苯甲酸甲酯和对羟基苯甲酸丙酯。在又一个实施方案中,水性液体分散体可以包含水分散体的0.05至约0.1重量%的对羟基苯甲酸甲酯和0.01-0.02重量%的对羟基苯甲酸丙酯。
[0174]
适用于本文所述的水悬浮液或分散体的粘度增强剂包括但不限于甲基纤维素、黄原胶、羧甲基纤维素、羟丙基纤维素、羟丙基甲基纤维素、plasdone.rtm.s-630、卡波姆(carbomer)、聚乙烯醇、海藻酸盐、阿拉伯胶、壳聚糖以及它们的组合。增粘剂的浓度将取决于所选择的试剂和所需的粘度。
[0175]
适用于本文所述的水悬浮液或分散体的天然和人造甜味剂的实例包括例如阿拉伯胶糖浆、乙酰磺胺酸钾、阿力甜(alitame)、茴香、苹果、阿斯巴甜、香蕉、巴伐利亚奶油(bavarian cream)、浆果、黑醋栗、奶油糖果、柠檬酸钙、樟脑、焦糖、樱桃、樱桃奶油、巧克力、肉桂、泡泡糖、柑橘、柑橘潘趣酒、柑橘奶油、棉花糖、可可、可乐、酷樱桃(cool cherry)、酷柑橘、甜蜜素、克力梅(cylamate)、右旋糖、桉树、丁香酚、果糖、水果潘趣酒、生姜、甘草次酸酯、甘草(欧亚甘草)糖浆、葡萄、葡萄柚、蜂蜜、异麦芽酮糖醇、柠檬、酸橙、柠檬奶油、甘草酸一铵麦芽酚、甘露醇、枫木、棉花糖、薄荷醇、薄荷奶油、混合浆果、新
橙皮苷dc、纽甜(neotame)、橙子、梨、桃子、薄荷、薄荷奶油、粉末、覆盆子、根汁汽水、朗姆酒、糖精、黄樟素、山梨糖醇、留兰香、留兰香奶油、草莓、草莓奶油、甜叶菊、三氯蔗糖、蔗糖、糖精钠、糖精、阿斯巴甜、乙酰磺胺酸钾、甘露醇、塔林、三氯蔗糖、山梨糖醇、瑞士奶油、塔格糖、橘子、奇异果甜蛋白、百果糖(tutti fruitti)、香草、核桃、西瓜、野樱桃、冬青、木糖醇或这些调味成分的任何组合,例如茴香-薄荷醇、樱桃-茴香、肉桂-橙子、樱桃-肉桂、巧克力-薄荷、蜂蜜-柠檬、柠檬-酸橙、柠檬-薄荷、薄荷醇-桉树、橙子-奶油、香草-薄荷以及它们的混合物。在一个实施方案中,水性液体分散体可以包含浓度范围为水分散体重量的约0.0001%至约10.0%的甜味剂或调味剂。在另一个实施方案中,水性液体分散体可以包含浓度范围为水分散体的约0.0005%至约5.0%wt%的甜味剂或调味剂。在又一个实施方案中,水性液体分散体可以包含浓度范围为水分散体的约0.0001%至0.1wt%、约0.001%至约0.01重量%或0.0005%至0.004%的甜味剂或调味剂。
[0176]
除了上面列出的添加剂,液体加奈索酮制剂还可以包含本领域常用的惰性稀释剂,例如水或其它溶剂、增溶剂和乳化剂。
[0177]
在一些实施方案中,加奈索酮制剂可以是自乳化药物递送系统(sedds)。乳液是一种不混溶相在另一相中的分散体,通常呈液滴形式。通常,乳液是通过剧烈的机械分散产生的。与乳液或微乳液相反,sedds在加入到过量的水中时会自发形成乳液,无需任何外部机械分散或搅拌。sedds的一个优点是只需轻轻混合即可将液滴分布在整个溶液中。此外,可以在即将施用时加入水或水相,这确保了不稳定或疏水活性成分的稳定性。因此,sedds为疏水活性成分的口服和肠胃外递送提供了一种有效的递送系统。sedds可以提高疏水活性成分的生物利用度。生产自乳化剂型的方法是本领域中已知的,包括但不限于例如美国专利no.5,858,401、6,667,048和6,960,563。
[0178]
示例性乳化剂为乙醇、异丙醇、碳酸乙酯、乙酸乙酯、苯甲醇、苯甲酸苄酯、丙二醇、1,3-丁二醇、二甲基甲酰胺、月桂基硫酸钠、多库酯钠、胆固醇、胆固醇酯、牛磺胆酸、磷脂酰胆碱、油类(例如棉籽油、花生油、玉米胚芽油、橄榄油、蓖麻油和芝麻油)、甘油、四氢糠醇、聚乙二醇、脱水山梨糖醇的脂肪酸酯、或这些物质的混合物等。
[0179]
在某些优选的实施方案中,液体药物制剂包含加奈索酮、羟丙基甲基纤维素、聚乙烯醇、月桂基硫酸钠、二甲硅油、对羟基苯甲酸甲酯、对羟基苯甲酸丙酯、苯甲酸钠、柠檬酸和柠檬酸钠,ph 3.8-4.2。悬浮液可以包含浓度为50mg/ml的加奈索酮。制剂还可以包含药学上可接受的甜味剂(例如,三氯蔗糖)和/或药学上可接受的调味剂(例如,樱桃)。制剂可以被封装在例如120ml、180ml、240ml或480ml的瓶子中。
[0180]
用于口服的制剂可以是口服固体剂型(例如,口服胶囊或片剂)或液体(例如,包含加奈索酮的口服悬浮液)。在某些实施方案中,口服悬浮液经由使用口服注射器施用于患者。
[0181]
在某些实施方案中,本发明的液体制剂可以是如申请人之前的标题为“liquid ganaxolone formulations and methods for the making and use thereof”的美国专利no.8,022,054中描述和制备的制剂。然而,可以根据本领域技术人员已知的其它方法制备加奈索酮的口服液体(例如,悬浮液)制剂。
[0182]
在某些优选的实施方案中,本发明的口服固体制剂可以是如申请人之前的标题为“solid ganaxolone formulations and methods for the making and use thereof’的
美国专利no.7,858,609中描述和制备的制剂。然而,可以根据本领域技术人员已知的其它方法制备加奈索酮的口服固体制剂。
[0183]
例如,如美国专利no.7,858,609中所公开的,口服固体制剂可以包含稳定化的颗粒,所述颗粒包含加奈索酮、亲水聚合物、润湿剂和有效量的在初始颗粒生长和达到终点后稳定颗粒生长的络合剂,所述络合剂是分子量小于550的有机小分子,并含有选自由苯酚部分、芳族酯部分和芳族酸部分组成的组的部分,其中稳定化的颗粒的颗粒体积加权中值直径(d50)是约50nm至约500nm,络合剂的存在量为基于固体颗粒的重量约0.05%至约5%w/w。基于固体颗粒的重量,亲水聚合物的量可为约3%至约50%w/w。基于固体颗粒的重量,润湿剂的量可为约0.01%至约10%w/w。基于稳定化的颗粒的重量,加奈索酮的量可为约10%至约80%(并且在某些实施方案中形成约50%至约80%)。当颗粒以0.5至1mg加奈索酮/ml的浓度分散在模拟胃液(sgf)或模拟肠液(sif)中并在36℃至38℃的加热浴中放置1小时时,与在相同条件下将颗粒分散在蒸馏水中时稳定化的颗粒的体积加权中值直径(d50)相比,稳定化的颗粒的d50增加不超过约150%,其中分散在sgf或sif中的稳定化的颗粒的体积加权中值直径(d50)小于约750nm。当制剂以0.5至1mg加奈索酮/ml的浓度分散在15ml sgf或sif中时,与在相同条件下将颗粒分散在蒸馏水中时稳定化的颗粒的d50相比,稳定化的颗粒的体积加权中值直径(d50)增加不超过约150%,其中分散在sgf或sif中的稳定化的颗粒的体积加权中值直径(d50)小于约750nm。固体稳定化的颗粒可以与任选的赋形剂组合并制备成粉末形式来施用,或者它们可以掺入选自由片剂或胶囊组成的组的剂型中。络合剂可以是对羟基苯甲酸酯、苯甲酸、苯酚、苯甲酸钠、邻氨基苯甲酸甲酯等。亲水聚合物可以是纤维素聚合物、乙烯基聚合物和它们的混合物。纤维素聚合物可以是纤维素醚,例如羟丙基甲基纤维素。乙烯基聚合物可以是聚乙烯醇,例如乙烯基吡咯烷酮/乙酸乙烯酯共聚物(s630)。润湿剂可以是月桂基硫酸钠、多库酯的药学上可接受的盐以及它们的混合物。当颗粒掺入固体剂型时,固体剂型还可以包含至少一种药学上可接受的赋形剂,例如离子分散调节剂、水溶性间隔剂、崩解剂、粘合剂、表面活性剂、增塑剂、润滑剂、稀释剂以及它们的任何组合或混合物。水溶性间隔物可以是糖类或铵盐,例如果糖、蔗糖、葡萄糖、乳糖、甘露醇。表面活性剂可以是例如聚山梨醇酯。增塑剂可以是例如聚乙二醇。崩解剂可以是交联羧甲基纤维素钠、交联聚维酮、它们的混合物等。
[0184]
可以例如通过将本文所述的掺混加奈索酮制剂置于胶囊内部来制备胶囊。在一些实施方案中,加奈索酮制剂(非水悬浮液和溶液)置于软明胶胶囊中。在其它实施方案中,加奈索酮制剂置于标准的明胶胶囊或非明胶胶囊,例如包含hpmc的胶囊中。在其它实施方案中,加奈索酮制剂置于喷洒胶囊中,其中可以将胶囊整个吞服或者可以打开胶囊并将内容物在进食前喷洒在食物上。在本发明的一些实施方案中,治疗剂量被分成多个(例如,两个、三个或四个)胶囊。在一些实施方案中,加奈索酮制剂的全部剂量以胶囊形式递送。
[0185]
在某些实施方案中,每个胶囊含有200mg或225mg加奈索酮,以及羟丙基甲基纤维素、蔗糖、聚乙二醇3350、聚乙二醇400、月桂基硫酸钠、苯甲酸钠、无水柠檬酸、对羟基苯甲酸甲酯钠、微晶纤维素、30%二甲硅油乳液、明胶胶囊、聚山梨醇酯80和氯化钠。在一些实施方案中,胶囊的尺寸是00。
[0186]
或者,本发明的口服剂型可以呈控制释放剂型的形式,如美国专利no.7,858,609中所述。
[0187]
在某些优选的实施方案中,本发明的口服固体制剂可以是如美国专利no.8,367,651所述和制备的制剂。
[0188]
如美国专利no.8,367,651中所述,固体稳定化的颗粒可包含加奈索酮、亲水聚合物、润湿剂和有效量的在初始颗粒生长和达到终点后稳定颗粒生长的络合剂,所述络合剂是分子量小于550的有机小分子,并含有选自由苯酚部分、芳族酯部分和芳族酸部分组成的组的部分,其中稳定化的颗粒的颗粒体积加权中值直径(d50)是约50nm至约500nm,并且固体稳定化的颗粒中的加奈索酮浓度为至少50重量%。基于固体颗粒的重量,亲水聚合物的量可为约3%至约50%w/w。基于固体颗粒的重量,润湿剂的量可为约0.01%至约10%w/w。在一些实施方案中,当颗粒以0.5至1mg加奈索酮/ml的浓度分散在模拟胃液(sgf)或模拟肠液(sif)中并在36℃至38℃的加热浴中放置1小时时,与在相同条件下将颗粒分散在蒸馏水中时稳定化的颗粒的体积加权中值直径(d50)相比,稳定化的颗粒的d50增加不超过约150%,其中分散在sgf或sif中的稳定化的颗粒的体积加权中值直径(d50)小于约750nm。在一些实施方案中,当制剂以0.5至1mg加奈索酮/ml的浓度分散在15ml sgf或sif中时,与在相同条件下将颗粒分散在蒸馏水中时稳定化的颗粒的d50相比,稳定化的颗粒的体积加权中值直径(d50)增加不超过约150%,其中分散在sgf或sif中的稳定化的颗粒的体积加权中值直径(d50)小于约750nm。在一些实施方案中,基于颗粒的重量,加奈索酮的存在量可以大于50%至约80%。在一些实施方案中,当颗粒以0.5至1mg加奈索酮/ml的浓度分散在模拟胃液(sgf)或模拟肠液(sif)中并在36℃至38℃的加热浴中放置1小时时,与在相同条件下将颗粒分散在蒸馏水中时稳定化的颗粒的体积加权中值直径(d50)相比,稳定化的颗粒的d50增加可不超过约150%,其中分散在sgf或sif中的稳定化的颗粒的体积加权中值直径(d50)小于约750nm。在一些实施方案中,固体稳定化的颗粒可以呈粉末形式。在一些实施方案中,可以将颗粒掺入选自由片剂或胶囊组成的组的剂型中。在一些实施方案中,分散在蒸馏水中的稳定化的颗粒的体积加权中值直径(d50)为约100nm至约350nm。在一些实施方案中,络合剂选自由对羟基苯甲酸酯、苯甲酸、邻氨基苯甲酸甲酯和它们的药学上可接受的盐以及它们的混合物组成的组。在一些实施方案中,对羟基苯甲酸酯选自由对羟基苯甲酸甲酯、对羟基苯甲酸乙酯、对羟基苯甲酸丙酯、它的药学上可接受的盐以及它们的混合物组成的组。在一些实施方案中,亲水聚合物选自由纤维素聚合物、乙烯基聚合物以及它们的混合物组成的组。在一些实施方案中,纤维素聚合物是纤维素醚。在一些实施方案中,纤维素醚是羟丙基甲基纤维素。在一些实施方案中,乙烯基聚合物是聚乙烯醇。在一些实施方案中,润湿剂选自由月桂基硫酸钠、多库酯的药学上可接受的盐以及它们的混合物组成的组。在一些实施方案中,将颗粒掺入固体剂型中,固体剂型还包含至少一种药学上可接受的赋形剂,所述赋形剂选自由以下组成的组:离子分散调节剂、水溶性间隔物、崩解剂、粘合剂、表面活性剂、增塑剂、润滑剂,以及它们的任何组合或混合物。在一些实施方案中,药学上可接受的赋形剂包含离子分散调节剂。在一些实施方案中,基于固体颗粒的重量,离子分散调节剂的量为约1%至约50%w/w。在一些实施方案中,离子分散调节剂是盐。在一些实施方案中,离子分散调节剂是选自由镁盐、钙盐、锂盐、钾盐、钠盐以及它们的混合物组成的组的无机盐。在一些实施方案中,离子分散调节剂是选自由柠檬酸盐、琥珀酸盐、富马酸盐、苹果酸盐、马来酸盐、酒石酸盐、戊二酸盐、乳酸盐和它们的混合物组成的组的有机盐。在一些实施方案中,药学上可接受的赋形剂包含水溶性间隔物。在一些实施方案中,基于固体颗粒的重量,水溶
性间隔物的量为约2%至约60%w/w。在一些实施方案中,水溶性间隔物是糖类或铵盐。在一些实施方案中,糖类选自由果糖、蔗糖、葡萄糖、乳糖、甘露醇以及它们的混合物组成的组。在一些实施方案中,崩解剂选自由交联羧甲基纤维素钠、交联聚维酮以及它们的任何组合或混合物组成的组。在一些实施方案中,表面活性剂是聚山梨醇酯。在一些实施方案中,增塑剂是聚乙二醇。在一些实施方案中,固体剂型是立即释放剂型。在一些实施方案中,固体剂型是控制释放剂型。在一些实施方案中,颗粒掺入口服固体剂型中,所述口服固体剂型包含(i)控制释放组分,所述控制释放组分包含稳定化的颗粒的第一部分;和控制释放材料,以及(ii)包含稳定化的颗粒的第二部分的立即释放组分,稳定化的颗粒的第一部分和第二部分具有约50nm至约500nm的体积加权中值直径(d50)。在一些实施方案中,控制释放与立即释放中的加奈索酮的比率为约4:1至约1:4。在一些实施方案中,剂型在施用后提供约8小时至约24小时的治疗作用。在一些实施方案中,基于固体颗粒的重量,络合剂的量为约0.05%至约5%w/w。在一些实施方案中,络合剂包含对羟基苯甲酸甲酯或其盐。在一些实施方案中,络合剂包含苯甲酸或其盐。在一些实施方案中,络合剂包含邻氨基苯甲酸甲酯。在一些实施方案中,制剂包括约200mg至约800mg加奈索酮。
[0189]
如美国专利no.8,367,651中进一步描述,固体稳定化的颗粒还可以包含加奈索酮、亲水聚合物、润湿剂和有效量的络合剂,所述络合剂选自分子量小于550的有机小分子的组并含有选自由苯酚部分、芳族酯部分和芳族酸部分组成的组的部分,稳定化的颗粒的颗粒体积加权中值直径(d50)是约50nm至约500nm,固体稳定化的颗粒中的加奈索酮浓度为至少50重量%。在一些实施方案中,基于颗粒的重量,加奈索酮的存在量大于50%至约80%。在一些实施方案中,颗粒掺入选自由片剂或胶囊组成的组的剂型中。在一些实施方案中,络合剂选自由对羟基苯甲酸酯、苯甲酸、邻氨基苯甲酸甲酯和它们的药学上可接受的盐以及它们的混合物组成的组。
[0190]
在某些优选的实施方案中,本发明的制剂可以是美国专利no.9,029,355中描述的药物组合物。
[0191]
在某些实施方案中,组合物可以包含如上所述的加奈索酮纳米颗粒,进一步呈美国专利no.9,029,355中描述的制剂。在一些实施方案中,药物组合物是压缩片剂。在一些实施方案中,药物组合物含在胶囊内。
[0192]
e.组合
[0193]
在某些实施方案中,在加奈索酮的持续静脉内输注之前、期间或之后施用另外的抗癫痫药。下面的另外的抗癫痫药部分提供了可以施用的另外的抗癫痫药的实例。在一些实施方案中,另外的抗癫痫药可以选自由以下组成的组:苯二氮类、苯妥英、磷苯妥英、丙戊酸、苯巴比妥和/或左乙拉西坦。在一些实施方案中,抗癫痫药是苯二氮类(例如,地西泮、劳拉西泮等)。
[0194]
在某些实施方案中,与加奈索酮一起施用的另外的抗癫痫药选自由以下组成的组:氯去甲基地西泮(chlordesmethyldiazepam)、氯瑞唑(loreclezole)、甲琥胺(methsuximide)、二丙基乙酰胺、苯乙酰脲(pheneturide)、二氨基甲酸2-氟-2-苯基-1,3-丙二酯、乙基苯基乙内酰脲、6-甲氧基四氢咔啉、n-去甲基氯巴占(n-desmethylclobazam)、邻氨基苯甲酸、org 2766、舒噻嗪(sulthiame)、二甲双酮、2-(2,3-二羧基环丙基)甘氨酸、ncs 382、哌夸林(pipequaline)、溴他西尼(bretazenil)、登齐醇(denzimol)、司替戊醇
(stiripentol)、普罗加比酸(progabide acid)、布瓦西坦(brivaracetam)、u 54494a、大麻二酚(epidiolex)、溴化物、美芬妥英(mephenytoin)、乙琥胺(ethosuximide)、三甲双酮(trimethadione)、美贝维林(mebeverine)、5-(2-亚环己基-乙基)-5-乙基巴比妥酸酯、2-丙基-2-戊烯酸、新京都肽(neo-kyotorphin)、4-苯基-全氢吡咯(1,2-a)吡嗪-1,3-二酮、α-六氯环己烷、阿贝卡尔(abecarnil)、曲米沙特(tramiprosate)、噻普酰胺(thioperamide)、dn 1417、瑞马西胺(remacemide)、贝美噻(bemethyl)、他谷酰胺(taglutimide)、n-(4,4-二苯基-3-丁烯基)哌啶甲酸、加波沙朵(gaboxadol)、zk 93423、pd 117302、zk 93426、茚洛嗪(indeloxazine)、米拉醋胺(milacemide)、扑米酮(primidone)、zk 91296、佐加滨(ezogabine)、醉椒素(kavain)、香草醛(vanillin)、神经妥乐平(neurotropin)、磷苯妥英、扎来普隆(zaleplon)、cgp 39551、2-氨基-7-膦酰基庚酸、2-氨基-4-膦酰基丁酸、3-(2-羧基哌嗪-4-基)丙基-1-膦酸、2-氨基-4-甲基-5-膦酰基-3-戊烯酸、林卡唑(rimcazole)、当归素(angelicin)、噻加宾(tiagabine)、左乙拉西坦、唑尼沙胺(zonisamide)、三聚乙醛、2,3-哌啶二甲酸、6-(1h-咪唑-1-基)-7-硝基-2,3(1h,4h)-喹喔啉二酮、醋酸艾司利卡西平(eslicarbazepine acetate)、氨己烯酸(vigabatrin)、1-(4-氯苯基)-4-哌啶-1-基-1,5-二氢咪唑-2-酮、谷氨酸二乙酯、氟地西泮(fludiazepam)、吉达西泮(gidazepam)、乙妥英(ethotoin)、甲基苯巴比妥(mephobarbital)、乙酰唑胺(acetazolamide)、nnc 711、吲哚-3-基丙酮酸、卢非酰胺(rufinamide)、托吡酯(topiramate)、氯硝西泮、替来他明(tiletamine)、利鲁唑(riluzole)、普罗加比(progabide)、德伦环烷(deramciclane)、多拉菌素(doramectin)、氯甲噻唑(chlormethiazole)、l 701324、二钾氯氮(clorazepate dipotassium)、拉考沙胺、硫喷妥钠、丙戊酸、非氨酯(felbamate)、2,3-二氧代基-6-硝基-7-氨磺酰基苯并(f)喹喔啉、7-硝基吲唑、gyki 52466、芬纳西泮(phenazepam)、4-氨基-3-苯基丁酸、乙哌立松(eperisone)、双苯斯酮胺(sidnocarb)、利奥地平(ryodipine)、尼美西泮(nimetazepam)、硝基安定(nitrazepam)、甲丙氨酯(meprobamate)、氯巴占(clobazam)、艾司唑仑(estazolam)、劳拉西泮、苯巴比妥、硫酸镁、替扎尼定(tizanidine)、拉莫三嗪(lamotrigine)、氟桂利嗪(flunarizine)、普瑞巴林(pregabalin)、加巴喷丁(gabapentin)、苯妥英、苯巴比妥、奥卡西平(oxcarbazepine)、卡马西平、美达西泮(medazepam)、它们的药学上可接受的盐以及任何前述物质的混合物。
[0195]
在某些实施方案中,与加奈索酮一起施用的另外的抗癫痫药选自由苯二氮类、苯妥英、磷苯妥英、丙戊酸、苯巴比妥和/或左乙拉西坦组成的组。
[0196]
在某些实施方案中,另外的抗癫痫药是苯二氮类(例如,地西泮、劳拉西泮等)。
[0197]
f.定义
[0198]
本公开引用的所有公布和专利皆以引用的方式整体并入本文中。在以引用的方式并入的材料与本说明书相矛盾或不一致的情况下,本说明书将取代任何这类材料。本文中任何参考文献的引用并不是承认这些参考文献是本公开的现有技术。当表示值的范围时,它包括使用该范围内的任何特定值的实施方案。另外,对范围中说明的值的提及包括该范围内的每一个值。所有范围都包括它们的端点并且可以组合。
[0199]
术语“一个(a/an)”并不表示数量的限制,而是表示至少有一个提及的项目存在。
[0200]
术语“约”与术语“大约”同义使用。就加奈索酮的剂量和量来说,术语“约”的使用是指略微超出所引用值的值,即加或减0.1%至20%。就本发明的目的来说,关于施用时间
段的术语“约”的使用意指包含该时间段之前的2小时和之后的2小时。例如,“约6小时”的时间段涵盖4小时的时间段和8小时的时间段。关于所列举的药代动力学参数值(例如,血浆浓度)或药代动力学参数值范围(例如,血浆浓度值范围)的术语“约”涵盖在所列举的值或范围的80%至120%内的药代动力学参数和范围。
[0201]“活性剂”是当单独或与另一种剂组合施用于受试者时,直接或间接地对患者产生生理作用的任何化合物、要素或混合物。当活性剂是化合物时,包括盐、游离化合物或盐的溶剂化物(包括水合物)、结晶和非结晶形式,以及化合物的各种多晶型物。化合物可以含有一种或多种不对称要素,例如立体异构源中心、立体轴等,例如不对称碳原子,使得化合物可以呈不同的立体异构形式存在。这些化合物可以是例如外消旋体或旋光形式。对于具有两种或更多种不对称要素的化合物,这些化合物还可以是非对映异构体的混合物。对于具有不对称中心的化合物,应该理解的是,涵盖所有纯形式的旋光异构体以及它们的混合物。此外,具有碳-碳双键的化合物可以呈z-形式和e-形式存在,化合物的所有异构形式都包括在本发明中。在这些情况下,单一对映异构体,即旋光形式,可以通过不对称合成、由光学纯前体合成或通过外消旋体的拆分来获得。外消旋体的拆分也可以例如通过常规方法,例如在拆分剂存在下结晶或使用例如手性hplc柱进行色谱法来实现。
[0202]
如本文所用,术语“抗癫痫剂(antiepileptic)”是术语“抗癫痫药(antiseizure)”的同义词,意指用于控制癫痫发作和/或癫痫症的药物。术语“抗癫痫药”涵盖抗惊厥药物(即,预防、停止或减轻惊厥的药物)和预防癫痫发作的药物。
[0203]
如本文所用,术语“急性重复性癫痫发作”(ars)是指表现为癫痫患者在相对较短的时间段内(通常为24小时)出现多次癫痫发作的疾患。ars可以是惊厥性的或非惊厥性的。ars可能在se中进展,但通常在癫痫发作和/或惊厥之间有一个恢复期(休息)。
[0204]
缩写“eeg”意指脑电图。
[0205]
如本文所公开的术语“血清”和“血浆”可以互换使用。
[0206]
术语“静脉内推注”是在短时间内,例如在1至60分钟(例如,3或5分钟)内施用相对大剂量的药物(例如,加奈索酮)。
[0207]
术语“cmax”是指血浆中加奈索酮在最大浓度点的浓度。
[0208]
缩写“eind”意指紧急治疗研究新药申请。
[0209]
缩写“gnx”意指加奈索酮。
[0210]“加奈索酮”意指3α-羟基-3β-甲基-5α-孕烷-20-酮。
[0211]“输注”施用是非口服施用,通常是静脉内施用,但在一些实施方案中包括其它非口服途径,例如硬膜外施用。输注施用发生的时间比推注施用长,例如大于1小时的时间段(例如,从约1小时至约120小时)。
[0212]
如本文所用,术语“受试者”是指需要对癫痫持续状态进行医学治疗的人。
[0213]“药物组合物”是包含至少一种活性剂如加奈索酮的化合物或盐、溶剂化物或水合物,以及至少一种其它物质如载体的组合物。药物组合物任选地含有一种或多种另外的活性剂。当指定时,药物组合物符合美国fda的人用或非人用药物的gmp(良好生产规范)标准。“药物组合”是至少两种活性剂的组合,它们可以组合在单一剂型中或以单独的剂型一起提供,并附有将活性剂一起用于治疗例如癫痫持续状态的病症的说明。
[0214]
术语“癫痫持续状态”(se)定义为持续性的自我维持的癫痫发作或癫痫发作之间
没有恢复意识的反复癫痫发作(lowenstein和alldredge,1998)。国际抗癫痫联盟(international league against epilepsy)进一步将se定义为由以下引起的疾患:负责终止癫痫发作的机制失效,或启动了导致异常长时间的癫痫发作(强直阵挛性se 5分钟和伴有意识损害的局灶性se 10分钟)并且可能产生长期后果(强直阵挛性se 30分钟后和伴有意识受损的局灶性se 60分钟后),包括神经元死亡和/或损伤,以及神经元网络改变的机制,后果取决于癫痫发作的类型和持续时间。se涵盖全身性惊厥性癫痫持续状态(gcse)、非惊厥性癫痫持续状态(ncse)、早期癫痫持续状态、确定性癫痫持续状态(ese)、难治性癫痫持续状态(rse)和超难治性癫痫持续状态(srse)。
[0215]
gcse定义为特征是与四肢强直-阵挛运动和精神状态障碍相关的惊厥的癫痫持续状态,并且可能导致发作后持续数小时至数天的局灶性神经功能缺损(brophy等人,2012)。gcse与许多并发症有关,包括心律失常、横纹肌溶解、肺水肿、电解质和葡萄糖失衡以及温度紊乱。
[0216]
ncse定义为在eeg上看到癫痫发作活动而没有惊厥症状的癫痫持续状态;然而,重症受试者在ncse发作期间可能会出现精神状态受损(brophy等人,2012)。
[0217]
rse定义为在给予一线(即,苯二氮类)和二线抗癫痫药物后未能中止的癫痫持续状态。持续时间不是rse定义的一部分,rse仅基于给予的药物和癫痫发作的持续性(falco walter等人,2016)。
[0218]
srse定义为在麻醉开始后持续24小时或更长时间的se,包括那些在麻醉减少或取消后se再次出现的情况(shorvon和ferlisi,2011)。
[0219]
术语“癫痫发作(seizure)”或“癫痫发作(epileptic seizure)”是指与大脑中异常、过度或同步的神经元活动相关的体征和/或症状的短暂出现。在大脑中通过测量eeg活动来检测癫痫发作。可能会有不表现为惊厥,只能通过eeg活动检测到的癫痫发作(在大脑中)。术语“癫痫发作”涵盖惊厥和eeg癫痫发作。
[0220]“逐渐减量期”是在停止静脉内输注之前逐渐降低加奈索酮的持续静脉内输注的时期。
[0221]
如本文所用,术语“治疗有效量”是指足以停止癫痫持续状态或其一种或多种症状或减轻严重度的加奈索酮的量。例如,足以抑制癫痫发作的量。术语“治疗有效量”包括例如预防有效量。本领域技术人员将根据具体患者和疾病选择加奈索酮的有效量。应当理解,由于加奈索酮的代谢、受试者的年龄、体重、一般状况、正在治疗的疾患、正在治疗的疾患的严重度的变化以及开处方的医师的判断,治疗有效量可能因受试者而异。
[0222]
如本文所用,术语“治疗(treat)”或“治疗(treatment)”是指癫痫持续状态的任何改善或任何后果,例如减少或消除癫痫发作活动和/或减少或消除惊厥和/或完全抑制癫痫持续状态(即,抑制eeg癫痫发作活动和惊厥)。如本领域中容易理解的,优选完全根除se,但不是治疗行为的必要条件。治疗可以是治愈、医治、减轻、缓解、改变、补救、好转、缓和、改善或影响病症、se症状或se倾向。例如,治疗可以实现癫痫发作的抑制。
[0223]
5.等效物
[0224]
对于本领域的技术人员来说显而易见的是,在不背离本公开或实施方案的范围下在此描述的本发明的方法的其它合适的修改和调整是明显的并且可以使用合适的等效物来进行。现已经详细描述了某些化合物和方法,通过参考以下实施例将更清楚地理解这些
化合物和方法,这些实施例只是为了说明而引入,不意图限制。
[0225]
6.实施例
[0226]
通过以下实施例进一步描述本发明,这些实施例不意图以任何方式进行限制。
[0227]
实施例1:静脉内加奈索酮药代动力学和药效学的初步临床证据
[0228]
进行i期临床试验,评估iv加奈索酮制剂。该临床试验旨在研究30名健康受试者中静脉内推注加奈索酮和持续静脉内输注加奈索酮的安全性、药代动力学和药效学。向受试者施用10-20mg的量的加奈索酮静脉内推注,持续2分钟至1小时的时间段,或6mg的量的加奈索酮静脉内推注,持续5分钟的时间段,以及20mg/h的量的持续静脉内输注,持续4小时的时间段。
[0229]
药代动力学分析表明,所有30名用活性加奈索酮治疗的健康受试者的血浆中加奈索酮水平可量化,并且血浆中的加奈索酮浓度通常与施用剂量成比例。根据给予口服加奈索酮的受试者的历史数据,本研究中达到的血浆浓度在与潜在抗惊厥作用相关的浓度范围内。药效学数据分析表明,在测量双频谱指数(bis)时,bis评分与估计的加奈索酮血浆浓度相关。正如预期的那样,较高的血浆浓度与较低的bis评分相关(图1)。血浆中药物的出现与bis评分的变化之间几乎没有或没有延迟。
[0230]
实施例2:在具有癫痫持续状态的受试者中的功效的临床初步证据
[0231]
实施例2是一项正在进行的、双盲、随机、安慰剂对照的2期研究,旨在评估辅助性iv gnx在进行苯二氮类和至少一种aed初始治疗失败的se受试者中的安全性、耐受性和有效性。该研究由以下组成:一个小型开放标签组,以优化输注参数并初步评估gnx施用的安全性、功效和耐受性;随后是一个双盲组,将以1:1的比率随机接受gnx或安慰剂。在开放标签组和双盲组中,研究药物治疗是标准护理的辅助疗法,受试者将接受研究药物推注剂量和同时持续输注治疗,目标是尽可能快地施用治疗剂量以阻止癫痫发作并防止永久性神经损伤。具体来说,当在se治疗期间第一个二线iv aed失败并且第二个二线iv aed有医学指征时,研究药物将加入到标准护理中。研究药物必须与二线iv aed一起施用,尽可能接近第二个二线iv aed的剂量开始,但在抑制爆发的三线iv麻醉剂开始之前。
[0232]
用于本研究的加奈索酮是由(β-环糊精磺丁基醚钠)溶解的专有iv制剂。的最大水平不会超过50克/天。用于iv施用的加奈索酮将作为单独的玻璃小瓶提供给现场,开放标签组含有3mg/ml加奈索酮,双盲组含有5mg/ml加奈索酮。用于双盲组iv施用的安慰剂将作为含有0.9%氯化钠溶液的盲匹配小瓶提供给现场。
[0233]
该研究的主要目标是确定iv gnx与二线iv aed疗法同时给予在停止至少一种二线iv aed疗法失败的se方面是安全有效的,并防止治疗升级成需要iv麻醉药物(三线治疗)来抑制癫痫发作。次要目标包括评估死亡率、se受试者的癫痫发作停止和评估iv gnx在se受试者中的药代动力学。开放标签组和双盲组将招收大约262名受试者。
[0234]
总的辅助gnx疗法输注治疗计划为3天或5天(包括18小时的逐渐减量)。所有受试者将接受3分钟推注剂量,以及以约10毫克/小时至约85毫克/小时或约18毫克/小时至80毫克/小时的速率持续输注,以及18小时的逐渐减量。一旦研究药物施用开始,它将在逐渐减量之前递送整整2天或4天(48小时或96小时)。在第2天施用结束时,将决定再施用研究药物2天(即,总共4天)。如果根据研究者的医学判断,受试者将继续从研究药物施用中受益,则加奈索酮将再施用2天。
[0235]
加奈索酮剂量将在停药前逐渐减量。为了在治疗2天或4天后使加奈索酮逐渐减量,每6小时持续输注将减少25%;18小时内75%、50%、25%,然后停止。如果在这18小时内输注速率变得太低而无法维持输液管,则可以在此时停止。考虑到,如果受试者服用研究药物少于2小时和/或需要iv麻醉药物(3线治疗)来抑制癫痫发作,则应在研究药物没有逐渐减量的情况下停止研究药物。
[0236]
计划了以下给药方案。
[0237]
体重至少40kg的受试者:
[0238]
施用25mg推注剂量(约3分钟内),以及以80毫克/小时持续输注2小时,然后以40毫克/小时的持续输注速率持续输注6小时,然后第1天的剩余16小时以18毫克/小时持续输注。在第一个24小时持续输注(第1天)结束时,输注速率将增加到29毫克/小时,持续剩余治疗、第2天(24-48小时)或第2天至第4天(24-96小时)。
[0239]
表2.受试者≥40kg的给药(以毫克/小时计)
[0240][0241][0242]
体重<40kg的受试者将根据每千克给药:
[0243]
施用0.375mg/kg推注剂量(约3分钟内),以及以1.2mg/kg/小时持续输注2小时,然后以0.6mg/kg/小时的持续输注速率持续输注6小时,以及第1天的剩余16小时以0.27mg/kg/小时持续输注。在第一个24小时持续输注(第1天)结束时,输注速率将增加到0.435mg/kg/小时,持续剩余治疗期、第2天(24-48小时)或第2天至第4天(24-96小时)。
[0244]
表3.受试者《40kg的给药(以mg/kg/小时计)
[0245][0246][0247]
这些输注给药参数预计会引起加奈索酮的日剂量约≤714毫克/天,captisol的日剂量约≤50克/天。根据pk模型,预计在输注期间加奈索酮的最大浓度应保持在1,000ng/ml以内,但由于例如受试者体重的差异等原因,预计会有一些变化。
[0248]
截至2019年3月22日,根据将captisol每日暴露量限制在35克/天的原始方案,将5
名受试者招收到研究1042-se-2001开放标签组。在所有5例病例中,初始3分钟推注剂量30mg gnx,同时以85mg/h持续输注2小时,随后以40mg/h输注2小时gnx,使得如se受试者的eeg活动所证明,癫痫发作立即停止,要不然癫痫发作对几种被认为是标准护理的二线iv aed有抗性。研究医师将输注开始后最初的eeg模式描述为“轻度”爆发抑制,在所有受试者中维持数小时。尽管一些受试者需要插管以保护气道,但没有受试者直接因gnx疗法而必须插管。此外,未观察到需要药物干预的gnx相关心血管事件。据观察,当gnx暴露量降低(2小时20mg/h,以及第1天剩余18小时以10mg/h结束)以不超出这个界限时,不能维持癫痫发作控制并且如eeg变化所证明,癫痫发作活动(但不是se)再次发生。来自这5名受试者的药代动力学模型数据(图2)表明,大约1000ng/ml的gnx暴露水平与快速和完全的se抑制相关,而《500ng/ml的gnx暴露水平与癫痫复发有关。当5名受试者中有4名gnx血浆浓度下降《500ng/ml时,癫痫发作活动复发。
[0249]
5名受试者的病例报告如下所呈现。
[0250]
1.受试者004-101
[0251]
受试者004-101是一名75岁的女性,她因跌倒出现了硬膜下血肿(第1天)。开始使用左乙拉西坦。在医生检查中,发现受试者躺在床上,对语言和有害刺激都没有反应。瞳孔大小相等,圆形,对光有反应,无角膜,无呕吐物,前庭眼反射完好。血压和饱和度稳定。由于精神状态改变,决定对受试者进行插管以保护气道。第3天,eeg显示部分性癫痫发作,额外输注左乙拉西坦,随后多次输注拉考沙胺。在研究招收讨论期间,家人报告说该受试者过去从麻醉中清醒过来的速度很慢。
[0252]
第3天,iv gnx施用以30mg推注3分钟开始,并以85mg/h持续输注2小时。eeg几乎立即显示出癫痫发作的抑制,首席研究员将eeg模式描述为“使受试者处于弱爆发抑制中”。在治疗的第二个小时期间,在对受试者进行插管以保护气道时,研究药物施用中断14分钟。插管被认为与研究药物无关;插管的决定是在开始gnx输注之前做出的。顺利地重新开始持续输注。按照方案继续给药,在给药后2小时输注速率降低至40mg/h,在给药后4小时降低至20mg/h,在给药后6小时降低至10mg/h。在输注开始后约5小时癫痫复发,此时受试者以20mg/h的输注速率接受gnx。第2天停用gnx。在癫痫复发时,受试者的gnx血浆浓度《500ng/ml(图3)。图4提供了gnx开始之前和之后的受试者eeg模式的快照。
[0253]
2.受试者004-102
[0254]
受试者004-102是一名43岁的女性,有癫痫病史,出现了ncse(第1天)。先前的aed药物包括拉莫三嗪。对受试者进行插管并给予单剂量的磷苯妥英,然后给予左乙拉西坦。同一天,iv gnx 30mg推注3分钟,并开始持续输注(85mg/h)。在给药开始后60分钟和2小时,没有在eeg上发现癫痫发作活动。根据方案,gnx依次降低至40mg/h、20mg/h和10mg/h。在第1天的剩余18小时继续10mg/h。受试者继续没有发作癫痫;然而,在给药开始后5至6小时,相关的eeg模式恢复,此时受试者正在以20mg/h的输注速率接受gnx。图5中示出了癫痫复发时受试者的gnx血浆浓度。eeg模式的恢复发生在大约相同的时间范围内,并且在接下来的48小时内发生变化,并且在给药开始后大约42.5小时需要额外的干预,同时受试者以20mg/h的输注速率接受gnx。第2天中止gnx。图6提供了开始gnx之前和之后受试者的定性eeg模式的快照。
[0255]
3.受试者006-101
[0256]
受试者006-101是一名59岁的女性,她出现了ncse,病因不明(第1天)。受试者对语言和身体刺激没有反应。给予单剂量的拉考沙胺并对受试者进行插管以保护气道。eeg显示与迟钝和肢体开关相关的癫痫样放电,并且给予受试者劳拉西泮剂量,没有改善。同一天,给予iv gnx 30mg推注,并开始持续输注(85mg/h)。根据现场报告,se在推注施用后1分钟内中止。在给药开始后60分钟和2小时,没有在eeg上发现癫痫发作活动。根据方案,gnx依次降低至40mg/h、20mg/h和10mg/h。在输注开始后大约6小时,癫痫复发,此时受试者正在以20mg/h的输注速率接受gnx。在第4天开始gnx逐渐减量。在癫痫复发时,受试者的gnx血浆浓度《500ng/ml(图7)。图8提供了开始gnx之前和之后受试者的eeg模式的快照。
[0257]
在受试者的输注速率为10mg/h时se复发。两个相邻的pk样本结果在输注速率的低预测值范围内。已经确认pk样品是从输注部位收集的。已经确认生物分析实验室执行了正确的分析程序。
[0258]
4.受试者006-102
[0259]
受试者006-102是一名88岁的女性,有癫痫和痴呆病史,在被女儿发现精神状态改变并且无法用语言表达她的疾病后从疗养院转移(第1天)。家人确认受试者在前一周跌倒并可能撞到了她的头部。计算机断层扫描(ct)发现硬膜下血肿(1.4cm)。对受试者进行插管,使用丙泊酚,并从偏远的医院转移到研究地点,在那里准备清除硬膜下血肿。停止使用丙泊酚。体检时,受试者的眼睛自然睁开,瞳孔等圆,对光有反应。她听从简单的命令,自发地移动了四肢。受试者在第1天和第4天施用单剂量左乙拉西坦,在第3天每天给予两次。在第5天施用三次单剂量的劳拉西泮,然后施用gnx,同时施用多剂量的左乙拉西坦和单剂量的拉考沙胺。第5天,受试者的神经系统检查恶化,头部ct显示右脑半球有中风迹象。同一天,eeg证实了ncse的诊断,此时受试者被招收到临床研究并开始iv gnx 30mg推注剂量加连续输注(85mg/h)。根据现场报告,se在推注gnx施用后中止。在给药开始后60分钟、2小时和4小时,没有在eeg上发现癫痫发作活动。根据方案,gnx依次降低至40mg/h、20mg/h和10mg/h。在输注开始后大约6小时,癫痫复发,此时受试者正在以20mg/h的输注速率接受gnx。在gnx疗法的第四天开始gnx逐渐减量。在癫痫复发时,受试者的gnx血浆浓度《500ng/ml(图9)。
[0260]
5.受试者015-101
[0261]
受试者015-101是一名24岁的女性,她因肿瘤出现了局灶性惊厥性se(第1天)。近期病史包括惊厥性癫痫发作、se和多形性顶叶胶质母细胞瘤。在研究招收之前,向受试者施用左乙拉西坦用于se,和劳拉西泮、地西泮、地塞米松(dexamethasone)和多剂量左乙拉西坦用于控制癫痫发作。第3天,受试者被招收入研究并开始iv gnx 30mg推注剂量加持续输注(85mg/h)。在剂量开始时,受试者是警觉的。推注开始后不久,受试者出现明显的嗜睡。她可以用声音唤醒,但需要持续的刺激才能保持清醒或听从命令。她维持她的气道并能够证明麻木已经解决并报告她不再感到抽搐。她有一种厄运和死亡即将到来的感觉。受试者有明显的变向性眼球震颤并抱怨视力模糊。与此同时,她出现了紧迫的尿潴留。膀胱扫描仪显示至少750ml的尿液,并放置了弗利氏导管(foley catheter)。在接下来的2小时内,受试者保持嗜睡并且变得越来越不安。根据方案,gnx在剂量开始后2小时降低至40mg/h。在输注速率降低至40mg/h后大约10至15分钟,受试者的觉醒得到改善,她变得健谈,并且想吃东西。此时她没有发作癫痫。生命体征保持稳定。在gnx输注期间,由于麻木增加,伴随拉考沙胺增
加。治疗期间癫痫发作没有恢复,研究者在2天后按照方案逐渐减少研究药物。一旦gnx逐渐减量完成,调查员报告没有后遗症。图10提供了受试者的gnx血浆浓度随时间的变化。
[0262]
总之,所有5名受试者在开始初始推注加持续输注剂量时立即停止se。根据这些数据,美国食品和药物管理局(fda)允许captisol的每日暴露量限制增加到50克/天(并且gnx的总日剂量从500mg增加到715mg),从而允许gnx暴露量维持在》500ng/ml,持续约8小时。
[0263]
根据修订后的50克/天captisol限制的方案,截至2019年3月26日,将1名受试者招收到开放标签研究。这名男性受试者因肿瘤而出现了ncse。受试者进行3次二线iv aed治疗失败,并根据研究的纳入/排除标准有资格参加研究。在开始iv gnx输注后3分钟内,rse停止并且在剩余的48小时gnx治疗中维持癫痫发作保护。受试者成功停止使用gnx(即没有复发癫痫)。根据初步评估,与gnx相关的唯一安全性发现是增加镇静作用(可能是由于同时使用gnx和几种具有cns抑制特性的aed作为标准护理抗癫痫治疗的一部分)。撰写本报告时无法获得药代动力学数据。
[0264]
此外,gnx已在单独的紧急治疗ind(eind)下用于2名srse受试者。
[0265]
根据eind第131,642号,iv gnx被施用于一名srse受试者,该受试者无法用氯胺酮(ketamine)和巴比妥类维持停止状态。第1天给药方案递送900mg gnx,相当于900至1200ng/ml血浆浓度的gnx。由于受试者无法维持抑制爆发,临床团队能够利用eeg变化来估量反应(图11)。gnx的作用始于60mg/h的剂量,并在120mg/h的剂量下完全停止癫痫发作。然而,由于与fda商定每日captisol限制为63克/天的给药计划,第1天的初始120mg/h剂量无法维持超过1小时,然后必须减少到30mg/h剂量。第一次癫痫发作在gnx剂量从120mg/h变化至30mg/h后15至20分钟内再次发生。
[0266]
此外,根据eind第137,883号,iv gnx施用于先前使用左乙拉西坦、托吡酯、氯巴占、苯巴比妥、卢非酰胺、吡仑帕奈(perampanel)、戊巴比妥和氯胺酮治疗失败的srse儿科受试者。在eind时,尚无gnx iv制剂的儿科药代动力学数据。剂量方案(gnx以75mg/h开始,1小时后速率降至40mg/h)基于成人血浆药物浓度水平,该成人血浆药物浓度水平在成人中测量并且被设计成在1小时内达到约1000ng/ml的血浆药物浓度并再保持该水平23小时。在gnx开始时,对受试者进行插管并以2.25mg/kg/h的速率接受戊巴比妥。在gnx推注时,eeg显示持续抑制的背景。该活动持续约2小时,此时戊巴比妥降至1mg/kg/h。经检查,受试者的瞳孔无反应,停止输注gnx。
[0267]
有了这些令人鼓舞的数据,marinus获得了美国fda的许可,将captisol的每日限制从35克/天提高到50克/天。尽管3次二线iv aed失败,但captisol每日限制增加的一名受试者在gnx治疗后经历了快速rse停止,并成功停止使用gnx而没有复发癫痫。
[0268]
这项研究正在进行中,一旦完成,将用于设计rse受试者的关键3期研究。
[0269]
实施例3:2期开放标签剂量范围研究
[0270]
进行一项开放标签的剂量范围探索研究,其中将iv加奈索酮加入到初始苯二氮类和至少一个二线iv aed失败但未进展到iv麻醉剂的se患者的标准护理iv aed中。该研究的主要目的是确定iv加奈索酮在加入到标准护理iv aed疗法以停止se和防止治疗升级到iv麻醉以抑制癫痫发作时是安全有效的。次要目标包括评估不良事件和评估iv加奈索酮在se患者中的药代动力学。
[0271]
符合条件的患者接受持续辅助iv加奈索酮输注治疗。初始给药包括3分钟的推注
剂量(25mg或30mg),以10至85毫克/小时的速率持续输注长达96小时,然后是18小时的研究药物逐渐减量。
[0272]
该研究招收了17名患者,分为3个给药群组。iv溶液利用作为溶解加奈索酮的赋形剂。根据食品和药物管理局(fda),参与研究1042-se-2001的患者的captisol暴露量不得超过50克/天。鉴于每日captisol限制,研究3种不同剂量的gnx iv溶液;500、650和713毫克/天的总gnx分别称为低剂量水平、中等剂量水平和高剂量水平群组。
[0273]
下面提供了每个剂量组在最初24小时内输注参数的详细信息:
[0274]
表4.每个剂量群组的输注参数
[0275][0276]
低剂量群组与高剂量群组之间的主要区别在于预测血浆gnx水平≥500ng/ml的持续时间(分别为4小时和8小时)。中等剂量群组和低剂量/高剂量群组之间的主要区别在于初始预测血浆gnx水平≥700ng/ml的持续时间(分别为数分钟和2小时)并且中等剂量群组中的预测gnx血浆水平从未超过500ng/ml。图14中示出了与每个给药群组相关的预测24小时gnx血浆浓度。
[0277]
下表5呈现了招收到三个剂量水平群组中的每一个群组的患者人数。
[0278]
表5.招收到研究的参与者
[0279][0280]
这项开放标签的剂量探索研究1042-se-2001在rse患者中的初步结果表明,所有患者(100%;n=17)在gnx治疗开始后的前24小时内不需要治疗升级为iv麻醉药物来控制se,从而达到主要终点。16名患者(94%)在开始gnx治疗后的前24小时内实现se停止并维持。14名患者(82%)不需要另外的iv aeds或iv麻醉剂来治疗状态复发,长达4周。下表6中提供了总结。
[0281]
表6.rse患者的开放标签的剂量探索研究的初步结果
[0282][0283]
从gnx治疗开始到se停止的中位时间为5分钟(n=15名可评估患者)。图12。15名患者中有14名在《30分钟内实现了se停止。
[0284]
在15名可评估患者中iv gnx实现了eeg癫痫发作负担的快速和剂量依赖性持续降低(图15)。
[0285]
gnx血浆浓度》500ng/ml的急性维持与eeg上癫痫发作控制的改善相关(图13a-13d)。
[0286]
gnx输注在该患者群体中通常具有良好的耐受性,并且gnx的安全特性与其gaba能作用机制一致。2名参与者报告了与gnx治疗相关的sae(重度镇静),导致gnx早期停药。这2例发生在同时接受其它几种cns抑制药物的参与者中,并且在gnx的最高预测血浆浓度时没有发生。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1