胆汁酸在体外抑制鸽毛滴虫活性中的应用
本发明涉及药物对滴虫活性抑制技术领域,特别涉及胆汁酸对鸽毛滴虫活性抑制的应用。
背景技术:
鸽毛滴虫是一种呈梨形、椭圆形或纺锤形的单细胞寄生虫,虫体长5μm~10μm,宽4μm~8μm,由细胞核、毛基体、鞭毛、波动膜、氢化酶体和轴柱等结构组成。鸽毛滴虫通过纵二分裂方式进行增殖,其生活史仅有滋养体时期,该阶段既是毛滴虫摄取营养阶段,也是其寄生和传播阶段。鸽毛滴虫最适宜ph为6.8~7.0,温度为36.5~38℃,兼性厌氧为最适宜生长繁殖环境。
鸽毛滴虫病具有广泛性和高发性,国内外均有关于鸽毛滴虫病流行感染的报道。国内有关毛滴虫的报道表明,不同年份不同地区中规模养殖鸽毛滴虫的感染率从14.9%到49.2%不等,感染情况严重且多年来没有明显改观;西班牙、土耳其、美国和德国等国家对相关地区的家鸽毛滴虫感染率调查表明其感染率在44%~89%。由于鸽毛滴虫的流行感染与饲养方式、气候、管理水平等多种因素有关,鸽毛滴虫病的流行感染情况也存在差异。
鸽毛滴虫主要的传播途径是接触性感染,主要以种鸽间的亲吻、种鸽哺育期嗉囊分泌鸽乳哺育乳鸽直接接触造成感染,也通过被毛滴虫污染的饲料、饮水和垫料等间接接触感染毛滴虫。鸽毛滴虫在侵染宿主过程中,以入侵宿主上消化道黏膜为主,虫体在鸽口腔黏膜上附着并释放分泌因子和外泌体等物质作用于黏膜中的扁平细胞,使其出现损伤、凋亡、坏死和移除等,随着毛滴虫在入侵部位的增殖和损害,使得入侵部位逐渐出现溃疡和病灶结节,并进一步扩张导致上消化道形成多处病灶部位,毛滴虫由病灶部位进入机体循环系统,并在肝脏和脾脏沉积,造成肝脏和脾脏肿大、炎性细胞浸润、空泡变性和组织坏死,最终导致病鸽机能衰竭而亡。
根据鸽感染毛滴虫的临床症状及病变部位,将其分为4种类型:咽型、内脏型、脐型和外伤感染型。其中,咽型在患毛滴虫病鸽中最为常见,病鸽主要临床症状表现为口腔内散发恶臭味,流淌青绿色的涎水,在口腔和咽喉部能够观察到浅黄色的干酪样沉积物,口腔、咽部和食道等部位的病灶不同程度的影响病鸽的采食、呼吸和饮水等行为,常表现伸颈作吞咽姿势。内脏型是毛滴虫由病灶部位进入机体循环系统,随着循环系统在内脏器官上沉积,主要病变器官为肺脏、肝脏和肠道,临床症状表现为羽毛松乱、翅下垂、采食量下降、大量饮水、体重减轻,解剖可见肺脏表面有霉斑样病灶,肝脏和脾脏出现不同程度的结节和坏死,最终导致机体器官衰竭;脐型多发生于乳鸽,由巢盘或垫料中的毛滴虫侵染乳鸽的脐孔,引起乳鸽脐部皮下组织炎症、溃疡或干酪样病变,病灶部位集中在脐部及其周围,病灶部位严重影响乳鸽的仰头、行走和采食等行为、最终因发育不良而形成僵鸽。单纯感染毛滴虫的病例有少量报道,更多的是由毛滴虫病引发的混合感染,主要是与大肠杆菌、白色念珠菌混合感染,个别与副粘病毒、链球菌混合感染。
鸽毛滴虫病的治疗在肉鸽养殖中一直是被关注的热点,相关专家和学者也在不断地开发药物对鸽毛滴虫进行治疗。甲硝唑的发现为毛滴虫病的治疗做出了显著改善,也是who推荐杀滴虫的首选药物。此外,地美硝唑、洛硝哒唑和卡硝唑等几种硝基咪唑类药物也可用于鸽毛滴虫感染的治疗。但随着甲硝唑等药物的使用,不断有报道证明毛滴虫对甲硝唑、地美硝唑、洛硝哒唑和卡硝唑等几种硝基咪唑类存在明显的抗药性,且抗生素的使用易诱发机体的癌变和畸形,损伤中枢神经系统等。因此,开发研制具有特异性、低毒和副作用少的制剂代甲硝唑类抗生素药物,对肉鸽行业无抗养殖和绿色发展具有重要意义。
胆汁酸是由胆固醇在肝脏中代谢过程中产生的胆烷酸的总称,是胆汁的重要组成成分。胆汁酸能够调节机体的炎症反应,并能抑制大肠杆菌、链球菌、沙门氏菌等细菌的增殖,能阻止有害菌入侵皮下组织,并能降低细菌的定植,阻止细菌转移到其他器官。此外,胆汁酸具有保肝利胆的功能,胆汁酸能有效分解细菌产生的内毒素,减少机体对细菌内毒素的吸收,达到保护肝脏的目的。胆汁酸代谢过程中,经“肠肝循环”进入肝脏的胆汁酸,还可刺激肝细胞分泌胆汁,增加胆汁容量,消除胆汁淤滞,预防胆结石,起到利胆作用。
技术实现要素:
本发明的目的是提供一种抑制鸽毛滴虫活性的方法,以代替甲硝唑在抑制鸽毛滴虫活性中的应用,减少抗生素类药物的使用,实现绿色、环保、无污染的养殖目标。
为达到上述目的,本发明提供了一种体外胆汁酸抗毛滴虫活性的新应用,具体步骤如下:
步骤1.毛滴虫纯化培养:将纯化后的毛滴虫接种到含有4%胎牛血清和1%三抗的tf培养基中,36.5~38℃恒温培养。
步骤2.虫体死活鉴别和数量统计:使用血球计数法对鸽毛滴虫虫株液进行计数,并通过台盼蓝染色判定虫体死活。
步骤3.虫体生长曲线测定:将步骤二中配制的虫株液制备成密度为1.5×105个/ml的虫液,在无菌条件下培养第3、6、9、12、15、18、21、24、48、72h采样观察计数,并绘制鸽毛滴虫在tf完全培养基中的生长曲线。
步骤4.抗鸽毛滴虫活性测定:将不同终浓度的胆汁酸毛滴虫培养液和甲硝唑毛滴虫培养液分别与虫株液混合培养,设置pbs代替胆汁酸为空白对照组,36.5~38℃恒温培养,分别于3、6、9、12、18、24h观察虫体状态,并统计不同药物的相对抑制率。
步骤5.体外细胞毒性测定:体外培养鸽胚胎成纤维细胞,并使用步骤四中相同浓度的胆汁酸dmem完全培养基、甲硝唑dmem完全培养基和含有等量pbs的dmem完全培养基进行培养。
在以上技术方案的基础上,优选地,步骤1中所述鸽毛滴虫活力旺盛,在显微镜下能观察到快速游动;
在以上技术方案的基础上,优选地,步骤1、3和4中所述三抗包括青霉素、链霉素和两性霉素;
在以上技术方案的基础上,优选地,步骤1中所述完全培养基为95%tf培养基,4%胎牛血清(fbs)和1%三抗;
在以上技术方案的基础上,优选地,步骤4中所述胆汁酸的主要成分为脱氧胆酸钠,纯度为95%,甲硝唑纯度为99%。
本发明的有益效果:
本发明填补了胆汁酸在抗鸽毛滴虫活性应用上的空白。
本发明采用的胆汁酸为胆膏提取物,具有绿色、天然和无污染的特点。
附图说明
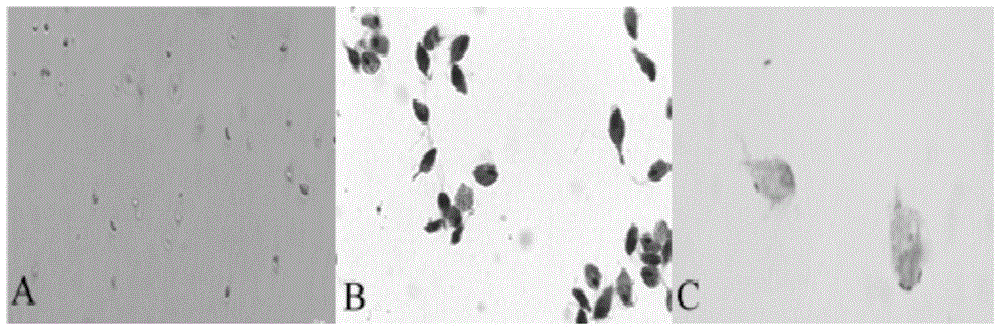
图1为本发明培养的鸽毛滴虫显微镜图(图1-a,100×)、鸽毛滴虫瑞氏-吉姆萨染色显微镜图,染色后虫体呈紫红色,细胞核呈深紫色(图1-b,1000×)和鸽毛滴虫迪夫染色显微镜图,染色后,虫体呈浅蓝色,细胞核呈深蓝色(图1-c,1000×);
图2为本发明体外使用tf培养基在适宜条件下测定的鸽毛滴虫生长曲线图;
图3为本发明正常毛滴虫dapi荧光染色显微镜图,细胞核呈蓝色,核较小(图3-a、b,100×)、胆汁酸处理24h后dapi荧光染色显微镜图,虫体细胞核呈蓝色,部分虫体的细胞核较大(图3-c,100×);甲硝唑处理24h后毛滴虫dapi荧光染色显微镜图,虫体细胞核呈蓝色,部分虫体的细胞核较大(图3-d,100×)。
具体实施方式
下面结合具体实施,对本发明进一步详细、完整地描述,但本发明的实施方式不限于此,本领域其他技术人员没有做出创造性劳动前提下所获得的所有其他实施方式,都属于本发明保护的范围。
下面实施例中未注明具体条件的实验方法,按照常规方法和条件。下面实施例中描述的试剂和实验器具在使用前均经过灭菌处理。本文中所用的术语均具有本领域技术人员常规理解的含义。
实施例1:胆汁酸对鸽毛滴虫的体外抑制浓度
在北京某鸽场选取患毛滴虫病的种鸽为采集对象,用浸润在无菌生理盐水中的棉棒分别采集病鸽口腔和咽部病灶部位和周围黏膜处的样本,将棉签置于含有无菌生理盐水的1.5ml离心管中,5000r·min-1离心5min后去除棉签和上清液,用无菌pbs重悬底部沉淀,percoll密度梯度离心法去除沉淀中的细胞或组织,得到纯化的毛滴虫虫株液,将毛滴虫接种到含有4%胎牛血清和1%青链霉素双抗的tf培养基中,36.5~38℃恒温培养。
虫体鉴定:收集纯化后培养的虫体,用100μlpbs重悬虫体,使用pbs洗涤3次后,甲醛固定,分别使用瑞氏-吉姆萨和迪夫染色,置于光学显微镜下观察并拍照,观察其形态结构。在超净台中用无菌枪头将虫株液轻轻吹打均匀,吸取一定悬液与等体积0.4%的台盼蓝混合,然后取10μl滴于已加盖玻片的血球计数板上,统计活虫体数量。
虫体死活的判定:活毛滴虫呈无色透明状,虫体运动,鞭毛或波动膜不停波动;死亡毛滴虫被染成明显的蓝色,虫体变圆、结构模糊、虫体内颗粒化、失去原有的透明度、鞭毛停止运动、细胞膜破损。
虫体密度=(4大格虫体总数/4)×104×稀释倍数(个/ml)
虫体活力=活虫体个数/(活虫体个数+死亡虫体个数)×100%
使用分析天平称取一定量的甲硝唑,溶解在tf完全培养基中,配制不同浓度梯度的甲硝唑毛滴虫培养液(甲硝唑tf完全培养液),以相同方式配制不同浓度梯度的胆汁酸毛滴虫培养液(胆汁酸tf完全培养液)和含pbs的tf完全培养液。试验组:取密度为1×106个/ml的虫株液600μl与400μl胆汁酸tf完全培养液混合培养,于36.5~38℃恒温培养,分别于3、6、9、12、18、24h观察;甲硝唑对照组:取密度为1×106个/ml的虫株液600μl与400μl甲硝唑tf完全培养液混合培养,于36.5~38℃恒温培养,分别于3、6、9、12、18、24h观察;空白对照组:取密度为1×106个/ml的虫株液600μl与400μl含pbs的tf完全培养液混合培养,于36.5~38℃恒温培养,分别于3、6、9、12、18、24h观察。统计活虫体数量,计算不同药物的相对抑制率。
相对存活率(%)=(试验组活虫体数量/对照组活虫体数量)×100%
相对抑制率(%)=100%-相对存活率(%)
结果:在不同浓度甲硝唑抗虫效果观察试验中,均对毛滴虫的活性有抑制作用,随着浓度的增加和作用时间的延长,抑制效果更佳明显,当甲硝唑浓度达到80μg/ml,作用时间为24h时,能够对鸽毛滴虫达到100%的抑制效果。结果详见表1;在不同浓度胆汁酸抗虫效果观察试验中,胆汁酸与甲硝唑的作用相似,当胆汁酸浓度达到800μg/ml,作用时间为24h时,能够对鸽毛滴虫达到100%的抑制效果,详见表2。
表1甲硝唑对毛滴虫的体外抑制效果
注:同列数据肩标相同小写字母表示差异不显著(p﹥0.05),相邻小写字母表示差异显著(p﹤0.05)。
表2胆汁酸对毛滴虫的体外抑制效果
注:同列数据肩标相同小写字母表示差异不显著(p﹥0.05),相邻小写字母表示差异显著(p﹤0.05)。
实施例2:胆汁酸对鸽毛滴虫细胞核的作用
为观察不同处理下鸽毛滴虫细胞核的变化,用dapi荧光染料对其进行染色,操作方法如下:
(1)收集不同处理后的虫体,并用pbs洗涤3次;
(2)洗涤后的虫体加入200μldapi工作液均匀混合,室温下孵育15min;
(3)洗去dapi:孵育结束后,用1ml1×pbs,洗涤虫体3次,弃上清液;
(4)用200μl1×pbs重悬虫体,荧光显微镜观察。
结果:对甲硝唑处理24h和胆汁酸处理24h后的毛滴虫进行dapi染色观察,与正常毛滴虫在dapi染色后结果对比,明显能看到在处理后的毛滴虫中,细胞核明显变变大变圆,由此表明,甲硝唑和胆汁酸对毛滴虫的细胞核均有损伤作用,详见图2。
实施例3:胆汁酸对鸽胚胎成纤维细胞的毒性作用
观察测定甲硝唑和胆汁酸对鸽胚胎成纤维细胞的毒性作用,具体操作如下:
(1)收集扩增一代的鸽胚胎成纤维细胞,使用计数器计数,用dmem完全培养基调整细胞密度为4×105个/ml,37℃、5%co2温箱放置备用;
(2)无菌条件下,96孔板四周一圈加入灭菌水,自第二排开始每孔加入100μl细胞悬液,置于37℃、5%co2温箱孵育6h使细胞贴壁;
(3)制备与虫体处理中相同浓度的甲硝唑和胆汁酸dmed完全培养液;
(4)孵育6h后,吸弃培养液上清,然后每孔加入100μl甲硝唑/胆汁酸dmem完全培养液,每个浓度设4个重复,同时设空白培养液对照孔为调零组和不加药物的细胞对照孔为细胞对照组,最后将96孔板置于37℃、5%co2培养箱中继续孵育40h;
(5)孵育40h后,每加样孔加入0.5%(5mg/ml)的cck8溶液10μl,37℃继续孵育1~4h;
(6)用酶联免疫检测仪检测在波长450nm处测od值;
(7)细胞死亡率(%)=[(细胞对照组od450-试验组od450)/(细胞对照组od450-调零组od450)]×100%。
结果:鸽胚胎成纤维细胞的死亡率随药物浓度的增加而升高,不同浓度的甲硝唑体外与鸽胚胎成纤维细胞作用24h后,均对细胞有损伤作用;低浓度的胆汁酸与细胞作用24h后能够促进细胞的增殖,超过一定浓度后,对细胞也有抑制作用。由此表明,胆汁酸的细胞毒性<甲硝唑的细胞毒性,详见表3。
表3胆汁酸和甲硝唑细胞毒性对比
综上所述,胆汁酸能够代替甲硝唑对毛滴虫产生抑制效果,并对鸽胚胎成纤维细胞的损伤较小,可以根据试验结果,将胆汁酸运用到实际生产中,代替甲硝唑的使用,达到无抗养殖的目的。
以上所述仅为本发明的较佳实施方式而已,但本发明的实施方式并不仅限于上述实施例,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!