一种含牛血清白蛋白的脂质纳米抗肿瘤药物及其制备方法
本发明涉及纳米药物
技术领域:
,尤其涉及一种含牛血清白蛋白的脂质纳米抗肿瘤药物及其制备方法。
背景技术:
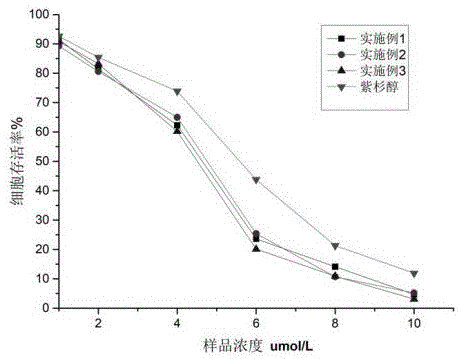
:紫杉醇是一种天然的小分子抗肿瘤药物,具有非常出色的抗肿瘤活性,对多种肿瘤都具有较好的抑制效果。但是紫杉醇水溶性较差,吸收效率低,对肿瘤细胞缺乏选择性,在治疗肿瘤的同时,也对患者的正常组织细胞造成了巨大的伤害。为了提高紫杉醇的水溶性,现有技术中将紫杉醇做成脂质体的形式,如中国专利cn101011357公开的一种紫杉醇脂质体制剂的制备方法,采用薄膜分散法或喷雾干燥法制备长循环紫杉醇脂质体,以胆固醇、二硬脂酰基磷脂酰胆碱和十四酸为稳定剂,蔗糖为冻干保护剂,氯仿、甲醇为有机溶剂;并且采用两亲性聚乙二醇衍生物修饰脂质体膜,同时采用挤压或高压均质的方法使脂质体粒径≤100nm,包封率≥85%。该方法制得的紫杉醇脂质体制剂有效改善了紫杉醇的水溶性,提高了生物利用度,但是有毒副作用。为了降低紫杉醇的毒副作用,人们选择采用多糖类化合物作为药物载体。例如,壳聚糖是一种天然的碱性多糖,具有生物利用度高、可降解等多种优点,可以被用来制备各种类型的纳米载体。牛血清白蛋白是来自于血液中的一种球蛋白,具有出色的可降解性和生物利用度,同时能够显著提高药物在体内的运输效率。目前多数学者都是采用单一的壳聚糖或者牛血清白蛋白作为药物载体,虽然在一定程度上改善了紫杉醇的水溶性、生物利用度,但是这些药物载体仍不能适应人体复杂的代谢环境。因此,采用多种材料复合的方式,集合各种材料的优点,制备新型的纳米载体受到科学家的关注。技术实现要素:本发明的目的是解决现有技术中的问题,提供一种集合壳聚糖、牛血清白蛋白以及脂质体纳米药物的多种优点,载药率高、毒副作用低的含牛血清白蛋白的脂质纳米抗肿瘤药物及其制备方法。本发明的技术方案是:一种含牛血清白蛋白的脂质纳米抗肿瘤药物的制备方法,包括以下步骤:⑴正辛基改性壳聚糖的制备:称取壳聚糖和溴代正辛烷,加入到溶剂中,搅拌,加入有机碱,升温至80~120℃,搅拌反应24~48小时,降温至15~35℃,加入乙醇稀释,继续搅拌10~30分钟,过滤,滤饼干燥,得正辛基改性壳聚糖;⑵包裹紫杉醇的壳聚糖脂质体纳米材料的制备:取叶酸聚乙二醇磷脂、卵磷脂和紫杉醇,用二氯甲烷和甲醇的混合溶剂溶解,超声5~15分钟,减压蒸馏除去混合溶剂,得到固体,向所得固体中加入水,超声5~15分钟,加入步骤⑴制备的正辛基改性壳聚糖,升温至30~50℃,超声10~30分钟,搅拌0.5~1.5小时,用0.45μm的滤膜过滤,滤液冻干得包裹紫杉醇的壳聚糖脂质体纳米材料;⑶含牛血清白蛋白的脂质纳米抗肿瘤药物的制备:将步骤⑵所得包裹紫杉醇的壳聚糖脂质体纳米材料加入到牛血清白蛋白水溶液中,超声10~30分钟,搅拌0.5~1.5小时,用0.45μm的滤膜过滤,滤液冻干得含牛血清白蛋白的脂质纳米抗肿瘤药物;所述溶剂为二甲亚砜或n,n-二甲基甲酰胺;所述有机碱是三乙胺或4-二甲氨基吡啶或n,n-二异丙基乙胺;所述二氯甲烷和甲醇的混合溶剂中,二氯甲烷和甲醇的质量比是1:1~1:2;所述牛血清白蛋白的水溶液的质量浓度为0.5~1%;其中壳聚糖、溴代正辛烷、溶剂、有机碱、乙醇、叶酸聚乙二醇磷脂、卵磷脂、紫杉醇、二氯甲烷和甲醇的混合溶剂、水、牛血清白蛋白的水溶液的质量比为1~2:0.2~0.5:50~150:0.4~0.6:200~400:0.05~0.15:0.4~0.6:0.05~0.15:5~10:100~200:100~140。优选的,所述溶剂为二甲亚砜。优选的,所述有机碱是三乙胺。优选的,所述二氯甲烷和甲醇的混合溶剂中,二氯甲烷和甲醇的质量比是1:1.5。优选的,所述牛血清白蛋白的水溶液的质量浓度为0.8%。优选的,所述叶酸聚乙二醇磷脂,聚乙二醇的分子量为2000。优选的,所述壳聚糖的平均分子量是5万,脱乙酰度大于90%。一种含牛血清白蛋白的脂质纳米抗肿瘤药物包括三层球状结构,内层为叶酸聚乙二醇磷脂、卵磷脂和紫杉醇组成的脂质体,中间层为正辛基改性壳聚糖,外层为牛血清白蛋白。本发明的有益效果为:以正辛烷对壳聚糖的结构进行改性,制备正辛基改性壳聚糖,在壳聚糖结构中引入了亲脂性长链烷基,长链烷基可插入到脂质体的烷基链中,对脂质体具有保护作用;正辛基改性壳聚糖中还含有部分未反应的氨基,在肿瘤组织的酸性微环境中,氨基可以质子化,从而使纳米载体解散,释放出抗肿瘤药物紫杉醇,提高药物对肿瘤细胞的靶向性。本发明的纳米抗肿瘤药物在制备时,首先将叶酸聚乙二醇磷脂和卵磷脂溶解在二氯甲烷和甲醇的混合液中,旋干后加入水,使其形成脂质体微粒,然后加入紫杉醇和正辛基改性壳聚糖,通过超声和搅拌使紫杉醇进入到纳米脂质体的内部,同时正辛基改性壳聚糖的烷基嵌入到脂质体中,在脂质体外层形成保护,另外正辛基改性壳聚糖中剩余的氨基可以和牛血清白蛋白中的羧基结合,在材料最外层形成保护层,既能够改善载体的生物相容性,又能延长药物载体内的循环时间,提高药物的生物利用度。附图说明图1为肿瘤细胞的抑制活性实验实验结果;图2为透射电镜测定的实施例3制备的纳米脂质体药物的结构形态;图3为透射电镜测定的实施例3制备的纳米脂质体药物的结构形态;图4为原子力显微镜测定的实施例3制备的纳米脂质体药物的结构形态。具体实施方式为了使本发明的技术手段、技术特征、发明目的与技术效果易于明白了解,下面结合具体图示,进一步阐述本发明。实施例1:⑴正辛基改性壳聚糖的制备:称取10g壳聚糖和2g溴代正辛烷,加入到500g二甲亚砜中,搅拌,加入4g4-二甲氨基吡啶,升温至80℃,搅拌反应24小时,降温至15℃,加入2000g乙醇稀释,继续搅拌10分钟,过滤,滤饼干燥,得正辛基改性壳聚糖;⑵包裹紫杉醇的壳聚糖脂质体纳米材料的制备:取0.5g叶酸聚乙二醇磷脂、4g卵磷脂和0.5g紫杉醇,用50g二氯甲烷和甲醇的混合溶剂(二氯甲烷和甲醇的质量比是1:1)溶解,超声5分钟,减压蒸馏除去混合溶剂,得到固体,向所得固体中加入1000g水,超声5分钟,加入步骤⑴制备的正辛基改性壳聚糖,升温至30℃,超声10分钟,搅拌0.5小时,用0.45μm的滤膜过滤,滤液冻干得包裹紫杉醇的壳聚糖脂质体纳米材料;⑶含牛血清白蛋白的脂质纳米抗肿瘤药物的制备:将步骤⑵所得包裹紫杉醇的壳聚糖脂质体纳米材料加入到1000g牛血清白蛋白水溶液中(质量浓度为0.5%),超声10分钟,搅拌0.5小时,用0.45μm的滤膜过滤,滤液冻干得含牛血清白蛋白的脂质纳米抗肿瘤药物。实施例2:⑴正辛基改性壳聚糖的制备:称取20g壳聚糖和5g溴代正辛烷,加入到1500gn,n-二甲基甲酰胺中,搅拌,加入6gn,n-二异丙基乙胺,升温至120℃,搅拌反应48小时,降温至35℃,加入4000g乙醇稀释,继续搅拌30分钟,过滤,滤饼干燥,得正辛基改性壳聚糖;⑵包裹紫杉醇的壳聚糖脂质体纳米材料的制备:取1.5g叶酸聚乙二醇磷脂、6g卵磷脂和1.5g紫杉醇,用100g二氯甲烷和甲醇的混合溶剂(二氯甲烷和甲醇的质量比是1:2)溶解,超声15分钟,减压蒸馏除去混合溶剂,得到固体,向所得固体中加入2000g水,超声15分钟,加入步骤⑴制备的正辛基改性壳聚糖,升温至50℃,超声30分钟,搅拌1.5小时,用0.45μm的滤膜过滤,滤液冻干得包裹紫杉醇的壳聚糖脂质体纳米材料;⑶含牛血清白蛋白的脂质纳米抗肿瘤药物的制备:将步骤⑵所得包裹紫杉醇的壳聚糖脂质体纳米材料加入到1400g牛血清白蛋白水溶液中(质量浓度为1%),超声30分钟,搅拌1.5小时,用0.45μm的滤膜过滤,滤液冻干得含牛血清白蛋白的脂质纳米抗肿瘤药物。实施例3:⑴正辛基改性壳聚糖的制备:称取15g壳聚糖和3.5g溴代正辛烷,加入到1000g二甲亚砜中,搅拌,加入5g三乙胺,升温至100℃,搅拌反应36小时,降温至25℃,加入3000g乙醇稀释,继续搅拌20分钟,过滤,滤饼干燥,得正辛基改性壳聚糖;⑵包裹紫杉醇的壳聚糖脂质体纳米材料的制备:取1g叶酸聚乙二醇磷脂(聚乙二醇的分子量为2000)、5g卵磷脂和1g紫杉醇,用80g二氯甲烷和甲醇的混合溶剂(二氯甲烷和甲醇的质量比是1:1.5)溶解,超声10分钟,减压蒸馏除去混合溶剂,得到固体,向所得固体中加入1500g水,超声10分钟,加入步骤⑴制备的正辛基改性壳聚糖,升温至40℃,超声20分钟,搅拌1小时,用0.45μm的滤膜过滤,滤液冻干得包裹紫杉醇的壳聚糖脂质体纳米材料;⑶含牛血清白蛋白的脂质纳米抗肿瘤药物的制备:将步骤⑵所得包裹紫杉醇的壳聚糖脂质体纳米材料加入到1200g牛血清白蛋白水溶液中(质量浓度为0.8%),超声20分钟,搅拌1小时,用0.45μm的滤膜过滤,滤液冻干得含牛血清白蛋白的脂质纳米抗肿瘤药物。实施例4:纳米脂质体的包封率测试以hplc法测定纳米脂质体药物对紫杉醇的包封率,分别称取本发明3个实施例所制备的纳米脂质体材料,加入10体积的水,超声,在高速离心机上离心,去除上清液,由于紫杉醇不溶于水,未包封的紫杉醇沉淀在离心管底部,将所得沉淀用一定量的甲醇溶解,在高效液相色谱仪上测定甲醇溶液的吸光度,根据峰面积计算未包封的紫杉醇的含量。采用hplc法做紫杉醇标准曲线,测定不同浓度的紫杉醇甲醇溶液的高效液相谱图,绘制标准曲线。为了确保测试结果的准确性,做紫杉醇标准曲线时,确保浓度适宜,使纳米药物中未包封的紫杉醇浓度在标准曲线浓度范围之内。包封率按照如下公式计算:包封率=紫杉醇的加入量-未被包封的紫杉醇的量/紫杉醇的加入量×100%测试结果见表1,本发明制备的纳米脂质体对紫杉醇具有较高的包封率,均在92%以上,大多数紫杉醇都被包裹在药物中。表1.纳米脂质体对紫杉醇的包封率样品名称实施例1实施例2实施例3纳米脂质体对紫杉醇的包封率93.4%92.5%94.1%对肿瘤细胞的细胞抑制活性本实验采用cck8法,按照cck8试剂盒的步骤测定纳米脂质体药物对肿瘤细胞的抑制活性。选取的肿瘤细胞系为hepg2,化合物的作用浓度为(以紫杉醇计):0,1,2,4,6,8,10μmol/l,药品处理肿瘤细胞的时间时24小时。如图1所示,为肿瘤细胞的抑制活性实验实验结果,将紫杉醇包裹在本发明制备的纳米脂质体中之后,其对肿瘤细胞的抑制活性明显增强,且对肿瘤细胞的抑制率随着紫杉醇浓度的增加逐渐升高,当紫杉醇的浓度为6μmol/l时,本发明制备的纳米脂质体药物对肿瘤细胞抑制活性较好,肿瘤细胞的存活率在20%左右。单纯的紫杉醇(6μmol/l)作用下,肿瘤细胞的存活率约在65%。这说明本发明制备的纳米载体可有效提高紫杉醇的抗肿瘤活性。材料的结构形态测定选取实施例3制备的纳米脂质体药物,采用透射电镜技术对其结构形态进行测试。如图2和3所示,为透射电镜测定的实施例3制备的纳米脂质体药物的结构形态,实施例3制备的纳米脂质体药物为均匀的球状结构,粒径分布在100~200nm之间。如图4所示,为原子力显微镜测定的实施例3制备的纳米脂质体药物的结构形态,通过原子力显微镜测试进一测定了纳米脂质体药物的结构形态,结果表明多数的纳米脂质体均为球状结构。这表明实施例3制备的纳米脂质体药物在结构上具有较好的正态分布性。综上所述仅为本发明较佳的实施例,并非用来限定本发明的实施范围。即凡依本发明申请专利范围的内容所作的等效变化及修饰,皆应属于本发明的技术范畴。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1