胶原蛋白7的组合物及其使用方法与流程
胶原蛋白7的组合物及其使用方法
1.本技术是申请日为2016年12月21日,申请号为201680075057.5,发明名称为“胶原蛋白7的组合物及其使用方法”的申请的分案申请。
2.相关申请的交叉引用
3.本技术要求2015年12月23日提交的美国临时专利申请号62/387,241;2016年1月14日提交的美国临时专利申请号62/278,816;以及2016年2月9日提交的美国临时专利申请号62/293,209的益处,并依赖于其申请日,其全部公开内容通过引用的方式并入本文。
4.领域
5.本发明涉及组合物(例如药物组合物),并且更具体地涉及胶原蛋白7的组合物和使用其治疗营养不良性大疱性表皮松解症(dystrophic epidermolysis bullosa)的方法。
6.背景
7.胶原蛋白vii(c7)蛋白质是一种结构蛋白质,其中c7是形成能够使表皮和真皮连接的固着性原纤维的结构和功能前体。c7单体组装成含有一个nc-1结合区和一个nc-2结合区的约900kda的同源三聚体。同源三聚体通过α螺旋线圈保持在一起。由同源三聚体,这些c7蛋白质前体排列成反向平行二聚体,分子量增加至1.8mda。横向组装反向平行二聚体导致固着性原纤维的形成。rc7蛋白表现出“粘性”,以及在较高蛋白质浓度下沉淀的倾向,特别是在pbs缓冲液中。
8.缺乏c7导致这些固着性原纤维的异常减少和称为营养不良性大疱性表皮松解症(deb)的状况。eb包括一组分子多样性疾病,其特征在于对皮肤的轻微机械创伤后发展出水疱。(1)严重程度、皮外表现和临床过程取决于eb的类型;然而,几乎所有患者都会出现起水疱或皮肤破裂。(2)
9.营养不良性大疱性表皮松解症(ebb)是eb的一种形式,其特征在于愈合时发展出瘢痕。(3)在deb患者中,由于皮肤极其脆弱的性质,即使轻微机械创伤也会引发起水疱。这导致起水疱、愈合和再次起水疱的长期循环,使患者遭受伤口疼痛和使上皮组织的疤痕虚弱。deb无法治愈,并且管理集中于支持性护理。
10.营养不良性eb是由col7al基因突变引起的,该基因编码胶原蛋白vii(c7)的α链,该蛋白质是形成将基底膜锚定在下层真皮上的固着性原纤维所必需的蛋白质。(4)这种状况以显性形式(ddeb)或隐性形式(rdeb)遗传,rdeb通常具有更严重的表型。(5)
11.deb小鼠模型(col7a1-/-)对col7al基因具有靶向灭活作用,引起严重的水疱,其模拟严重的人rdeb的组织学和超微结构表现。(6)这些小鼠在真皮-表皮基底膜区(bmz)没有可检测的胶原蛋白vii,完全缺乏固着性原纤维,且出生时在它们的腹侧面上出现大量的皮肤水疱并且在它们的爪子和颈部出现出血性水疱,通常观察到在生命的第一周内死亡。
12.概述
13.本公开涉及包含胶原蛋白7的组合物和制备这种组合物的方法。在某些实施方案中,组合物包含重组胶原蛋白7、磷酸钠、柠檬酸钠、氯化钠、精氨酸、糖和表面活性剂。可以从该组合物中排除磷酸钠、柠檬酸钠、氯化钠、精氨酸、糖或表面活性剂中的一种或多种。
14.在某些实施方案中,糖是蔗糖。在某些实施方案中,表面活性剂是聚山梨酸酯,例
如聚山梨酸酯20或聚山梨酸酯80。
15.在某些实施方案中,磷酸钠以100mm至1mm、50mm至5mm、25mm至5mm、10mm至5mm、10mm至1mm或约10mm的量存在。
16.在某些实施方案中,柠檬酸钠以100mm至1mm、50mm至1mm、25mm至1mm、10mm至1mm、5mm至1mm或约5mm的量存在。
17.在某些实施方案中,氯化钠以200mm至10mm、100mm至20mm、80mm至50mm或约70mm的量存在。
18.在某些实施方案中,精氨酸以200mm至5mm、150mm至50mm、100mm至75mm或约100mm的量存在。
19.在某些实施方案中,糖以100mm至10mm、100mm至50mm、75mm至35mm、60mm至40mm或约50mm的量存在。在某些实施方案中,蔗糖以100mm至1mm、100mm至50mm、75mm至35mm、60mm至40mm或约50mm的量存在。
20.在某些实施方案中,表面活性剂以1%至0.01%、0.5%至0.05%、0.025%至0.05%、0.1%至0.05%、0.05%至0.01%或约0.05%(w/v)的量存在。在某些实施方案中,聚山梨酸酯(例如聚山梨酸酯20)以1%至0.01%、0.5%至0.05%、0.025%至0.05%、0.1%至0.05%、0.05%至0.01%或约0.05%(w/v)的量存在。
21.在某些实施方案中,组合物的ph为8.0至6.0、7.5至6.5、7.5至7.0、7.4至7.0、7.3至7.0、7.2至7.0、7.1至7.0、7.2至7.1、7.2
±
0.3、约7.1或约7.2。
22.在某些实施方案中,组合物包含重组胶原蛋白7、100mm至10mm的磷酸钠、100mm至1mm的柠檬酸钠、200mm至10mm的氯化钠、200mm至10mm的精氨酸、100mm至10mm的蔗糖和1.0%至0.01%(w/v)的聚山梨酸酯20,并且任选地ph为7.2至7.1。
23.在某些实施方案中,组合物包含重组胶原蛋白7、25mm至5mm的磷酸钠、25mm至1mm的柠檬酸钠、100mm至20mm的氯化钠、150mm至50mm的精氨酸、75mm至35mm的蔗糖和0.5%至0.05%的聚山梨酸酯20(w/v),并且任选地ph为7.2至7.1。
24.在一个实施方案中,组合物包含重组胶原蛋白7、约10mm的磷酸钠、约5mm的柠檬酸钠、约70mm的氯化钠、约100mm的精氨酸、约50mm的蔗糖和约0.05%的聚山梨酸酯20(w/v),并且ph为约7.1。
25.在另一个实施方案中,组合物包含重组胶原蛋白7、10mm的磷酸钠、5mm的柠檬酸钠、70mm的氯化钠、100mm的精氨酸、50mm的蔗糖和0.05%的聚山梨酸酯20(w/v),并且ph为约7.1。
26.在另一个实施方案中,组合物包含重组胶原蛋白7、10mm的磷酸钠、5mm的柠檬酸钠、70mm的氯化钠、100mm的精氨酸、50mm的蔗糖和0.05%的聚山梨酸酯20(w/v),并且ph为7.2
±
0.3。
27.在某些实施方案中,重组胶原蛋白7是人胶原蛋白7。
28.胶原蛋白7的组合物具有增加的稳定性。在某些实施方案中,组合物在1升聚碳酸酯瓶(500ml组合物)中在-65
±
5℃或-20
±
5℃下储存后持续3个月是稳定的。在某些实施方案中,组合物在10cc玻璃瓶(5.5ml组合物)中在-65
±
5℃或-20
±
5℃下储存后持续6个月是稳定的。在某些实施方案中,组合物在25
±
3℃下储存2周后是稳定的。在某些实施方案中,组合物在5
±
3℃下储存长达1个月后是稳定的。
20和约7.2的ph。
45.与先前使用的pbs缓冲液相比,这些改进的制剂增强rc7溶解度,与先前使用的pbs缓冲液相比rc7蛋白质浓度增加约8-10倍,并且增强了针对冷冻和解冻以及储存和处理期间的热应激的稳健性/稳定性。在某些实施方案中,本文所述的rc7组合物在-65
±
5℃和-20
±
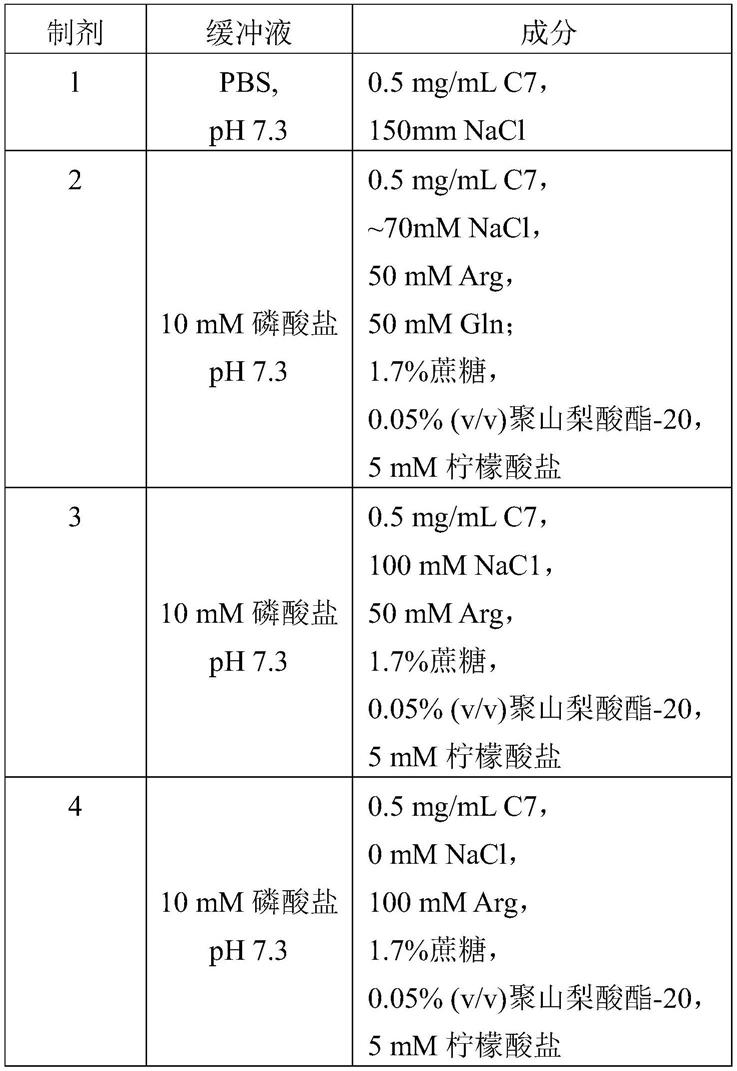
5℃下均稳定3个月。在某些实施方案中,本文所述的rc7组合物在-65
±
5℃和-20
±
5℃下均稳定6个月。在某些实施方案中,rc7组合物在25
±
3℃下稳定2周,并且在5
±
3℃下稳定至多1个月。就递送装置相容性而言,在某些实施方案中,本文所述的rc7组合物在储存于一次性注射器中时在25
±
3℃下稳定长达8小时,或当稀释到盐水中至0.1mg/ml时在25
±
3℃下稳定长达6小时。如本文所用,“稳定”是指在指定的储存条件后,蛋白质的量没有显着差异(如通过在280nm处的吸光度所测量的),高分子量物质、二聚体、同源三聚体和低分子量物质没有显著差异(如通过sec-hplc所测量的),并且效力没有显着损失(如在纤连蛋白结合测定中所测量的)。
46.可在组合物中使用的糖包括但不限于非还原性二糖(例如蔗糖、海藻糖)或糖醇,例如山梨醇。在某些实施方案中,组合物中的糖是蔗糖。
47.组合物还可以包含一种或多种缓冲液,例如磷酸盐缓冲液(例如磷酸钠)、组氨酸缓冲液、三(羟甲基)氨基甲烷缓冲液。
48.该组合物还可以包含一种或多种表面活性剂和/或膨松剂。表面活性剂包括但不限于泊洛沙姆(例如)、聚山梨酸酯(例如聚山梨酸酯80、聚山梨酸酯20)、ctab(十六烷基三甲基溴化铵)或sds(十二烷基硫酸钠或月桂基硫酸钠)。在某些实施方案中,组合物中的表面活性剂是聚山梨酸酯(例如聚山梨酸酯20)。膨松剂包括但不限于pvp、peg、葡聚糖、甘露醇和甘氨酸。
49.该组合物还可以包含一种或多种另外的药学上可接受的赋形剂。药学上可接受的赋形剂的实例包括但不限于盐、蛋白质(例如白蛋白)、螯合剂(例如柠檬酸盐、edta)、胶凝聚合物、脲(或其衍生物)及其组合。
50.一个方面涉及本文所述的组合物治疗deb的用途。还提供了治疗deb的方法,其包括向有需要的受试者施用包含重组胶原蛋白7、缓冲液、非必需氨基酸、冷冻保护剂、表面活性剂和螯合剂的组合物。在某些实施方案中,缓冲液是磷酸盐缓冲液(例如磷酸钠)。在某些实施方案中,非必需氨基酸是精氨酸。在某些实施方案中,冷冻保护剂是糖,例如蔗糖。在某些实施方案中,表面活性剂是聚山梨酸酯,例如聚山梨酸酯20或聚山梨酸酯80。在某些实施方案中,螯合剂是柠檬酸盐。每个组分的量可以变化,如整个申请中所描述的。在一个实施方案中,组合物包含重组胶原蛋白7、10mm的磷酸钠、5mm的柠檬酸钠、70mm的氯化钠、100mm的精氨酸、50mm的蔗糖和0.05%聚山梨酸酯20(w/v),并且ph为7.1或7.2。
实施例
51.实施例1
52.选择五种制剂来比较冷冻/解冻特性和热稳定性,包括先前使用的pbs制剂。这些制剂列在表1中。
53.表1:
54.[0055][0056]
通过测试这些制剂,发现l-精氨酸和蔗糖,优选75-100mm的l-精氨酸和1.7%(w/v)蔗糖提高了溶解度。包含表面活性剂(例如0.05%聚山梨酸酯-20)改善了可过滤性,并且预计会降低潜在的非特异性吸附。在制剂中包含nacl,优选约70mm的nacl,改善了外观。
[0057]
先前使用的rc7制剂(pbs)仅实现了0.4mg/ml以上的溶解度,并在高于该浓度时具有显著的粘度挑战。在某些情况下,pbs制剂可能被推到0.8mg/ml以上,但只能在非常具体的实验室条件下进行,这些条件不能够放大或者与常规蛋白质纯化过程(如uf/df)不相容。ph为约7.2的包含1mg/ml rc7、10mm的磷酸盐、5mm的柠檬酸盐、100mm的l-精氨酸、1.7%(w/v)的蔗糖、70mm nacl、0.05%(v/v)聚山梨酸酯-20的制剂(“i期制剂”)使用具有100kda pes截留分子量的常规离心柱(spin column)能够实现高约10倍的蛋白质浓度(约4mg/ml以上)。
[0058]
与pbs制剂相比,还可以看到粘度的改善。pbs制剂不能支持高于0.8mg/ml的蛋白质浓度。因此,与较高浓度的蛋白质制剂进行头对头比较(head-to-head comparison)是不可能的。然而,3mg/ml rc7蛋白质制剂的粘度读数均为约4厘泊(cp),这不被认为是高度粘稠的。这些数据表明,一般来说,粘度的增加与rc7蛋白质浓度的增加相关。如果将粘度与蛋白质浓度(cp/蛋白质浓度)进行比较,则明显的是包含精氨酸的制剂具有比pbs制剂中的值更低的值。因此,精氨酸制剂支持较高的蛋白质含量,同时更好地控制粘度的增加。
[0059]
在tyndall光的强度下,较高蛋白质浓度(高于3-4mg/ml)的i期制剂的蛋白质和蛋白质沉淀物的折射显著更少。这使i期制剂具有更加澄清和浊度更低的外观。
[0060]
使用稳健的小规模冷冻/解冻模型,使i期制剂也经受了冷冻和解冻应激条件。将i期制剂暴露于三个冷冻/解冻循环(参见表2)以反映在生产规模下可能遇到的冷冻/解冻应激(可放大性)。
[0061]
表2:在petg瓶中100ml的冷冻/解冻(f/t)应激循环
[0062]
步骤倾斜目标温度时间1保持5℃30min
2倾斜-5℃0.2℃/min3保持-5℃6小时4倾斜-20℃0.2℃/min5保持-20℃6小时6倾斜-25℃0.2℃/min7保持25℃3小时8倾斜5℃30min
[0063]
3个循环完成后,蛋白质含量(通过在a280nm处的吸光度所测量的;参见表3)或连接状态(通过sec-hplc所测量的;参见图4)没有变化。
[0064]
表3:冷冻/解冻应激后的变化
[0065][0066]
使含精氨酸的制剂在-65℃、-20℃、5
±
3℃和25℃的温度下储存2个月。在任何储存条件下2个月后外观均没有变化。除了在5
±
3℃(最低)或25℃储存的制剂以外,相同的材料显示蛋白质浓度(a280nm)或sec-hplc谱图(参见表4)没有显著变化。在25℃储存2个月后,观察到高分子量(hmw)物质的增加(~2%)。
[0067]
表4:在不同温度下储存两个月后的变化
[0068][0069]
还评估了1mg/ml剂量的i期制剂与动物递送装置和给药注射器的相容性。用合适的注射器将1mg/ml药品注入输液器中,并且使药物在每个装置中保持长达60分钟。装置中60分钟后没有可见的颗粒或ph偏移。sec-hplc谱图也没有显示出明显的变化。
[0070]
很难知道将rc7静脉内注射入血流后会发生什么。然而,通过监测该蛋白质暴露于更加生理相关的条件如含有10%牛血清的缓冲液并保持在37℃下时的任何变化,可以评估产品质量变化的可能性。rc7蛋白质倾向于可溶性聚集和沉淀。这些事件可以通过常用的分析技术进行监测。a280吸光度用于监测蛋白质含量的变化。a320吸光度用于监测由于不溶性颗粒形成导致的浊度变化。sec-hplc用于监测其中hmw和/或lmw物质可以形成的可溶性
蛋白质的变化。为了使血清效应的影响最大化,用等份的血清稀释缓冲液,并在最终蛋白质浓度为0.5mg/ml的rc7存在下(在i期制剂中)孵育。为了模拟体温,将所有样品在37℃保持1小时。这些结果的总结列于表5中。结果表明,在37℃暴露于生理介质1小时后,蛋白质含量(a280)或浊度(a320)没有变化。因此,数据表明rc7递送到血清中稀释后没有明显的立即溶解度限制。
[0071]
表5:在37℃暴露1小时后a280和a320吸光度
[0072][0073]
为了观察钙和镁是否对产品质量的变化有影响,获得在缓冲液中不包含ca
2+
和mg
2+
阳离子的起始dulbecco磷酸盐缓冲盐水(d-pbs)。测试该溶液,并与其中加入生理水平的ca
2+
和mg
2+
的d-pbs进行比较。发现这些对结果没有影响(表5)。
[0074]
sec-hplc谱图证实,在37℃下暴露于多种测试缓冲液基质1小时后,不溶性聚集体没有增加。图5。暴露于多种缓冲液引发峰的较低分子量区域的初始变化,这可能是由于α-螺旋的灵活性增加。
[0075]
对含有不同量的l-精氨酸(25mm至100mm)的rc7制剂进行热稳定性研究。结果显示,降低l-精氨酸水平导致在5
±
3℃和25
±
3℃下储存长达1个月后高分子量物质的轻微增加和效力的下降(通过纤连蛋白结合测定所测量的)。图6和7。另外,在25mm和50mm精氨酸的样品中看到更多的乳光。在这些研究中其他赋形剂水平保持相同。
[0076]
实施例2
[0077]
基于最初的开发研究,将含有10mm的磷酸钠、5mm的柠檬酸钠、70mm的氯化钠、100mm的精氨酸、50mm的蔗糖、0.05%的聚山梨酸酯20且ph为约7.1的制剂用于施用于deb小鼠模型中的col7a1-/-小鼠。
[0078]
在cho细胞中产生重组人胶原蛋白7(rc7)。使用两种不同的制造方法从cho细胞纯化rc7。将由每个制造方法产生的rc7批次配制在包含10mm的磷酸钠、5mm的柠檬酸钠、70mm的氯化钠、100mm的精氨酸、50mm的蔗糖、0.05%的聚山梨酸酯20且ph为约7.1的组合物中。
[0079]
在3个治疗组共59只新生col7a1-/-小鼠中进行该研究,以评估在出生后2-3天单次静脉内施用rc7后的分布和组织学改善。在这项研究中还另外检查了总存活率。以0.4mg/ml(16μg,40μl)的剂量将每种组合物(测试制品1和测试制品2)静脉内施用至26只新生col7a1-/-小鼠。在出生后第2-3天通过颞浅静脉以单次iv推注施用组合物。还将包含10mm的磷酸钠、5mm的柠檬酸钠、70mm的氯化钠、100mm的精氨酸、50mm的蔗糖、0.05%的聚山梨酸酯20和ph为约7.1但不含rc7的对照组合物静脉内施用于新生col7a1-/-小鼠。
[0080]
施用测试制品1和测试制品2使得rc7分布到新生col7a1-/-小鼠的舌和前腿皮肤中的真皮-表皮bmz。图1。相比之下,在用溶媒对照注射的任何小鼠中未检测到c7。图1。
[0081]
如通过舌组织切片的代表性苏木精和曙红(h&e)图像所证明的,与溶媒对照相比,静脉内施用测试组合物校正了col7a1-/-小鼠中真皮-表皮分离。图2。由于缺少毛发,舌是检查真皮-表皮分离的最佳组织,其可用于将表皮锚定到真皮并防止形成新引起的水疱。
[0082]
对于施用测试制品1、测试制品2和溶媒对照的col7a1-/-小鼠,在舌的表皮和真皮之间完全闭合(即无分离)的小鼠比例分别为50%(26只中的12只)、63%(26只中的15只)和10%(10只中的1只)。rc7治疗的小鼠中真皮-表皮分离完全闭合的col7a1-/-小鼠的比例高于溶媒对照(测试制品1相比于溶媒fisher p=0.06,测试物品2相比于溶媒fisher p=0.02)。在经rc7治疗的小鼠之间,真皮-表皮分离闭合的col7a1-/-小鼠的比例没有差异(fisher p=0.58)。
[0083]
如下表7和图3所示,与溶媒对照相比,向新生col7a1-/-小鼠单次静脉内施用测试制品1或2导致存活率的统计学显著的提高。对于施用溶媒对照、测试制品1和测试制品2的col7a1-/-小鼠,中位数(四分位距)存活时间分别为2.5、9和14天。
[0084]
表6
[0085]
比较治疗组的风险比
[0086][0087]
在表6中,在cox比例风险模型中评估风险比。按照schoenfeld残差(p》0.37)所评估的,满足比例风险假定。
[0088]
该研究证实了在deb的新生小鼠模型中测试的rc7组合物的功效。具体而言,在
dystrophicepidermolysis bullosa.j cell sci.1999 nov;l12(21):3641-8.
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1