靶向调控线粒体呼吸链的微纳水凝胶微球及其制备与应用
1.本发明属于生物医学工程材料技术领域,涉及一种水凝胶微球,具体涉及一 种靶向调控线粒体呼吸链的微纳水凝胶微球及其制备与应用。
背景技术:
2.线粒体是真核细胞中的重要细胞器,通过细胞凋亡、自噬等多个途径调节能 量代谢和细胞周期,是真核细胞的“能源工厂”。线粒体呼吸链(mrc)是电 子传递(etc)与三磷酸腺苷(atp)合成相互偶联的过程,该过程在线粒体内 膜(imm)上进行。当细胞在衰老、炎症等多因素的影响下,线粒体呼吸链的 电子传递发生电子漏,泄漏的电子直接与氧分子形成氧自由基,导致氧化应激增 加;另一方面,受损的线粒体呼吸链还会出现质子漏,使线粒体呼吸链断裂、 atp生成减少,进一步促进中枢神经系统、心脏、肾脏和骨骼肌肉系统发生退行 性变化。由于mrc在调控细胞的能量代谢和氧化应激中起关键作用,因此,改 善mrc的电子传递效率,恢复呼吸链复合体活性,对于有效治疗多种与mrc 功能失常相关的退行性疾病是非常有前景的。然而,由于线粒体所处于亚细胞室 和细胞内环境的复杂性,如何精准地将治疗药物运输到线粒体中仍需要克服多种 生理屏障。
3.目前,基于以亚细胞结构为靶向的生物材料平台有可能成为治疗与线粒体功 能障碍相关疾病的强大工具。以三苯基膦(tpp)作为线粒体靶向装置,修饰于 药物分子或纳米粒子表面,是报道最多的策略。然而,该方法存在靶向效率较低、 破坏线粒体电子传递链、细胞毒性作用等不足之处。另有报道基于精氨酸修饰的 脂肽(dlp)或者r8(八聚精氨酸)修饰的mito-porter脂质体,这些线粒体 靶向纳米颗粒模仿了天然线粒体前体蛋白(mpp)中的特定氨基酸结构域,提高 了线粒体的靶向递送能力。但是,这些与mpp相似的多肽与线粒体结合时,影 响了线粒体正常膜电位,具有一定的毒性作用。因此,上述这些纳米材料大部分 具有破坏线粒体结构和细胞毒性作用而主要应用于肿瘤的治疗,即该类生物材料 的应用目的在于“破坏”而非“修复”。
4.然而,在以骨关节炎(oa)为代表的与mrc功能紊乱相关的退行性疾病 中,上述这些靶向破坏线粒体的生物材料并不适合oa这类需要修复mrc的退 行性疾病。oa是一种慢性进行性软骨退行性疾病,发病率和致残率高,在炎症 因子、异常机械应力等的影响下,软骨细胞的mrc功能会受损,线粒体膜通透 性增加,细胞色素c和凋亡诱导因子等从线粒体释放到细胞质,诱导软骨细胞 凋亡和细胞外基质降解等。因此,mrc功能紊乱是oa发生、进展的重要机制, 当前迫切需要一种更安全、稳定的靶向线粒体的生物材料,治疗这些与mrc功 能紊乱相关的退行性疾病。
5.为了改善靶向线粒体的纳米颗粒的安全性,一种新型线粒体靶向肽(mts) ——elamipretide(ss-31)近年来得到了较多的关注。ss-31是一种能被细胞摄 取的四肽,可特异性的与线粒体内膜结合,并改善内膜嵴弯曲,使细胞的线粒体 电子传递链恢复活力,减少ros产生。因此,使用ss-31取代r8修饰脂质体, 可以解决细胞毒性问题,同时保留了对线粒体内膜的靶向性。此外,白藜芦醇是 一种sirt蛋白激动剂,sirtuin 3(sirt3)作为一种
线粒体烟酰胺腺嘌呤二核苷 酸(nad)依赖的蛋白去乙酰化酶,是线粒体氧化还原稳态的主要调节因子, 可以调节mrc以维持正常的氧化机制,所以靶向线粒体递送白藜芦醇,能更有 效地增强它保护mrc的功能。然而,在oa患者的关节腔内,由于软骨的炎症 细胞会分泌多种炎症因子和金属蛋白酶(mmps),使滑膜组织处于炎症肿胀状 态,当多肽和药物在关节腔内直接暴露时容易被炎症滑膜的血管清除代谢,通常 需要多次使用才能达到治疗效果。
6.因此,如何解决靶向调控线粒体呼吸链的脂质体在关节腔的复杂递送问题, 以期为治疗多种与mrc功能紊乱相关的退行性疾病提供依据,提升治疗指数, 成为现阶段亟待解决的技术问题。
技术实现要素:
7.本发明的目的就是为了解决上述技术问题,从而提供一种靶向调控线粒体 呼吸链的微纳水凝胶微球及其制备与应用。本发明提供的微纳水凝胶微球系统具 有高效的细胞摄取效率和线粒体靶向性,该系统能显著提高mrc功能,减少质 子泄漏,保护线粒体,下调ros的表达,促进软骨细胞外基质的生成。同时体 内实验证明该系统在大鼠骨关节炎模型中可以有效的减缓骨性关节炎的进展。
8.本发明的目的之一是提供一种靶向调控线粒体呼吸链的微纳水凝胶微球的 制备方法,其包括以下步骤:
9.(1)将ss-31肽与二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000-琥珀酰亚胺酯 发生酯化反应,得到功能化合物一;
10.(2)将wyrgrl肽的羧基经edc/nhs活化后与二硬脂酰基磷脂酰乙醇胺-n
‑ꢀ
氨基-聚乙二醇5000发生反应,得到功能化合物二;
11.(3)将功能化合物一和功能化合物二与蛋黄卵磷脂、胆固醇和白藜芦醇混 合,有机溶剂溶解,通过薄膜水化法制备得到纳米脂质体;
12.(4)采用透明质酸与甲基丙烯酸酐合成甲基丙烯酸化透明质酸水凝胶,然 后将步骤(3)所得纳米脂质体与水凝胶溶液混合,通过微流控装置制备水凝胶 微球,然后经紫外光交联,得到所述微纳水凝胶微球。
13.本发明制备了以ss-31与特异性ii型胶原靶向肽(wyrgrl)修饰的负载白藜 芦醇的长循环脂质体,并将该脂质体通过非共价键连接在水凝胶微球的纳米网络 内,wyrgrl与ss-31的修饰使脂质体具有靶向关节软骨细胞线粒体的能力,且 ss-31能稳定线粒体内膜心磷脂(cl)结构,与sirt3激活剂白藜芦醇(rev) 发挥协同作用,改善细胞mrc电子传递效率,从而构建了一种具有靶向调控线 粒体呼吸链功能的微纳水凝胶微球体系。该体系在与软骨细胞共培养时,活死染 色验证了该体系具有良好的生物相容性,流式细胞技术与免疫荧光标记实验则证 明了ss-31修饰的脂质体具有优良的细胞摄取率和线粒体靶向性;细胞能量代谢 和分子生物学实验进一步验证了该体系能有效减少氧化应激状态下的软骨细胞 线粒体呼吸链质子漏,恢复atp生成,且脂质体内释放的白藜芦醇(rev)可 通过激活sirt3蛋白,与ss-31发挥协同作用以恢复线粒体呼吸链的正常功能。 此外,在动物实验中观察到该体系最能有效恢复软骨表面损伤,骨关节炎oarsi 评分较pbs组下降72%。总体而言,本发明制备的靶向细胞线粒体的微纳水凝 胶微球能有效调控线粒体呼吸链的电子传递效率,有望效治疗以骨性关节炎为代 表的与线粒体呼吸链功能紊乱相关的退行性疾病。
14.进一步的是,步骤(1)中所述ss-31肽与二硬脂酰基磷脂酰乙醇胺-聚乙二 醇2000-琥珀酰亚胺酯的摩尔比为2:1。
15.进一步的是,步骤(2)中所述wyrgrl肽与二硬脂酰基磷脂酰乙醇胺-n-氨 基-聚乙二醇5000的摩尔比为2:1。
16.进一步的是,步骤(3)中所述功能化合物一、功能化合物二、蛋黄卵磷脂、 胆固醇和白藜芦醇的摩尔比为5:1:1.5:1.2:1。
17.进一步的是,步骤(3)中所述薄膜水化法的具体步骤为:采用三氯甲烷与 甲醇按体积比9:1组成的有机溶剂溶解原料,去除有机溶剂后,得到一层透明 脂膜,在ph=7.4的磷酸盐缓冲盐水溶液中37℃水合生成磷脂,用探针式超声探 头超声10分钟,得到所述纳米脂质体。
18.进一步的是,步骤(4)中所述透明质酸与甲基丙烯酸酐的质量比为1:2.08。
19.进一步的是,步骤(4)中通过微流控装置制备水凝胶微球时,是以纳米脂 质体和水凝胶溶液作为水相,以石蜡油中含5wt%span 80作为油相。
20.进一步的是,步骤(4)中所述纳米脂质体与水凝胶溶液的质量比为1:2。
21.本发明的目的之二是提供一种由上述方法制备得到的靶向调控线粒体呼吸 链的微纳水凝胶微球。
22.本发明的目的之三是提供上述靶向调控线粒体呼吸链的微纳水凝胶微球在 制备与线粒体呼吸链功能紊乱相关的退行性疾病的药物方面的应用。
23.本发明的有益效果如下:
24.本发明提供了一种能够靶向调控细胞线粒体呼吸链功能的微纳水凝胶微球 系统,该系统具有高效的细胞摄取效率和线粒体靶向性,同时该系统能显著提高 线粒体呼吸链功能,减少质子泄漏,保护线粒体,下调ros的表达,促进软骨 细胞外基质的生成。另外,该系统在大鼠骨关节炎模型中可以有效的减缓骨性关 节炎的进展。该体系作为一种新型靶向调控线粒体呼吸链功能的生物材料,未来 在治疗多种与线粒体呼吸链功能紊乱相关的退行性疾病时拥有巨大潜力。
附图说明
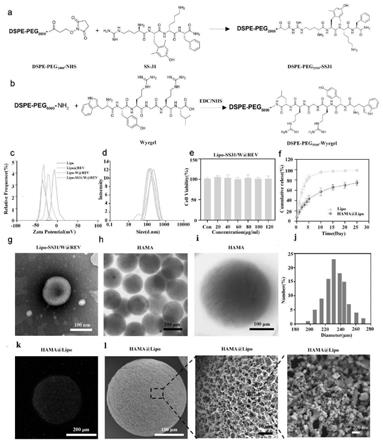
25.图1为微纳水凝胶微球的制备及表征结果;a-b:dspe-peg
2000-ss31 与dspe-peg
5000-wyrgrl合成分子式;c-d:dls测试不同配方脂质体 的粒径与电位;e:cck-8测试lipo-ss31/w@rev的生物相容性;f: lipo与hama@lipo的累计药物释放率;g:tem观察脂质体;h-j: 光镜下观察hama水凝胶微球与微球粒径分散曲线;k:cslm观察
26.图2为dspe-peg
2000-ss31的1hnmr。
27.图3为dspe-peg
5000-wyrgrl的1hnmr。
28.图4为微纳水凝胶微球的制备流程与微流控装置示意图。
29.图5为微纳水凝胶微球的sem能谱(mapping)扫描。
30.图6为微纳水凝胶微球合成与调控线粒体呼吸链示意图;细胞内正常线粒体在 ros作用下会受损,受损的线粒体将产生更多的ros影响其他正常线粒体,受 损的线粒体经过hama@lipo-ss31/w@rev干预后,减少电子泄露、提高atp 生成,能恢复到正常线粒体状态,以促进软骨修复。
31.图7为水凝胶微球在透明质酸酶中降解。
32.图8为微纳水凝胶微球的线粒体靶向性与体外细胞相容性;a:在1、2和3天内, 对照、hama、hama@lipo组的活(绿色)/死亡(红色)荧光结果,比例标 尺100μm;b、活/死分析总结的活细胞计数;cck-8检测不同分组对软骨细胞 的细胞毒性;c:dil标记不同配方脂质体对线粒体靶向性,记录dil(红色)和 mitochondrial线粒体染色(绿色),比例尺表示50μm;d:通过流式细胞仪分 析cy5.5标记不同配方脂质体孵育后的细胞摄取。
33.图9为dil染色lipo-ss31/w@rev(红色)靶向mitochondrial(绿色)标记线 粒体,标尺50μm。
34.图10为微纳水凝胶微球对细胞线粒体呼吸链的影响;a:微纳水凝胶微球对线粒 体呼吸链影响示意图(红色etc代表线粒体呼吸链损伤;绿色etc代表经ss-31 和白藜芦醇修复后的线粒体呼吸链);b:不同分组处理c28/i2细胞后的ocr; c:根据ocr分析显示了一些参数,包括基础呼吸、atp的产生和质子泄露;d: jc-1分析的荧光图像h2o2干预细胞后线粒体膜去极化;e:不同分组处理细胞后 sirt3蛋白表达情况(#代表与control组对比)。
35.图11为a:dcfh-da对h2o2(10mu)干预c28/i2细胞不同配方微球处理后 细胞内ros的荧光图像分析,标尺50μm;b:(a)的dcf平均荧光强度;c: h2o2干预细胞不同处理后,细胞内线粒体的生物透射电镜图像,红箭头示线粒 体肿胀,嵴结构破坏,黄箭头显示线粒体稍肿胀,标尺100nm(#代表与control 组对比)。
36.图12为微纳水凝胶微球在体外保护软骨细胞;a:h2o2(10mu)干预后,不同 分组治疗12h后oa相关基因(il-6、mmp13、adamts5、aggrecan和col2α1) 的表达;b:col2α1蛋白表达的定量分析比较(#代表与control组对比);c: 用10mu h2o2处理并与hama、lipo、hama@lipo共培养24h的ii型胶原 免疫荧光图像,标尺100μm。
37.图13为微纳水凝胶微球治疗后的影像学评估;a:动物体内实验流程展示;b: 具有代表性的膝关节侧位x-ray(x线)图像;c:具有代表性的膝关节micro-ct 三维重建图像;d:从x-ray(lat)测量的膝关节内侧隔间相对宽度和实验组 骨赘的相对体积(*代表与sham组对比;#代表与hama@lipo组对比)。
38.图14为微纳水凝胶微球促进了大鼠骨关节炎模型中的软骨修复;a:h&e染色 的代表性图像;b:各个组的番红固绿染色;c:展示的是各组关节软骨中ii型胶 原表达的免疫组织化学图像;d:各组关节软骨的整体oarsi评分;e:各组ii 型胶原蛋白阳性细胞的定量;f:各组关节软骨侵蚀的深度(*代表与sham组对 比;#代表与hama@lipo组对比)。
具体实施方式
39.为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例对本 发明进行具体描述,有必要指出的是,以下实施例仅仅用于对本发明进行解释和 说明,并不用于限定本发明。本领域技术人员根据上述发明内容所做出的一些非 本质的改进和调整,仍属于本发明的保护范围。
40.一、实施方法例
41.1材料与方法
42.1.1主要试剂:
43.ss-31肽由selleck中国公司(上海蓝木化工有限公司)提供;wyrgrl肽由 中国楚
肽提供;dspe-peg
5000-nh2(二硬脂酰基磷脂酰乙醇胺-n-氨基-聚乙二醇 5000)、dspe-peg
2000-nhs(二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000-琥珀酰 亚胺酯)、rev(白藜芦醇)由上海艾伟拓提供;胆固醇、蛋黄卵磷脂由上海生 工提供;透明质酸(ha)由中国bloomage freda提供;甲基丙烯酸酐(中国阿 拉丁);xf线粒体压力测试实验技术服务由中国上海亚载生物提供;c28/i2细 胞(htx2308)购自中国otwo biotch;培养试剂包括胎牛血清(fbs)、dmem (高糖)、抗生素和胰蛋白酶-edta,均购自gibico公司。
44.1.2长循环脂质体的制备:
45.利用ss-31的-nh2与dspe-peg
2000-nhs发生酯化反应,将ss-31溶于二甲 基甲酰胺(dmf)中,加入dspe-peg
2000-nhs,摩尔比为2:1,混合物在室温 下黑暗中轻轻搅拌12小时,合成dspe-peg
2000-ss31(功能化合物一)。wyrgrl 的-cooh经edc/nhs(1-乙基-3-(3-二甲基氨丙基)-碳化二亚胺,edc;n-羟基 琥珀酰亚胺,nhs)活化后,使用上述相同的方法与dspe-peg
5000-nh2(摩尔 比为2:1)合成dspe-peg
5000-wyrgrl(功能化合物二)。最后分别将两种化合物 用ddh2o透析48小时,纯化后的透析液冷冻干燥,在-20℃下保存。分别用 1h-nmr对dspe-peg
2000-ss31和dspe-peg
5000-wyrgrl进行分析。
46.采用薄膜水化法制备lipo-ss31/w@rev脂质体,具体方法如下:在梨型烧 瓶中用三氯甲烷:甲醇(9:1,v/v)溶解以下物质(蛋黄卵磷脂:胆固醇: dspe-peg
2000-ss31:dspe-peg
5000-wyrgrl:rev=5:1:1.5:1.2:1,摩尔:摩尔)。 去除有机溶剂后,得到一层透明脂膜,在ph=7.4的磷酸盐缓冲盐水(pbs)溶 液中37℃水合生成磷脂,用探针式超声探头超声后(20%,10分钟),得到 lipo-ss31/w@rev脂质体。
47.1.3微纳水凝胶微球的制备:
48.将5g ha(分子量=74kda,bloomage freda生物制药有限公司,中国)与 10.4g甲基丙烯酸酐(中国阿拉丁)反应制备hama(甲基丙烯酸化透明质酸) 水凝胶,透析4天后冻干,在-80℃下保存,然后采用微流控技术制备微纳水凝 胶微球(图9)。水相:纳米脂质体与水凝胶溶液混匀(4wt%hama、2wt%脂 质体和0.4wt%光引发剂);油相:石蜡油与5wt%span 80混合,分别从注射 器注入微流控装置的入口,调整水相与油相的流速比。生成的液滴在-30℃冷 冻后,在紫外光下交联得到hama@lipo-ss31/w@rev,之后去除多余的石蜡 油和其他添加剂。
49.1.4微纳水凝胶微球表征:
50.(i)动态光散射(dls):用动态光散射法测量脂质体的粒径与zeta电位 (英国马尔文的zetasizernano s);(ii)透射电子显微镜(tem):将脂质体溶 液用5wt%的磷钨酸负染,晾干后进行透射电镜(tem)(日本jem-1400plus) 观察脂质体的形态;(iii)用明场显微镜(lsm800,zeiss,德国)测定水凝胶 微球的形态和直径;(iv)扫描电子显微镜(sem)(zeiss,德国):加入10 wt%的海藻糖,冷冻干燥后,对hama@lipo-ss31/w@rev微球形貌进行观察; (v)激光扫描共聚焦显微镜(lscm)(zeiss,axio imager m1,德国):用 5μm的dii(beyotime,中国)对脂质体进行染色,将脂质体与hama微球结 合后用激光扫描共聚焦显微镜观察微球中染料标记的脂质体;(vi)紫外分光光 度计(德国eppendorf):检测rev包封率及释放。
51.1.5微球降解与药物释放:
52.hama@lipo-ss31/w@rev微球的降解测试方法如下:将微球浸泡在含透 明质酸酶
的磷酸盐缓冲液,置于摇床(80rpm,37℃)中,每隔48小时将上清 液换成新鲜透明质酸酶溶液,在指定的时间点,测量微球的残留量,并与初始重 量进行比较,计算微球的降解百分率,并且通过显微镜观察微球的形态变化。
53.在初步制备lipo-ss31/w@rev后,通过使用20μm孔径的过滤器过滤掉未 溶的rev(难溶于水),然后取200μl稀释10倍的脂质体溶液(甲醇稀释), 在紫外分光光度计下测量od值,通过rev标准曲线计算包封率。包封率计算 公式为:
54.ee=w/w0×
100%(w0为初始加入脂质体的rev重量,w为脂质体中rev 的重量)。
55.为了考察rev从脂质体或hama@lipo微凝胶中的释放动力学,将lipo 和hama@lipo中的rev浓度调整为200μm,分别包裹在一个透析膜袋(截 留分子量为1000da)中,然后将其浸入含有5mlpbs(ph=7.4)的试管中,在 旋转孵化器(37℃,80rpm)中摇晃试管,于不同时间点取试管内溶液1ml, 补充同等体积的磷酸盐缓冲液(pbs),用紫外分光光度计法测定28天内的rev 累积释放浓度。
56.1.6线粒体靶向性
57.将c28/i2细胞接种于含10%胎牛血清的dmem培养皿中,温度37℃, co2浓度5%。4h后洗涤细胞,去除未贴壁细胞,更新培养液。24h后,将细 胞与cy5.5标记的纳米脂质体(lipo@rev,lipo-w@rev和 lipo-ss31/w@rev)共同孵育4h,收集活细胞,再悬浮于pbs中,流式细胞 仪分析细胞摄取情况(bd facsverse,美国)。为了进行线粒体共定位分析, 用cy5.5标记的不同分组(lipo@rev、lipo-w@rev、lipo-ss31/w@rev) 处理细胞,4h后用0.5μm mitotracker green(中国碧云天)染色,然后洗涤和 预温的磷酸盐缓冲液中保存,最后,用荧光显微镜(lsm800,zeiss,德国) 观察。
58.1.7细胞生物相容性:
59.采用活/死染色法评价hama、hama@lipo-ss31/w@rev对c28/i2细胞 增殖的影响。将c28/i2细胞(1.0
×
104ml-1
)在24孔板(美国康宁0.4μm孔) 的下室中培养,而hama、hama@lipo-ss31/w@rev在上室中培养。第1、 第3和第5天,细胞与250μl calceinam/pi检测工作溶液(碧云天,中国)孵 育30min,随后在荧光显微镜下观察。另外使用细胞计数试剂盒kit-8(cck-8, beyotime,中国)检测hama、hama@lipo-ss31/w@rev培养后的细胞增殖 情况。简单地说,c28/i2细胞(0.8
×
104ml-1
)在96孔板(0.4μm孔)培养, hama、hama@lipo-ss31/w@rev在上腔。第1、3、5天,下腔室充满10μlcck-8溶液。在37℃孵育1小时后,通过flexstaston3酶标仪(分子器件,日 本)在450nm处测量吸光度值。
60.1.8代谢分析
61.将c28/i2细胞(1
×
105个/孔)接种于xf-24细胞培养板(agilenttechnologies),过夜贴壁,加入h2o2诱导细胞氧化应激模型,同时加入不同分 组水凝胶微球,处理12h后使用xf-24型通量分析仪(agilent technologies)测 定细胞的氧气消耗率。首先用oligomycin处理软骨细胞,测量各组的三磷酸腺 苷(atp)产量,然后在上清液中加入fccp,同时检测线粒体耗氧量的增加作 为线粒体的最大耗氧量,最后加入抑制呼吸链、完全抑制线粒体耗氧量的 antimycina和rotenone。(其中oligomycin药物浓度为2.0μm、fccp的浓度 为1μm、antimycina和rotenone的药物浓度为0.5μm)。
62.1.9细胞内ros、线粒体膜电位测定与线粒体形态观察:
63.将c28/i2细胞接种于6孔板中培养后,h2o2诱导细胞建立氧化应激模型, 分别与不
同分组(pbs、hama、hama@lipo-w@rev、hama@lipo-ss31/w、 hama@lipo-ss31/w@rev)共培养12h。用荧光染料dcfh-da(10μm)(碧 云天)处理所有细胞20min。细胞洗涤3次后,然后使用显微镜(lsm800,zeiss, 德国)观察;另外相同方法处理12h后,使用jc-1膜电位检测试剂盒(碧云天, 中国)染色30min后,在显微镜(lsm800,zeiss,德国)下观察。
64.按上述方法培养细胞12h后,用细胞刮刀刮下细胞,3000rpm离心5min, 弃上清,缓慢加入4℃预冷戊二醛固定液,脱水处理后的样品在leica em uc7 型超薄切片机中切片,获得70-90nm的切片,切片经柠檬酸铅溶液和醋酸双氧 铀50%乙醇饱和溶液各染色5-10min,晾干后即在透射电镜(日立h-7650)中 观察。
65.1.10oa模型相关基因与蛋白检测:
66.为了评估该微纳水凝胶体系调控线粒体呼吸链后对oa的影响,首先使用 h2o2(10mu)干预c28/i2细胞,使用pbs、hama、lipo-ss31/w@rev、 hama@lipo-ss31/w@rev分别处理细胞12h后,从c28/i2细胞中提取总 rna,用revertaid first strand cdna synthesis kit(美国赛默飞)和faststartuniversal sybr green master(rox)(德国罗氏)逆转录,然后进行定量实时聚合 酶链反应(qrtpcr);il-6、adatms-5、mmp-13、col2、aggrecan引物序 列如下表所示,使用2-δδct
法计算结果,所有实验都重复了三次。
67.表1引物序列
[0068][0069]
同样方法处理细胞24h后,使用免疫荧光染色测定细胞col2表达。先用pbs 洗涤细胞二次,然后用4%多聚甲醛固定细胞10min。0.1%tritonx-100处理细 胞15min,随后用兔抗col 2(中国servicebio)多克隆抗体与固定的细胞4℃孵 育过夜。第二天使用cy3标记的山羊抗兔igg(中国servicebio)再次室温孵育 1小时。细胞骨架和细胞核使用分别被fitc标记的鬼笔环肽(中国servicebio) 和dapi(中国servicebio)染色,然后使用lscm(德国zeiss)获得荧光图像, 使用image j软件进行定量。
[0070]
1.11大鼠骨关节炎模型:
[0071]
动物实验获得川北医学院附属医院研究伦理委员会批准(2021-26)。选取 30只12周龄雄性sprague dawley(sd)大鼠(6-8周,体重约180g-240g)(中 国维通利华)进行动物实验。
[0072]
骨关节炎大鼠模型的建立:将大鼠麻醉备皮后,打开关节腔横断前交叉韧带 (acl),切断内侧半月板(aclt+mmx),然后逐层缝合。假手术组(n=6) 仅接受麻醉和皮肤手术,不损伤韧带和半月板。将骨关节炎大鼠(n=24)分为四 组,于术后第二周、第五周向膝关节内分别注射等量100ul pbs(n=6)、hama (n=6)、hama@lipo-w@rev(n=6)、hama@lipo-ss31/w@rev(n=6)。 1.12x线与ct成像:
[0073]
所有大鼠于术后第9周,采用美国faxitron x-ray系统进行x线摄片(32kv 电压,曝光时间为10s)。用右膝关节侧位x线片分析关节间隙宽度。此外,处 死大鼠收集膝关节样本,使用高分辨率微ct成像系统(skyscan1172, brukerbiospin,比利时)对样本进行关节造影。根据微ct扫描和重建的结果, 评估关节间隙宽度和相对骨赘体积。
[0074]
1.13组织学和免疫组织化学分析:
[0075]
术后第9周处死小鼠后,获取的膝关节样本用4%多聚甲醛固定,随后脱钙、 包埋切片。矢状面通过h&e染色、甲苯胺蓝染色和safranino-fast绿色染色评估 组织病理学特征,然后采用oarsi标准进行相应的评分。此外,在免疫组织化 学中,石蜡切片用兔抗集聚蛋白多克隆抗体(servicebio,中国)染色。然后对 二抗和dab底物进行复染。使用image j软件测定col2的相对表达含量。
[0076]
1.14统计分析
[0077]
统计学分析:所有数据均以均数
±
标准差表示。采用spss软件(第24版), 对结果进行单因素方差分析。p《0.05表明差异有统计学意义。
[0078]
二、实验结果例
[0079]
2.1靶向调控细胞线粒体呼吸链的微纳水凝胶微球的构建
[0080]
为了提高脂质体对软骨细胞和线粒体的靶向性,本发明采用了两种合成的 功能化合物dspe-peg
2000-ss31和dspe-peg
5000-wyrgrl对纳米脂质体进行修饰。 功能化合物一(dspe-peg
2000-ss31)是将ss-31的-nh2与dspe-peg
2000-nhs 中的活性酯基团反应合成的;功能化合物二(dspe-peg
5000-wyrgrl)是将wyrgrl 的-cooh经过edc/nhs活化后与dspe-peg
5000
的-nh2合成的(图1中a和b)。 dspe-peg
2000-ss31和dspe-peg
5000-wyrgrl的h1-nmr(图2和图3)的谱带证 明合成成功。
[0081]
通过薄膜水化法制备了lipo-ss31/w@rev纳米脂质体,使用紫外分光光 度计测得rev包封率约为85.14
±
4.36%,并在tem下观察了脂质体 (lipo-ss31/w@rev)形貌(图1中g),脂质体粒径约为120nm,并为多层 壳结构。
[0082]
dls分析lipo、lipo@rev、lipo-w@rev、lipo-ss31/w@rev的粒径 (图1中c和d):lipo与lipo@rev组粒径约为100nm,在脂质体上连接 dspe-peg
5000-w后粒径约为130nm,pdi约为0.23,这一分析与之前tem图 像一致。lipo组的电荷显示负电荷,在连接dspe-peg
2000-ss31后电荷变为中性, 由于线粒体也是负电荷,因此中性的纳米粒子不会因为强烈的静电斥力而阻止纳 米脂质体靶向线粒体,且不会对细胞膜造成损害。cck-8实验进一步验证了纳 米脂质体(lipo-ss31/w@rev)对细胞增殖的影响(图1中e),在共培养24h 后,各组间结果没有统计学差异,表明了纳米脂质体具有良好的细胞相容性。
[0083]
图4是通过微流控技术制备hama微球,图1中h-i显示微球 粒径约为248微米,分散度如图1中j所示。将dil染色的脂质体 (lipo-ss31/w@rev)与hama水凝胶前体溶液混匀,通过微流控 技术制备了hama@lipo-ss31/w@rev的微纳水凝胶微球,并在激 光共聚焦显微镜下观察到dil染色的脂质体(红色)在hama微球 内大量负载(图1中k);然后将hama@lipo-ss31/w@rev在10 wt%的海藻糖保护下冻干后在sem下观察其形貌,放大后可见直径 约为200nm的网络结构,并且可见结合在网络上的纳米脂质体(图 1中l);另外,通过扫描电镜能谱分析(mapping)方法分析了 hama@lipo-ss31/w@rev微球的表面元素组成,可见少量磷元素 分布,表明lipo-ss31/w@rev脂质体成功结合在hama微球上(图 5)。
[0084]
在药物释放实验中,可以观察到lipo-ss31/w@rev组约在5天内药物累 计释放率达到80%以上;而在hama@lipo-ss31/w@rev体系中,药物在25 天累计释放率为70%左右。这是因为脂质体在微球纳米网络被非共价键连接(如 图6所示),从而实现了脂质体内药物的缓释。另外,将 hama@lipo-ss31/w@rev水凝胶微球置于透明质酸酶溶液后,在不同时间点 可发现微球从外层到内层开始逐渐溶胀,最终在65天左右被降解(图7)。
[0085]
2.2微纳水凝胶微球的线粒体靶向性与生物相容性
[0086]
本发明通过活/死实验和cck-8实验评价了hama、 hama@lipo-ss31/w@rev对c28/i2细胞的生物安全性。在5天的培养过程中, 各组之间的活/死细胞数量没有统计学差异(图8中a和b)。cck-8实验检测 结果显示(图8中b),在不同时间点,各组间c28/i2细胞的增殖活性和细胞存 活率无统计学差异。此外,采用流式细胞仪分析了细胞对cy5.5标记的纳米脂质 体(lipo、lipo-w、lipo-ss31/w)摄取效率,与没有ss-31多肽修饰的脂质体 相比,ss-31修饰的脂质体(lipo-ss31/w)被显著内化到细胞内,表明ss-31 可以提高纳米脂质体进入细胞的能力(图8中d)。
[0087]
另外,为了评价脂质体的线粒体靶向性,首先在体外用红色荧光染料(dil) 标记lipo-ss31/w@rev、lipo-w@rev和lipo@rev脂质体,用绿色荧光染 料(mitotracker green fm)标记软骨细胞线粒体,然后在荧光显微镜下观察脂质 体和线粒体的共同定位荧光信号(黄色)。结果显示,ss-31修饰的脂质体能高 效的定位于细胞线粒体,然而没有ss-31修饰的纳米粒子则不能有效靶向细胞线 粒体(图8中a,图9)。以上结果表明,该微纳水凝胶微球具有良好的生物相 容性,且其内负载的脂质体具有高效的线粒体靶向性。
[0088]
2.3微纳水凝胶微球调控关节软骨细胞的线粒体呼吸链功能
[0089]
在oa(骨关节炎)的软骨细胞中,线粒体呼吸链功能发生障碍、atp合成 减少,进而诱导氧化应激、软骨细胞凋亡和细胞外基质的降解。先前有报道称, 通过上调软骨细胞线粒体呼吸链功能,可以防止软骨细胞基质降解和促进软骨修 复。
[0090]
在本发明中,通过ocr技术检测了由h2o2诱导的细胞氧化应激模型被不同 分组干预12小时后的氧气消耗速率(图10中b),结果证明了h2o2可导致细 胞基础呼吸速率降低和质子泄露增加(图10中c),提示软骨细胞线粒体呼吸 链功能下降。然而,通过hama@lipo-w@rev、hama@lipo-ss31/w、hama@lipo-ss31/w@rev处理后,可有效减少h2o2干预的软骨细胞线粒体 质子泄露和恢复atp生成能力;更重要的是,在ss-31与rev的共同作用下, 可表现出更强的协同疗效(图10中c)。
[0091]
此外,本发明使用jc-1荧光染料监测线粒体膜电位的变化,jc-1聚集体(红 色荧光)代表正常线粒体电位,jc-1单体(绿色荧光)代表线粒体去极化。如 图10中d所示,hama@lipo-ss31/w@rev处理组的关节软骨细胞线粒体膜 电位水平更接近于control组,对线粒体膜的保护作用更强。有研究报道,sirtuin 3(sirt3)是作为一种线粒体烟酰胺腺嘌呤二核苷酸(nad)依赖的蛋白去乙 酰化酶,是线粒体氧化还原稳态的主要调节因子,可以调节mrc维持正常的 氧化机制。所以本发明采用免疫荧光检测不同分组处理软骨细胞后sirt3蛋白的 表达情况,与正常软骨细胞相比,观察到使用白藜芦醇的分组明显促进了sirt3 的蛋白表达(图10中e)。
[0092]
如图11中b,通过生物透射电镜进一步观察了软骨细胞线粒体形态的变化, 评价线粒体的损伤程度。h2o2组和h2o2+hama组的软骨细胞线粒体外膜肿胀, 内膜嵴断裂,损伤
严重;与之相比,hama@lipo-w@rev组线粒体损伤稍有 改善,但仍有部分线粒体肿胀,内膜嵴消失;然而,使用ss-31修饰的 hama@lipo-ss31/w组和hama@lipo-ss31/w@rev组显示,细胞线粒体结 构清楚,内膜嵴完整,几乎没有肿胀的线粒体。
[0093]
2.4活性氧(ros)清除评价
[0094]
线粒体既能产生ros,同时又是ros作用的敏感靶点,当部分受损的线粒 体mrc功能障碍时,可产生过量的ros,这又会影响其他正常的线粒体功能, 出现恶性反馈,进而引起软骨细胞凋亡、老化、基质降解等,引起oa(骨关节 炎)的发生、发展。因此,本发明在体外以h2o2干预软骨细胞(c28/i2)以建 立氧化应激损伤细胞模型,进行微纳水凝胶微球抗氧化能力的验证。用ros的 荧光探针2
′
,7
′‑
dichlorodihydrofluorescein diacetate(dcfh-da)特异性检测各组 的ros水平,评价各组间不同的ros清除能力(图11中a)。与h2o2组和 h2o2+hama组相比,经hama@lipo-w@rev、hama@lipo-ss31/w@rev、 hama@lipo-ss31/w@rev处理后,软骨细胞内ros水平均明显降低,但是 hama@lipo-ss-31/w@rev表现出更强的抗ros作用。我们认为可能是使用ss-31修饰脂质体后,让脂质体有了靶向线粒体的能力,增强了rev的输送治 疗效率,与ss-31发挥协同治疗作用,能更加增强该体系的抗氧化应激能力。这 些发现与前人的研究发现是一致的,因此本发明后续的体内、外实验研究中使用 的脂质体是lipo-ss31/w@rev。
[0095]
2.5微纳水凝胶微球在体外对软骨细胞退变的保护作用
[0096]
软骨细胞线粒体呼吸链功能受损、过度的氧化应激,会导致软骨细胞损伤, 其中包括炎症损伤、细胞外基质合成代谢和分解代谢失衡。因此,本发明利用 transwell apparatus和软骨细胞形成共培养体系,以此评价微纳水凝胶微球在改 善线粒体呼吸链功能后对软骨细胞炎症及退变的影响。使用h2o2干预软骨细胞, 模拟ros应激反应,然后采用定量逆转录聚合酶链反应(qrtpcr)和免疫荧 光分析微纳水凝胶微球对h2o2处理后的软骨细胞的炎症反应和细胞外基质的分 解代谢是否具有保护作用。如图12中a所示,与空白组相比,在h2o2干预12 小时后,il-6、adamts、mmp-13的表达显著上调,而aggrecan和col2a1的 表达显著下调。与单独h2o2干预组相比,使用hama微球组的各项mrna的 表达没有统计学差异;然而,随着lipo-ss31/w@rev与 hama@lipo-ss31/w@rev加入后,il-6、mmp-13和adamts mrna的表达 明显下调,而aggrecan和col2a1的表达逐渐上调,且lipo-ss31/w@rev与 hama@lipo-ss31/w@rev之间没有统计学差异。作为软骨细胞外基质的主要 成分,ii型胶原(col2)被认为是成软骨分化的主要指标。将h2o2干预后的软 骨细胞与hama、lipo-ss31/w@rev、hama@lipo-ss31/w@rev共同培养, 免疫荧光染色检测显示对照组的col2α1蛋白的染色强度明显高于h2o2组。这 意味着经h2o2处理后,ii型胶原(col2)的蛋白表达水平显著降低(图12中c)。 在加入lipo-ss31/w@rev、hama@lipo-ss31/w@rev后,与h2o2组相比, ii型胶原(col2)的蛋白表达情况显著恢复,col2表达水平增加了约40%(图 12中b),但是lipo-ss31/w@rev与hama@lipo-ss31/w@rev组间没有统 计学差异。相关研究结果表明该微纳水凝胶微球体系具有对软骨细胞的保护作 用,而lipo-ss31/w@rev与hama@lipo-ss31/w@rev组相比没有显著差异, 可能是由于lipo组的纳米脂质体在体外培养条件下不会像在体内一样被迅速代 谢清除。
[0097]
2.6体内验证微纳水凝胶微球治疗骨关节炎
[0098]
本发明采用切断大鼠前交叉韧带与内侧半月板的方法建立骨关节炎模型,将 大
鼠分为假手术组、pbs组、hama组、lipo-ss31/w@rev组及 hama@lipo-ss31/w@rev组。在术后每3周对不同分组的大鼠分别进行相应 药物的膝关节注射治疗,并于第8周处死动物,分别进行了x线摄片、micro-ct 扫描和重建、组织学和免疫组织化学染色。
[0099]
膝关节炎的特征性影像学表现为:关节间隙变窄、骨赘形成和软骨下骨质硬 化。因此,我们采用x-ray和micro-ct的影像学方法评价大鼠的膝关节间隙宽 度和骨赘形成的变化。如图13中a-c所示,在x-ray左侧位测量中,pbs组、 hama组、lipo-ss31/w@rev组大鼠膝关节内侧间隙与假手术组相比明显变 窄,然而hama@lipo-ss31/w@rev组与假手术组无明显差异。在micro-ct 重建分析中,对大鼠膝关节进行了进一步的检查,micro-ct成像更清楚地显示 了oa的特征。其中关节间隙宽度变化的程度与x-ray结果一致,不仅如此,与 假手术组相比,实验组有均有不同程度的骨赘形成和软骨下骨质硬化(图13中 b)。在定量分析方面,尽管所有实验组的骨赘体积都有所增加,但 hama@lipo-ss31/w@rev组的骨赘体积低于其他组。
[0100]
除影像学检查外,本发明还采用了苏木精-伊红(h&e)染色和番红o-坚固 绿染色检测软骨表面的组织学改变。更重要的是,还用苏木精-伊红(h&e)染 色和番红o-固绿染色观察了不同处理组的软骨表面变化。与假手术组相比,pbs 组与hama组可见关节软骨表面出现软骨侵蚀和软骨基质降解,是典型的骨性 关节炎形态学改变;lipo-ss31/w@rev组关节软骨表面剥蚀和变形减少,损伤 较轻;hama@lipo-ss31/w@rev组最能维持正常关节软骨结构,软骨的退行 性改变都不明显(图14中a-f)。此外,与pbs组相比,lipo-ss31/w@rev组 和hama@lipo-ss31/w@rev组的oarsi评分分别下降约43%和71%, hama@lipo-ss31/w@rev组效果最好(图14中d)。用免疫组织化学方法 检测ii型胶原蛋白的表达水平,与假手术组相比,pbs组、hama组、 lipo-ss31/w@rev组软骨中的col2蛋白表达明显减少,而 hama@lipo-ss31/w@rev组无明显差异(图14中c和e)。
[0101]
结论:线粒体是大多数真核细胞中的亚细胞器,参与了许多细胞代谢过程, 如三磷酸腺苷atp生成、糖酵解、氧化磷酸化(oxphos)等。mrc不仅调控 细胞的能量代谢,也在细胞的氧化应激过程中起关键作用。有研究报道mrc复 合物功能失常时会引起的电子泄漏,泄漏的电子导致过量的氧自由基形成,从而 导致细胞的氧化应激增加。在骨关节炎中,当氧自由基或者ros的过度积聚或 者清除不足时,可损伤软骨细胞线粒体dna,引起软骨细胞凋亡、老化、基质 降解等,进而促进oa的进程。因此本发明合成了一种靶向线粒体的 hama@lipo-ss31/w@rev的微纳水凝胶微球体系,在oa早期改善软骨细胞 的mrc电子传递效率,恢复mrc复合体活性,以此促进oa患者的软骨修复, 逆转oa的进程。
[0102]
目前,许多靶向线粒体的纳米材料已经被设计出来,但是这些纳 米材料主要集中在通过诱导线粒体靶向凋亡来进行抗癌治疗,即该类 生物材料的应用目的在于“破坏”而非“修复”。ss-31是一种抗氧 化的线粒体靶向多肽药物,同时其兼具促进细胞摄取及良好的生物安 全性,因而得到了较多的关注。在本发明中,通过nhs酯化反应将 ss-31连接在dspe-peg
2000-nhs末端(图2),然后修饰于纳米脂质 体表面。在图3中,我们发现经ss-31修饰后的纳米脂质体不仅具有 良好的靶向线粒体的能力,同时具备良好的生物相容性。另外,为了 增强纳米脂质体对软骨细胞的靶向性,将一种特异性胶原蛋白ii靶向 肽(wyrgrl)同样通过nhs酯化反应接在dspe-peg
5000-nh2末端(图3),与dspe-peg
2000-ss31共同修饰了长循环脂质体,目的是让纳米 脂质体能在关节腔中靶向到软骨细胞,并且通过
peg
5000
在脂质体最 外层构建立体位阻层,以保护内层的ss-31多肽在体内不会被快速分 解代谢。脂质纳米颗粒的粒径和zata电位是决定纳米颗粒功能的关 键因素,所有4种配方粒径均小于130nm(图8中a),并且经ss-31 修饰后的脂质体电荷为中性,这种粒径的纳米脂质体能在最外层 wyrgrl肽的作用下进入软骨基质,通过ss-31肽可促进软骨细胞摄取。 此外,为了增强纳米脂质体的稳定性,通过透明质酸(ha)与脂质 体的电荷偶极作用,以非共价键形式将脂质体锚定在水凝胶微球的纳 米网络中(图1)。val
é
rie等人的研究认为rev能提高线粒体复合物 i活性,促进sirt3蛋白的表达,继而改善线粒体功能。因此,在 本发明中,使用脂质体负载了线粒体电子传递激动剂——白藜芦醇, 以求协同增强微纳水凝胶微球体系的治疗效应。 hama/lip-ss31/w@rev分组有效促进了sirt3蛋白的表达,因此 在本体系中,rev可以与ss-31通过协同作用实现多途径改善、调 控mrc功能。另外本发明还观察了rev在纳米脂质体中及 hama/lip-ss31/w@rev中的释放量,由于纳米脂质体稳定性较差, 在37℃的pbs中,第5天累计释放了85%以上;但是在使用水凝胶 微球负载脂质体后,可以实现药物3周以上的释放,以达到缓释治疗 (图1中d)。
[0103]
mrc中的电子传递是在线粒体内膜(imm)上进行的,imm主 要成分包括心磷脂、磷脂酰胆碱和磷脂酰乙醇胺;因此imm的脂质 组成的变化可以极大地影响线粒体呼吸链。有研究表明,线粒体的泄 漏的电子可与氧分子结合生成氧自由基,促进ros表达。本发明中 通过ocr检测观察到h2o2干预c28/i2细胞后,线粒体呼吸被明显 抑制,atp生成减少、质子泄漏增加;引起了线粒体mrc功能紊乱; 经过hama@lipo-ss31/w@rev的处理后可使细胞mrc功能接近 于到正常水平(图11),减少细胞ros的表达(图12中a)。有研究 者认为ss-31能通过与ant1的直接结合和atp合酶的稳定,有效 地阻止了线粒体质子的过度进入,恢复了线粒体的功能。在对线粒体 膜电位检测的结果显示,h2o2干预后的细胞线粒体内膜是去极化状 态,而使用hama@lipo-ss31/w@rev处理后,电位恢复到正常水 平,改善了mrc的电子传递。同时对线粒体的形态学观察发现(图 12中c),hama@lipo-ss31/w@rev有效改善了软骨细胞线粒体内 膜肿胀和内膜嵴弯曲,恢复细胞的线粒体正常状态。当细胞mrc功 能紊乱时,可引起软骨细胞的炎症反应,产生的肿瘤坏死因子-α和白 细胞介素-1β又可负反馈抑制mrc复合物i的活性,从而导致细胞 mrc功能进一步降低。我们通过qpcr对h2o2干预后软骨细胞的相 关炎症基因(肿瘤坏死因子-α、白细胞介素-1β、mmp-13)进行了检 测,在氧化应激下肿瘤坏死因子-α、白细胞介素-1β、mmp-13表达量 增加(图13);使用hama@lipo-ss31/w@rev处理后,观察到炎 症基因表达下降,且线粒体膜电位恢复到正常。综上,我们认为微纳 水凝胶微球调控线粒体呼吸链功能障碍的可能方式如图11中a所 示:1)首先水凝胶微球缓释的纳米颗粒被软骨细胞摄取后,靶向到 达细胞线粒体;2)ss-31肽与线粒体内膜的心磷脂结合,改善内膜 嵴弯曲,恢复细胞的线粒体电子传递链恢复活力;3)释放的白藜芦 醇激活sirt3蛋白表达,保护mrc功能、改善氧化应激。
[0104]
体内研究还表明,hama@lipo-ss31/w@rev微纳水凝胶微球体系对oa 有明显的治疗效果,包括使关节间隙接近正常、骨赘生成减少、有效修复关节软 骨、减轻炎症等。其中lipo-ss31/w@rev组与hama@lipo-ss31/w@rev组 在体外与体内对软骨细胞保护具有差异性,我们认为是由于纳米粒子在体内使用 时,会迅速从局部注射部位清除,且给药周期是每3周1次,不能达到有效治疗 剂量导致;有临床研究表明,在对类似于膝关节的深部组织器官进行微创注射治 疗时,反复频繁的穿刺无疑增大了患者感染的风险,会带来严重的后
果,因此我 们认为hama@lipo-ss31/w@rev组相较于lipo
‑‑
ss31/w@rev组,具有更 大的治疗优势。
[0105]
因此,本发明创新性地构建了一种靶向调控线粒体呼吸链的微纳水凝胶微球 体系,ss-31和软骨靶向肽修饰的纳米脂质体能将白藜芦醇高效地输送到软骨细 胞线粒体,且ss-31能结合线粒体内膜,稳定线粒体电子传输链。ss-31与白藜 芦醇的协同治疗,能改善mrc功能,具有减少质子泄露和抗氧化作用,在骨性 关节炎有效促进了关节软骨修复。另外通过微流控技术制备的 hama@lipo-ss31/w@rev微球,不仅能保护纳米脂质体,且在体外显著延长 了白藜芦醇的释放效率,提升体内的治疗指数。综上所述,该微纳水凝胶微球体 系可能成为治疗骨关节炎的一种新的策略,此外还可以应用于其他与线粒体呼吸 链功能紊乱相关的退行性疾病中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1