固体分散体、制剂、其制备方法及其应用与流程
1.本发明涉及一种固体分散体、制剂、其制备方法及其应用。
背景技术:
2.如式(i)所示的化合物4-{4-{[6-(4-氯-苯基)-螺[3,5]壬烷-6-烯-7-基]甲基}-哌嗪-1-基}-n-{{3-硝基-4-[((2s)-[1,4]二氧六环-2-基甲基)-氨基]苯基}磺酰基}-2-(1h-吡咯并[2,3-b]吡啶-5-基氧基)-苯甲酰胺是一种bcl-2抑制剂,bcl-2是调节蛋白bcl-2家族中最先发现的成员,其通过诱导(促凋亡的)或抑制(抗凋亡的)细胞凋亡来调节细胞死亡(细胞凋亡)。
[0003][0004]
该化合物通常为结晶形态,溶解性极低,难溶于水性介质以及大多数有机溶剂如甲醇、乙醇、异丙醇和丙酮,为了改善药物在胃肠溶液中的溶解度、溶出度从而提高口服生物利用度,亟需开发一种稳定性好、溶出度高的含有该化合物的制剂。
技术实现要素:
[0005]
本发明所要解决的技术问题是克服现有bcl-2抑制剂溶解度较低,制剂困难的缺陷,提供了一种固体分散体、制剂、其制备方法及其应用。该固体分散体具有良好的溶出度,有效成分的溶解度显著提高,该制剂可以有效改善bcl-2抑制剂的生物利用度,具有良好的溶出度和稳定性,可提高用药安全。
[0006]
为了实现上述发明目的,本发明提供以下技术方案:
[0007]
本发明提供了一种固体分散体,其包含载体和活性成分,所述活性成分为如式(i)所示的化合物和/或其药学上可接受的盐;所述载体为“n-乙烯基内酰胺的均聚物和共聚物”和/或ph依赖型纤维素类衍生物;
[0008][0009]
式(i)化合物通常为结晶形态,溶解性极低,在水性介质中,37℃、24小时,ph值为1-7的酸性或中性介质中,溶解度为0.0006-0.0003mg/ml。申请人通过研究出乎意料的发现,通过使式(i)化合物与合适的载体进行组合,式(i)化合物可以以无定形状态高度分散在载体中,在保持较高载药量的基础上,还大大改善了式(i)化合物的溶解性,提高其溶出速率和生物利用度,并大幅提高了固体分散体的稳定性。即使在高湿(60%)、长期(12个月)放置后,本发明的固体分散体中式(i)化合物也不会转化或降解。
[0010]
较佳地,所述“n-乙烯基内酰胺的均聚物和共聚物”为n-乙烯基吡咯烷酮的均聚物(即聚维酮或pvp)和共聚物;更佳地,为k值(聚维酮的水溶液的粘度)为大约12、大约25、大约30或者大约90的聚维酮,或者是pvp与聚乙酸乙烯酯的共聚物(pvp-va系列,例如pvp va64,即聚乙烯吡咯烷酮和聚乙酸乙烯酯以60:40聚合形成的共聚物)。
[0011]
较佳地,所述聚维酮包括但不限于pvp k30。
[0012]
较佳地,所述pvp与聚乙酸乙烯酯的共聚物包括但不限于pvp va64。
[0013]
较佳地,所述ph依赖型纤维素类衍生物为醋酸羟丙甲纤维素琥珀酸酯;更佳地,所述醋酸羟丙甲纤维素琥珀酸酯中乙酰基的取代度可以为5%~9%、7%~11%或10~14%,琥珀酰基的取代度分别为14~18%、10~14%或4~8%。
[0014]
较佳地,所述醋酸羟丙甲纤维素琥珀酸酯包括但不限于hpmcas 716g、hpmcas 912g、hpmcas 126g、hpmcas 716f、hpmcas912f、hpmcas126f、hpmcas lg、hpmcas mg、hpmcas hg、hpmcas lf、hpmcas mf和hpmcas hf中的一种或多种,例如hpmcas 716g、hpmcas lg、hpmcas 126g、hpmc as hg、hpmcas 912g和hpmcas mg中的一种或多种。
[0015]
较佳地,所述载体为聚维酮、共聚维酮和醋酸羟丙甲纤维素琥珀酸酯中的一种或多种;更佳地,所述载体为pvp k30、pvp va64、hpmcas 716g、hpmcas lg、hpmcas 126g、hpmc as hg、hpmcas 912g和hpmcas mg中的一种或多种,优选为pvp va64、hpmcas 716g和hpmcas lg中的一种或多种。
[0016]
所述载体的用量可为本领域常规,所述活性成分与所述载体的质量比优选为1:(1~10),进一步优选为1:(1.5~7)(例如1:1.5、1:2、3:7、1:3、1:4或1:6.7),最优选为1:(3~4)。活性成分和载体的质量比在1:(1.5~7)范围内时,固体分散体的平衡溶解度、成型性和溶出度等至少一个方面具有较好的效果,例如溶出度均优于单独的活性成分。当活性成分和载体的质量比在1:(3~4)范围内时,固体分散体的平衡溶解度、成型性和溶出度等至少一个方面具有更好的效果,例如60min时溶出度可达90%以上;在温度为25℃、湿度为60%
rh的条件下,放置12个月仍然保持无定形状态,无结晶析出;与单独的活性成分相比,平衡溶解度显著提高。
[0017]
所述固体分散体中,较佳地,还进一步包含表面活性剂。
[0018]
当所述固体分散体还包含表面活性剂时,所述表面活性剂的种类可为本领域常规,较佳地,所述表面活性剂为辛酸癸酸聚乙二醇甘油酯(labrasol)、tpgs、泊洛沙姆和吐温80(tween80)中的一种或多种。
[0019]
当所述固体分散体还包含表面活性剂时,所述表面活性剂的用量可为本领有常规,所述表面活性剂与所述活性成分的质量比优选为(0.1~5):1(例如0.21:1、0.33:1、0.4:1、0.58:1、0.8:1或1.2:1),更佳地为(0.1~2):1。
[0020]
所述固体分散体中,较佳地,还进一步包含助流剂。
[0021]
当所述固体分散体还包含助流剂时,所述助流剂的种类可为本领域常规,较佳地,所述助流剂为胶态二氧化硅。
[0022]
当所述固体分散体还包含助流剂时,所述助流剂的用量可为本领域常规,所述助流剂与所述活性成分的质量比优选为(0.02~1):1(例如0.03:1、0.04:1、0.05:1、0.06:1、0.08:1或0.2:1),更佳地为(0.02~0.2):1。
[0023]
在本发明一实施方案中,所述的固体分散体为无定形固体分散体。
[0024]
作为本发明的一个优选方案,所述的固体分散体包含以下质量份的组分:1份所述活性成分和1~10份所述载体。
[0025]
作为本发明的一个优选方案,所述的固体分散体包含以下质量份的组分:1份所述活性成分和1.5~7份所述载体。
[0026]
作为本发明的一个优选方案,所述的固体分散体包含以下质量份的组分:1份所述活性成分和3~4份所述载体。
[0027]
作为本发明的一个优选方案,所述的固体分散体包含以下质量份的组分:1份所述活性成分、1~10份所述载体和0.1~5份表面活性剂。
[0028]
作为本发明的一个优选方案,所述的固体分散体包含以下质量份的组分:1份所述活性成分、1.5~7份所述载体和0.1~2份表面活性剂。
[0029]
作为本发明的一个优选方案,所述的固体分散体包含以下质量份的组分:1份所述活性成分、1~10份所述载体和0.02~1份助流剂。
[0030]
作为本发明的一个优选方案,所述的固体分散体包含以下质量份的组分:1份所述活性成分、1.5~7份所述载体和0.02~0.2份助流剂。
[0031]
作为本发明的一个优选方案,所述的固体分散体包含以下质量份的组分:1份所述活性成分、1.5~7份所述载体、0.1~5份表面活性剂和0.02~0.2份助流剂。
[0032]
作为本发明的一个优选方案,所述的固体分散体包含以下质量份的组分:1份所述活性成分、1.5~7份所述载体、0.1~2份表面活性剂和0.02~0.2份助流剂。
[0033]
作为本发明的一个优选方案,所述的固体分散体包含以下质量份的组分:1份所述活性成分和4份pvp va64。
[0034]
作为本发明的一个优选方案,所述的固体分散体包含以下质量份的组分:1份所述活性成分和3份pvp va64。
[0035]
作为本发明的一个优选方案,所述的固体分散体包含以下质量份的组分:1份所述
活性成分和4份pvp k30。
[0036]
作为本发明的一个优选方案,所述的固体分散体包含以下质量份的组分:1份所述活性成分、6.7份pvp va64、0.58份吐温80和0.0834份胶态二氧化硅。
[0037]
作为本发明的一个优选方案,所述的固体分散体包含以下质量份的组分:1份所述活性成分、3份hpmcas 716g和0.08份胶态二氧化硅。
[0038]
作为本发明的一个优选方案,所述的固体分散体包含以下质量份的组分:1份所述活性成分、3份hpmcas 126g和0.08份胶态二氧化硅。
[0039]
作为本发明的一个优选方案,所述的固体分散体包含以下质量份的组分:1份所述活性成分、3份hpmcas 912g和0.08份胶态二氧化硅。
[0040]
作为本发明的一个优选方案,所述的固体分散体包含以下质量份的组分:1份所述活性成分、6.7份hpmcas 716g和0.08份胶态二氧化硅。
[0041]
作为本发明的一个优选方案,所述的固体分散体包含以下质量份的组分:1份所述活性成分、3份hpmcas 716g、0.21份吐温80和0.08份胶态二氧化硅。
[0042]
作为本发明的一个优选方案,所述的固体分散体包含以下质量份的组分:1份所述活性成分、3份pvp va64和1.2份泊洛沙姆。
[0043]
作为本发明的一个优选方案,所述的固体分散体包含以下质量份的组分:1份所述活性成分、3份pvp va64和0.8份tpgs。
[0044]
作为本发明的一个优选方案,所述的固体分散体包含以下质量份的组分:1份所述活性成分、3份pvp va64和0.4份labrasol。
[0045]
作为本发明的一个优选方案,所述的固体分散体包含以下质量份的组分:1份所述活性成分、2份hpmcas 716g和0.33份tpgs。
[0046]
本发明还提供了所述固体分散体的制备方法,包括以下方法一、方法二或方法三:
[0047]
所述方法一包含以下步骤:将所述如式i所示的化合物、其药学上可接受的盐、其晶型和其溶剂合物中的一种或多种、以及其他组分,与溶剂混合,形成溶液或悬浮液;除去所述溶剂,得所述固体分散体;
[0048]
所述方法二包含以下步骤:将所述如式i所示的化合物、其药学上可接受的盐、其晶型和其溶剂合物中的一种或多种、以及其他组分混合,加热后挤出,得所述固体分散体;
[0049]
方法三包含以下步骤:将所述如式i所示的化合物、其药学上可接受的盐、其晶型和其溶剂合物中的一种或多种、以及其他组分,与溶剂混合,进行喷雾干燥,得所述固体分散体。
[0050]
方法一中,所述溶剂的种类可为本领域常规,较佳地,所述溶剂为水、醇类溶剂、酯类溶剂、酮类溶剂、卤代烃溶剂、腈类溶剂和醚类溶剂中的一种或多种。其中,所述醇类溶剂可为乙醇和/或甲醇;所述酯类溶剂可为乙酸乙酯;所述的酮类溶剂可为丙酮;所述卤代烃溶剂可为二氯甲烷;所述腈类溶剂可为乙腈;所述醚类溶剂可为四氢呋喃。较佳地,所述溶剂为丙酮和/或乙醇。
[0051]
方法一中,所述溶剂的用量可为本领域常规,较佳地,“所述如式i所示的化合物、其药学上可接受的盐、其晶型和其溶剂合物中的一种或多种”与所述溶剂的质量体积比为(0.1~30):1mg/ml,可为(1~10):1mg/ml。
[0052]
方法二中,所述挤出的温度可为本领域常规,较佳地,所述挤出的温度为150~250
℃,更佳地,所述挤出的温度为160~220℃。
[0053]
方法二中,较佳地,所述挤出操作后还包含粉碎步骤。
[0054]
方法三中,所述溶剂的种类可为本领域常规,较佳地,所述溶剂为醇类溶剂和/或卤代烃溶剂,其中,所述醇类溶剂可为甲醇;所述卤代烃溶剂可为二氯甲烷。较佳地,所述溶剂为乙醇和二氯甲烷,其中,乙醇和二氯甲烷的体积比优选为5:95。
[0055]
方法三中,所述溶剂的用量可为本领域常规,较佳地,“所述如式i所示的化合物、其药学上可接受的盐、其晶型和其溶剂合物中的一种或多种”与所述溶剂的质量体积比为(0.1~30):1mg/ml。
[0056]
方法三中,较佳地,所述喷雾干燥物料温度可以设定为40℃~200℃,优选50℃~110℃。
[0057]
本发明还提供了一种包含上述固体分散体的制剂,其包含:所述固体分散体、填充剂和崩解剂。
[0058]
所述制剂中,所述填充剂的种类可为本领域常规,较佳地,所述填充剂为微晶纤维素、乳糖、预胶化淀粉、磷酸氢钙和磷酸钙中的一种或多种;例如为微晶纤维素、乳糖、磷酸氢钙、微晶纤维素和乳糖的组合、微晶纤维素和预胶化淀粉的组合、或者“微晶纤维素和磷酸钙的组合”;更佳地,所述填充剂为磷酸氢钙或者“微晶纤维素和磷酸钙的组合”。
[0059]
当所述填充剂为微晶纤维素和磷酸钙的组合时,较佳地,所述微晶纤维素和磷酸钙的质量比为1:(0.5~2)(例如1:0.5、1:1或1:2),更佳地为1:(1~2),最佳为1:1。
[0060]
其中,当所述填充剂含微晶纤维素时,所述微晶纤维素的种类可为本领域常规,较佳地,所述微晶纤维素为微晶纤维素avicelph102、硅化微晶纤维素90、硅化微晶纤维素hd 90、微晶纤维素ph105、微晶纤维素kg802和微晶纤维素avicelph101中的一种或多种,更佳地,所述微晶纤维素为微晶纤维素avicelph102和/或微晶纤维素kg802。
[0061]
所述制剂中,所述填充剂的用量可为本领域常规,较佳地,以所述的固体分散体的质量为1份计,所述填充剂的质量份数为0.2~8份;更佳地,所述填充剂的质量份数为0.2~2份,例如0.25份、0.40份、0.43份、0.72份、0.84份、0.85份、0.86份或0.90份。
[0062]
所述制剂中,所述崩解剂的种类可为本领域常规,较佳地,所述崩解剂为交联羧甲基纤维素钠、低取代羟丙基纤维素钠和羧甲基淀粉钠中的一种或多种;更佳地,所述崩解剂为交联羧甲基纤维素钠。
[0063]
所述制剂中,所述崩解剂的用量可为本领域常规,较佳地,以所述的固体分散体的质量为1份计,所述崩解剂的质量份数为0.03~0.4份;更佳地,所述崩解剂的质量份数为0.05~0.3份,例如0.075份、0.09份、0.1份、0.14份。
[0064]
所述制剂中,较佳地,还进一步包含助流剂。
[0065]
当所述制剂还包含助流剂时,所述助流剂的种类可为本领域常规,较佳地,所述助流剂为胶态二氧化硅。
[0066]
当所述制剂还包含助流剂时,所述助流剂的用量可为本领域常规,较佳地,以所述的固体分散体的质量为1份计,所述助流剂的质量份数为0.006~0.2份;更佳地,所述助流剂的质量份数为0.01~0.06份;例如0.01份、0.02份、0.03份或0.04份。
[0067]
所述制剂中,较佳地,还进一步包含润滑剂。
[0068]
当所述制剂还包含润滑剂时,所述润滑剂的种类可为本领域常规,较佳地,所述润
滑剂为硬脂酸镁和/或硬脂富马酸钠。
[0069]
当所述制剂还包含润滑剂时,所述润滑剂的用量可为本领域常规,较佳地,以所述的固体分散体的质量为1份计,所述润滑剂的质量份数为0.004~0.1份;更佳地,所述润滑剂的质量份数为0.004~0.04份;例如0.006份、0.007份、0.01份或0.02份。
[0070]
所述制剂中,较佳地,还进一步包含包衣剂。
[0071]
当所述制剂还包含包衣剂时,所述包衣剂的种类可为本领域常规,较佳地,所述包衣剂为胃溶型薄膜包衣预混剂,例如ii。
[0072]
当所述制剂还包含包衣剂时,所述包衣剂的用量可为本领域常规,较佳地,以所述的固体分散体的质量为1份计,所述包衣剂的质量份数为0.01~0.2份;更佳地,所述包衣剂的质量份数为0.04~0.1份,例如0.06份。
[0073]
作为本发明的一个优选方案,所述制剂包含以下质量份的组分:1份所述固体分散体、0.2~8份所述填充剂和0.03~0.4份所述崩解剂。
[0074]
作为本发明的一个优选方案,所述制剂包含以下质量份的组分:1份所述固体分散体、0.2~2份所述填充剂和0.05~0.3份所述崩解剂。
[0075]
作为本发明的一个优选方案,所述制剂包含以下重量份的组分:1份所述固体分散体、0.2~8份所述填充剂、0.03~0.4份所述崩解剂和0.006~0.2份助流剂。
[0076]
作为本发明的一个优选方案,所述制剂包含以下质量份的组分:1份所述固体分散体、0.2~2份所述填充剂、0.05~0.3份所述崩解剂和0.01~0.06份助流剂。
[0077]
作为本发明的一个优选方案,所述制剂包含以下重量份的组分:1份所述固体分散体、0.2~8份所述填充剂、0.03~0.4份所述崩解剂、0.006~0.2份助流剂和0.004~0.1份润滑剂。
[0078]
作为本发明的一个优选方案,所述制剂包含以下质量份的组分:1份所述固体分散体、0.2~2份所述填充剂、0.05~0.3份所述崩解剂、0.01~0.06份助流剂和0.004~0.04份润滑剂。
[0079]
作为本发明的一个优选方案,所述制剂包含以下重量份的组分:1份所述固体分散体、0.2~8份所述填充剂、0.03~0.4份所述崩解剂、0.006~0.2份助流剂、0.004~0.1份润滑剂和0.01~0.2份包衣剂。
[0080]
作为本发明的一个优选方案,所述制剂包含以下质量份的组分:1份所述固体分散体、0.2~2份所述填充剂、0.05~0.3份所述崩解剂、0.01~0.06份助流剂、0.004~0.04份润滑剂和0.04~0.1份包衣剂。
[0081]
作为本发明的一个优选方案,所述制剂包含以下质量份的组分:1份所述固体分散体和0.05份胶态二氧化硅。
[0082]
作为本发明的一个优选方案,所述制剂包含以下质量份的组分:1份所述固体分散体、0.9份微晶纤维素(avicelph102)和0.1份交联羧甲基纤维素钠。
[0083]
作为本发明的一个优选方案,所述制剂包含以下质量份的组分:1份所述固体分散体、0.6份微晶纤维素(avicelph102)、0.3份乳糖和0.1份交联羧甲基纤维素钠。
[0084]
作为本发明的一个优选方案,所述制剂包含以下质量份的组分:1份所述固体分散体、0.6份微晶纤维素(avicelph102)、0.3份预胶化淀粉和0.1份交联羧甲基纤维素钠。
[0085]
作为本发明的一个优选方案,所述制剂包含以下质量份的组分:1份所述固体分散
体、0.6份微晶纤维素(avicelph102)、0.3份磷酸钙和0.1份交联羧甲基纤维素钠。
[0086]
作为本发明的一个优选方案,所述制剂包含以下质量份的组分:1份所述固体分散体、0.45份微晶纤维素(avicelph102)、0.45份磷酸钙和0.1份交联羧甲基纤维素钠。
[0087]
作为本发明的一个优选方案,所述制剂包含以下质量份的组分:1份所述固体分散体、0.3份微晶纤维素(avicelph102)、0.6份磷酸钙和0.1份交联羧甲基纤维素钠。
[0088]
作为本发明的一个优选方案,所述制剂包含以下质量份的组分:1份所述固体分散体、0.428份微晶纤维素(avicelph102)、0.428份磷酸钙、0.1份交联羧甲基纤维素钠、0.04份胶态二氧化硅和0.06份硬脂酸镁。
[0089]
作为本发明的一个优选方案,所述制剂包含以下质量份的组分:1份所述固体分散体、0.45份硅化微晶纤维素90、0.45份磷酸钙和0.1份交联羧甲基纤维素钠。
[0090]
作为本发明的一个优选方案,所述制剂包含以下质量份的组分:1份所述固体分散体、0.45份硅化微晶纤维素hd 90、0.45份磷酸钙和0.1份交联羧甲基纤维素钠。
[0091]
作为本发明的一个优选方案,所述制剂包含以下质量份的组分:1份所述固体分散体、0.43份微晶纤维素ph105、0.43份磷酸钙、0.1份交联羧甲基纤维素钠和0.04份胶态二氧化硅。
[0092]
作为本发明的一个优选方案,所述制剂包含以下质量份的组分:1份所述固体分散体、0.43份微晶纤维素kg802、0.43份磷酸钙、0.1份交联羧甲基纤维素钠和0.04份胶态二氧化硅。
[0093]
作为本发明的一个优选方案,所述制剂包含以下质量份的组分:1份所述固体分散体、0.42份微晶纤维素(avicelph101)和0.07份交联羧甲基纤维素钠。
[0094]
作为本发明的一个优选方案,所述制剂包含以下质量份的组分:1份所述固体分散体、0.42份微晶纤维素(avicelph101)和0.07份低取代羟丙基纤维素钠。
[0095]
作为本发明的一个优选方案,所述制剂包含以下质量份的组分:1份所述固体分散体、0.39份微晶纤维素(avicelph101)、0.07份交联羧甲基纤维素钠和0.03份胶态二氧化硅。
[0096]
作为本发明的一个优选方案,所述制剂包含以下质量份的组分:1份所述固体分散体、0.3份微晶纤维素(avicelph102)、0.6份磷酸钙、0.1份交联羧甲基纤维素钠和0.06份胶态二氧化硅。
[0097]
作为本发明的一个优选方案,所述制剂包含以下质量份的组分:1份所述固体分散体、0.3份微晶纤维素(avicelph102)、0.6份磷酸钙、0.1份交联羧甲基纤维素钠、0.04份胶态二氧化硅和0.01份硬脂酸镁。
[0098]
作为本发明的一个优选方案,所述制剂包含以下质量份的组分:1份所述固体分散体、0.42份微晶纤维素kg802、0.42份磷酸钙、0.1份交联羧甲基纤维素钠、0.04份胶态二氧化硅和0.02份硬脂酸镁。
[0099]
作为本发明的一个优选方案,所述制剂包含以下质量份的组分:1份所述固体分散体、0.43份微晶纤维素(avicelph102)、0.43份磷酸钙、0.1份交联羧甲基纤维素钠、0.04份胶态二氧化硅、0.02份硬脂酸镁和0.006份胃溶型薄膜包衣预混剂(ii)。
[0100]
作为本发明的一个优选方案,所述制剂包含以下质量份的组分:1份所述固体分散
体、0.42份微晶纤维素kg802、0.42份磷酸钙、0.1份交联羧甲基纤维素钠、0.04份胶态二氧化硅、0.02份硬脂酸镁和0.06份胃溶型薄膜包衣预混剂(ii)。
[0101]
作为本发明的一个优选方案,所述制剂包含以下质量份的组分:1份所述固体分散体、0.26份磷酸氢钙、0.01份胶态二氧化硅和0.006份硬脂富马酸钠。
[0102]
作为本发明的一个优选方案,所述制剂包含以下质量份的组分:1份所述固体分散体、0.26份磷酸氢钙、0.1份交联羧甲基纤维素钠、0.01份胶态二氧化硅和0.007份硬脂富马酸钠。
[0103]
作为本发明的一个优选方案,所述制剂包含以下质量份的组分:1份所述固体分散体、0.36份微晶纤维素、0.36份磷酸钙、0.1份交联羧甲基纤维素钠、0.04份胶态二氧化硅和0.02份硬脂酸镁。
[0104]
本发明还提供了上述包含所述固体分散体的制剂的制备方法,其包含以下步骤:将所述制剂的各组分混合即可。
[0105]
所述制剂的制备方法中,较佳地,各组分先进行粉碎步骤再混合。
[0106]
本发明还提供了上述包含所述固体分散体的制剂在制备用于治疗过度增殖性疾病的药物中的应用。
[0107]
较佳地,所述过度增殖性疾病是癌症。
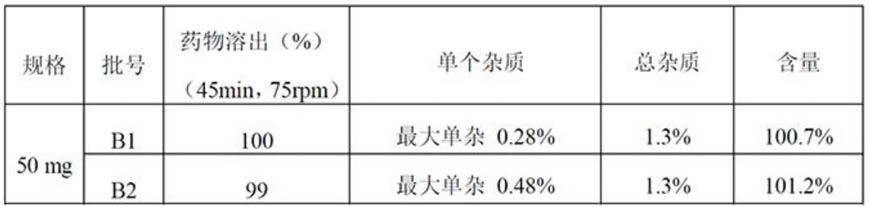
[0108]
较佳地,所述癌症选自急性单核细胞白血病、急性髓性白血病、慢性髓性白血病、慢性淋巴细胞白血病混合谱系白血病、nut-中线癌、多发性骨髓瘤、小细胞肺癌、神经母细胞瘤、伯基特淋巴瘤、宫颈癌、食道癌、卵巢癌、结肠直肠癌、前列腺癌和乳腺癌。
[0109]
在不违背本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。
[0110]
本发明所用试剂和原料均市售可得。
[0111]
本发明的积极进步效果在于:本发明提供的固体分散体能使活性成分以无定形状态高度分散在载体中,在保持较高载药量的基础上,还改善了式(i)化合物在胃肠液中的溶解,提高其溶出速率和生物利用度,并大幅提高了固体分散体的稳定性。本发明制剂溶出度好,杂质含量低(总杂含量低于2%,最大单杂低于0.5%),批次差异小,含量均匀度佳。
附图说明
[0112]
图1为实施例7固体分散体的xrd衍射图谱;
[0113]
图2为实施例7中固体分散体长期放置后的xrd衍射图谱;
[0114]
图3为实施例27中条件3制得固体分散体的dsc图谱;
[0115]
图4为实施例44固体分散体的xrd衍射图谱;
[0116]
图5为实施例45固体分散体的xrd衍射图谱。
具体实施方式
[0117]
下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。
[0118]
以下实施例中,所用试剂和原料均市售可得。
[0119]
x-射线粉末衍射测定条件:cu 40kv/40ma,步长为0.02
°
,扫描速度为60
°
/分钟,范围:4
°
~60
°
。
[0120]
dsc测试条件:将测试样品置于一个封闭的铝盘中,在氮气流下以10℃/分钟升温速度至约240℃得到差示扫描量热法(dsc)曲线。
[0121]
以下实施例中,按照wo2018/027097a1制备式(i)化合物,再将式(i)化合物置于瓶中,加入适量常规溶剂,如丙酮、乙腈、乙酸乙酯、1,4-二氧六环、甲苯或乙醇等,室温静置,将得到的晶型离心分离,室温干燥,得到化合物(i)的结晶形式。
[0122]
实施例1:式(i)化合物的制备
[0123]
按照wo2018/027097a1制备式(i)化合物,再将式(i)化合物置于瓶中,加入适量1,4-二氧六环,室温静置2天,将得到的晶型离心分离,室温干燥,得到化合物(i)的结晶形式。
[0124]
实施例2:式(i)化合物的制备
[0125]
按照wo2018/027097a1制备式(i)化合物,再将式(i)化合物置于瓶中,加入适量乙醇,室温搅拌5天,离心分离,得到的晶型再加入丙酮,室温搅拌1.5小时,离心分离,室温干燥,得到丙酮溶剂合物结晶形式。
[0126]
实施例3:式(i)化合物的制备
[0127]
按照wo2018/027097a1制备式(i)化合物,再将式(i)化合物置于瓶中,加入适量乙腈溶剂,室温搅拌5天,将得到的晶型离心分离,室温干燥,得到乙腈溶剂合物结晶形式。
[0128]
式(i)化合物的无定形物或其他结晶形式也可用于制备固体分散体。当然,也可以采用式(i)化合物的盐制备固体分散体。
[0129]
实施例4:固体分散体的制备
[0130]
采用以下减压蒸发法制备固体分散体:精密称取实施例1制备的化合物(i)的结晶形式(以下简称“api”或“原料药”)约100mg,置于100ml圆底烧瓶中,加入20ml丙酮,振荡使溶解;精密称取一定量载体,置于同一圆底烧瓶中,加入适量丙酮或乙醇使完全溶解,超声使混合均匀,置于旋转蒸发仪上,60℃加热、旋转,逐渐加真空,至圆底烧瓶内出现沸腾时,提高温度至80℃,直至溶剂挥干,继续旋蒸1h后取出,得固体分散体粉末。
[0131]
本实施例中,化合物(i)的结晶形式和pvp va64的质量比为1:4,即载药量为20%。
[0132]
对固体分散体进行药物溶出测试(转篮法,0.2%sds溶液,500ml,100rpm)。结果表明:10min、30min以及60min的药物溶出分别为67.47%、88.99%和95.86%。相同条件下,api(实施例1制备的化合物)在10min、30min以及60min的药物溶出分别为7%、13%和22%。
[0133]
实施例5:固体分散体的制备
[0134]
将实施例4中的pvp va64替换为pvp k30,采用和实施例4相同的方法制备固体分散体并对其进行表征。对固体分散体进行药物溶出测试(转篮法,0.2%sds溶液,500ml,100rpm),结果表明:10min、30min以及60min的药物溶出分别为36.59%、71.47%和84.39%。
[0135]
实施例6:固体分散体的制备
[0136]
将实施例4中化合物(i)的结晶形式和pvp va64的质量比替换为1:3,即载药量替换为25%,采用和实施例4相同的方法制备固体分散体并对其进行表征。对固体分散体进行药物溶出测试(转篮法,0.2%sds溶液,500ml,100rpm),结果表明:10min、30min以及60min的药物溶出分别为68.46%、89.56%和92.73%。
[0137]
实施例7:固体分散体的制备
[0138]
称取实施例1制备的原料药、载体pvp va64和胶态二氧化硅(其中,原料药、载体pvp va64和胶态二氧化硅的质量占比分别为23.75%、71.25%和5.00%)分别过30目筛,将原料药和pvp va64在混合桶内转速20rpm下混合10分钟后加入热熔挤出料斗内进行热熔挤出,工艺参数:195℃、饲料速度:50g/min,螺杆转速:135rpm,制得的挤出物进行粉碎后加入处方量助流剂胶态二氧化硅,在混合桶内转速20rpm下混合10分钟制得固体分散体。
[0139]
将制得的固体分散体进行xrd扫描,经过表征,参见附图1,活性成分以无定形状态分散在载体中。为考察该固体分散体稳定性,在温度为25℃、湿度为60%rh的条件下,放置12个月,再次对固体分散体进行xrd扫描,结果如图2所示。结果显示,该固体分散体仍然保持了无定形的状态,无任何结晶析出。
[0140]
实施例8:制剂的制备
[0141]
将实施例1制备的原料药和载体pvp va64分别过30目筛网,按照载药量为25%(即药载比为1:3)的比例加入料斗混合器内,在混合转速20rpm下混合10分钟,在热熔挤出机中进行热熔挤出,工艺参数为:操作温度195℃,饲料速度:约50rpm,螺杆转速:135rpm;所得挤出物为固体分散体。
[0142]
称取上述固体分散体、微晶纤维素(avicelph102)和交联羧甲基纤维素钠(其中,固体分散体、微晶纤维素(avicelph102)和交联羧甲基纤维素钠在总物料中的质量占比分别为50%、45%和5%),将固体分散体、微晶纤维素(avicelph102)和交联羧甲基纤维素钠粉碎、过30目网筛,料斗混合器混合,转速20rpm,混合时间10分钟。
[0143]
以10mm圆形冲模在实验型压片机(zp14)上进行压片,制成片重为400mg的素片。测试素片的各参数,其中,平均硬度为100n,平均厚度为5.87mm,崩解时间为5分30秒。
[0144]
实施例9:制剂的制备
[0145]
称取实施例8制得的固体分散体、微晶纤维素(avicelph102)、乳糖和交联羧甲基纤维素钠(其中,固体分散体、微晶纤维素(avicelph102)、乳糖和交联羧甲基纤维素钠在总物料中的质量占比分别为50%、30%、15%和5%),将固体分散体、微晶纤维素(avicelph102)、乳糖和交联羧甲基纤维素钠过筛、粉碎、混合,具体的操作和参数同实施例8。
[0146]
以10mm圆形冲模在实验型压片机(zp14)上进行压片,制成片重为400mg的素片。测试素片的各参数,其中,平均硬度为51n,平均厚度为5.81mm,崩解时间为3分55秒。
[0147]
实施例10:制剂的制备
[0148]
称取实施例8制得的固体分散体、微晶纤维素(ph102)、预胶化淀粉和交联羧甲基纤维素钠(其中,固体分散体、微晶纤维素(avicelph102)、预胶化淀粉和交联羧甲基纤维素钠在总物料中的质量占比分别为50%、30%、15%和5%),将固体分散体、微晶纤维素(avicelph102)、预胶化淀粉和交联羧甲基纤维素钠过筛、粉碎、混合,具体的操作和参数同实施例8。
[0149]
以10mm圆形冲模在实验型压片机(zp14)上进行压片,制成片重为400mg的素片。测试素片的各参数,其中,平均硬度为57n,平均厚度为5.81mm,崩解时间为4分16秒。
[0150]
实施例11:制剂的制备
[0151]
称取实施例8制得的固体分散体、微晶纤维素(avicelph102)、磷酸钙和交联羧
甲基纤维素钠(其中,固体分散体、微晶纤维素(avicelph102)、磷酸钙和交联羧甲基纤维素钠在总物料中的质量占比分别为50%、30%、15%和5%),将固体分散体、微晶纤维素(avicelph102)、磷酸钙和交联羧甲基纤维素钠过筛、粉碎、混合,具体的操作和参数同实施例8。
[0152]
以10mm圆形冲模在实验型压片机(zp14)上进行压片,制成片重为400mg的素片。测试素片的各参数以及药物溶出度,其中,平均硬度为59n,平均厚度为5.29mm,崩解时间为49秒。
[0153]
溶出度测定:采用药典溶出度测定第ⅱ法(桨法),以ph6.8磷酸盐溶液(0.2%十二烷基硫酸钠)900ml为溶出介质,转速为每分钟75转,经45分钟时累计溶出量不低于标示量的75%,经测定该制剂在5min、15min、30min、45min、60min、90min以及120min的药物溶出分别为14%、39%、63%、76%、83%、90%和91%。
[0154]
实施例12:制剂的制备
[0155]
称取实施例8制得的固体分散体、微晶纤维素(avicelph102)、磷酸钙和交联羧甲基纤维素钠(其中,固体分散体、微晶纤维素(avicelph102)、磷酸钙和交联羧甲基纤维素钠在总物料中的质量占比分别为50%、30%、15%和5%),将固体分散体、微晶纤维素(avicelph102)、磷酸钙和交联羧甲基纤维素钠过筛、粉碎、混合,具体的操作和参数同实施例8。
[0156]
以10mm圆形冲模在实验型压片机(zp14)上进行压片,调整压力,制成片重为400mg的素片。测试素片的各参数,其中,平均硬度为78n,平均厚度为5.05mm,崩解时间为3分22秒。
[0157]
实施例13:制剂的制备
[0158]
称取实施例8制得的固体分散体、微晶纤维素(avicelph102)、磷酸钙和交联羧甲基纤维素钠(其中,固体分散体、微晶纤维素(avicelph102)、磷酸钙和交联羧甲基纤维素钠在总物料中的质量占比分别为50%、22.5%、22.5%和5%),将固体分散体、微晶纤维素(avicelph102)、磷酸钙和交联羧甲基纤维素钠过筛、粉碎、混合,具体的操作和参数同实施例8。
[0159]
以10mm圆形冲模在实验型压片机(zp14)上进行压片,制成片重为400mg的素片。测试素片的各参数,其中,平均硬度为78n,平均厚度为4.95mm,崩解时间为3分7秒。
[0160]
实施例14:制剂的制备
[0161]
称取实施例8制得的固体分散体、微晶纤维素(avicelph102)、磷酸钙和交联羧甲基纤维素钠(其中,固体分散体、微晶纤维素(avicelph102)、磷酸钙和交联羧甲基纤维素钠在总物料中的质量占比分别为50%、15%、30%和5%),将固体分散体、微晶纤维素(avicelph102)、磷酸钙和交联羧甲基纤维素钠过筛、粉碎、混合,具体的操作和参数同实施例8。
[0162]
以10mm圆形冲模在实验型压片机(zp14)上进行压片,制成片重为400mg的素片。测试素片的各参数,其中,平均硬度为79n,平均厚度为4.84mm,崩解时间为2分21秒。
[0163]
实施例15:制剂的制备
[0164]
称取实施例8制得的固体分散体、微晶纤维素(avicelph102)、磷酸钙、交联羧甲
基纤维素钠、胶态二氧化硅和硬脂酸镁(其中,固体分散体、微晶纤维素(avicelph102)、磷酸钙、交联羧甲基纤维素钠、胶态二氧化硅和硬脂酸镁在总物料中的质量占比分别为50%、21.4%、21.4%、5%、2%和0.3%),将固体分散体、微晶纤维素(avicelph102)、磷酸钙、交联羧甲基纤维素钠、胶态二氧化硅和硬脂酸镁过筛、粉碎、混合,具体的操作和参数同实施例8。
[0165]
以10mm圆形冲模在实验型压片机(zp14)上进行压片,制成片重为400mg的素片。测试素片的各参数以及药物溶出度,其中,平均硬度为50n,平均厚度为5.10mm。素片中,含量(以干品计)为100.2%,总杂为1.76%,溶出度方面(桨法,以ph6.8磷酸盐溶液(0.2%十二烷基硫酸钠)900ml为溶出介质,转速为每分钟75转),在5min、30min、45min、60min、90min以及120min的溶出度分别为5%、64%、84%、93%、98%、98%。
[0166]
实施例16:制剂的制备
[0167]
称取实施例8制得的固体分散体、硅化微晶纤维素90、磷酸钙和交联羧甲基纤维素钠(其中,固体分散体、硅化微晶纤维素90、磷酸钙和交联羧甲基纤维素钠在总物料中的质量占比分别为50%、22.5%、22.5%和5%),将固体分散体、硅化微晶纤维素90、磷酸钙和交联羧甲基纤维素钠过筛、粉碎、混合,具体的操作和参数同实施例8。
[0168]
以10mm圆形冲模在实验型压片机(zp14)上进行压片,制成片重为400mg的素片。测试素片的各参数,其中,平均硬度为65n,平均厚度为5.11mm。
[0169]
实施例17:制剂的制备
[0170]
称取实施例8制得的固体分散体、硅化微晶纤维素hd 90、磷酸钙和交联羧甲基纤维素钠(其中,固体分散体、硅化微晶纤维素hd 90、磷酸钙和交联羧甲基纤维素钠在总物料中的质量占比分别为50%、22.5%、22.5%和5%),将固体分散体、硅化微晶纤维素hd 90、磷酸钙和交联羧甲基纤维素钠过筛、粉碎、混合,具体的操作和参数同实施例8。
[0171]
以10mm圆形冲模在实验型压片机(zp14)上进行压片,制成片重为400mg的素片。测试素片的各参数,其中,平均硬度为43n,平均厚度为5.09mm。
[0172]
实施例18:制剂的制备
[0173]
称取实施例8制得的固体分散体、微晶纤维素ph105、磷酸钙、交联羧甲基纤维素钠和胶态二氧化硅(其中,固体分散体、微晶纤维素ph105、磷酸钙、交联羧甲基纤维素钠和胶态二氧化硅在总物料中的质量占比分别为50%、21.5%、21.5%、5%和2%),将固体分散体、微晶纤维素ph105、磷酸钙、交联羧甲基纤维素钠和胶态二氧化硅过筛、粉碎、混合,具体的操作和参数同实施例8。
[0174]
以10mm圆形冲模在实验型压片机(zp14)上进行压片,制成片重为400mg的素片。测试素片的各参数,其中,平均硬度为75n,平均厚度为5.12mm。
[0175]
实施例19:制剂的制备
[0176]
称取实施例8制得的固体分散体、微晶纤维素kg802、磷酸钙、交联羧甲基纤维素钠和胶态二氧化硅(其中,固体分散体、微晶纤维素kg802、磷酸钙、交联羧甲基纤维素钠和胶态二氧化硅在总物料中的质量占比分别为50%、21.5%、21.5%、5%和2%),将固体分散体、微晶纤维素kg802、磷酸钙、交联羧甲基纤维素钠和胶态二氧化硅过筛、粉碎、混合,具体的操作和参数同实施例8。
[0177]
以10mm圆形冲模在实验型压片机(zp14)上进行压片,制成片重为400mg的素片。测
试素片的各参数,其中,平均硬度为93n,平均厚度为5.10mm。
[0178]
从实施例15~19可知,微晶纤维素的种类对片剂的硬度有一定影响,但影响不大,其中,含微晶纤维素kg802的片剂处方在相同水平片厚下,硬度最大,压缩成型性最好。
[0179]
实施例20:制剂的制备
[0180]
称取实施例8制得的固体分散体、微晶纤维素(avicelph101)和交联羧甲基纤维素钠(其中,固体分散体、微晶纤维素(avicelph101)和交联羧甲基纤维素钠在总物料中的质量占比分别为66.7%、28.3%和5%),将固体分散体、微晶纤维素(avicelph101)和交联羧甲基纤维素钠过筛、粉碎、混合,具体的操作和参数同实施例8。
[0181]
以10mm圆形冲模在实验型压片机(zp14)上进行压片,制成片重为300mg的素片。测试素片的各参数以及药物溶出度,其中,平均硬度为35n,平均厚度为4.94mm。溶出度方面(桨法,以ph6.8磷酸盐溶液(0.2%十二烷基硫酸钠)900ml为溶出介质,转速为每分钟75转),5min、15min、30min、45min、60min、90min以及120min的药物溶出分别为1%、10%、33%、53%、67%、85%和93%。
[0182]
实施例21:制剂的制备
[0183]
称取实施例8制得的固体分散体、微晶纤维素(avicelph101)和低取代羟丙基纤维素钠(其中,固体分散体、微晶纤维素(avicelph101)和低取代羟丙基纤维素钠在总物料中的质量占比分别为66.7%、28.3%和5%),将固体分散体、微晶纤维素(avicelph101)和低取代羟丙基纤维素钠过筛、粉碎、混合,具体的操作和参数同实施例8。
[0184]
以10mm圆形冲模在实验型压片机(zp14)上进行压片,制成片重为300mg的素片。测试素片的各参数以及药物溶出度,其中,平均硬度为31n,平均厚度为5.10mm。溶出度方面(桨法,以ph6.8磷酸盐溶液(0.2%十二烷基硫酸钠)900ml为溶出介质,转速为每分钟75转),5min、15min、30min、45min、60min、90min以及120min的药物溶出分别为1%、2%、6%、11%、14%、21%和29%。
[0185]
由实施例20~21可知,崩解剂的种类对片剂的硬度和溶出度有一定影响,其中,交联羧甲基纤维素钠作为崩解剂效果最优。
[0186]
实施例22:制剂的制备
[0187]
称取实施例8制得的固体分散体、微晶纤维素(avicelph101)、交联羧甲基纤维素钠和胶态二氧化硅(其中,固体分散体、微晶纤维素(avicelph101)、交联羧甲基纤维素钠和胶态二氧化硅在总物料中的质量占比分别为66.7%、26.3%、5%和2%),将固体分散体、微晶纤维素(avicelph101)、交联羧甲基纤维素钠和胶态二氧化硅过筛、粉碎、混合,具体的操作和参数同实施例8。
[0188]
以10mm圆形冲模在实验型压片机(zp14)上进行压片,制成片重为300mg的素片。测试素片的各参数以及药物溶出度,其中,平均硬度为26n,平均厚度为4.85mm。溶出度方面(桨法,以ph6.8磷酸盐溶液(0.2%十二烷基硫酸钠)900ml为溶出介质,转速为每分钟75转),5min、15min、30min、45min、60min、90min以及120min的药物溶出分别为3%、14%、38%、58%、73%、89%和96%。实验结果表明,与实施例20相比,本实施例处方中加入2%的助流剂胶态二氧化硅,对片剂的理化特性基本无影响,对药物溶出有一定的促进作用。
[0189]
实施例23:制剂的制备
[0190]
称取实施例8制得的固体分散体、微晶纤维素(avicelph102)、磷酸钙、交联羧甲基纤维素钠、胶态二氧化硅和硬脂酸镁(其中,固体分散体、微晶纤维素(avicelph102)、磷酸钙、交联羧甲基纤维素钠、胶态二氧化硅和硬脂酸镁在总物料中的质量占比分别为48.9%、14.6%、29.3%、4.9%、2%和0.3%),将固体分散体、微晶纤维素(avicelph102)、磷酸钙、交联羧甲基纤维素钠、胶态二氧化硅和硬脂酸镁过筛、粉碎、混合,具体的操作和参数同实施例8。
[0191]
以10mm圆形冲模在实验型压片机(zp14)上进行压片,制成片重为409.2mg的素片,压片正常。测试素片的各参数,其中,平均硬度为60n,平均厚度为5.01mm,崩解时间为4分23秒。
[0192]
实施例24:制剂的制备
[0193]
称取实施例8制得的固体分散体、微晶纤维素(avicelph102)、磷酸钙、交联羧甲基纤维素钠、胶态二氧化硅和硬脂酸镁(其中,固体分散体、微晶纤维素(avicelph102)、磷酸钙、交联羧甲基纤维素钠、胶态二氧化硅和硬脂酸镁在总物料中的质量占比分别为48.8%、14.6%、29.2%、4.9%、2%和0.5%),将固体分散体、微晶纤维素(avicelph102)、磷酸钙、交联羧甲基纤维素钠、胶态二氧化硅和硬脂酸镁过筛、粉碎、混合,具体的操作和参数同实施例8。
[0194]
以10mm圆形冲模在实验型压片机(zp14)上进行压片,制成片重为410mg的素片,压片正常。测试素片的各参数,其中,平均硬度为56n,平均厚度为5.04mm,崩解时间为4分40秒。
[0195]
实施例25:制剂的制备
[0196]
称取实施例8制得的固体分散体、微晶纤维素kg802、磷酸钙、交联羧甲基纤维素钠、胶态二氧化硅和硬脂酸镁(其中,固体分散体、微晶纤维素kg802、磷酸钙、交联羧甲基纤维素钠、胶态二氧化硅和硬脂酸镁在总物料中的质量占比分别为50%、21%、21%、5%、2%和1%),将固体分散体、微晶纤维素kg802、磷酸钙、交联羧甲基纤维素钠、胶态二氧化硅和硬脂酸镁过筛、粉碎、混合,具体的操作和参数同实施例8。
[0197]
以10mm圆形冲模在实验型压片机(zp14)上进行压片,制成片重为400mg的素片,压片正常。测试素片的各参数,其中,平均硬度为64n,平均厚度为5.25mm,崩解时间为7分02秒。
[0198]
实施例26:制剂的制备
[0199]
api对光敏感,参考实施例15的制备方法,选择胃溶型薄膜包衣预混剂(ii 85f92209黄色)进行片剂包衣,目标包衣增重为3%(即在实施例15素片的基础上进行包衣,所得包衣片约含素片片重3%的包衣剂)。结果显示,包衣片中,含量(以干品计)为99.8%,总杂为1.73%,溶出度方面(桨法,以ph6.8磷酸盐溶液(0.2%十二烷基硫酸钠)900ml为溶出介质,转速为每分钟75转),在5min、15min、30min、45min、60min、90min以及120min的溶出度分别为6%、22%、55%、77%、87%、94%、95%,符合质量要求。
[0200]
实施例27:固体分散体的制备
[0201]
将实施例1制备的原料药和载体pvp va64,按照载药量为25%(即药载比为1∶3)的比例在合适的料斗机中进行混合,预混合采用常规料斗混合机,热熔挤出参数如下表1所示,所得挤出物为固体分散体。
[0202]
表1
[0203] 条件1条件2条件3条件4条件5条件6设定温度(℃)180185185185200195加料速度(g/min)202030302030外观透明透明透明透明透明透明总杂(%)1.771.891.711.772.372.08
[0204]
在挤出温度为180~200℃范围内得到的挤出物均为无定形。
[0205]
条件3制得的固体分散体进行dsc扫描,参见附图3,dsc图谱中无活性成分晶型的特征峰,结果显示活性成分以无定形状态分散在载体中。
[0206]
实施例28:制剂的制备
[0207]
本实施例中制剂由以下组分组成:
[0208]
实施例1制备的原料药12.14%(w/w),
[0209]
pvp va64 36.41%(w/w),
[0210]
微晶纤维素kg802 20.39%(w/w),
[0211]
磷酸钙20.39%(w/w),
[0212]
交联羧甲基纤维素钠4.85%(w/w),
[0213]
胶态二氧化硅1.94%(w/w),
[0214]
硬脂酸镁0.97%(w/w)
[0215]
ii薄膜包衣预混剂2.91%(w/w)。
[0216]
按照实施例27条件3的方法制备固体分散体,按照实施例8的制备方法制备规格为50mg的制剂。
[0217]
按照前述方法测定制剂的溶出度(桨法,以ph6.8磷酸盐溶液(0.2%十二烷基硫酸钠)900ml为溶出介质,转速为每分钟75转)、含量及有关物质,做2个批次,分析数据如表2所示:
[0218]
表2
[0219][0220]
从结果可以看出,50mg规格的制剂不同批次在45min、75rpm的最低溶出度为99%。不同批次单杂均不超过0.5%、总杂不超过1.5%,含量限度和含量均匀度均符合预期。
[0221]
实施例29:制剂的制备
[0222]
本实施例中制剂由以下组分组成:
[0223]
实施例1制备的原料药14.8%(w/w),
[0224]
pvp va64 44.4%(w/w),
[0225]
微晶纤维素kg802 13.9%(w/w),
[0226]
磷酸钙13.9%(w/w),
[0227]
交联羧甲基纤维素钠10%(w/w),
[0228]
胶态二氧化硅2%(w/w),
[0229]
硬脂酸镁1%(w/w)。
[0230]
按照实施例27条件3的方法制备固体分散体,按照实施例8的制备方法制备为规格200mg的制剂。
[0231]
按照前述方法测定制剂的溶出度(桨法,以ph6.8磷酸盐溶液(0.5%十二烷基硫酸钠)900ml为溶出介质,转速为每分钟75转)及有关物质做2个批次,分析数据如表3所示:
[0232]
表3
[0233][0234]
从结果可以看出,200mg规格的制剂不同批次在45min、75rpm的溶出度均大于90%。不同批次单杂均不超过0.5%、总杂不超过1.5%。
[0235]
实施例30
[0236]
将实施例1制备的原料药、载体pvp va64分别过30目筛,加入50l料斗混合器内,在混合转速20rpm下混合10分钟,其中原料药和pvp va64的质量比分别为12.5%和37.5%。
[0237]
将上述混合好的物料加入到热熔挤出机的加料器中,在热熔挤出机中进行热熔挤出,工艺参数为:操作温度180~200℃,螺杆转速:95~105rpm,给药速度为25~35g/min;所得挤出物为固体分散体。
[0238]
将该固体分散体、微晶纤维素kg802、磷酸钙、交联羧甲基纤维素钠、胶态二氧化硅和硬脂酸镁(其中,固体分散体、微晶纤维素kg802、磷酸钙、交联羧甲基纤维素钠、胶态二氧化硅和硬脂酸镁在总物料中的质量占比分别为50%、21%、21%、5%、2%和1%)过筛、粉碎、混合,具体的操作和参数同实施例8。
[0239]
以10mm圆形冲模在实验型压片机(zp14)上进行压片,制成片重为400mg的素片。测试素片的各参数,其中,平均硬度为50n。
[0240]
实施例31
[0241]
将实施例1制备的原料药、载体pvp va64和胶态二氧化硅分别过30目筛网,将过筛后的物料混合均匀(过30目筛网3遍后ldpe袋内振摇混合100次),再加入粉碎机内;减重法塑料滴管移取处方量吐温80,均匀分布地滴加入上述混合粉体中,启动粉碎机将吐温80和粉体混合均匀;其中,实施例1制备的原料药、载体pvp va64、胶态二氧化硅和吐温80的质量比为1:6.67:0.08:0.58。
[0242]
将上述混合好的物料加入到热熔挤出机的加料器中,在热熔挤出机中进行热熔挤出,工艺参数为:操作温度195℃,螺杆转速:500rpm;所得挤出物为固体分散体。
[0243]
称取上述固体分散体、磷酸氢钙、胶态二氧化硅和硬脂富马酸钠(其中,固体分散体、磷酸氢钙、胶态二氧化硅和硬脂富马酸钠在总物料中的质量占比分别为78.49%、20%、1%和0.51%),将固体分散体、磷酸氢钙、胶态二氧化硅和硬脂富马酸钠过筛、粉碎、混合,
具体的操作和参数同实施例8。
[0244]
以10mm圆形冲模在实验型压片机(zp14)上进行压片,制成片重为530.9mg的素片。测试素片的各参数,其中,平均硬度为120n。
[0245]
实施例32:固体分散体的制备
[0246]
称取实施例1制备的原料药、载体pvp va64和泊洛沙姆188(其中,原料药、载体pvp va64和泊洛沙姆188的质量占比分别为19.23%、57.69%和23.08%)分别过30目筛,将原料药、pvp va64和泊洛沙姆188在混合桶内转速20rpm下混合10分钟后加入热熔挤出料斗内进行热熔挤出,工艺参数:200℃
±
5,螺杆转速:500rpm,制得的挤出进行粉碎,制得固体分散体。
[0247]
实施例33:固体分散体的制备
[0248]
称取实施例1制备的原料药、载体pvp va64和tpgs(其中,原料药、载体pvp va64和tpgs的质量占比分别为20.83%、62.5%和16.67%)分别过30目筛,将原料药、pvp va64和tpgs在混合桶内转速20rpm下混合10分钟后加入热熔挤出料斗内进行热熔挤出,工艺参数:200℃
±
5,螺杆转速:500rpm,制得的挤出进行粉碎,制得固体分散体。
[0249]
实施例34:固体分散体的制备
[0250]
称取实施例1制备的原料药、载体pvp va64和labrasol(其中,原料药、载体pvp va64和labrasol的质量占比分别为22.73%、68.18%和9.09%)分别过30目筛,将原料药、pvp va64和labrasol在混合桶内转速20rpm下混合10分钟后加入热熔挤出料斗内进行热熔挤出,工艺参数:200℃
±
5,螺杆转速:500rpm,制得的挤出进行粉碎,制得固体分散体。
[0251]
实施例35:固体分散体的制备-载体类型
[0252]
将实施例1制备的原料药、hpmcas 716g和胶态二氧化硅以质量比为24.5:73.5:2的比例溶于甲醇/二氯甲烷(5:95,v/v)中,浓度为13.33mg/ml。采用喷雾干燥法制备固体分散体,喷雾干燥的参数:喷腔孔径:1.5mm;进风温度:85℃;风量100%;蠕动泵转速:20-25%;q-flow:20-30mm;蠕动管管材:nsf-51,内径:2mm,外径:3.7mm。
[0253]
实施例36:固体分散体的制备
[0254]
将实施例1制备的原料药、hpmcas 716g和胶态二氧化硅(其中,原料药、hpmcas 716g和胶态二氧化硅的质量占比分别为12.86%、86.14%和1%)溶于甲醇/二氯甲烷(5:95,v/v)中,浓度为13.33mg/ml。采用喷雾干燥法制备固体分散体,喷雾干燥的参数:喷腔孔径:1.5mm;进风温度:85℃;风量100%;蠕动泵转速:20-25%;q-flow:20-30mm;蠕动管管材:nsf-51,内径:2mm,外径:3.7mm。
[0255]
实施例37:固体分散体的制备
[0256]
将实施例1制备的原料药、hpmcas 716g、吐温80和胶态二氧化硅(其中,原料药、hpmcas 716g、吐温80和胶态二氧化硅的质量占比分别为23.3%、69.7%、5%和2%)溶于甲醇/二氯甲烷(5:95,v/v)中,浓度为13.33mg/ml。采用喷雾干燥法制备固体分散体,喷雾干燥的参数:喷腔孔径:1.5mm;进风温度:85℃;风量100%;蠕动泵转速:20-25%;q-flow:20-30mm;蠕动管管材:nsf-51,内径:2mm,外径:3.7mm。
[0257]
实施例38:固体分散体的制备
[0258]
将实施例1制备的原料药、hpmcas 716g、和胶态二氧化硅(其中,原料药、hpmcas716g和胶态二氧化硅的质量占比分别为24.5%、73.5%和2%)溶于甲醇/二氯甲烷
(5:95,v/v)中,浓度为13.33mg/ml。采用喷雾干燥法制备固体分散体,喷雾干燥的参数:喷腔孔径:1.5mm;进风温度:85℃;风量100%;蠕动泵转速:20-25%;q-flow:20-30mm;蠕动管管材:nsf-51,内径:2mm,外径:3.7mm。
[0259]
溶出度方面(桨法,以ph7.4磷酸盐溶液(0.05%十二烷基硫酸钠)900ml为溶出介质,转速为每分钟75转),在30min、60min、90min、120min、150min以及180min的溶出度分别为81.8%、86.6%、89.3%、90.0%、90.3%、90.8%。
[0260]
实施例39:固体分散体的制备
[0261]
将实施例38中的载体替换为hpmcas 126g,其余参数不变,该固体分散体在30min、60min、90min、120min、150min以及180min的溶出度分别为80.9%、87.6%、90.3%、90.7%、91.0%、91.2%;
[0262]
将实施例38中的载体替换为hpmcas 912g,其余参数不变,该固体分散体在30min、60min、90min、120min、150min以及180min的溶出度分别为78.8%、84.8%、86.6%、87.2%、87.3、88.1%。
[0263]
实施例40:制剂的制备
[0264]
称取实施例36制备的固体分散体、交联羧甲基纤维素钠、磷酸氢钙、胶态二氧化硅和硬脂富马酸钠(其中,固体分散体、交联羧甲基纤维素钠、磷酸氢钙、胶态二氧化硅和硬脂富马酸钠在总物料中的质量占比分别为70.6%、10.0%、18.0%、0.9%和0.5%),将固体分散体、交联羧甲基纤维素钠、磷酸氢钙、胶态二氧化硅和硬脂富马酸钠过筛、粉碎、混合,具体的操作和参数同实施例8。
[0265]
以10mm圆形冲模在实验型压片机(zp14)上进行压片,制成片重为550.4mg的素片。测试素片的各参数,其中,平均硬度为226n,崩解时间为1分30秒。溶出度方面(桨法,以ph7.4磷酸盐溶液(0.05%十二烷基硫酸钠)900ml为溶出介质,转速为每分钟75转),在30min和60min的溶出度分别为43.5%、91.4%。
[0266]
实施例41:制剂的制备
[0267]
称取实施例37制备的固体分散体、微晶纤维素、交联羧甲基纤维素钠、磷酸钙、胶态二氧化硅和硬脂酸镁(其中,固体分散体、微晶纤维素、交联羧甲基纤维素钠、磷酸钙、胶态二氧化硅和硬脂酸镁在总物料中的质量占比分别为53.7%、19.2%、5.0%、19.2%、2.0%和1.0%),将固体分散体、微晶纤维素、交联羧甲基纤维素钠、磷酸钙、胶态二氧化硅和硬脂酸镁过筛、粉碎、混合,具体的操作和参数同实施例8。
[0268]
以10mm圆形冲模在实验型压片机(zp14)上进行压片,制成片重为400mg的素片。测试素片的各参数,其中,平均硬度为100.4n,崩解时间为23秒。溶出度方面(桨法,以ph6.8磷酸盐溶液(0.2%十二烷基硫酸钠)900ml为溶出介质,转速为每分钟75转),在5min、15min、30min、45min和60min的溶出度分别为96.6%、99.7%、98.4%、98.8%和100.2%。
[0269]
实施例42:固体分散体的制备-热熔挤出
[0270]
称取实施例1制备的原料药、hpmcas 716g和tpgs(其中,原料药、hpmcas 716g和tpgs的质量占比分别为30%、60%和10%)分别过30目筛,将原料药、hpmcas 716g和tpgs在混合桶内转速20rpm下混合10分钟后加入热熔挤出料斗内进行热熔挤出,工艺参数:180℃,饲料速度:30rpm,螺杆转速:100rpm,制得的挤出进行粉碎,制得固体分散体。
[0271]
实施例43:固体分散体的制备-喷雾干燥
[0272]
称取实施例1制备的原料药、hpmcas 716g和tpgs(其中,原料药、hpmcas 716g和tpgs的质量占比分别为30%、60%和10%)溶于甲醇/二氯甲烷(5:95,v/v)中,浓度为13.33mg/ml。采用喷雾干燥法制备固体分散体,喷雾干燥的参数:喷腔孔径:1.5mm;进风温度:85℃;风量100%;蠕动泵转速:20-25%;q-flow:20-30mm;蠕动管管材:nsf-51,内径:2mm,外径:3.7mm。
[0273]
实施例44:固体分散体的制备
[0274]
将实施例2的式(i)化合物丙酮溶剂合物和载体pvp va64分别过30目筛网,按照载药量为25%(即药载比为1:3)的比例加入料斗混合器内,在混合转速20rpm下混合10分钟,在热熔挤出机中进行热熔挤出,工艺参数为:操作温度165℃,螺杆转速:150rpm;所得挤出物为固体分散体。
[0275]
溶出度方面(桨法,以ph6.8磷酸盐溶液(0.2%十二烷基硫酸钠)900ml为溶出介质,转速为每分钟75转),5min、15min、30min、45min、60min以及90min的药物溶出分别为57.6%、88.4%、97.9%、99.7%、99.9%和100.0%。
[0276]
对制得的固体分散体进行xrd检测,结果如图4所示,xrd图谱中无活性成分晶型的特征峰,结果显示活性成分以无定形状态分散在载体中。
[0277]
实施例45:固体分散体的制备
[0278]
将实施例3的式(i)化合物乙腈溶剂合物和载体pvp va64分别过30目筛网,按照载药量为25%(即药载比为1:3)的比例加入料斗混合器内,在混合转速20rpm下混合10分钟,在热熔挤出机中进行热熔挤出,工艺参数为:操作温度165℃,螺杆转速:150rpm;所得挤出物为固体分散体。
[0279]
溶出度方面(桨法,以ph6.8磷酸盐溶液(0.2%十二烷基硫酸钠)900ml为溶出介质,转速为每分钟75转),5min、15min、30min、45min、60min以及90min的药物溶出分别为57.9%、89.3%、97.9%、99.6%、99.7%和100.0%。
[0280]
对制得的固体分散体进行xrd检测,结果如图5所示,xrd图谱中无活性成分晶型的特征峰,结果显示活性成分以无定形状态分散在载体中。
[0281]
效果实施例1:平衡溶解度测试
[0282]
测定平衡溶解度:将过量的api(实施例1制备)、固体分散体分别在37℃下与溶媒混合搅拌2、24小时,分别在2、24小时高速离心后取上清液,用高效液相色谱测定上清液中api的浓度。api在不同溶媒中的平衡溶解度测定结果如下表4所示:
[0283]
表4
[0284][0285]
上述结果可以看出,将api制备为固体分散体后,平衡溶解度大大提高。
[0286]
效果实施例2:生物利用度测试
[0287]
小鼠绝对生物利用度试验条件:
[0288]
口服灌胃给药组:选用cd-1小鼠72只(雌雄各半),随机分为三组,12只/性别/组,单次灌胃给予供试品(实施例7制备的固体分散体)给药剂量为25、50、100mg/kg,溶媒为反渗透(r.o.)水。
[0289]
静脉注射给药组:选用cd-1小鼠24只,雌雄各半,单次静脉注射给予供试品(实施例1制备的原料药),给药剂量为2mg/kg,溶媒为5%dmso+5%solutol hs15+90%生理盐水。
[0290]
所有动物于给药前及给药后0.083h(仅静注)、0.25h、0.5h、1h、2h、4h、6h、8h、12h和24h采集血样,分离出血浆。采用经验证的lc-ms/ms分析方法检测血浆中的药物浓度,分析方法的定量下限为2ng/ml。用代谢动力学数据分析软件winnonlin的非房室模型(nca)对血浆浓度数据进行分析计算药代参数。
[0291]
beagle犬绝对生物利用度试验条件:
[0292]
本试验选用雌性和雄性beagle犬各3只,分为口服供试品(实施例7制备的固体分散体混悬液)组,3个剂量分别为:5、10、20mg/kg,以及静脉注射供试品(实施例1制备的原料药溶液)组,给药剂量为0.5mg/kg。口服灌胃给药组溶媒为反渗透(r.o.)水,静脉注射给药组溶媒为5%dmso+5%solutol hs15+90%生理盐水。
[0293]
各组动物于给药前及给药后0.083h(仅静注)、0.25h、0.5h、1.0h、2.0h、4.0h、6.0h、8.0h、24h、48h和72h采集血样,分离出血浆。采用经验证的lc-ms/ms方法检测犬血浆中的药物浓度,方法的定量下限为2ng/ml。用代谢动力学数据分析软件winnonlin的非房室模型(nca)对血浆浓度数据进行分析计算药代参数,计算绝对生物利用度。
[0294]
如上所述,采用实施例7制备的固体分散体,选择小鼠和beagle犬两种动物模型进行药代动力学行为评价,结果显示上述固体分散体在小鼠和犬的绝对生物利用度分别为19%~27.2%和19.5%~23.6%。
[0295]
效果实施例3:药代动力学测试
[0296]
随机四组雄性小鼠,其中2组为供试品1(实施例7制备的固体分散体,用反渗透水作溶剂配制成混悬液)组给药剂量分别为25mg/kg和100mg/kg,另2组为供试品2(实施例1制备的原料药,用含助悬剂0.2%hpmc-e5的水溶液配制成混悬液)组,给药剂量分别为25mg/kg和100mg/kg。各组动物均为单次灌胃给药。
[0297]
所有动物于给药后0.087h、0.25h、0.5h、1h、2h、4h、6h、8h、24h的时间点采集血样,分离血浆。所有血浆样品采用lc-ms/ms方法分析小鼠血浆中原料药的浓度,方法的定量下限为10ng/ml。用代谢动力学数据分析软件winnonlin8.0.0.3176的非房室模型法(nca)对血浆浓度数据进行分析计算药代参数,评估各组给药后原料药在动物体内的动力学特征。结果如表5所示。
[0298]
表5
[0299][0300]
效果实施例4:长期稳定性试验
[0301]
将实施例28中规格为50mg批号为b1批次的制剂进行长期稳定性研究,样品在40
±
2℃,75%
±
5%rh条件下放置6个月,结果如表6所示。
[0302]
表6
[0303][0304]
以上结果表明,各检测项目无明显变化。
[0305]
效果实施例5:药代动力学测试-beagle犬
[0306]
本试验选用雄性beagle犬3只,分为口服供试品(未包衣素片)组,给药剂量为:5mg/kg,口服灌胃给药溶媒为纯化水。
[0307]
各动物于给药给药后1.0h、2.0h、4.0h、6.0h、8.0h、24h、48h采集血样,分离出血浆。采用经验证的lc-ms/ms方法检测犬血浆中的药物浓度,方法的定量下限为2ng/ml。用代谢动力学数据分析软件winnonlin的非房室模型(nca)对血浆浓度数据进行分析计算药代参数。
[0308]
结果如表7所示。
[0309]
表7 beagle犬药代动力学参数
[0310][0311]
效果实施例6:药代动力学测试-小鼠
[0312]
随机cd-1雄性小鼠9只,供试品为固体分散体,用纯化水作溶剂配制成混悬液,给药剂量为50mg/kg。各动物均为单次灌胃给药。
[0313]
所有动物于给药后0.083h、0.25h、0.5h、1h、2h、4h、6h、8h、24h的时间点采集血样,分离血浆。所有血浆样品采用lc-ms/ms方法分析小鼠血浆中原料药的浓度,方法的定量下限为10ng/ml。用代谢动力学数据分析软件winnonlin8.0.0.3176的非房室模型法(nca)对血浆浓度数据进行分析计算药代参数,评估各组给药后原料药在动物体内的动力学特征。结果如表8所示。
[0314]
表8 小鼠药代动力学参数
[0315][0316]
效果实施例7:药代动力学测试-小鼠
[0317]
口服灌胃给药组:选用cd-1小鼠9只,单次灌胃给予供试品(固体分散体)给药剂量为50mg/kg,溶媒为纯化水。
[0318]
所有动物于给药后0.083h、0.25h、0.5h、1h、2h、4h、6h、8h和24h采集血样,分离出血浆。采用经验证的lc-ms/ms分析方法检测血浆中的药物浓度,分析方法的定量下限为10ng/ml。用代谢动力学数据分析软件winnonlin的非房室模型(nca)对血浆浓度数据进行分析计算药代参数,评估各组给药后原料药在动物体内的动力学特征。结果如表9所示。
[0319]
表9 小鼠药代动力学参数
[0320][0321]
效果实施例8:药代动力学测试-beagle犬
[0322]
本试验选用雄性beagle犬3只,口服供试品(固体分散体混悬液),给药剂量:5mg/kg。
[0323]
各动物于给药前及给药后0.083h、0.25h、0.5h、1.0h、2.0h、4.0h、6.0h、8.0h、24h和48h采集血样,分离出血浆。采用经验证的lc-ms/ms方法检测犬血浆中的药物浓度,方法的定量下限为2ng/ml。用代谢动力学数据分析软件winnonlin的非房室模型(nca)对血浆浓度数据进行分析计算药代参数。结果如表10所示。
[0324]
表10
[0325]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1