氯化镁的热分解的制作方法
本发明涉及将氯化镁转化为氧化镁和HCl的方法。本发明还涉及转化氯化镁溶液的方法以及包括发酵步骤、分离步骤、和转化氯化镁溶液步骤的整合方法。
背景技术:
通过发酵生产羧酸的方法在本领域中是已知的。在这些方法中,羧酸通常以盐如镁盐的形式制备。当回收羧酸时,获得需要进一步处理的盐溶液。例如,WO00/17378描述了一种生产乳酸的方法,其中在发酵过程中制备了乳酸镁溶液。乳酸镁溶液用HCl酸化以获得在氯化镁溶液中包含乳酸的溶液。由所述溶液回收乳酸。可以对所得氯化镁溶液进行处理,通过使其经受至少500℃温度下的热水解步骤而使氯化镁与水反应产生氧化镁粉末和盐酸。热水解反应所需的热量由原位燃料燃烧提供。
WO2013/025106描述了一种通过包括如下步骤的过程生产羧酸的方法:用HCl酸化羧酸的镁盐以形成酸和氯化镁溶液,和通过沉淀使所述酸与溶液分离。这表明可以通过热分解处理氯化镁溶液。
WO2013/093028描述了一种通过包括如下步骤的过程生产羧酸的方法:用HCl酸化羧酸的镁盐以形成酸和氯化镁溶液,和通过萃取及随后的反萃取而使所述酸与溶液分离。这表明可以通过热分解处理氯化镁溶液。
在上述参考文献中,通过将氯化镁溶液提供给热分解步骤而处理所述溶液,其中溶液中的氯化镁与水反应形成固体氧化镁和包含水和HCl的气体物流。
还公开了转化氯化镁为氧化镁的其它方法。EP25427描述了喷雾干燥氯化镁溶液形成氯化镁二水合物和在转炉中在600℃下焙烧所述氯化镁二水合物。US4425314也描述了在600-800℃的温度下将氯化镁二水合物转化为MgO。有利地通过使氯化镁水溶液干燥形成氯化镁六水合物和将所述化合物转化为二水合物而获得氯化镁二水合物。DD28740描述了干燥氯化镁溶液形成氯化镁二水合物,例如应用喷雾干燥器。然后在反应室中在至少800℃的温度下使氯化镁二水合物与热气接触。
虽然据信转化氯化镁二水合物为氧化镁对于处理氯化镁溶液来说获得了具有改进的灵活性的方法,但已经发现仍需要改进的方法,特别是能够在比本领域已知方法更高的速度和更低的温度下实施的方法。本发明提供了这样一种方法。
技术实现要素:
本发明涉及转化氯化镁为氧化镁和HCl的方法,包括如下步骤:
-向热水解反应器提供氯化镁化合物,其中所述反应器处于至少300℃的温度下,
-从热水解反应器中抽出固态MgO和包含HCl的气体物流,其中提供给热水解反应器的氯化镁化合物为包含至少50wt%的MgCl2.4H2O的固体氯化镁化合物。
已经令人惊讶地发现通过提供包含至少50wt%的MgCl2.4H2O水合物的固体氯化镁化合物作为热水解原料,可以获得快速的、可以在不堵塞设备的情况下实施并且可以以设备和能量均有效的方式操作的方法。所述方法还可以整合在转化氯化镁溶液的方法中。
下面将更详细地描述本发明。
附图说明
通过如下附图描述本发明,但不局限于或受限于所述附图。
图1描述了本发明的第一个实施方案。
图2描述了本发明的第二个实施方案,其中转化具体氯化镁化合物为氧化镁和HCl的步骤与由氯化镁溶液生产具体氯化镁化合物的步骤组合。
图3描述了本发明的第三个实施方案,其中将图2的方法整合入发酵方法中。
具体实施方式
在本发明方法中,已经发现选择MgCl2.4H2O作原料给出了有吸引力的结果。与之相对比,其它固体氯化镁化合物较不合适用作热水解的原料。更具体地,已经发现无水氯化镁和氯化镁一水化物需要长的反应时间、更高的反应温度、和HCl的存在。氯化镁二水合物也需要相对长的反应时间和更高的温度。另一方面,发现氯化镁六水合物会熔化,这会导致设备堵塞。
在本发明方法中,向热水解反应器提供包含至少50wt%MgCl2.4H2O的固体氯化镁化合物。对于氯化镁化合物来说,优选的是包含少于30wt%、特别地为少于20wt%、更特别地为少于10wt%的氯化镁六水合物,和/或包含少于40wt%、优选少于30wt%、更优选少于20wt%、仍更优选少于10wt%的无水氧化镁和氯化镁一水化物的总和。对于氯化镁化合物来说,还优选的是包含少于40wt%、优选少于30wt%、更优选少于20wt%、仍更优选少于10wt%的无水氯化镁、氯化镁一水化物和氯化镁二水合物的总和。在本实施方案内,优选的是还满足上述指定的氯化镁六水合物的百分比要求。对于氯化镁化合物,优选的是包含至少60wt%、特别是至少80wt%、更特别是至少90wt%的MgCl2.4H2O。这是因为MgCl2.4H2O在转化为氧化镁时给出最好的结果,需要较低的转化温度和较短的反应时间。氯化镁化合物的组成可以由本领域中已知的方法如XRD确定。
在热水解步骤中,将氯化镁化合物加热至至少300℃的温度。该过程步骤有时也被称为焙烧步骤或热分解步骤。在热水解步骤中,氯化镁与H2O反应形成MgO和HCl。MgO以固态从热水解反应器中抽出。还从热水解反应器中抽出包含HCl的气体物流。
在至少300℃的温度下实施热分解,该温度是MgCl2分解的最低温度。热分解优选在至少400℃的温度下实施。由于能量成本,所述温度优选低于1000℃、更优选低于800℃、特别是低于700℃、更特别地低于600℃。已经发现当在本发明中应用氯化镁四水合物时,在300-600℃的温度范围内可以获得高的转化率,同时可在合理的通量下操作。在350-550℃、特别是400-500℃的温度范围内操作被认为是优选的,因为在这种温度范围内可以在影响温度选择的能量因素和通量因素之间获得最优平衡。所提到的温度为装置内气体的温度。
在本发明中采用的热分解优选在0.1-10bar的压力下实施。但应用高压可能并不理想,因为HCl不能冷凝而增加了腐蚀风险。热分解优选在常压下实施,以避免不必要的能量成本和对昂贵的高压设备的需求。
在热分解步骤中,氯化镁四水合物转化为MgO和HCl。氯化镁水合物中存在的水合水的量足以提供化学计量转化所需的氧和氢。但在热分解步骤中可能优选的是加入少量水,因为这可能有助于完全转化。如果添加,以氯化镁化合物的重量计,合适的水量例如为0.01-10wt%。
通常在提供给反应器的气体物流的存在下实施热水解,所述气体物流可用于为系统提供热量并从反应器中抽出HCl。气体物流的性质不是很关键。例如,其可以为空气或燃烧气体。后者可能是优选的,因为它具有更高的温度。在一个实施方案中,气体物流包含40-100wt%的氮气,特别是40-80wt%的氮、0-15wt%的氧和0-20wt%的CO2。例如,水可以以5-20wt%的量存在。很显然,总计组成为100wt%。合适的气体例如可以为燃烧步骤例如天然气燃烧得到的气体物流。
已经发现HCl的存在可能有助于确保在反应时限内完全转化。不希望被理论局限,据信HCl的存在可能有助于防止形成具有较低反应性的MgClOH。因为在反应过程中形成HCl,可以通过引导产品气流过仍待转化的氯化镁化合物而利于其有利存在。如果需要,可以在反应过程中加入更多的HCl。
热水解反应器可以具有任何传统的大小或形状,和可以以连续或间歇方式操作。当可应用时,气体物流可以与氯化镁化合物的输送方向并流或与氯化镁化合物的输送方向逆流。在一个优选的实施方案中,气体物流的方向与氯化镁化合物的输送方向逆流。合适的热水解设备在现有技术中是已知的,和包括喷雾焙烧炉和流化床焙烧炉。在本发明中,例如可以使用具有高装填度,例如以设备内部体积计装填度10-50vol%的设备。具有相对较高装填度的优点是可以很容易地控制温度和停留时间。
在一个实施方案中,热水解反应器为管式反应器,其中氯化镁化合物在反应器的一端(进一步称为进料端)或其附近进入反应器、和产品氧化镁在反应器的另一端(进一步称为产品端)或其附近抽出,而气体物流在产品端或其附近进入反应器,和包含HCl的气体物流在进料端或其附近抽出。这种实施方案是优选的,因为正如上文所解释的,这样确保了引导产品气流过仍待转化的氯化镁化合物。因为这样能有效利用能量,也是很有吸引力的。另外,正如上文所指出,管式反应器能应用相对高的装填度。正如下文将更为详细讨论的,管式反应器通常装备有混合设施和/或输送设施。
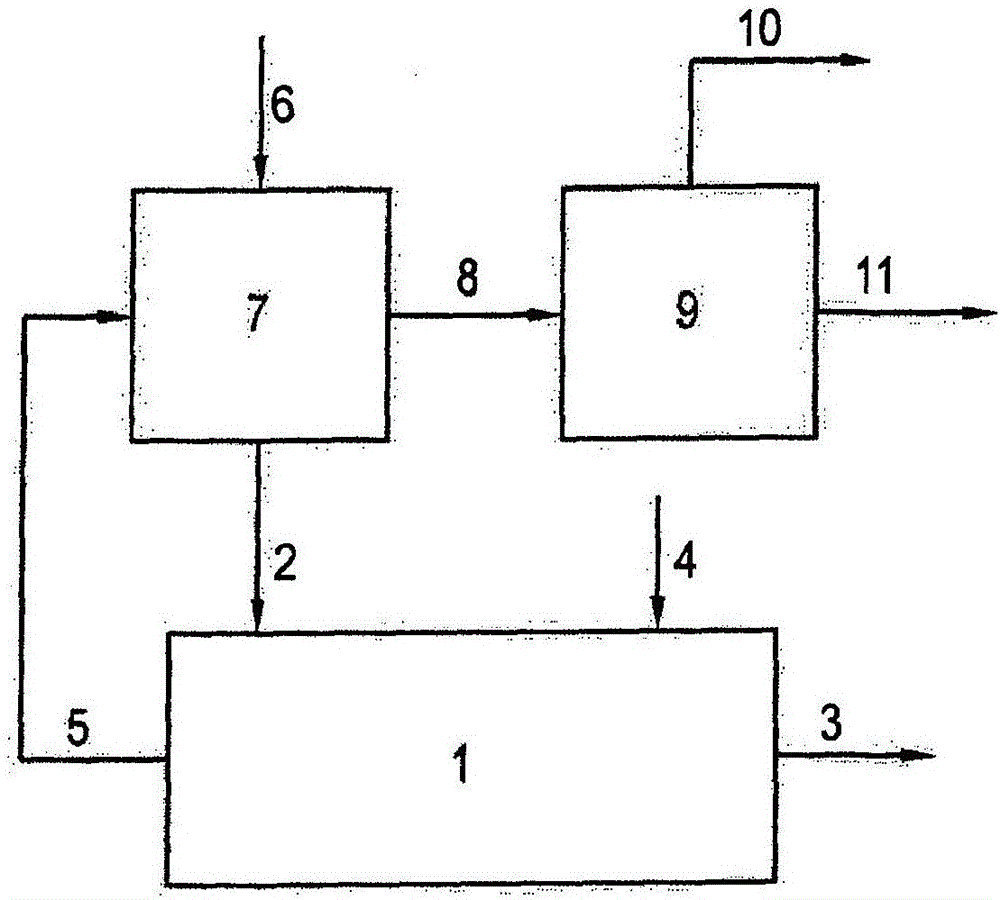
该实施方案在图1中描述。在图1中,描述了管式反应器(1),其通过加热设施(图中未示出)而处于高温下。氯化镁化合物通过管线(2)提供给反应器,在其中转化为氧化镁,后者通过管线(3)抽出。反应器可以包含固体物料的输送设施(图中未示出)。合适的输送设施包围旋转的内螺旋、桨叶或转盘、或旋转壁。反应器也可能与水平方向成一定角度,此时进料端设置比产品端高。反应器也可以是立式,或者配备有移动床。将热气体物流通过管线(4)提供给反应器。气体物流与反应器中存在的固体物料即氯化镁化合物和氧化镁接触。转化反应过程中产生的HCl被气体物流吸收,和含HCl的产品物流通过管线(5)脱除。合适的反应器在本领域中是已知的。例如它们包括转炉、移动床或螺旋输送机。选择合适的反应器结构在本领域熟练技术人员的认知范围内。
在这个实施方案中,由于热传递,提供给该装置的气体物流的温度在流过该装置后将降低。优选的是从所述装置脱除的气体物流的温度为至少300℃、特别是至少400℃。最大温度可以为至多1000℃、特别是至多800℃、更特别地为至多700℃,在一些实施方案中,至多为600℃。350-550℃、特别是400-500℃的范围可能是优选的。进入装置的气体物流的温度将高于它离开装置时的温度。精确的入口温度将取决于气体物流的来源和在所述装置中的传热特性。例如入口温度可以为700-1500℃,特别是800-1500℃。
已经发现本发明方法可以有效地将氯化镁化合物转化为氧化镁。这产生短的停留时间。在一个实施方案中,从氯化镁化合物进入反应器到对应的氧化镁从反应器脱除来计算,反应器中的停留时间为至多30分钟。所述停留时间可以更短,例如至多20分钟、或至多15分钟、或至多10分钟、或甚至更少,例如至多5分钟。反应时间通常为至少15秒。精确的停留时间取决于反应器的类型和工艺条件。通过选择更高的操作温度、更小的颗粒粒度和提供更多的水(蒸汽)或HCl,可以缩短停留时间。
本发明的原料为包含至少50wt%MgCl2.4H2O的固体氯化镁化合物。正如上文指出的,对于氯化镁化合物,优选的是包含至少60wt%的MgCl2.4H2O,特别是至少80wt%、更特别地为至少90wt%。
包含至少50wt%MgCl2.4H2O的氯化镁化合物可以通过在控制条件即100-160℃的温度下干燥氯化镁溶液而获得。如果在温度低于100℃下实施干燥,将会以过高量形成氯化镁六水合物,而它的存在将会不利地影响至MgO的转化。由于这个原因,对于干燥,可能优选的是在至少110℃下实施,特别是至少120℃。另一方面,如果在温度高于160℃下实施干燥,无水氯化镁、氯化镁一水化物和氯化镁二水合物将会以过高量形成,而它们的存在也将不利地影响至MgO的转化步骤。可能优选的是在至多140℃下实施干燥。对于干燥步骤来说,可能优选的是在110-160℃、更具体地在120-160℃的温度下实施。对于这种温度范围的偏好源自希望形成氯化镁四水合物和能量因素。选择合适的干燥温度在本领域熟练技术人员的认知范围内。应注意这里所指的干燥步骤的温度为干燥器中的温度。
氯化镁起始溶液的浓度不是很关键,可能取决于所能获得的原料浓度。可以提及的通用值范围为5-45wt%。可能优选的是氯化镁的浓度相对较高,例如20-45wt%、更特别地为30-45wt%。应用较浓的溶液可以伴随着较少的水脱除,从经济角度看这是有利的。在具体实施方案中应用较高浓度的其它优点将在下文讨论。
干燥步骤可以以现有技术中已知的方法实施。从实际角度和经济角度看,喷雾干燥是合适的。也可以应用其它方法如流态化床干燥。确定合适的干燥方法在本领域熟练技术人员的认识范围内。
在一个实施方案中,在包含HCl的气体物流的存在下实施干燥步骤。这将是将从热水解步骤获得的包含HCl的气体物流提供给干燥步骤的情况。这是特别有利的,因为从热水解步骤在高温下获得所述气体物流,例如至少300℃、特别是至少400℃,和所述高温可用于蒸发水。气体物流优选为至多1000℃、特别是至多800℃、更特别地为至多700℃,在一些实施方案中为至多600℃。350-550℃、特别是400-500℃可能是优选的。
应注意在将这种温度范围内的气体物流用于喷雾干燥,由于水蒸发其温度将立即降为更低值、特别是100-160℃的值。在喷雾干燥器的情况下,如上文所述,装置中的干燥温度对于形成理想类型的氯化镁水合物很重要,其取决于入口气体温度和氯化镁溶液的浓度,后者决定了待蒸发的水量。通过调节喷雾干燥气体的温度和氯化镁溶液的浓度,装置内的干燥温度可以设定为理想值。
在一个实施方案中,本发明涉及转化氯化镁溶液为氧化镁和HCl的整合方法,所述方法包括如下步骤:
-使氯化镁溶液在100-160℃、特别是120-160℃的温度下经受干燥步骤,以形成包含至少50wt%的MgCl2.4H2O的氯化镁化合物,
-向热水解反应器提供所述氯化镁化合物,所述反应器处于至少300℃的温度下,和
-从热水解反应器中抽出固态MgO和包含HCl的气体物流。
在一个优选的实施方案中,所述干燥步骤为喷雾干燥步骤,和将所述从热水解反应器抽出的包含HCl的气体物流提供给所述喷雾干燥步骤以与氯化镁溶液混合。这将在下文中更为详细地讨论。
上文给出的各步骤的各方面的描述同样也适用于整合方法。
图2描述了整合方法的一个实施方案。在图2中,管线(6)为干燥器(7)提供氯化镁溶液。在干燥器(7)中,形成固体氯化镁化合物,其通过管线(2)提供给热水解反应器(1)。在反应器(1)中,将氯化镁化合物转化为氧化镁,其通过管线(3)抽出。将热的气体物流通过管线(4)提供给反应器。气体物流与反应器中存在的固体物料即氯化镁化合物和氧化镁接触。转化反应过程中产生的HCl被气体物流吸收,和含HCl的产品物流通过管线(5)脱除。在图(2)所示的实施方案中,将包含HCl的气体物流提供给干燥器(7),在其中将气体中的热量用于干燥。干燥器(7)产生尾气,其通过管线(8)抽出。至少在该情况下,将来自反应器(1)的流出物物流(5)提供给干燥器(7),来自干燥器(7)的尾气含有通常为5-30wt%、特别地为15-30wt%、更特别地为20-25wt%的HCl。尾气的进一步组成不是很关键。这取决于通过管线(4)提供给反应器(1)的气体。它通常包含氮和任选如下的一种或多种:氧、二氧化碳和其它化合物。尾气可以按需要进行处理。在一个实施方案中,如图2所示,将尾气提供给吸收器(9),在其中与水接触,水吸收HCl以形成HCl水溶液。取决于尾气中HCl的浓度,HCl溶液可能具有10-30wt%的浓度,特别地为15-30wt%、更特别地为20-25wt%。当将相对高浓度的氯化镁溶液用作干燥步骤的原料时,可以特别地获得这些高的浓度范围。这也是优选应用这些更浓溶液的进一步理由。
正如前文指出,本发明方法特别适合并入生产有机组分的方法中,特别是应用发酵步骤生产羧酸的方法中。
因此,在一个实施方案中,本发明涉及包括如下步骤的方法:
-使碳源经受发酵步骤以形成羧酸,其中所述发酵步骤包括在发酵液中通过微生物使碳原发酵和通过加入选自氧化镁和氢氧化镁的镁碱而中和至少一部分羧酸的步骤,从而获得羧酸镁,
-使羧酸镁经受酸化步骤,其中在含水环境中使羧酸镁与HCl接触以形成含羧酸和氯化镁的含水混合物,
-使所述含羧酸和氯化镁的含水混合物经受分离步骤,以形成含羧酸的流出物和氯化镁溶液,
-使所述氯化镁溶液在100-160℃、特别是120-160℃的温度下经受干燥步骤,以形成包含至少50wt%的MgCl2.4H2O的氯化镁化合物,
-向热水解反应器提供所述氯化镁化合物,所述反应器处于至少300℃的温度下,
-从热水解反应器中抽出固态MgO,
-从热水解反应器中抽出包含HCl的气体物流。
在这种整合工艺的一个优选实施方案中,可以将从热水解反应器抽出的氧化镁至少部分循环至发酵步骤。这可以以MgO的形式实现或者在转化为氢氧化镁例如通过使氧化镁与水接触获得氢氧化镁浆液后实现。在整合方法的一个优选的实施方案中,将从干燥步骤得到的包含HCl的气体物流至少部分循环至酸化步骤。在一个实施方案中,通过在水中吸收而将包含HCl的气体物流转化为HCl溶液,和将所述溶液循环至酸化步骤。在另一个实施方案中,以气态形式将所述包含HCl的气体物流提供给酸化步骤。对于本发明的整合方法来说,特别优选的是包含上述MgO循环和HCl循环的组合。
上述本发明方法的具体实施方案和优选也同样适用于整合方法。
下面将讨论在整合方法中对处理氯化镁溶液来说附加的各步骤。
在第一步中,使碳源经受发酵步骤以形成羧酸,其中所述发酵步骤包括在发酵液中通过微生物使碳原发酵和通过加入选自氧化镁和氢氧化镁的镁碱而中和至少一部分羧酸的步骤,从而获得羧酸镁。生产羧酸的发酵方法在本领域中是已知的,不需要在这里进一步描述。对于本领域的熟练技术人员来说,应用公知常识根据希望生产的酸、碳源和可获得的微生物选择合适的发酵过程在其认知范围内。
发酵过程的产品是发酵液,为包含羧酸镁、生物质和任选其它组分的含水液体,所述其它组分如杂质等为糖、蛋白质和盐。如果需要,在进一步处理前,可以使所述发酵液经受生物质脱除步骤,例如过滤步骤。为了提高产品质量这通常是优选的。取决于所产生的羧酸,在生物质脱除之前、之后或者同时,另一个中间步骤可以为从发酵液中分离出固体反应产物如羧酸镁,和任选使羧酸镁经受洗涤步骤。
取决于所产生的羧酸,另一个中间步骤可以为使所述发酵液经受浓缩步骤以在酸化前增加组合物中羧酸镁的浓度。这个步骤可以在生物质脱除之前、之后或同时实施。其它中间步骤如纯化步骤可以按需要实施,这对本领域熟练技术人员来说是明显的。
本发明的整合方法的下一步是使羧酸镁经受酸化步骤,有时也称为酸解步骤,其中在含水环境中使羧酸镁与HCl接触以形成含羧酸和氯化镁的含水混合物。有多种方法可以实施这个步骤。酸化步骤通常通过使羧酸盐与酸性HCl溶液接触而实施。但在一些实施方案中,也有可能使羧酸盐与气态HCl接触。羧酸盐可以为固体和/或溶解形式。在一个实施方案中,以固态提供羧酸盐。在这种情况下,通过使羧酸盐与酸性溶液接触而实施所述酸解步骤。由固态羧酸盐制备含水混合物的优点是可以获得非常高的羧酸浓度,例如浓度为至少15wt%、特别是至少25%至例如50wt%或例如40wt%。羧酸盐也可以为溶解形式,典型地作为水溶液的一部分。在这种情况下,所述酸解步骤可以通过使羧酸盐与酸性溶液或酸性气体接触而实施。酸解步骤也可以用羧酸和羧酸盐的混合物来实施。例如可以在低pH的发酵中获得这种混合物。所述混合物例如可以为含水悬浮液。
当羧酸盐的酸解通过使其与酸性HCl溶液接触而实施时,优选具有尽可能高的酸浓度。这种高的酸浓度将会形成具有高羧酸浓度的含水混合物,这是希望的。因此,以酸性溶液的总重量计,所述酸性溶液包含至少5wt%、更优选至少10wt%和甚至更优选至少20wt%的酸。酸解通常应用过量酸实施。这种过量优选较小,从而所获得的含水混合物不是强酸性的,从进一步处理这种混合物的角度来看,强酸性可能不是理想的。例如,所应用酸的过量程度可以使所得含水混合物的pH为2或更低,优选pH为0-1。当应用气态HCl时,它可以与羧酸盐溶液或悬浮液接触。具体地,可以使HCl气体鼓风通过所述溶液或悬浮液。
优选地,在75℃或更低的温度下实施酸解。在更高温度下,使设备经受高温下的酸性环境的苛刻条件将会变得不经济。
酸化步骤形成包含羧酸和氯化镁的含水液体。使这种含水液体经受分离步骤,任选在已实施中间处理步骤如浓缩步骤后。合适的分离步骤在本领域中是已知的。所应用的步骤的性质取决于酸的性质和特性。当羧酸全部或部分作为固体存在于含水液体中时,可以应用常规的固-液分离方法如过滤、离心分离等实施分离。当羧酸全部或部分作为独立的有机相存在于含水液体中时,可以应用传统的液-液分离方法如倾析、沉降、离心分离、应用板式分离器、应用聚结器和应用旋液分离器等实施分离。可以添加提取剂以提高分离效率。也可以应用不同的方法和设备的组合。当羧酸以溶解态存在于含水液体中时,例如可以应用合适的萃取剂进行萃取而实施分离。
对于本发明的整合方法来说,所生产的羧酸的性质不是很关键。在一个实施方案中,所述羧酸为含至少2个但不多于6个碳原子的单-、二-或三-羧酸(C2-6羧酸)。在一个实施方案中,所述羧酸选自:乳酸、琥珀酸、丙酸、3-羟基丙酸、2-、3-和4-羟基丁酸、柠檬酸、富马酸、衣康酸、己二酸、丙烯酸、乙酰丙酸、马来酸、2,5-呋喃二羧酸、扁桃酸、苹果酸和酒石酸。所述羧酸优选选自乳酸、琥珀酸、丙酸、3-羟基丙酸、2-、3-和4-羟基丁酸和柠檬酸。
在一个实施方案中,所述羧酸选自具有2-6个碳原子的单羧酸。在一个实施方案中,所述具有2-6个碳原子的单羧酸不含羟基。在该组中,合适酸的例子有丙酸、丙烯酸、丁酸和戊酸。
在另一个实施方案中,所述单羧酸包含至少一个羟基。在该组中,在一个实施方案中其可能优选选自如下的酸:乳酸、羟基乙酸、3-羟基丙酸、2-、3-和4-羟基丁酸。在另一个这类的实施方案中,其可能优选选自如下的酸:羟基乙酸、3-羟基丙酸、2-、3-和4-羟基丁酸。在另一个实施方案中,对于酸来说可能优选为乳酸。
在另一个实施方案中,所述羧酸为含至少2个但不多于6个碳原子的多羧酸(C2-6羧酸),特别是二-或三-羧酸。在一个实施方案中,所述多羧酸选自琥珀酸、柠檬酸、富马酸、衣康酸、己二酸、马来酸、2,5-呋喃二羧酸、扁桃酸、苹果酸和酒石酸。所述多羧酸优选选自琥珀酸、柠檬酸、富马酸、衣康酸、己二酸和2,5-呋喃二羧酸。所述多羧酸可以特别地选自琥珀酸、富马酸、衣康酸和2,5-呋喃二羧酸。
图3描述了本发明的整合方法的实施方案。在图3中,在发酵反应器(101)中实施发酵步骤,其中所述发酵反应器提供有碳源和任选的通过图中未示出的管线提供的其它组分如营养物。在发酵步骤中,在发酵液中通过微生物使碳源发酵以形成羧酸,和通过加入镁碱使至少部分羧酸中和,从而获得羧酸镁。镁碱通过管线(3)加入。所述镁碱得自于热分解步骤产生的MgO。MgO可以原样提供,或者在图中未示出的步骤中在含水液体中形成浆液或者转化为氢氧化镁后提供。含羧酸镁盐的发酵液通过管线(102)提供给酸化步骤(103)。可以实施中间步骤如生物质脱除或浓缩,但图中没有示出。在酸化步骤(103)中,羧酸镁在含水环境中与HCl接触以形成包含羧酸和氯化镁的含水混合物。HCl通过管(10)提供,和得自于干燥步骤(7)。在图3所示的实施方案中,由干燥器(7)获得的包含HCl的气体物流通过管线(8)提供给吸收器(9),其中HCl在水中吸收以形成HCl溶液,后者通过管线(10)提供给酸化步骤(103)。也可能直接向酸化步骤(103)提供包含HCl的气体物流(8)。
通过管线(104)将包含羧酸和氯化镁的含水混合物提供给分离步骤(105)。分离步骤可以如上所述实施。当分离步骤(105)应用萃取剂时,通过图中未示出的管线提供萃取剂。分离步骤(105)将会产生含羧酸的流出物和氯化镁溶液。产品羧酸通过管线(106)抽出。氯化镁溶液通过管线(6)抽出,和按图(2)的相关内容所述进一步处理。
对于本领域熟练技术人员来说很明显的是,当热水解步骤并入转化氯化镁溶液的方法中时,各其方面也是可应用的。当转化氯化镁溶液的方法并入整合发酵过程中时,各其方面也是可应用的。
通过如下实施例描述本发明,但本发明不局限于或受限于实施例。
实施例
原料按如下制备:
MgCl2.6H2O:氯化镁六水合物商购获得。
MgCl2.4H2O:通过将氯化镁六水合物在130℃在烤箱中放置24小时而获得氯化镁四水合物。测量样品重量的减少,确认氯化镁四水合物的形成。
MgCl2.2H2O:通过在140℃下喷雾干燥氯化镁溶液而产生氯化镁二水合物。TGA测量证实所述氯化镁化合物包含至少80wt%的氯化镁二水合物。
MgCl2:无水氯化镁商购获得。
样品按如下测试:
将少量固体物料放置于带有多孔金属圆盘作基底的石英玻璃坩埚中。将在带有多孔金属基底的容器中的材料布置放置在连接至燃烧器的玻璃管中。应用抽吸泵将热气从燃烧器转移流过样品。在样品内设置温度传感器以记录温度,和通过控制抽吸泵的输送流量控制温度。
对于每种材料,在500℃和600℃下各实施一组实验。在指定的时间间隔后取样,并确定向氧化镁的转化率。结果示于表1和2。
表1:在500℃下的热分解–转化率
表2:在600℃下的热分解–转化率
由上表可以看出,MgCl2.6H2O在500℃和600℃下均发生熔化。而MgCl2在这些反应条件下在所述时间段内没有表现出任何向MgO的转化。MgCl2.4H2O和MgCl2.2H2O均明显转化为MgO。在500℃时,MgCl2.4H2O在10分钟后转化了80%,而在600℃下,2分钟后已经转化95%,5分钟后转化100%。对于MgCl2.2H2O,在500℃和600℃转化都很慢。这表明在较低的反应温度下MgCl2.4H2O比MgCl2.2H2O转化更快。
- 还没有人留言评论。精彩留言会获得点赞!