Sn-MOF复合材料与SnS2-C复合材料及其制备方法和应用
本发明涉及锂离子与钠离子电池电极材料技术领域,特别涉及一种sn-mof复合材料与sns2-c复合材料及其制备方法和应用。
背景技术:
二硫化锡(sns2)作为一种典型的层状双卤代化合物,理论上可以获得较高的比容量,然而在以纯二硫化锡作为锂离子/钠离子电池的负极基底材料时,其循环稳定性通常较差,原因在于材料在锂/钠脱嵌过程中体积膨胀非常严重,从而导致电极材料脱落、电池可逆容量急剧下降,这点在大电流充放电的情形下表现得更为突出,难以满足动力电池和储能电池所需的高能量密度要求。
中国专利文献cn104716311a中公开了一种二硫化锡纳米片复合材料及其制备方法,其先制备花状二硫化锡纳米片,将二硫化锡纳米片于油酸中浸泡后,在400-1000℃条件下加热碳化,得到无定形碳包覆的二硫化锡纳米片复合材料。采用上述复合材料作为负极基底材料的锂电池在低电流条件下的充放电性能表现较佳,表现出了良好的可逆性。应当指出的是,上述包覆在纳米片表面的无定形碳只能在一定程度上降低锂离子嵌/脱阻力,于低电流充放电过程中可以减少材料体积膨胀,但在大电流充放电条件下仍将面临电池可逆容量急剧下降的问题。中国专利文献cn111816860a中公开了一种包含硫化的镍金属有机框架的复合材料及其制备方法,其先制备圆片形的镍金属有机框架,然后对镍金属有机框架作硫化处理,最后将硫化的镍金属有机框架分散在硫代乙酰胺与五水合四氯化锡的乙醇溶液中,加热反应后在硫化的镍金属有机框架表面形成竖直生长的带状二硫化锡。理论上来说,通过镍金属有机框架限制sns2以避免其在充放电过程中过度膨胀可以对材料的电化学性能起到正面影响,遗憾的是,由于上述文献中的二硫化锡只是附着在镍金属有机框架表面,并未嵌入其中,有机框架在sns2体积膨胀时的限域作用有限,另外,上述包含镍金属有机框架的复合材料的制备步骤较为复杂,也不利于规模化生产应用。
技术实现要素:
本发明的目的之一是提供一种步骤简单的制备sn-mof复合材料的方法。进一步地,本发明还涉及用前述sn-mof复合材料为前驱体制备sns2-c复合材料的方法,以改善传统二硫化锡电极材料在充放电过程中离子/电子的传输速度以及因sns2体积变化而引起的材料结构坍塌问题,提高离子嵌入/脱出的可逆性和li+/na+的存储容量。
为了实现上述目的,本发明采用以下方案:sn-mof复合材料的制备方法,包括以下步骤;
1)取适量对苯二甲酸和一水合氢氧化锂溶于n,n-二甲基甲酰胺的水溶液中,得到无色透明溶液a,将溶液a置于40℃-60℃水浴中均匀加热;
2)称取适量硫酸亚锡溶于去离子水中,溶解后得溶液b;
3)将溶液b加入溶液a中,混合后得到混合液,将混合液在原水浴条件下继续加热并持续搅拌使其充分反应,反应完成后冷却至室温,收集反应生成的白色沉淀,得到微米级呈多孔六面体形状的sn-mof复合材料。
其中,所述n,n-二甲基甲酰胺的水溶液由n,n-二甲基甲酰胺与去离子水按1:1的体积比配制而成,所述对苯二甲酸、一水合氢氧化锂及硫酸亚锡的质量比为2:1:1.1。
进一步地,本发明还提供一种sn-mof复合材料,其采用上面所述的制备方法制备而成。
此外,本发明还涉及上述sn-mof复合材料在制备锂离子电池负极材料或钠离子电池负极材料中的应用。
在前述sn-mof复合材料的基础之上,本发明还涉及一种sns2-c复合材料的制备方法,通过采用双温区固相法对sn-mof复合材料进行硫化和碳化处理,处理完成后得到以微米级的多孔碳六面体为基体且于基体中镶嵌有sns2纳米片的sns2-c复合材料。
其中,采用双温区固相法对sn-mof复合材料进行硫化和碳化处理时:
将适量硫源置于1#温区,将sn-mof复合材料置于2#温区,1#温区和2#温区均分两个阶段进行升温和保温,1#温区和2#温区中均通入氩气保护,氩气由1#温区流向2#温区;
通过调整氩气流速以及1#温区和2#温区的升温速率、保温时间,使得在同一时间段内硫源产生含硫气体气体与sn-mof向sns2的转化这两个过程同步进行。
其中,以硫脲作为硫源,第一阶段氩气流速约为0.18sccm,第二阶段氩气流速约为0.2sccm;
1#温区第一阶段以2℃min-1的升温速率升温至250℃,保温3h,第二阶段以5℃min-1的升温速率升温至500℃,保温3h;
2#温区第一阶段以4℃min-1的升温速率升温至400℃,保温(3+x)h,第二阶段以2℃min-1的升温速率升温至500℃,保温3h,其中,x为第一阶段升温过程中1#温区与2#温区所耗费的时间的差值。
在本发明的一个实施例中,是在管式炉内对sn-mof复合材料进行硫化和碳化处理,1#温区位于管式炉上游,2#温区位于管式炉下游,管式炉的上游与下游之间通过隔热部件分隔,从而在管式炉内形成双温区。
进一步地,本发明还提供一种sns2-c复合材料,其是采用上面所述的制备方法制备得到。
最后,本发明还涉及上述sns2-c复合材料在锂离子电池负极材料或钠离子电池负极材料或超级电容器中的应用。
本发明在50℃左右的低温水浴条件下制备得到了微米级的呈多孔六面体形状的sn-mof复合材料,与现有的制备sn-mof复合材料的方法相比,本发明所采用的制备温度相对较低,反应过程安全性高且能耗低,更利于工业化生产应用。此外,本发明制备的sn-mof复合材料的微观形貌呈微米级的六面体形状,其表面相对光滑、内部有大量纳米级的微孔,上述形貌使得该sn-mof复合材料具有大比表面积,而大比表面积和多孔结构理论上会具有更高的离子容量,从而有利于提高电池能量密度,因此上述sn-mof复合材料具备用于作为电极材料的潜在应用价值。
此外,本发明还以上述sn-mof复合材料为基础,通过双温区固相反应制备了二硫化锡-碳(sns2-c)多孔六面体材料,以mof衍生的多孔碳作为基体并于其中镶嵌有sns2纳米片,多孔碳可以显著缓解sns2在充放电过程中体积变化引起的应力,从而形成稳定的sei层,减轻了sns2在充放电过程中引起的剧烈体积膨胀,也能提高导电性能、提供电子转移通道。通过循环伏安、恒流充放电等测试,显示上述sns2-c复合材料用作锂离子电池和钠离子电池的电极材料时,具有良好的电化学性能。
附图说明:
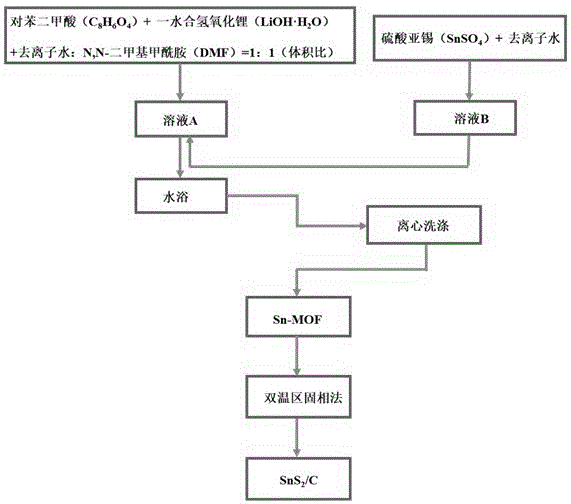
图1为sns2-c复合材料的制备流程图;
图2为对sn-mof复合材料进行硫化和碳化处理的示意图;
图3为sns2-c复合材料的xrd图;
图4中,(a)为sns2-c复合材料的xps全谱图,(b)、(c)、(d)分别为sn、s、c元素的高分辨扫描图谱;
图5中,(a)为sn-mof复合材料的fesem图,(b)为sns2-c复合材料的fesem图,(c)为sns2-c复合材料的tem图,(d)为sns2-c复合材料的hrtem图,(e)为sns2-c复合材料中s、c、sn的元素分布图和质量百分比;
图6为sns2-c复合材料的n2吸-脱附等温线和孔径分布图;
图7为sns2-c复合材料的tga曲线图;
图8中,(a)为不设置双温区时所得产物的xrd图谱,(b)为不设置双温区时所得产物的sem图,(c)为不设置双温区时所得产物的c、o、sn的元素分布图,(d)为不设置双温区时所得产物的edx图谱;
图9中,(a)为以2℃min-1的速率升温至250℃保温1h(硫化),再以2℃min-1的速率升温至550℃(碳化)以后所得产物的xrd图谱;(b)为以2℃min-1升温至400℃,保温4h所得产物的xrd图谱;(c)为以2℃min-1的速率升温至200℃,保温1h所得产物的xrd图谱;(d)为以2°min-1升温至250℃,保温2h(硫化),再以2℃min-1升温至500℃(碳化),保温3h所得产物的xrd图谱;
图10中,(a)为sns2-c复合材料作为锂离子电池负极材料时的循环伏安(cv)曲线图,(b)为sns2-c复合材料作为锂离子电池负极材料时的恒流充放电曲线图,(c)为sns2-c复合材料作为锂离子电池负极材料时,电流密度为0.1ag-1时的循环性能图,(d)为sns2-c复合材料作为锂离子电池负极材料时的倍率性能图,(e)为sns2-c复合材料作为锂离子电池负极材料时,电流密度为1ag-1时的循环性能图;
图11为100圈循环后sns2-c复合材料电极在100khz-100mhz频率范围的奈奎斯特图;
图12中,(a)为sns2-c复合材料作为锂离子电池负极材料时,在0.1-1.0mvs-1扫速条件下得到的cv曲线图,(b)为sns2-c复合材料作为锂离子电池负极材料时log(𝓋)和log(ip)的关系曲线图,(c)为sns2-c复合材料作为锂离子电池负极材料时,在1.0mvs-1扫速条件下的赝电容贡献和扩散贡献图,(d)为sns2-c复合材料作为锂离子电池负极材料时,不同扫速下的赝电容贡献率图;
图13中,(a)为lifepo4/sns2-c全电池示意图,(b)为电压窗口为1.0-3.7v,0.2ag-1电流密度时不同圈数的充放电曲线图,(c)为0.2ag-1电流密度下的循环性能图,(d)为0.2-1ag-1时的倍率性能图;
图14中,(a)为sns2-c复合材料作为钠离子电池负极材料时的循环伏安(cv)曲线图,(b)为sns2-c复合材料作为钠离子电池负极材料时的恒流充放电曲线图,(c)为sns2-c复合材料作为钠离子电池负极材料时的倍率性能图,(d)为sns2-c复合材料作为钠离子电池负极材料时,电流密度为0.1ag−1时的循环稳定性图,(e)为sns2-c复合材料作为钠离子电池负极材料时,电流密度为1ag−1时的循环稳定性图。
具体实施方式
为了便于本领域技术人员的理解,下面结合实施例对本发明作进一步的说明,实施例提及的内容并非对本发明的限定。需要提前说明的是,以下实施例是在实验室完成的,本领域技术人员应当明白,实施例中给出的各组分用量仅代表了各组分之间的配比关系,而非具体的限定。
一、sns2-c复合材料的制备。
总体制备流程见图1所示,主要包括两大部分,其一为sn-mof的制备,其二为sn-mof的的硫化和碳化处理。下面分别对上述两个部分进行详细说明。
1.1sn-mof的制备。
通过低温水浴法制备尺寸均匀的微米级sn-mof六面体。
首先,称取2.0g对苯二甲酸(c8h6o4)和1.0g一水合氢氧化锂(lioh·h2o)溶于体积比为1:1的n,n-二甲基甲酰胺(dmf)和去离子水混合液中,磁力搅拌溶解后得到无色透明溶液a,置于50℃水浴中均匀加热;称取1.1g硫酸亚锡(snso4)溶于20ml去离子水,磁力搅拌充分溶解后得溶液b,将溶液b逐滴于溶液a中,可以明显观察到溶液a在逐滴加入溶液b的过程中逐渐由无色透明变成乳白色。滴加完溶液b后混合液在50℃水浴条件下持续搅拌2h使其充分反应。待混合溶液冷却至室温后离心收集得到白色沉淀。随后用去离子水以及dmf反复离心洗涤三次收集最后的白色沉淀,最后在60℃真空环境中干燥24h即得sn-mof。
1.2sns2-c的制备。
由sn-mof向sns2-c的转化过程(硫化和碳化)通过双温区固相法实现。
按质量比5:1分别称取硫脲(ch4n2s)和sn-mof置于两个开放的反应容器中。如图2所示,将硫脲以及sn-mof分别放在管式炉的上游和下游。采用双温区的方式进行硫化以及碳化步骤,整个流程都在氩气(ar)保护气氛下进行,氩气从上游流向下游。通过在管式炉玻璃管中央放上隔热塞(隔热塞应当能够让氩气通过)达到双温区效果。具体的温度设置方法为:上游第一阶段以2℃min-1左右的升温速率升温至250℃左右,保温3h,在第二阶段以5℃min-1左右的升温速率升温至500℃左右,保温3h;下游在第一阶段以4℃min-1左右的升温速率升温至400℃左右,保温(180+x)min(x为第一阶段升温过程中上游与下游相差的时间),在第二阶段以2℃min-1左右的升温速率升温至500℃左右,保温3h。其中第一个升温阶段将氩气流速控制为0.18sccm左右,第二个升温阶段开始流速调整为0.2sccm左右。设置双温区的目的在于使得sn-mof的硫化温度与硫脲产生硫化氢(h2s)的温度大致处于同一时间段内,即预留出足够的硫化时间,当上游的硫脲产生了h2s气体后,随着气流到达下游,从而使得sn-mof被h2s充分硫化。
二、产物的形貌与结构表征。
通过xrd、sem和tem等分析手段对产物的结构和组成进行分析。
由图3可知,样品的xrd谱图和目前已知的硫化锡材料的标准衍射图谱相匹配,在14.969°、28.139°、32.064°、41.826°和49.900°的衍射峰分别属于sns2(pdf#23-0677)的(001)、(100)、(101)、(102)和(110)晶面。
采用xps检测方法对样品进行化学组分及样品纯度分析的结果见图4所示,从产物材料的全谱图(a)可看出,除了空气中吸附的o杂质峰及mof衍生的多孔碳中c峰之外,只有s和sn的两个峰,且o峰强度极小,推断应该是由于产物暴露于空气中空气时间过长导致。此外,观察不到任何其它杂质峰的存在,这一点进一步证实了产物的高纯性。图4(b)中sn3d光谱图中显示了结合能为494.8ev、486.4ev处的峰,对应的是sn3d3/2、sn3d5/2,由此可证明合成的锡基硫化物中存在的是sn4+,而不属于其他价态。图4中(c)所示s2p谱中位于161.4ev和162.6ev结合能处的xps峰分别对应到s2p3/2和s2p1/2,说明s2-离子的存在。在图4(d)中,在s2p164.9ev和163.8ev结合能处和c1s光谱中285.2ev结合能处均存在c-s键,表明一定量的s可能被掺杂到sns2-c材料中的介孔碳上。推测是因为在sns2的分解过程中,sn-s键断裂,形成硫(蒸气),导致s掺杂到介孔碳中形成了c-s键。由此形成的内部缺陷,会以另一种形式提高sns2-c复合材料的电导率,进而改善sns2/c电极的电化学性能。最终的检测结果表明sn元素与s元素所分别对应的结合能与sns2中两种元素的结合能总体上是一致的,与现有技术中sns2的拉曼特征峰一致,证实了所产物中sns2的存在及其sn元素与s元素的价态,排除了其他snsx存在的可能性。
sem和tem表征了样品的形貌和微观结构,图5中(a)和(b)分别为前驱体sn-mof和最终产物sns2-c的sem图。从图5中(a)可以看出sn-mof是由相对光滑的直径约为1-3μm的六面体组成。结合图5中(b)可以看出,经过硫化及碳化处理后,得到的sns2-c形貌与前驱体基本一致,很完整的保留了sn-mof前驱体的六面体形貌,总体上并没有实质上的改变。与sn-mof前驱体不同的是,sns2-c材料中产生了sns2纳米片,sns2纳米片均匀嵌入到了mofs衍生的六面体碳基体中。采用透射电子显微镜(tem)对硫化后得到的产物sns2-c进行进一步研究。从图5中(c)可以清晰看出每个纳米片是穿插在介孔碳骨架中的,这与sem图像一致,并且聚簇状sns2纳米片与碳骨架穿插在一起,依旧能看出碳基体是存在孔洞结构的,并不是密实的。通过hrtem手段进一步的检测了sns2纳米片的晶面,从图5(d)中可以看到0.216nm的晶格间距对应的二硫化锡的(102)晶面的清晰的晶格条纹,另一个晶面间距为0.279nm的晶面与(101)平面对应。由图5(e)的edx测试结果可知c、sn、s元素保持着均匀的分布,s/sn的原子比为2.03,进一步说明了sns2的形成。
图5中(c)为高倍数的tem图,从图中也可以看出sns2-c六面体虽然表面光滑但是内部存在多孔结构,且在碳基骨架内部均匀分布。为进一步探索多孔结构性质,使用氮气吸脱附测试sns2-c材料的比表面积和孔隙率。如图6中所示,sns2-c材料的氮气吸-脱附等温线表现出了典型的iv型等温线,表明了该样品的介孔性质。bet结果表明sns2-c材料比表面积约为30.1915m2g−1,平均孔径为12nm,而从sns2-c材料的孔径分布图中可以看出,分布在2nm和4nm处的孔径出现峰值(sns2-c材料的平均孔径分布在介孔区),其中存在大量直径为1.3nm以及3.6nm左右的小孔。sns2-c材料的大比表面积和孔结构都能促进锂离子进入纳米片两侧的孔洞或其它纳米结构。
为进一步确定sns2纳米片的含量,对样品进行了热重测试(图7)从tga曲线可以看出,sns2-c材料的失重曲线随温度的升高呈现出以下几个区域的失重:200℃以下温度区间的失重是由材料中吸附水随温度升高而蒸发引起的;在200-450℃的失重,可归因于sns2向sno2的转化;而450-600℃的失重是因为碳骨架的分解。tga曲线表明sns2-c纳米复合材料中的碳含量约为12.6%。
上述检测结果表明,在管式炉分段加热的条件下,通过简单的固相法,完成了由sn-mof向sns2-c的转化。sns2以纳米片的形式均匀的嵌入到碳骨架中,并且由于mof经过碳化后衍生成多孔碳,形成了介孔结构。这一结构能在sns2充放电过程中引起体积膨胀时起到一定的限域作用,将对后续的电化学性能产生重大影响。
三、其它反应条件及相应产物的检测和表征。
首先,应当指出的是,上述制备过程中最终能获得较纯的sns2物相的关键步骤在于双温区的硫化过程。固相反应过程中的硫化步骤差异对于最终产物物相的影响在下面会进行详细分析,并采用xrd物相分析分别对不同的反应温度以及不同的温度设置方式下的产物物相进行分析,同时对不设置双温区(上下游)时所制备的材料作sem检测,观察其形貌与元素的变化和特征。
例如在上下游采用同样温度条件进行硫化和碳化,所得到的结果就会完全不同的。在其他条件完全相同的情况下,上下游不设置温差所得到产物的xrd结果见图8中(a)所示,通过与标准pdf卡片比对可知,测试结果中的xrd图谱显示的峰能很好的对应到sn单质与li2sno3,但是从图谱中并未观测到snsx的峰,说明硫化过程并未成功。产物中li元素来源于制备过程中用到的lioh·h2o,最终的产物中还残留有li元素,推测原因可能是制备时的水解过程未进行完全,导致在随后的离心洗涤步骤完成后li未被洗净。最后的物相中有sn单质而未出现锡基氧化物,此现象可归因于碳化过程中碳化温度的设定。sn单质的产生是由于不同的碳化温度会产生sno2、sno以及sn中的不同物相。这都是歧化反应:sno⇌sno2+sn引起的结果。当温度大于500℃时,此反应朝着正反应进行,产物主要是sno2与sn,并且还会伴随着sno2向sn的转化,因此在这两个反应存在的情况下,最终反应产物几乎只剩下sn单质。相反,当反应温度低于500℃时,歧化反应偏向于逆反应进行,所以最终的产物只有sno。用同样的硫源进行硫化却未得到所需的物相,这是硫源(硫脲)未在有效的硫化温度将sn-mof进行硫化导致的,而并不是因为硫源在所设置的温度区间内未能产生h2s气体。硫脲产生h2s气体的温度大概在300℃左右,但sn-mof向sns2的转化反应需要更高的温度。这也就意味着硫脲产生h2s气体必须与sn-mof向sns2的转化处于同一时间段内。从而也就只有通过调整升温速率使得在同一时间段内硫脲产生h2s气体和sn-mof向sns2的转化这两个过程同步进行,才能成功制备出较纯的sns2物相。图8中(b)为上述不设置双温区时所得产物的sem图。总体上来看,碳骨架不受温度设置形式的影响,设置双温区和不设置双温区的固相反应过程并不会改变碳骨架的六面体结构,同样形貌均匀,尺寸仍在3-5μm左右。唯一不同的是,在不设置双温区的反应方式所得产物中,与碳骨架复合的是颗粒状的物质,这与sns2的片状形貌不同。这些颗粒尺寸大小各异,图中能看出碳骨架表面有微米级的小球,也有纳米级尺寸的颗粒,能确定的是颗粒表面是很光滑的,并且没有观察到裂痕,这也证明碳骨架在整个反应过程中并不不会阻碍到其内部与表面的锡基材料的生长。图8中(c)为产物中sn/li2sno3/c材料的元素分布图,可以看出sn、o、c元素是均匀分布的。图8中(d)为该材料的edx图谱,mapping结果显示了o、sn、c元素的存在。
接下来通过设置不同的反应温度对产物物相进行分析,结果如图9所示。图9中(a)为以2℃min-1的速率升温至250℃保温1h(硫化),2℃min-1的速率升温至550℃(碳化)以后所得产物的xrd图谱。从图谱中明显看出峰很杂,物相不纯,主要出现了sn单质、li2sno3和sns这三个物相。由于碳化温度大于500℃,所以最终产物的物相中没有sno或sno2,只有sn单质。出现了sns物相,但不全为sns,推测原因可能是硫化时间过短,硫化不完全。图9中(b)为2℃min-1升温至400℃保温4h所得的产物,物相分析结果显示产物中主要存在sno2、sno和sns三种物相,与前几种制备方法不同的是,其只有一次升温过程,而且由于温度上限只到了400℃,所以最终产物的物相中并没有发现单质sn的存在。这也再一次验证了前面所说的温度位于500℃以上与500℃以下对产物的影响。图9中(c)显示的是以2℃min-1的速率升温至200℃保温1h产物的物相分析结果,主要的峰对应的是sno2物相,推测前驱体并未经过硫化过程。图9中(d)为以2°min-1升温至250℃,保温2h,再以2℃min-1升温至500℃,保温3h后得到的结果,xrd图谱中显示存在sns、sno和sn这些物相。综上所述,在不设置双温区的情况下,得到的产物物相都不纯,甚至完全检测不到锡基硫化物的存在。由此可以说明双温区的策略对于sns2-c的制备是可行且必要的。
四、产物的储锂性能测试。
步骤二中制备得到sns2-c复合材料的电化学测试结果如图10所示。通过循环伏安(cv)测试分析其储锂机制:电压范围为0.01-3v,扫速为0.1mvs-1,循环3圈,测试结果见图10中(a)所示。首圈循环后,负向扫描过程中,在1.24v和1.50v位置附近出现2个不可逆还原峰,反应了两个不可逆过程:第一,锂插入sns2层而不发生相分解;第二,sns2被转化为金属sn和li2s,在这一过程中还伴随着固体电解质界面膜(sei)的形成。在0.8v位置处形成第三个还原峰,这是因为sn和li的合金化产生的。在随后的循环中1.24v处的还原峰逐渐消失,剩下0.85v与1.3v附近的两个还原峰正向扫描后,在0.60v、1.0v、1.77v以及2.3v处的位置附近出现了氧化峰,主要是产生于锡锂合金的去合金化过程和逆转化生成sns2的过程,还包括锂从sns2层插入/脱嵌这一个部分可逆的过程。
图10中(b)为100mahg-1电流密度下的恒流充放电曲线,由图可知首圈充放电比容量分别为1121.6mahg-1和1879.6mahg-1,由于该材料为碳与sns2复合而得,其充放电曲线中的平台并不明显,在1.24v附近出现放电电压平台,对应于首圈的还原峰。随后第2圈,第3圈的充放电曲线基本重合,表明sns2-c电极在开始的充放电曲线测试中,电极具备较好的重现性。整个充放电过程的储锂机制可用下列公式表示:
为进一步检测产物的电化学性能,在0.1ag-1、0.3ag-1、0.5ag-1、1ag-1这几个电流密度下对sns2-c电极进行了倍率性能测试,如图10中(d)所示。在电流密度为0.1ag-1,经10次循环后,其可逆容量稳定维持在1147mahg-1左右。当电流密度分别提高到0.3ag-1和0.5ag-1并经过10个循环后,sns2-c电极的可逆比容量分别能保持在800和750mahg-1左右。即使在1ag-1的高电流密度下,循环10圈后电极的可逆比容量仍保持在500mahg-1左右,最终回到0.1ag−1电流密度时仍能保持900mahg-1左右的比容量。从sns2-c材料的倍率性能图中可以看出随着电流密度由100mag-1增至1ag-1,充放电比容量分别由1034.7mahg-1和1068.4mahg-1降至499.6mahg-1和510.2mahg-1。由比容量随电流密度变化的曲线图可以看出,曲线比较平稳,随着电流密度的增加,比容量呈阶梯状下降。由此看出sns2-c材料具备较好的倍率性能,原因可能是材料中介孔碳的存在,提高了材料的导电性,使其具备较好的高倍率性能。此外,也表明sns2-c能够在经历大倍率的循环后仍能保持其结构完整性基本上不被破坏,得益于sns2-c材料的介孔结构,对充放电性能也有提高的作用。
图10中(c)显示了在电流密度为0.1ag-1时,sns2-c电极的充放电循环图。首圈充放电的放电比容量达到了1880mahg-1。在经过充放电循环100圈后,可逆比容量能维持在833mahg-1左右,库伦效率为98.28%。整个循环过程中容量无大的波动,曲线较为平缓。在相同的电流密度下充放电循环同样的次数后,对比于纯sns2材料的性能,sns2-c有更高的充放电比容量,容量损失率较低,具有更加突出的电化学性能。由此可说明介孔碳骨架的引入可以有效抑制材料在脱嵌锂反应中的体积膨胀,碳材料的存在也提高了材料的导电性,有利于保持材料的稳定性。当电流密度为1ag-1对电池进行充放电循环时,首圈放电比容量为1098.3mahg-1和181.6mahg-1。100圈充放电循环后的充放电比容量为363.4mahg-1和371.4mahg-1,库伦效率稳定在98%左右。由此看来,作为锂离子电池负极材料,sns2-c比纯sns2电极具有更佳的循环稳定性。尤其是在较长循环充放电的情况下,sns2-c电极在循环稳定性方面体现出的优异性更为明显。主要原因为sns2-c结构中含有片状sns2所缺失的介孔成分。在长时间的充放电循环过程中,纯sns2电极由于锂的反复嵌-脱过程,造成体积膨胀严重,结构坍塌,电极材料粉化,对电池的长循环性能造成致命性的影响,而通过将mof衍生多孔碳的引入,在很大程度上缓解了体积膨胀问题。
综合上述测试结果可知,得益于mof衍生多孔碳和sns2纳米片之间的协同效应,大大提高了sns2-c复合材料的储锂性能,结构良好的sns2纳米片缩短了锂离子的扩散路径,为锂离子的储存提供了大量的活性位点,而循环稳定性方面的优异性能表明mof衍生多孔碳的有效作用,这个有效作用可以从以下三个方面解释:1、介孔网络使锂离子更容易到达活性位点,并最大限度地减少电极与电解质之间的传输距离。2、mof衍生多孔碳具有的大比表面积和有序通道,既能提供充分的空间减缓体积变化,又能阻碍sns2的团聚。3、多孔碳作为导电基体,可以作为一种电子传输途径,提高sns2-c复合材料的导电性。
此外,电化学阻抗测试(eis)的结果也说明了所合成的sns2-c材料具有出色的储锂性能。如图11所示,循环前的eis图谱包含高频区的半圆和低频区的直线,分别对应电荷转移电阻和li+的扩散过程,sns2-c电极的锂离子电解液阻抗(rs)和界面电荷转移电阻(rct)能稳定在一个较低的水平。图11中插图为等效电路图,在锂离子电池中循环之前,rct的值分别为15和120ω(振幅为5mv,范围为100khz~10mhz)。
为了更好地了解sns2/c电极的优异电化学性能的动力学机制,下面利用不同扫速的cv测试对sns2/c电极进行赝电容计算。采用0.1、0.2、0.4、0.6、0.8和1mvs-1的不同扫描速率下对sns2/c电极进行循环伏安法(cv)测试。从图12中(a)可以看出,随着扫描速率的增加,不同扫描速率下得到的cv曲线形状相似,随着扫描速率的增加,峰值有轻微的偏移,这一结果表明在高扫描速率下电极具有的动力学性能良好和极化低的特点。
通常认为,具有高比表面积和复杂结构的材料一般具有较高的外部赝电容贡献。测量到的电流(i)与相应的扫描速率(𝓋)之间的关系可以用下列公式来描述:
其中a和b是两个可调参数,𝓋是扫描速率(mvs-1),ip是不同扫描速率下的峰电流值(ma)。储存机制可以通过b的值的范围来区分,其中b值为将log(𝓋)与log(ip)分别作为横纵坐标后拟合得到的直线斜率。如果b值为0.5,电极材料表现为电池属性,过程为扩散控制;如果b的值处于0.5-1范围内,电极材料表现为电池属性和赝电容属性;如果b的值≥1,则可以说明电极反应为一个电容性过程,电极材料表现为赝电容属性。图12中(b)示出了不同的锂离子存储机制对应的b值在0.5-1之间变化。峰1、2、3为电极cv曲线的氧化峰,峰4为还原峰,这四处的峰电流对应的b值分别为0.954,0.743,0.730,和0.791,由此可以说明sns2-c电极的动力学主要由表面电容控制,即sns2/c电极的储锂过程主要是赝电容行为。图12中(c)为1.0mvs−1扫速条件下的赝电容贡献率,计算得到的电容贡献率78.5%。图12中(d)显示了0.1、0.2、0.4、0.6、0.8mvs−1几个扫速下对应的电容贡献率分别为52.2%、62.5%、68.2%、72.3%、75.6%。由此可看出,赝电容行为的容量贡献会随着扫描速率的加快而增加,在一定范围内,扫速越快,赝电容行为的贡献比例就越大。已有研究表明,在高的扫描速率下,赝电容行为占据了主导地位,这有利于li+快速地嵌入/脱出。较高的赝电容容量赋予了sns2-c优异的倍率性能和杰出的循环稳定性,同时也使之拥有应用于超级电容器的潜力。
为了进一步论证上述sns2-c电极的潜在实际应用价值,如图13中(a)所示,通过选用商用lifepo4材料作为正极组装锂离子全电池。在进行全电池电化学性能测试之前,先将sns2-c为负极材料组装成的锂离子半电池预嵌锂,此过程是为了补偿初始阶段的充放电过程中负极形成的sei膜后造成的锂损失。
对于全电池而言,化成(达到电池活化的目的)时负极界面形成的sei膜会消耗掉从正极脱嵌的锂离子,并降低电池的容量。如果从正极材料外再寻找到一个锂源,让sei膜的形成消耗外界锂源的锂离子,这样就可以保证正极脱嵌的锂离子不会浪费于化成过程,最终就可以提高全电池容量。这个提供外界锂源的过程,就是预锂化。
预嵌锂过程以半电池的组装方法通过选用金属锂片作为负极,而所研究的材料置于正极的位置,将充放电过程设置先放电再充电,最终停留在充电结束后静置的状态,目的为使所研究的负极材料经过预嵌锂步骤后处于几乎无锂的状态,从而在后续作为全电池负极材料时能提供充足的空间容纳来自于正极材料的锂离子。
预嵌锂过程采用200mag-1的电流密度充放电循环5圈。为了保证能够充分利用sns2-c电极,按lifepo4与sns2-c电极的容量比约为1.2:1组装全电池。保证正极材料处于过量的状态。由于正极的活性物质是过量的,因此全电池的容量只以负极sns2/c活性物质的质量为基准计算。图13中(b)示出了电压窗口为1.0–3.7v,电流密度为200mag-1时,锂离子全电池分别对应的第2,第11以及第41圈的恒流充放电循环曲线。由图可知第11与第41圈的充放电曲线接近,几乎重合,表明全电池具有优秀的循环稳定性能。从图13中(c)可以看出,在电流密度为0.2ag-1时全电池显示出良好的循环稳定性,库仑效率高达96%左右,而前几个循环中是由于形成了sei层,所以库仑效率相对较低,在经过50圈恒流充放电循环后,可逆比容量保持在275.6mahg-1左右。全电池的倍率性能测试结果如图13中(d)所示,电流密度分别为0.2、0.4、0.8、1.0和0.2ag-1时对应的放电比容量分别为559.3-373.4,367.8-328.2,325.2-287.5,285.3-265.7和264.7-272.1mahg-1。良好的倍率性能归因于sns2-c电极中sns2纳米片的小晶粒尺寸、较高导电性的mof衍生的多孔碳质基体以及层状结构的sns2中良好的锂离子扩散能力。
五、产物的储钠性能测试。
以sns2-c作为钠离子电池负极材料,测试其电化学性能,测试结果如下:
在0.01-3.0v(vs.na+/na)电位范围内测试sns2-c作为钠离子半电池负极材料的电化学性能结果见图14所示。采用循环伏安法(cv)表征sns2-c的储钠行为,扫描速率为0.1mvs−1,循环3圈,cv曲线结果如图14中(a)所示,在初始扫描曲线中,大约1.7v处的还原峰可能是由于na+插入sns2层间形成了nasns2(反应式4-7)。在随后的cv曲线中,峰变得非常弱,表明这一反应几乎是不可逆的。此外,在0.65v左右的宽峰主要与sei膜的形成、锡的转化反应(反应式4-8)和锡钠的合金反应(反应式4-9)有关。可以看出,3次循环的阳极扫描曲线基本一致。在随后的氧化反应中,对应的曲线分别在约0.63v、1.22v和2.20v处出现了四个峰,在0.63v出峰值的出现与可逆脱合金反应有关,而1.22v、和2.20v左右出现的氧化峰与na15sn4合金的脱合金和转化反应有关。此外,除第一个循环外,第二和第三个循环的cv曲线基本重合,说明在后续的电化学循环中,sns2/c电极具有良好的循环可逆性。
sns2-c的第1、第10以及第99个循环的充放电曲线图如图14中(b)所示。从图中可以看出,在100mag-1的小电流下,首圈放电比容量和充电比容量分别为1145.0mahg-1和503.1mahg-1。
经过100mag-1小电流3个循环的活化后,对sns2-c进行了一系列不同电流密度的倍率性能测试,sns2-c电极作为钠离子电池负极材料时的倍率性能测试结果见图14中(d)所示。测试电流密度大小设置为100mag-1到1ag-1。其中,100mag-1、300mag-1、500mag-1以及1ag-1的电流密度下,分别经过10圈循环后放电容量分别为462.8mahg-1、345.6mahg-1、292.3mahg-1、223.9mahg-1,当电流密度回到1mag-1时,放电容量为461.9mahg-1。此外,从图14中(c)可看出在100mag-1的小电流下,100次循环之后可逆容量基本稳定在249.6mahg-1左右,同时,库伦效率都维持在98%左右。见图14中(e)所示,当电流增至1ag-1时,首圈放电容量为927.5mahg-1,100次恒流充放电循环后,sns2-c电极的可逆容量能维持在228.1mahg-1,库伦效率保持在98%左右。
综上所述,在本实施例中,通过低温水浴法成功合成了形貌均匀的六面体sn-mof,随后通过采用双温区的方式,于管式炉上下游形成温度差,使得经过固相反应后顺利将sn-mof硫化并碳化,得到了含有介孔结构,且sns2纳米片均匀镶嵌于多孔碳骨架中的六面体sns2-c复合材料。bet测试证明了其介孔的存在。通过cv测试、循环伏安测试以及倍率性能测试结果表明:
(1)sns2-c用于锂离子电池负极材料时,在0.1ag-1的电流密度下,首圈放电比容量高达1880mahg-1,循环100圈后仍能保持833mahg-1的可逆比容量;而在1ag-1的高倍率电流下循环100圈,依旧有363mahg-1的可逆比容量,表现出不错的电化学性能。
(2)sns2-c纳米片用于钠离子电池负极材料时,0.1ag-1的电流密度下具有1145mahg-1的初始放电比容量,经过100次充放电循环后保持了249.6mahg-1的可逆容量;而在1ag-1的电流密度下首圈放电比容量为927.5mahg-1,循环100圈后可逆比容量为228.1mahg-1,库伦效率保持在98%左右,同样表现出较佳的电化学性能。
作为锂离子或者钠离子电池负极时,相比于纯的sns2电极,具有介孔结构的sns2-c在长循环过程中表现出更优异的性能,主要得益于介孔结构能缓解锂/钠脱嵌过程中产生的体积膨胀,更能保持电极结构完整性,减小结构坍塌,从而呈现出相对较小的容量损失。
上述实施例在低温水浴(50℃左右)条件下制备了微米级的呈多孔六面体形状的sn-mof复合材料,sn-mof复合材料的制备反应温度较低,反应过程安全性高且能耗低。以上述sn-mof复合材料为基础,在上述实施例中还创造性地采用双温区固相法制备了mof衍生多孔碳框架与sns2纳米片嵌合的复合材料——sns2-c,sns2-c复合材料的总体制备工艺流程较短并且简易可行,适于规模化生产应用。
上述实施例为本发明较佳的实现方案,除此之外,本发明还可以其它方式实现,在不脱离本技术方案构思的前提下任何显而易见的替换均在本发明的保护范围之内。
最后,应该强调的是,为了让本领域普通技术人员更方便地理解本发明相对于现有技术的改进之处,本发明的一些描述已经被简化,并且为了清楚起见,本申请文件还省略了一些其它元素,本领域技术人员应该意识到这些省略的元素也可构成本发明的内容。
- 还没有人留言评论。精彩留言会获得点赞!