一种储能设备、锂锰氧化物及其制备方法和应用与流程
1.本技术涉及电池领域,具体而言,涉及一种储能设备、锂锰氧化物及其制备方法和应用。
背景技术:
2.在众多的电池储能技术中,锂离子电池以较高的能量密度、较长的循环使用寿命和对环境较低的污染等优势而备受关注。近年来,锂离子电池已经被广泛应用于各种消费类电子产品,并被作为未来大规模储能发展的关键技术。
3.作为锂离子电池的关键组成部分,正极材料对锂离子电池的发展起着至关重要的作用。
4.当前商用化的锂离子电池正极材料主要以含钴的氧化物(例如钴酸锂/licoo2)为主。然而,钴元素较高的成本直接限制了锂离子电池在智能电网、电动汽车等大规模储能领域的应用。
5.虽然以磷酸铁锂和锰酸锂为代表的正极材料具有成本优势,但是其能量密度相对较低,仍然难以满足大规模储能技术对能量密度的日益增长的需求。
6.因此,开发低成本且具有高能量密度的正极材料对推动锂离子电池在大规模储能领域的应用至关重要。
技术实现要素:
7.本技术提供了一种储能设备、锂锰氧化物及其制备方法和应用,其具有大的能量密度。
8.本技术是这样实现的:
9.在第一方面,本技术的示例提供了一种具有锂缺陷的锂锰氧化物的制备方法,并且该制备方法包括:提供前驱体,前驱体含有钠锰氧化物和锂源,且钠锰氧化物中含锂元素;在氧化性气氛中,以选定的第一升温速率将前驱体加热至第一预设温度进行煅烧、随后冷却;其中,煅烧过程通过固相的熔盐反应使钠锰氧化物中的钠元素通过离子交换的方式被替代为来自于锂源中的锂元素。
10.其中的“锂缺陷”可以通过锂锰氧化物的化学通式li
x
mny(tm)zo2中的锂的取值而体现,如x《1,或者通过锂和氧的化学计量比的比值x/2小于0.5而体现。其中tm表示不是锰的过渡金属元素。
11.根据本技术的一些示例,冷却方式为自然冷却或以选定的第一降温速率的受控冷却。
12.可选地,制备方法还包括在以选定的第一升温速率将前驱体加热至第一预设温度进行煅烧、随后冷却之后实施的下述步骤:水洗并将水的难溶物干燥。
13.根据本技术的一些示例,钠锰氧化物由锂化合物、钠化合物、锰化合物和可选的过渡金属氧化物制作而成;可选地,钠锰氧化物由锂化合物、钠化合物、锰化合物和可选的过
渡金属氧化物在混合状态下固相烧结而成;可选地,锂化合物、钠化合物、锰化合物和可选的过渡金属氧化物的混合方式是粉末混合或者粉末混合且被压制为片状;可选地,锂化合物、钠化合物、锰化合物和可选的过渡金属氧化物的混合方式是粉末混合且在2mpa-20mpa的压力下被压制为片状;可选地,钠锰氧化物由锂化合物、钠化合物、锰化合物和可选的过渡金属氧化物以选定的第二升温速率加热至第二预设温度进行煅烧、随后冷却制作而成;其中,过渡金属氧化物中的过渡金属元素包括钛、锆或铌且不含锰。
14.根据本技术的一些示例,钠锰氧化物由锂化合物、钠化合物、锰化合物和可选且不含锰的过渡金属氧化物按照下述摩尔比配料:li:na:mn:tm=x:y:1-x-z:z;其中,0.18≤x≤0.2,0.5《y≤0.65,0≤z≤0.05,tm表示可选且不含锰的过渡金属氧化物中的非锰的过渡金属元素。
15.根据本技术的一些示例,锂化合物包括lioh、li2co3、li2o2或li2o;和/或,钠化合物包括naoh、na2co3、na2o2或na2o;和/或,锰化合物包括mnco3、mno2、mnooh、mno、mno2;和/或,过渡金属氧化物包括tio2、zro2或nb2o5;
16.可选地,钠锰氧化物由锂化合物、钠化合物、锰化合物和可选的过渡金属氧化物以2℃/min至5℃/min的升温速率升温至650℃至1000℃的温度烧结而成;可选地,烧结时间为12小时至24小时;可选地,烧结后冷却。其中的冷却方式可以是自然冷却,也可以是具有选定的第二降温速率的受控冷却;其中的第二降温速率为10℃/min-15℃/min。
17.根据本技术的一些示例,锂源包括硝酸锂和氯化锂,可选地,硝酸锂和氯化锂的摩尔比为88:12;可选地,钠锰氧化物与锂源的按照na:li的摩尔比为1:10的方式配料;可选地,第一升温速率为2℃/min至10℃/min,第一预设温度为250℃至350℃;可选地,以选定的第一升温速率将前驱体加热至第一预设温度进行煅烧的步骤中,在第一预设温度下煅烧时间为2小时至6小时;煅烧后可以选择在第一降温速率下进行冷却。示例的第一降温速率为10℃/min-15℃/min。
18.在第二方面,本技术的示例提出了一种锂锰氧化物。该锂锰氧化物为第一组分或第二组分纯相;或者,锂锰氧化物是第一组分和第二组分构成的复合相;其中,第一组分具有带状超晶格结构,化学式为li
x1
mn
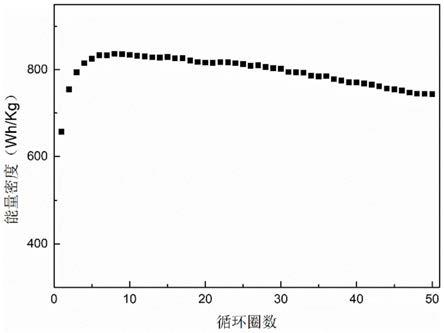
y1
o2,其中,x1,y1的取值符合电荷平衡,且0.75≤x1≤0.8,0.75≤y1≤0.8;第二组分具有带状超晶格结构且具有非锰的过渡金属元素,化学式为li
x2
mn
y2
(tm)zo2,其中,x2,y2,z的取值符合电荷平衡,且0.75≤x2≤0.8,0.75≤y2≤0.8,0《z≤0.05,tm表示过渡金属元素并通过对li
x1
mn
y1
o2中的mn元素进行部分的掺杂取代而引入,且部分的li元素通过对li
x1
mn
y1
o2中的mn元素进行部分的掺杂取代而引入。
19.在第三方面,本技术的示例提出了一种锂锰氧化物在储能设备中的应用。
20.根据本技术的一些示例,储能设备包括移动设备、电动车、分布电站、后备电源或通信基站的储能设备。
21.根据本技术的一些示例,储能设备包括电池;可选地,储能设备为锂离子电池;可选地,储能设备为锂离子二次电池;可选地,锂锰氧化物作为锂离子电池的正极材料。
22.在第四方面,本技术的示例提出了一种储能设备,其包括电池,且电池的正极活性物质含有上述的锂锰氧化物。
附图说明
23.为了更清楚地说明本技术实施例或现有技术中的技术方案,以下将对实施例或现有技术描述中所需要使用的附图作简单地介绍。
24.图1示出了本技术实施例2中的锂锰氧化物的x射线衍射图和带状超晶格结构高分辨原子像;
25.图2示出了本技术实施例2提供的锂锰氧化物正极材料在20ma/g电流密度下的放电比容量循环性能图;
26.图3为本发明实施例2提供的锂锰氧化物正极材料在20ma/g电流密度下的放电能量密度循环性能图。
具体实施方式
27.作为一类重要且具有巨大的发展潜力的锂离子电池正极材料,锰系材料具有原料丰富、污染小、价格低、过充过放性能佳、热稳定性好等优点。
28.在锰系锂离子电池正极材料中,层状的锂酸锰(limno2)的研究和应用较多。为了改善这一类型的锰系正极材料的性能,在实践中可以对其通过掺杂调整组分构成而实现改性。然而,上述方式对仍存在一些缺陷,例如其性能有待进一步提高。
29.具体而言,在示例中,发明人提出了一种可以作为锂离子电池的正极材料的具有带状超晶格结构的锂锰氧化物。该锂锰氧化物主要涉及组分、工艺以及微观结构方面的改进。并且,为了便于本领域技术人员实施该方案,示例中还提出一种制作该产品的合成方法。通过进一步的实验表明:该材料具有较高的可逆比容量和较好的循环稳定性。另外,突出的是,该材料还具有较低的制作成本(包括制作原料的低价易获得)。
30.从组分上而言,本技术示例中的该锰系材料使用除锰之外的过渡金属元素进行掺杂改性;从微观结构上而言,通过结合其组分和制作工艺而获得了带状超晶格结构。
31.下面将结合实施例对本技术的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本技术,而不应视为限制本技术的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
32.以下针对本技术实施例进行具体说明。
33.在本技术的示例中,发明人提出了一种锂锰氧化物;其包括锂元素、锰元素、氧元素以及可选的非锰的过渡金属元素。该锂锰氧化物属于具有锂缺陷的锰基正极材料。
34.从化学通式上而言,该锂锰氧化物可以被表示为li
x
mny(tm)zo2。其中,li表示锂元素,mn表示锰元素,tm表示非锰的过渡金属元素(tm所表示的过渡金属元素例如是ti、zr或nb),o表示氧元素。x,y,z的取值符合电荷平衡,即满足该锂锰氧化物中的各元素的化合价之和为零。在本技术示例中,上述x、y和z的取值为:0.75≤x≤0.8,0.75≤y≤0.8,0≤z≤0.05。其中,当z取值为零时,则该锂锰氧化物是由锂元素、锰元素和氧元素构成的具有带状超晶格结构的材料。锂锰氧化物中锰元素具有高的化合价位,例如示例中其(平均)化合价可以达到+4价。
35.该锂锰氧化物具有带状的超晶格结构,并且由于锰元素也属于过渡金属元素,因此从晶胞结构而言,该材料具有可以按照层状结构的方式描述的晶胞结构。该晶胞结构中
具有锂离子层、过渡金属层和氧原子层的结构。且其中的锂层与过渡金属层交替排布,形成的层状结构。因此其可以表示为[li
x1
][li
x2
mnytmz][o2];其中[li
x1
]表示锂离子层,其中[li
x2
mnytmz]表示过渡金属元素层,[o2]表示氧元素层。需要指出的是,前述的层状结构并不表明其非材料形貌或微观的实际排布方式是层状结构。锂锰氧化物中元素比例的配置,有助于层状的晶胞结构的形成,从而也利于获得改善的循环性能和充放电容量。
[0036]
作为一种示例,当本技术示例中的锂锰氧化物中不存在锰元素之外的过渡金属元素时,其可以表示为[li
a1
][li
a2
mn
b1
][o2](第一材料)。当锂锰氧化物存在锰元素之外的非锰过渡金属元素时,其可以表示为[li
a1
][li
a2+a3
mn
b1-b2
tmc][o2](第二材料)。因此,可以知晓其中的过渡金属层中含有锂元素和锰元素。也因此,当示例中的锂锰氧化物材料中,存在非锰的过渡金属元素tm时,第二材料在形式上可以是由第一材料中的过渡金属层[li
a2
mn
b1
]中的部分锰元素被锂元素和过渡金属元素掺杂且替代为[li
a2+a3
mn
b1-b2
tmc]而构成。
[0037]
如前文所述,该锂锰氧化物具有可以被用于制备电池的正极材料。其中的电池例如是锂离子电池,并且可以是一次电池,也可以是二次电池。相应地,上述的电池可以作为各种用电设备的储能装置。例如,锂锰氧化物可以作为移动设备、电动车、分布电站、后备电源或通信基站的储能设备。例如,锂锰氧化物被制作为正极材料,作为电动汽车的动力电池。
[0038]
作为制作上述的锂锰氧化物的方法的一种示例,发明人提给出一种制作方法。总体上而言,在本技术示例中选择将中间产品(或称为钠锰氧化物,或者钠锂锰氧化物)中的元素进行替换的方式而获得锂锰氧化物。
[0039]
从化学通式的形式上而言,该中间产品元素含有钠元素,并且通过将钠元素替换为锂元素而实现制作最终产品—锂锰氧化物。如前述,锂锰氧化物中的非锰的过渡金属元素可以是钛、锆或铌。因此,锂锰氧化物可以对应是锂锰钛氧化物,锂锰锆氧化物或锂锰铌氧化物。
[0040]
中间产品可以表示为[na
a1
][li
a2
mn
b1
][o2],通过对na元素的替换可以构成[li
a1
][li
a2+a3
mn
b1-b2
tmc][o2]。从工艺上而言,钠元素通过反应被替换为锂元素。同时,从最终产品中化学通式中的元素比例而言,相比于[li
a2
mn
b1
][o2]本技术示例中的锂锰氧化物中的锰元素的部分还被额外引入的锂元素所替代(可以通过对制作中间产品的原料的用量比例控制实现)。而其中的非锰的过渡金属元素tm,则可以通过在制备上述中间产品时引入。
[0041]
如前述,本技术示例中的锂锰氧化物的化学通式为li
x
mny(tm)zo2,x,y,z的取值符合电荷平衡,且x、y和z的取值为:0.75≤x≤0.8,0.75≤y≤0.8,0≤z≤0.05。
[0042]
由于z可以的取值包括零,因此,本技术的锂锰氧化物包括两种可能的组分。其中第一组分是z=0的情况,且表示为li
x
mnyo2;第二组分是z≠0的情况,且表示为li
x
mny(tm)zo2。其中,第一组分和第二组分,分别是纯相(例如可以通过xrd谱图判断和证明)。
[0043]
因此,锂锰氧化物可以是单一的第一组分,也可以是单一的第二组分,也可以是第一组分和第二组分的混合物。其中的混合物在一些示例中,可以是分别是制作第一组分和第二组分,再将二者通过物理方式的机械混合而成。或者,在一些示例中,其中的混合物可以是同时制作第一组分和第二组分,二者在工艺过程中例如化学反应过程中同步或异步产生并混合;这可以通过对原料的用量的妥善选择而实现。
[0044]
本技术中的锂锰氧化物是一种具有锂缺陷的氧化物正极材料。而既有的锰系正极
材料多采用的是共沉淀法或高温固相烧结法(所有原料按照摩尔比研磨混匀,然后高温煅烧;难以获得纯相的锂锰氧化物)进行制作;这些方案都无法获得具有锂缺陷的氧化物正极材料。在本技术的示例中选择的是一种在熔盐中进行离子交换的方案。其中,“锂缺陷”可以通过其化学通式li
x
mny(tm)zo2中的锂的取值而体现,即x《1;或者说,通过锂和氧的化学计量比的比值x/2小于0.5而体现。并且,实验表明,锂缺陷与制备钠锰氧化物中间体时的li和na的投料比例有关。
[0045]
因此,本技术示例中的锂锰氧化物的制备方法包括前驱体(后文详述)进行煅烧。示例中,煅烧的方式是在氧化性气氛中,以选定的第一升温速率将前驱体加热至第一预设温度进行煅烧、随后冷却(例如自然冷却,即并不主动地进行降温速率受控的冷却操作)。
[0046]
其中的前驱体包括锂源和含有锂元素的钠锰氧化物。其中的煅烧过程通过固相的熔盐反应使钠锰氧化物中的钠元素通过离子交换的方式被替代为来自于锂源中的锂元素。即本技术示例的方案通过制作中间产品(钠锰氧化物),再使其与锂源反应,通过反应使前驱体中的钠被锂源中的锂替代,且锂源中的锂还可以替代部分的锰元素。
[0047]
其中煅烧过程中的第一升温速率和第一预设温度根据前驱体的具体组分不同而有所差异。在煅烧之后,为了获得更纯净的锂锰氧化物,且考虑到制作原料的溶解性,在一些示例中,可以选择在以选定的第一升温速率将前驱体加热至第一预设温度进行煅烧、随后冷却之后对煅烧产品进行水洗并将水的难溶物干燥。
[0048]
例如,本技术的部分示例中,钠锰氧化物由锂化合物、钠化合物、锰化合物和可选的过渡金属氧化物制作而成。示例性地,将锂化合物、钠化合物、锰化合物和可选的不含锰的过渡金属氧化物在混合状态下固相烧结而成。其中,混合的方式可以是将各种化合物或氧化物通过诸如球磨的方式进行粉末混合。或者,另一些示例种,还可以将各种化合物或氧化物通过诸如球磨且再进行压片的方式进行混合;即粉末混合并压制为片状。压制的作用力可以是按照2mpa-20mpa的压强选择;示例性地,压制力可以是3mpa、4mpa、6mpa、9mpa、13mpa、16mpa、17mpa或19mpa等等。实践表明,压片烧结有助于提高所获得的产品的致密度,从而也有助于在被制作为正极时在离子电池中的离子的传输;同时,压片烧结会增加材料的振实密度,从而增加材料的实际的体积能量密度。
[0049]
示例中,在使用上述化合物和氧化物的情况下,将其混合物以选定的第二升温速率加热至第二预设温度进行煅烧、随后冷却(例如是自然冷却,即未采取主动地进行降温速率受控的冷却操作),从而制作获得中间产品/钠锰氧化物。
[0050]
作为一些可替代的示例,上述制作钠锰氧化物的锂化合物可以是lioh、li2co3、li2o2或li2o;钠化合物包括但不限于naoh、na2co3、na2o2或na2o;锰化合物包括但不限于mnco3、mno2、mnooh、mno、mno2;过渡金属氧化物包括tio2、zro2或nb2o5,即制备钠锰氧化物的原料中的过渡金属氧化物的过渡金属元素和锰化合物中的锰元素不同,且可以包括钛、锆或铌。相比于使用ni、co元素的过渡金属元素掺杂,钛、锆和铌与o之间的键合力更强,可以更有效的稳定材料的储锂结构。
[0051]
在上述示例性的化合物和氧化物的情况下,钠锰氧化物由锂化合物、钠化合物、锰化合物和可选且不含锰的过渡金属氧化物按照下述摩尔比配料:
[0052]
li:na:mn:tm=x:y:1-x-z:z;其中,0.18≤x≤0.2,0.5《y≤0.65,0≤z≤0.05,tm表示非锰的过渡金属元素。在此基础上,钠锰氧化物可以由锂化合物、钠化合物、锰化合物
和可选且不含锰的过渡金属氧化物以2℃/min至5℃/min的升温速率升温至650℃至1000℃的温度烧结诸如12小时至24小时,在烧结后自然冷却或通过选定的降温速率冷却而成。通过对升温速率按照上述值进行控制,可以利于混合的材料的初步分解和初步接触形核反应。
[0053]
在上述原料和条件的实施情况下,在一些不含锰的过渡金属氧化物示例中,该制备获得的中间产品/钠锰氧化物可以表示为[na
α1
][li
α2
mn
α3
][o2]。含有不含锰的过渡金属氧化物示例中,该制备获得的中间产品/钠锰氧化物可以表示为[na
β1
][li
β2
mn
β3
tm
β4
][o2]。
[0054]
需要说明的是,在使用了非锰的过渡金属元素的示例中,进行配料时,含非锰的过渡金属元素的过渡金属氧化物的按照上述z取值小于等于0.05的方式称量进行配料。经过实验,如果z取值大于0.05会增加制作最终产品的原料成本,还会导致难以获得纯相。
[0055]
在获得上述的钠锰氧化物的基础上,将该钠锰氧化物与锂源进行反应。在反应结束后,锂源中的未彻底反应掉的可以通过诸如水洗的方式被去除。本技术的部分示例中,锂源包括但不限于硝酸锂和氯化锂。在该锂源中,硝酸锂作为在烧结过程中的助溶剂,而氯化锂则作为在烧结过程中的(离子)交换剂。如果只使用助溶剂,会降低离子交换效率。如果只使用交换剂,则会导致离子交换反应温度升高,增加材料制作成本,还容易导致反应原料的热挥发,进而引起物料的原子比例失衡而使获得的锂锰氧化物的组分构成偏离初始的设计目标。
[0056]
考虑到锂源中的两种锂化合物的作用,二者的摩尔比可以是硝酸锂和氯化锂的摩尔比为88:12。进一步地,将钠锰氧化物与锂源的按照na:li的摩尔比为1:10的方式配料。在按照上述比例配料之后,将其置于氧化性气氛(通入氧气或空气)的诸如马弗炉中,按照第一升温速率为2℃/min至10℃/min,第一预设温度为250℃至350℃的条件进行煅烧。煅烧2小时至6小时后,可以随炉自然冷却至常温或以选定的降温速率冷却至常温。
[0057]
通过受控的降温速率进行冷却,可以减少、甚至消除材料的残余应力,使得材料颗粒尺寸均一,利于离子迁移。示例性地,其中的降温速率例如可以是10℃/min至15℃/min。该降温速率同样也可以适用于在制作钠锰氧化物的工艺过程中。
[0058]
另外,钠锰氧化物和锂源的煅烧温度即第一预设温度控制在上述范围可以避免温度过高使原料如锂化合物挥发而造成的浪费和原料比例失衡,同时也可以确保锂化合物达到熔融状态,便于进行离子交换。
[0059]
由此,通过上述工艺,可以使用li以及可选的非锰过渡金属元素对晶胞结构中的过渡金属层中的部分量的mn元素进行掺杂取代,从而得到锂锰氧化物。通过对其进行微观结构表征,锂锰氧化物具有带状超晶格结构。示例中的锂锰氧化物中使用过渡金属的阳离子的掺杂。
[0060]
该锂锰氧化物可以作为锂离子电池正极材料,并且还具有较高的充放电比容量和能量密度;例如放电比容量可以达到250ma
·
h/g,能量密度可以达到800w
·
h/kg。进一步地,其生产过程无需特殊防护、反应条件容易控制,因此合成工艺简单。另外,该工艺的生产效率高、结果重复性好、产量大,同时工艺中所需的原料易得、无毒、成本低廉,因而适宜于规模化生产。
[0061]
以下结合实施例对本技术作进一步的详细描述。
[0062]
实施例1(无非锰的过渡金属元素)
[0063]
步骤a、将li2co3、na2co3与mnco3按照li:na:mn=0.2:0.6:0.8:的摩尔比配料,并置于球磨罐中以乙醇作为液体介质,在300r/min的转速下,球磨8个小时之后自然晾干、过筛得到混合均匀的金属盐前驱体。将得到的金属盐前驱体在2mpa的压力下压片,然后置于马弗炉中,空气气氛下以5℃/min的升温速率升温至700℃,并在700℃下处理24个小时,自然冷却至室温后得到钠锰氧化物前驱体。
[0064]
步骤b、将钠锰氧化物前驱体、锂源(硝酸锂和氯化锂的混合物)按照li:na=10:1的摩尔比进行机械球磨混合;其中硝酸锂和氯化锂的摩尔比为88:12。将上述球磨混合后的产物置于空气气氛的马弗炉中,以2℃/min的升温速率升温至250℃,并在250℃下处理3小时,自然冷却至室温后,得到锂锰氧化物前驱体。
[0065]
步骤c、将上述锂锰氧化物前驱体水洗、离心沉淀、晾干、研磨,得到锂离子电池锂锰氧化物正极材料li
0.8
mn
0.8
o2,其中mn
4+
。
[0066]
实施例2
[0067]
步骤1、将li2co3、na2co3、mnco3和tio2按照下述的摩尔比配料。具体地,li:na:mn:ti=0.19:0.61:0.77:0.03的摩尔比置于球磨罐中以乙醇作为液体介质,以300r/min的转速,球磨8个小时,之后自然晾干、过筛得到混合均匀的金属盐前驱体。将得到的金属盐前驱体在2mpa的压力下压片,然后置于马弗炉中,以5℃/min的升温速率升温至700℃,在700℃下处理24个小时,自然冷却至室温后得到钠锰氧化物前驱体。
[0068]
步骤2、将钠锰氧化物前驱体与混合物(硝酸锂和氯化锂的)按照li:na=10:1的摩尔比进行机械球磨混合;其中硝酸锂和氯化锂的摩尔比为88:12。将上述球磨混合后的产物置于马弗炉中,以2℃/min的升温速率升温至250℃,在250℃下处理3小时,自然冷却至室温后得到锂锰氧化物前驱体。
[0069]
步骤3、将上述锂锰氧化物前驱体水洗、离心沉淀、晾干、研磨,得到锂离子电池锂锰氧化物正极材料li
0.8
mn
0.77
ti
0.03
o2,其中mn
4+
,ti
4+
。
[0070]
实施例3
[0071]
按照实施例2的方式实施,主要区别在于:
[0072]
步骤1中,升温至750℃,并且在750℃下处理24个小时。
[0073]
步骤2中,在250℃下处理6小时。
[0074]
实施例4
[0075]
按照实施例2的方式实施,主要区别在于:
[0076]
步骤1中,升温至800℃,并且在800℃下处理15个小时。
[0077]
实施例5
[0078]
按照实施例2的方式实施,主要区别在于:
[0079]
步骤1中,升温至900℃,并且在900℃下处理12个小时。
[0080]
实施例6
[0081]
按照实施例2的方式实施,主要区别在于:
[0082]
步骤1中,升温至850℃,并且在850℃下处理12个小时。
[0083]
实施例7
[0084]
按照实施例2的方式实施,主要区别在于:
[0085]
步骤1中,升温至1000℃,并且在1000℃下处理14个小时。
[0086]
实施例8
[0087]
按照实施例2的方式实施,主要区别在于:
[0088]
步骤2中,在300℃下处理2小时。
[0089]
实施例9
[0090]
按照实施例2的方式实施,主要区别在于:
[0091]
步骤1中,升温至800℃,并且在800℃下处理20个小时。
[0092]
步骤2中,在300℃下处理5小时。
[0093]
实施例10
[0094]
按照实施例2的方式实施,主要区别在于:
[0095]
步骤1中,升温至750℃,并且在750℃下处理20个小时。
[0096]
步骤2中,在350℃下处理2小时。
[0097]
实施例11
[0098]
按照实施例2的方式实施,主要区别在于:
[0099]
步骤1中,过渡金属氧化物为zro2,升温至750℃,并且在750℃下处理24个小时。li:na:mn:zr=0.19:0.61:0.77:0.03;摩尔比。
[0100]
步骤2中,在250℃下处理6小时。
[0101]
步骤3中,获得正极材料为li
0.8
mn
0.77
zr
0.03
o2,其中,mn
4+
,zr
4+
。
[0102]
实施例12
[0103]
按照实施例2的方式实施,主要区别在于:
[0104]
步骤1中,过渡金属氧化物为zro2,升温至800℃,并且在800℃下处理15个小时。li:na:mn:zr=0.19:0.61:0.77:0.03;摩尔比。
[0105]
步骤3中,获得正极材料为li
0.8
mn
0.77
zr
0.03
o2,其中,mn
4+
,zr
4+
。
[0106]
实施例13
[0107]
按照实施例2的方式实施,主要区别在于:
[0108]
步骤1中,过渡金属氧化物为zro2,升温至900℃,并且在900℃下处理12个小时。li:na:mn:zr=0.19:0.61:0.77:0.03;摩尔比。
[0109]
步骤3中,获得正极材料为li
0.8
mn
0.77
zr
0.03
o2,其中,mn
4+
,zr
4+
。
[0110]
实施例14
[0111]
按照实施例2的方式实施,主要区别在于:
[0112]
步骤1中,过渡金属氧化物为zro2,升温至850℃,并且在850℃下处理12个小时。li:na:mn:zr=0.19:0.61:0.77:0.03;摩尔比。
[0113]
步骤3中,获得正极材料为li
0.8
mn
0.77
zr
0.03
o2,其中,mn
4+
,zr
4+
。
[0114]
实施例15
[0115]
按照实施例2的方式实施,主要区别在于:
[0116]
步骤1中,过渡金属氧化物为zro2,升温至1000℃,并且在1000℃下处理14个小时。li:na:mn:zr=0.19:0.61:0.77:0.03;摩尔比。
[0117]
步骤3中,获得正极材料为li
0.8
mn
0.77
zr
0.03
o2,其中,mn
4+
,zr
4+
。
[0118]
实施例16
[0119]
按照实施例2的方式实施,主要区别在于:
[0120]
步骤1中,过渡金属氧化物为zro2,升温至700℃,并且在700℃下处理24个小时。li:na:mn:zr=0.19:0.61:0.77:0.03;摩尔比。
[0121]
步骤2中,在300℃下处理2小时。
[0122]
步骤3中,获得正极材料为li
0.8
mn
0.77
zr
0.03
o2,其中,mn
4+
,zr
4+
。
[0123]
实施例17
[0124]
按照实施例2的方式实施,主要区别在于:
[0125]
步骤1中,过渡金属氧化物为zro2,升温至800℃,并且在800℃下处理20个小时。li:na:mn:zr=0.19:0.61:0.77:0.03;摩尔比。
[0126]
步骤2中,在300℃下处理5小时。
[0127]
步骤3中,获得正极材料为li
0.8
mn
0.77
zr
0.03
o2,其中,mn
4+
,zr
4+
。
[0128]
实施例18
[0129]
按照实施例2的方式实施,主要区别在于:
[0130]
步骤1中,过渡金属氧化物为zro2,升温至750℃,并且在750℃下处理20个小时。li:na:mn:zr=0.19:0.61:0.77:0.03;摩尔比。
[0131]
步骤2中,在300℃下处理2小时。
[0132]
步骤3中,获得正极材料为li
0.8
mn
0.77
zr
0.03
o2,其中,mn
4+
,zr
4+
。
[0133]
实施例19
[0134]
按照实施例2的方式实施,主要区别在于:
[0135]
步骤1中,过渡金属氧化物为nb2o5,升温至750℃,并且在750℃下处理24个小时。li:na:mn:nb=0.195:0.585:0.78:0.02的摩尔比。
[0136]
步骤2中,在250℃下处理6小时。
[0137]
步骤3中,获得正极材料为li
0.78
mn
0.78
nb
0.02
o2,其中,mn
4+
,nb
5+
。
[0138]
实施例20
[0139]
按照实施例2的方式实施,主要区别在于:
[0140]
步骤1中,过渡金属氧化物为nb2o5,升温至800℃,并且在800℃下处理15个小时。li:na:mn:nb=0.195:0.585:0.78:0.02的摩尔比。
[0141]
步骤3中,获得正极材料为li
0.78
mn
0.78
nb
0.02
o2,其中,mn
4+
,nb
5+
。
[0142]
实施例21
[0143]
按照实施例2的方式实施,主要区别在于:
[0144]
步骤1中,过渡金属氧化物为nb2o5,升温至900℃,并且在900℃下处理12个小时。li:na:mn:nb=0.195:0.585:0.78:0.02的摩尔比。
[0145]
步骤3中,获得正极材料为li
0.78
mn
0.78
nb
0.02
o2,其中,mn
4+
,nb
5+
。
[0146]
实施例22
[0147]
按照实施例2的方式实施,主要区别在于:
[0148]
步骤1中,过渡金属氧化物为nb2o5,升温至850℃,并且在850℃下处理12个小时。li:na:mn:nb=0.195:0.585:0.78:0.02的摩尔比。
[0149]
步骤3中,获得正极材料为li
0.78
mn
0.78
nb
0.02
o2,其中,mn
4+
,nb
5+
。
[0150]
实施例23
[0151]
按照实施例2的方式实施,主要区别在于:
[0152]
步骤1中,过渡金属氧化物为nb2o5,升温至1000℃,并且在1000℃下处理14个小时。li:na:mn:nb=0.195:0.585:0.78:0.02的摩尔比。
[0153]
步骤3中,获得正极材料为li
0.78
mn
0.78
nb
0.02
o2,其中,mn
4+
,nb
5+
。
[0154]
实施例24
[0155]
按照实施例2的方式实施,主要区别在于:
[0156]
步骤1中,过渡金属氧化物为nb2o5。
[0157]
li:na:mn:nb=0.195:0.585:0.78:0.02的摩尔比。
[0158]
步骤2中,在300℃下处理2小时。
[0159]
步骤3中,获得正极材料为li
0.78
mn
0.78
nb
0.02
o2,其中,mn
4+
,nb
5+
。
[0160]
实施例25
[0161]
按照实施例2的方式实施,主要区别在于:
[0162]
步骤1中,过渡金属氧化物为nb2o5。
[0163]
li:na:mn:nb=0.195:0.585:0.78:0.02的摩尔比。
[0164]
步骤2中,在300℃下处理5小时。
[0165]
步骤3中,获得正极材料为li
0.78
mn
0.78
nb
0.02
o2,其中,mn
4+
,nb
5+
。
[0166]
实施例26
[0167]
按照实施例2的方式实施,主要区别在于:
[0168]
步骤1中,过渡金属氧化物为nb2o5。升温至750℃,并且在750℃下处理20个小时。li:na:mn:nb=0.195:0.585:0.78:0.02的摩尔比。
[0169]
步骤2中,在350℃下处理2小时。
[0170]
步骤3中,获得正极材料为li
0.78
mn
0.78
nb
0.02
o2,其中,mn
4+
,nb
5+
。
[0171]
实施例27
[0172]
按照实施例1的方式实施,主要区别在于:
[0173]
步骤a中,升温至850℃,并且在850℃下处理12个小时。li:na:mn=0.2:0.8:0.78的摩尔比。
[0174]
步骤c中,获得正极材料为li
0.8
mn
0.8
o2,其中,mn
4+
。
[0175]
实施例28
[0176]
按照实施例1的方式实施,主要区别在于:
[0177]
步骤a中,升温至1000℃,并且在1000℃下处理14个小时。li:na:mn=0.2:0.8:0.78的摩尔比。
[0178]
步骤c中,获得正极材料为li
0.8
mn
0.8
o2,其中,mn
4+
。
[0179]
实施例29
[0180]
按照实施例1的方式实施,主要区别在于:
[0181]
步骤1中,li:na:mn=0.2:0.8:0.78的摩尔比。
[0182]
步骤2中,在300℃下处理2小时。
[0183]
步骤3中,获得正极材料为li
0.8
mn
0.8
o2,其中,mn
4+
。
[0184]
实施例30
[0185]
按照实施例1的方式实施,主要区别在于:
[0186]
步骤a中,升温至800℃,并且在800℃下处理20个小时。li:na:mn=0.2:0.8:0.78
的摩尔比。
[0187]
步骤b中,在300℃下处理5小时。
[0188]
步骤c中,获得正极材料为li
0.8
mn
0.8
o2,其中,mn
4+
。
[0189]
实施例31
[0190]
按照实施例1的方式实施,主要区别在于:
[0191]
步骤a中,升温至750℃,并且在750℃下处理20个小时。li:na:mn=0.2:0.8:0.78的摩尔比。
[0192]
步骤b中,在350℃下处理2小时。
[0193]
步骤c中,获得正极材料为li
0.8
mn
0.8
o2,其中,mn
4+
。
[0194]
实施例32
[0195]
按照实施例2的方式实施,主要区别在于:
[0196]
步骤1中,升温至750℃,并且在750℃下处理24个小时。
[0197]
步骤2中,在250℃下处理6小时。
[0198]
实施例33
[0199]
按照实施例2的方式实施,主要区别在于:
[0200]
步骤1中,过渡金属氧化物为zro2。
[0201]
li:na:mn:zr=0.19:0.61:0.77:0.03的摩尔比。
[0202]
步骤2中,在300℃下处理2小时。
[0203]
步骤3中,获得正极材料为li
0.8
mn
0.77
zr
0.03
o2,其中,mn
4+
,zr
4+
。
[0204]
实施例34
[0205]
按照实施例2的方式实施,主要区别在于:
[0206]
步骤1中,过渡金属氧化物为zro2。升温至800℃,并在800℃处理20小时。li:na:mn:zr=0.19:0.61:0.77:0.03的摩尔比。
[0207]
步骤2中,在300℃下处理5小时。
[0208]
步骤3中,获得正极材料为li
0.8
mn
0.77
zr
0.03
o2,其中,mn
4+
,zr
4+
。
[0209]
实施例35
[0210]
按照实施例2的方式实施,主要区别在于:
[0211]
步骤1中,过渡金属氧化物为zro2。升温至750℃,并在750℃处理20小时。li:na:mn:zr=0.19:0.61:0.77:0.03的摩尔比。
[0212]
步骤2中,在350℃下处理2小时。
[0213]
步骤3中,获得正极材料为li
0.8
mn
0.77
zr
0.03
o2,其中,mn
4+
,zr
4+
。
[0214]
实施例36
[0215]
按照实施例2的方式实施,主要区别在于:
[0216]
步骤1中,过渡金属氧化物为tio2。升温至800℃,并在800℃处理15小时。li:na:mn:ti=0.19:0.61:0.77:0.03的摩尔比。
[0217]
步骤3中,获得正极材料为li
0.8
mn
0.77
ti
0.03
o2,其中,mn
4+
,ti
4+
。
[0218]
实施例37
[0219]
按照实施例2的方式实施,主要区别在于:
[0220]
步骤1中,锰化合物为mnooh,过渡金属氧化物为tio2。升温至900℃,并在900℃处
理12小时。li:na:mn:ti=0.19:0.61:0.77:0.03的摩尔比。
[0221]
步骤3中,获得正极材料为li
0.8
mn
0.77
ti
0.03
o2,其中,mn
4+
,ti
4+
。
[0222]
实施例38
[0223]
按照实施例2的方式实施,主要区别在于:
[0224]
步骤1中,锰化合物为mno,过渡金属氧化物为nb2o5。升温至1000℃,并在1000℃处理14小时。
[0225]
其中,li:na:mn:nb=0.195:0.585:0.78:0.02的摩尔比。
[0226]
步骤3中,获得正极材料为li
0.78
mn
0.78
nb
0.02
o2,其中,mn
4+
,nb
4+
。
[0227]
实施例39
[0228]
按照实施例2的方式实施,主要区别在于:
[0229]
步骤1中,锰化合物为mnooh,过渡金属氧化物为nb2o5。li:na:mn:nb=0.195:0.585:0.78:0.02的摩尔比。
[0230]
步骤2中,在300℃下处理2小时。
[0231]
步骤3中,获得正极材料为li
0.78
mn
0.78
nb
0.02
o2,其中,mn
4+
,nb
4+
。
[0232]
实施例40
[0233]
按照实施例2的方式实施,主要区别在于:
[0234]
步骤1中,锰化合物为mno2,过渡金属氧化物为nb2o5。li:na:mn:nb=0.195:0.585:0.78:0.02的摩尔比。升温至800℃,并在800℃下处理20小时。
[0235]
步骤2中,在300℃下处理5小时。
[0236]
步骤3中,获得正极材料为li
0.78
mn
0.78
nb
0.02
o2,其中,mn
4+
,nb
4+
。
[0237]
试验例1
[0238]
将实施例2中的锂锰氧化物正极材料(作为活性物质)经过x射线衍射仪分析为纯相,并显示出有序的带状超晶格结构,如图1所示。
[0239]
以n-甲基吡络烷酮作为溶剂,按照活性物质:碳黑:pvdf(聚偏氟乙烯)=8:1:1的质量比例将调制混匀的浆料均匀的涂布在al箔上,之后在120℃的真空烘箱中烘干极片;以金属锂作为对电极,在氩气手套箱中组装半电池。
[0240]
在20ma/g的放电电流密度下对阳离子无序富锂正极材料进行电池性能测试,其放电比容量循环性能如图2所示,其放电能量密度循环性能如图3所示。
[0241]
由图3中可以看出,经过前几圈电化学循环活化之后,锂锰氧化物正极材料的放电比容量和能量密度分别可达约250ma h/g和800w h/kg,并且经过充放电循环50圈之后,仍然保持较高的放电比容量和能量密度,证明该材料具有良好的循环稳定性。
[0242]
以上所述仅为本技术的优选实施例而已,并不用于限制本技术,对于本领域的技术人员来说,本技术可以有各种更改和变化。凡在本技术的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本技术的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1