一种抗QKI-5单克隆抗体及其制备与应用的制作方法
本发明涉及生物
技术领域:
,具体涉及一种抗QKI-5单克隆抗体及其制备与应用。
背景技术:
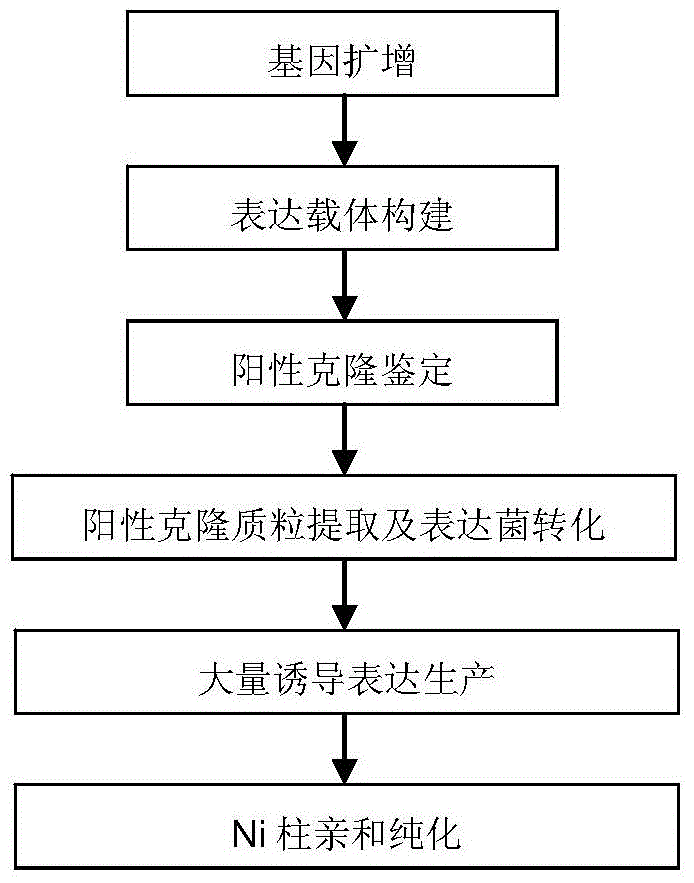
:单克隆抗体(MonoclonalAntibody,McAb)即单个B淋巴细胞克隆所分泌的抗体。抗体主要由机体的B淋巴细胞合成,每个B淋巴细胞有合成一种抗体的遗传基因。当机体受抗原刺激时,抗原分子上的许多决定簇分别激活各个具有不同基因的B细胞。被激活的B细胞分裂增殖形成该细胞的子孙,即克隆。如果选出一个合成一种抗体的细胞进行培养,就可得到由单细胞经分裂增殖而形成细胞群,即单克隆。单克隆细胞所合成的抗体即为单克隆抗体。单克隆抗体的特点是:理化性状高度均一、生物活性单一、与抗原结合的特异性强、便于人为处理和质量控制,并且来源容易。单克隆抗体技术是现代生命科学研究的重要工具,其在基因和蛋白质的结构和功能研究方面有着不可或缺的作用,成为解决生物学和医学等许多重大问题的重要手段,在人类和动物的免疫学诊断方面至今仍有着无可替代的重要作用。单克隆抗体技术的基本原理为:小鼠受到外界抗原刺激后可诱导免疫反应,产生相应的抗体,这一职能是由B淋巴细胞来承担。肿瘤细胞在体外培养条件下可以无限传代,是永久细胞。把小鼠的骨髓瘤细胞与经过免疫的小鼠脾细胞在聚乙二醇等介导下发生融合,融合后的杂交瘤细胞具有两种细胞的特性,一方面可以分泌特异性的抗体,一方面也具备了肿瘤细胞无限增殖的能力、可在体外培养条件下或移植到体内无限增殖,从而分泌大量单克隆抗体。免疫方法和筛选抗原是决定能否获得高亲和力、能识别天然抗原表位的单抗的重要因素。QKI蛋白是一种重要的RNA结合蛋白,对胚胎和出生后的个体发育至关重要。QKI蛋白有三种异构体,根据其mRNA的3’非翻译区(3’-UTR)的长度分别命名为QKI-5,QKI-6和QKI-7。这三种蛋白在细胞内的定位各不相同,其中QKI-5主要定位于细胞核内,QKI-6在细胞核和细胞质均有分布,而QKI-7则主要定位于细胞质。此外,这三种异构体的表达还具有组织、细胞的特异性。神经细胞中主要含有QKI-6和QKI-7,而表皮细胞中则主要是QKI-5。这三种异构体调控基因表达的分子机制并不相同。已有的报道发现癌组织中QKI的表达量往往低于癌旁组织,并且癌细胞往往是表皮细胞转化而来,故通过检测细胞、组织中的QKI-5的含量来预测、诊断癌症的发生发展,为癌症的早期诊断提供新的依据,并提供可能的治疗方案。另外,最新的研究结果显示,肺癌组织主要表达QKI-5,在肺癌早期病人中,QKI低表达的病例生存率显著降低,提示了QKI-5可以作为一个重要的预后标记物。因此,运用新的技术手段研究QKI-5在肿瘤诊疗方面的作用,具有深厚的潜力和深远的影响。但是,由于QKI的三种异构体在N端保守,仅仅是C端十几个氨基酸有所不同,目前常见的商业化QKI抗体很难特异性地识别其中一种异构体,而往往是对三种异构体均有反应。技术实现要素:本发明的目的在于提供一种仅仅特异性识别QKI-5的单克隆抗体及其制备与应用,所述抗体特异性高,仅仅识别QKI-5,对另外两种异构体QKI-6和QKI-7完全不识别,效价高,方便实验,且易于分离纯化。所述单克隆抗体的成功构建为把QKI-5开发成为监测肿瘤发生发展重要诊断方式提供了极具意义的工具,也给科研人员在实验过程中排除非特异性识别干扰提供了便利的手段。本发明的第一方面提供了一种抗QKI-5的单克隆抗体,所述单克隆抗体由保藏在中国典型培养物保藏中心的保藏号为CCTCCC2014228的杂交瘤细胞分泌。本发明的单克隆抗体具有较高的灵敏度和特异性,可识别QKI-5,对另外两种异构体QKI-6和QKI-7完全不识别,能够用于免疫印迹、免疫沉淀、免疫细胞化学、免疫荧光、免疫组织化学等免疫学检测,可应用于临床组织样本中QKI-5表达水平的检测。本发明的第二方面还提供分泌抗QKI-5的单克隆抗体的杂交瘤细胞系,其保藏号为CCTCCC2014228,被保藏于中国典型培养物保藏中心。本发明的杂交瘤细胞系具有较强的分泌本发明所述单克隆抗体的能力,能够稳定、大量分泌本发明的单克隆抗体。从杂交瘤细胞收集本发明的单克隆抗体时,可以从杂交瘤细胞体外培养上清液中获取抗体或者将杂交瘤细胞注入适宜的哺乳动物并从动物腹水中获取抗体。前一种方法适于获得高纯度的抗体,后一种方法适于大量获取抗体。通过上述方法获得的抗体,可以用常规方法纯化,例如盐析、凝胶过滤、亲和色谱层析等方法。本领域普通技术人员已知,可以直接采用QKI-5蛋白作为抗原,获得本发明的单克隆抗体。也可以将本发明QKI-5蛋白与已知标签形成重组蛋白作为抗原,获得对QKI-5有反应性,对标签没有反应性的本发明的单克隆抗体。因此,本发明第三方面还提供前述单克隆抗体的制备方法,该方法包括:所述方法包括:培养保藏号为CCTCCC2014228的杂交瘤细胞,从所述杂交瘤细胞上清液中或从注射所述杂交瘤细胞后的动物腹水中获取单克隆抗体。该方法仅是示例性的,例如可以用同样的方法免疫其它哺乳动物,大鼠、兔子、豚鼠或仓鼠等。本发明第四方面提供一种检测QKI-5的试剂盒,其含有本发明前述的的单克隆抗体。优选的,所述试剂盒还含有第二抗体、显示系统、或可被检测的荧光和/或放射标记,以及适宜的缓冲液。优选的,所述第二抗体为本发明所述的单克隆抗体或抗本发明所述单克隆抗体的抗体(例如本领域常用的羊抗鼠IgG)或按本领域已知技术制备的抗QKI的多抗。作为检测信号的荧光和/或放射标记可以是放射性同位素、荧光化合物、生物素和酶等。所述酶包括,但不限于,辣根过氧化酶、碱性磷酸酶、葡萄糖氧化酶等,优选辣根过氧化酶和/或碱性磷酸酶。本领域技术人员已知,针对不同的酶,可使用不同的底物。辣根过氧化酶作用的底物包括,但不限于,邻苯二胺(OPD)、四甲基联苯胺(TMB)、二氨基联苯胺(DAB)等。碱性磷酸酶的底物一般采用对硝基苯磷酸酯(p-NPP)、碱性磷酸酶红(AP-Red)、碱性磷酸酶也有发荧光底物(磷酸4-甲基伞酮)。优选的,所述第二抗体上标记有生物素,并进一步含有结合辣根过氧化酶和/或碱性磷酸酶的链霉亲和素,显示底物为邻苯二胺和/或碱性磷酸酶红;或第二抗体上直接标有辣根过氧化物酶和/或碱性磷酸酶,显示底物为邻苯二胺和/或碱性磷酸酶红。本发明第五方面提供本发明的单克隆抗体在制备体外检测样品中QKI-5的试剂或试剂盒中的应用。所述检测方法包括可以使用本发明抗体的所有免疫方法,例如免疫印迹、免疫沉淀、免疫组化、免疫荧光等。所述检测为非疾病诊断目的的检测。本发明第六方面还提供一种QKI-5检测或诊断试剂,该检测或诊断试剂含有本发明前述的单克隆抗体。所述检测试剂的制备方法可以是本领域技术人员熟知的任何方法,例如将本发明的单克隆抗体与适当的载体混合,如水、盐水、缓冲剂等。本发明的检测试剂可应用于临床组织样本中QKI-5蛋白的检测。所述检测或诊断为非疾病诊断目的的检测或诊断。本发明的有益效果为:本发明的抗QKI-5的单克隆抗体特异性高,仅仅识别QKI-5,对另外两种异构体QKI-6和QKI-7完全不识别,效价高,方便实验,且易于分离纯化。所述单克隆抗体的成功构建为把QKI-5开发成为监测肿瘤发生发展重要诊断方式提供了极具意义的工具,也给科研人员在实验过程中排除非特异性识别干扰提供了便利的手段。本发明杂交瘤细胞株保藏信息如下:杂交瘤细胞株名称:杂交瘤细胞株QKI5;保藏号为:CCTCCNO:C2014228。保藏日期:2014年12月11日;保藏单位名称:中国典型培养物保藏中心;保藏单位简称:CCTCC;保藏单位地址:中国.武汉.武汉大学。附图说明图1:小鼠融合前血清ELISA检测结果曲线图。图2:样品为HeLa细胞转染QKI-5,QKI-6和QKI-7表达质粒后的全蛋白裂解物。使用制备的单克隆抗体,免疫印迹显示抗体特异识别QKI-5。图3:样品为肺癌细胞系H520中KnockdownQKI后收集的细胞。使用制备的单克隆抗体,免疫印迹检测发现,敲低QKI之后,QKI的条带没有了,说明抗体特异识别QKI。图4:样品为小鼠各种组织的蛋白抽提物。使用制备的单克隆抗体,免疫印迹检测发现,QKI-5在肺中高表达,说明抗体不仅能够特异识别细胞系中的QKI-5,而且对组织中表达的QKI-5也能够特异的识别。图5、样品为肺正常细胞系(BEAS2B)的免疫荧光染色。使用制备的单克隆抗体进行免疫荧光染色,发现对于QKI敲低的细胞(sh-QKI)来说,QKI-5的细胞内定位几乎检测不到。这说明该单克隆抗体也能应用于免疫荧光染色,准确地检查QKI-5的细胞内定位、含量等。图6:QKI抗原生产的程序。具体实施方式本发明涉及一种抗QKI5的单克隆抗体,所述单克隆抗体由保藏在中国典型培养物保藏中心的保藏号为CCTCCC2014228的杂交瘤细胞分泌。本文所用的术语“单克隆抗体(单抗)”指从一类基本均一的群体获得的抗体,即该群体中包含的单个抗体是相同的,除少数可能存在的天然发生的突变外。单克隆抗体高特异性地针对单个抗原点。而且,与常规多克隆抗体制剂(通常具有针对不同决定簇的不同抗体)不同,各单克隆抗体是针对抗原上的单个决定簇。除了它们的特异性外,单克隆抗体的好处还在于它们是通过杂交瘤培养来合成的,不会被其它免疫球蛋白污染。修饰语“单克隆”表示了抗体的特性,是从基本均一的抗体群中获得的,这不应被解释成需要用任何特殊方法来产生抗体。本文所用的术语“抗体”和“免疫球蛋白”是有相同结构特征的约150,000道尔顿的异四聚糖蛋白,其由两个相同的轻链(L)和两个相同的重链(H)组成。每条轻链通过一个共价二硫键与重链相连,而不同免疫球蛋白同种型的重链间的二硫键数目不同。每条重链和轻链也有规则间隔的链内二硫键。每条重链的一端有可变区(VH),其后是多个恒定区。每条轻链的一端由可变区(VL),另一端有恒定区:轻链的恒定区与重链的第一个恒定区相对,轻链的可变区与重链的可变区相对。特殊的氨基酸在轻链和重链的可变区之间形成界面。本文所用的术语“可变”表示抗体中可变区的某些部分在序列上有所不同,它形成各种特定抗体对其特定抗原的结合和特异性。然而,可变性并不均匀地分布在整个抗体可变区中。它集中于轻链和重链可变区中称为互补决定区(CDR)或超变区中的三个片段中。可变区中较保守的部分称为架构区(FR)。天然重链和轻链的可变区中各自包含四个FR区,它们大致上呈p一折叠构型,由形成接连环的三个CDR相连,在某些情况下可形成部分p折叠结构。每条链中的CDR通过FR区紧密地靠在一起并与另一链的CDR一起形成了抗体的抗原结合部位(参见Kabat等,NIHPuB,No.91-3242,卷I,647-669页(1991)),恒定区不直接参与抗体与抗原的结合,但是它们表现出不同的效应功能,例如参与抗体的依赖于抗体的细胞毒性。单克隆抗体可用本领域技术人员熟知的各种方法来获得。例如,单克隆抗体可用杂交瘤方法(由Kohler等,Nature,256:495(1975)首先提出)制得,或用重组DNA方法(美国专利No.4,816,567)制得。单克隆抗体也可用例如Clackson等,Nature,352:624-628(1991)和Marks等,J.Mol.Biol.,222:581-597(1991)所述的技术从噬菌体抗体库中分离获得。所得单克隆抗体可用常规手段来鉴定。单克隆抗体的结合特异性可用免疫沉淀或体外结核试验(如放射性免疫测定Munson等,Anal.Biochem.,107:220(1980)的Scatchard)分析来测定。以下通过特定的具体实例说明本发明的实施方式,本领域技术人员可由本说明书所揭露的内容轻易地了解本发明的其它优点与功效。本发明还可以通过另外不同的具体实施方式加以实施或应用,本说明书中的各项细节也可以基于不同观点与应用,在没有背离本发明的精神下进行各种修饰或改变。在进一步描述本发明具体实施方式之前,应理解,本发明的保护范围不局限于下述特定的具体实施方案;还应当理解,本发明实施例中使用的术语是为了描述特定的具体实施方案,而不是为了限制本发明的保护范围;在本发明说明书和权利要求书中,除非文中另外明确指出,单数形式“一个”、“一”和“这个”包括复数形式。当实施例给出数值范围时,应理解,除非本发明另有说明,每个数值范围的两个端点以及两个端点之间任何一个数值均可选用。除非另外定义,本发明中使用的所有技术和科学术语与本
技术领域:
技术人员通常理解的意义相同。除实施例中使用的具体方法、设备、材料外,根据本
技术领域:
的技术人员对现有技术的掌握及本发明的记载,还可以使用与本发明实施例中所述的方法、设备、材料相似或等同的现有技术的任何方法、设备和材料来实现本发明。除非另外说明,本发明中所公开的实验方法、检测方法、制备方法均采用本
技术领域:
常规的分子生物学、生物化学、染色质结构和分析、分析化学、细胞培养、重组DNA技术及相关领域的常规技术。这些技术在现有文献中已有完善说明,具体可参见Sambrook等MOLECULARCLONING:ALABORATORYMANUAL,Secondedition,ColdSpringHarborLaboratoryPress,1989andThirdedition,2001;Ausubel等,CURRENTPROTOCOLSINMOLECULARBIOLOGY,JohnWiley&Sons,NewYork,1987andperiodicupdates;theseriesMETHODSINENZYMOLOGY,AcademicPress,SanDiego;Wolffe,CHROMATINSTRUCTUREANDFUNCTION,Thirdedition,AcademicPress,SanDiego,1998;METHODSINENZYMOLOGY,Vol.304,Chromatin(P.M.WassarmanandA.P.Wolffe,eds.),AcademicPress,SanDiego,1999;和METHODSINMOLECULARBIOLOGY,Vol.119,ChromatinProtocols(P.B.Becker,ed.)HumanaPress,Totowa,1999等。实施例1抗QKI-5的单克隆抗体制备及纯化1.抗原生产QKI抗原生产的程序,如图6所示。经过纯化,得到一个多表位的QKI-5蛋白抗原用于免疫。抗原的序列为GAVATKVRRHDMRVHPYQRIVTADRAATGNGAVATKVRRHDMRVHPYQRIVTADRAATGN(SEQIDNO:1),分子量为30kD,抗原浓度为0.22/ml。抗原浓度为85%。2.动物免疫将实施例1中所得1个多表位抗原免疫鼠龄为8~12周的雌性BALB/c健康小鼠3只。采取小鼠快速免疫方式,选择免疫反应最好的3只小鼠脾脏进行融合。选择血清效价最好的进行融合。Table1小鼠融合前血清ELISA检测数据表,PC是阳性对照(PositiveControl),NC是阴性对照(NegativeControl)判断标准是:大于NC两倍且大于0.25的OD450值对应的稀释度值即为该抗体的效价。3.融合和单抗筛选免疫反应最好的小鼠的脾细胞与骨髓瘤细胞(SP2/0)进行融合,融合后的细胞经过适当稀释,分置于96孔培养板中培养,培养10-14天进行ELISA检测,挑选OD值高的孔中的细胞进行有限稀释法亚克隆。具体方法如下:将有限稀释的细胞培养至96孔板中,待克隆生长到全孔的1/6时,标记单克隆及多克隆,对单克隆进行ELISA检测。ELISA检测后将OD值最高的单克隆再有限稀释接入96孔板中如上法所述再次亚克隆,此过程重复数次,直至阳性孔比率为100%,我们即认为此为单克隆。即我们通常认为的建株成功的细胞株。所述杂交瘤细胞株已经于2014年12月11日以保藏号CCTCCC2014228保藏于中国典型培养物保藏中心。将筛选得到的阳性单克隆扩大培养,细胞数按1-2x106/管进行冻存。同时收集细胞安排腹水制备。Table2:ELISA数据表,PC是阳性对照(PositiveControl),NC是阴性对照(NegativeControl)判断标准是:大于NC两倍且大于0.25的OD450值对应的稀释度值即为该抗体的效价。4.腹水制备细胞株采用小鼠腹腔接种法制备腹水,10-14天收集腹水,ELISA检测腹水是否制备成功。ELISA结果:AscitesIDtitreD2920-1hz-1-1R1M1M2/2D12800KD2920-1hz-1-1R1M1M2/2G5800KD2920-1hz-1-1R1M1M2/2F10100KD2920-1hz-1-1R1M1M2/2F3800KD2920-1hz-1-1R1M1M2/2A9800K5.抗体纯化挑选制备成功的小鼠腹水,采用ProteinG柱纯化,得到抗体。实施例2抗QKI-5的单克隆抗体在免疫印迹中的应用用实施例1制备所得单克隆抗体检测外源、内源QKI-5在细胞系中的蛋白表达,区分不同的异构体(图2、3)。以及检测不同小鼠组织中QKI-5的分布(图4)。将培养的HeLa细胞转染表达不同QKI异构体(QKI-5、QKI-6、QKI-7)的表达质粒,裂解全细胞,获得全蛋白,按照免疫印迹程序检测细胞裂解液中的QKI-5蛋白。这是检测外源QKI-5的蛋白表达(图2)。检测内源的蛋白表达,按照上述同样的方法,在H520细胞中检测QKI-5的表达(图3)。结果显示,该单克隆抗体可特异性识别QKI-5,而不识别QKI-6或者QKI-7其它异构体。而对于鼠源的QKI-5,该单克隆抗体也能很好的识别,并区别其在不同组织中的表达量(图4)。实施例3抗QKI5的单克隆抗体在免疫荧光中的应用利用实施例1中制备所得单克隆,采用免疫荧光的方法抗体检测QKI-5在BEAS2B中的细胞定位。在稳定敲低QKI的细胞中,QKI-5的表达几乎检测不到。而在正常的BEAS2B细胞系中,QKI-5定位于细胞核(图5)。上述实验说明:本发明抗QKI-5的单克隆抗体特异性高,仅仅识别QKI-5,对另外两种异构体QKI-6和QKI-7完全不识别,效价高,方便实验,且易于分离纯化。所述单克隆抗体的成功构建为把QKI-5开发成为监测肿瘤发生发展重要诊断方式提供了极具意义的工具,也给科研人员在实验过程中排除非特异性识别干扰提供了便利的手段。以上的实施例是为了说明本发明公开的实施方案,并不能理解为对本发明的限制。此外,本文所列出的各种修改以及发明中方法、组合物的变化,在不脱离本发明的范围和精神的前提下对本领域内的技术人员来说是显而易见的。虽然已结合本发明的多种具体优选实施例对本发明进行了具体的描述,但应当理解,本发明不应仅限于这些具体实施例。事实上,各种如上所述的对本领域内的技术人员来说显而易见的修改来获取发明都应包括在本发明的范围内。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1