基于GIP的混合激动剂用于治疗代谢紊乱和肥胖症的制作方法
相关申请的交叉引用
本申请要求享有以下申请的优先权:2008年6月17日提交的美国临时专利申请号61/073,274、2008年7月3日提交的美国临时专利申请号61/078,171、2008年8月20日提交的美国临时专利申请号61/090,448和2009年2月10日提交的美国临时专利申请号61/151,349。每一申请的公开内容以其整体在此明确引作参考。
本发明背景
前胰高血糖素原是158个氨基酸的前体多肽,其在不同组织中加工形成多种不同的胰高血糖素原衍生的肽,所述肽包括胰高血糖素、胰高血糖素样肽-1(GLP-1)、胰高血糖素样肽-2(GLP-2)和泌酸调节肽(OXM),它们涉及多种多样的生理功能,包括葡萄糖体内稳态、胰岛素分泌、胃排空和肠道生长以及摄食调节。胰高血糖素是29个氨基酸的肽,其对应于前胰高血糖素原的33到61位氨基酸,而产生的GLP-1作为对应于前胰高血糖素原的72到108位氨基酸的37个氨基酸肽。
当血糖开始下降时,由胰腺产生的激素胰高血糖素给肝脏发出信号分解肝糖并释放葡萄糖,导致血糖水平上升到正常水平。GLP-1具有与胰高血糖素相比不同的生物活性。其作用包括刺激胰岛素合成和分泌、抑制胰高血糖素分泌和抑制摄食。业已显示GLP-1在糖尿病患者中减弱高血糖症(高葡萄糖水平)。与GLP-1享有约50%氨基酸同一性的来自蜥蜴毒液的肽毒蜥外泌肽-4激活GLP-1受体并同样显示减弱糖尿病患者的高血糖症。
葡萄糖依赖性促胰岛素肽(GIP)是42个氨基酸的胃肠调节肽,其在葡萄糖存在下刺激胰腺β细胞分泌胰岛素。通过蛋白水解加工从133个氨基酸前体前GIP原获得GIP。
本发明简述
如本文所公开,提供作为天然胰高血糖素(SEQ ID NO:1)的类似物并表现出GIP活性的胰高血糖素肽。本发明亦提供使用所述肽的方法。
天然胰高血糖素不激活GIP受体,并通常具有约1%的天然-GLP-1对GLP-1受体的活性。对本文所述的天然胰高血糖素序列进行修饰,产生可表现以下活性的胰高血糖素肽:等同于或优于天然胰高血糖素(SEQ ID NO:1)活性的有效胰高血糖素活性、等同于或优于天然GIP(SEQ ID NO:4)活性的有效GIP活性和/或等同于或优于天然GLP-1活性的有效GLP-1活性。GLP-1(7-36)酰胺(SEQ ID NO:3)或GLP-1(7-37)(酸)(SEQ ID NO:2)为生物学上有效的GLP-1形式,它们对GLP-1受体显示基本上相等的活性。
本文所述数据显示,既具有GIP活性又具有GLP-1活性的肽对于诱导减重或防止增重以及用于治疗高血糖症(包括糖尿病)尤其有利。本文公开的体内数据证明,GIP激动剂活性与GLP-1激动剂活性组合比单独的GLP-1产生更大的减体重作用。为了减少日常摄食及减轻体重并提高胰岛素敏感性及能量消耗,拮抗GIP是可取的,鉴于本领域的这一教导,上述活性尤其是意想不到的。(Irwin等,Diabetologia 50:1532-1540(2007);和Althage等,J Biol Chem,2008年4月17日的电子出版物)
因此,本发明一方面提供用于诱导减重或防止增重的方法,所述方法涉及给予需要的患者有效量的化合物,例如胰高血糖素肽,它既对GIP受体又对GLP-1受体表现出活性,并任选还对胰高血糖素受体表现出活性。本文所述化合物包括GIP/GLP-1共-激动剂和胰高血糖素/GIP/GLP-1三-激动剂。
通过在1位的氨基酸修饰提供提高的针对GIP受体的活性。例如,用芳香族大氨基酸取代1位His,所述芳香族氨基酸任选为Tyr、Phe、Trp、氨基-Phe、硝基-Phe、氯-Phe、磺基-Phe、4-吡啶基-Ala、甲基-Tyr或3-氨基Tyr。
通过修饰提供提高的针对GIP受体的活性,所述修饰稳定胰高血糖素肽或其类似物的C-末端部分(12-29位氨基酸)的α螺旋结构。例如,可通过在i和i+4位置之间或j和j+3位置之间或k和k+7位置之间的两个氨基酸侧链间的共价键形成分子内桥。在例示性实施方案中,所述桥在12和16、16和20、20和24、24和28或17和20位之间。在其它实施方案中,在这些位置的带正电荷及带负电荷的氨基酸之间可形成非共价作用,例如盐桥。或者,例如通过在保留所需活性的位置有目的地引入一个或多个α,α-二取代氨基酸,可实现稳定胰高血糖素肽的C-末端部分(大约12-29位的氨基酸)的α螺旋结构。在某些实施方案中,胰高血糖素肽或其类似物的16、17、18、19、20、21、24或29位中的一个、二个、三个、四个或更多个位置被α,α-二取代氨基酸取代。例如,在缺乏盐桥或内酰胺时用氨基异丁酸(AIB)取代胰高血糖素肽或其类似物的16位,来提供稳定的α螺旋。本文认为所述肽为缺乏分子内桥的肽。在特定的方面,通过引入一个或多个α,α-二取代氨基酸而不引入共价分子内桥(例如内酰胺桥、二硫桥)来实现α-螺旋的稳定化。本文认为所述肽为缺乏共价分子内桥的肽。在某些实施方案中,用AIB取代16、20、21或24位中的一个、二个、三个或更多个。
通过在27和/或28位并任选29位的氨基酸修饰提供提高的针对GIP受体的活性。例如,用脂肪族大氨基酸任选Leu取代27位Met,用脂肪族小氨基酸任选Ala取代28位Asn,用脂肪族小氨基酸任选Gly取代29位Thr。
亦通过在12位的氨基酸修饰提供提高的针对GIP受体的活性。例如,用脂肪族非极性的大氨基酸任选Ile取代12位。
亦通过在17和/或18位的氨基酸修饰提供提高的针对GIP受体的活性。例如,用极性残基任选Gln取代17位,用脂肪族小氨基酸任选Ala取代18位。
通过在本文所述的天然胰高血糖素(SEQ ID NO:1)的16位的氨基酸修饰提供提高的针对胰高血糖素受体的活性。
例如,通过在本文所述的3位氨基酸修饰提供降低的、保持的或提高的针对胰高血糖素受体的活性。
通过修饰(其稳定胰高血糖素肽或其类似物的C-末端部分(12-29位氨基酸)的α螺旋结构)可恢复已经通过在1和/或2位的氨基酸修饰降低了的胰高血糖素的活性。例如,可通过在i和i+4位置之间或j和j+3位置之间或k和k+7位置之间的两个氨基酸侧链间的共价键形成分子内桥。在其它实施方案中,可在这些位置的带正电荷和带负电荷的氨基酸之间形成非共价作用,例如盐桥。在另外的其它实施方案中,在该C-末端部分(12-29位氨基酸)的保留所需活性的位置插入或取代一个或多个α,α-二取代氨基酸。例如,16、20、21或24位中的一个、二个、三个或全部位置被α,α-二取代氨基酸(例如AIB)取代。
通过用电中性基团(例如酰胺或酯)取代C-末端氨基酸的羧酸提供提高的针对GLP-1受体的活性。
通过稳定胰高血糖素肽或其类似物的C-末端部分(大约12-29位氨基酸)的α-螺旋结构的修饰提供提高的针对GLP-1受体的活性。在某些实施方案中,可通过在i和i+4位置之间或j和j+3位置之间或k和k+7位置之间的两个氨基酸侧链间的共价键形成分子内桥。在其它实施方案中,可在这些位置的带正电荷和带负电荷的氨基酸之间形成非共价作用,例如盐桥。在另外的其它实施方案中,在该C-末端部分(12-29位氨基酸)的保留所需活性的位置插入或取代一个或多个α,α-二取代氨基酸。例如,16、20、21或24位中的一个、二个、三个或全部位置被α,α-二取代氨基酸(例如AIB)取代。
通过在本文所述的20位氨基酸的修饰提供提高的针对GLP-1受体的活性。
通过将C-末端延伸肽例如GPSSGAPPPS(SEQ ID NO:95)或XGPSSGAPPPS(SEQ ID NO:96)添加到C-末端提供提高的针对GLP-1受体的活性。可通过修饰本文所述的18、28或29位或18和29位的氨基酸,来进一步提高所述类似物的GLP-1活性。
通过将10位的氨基酸更改为芳香族大氨基酸残基(任选Trp)来使GLP-1效能更为适中地增加。
如本文所述,例如通过在7位的氨基酸修饰,通过缺失位于27或28位氨基酸的C-末端处的一个或多个氨基酸以产生27个或28个氨基酸的肽,或通过其组合,来提供降低的针对GLP-1受体的活性。
通过将GPSSGAPPPS(SEQ ID NO:95)添加到C-末端来提供聚乙二醇化后的活性保留。
如本文所证明,通过以下来提供保持的或增加的针对胰高血糖素受体、GLP-1受体和GIP受体中每一种的活性(与含内酰胺的具有GIP-活性的基于胰高血糖素的类似物比较):(i)用式IV氨基酸进行16位Ser的氨基酸取代:
其中n为1-16或1-10或1-7或1-6或2-6或2或3或4或5,R1和R2各独立选自H、C1-C18烷基、(C1-C18烷基)OH、(C1-C18烷基)NH2、(C1-C18烷基)SH、(C0-C4烷基)(C3-C6)环烷基、(C0-C4烷基)(C2-C5杂环)、(C0-C4烷基)(C6-C10芳基)R7和(C1-C4烷基)(C3-C9杂芳基),其中R7为H或OH,式IV氨基酸侧链包含游离氨基;和(ii)用α,α-二取代氨基酸(例如AIB)进行20位Gln的氨基酸取代。在某些实施方案中,16位氨基酸为Lys,20位氨基酸为AIB。
包含16位式IV氨基酸和20位α,α二-取代氨基酸的类似物针对胰高血糖素受体、GLP-1受体和GIP受体中每一种的活性,可通过延长肽的长度来进一步提高,例如通过与例如长约1-21、约9-21、约6-18、约9-12或约10或11个氨基酸的C-末端延伸肽融合。在某些实施方案中,通过与GPSSGAPPPS(SEQ ID NO:95)或XGPSSGAPPPS(SEQ ID NO:96)融合来延伸C-末端,其中X为Gly或脂肪族或非极性或稍带极性的小氨基酸。在备选实施方案中,通过与GPSSGAPPPS(SEQ ID NO:95)融合来延长C-末端并将1-11个氨基酸(例如1-5或1、2、3、4、5、6、7、8、9、10、11个氨基酸)融合到GPSSGAPPPS(SEQ ID NO:95)的C-末端。GPSSGAPPPS(SEQ ID NO:95)的C-末端的1-11个氨基酸可包含例如一个或多个脂肪族小氨基酸,例如Ala或Gly。在这点上,C-末端延伸可为例如GPSSGAPPPSXm,其中m为1-11(例如1-5),而X为Ala或Gly。或者,融合到SEQ ID NO:95C-末端的1-11(例如1-5)个氨基酸可为不同的脂肪族小氨基酸的组合。例如,1-11(例如1-5)个氨基酸可为Ala和Gly残基的组合。
在对位于C-末端突出端(extension)内的氨基酸或C-末端氨基酸(例如加到C-末端突出端的C-末端的氨基酸)进行酰化或烷化后,可进一步实现具有GIP活性的基于胰高血糖素的类似物(包括包含16位式IV氨基酸和20位α,α二取代氨基酸的类似物)针对胰高血糖素、GLP-1和GIP受体中每一种的活性的提高。酰化或烷化可为位于例如30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49和50位中的任何位置上的氨基酸。在某些实施方案中,酰化或烷化的氨基酸位于37、38、39、40、41、42或43位。在某些实施方案中,酰化或烷化的氨基酸为连接到酰基或烷基(例如C10-C22)的Lys。在某些实施方案中,Lys位于由SEQ ID NO:95氨基酸序列组成的C-末端突出端的C-末端,致使Lys位于类似物的40位。任选酰化的C-末端延伸肽亦例如在24位聚乙二醇化。
可通过经由间隔物(例如氨基酸、二肽、三肽、亲水双官能间隔物、疏水双官能间隔物)的氨基酸酰化或烷化,另外实现具有GIP活性的基于胰高血糖素的类似物针对胰高血糖素、GLP-1和GIP受体中每一种的活性的提高。在某些实施方案中,具有GIP活性的基于胰高血糖素的类似物包含经由间隔物的酰基或烷基,所述间隔物与类似物的10位或40位氨基酸的侧链连接。在其它实施方案中,类似物包含位于29位氨基酸的C-末端处的1-21个氨基酸的C-末端突出端并且与酰基或烷基共价连接的间隔物与对应于关于SEQ ID NO:1的37-43位之一的位置的突出端的氨基酸连接。在某些实施方案中,间隔物长3-10个原子。在特定方面,间隔物和酰基或烷基的总长约14-约28个原子。本文进一步阐述用于提高针对胰高血糖素、GLP-1和GIP受体中的一种或多种活性目的的合适间隔物。
可单独施用或联合施用提高或降低GIP活性、提高或降低胰高血糖素受体活性和提高或降低GLP-1受体活性的任何上述修饰。也可让任何上述修饰与提供其它期需性质(例如增加溶解性和/或稳定性和/或作用时间)的其它修饰联合。或者,任何上述修饰可与基本上不影响溶解性或稳定性或活性的其它修饰联合。例示性修饰包括但不限于:
(A)例如通过在天然胰高血糖素的C-末端部分(优选在27位的C-末端位置)引入一个、二个、三个或更多个带电荷的氨基酸来改进溶解性。可通过用带电荷的氨基酸例如在28或29位取代天然氨基酸来引入所述带电荷的氨基酸,或作为备选通过例如在27、28或29位后面添加带电荷的氨基酸来引入所述带电荷的氨基酸。在例示性实施方案中,一个、二个、三个或全部带电荷的氨基酸带负电荷。在其它实施方案中,一个、二个、三个或全部带电荷的氨基酸带正电荷。所述修饰增加溶解性,例如当24小时后在25C测量时,在约5.5和8之间的给定pH(例如pH 7)下,提供相对于天然胰高血糖素至少2-倍、5-倍、10-倍、15-倍、25-倍、30-倍或更大的溶解性;
(B)如本文所述,通过例如在肽的16、17、20、21、24或29位、C-末端突出端内或C-末端氨基酸添加亲水部分(例如聚乙二醇链),来增加溶解性和作用时间或循环半衰期;
(C)如本文所述,通过对胰高血糖素肽的酰化或烷化来增加溶解性和/或作用时间或循环半衰期,和/或延迟作用开始;
(D)如本文所述,通过修饰1或2位氨基酸引入对二肽基肽酶IV(DPP IV)裂解的抗性来增加作用时间或循环半衰期;
(E)通过修饰15位的Asp,例如通过缺失或用谷氨酸、高谷氨酸、半胱磺酸(cysteic acid)或高半胱磺酸(homocysteic acid)取代,来提高稳定性。所述修饰可在5.5-8的pH范围内减少降解或裂解,例如在24小时后于25℃保留至少75%、80%、90%、95%、96%、97%、98%或99%、直至100%的原始肽。所述修饰减少Asp15-Ser16之间的肽键的裂解;
(F)通过修饰16位的Ser,例如通过用Thr或AIB取代,来提高稳定性。所述修饰亦减少Asp15-Ser16之间的肽键的裂解;
(G)通过修饰27位的甲硫氨酸,例如通过用亮氨酸或正亮氨酸取代,来提高稳定性。所述修饰可减少氧化性降解。亦可通过修饰20或24位的Gln,例如通过用Ala、Ser、Thr或AIB取代,来提高稳定性。所述修饰可减少通过Gln脱酰胺化发生的降解。可通过修饰21位的Asp,例如通过用Glu取代,来提高稳定性。所述修饰可减少通过Asp脱水以形成环状琥珀酰亚胺中间体接着异构化为异天冬氨酸盐而发生的降解;
(H)基本上不影响活性的非保守性或保守性取代、添加或缺失,例如,在2、5、9、10、11、12、13、14、15、16、17、18、19、20、21、24、27、28或29位中的一个或多个位置的保守性取代;用Ala取代这些位置中的一个或多个;缺失27、28或29位中的一个或多个氨基酸;或缺失29位氨基酸,其任选与用C-末端酰胺或酯代替C-末端羧酸基团联合;用Arg取代12位的Lys;用Val或Phe取代10位的Tyr。
在某些实施方案中,本文所述胰高血糖素肽表现出的GIP受体激活活性的EC50为约100nM或更小或约75、50、25、10、8、6、5、4、3、2或1nM或更小。在某些实施方案中,本文所述胰高血糖素肽表现出针对GIP受体的EC50为约0.001nM、0.01nM或0.1nM。在某些实施方案中,本文所述胰高血糖素肽表现出针对GIP受体的EC50为不大于约1nM、2nM、3nM、4nM、5nM、6nM、8nM、10nM、15nM、20nM、25nM、30nM、40nM、50nM、75nM或100nM。在某些实施方案中,胰高血糖素肽表现出的胰高血糖素受体激活EC50为约100nM或更小或约75、50、25、10、8、6、5、4、3、2或1nM或更小。在某些实施方案中,本文所述胰高血糖素肽表现出针对胰高血糖素受体的EC50为约0.001nM、0.01nM或0.1nM。在某些实施方案中,胰高血糖素受体的EC50不大于约1nM、2nM、3nM、4nM、5nM、6nM、8nM、10nM、15nM、20nM、25nM、30nM、40nM、50nM、75nM或100nM。在某些实施方案中,胰高血糖素肽表现出GLP-1受体激活EC50为约100nM或更小或约75、50、25、10、8、6、5、4、3、2或1nM或更小。在某些实施方案中,本文所述胰高血糖素肽表现出针对GLP-1受体的EC50为约0.001nM、0.01nM或0.1nM。在某些实施方案中,针对GLP-1受体的EC50为不大于约1nM、2nM、3nM、4nM、5nM、6nM、8nM、10nM、15nM、20nM、25nM、30nM、40nM、50nM、75nM或100nM。可通过体外测定来测量受体激活,所述体外测定在过表达所述受体的HEK293细胞中测量cAMP诱导,例如测定用编码受体和连接到cAMP响应元件的荧光素酶基因的DNA共转染的HEK293细胞,其如实施例16所述。
在某些实施方案中,胰高血糖素肽相对于天然GIP(GIP效价)表现出针对GIP受体的至少约0.1%、0.2%、0.3%、0.4%、0.5%、0.6%、0.7%、0.8%、0.9%、1%、5%、10%、20%、30%、40%、50%、60%、75%、100%、125%、150%、175%或200%或更高的活性。在某些实施方案中,本文所述胰高血糖素肽相对于天然GIP表现出针对GIP受体的活性不大于1000%、10,000%、100,000%或1,000,000%。在某些实施方案中,胰高血糖素肽相对于天然胰高血糖素(胰高血糖素效价)表现出针对胰高血糖素受体的至少约1%、5%、10%、20%、30%、40%、50%、60%、75%、100%、125%、150%、175%、200%、250%、300%、350%、400%、450%或500%或更高的活性。在某些实施方案中,本文所述胰高血糖素肽相对于天然胰高血糖素表现出针对胰高血糖素受体的活性不大于1000%、10,000%、100,000%或1,000,000%。在某些实施方案中,胰高血糖素肽相对于天然GLP-1(GLP-1效价)表现出针对GLP-1受体的至少约0.1%、0.2%、0.3%、0.4%、0.5%、0.6%、0.7%、0.8%、0.9%、1%、5%、10%、20%、30%、40%、50%、60%、75%、100%、125%、150%、175%或200%或更高的活性。在某些实施方案中,本文所述胰高血糖素肽相对于天然GLP-1表现出针对GLP-1受体的活性不大于1000%、10,000%、100,000%或1,000,000%。将胰高血糖素肽相对于某受体的天然配体针对该受体的活性计算为胰高血糖素肽对天然配体的EC50的反比。
因此,本发明一方面提供既对胰高血糖素受体又对GIP受体表现出活性的胰高血糖素肽(“胰高血糖素/GIP共激动剂”)。这些胰高血糖素肽失去了天然胰高血糖素对胰高血糖素受体优于GIP受体的选择性。在某些实施方案中,胰高血糖素肽针对GIP受体的EC50与其针对胰高血糖素受体的EC50有小于约50-倍、40-倍、30-倍或20-倍的差异(更高或更低)。在某些实施方案中,胰高血糖素肽的GIP效价与胰高血糖素肽的胰高血糖素效价有小于约500-倍、450-倍、400-倍、350-倍、300-倍、250-倍、200-倍、150-倍、100-倍、75-倍、50-倍、25-倍、20-倍、15-倍、10-倍或5-倍的差异(更高或更低)。在某些实施方案中,胰高血糖素肽针对GIP受体的EC50除以胰高血糖素肽针对胰高血糖素受体的EC50的比率小于约100、75、60、50、40、30、20、15、10或5。在某些实施方案中,针对GIP受体的EC50除以针对胰高血糖素受体的EC50的比率为约1或小于约1(例如约0.01、0.013、0.0167、0.02、0.025、0.03、0.05、0.067、0.1、0.2)。在某些实施方案中,胰高血糖素肽的GIP效价与胰高血糖素肽的胰高血糖素效价比较的比率小于约500、450、400、350、300、250、200、150、100、75、60、50、40、30、20、15、10或5。在某些实施方案中,针对GIP受体的效价除以针对胰高血糖素受体的效价的比率为约1或小于约1(例如约0.01、0.013、0.0167、0.02、0.025、0.03、0.05、0.067、0.1、0.2)。在某些实施方案中,例如通过7位的氨基酸修饰,通过缺失位于27或28位氨基酸的C-末端处的一个或多个氨基酸以产生27-或28-个氨基酸的肽或其组合,业已显著降低或破坏GLP-1活性。
本发明另一方面提供表现出针对胰高血糖素、GIP和GLP-1受体活性的胰高血糖素肽(“胰高血糖素/GIP/GLP-1三-激动剂”)。这些胰高血糖素肽失去了天然胰高血糖素对胰高血糖素受体优于GLP-1受体和GIP受体这二种受体的选择性。在某些实施方案中,胰高血糖素肽针对GIP受体的EC50与其分别针对胰高血糖素受体和GLP-1受体的EC50有小于约50-倍、40-倍、30-倍或20-倍的差异(更高或更低)。在某些实施方案中,胰高血糖素肽的GIP效价与胰高血糖素肽的胰高血糖素和GLP-1效价有小于约500、450、400、350、300、250、200、150、100、75、50、25、20、15、10或5倍的差异(更高或更低)。在某些实施方案中,三-激动剂针对GIP受体的EC50除以三-激动剂针对GLP-1受体的EC50的比率小于约100、75、60、50、40、30、20、15、10或5。在某些实施方案中,针对GIP受体的EC50除以针对GLP-1受体的EC50的比率为约1或小于约1(例如约0.01、0.013、0.0167、0.02、0.025、0.03、0.05、0.067、0.1、0.2)。在某些实施方案中,三-激动剂的GIP效价与三-激动剂的GLP-1效价比较的比率小于约100、75、60、50、40、30、20、15、10或5。在某些实施方案中,针对GIP受体的效价除以针对GLP-1受体效价的比率为约1或小于约1(例如约0.01、0.013、0.0167、0.02、0.025、0.03、0.05、0.067、0.1、0.2)。在相关实施方案中,三-激动剂针对GIP受体的EC50除以三-激动剂针对胰高血糖素受体的EC50的比率小于约100、75、60、50、40、30、20、15、10或5。在某些实施方案中,针对GIP受体的EC50除以针对胰高血糖素受体的EC50的比率为约1或小于约1(例如约0.01、0.013、0.0167、0.02、0.025、0.03、0.05、0.067、0.1、0.2)。在某些实施方案中,三-激动剂的GIP效价与三-激动剂的胰高血糖素效价比较的比率小于约500、450、400、350、300、250、200、150、100、75、60、50、40、30、20、15、10或5。在某些实施方案中,针对GIP受体的效价除以针对胰高血糖素受体的效价的比率为约1或小于约1(例如约0.01、0.013、0.0167、0.02、0.025、0.03、0.05、0.067、0.1、0.2)。在某些实施方案中,三-激动剂针对GLP-1受体的EC50除以三-激动剂针对胰高血糖素受体的EC50的比率小于约100、75、60、50、40、30、20、15、10或5。在某些实施方案中,针对GLP-1受体的EC50除以针对胰高血糖素受体的EC50的比率为约1或小于约1(例如约0.01、0.013、0.0167、0.02、0.025、0.03、0.05、0.067、0.1、0.2)。在某些实施方案中,三-激动剂的GLP-1效价与三-激动剂的胰高血糖素效价比较的比率小于约100、75、60、50、40、30、20、15、10或5。在某些实施方案中,针对GLP-1受体的效价除以针对胰高血糖素受体的效价的比率为约1或小于约1(例如约0.01、0.013、0.0167、0.02、0.025、0.03、0.05、0.067、0.1、0.2)。
本发明又一方面提供具有以下特性的胰高血糖素肽(“GIP/GLP-1共激动剂”):表现出既针对GLP-1受体又针对GIP受体的活性,但例如通过3位的氨基酸修饰业已显著降低或破坏胰高血糖素活性。例如,用酸性、碱性或疏水氨基酸(谷氨酸、鸟氨酸、正亮氨酸)在该位置取代来降低胰高血糖素活性。在某些实施方案中,胰高血糖素肽针对GIP受体的EC50与其针对GLP-1受体的EC50有小于约50-倍、40-倍、30-倍或20-倍的差异(更高或更低)。在某些实施方案中,胰高血糖素肽的GIP效价与胰高血糖素肽的GLP-1效价有小于约25、20、15、10或5倍的差异(更高或更低)。在某些实施方案中,这些胰高血糖素肽具有天然胰高血糖素针对胰高血糖素受体活性的约10%或更小,例如约1-10%或约0.1-10%或大于约0.1%但小于约10%。在某些实施方案中,胰高血糖素肽针对GIP受体的EC50除以胰高血糖素肽针对GLP-1受体的EC50的比率小于约100、75、60、50、40、30、20、15、10或5但不小于1。在某些实施方案中,胰高血糖素肽的GIP效价与胰高血糖素肽的GLP-1效价比较的比率小于约100、75、60、50、40、30、20、15、10或5但不小于1。
本发明另外方面提供具有以下特性的胰高血糖素肽(“GIP激动剂胰高血糖素肽”):表现出针对GIP受体的活性,但例如通过3和7位的氨基酸修饰业已显著降低或破坏胰高血糖素和GLP-1活性。在某些实施方案中,这些胰高血糖素肽具有天然胰高血糖素针对胰高血糖素受体活性的约10%或更小,例如约1-10%或约0.1-10%或大于约0.1%、0.5%或1%但小于约1%、5%或10%。在某些实施方案中,这些胰高血糖素肽亦具有天然GLP-1针对GLP-1受体活性的约10%或更小,例如约1-10%或约0.1-10%或大于约0.1%、0.5%或1%但小于约1%、5%或10%。
根据本发明某些实施方案,具有GIP激动剂活性的胰高血糖素(SEQ ID NO:1)类似物包含含有以下修饰的SEQ ID NO:1:(a)提供GIP激动剂活性的1位氨基酸修饰;(b)稳定类似物的C-末端部分(12-29位氨基酸)的α螺旋结构的修饰;和(c)任选1-10(例如1、2、3、4、5、6、7、8、9、10)个另外的氨基酸修饰。在某些实施方案中,类似物表现出天然GIP针对GIP受体的活性的至少约1%,或本文所述的针对GIP受体的任何其它活性水平。稳定α螺旋结构的修饰可为本领域已知的任何修饰,例如本文所述的任何修饰。参见“α螺旋结构的稳定化”章节下的教导。在某些实施方案中,稳定α螺旋结构的修饰为选自以下的修饰:(i)在i和i+4位置的氨基酸侧链之间或在j和j+3位置的氨基酸侧链之间的内酰胺桥,其中i为12、13、16、17、20或24,其中j为17;和(ii)在类似物的16、20、21和24位中的一个、二个、三个或全部氨基酸被α,α-二取代氨基酸取代。本文进一步阐述所述具有GIP激动剂活性的胰高血糖素类似物。
在某些实施方案中,本发明提供具有GIP激动剂活性的胰高血糖素(SEQ ID NO:1)类似物,且含以下修饰:
(a)1位氨基酸修饰;
(b)(i)i和i+4位置的氨基酸侧链之间或j和j+3位置的氨基酸侧链之间的内酰胺桥,其中i为12、13、16、17、20或24,其中j为17;或(ii)用α,α-二取代氨基酸取代16、20、21或24位中的一个、二个、三个或全部氨基酸;
(c)在27、28和29位中的一个、两个或全部位置的氨基酸修饰;和
(d)1、2、3、4、5、6或8个另外的氨基酸修饰;
其中类似物的GIP受体激活EC50为约100nM或更小。
在例示性实施方案中:
(a)1位氨基酸修饰是在1位用芳香族大氨基酸取代His,所述芳香族大氨基酸任选为Tyr、Phe、Trp、氨基-Phe、硝基-Phe、氯-Phe、磺基-Phe、4-吡啶基-Ala、甲基-Tyr或3-氨基Tyr;
(b)(i)内酰胺桥在16和20位氨基酸之间,其中16和20位的氨基酸之一被Glu取代,16和20位的其他氨基酸被Lys取代;或(ii)所述α,α-二取代氨基酸为AIB;
(c)用脂肪族大氨基酸任选Leu取代27位Met;
(d)用脂肪族小氨基酸任选Ala取代28位Asn;和
(e)用脂肪族小氨基酸任选Gly取代29位Thr。
类似物可包含更多的修饰,所述修饰包括但不限于:
(a)12位的氨基酸修饰,任选用Ile取代;
(b)17和18位的氨基酸修饰,任选在17位用Q取代,在18位用A取代;
(c)将GPSSGAPPPS(SEQ ID NO:95)添加到C-末端;
或其任何组合。
类似物可作为备选或另外包含更多的修饰,所述修饰包括但不限于:
(a)用D-Ser、Ala、D-Ala、Gly、N-甲基-Ser、AIB、Val或α-氨基-N-丁酸取代2位Ser;
(b)用Trp、Lys、Orn、Glu、Phe或Val取代10位Tyr;
(c)酰基与10位的Lys连接;
(d)用Arg取代12位Lys;
(e)用Glu、Gin、高谷氨酸、高半胱磺酸、Thr、Gly或AIB取代16位Ser;
(f)用Gln、Lys或Glu取代17位Arg;
(g)用Ala、Ser、Thr或Gly取代18位Arg;
(h)用Ala、Ser、Thr、Lys、瓜氨酸、Arg、Orn或AIB取代20位Gln;
(i)用Glu、高谷氨酸、高半胱磺酸取代21位Asp;
(j)用Ile取代23位Val;
(k)用Asn、Ala、Ser、Thr、Glu、Lys或AIB取代24位Gln;知
(l)在2、5、9、10、11、12、13、14、15、16、17、18、19、20、21、24、27、28和29位中的任何位置的保守性取代;
或其任何组合。
在某些实施方案中,当胰高血糖素肽未聚乙二醇化时,类似物的GIP受体激活EC50为约4、2、1nM或更小,或类似物具有天然GIP针对GIP受体活性的至少约1%、2%、3%、4%或5%。在相关实施方案中,未聚乙二醇化的类似物对GLP-1受体激活的EC50为约4、2、1nM或更小,或具有天然GLP-1针对GLP-1受体活性的至少约1%、2%、3%、4%或5%。在另外的其它相关实施方案中,未聚乙二醇化类似物对胰高血糖素受体激活的EC50为约4、2、1nM或更小,或具有天然胰高血糖素针对胰高血糖素受体活性的至少约5%、10%、15%或20%。在某些实施方案中,未聚乙二醇化类似物具有小于约1%的天然胰高血糖素针对胰高血糖素受体的活性。在其它实施方案中,未聚乙二醇化类似物具有小于约10%、5%或1%的天然GLP-1针对GLP-1受体的活性。
在某些实施方案中,在16、17、20、21、24或29位氨基酸、29位后的C-末端突出端内添加的氨基酸(例如30位)或在C-末端氨基酸的任何氨基酸位置,胰高血糖素肽与亲水部分共价连接。在例示性实施方案中,所述亲水部分在这些位置的任意之处与Lys、Cys、Orn、高半胱氨酸或乙酰基-苯丙氨酸残基共价连接。例示性的亲水部分包括例如分子量约1,000道尔顿-约40,000道尔顿或约20,000道尔顿-约40,000道尔顿的聚乙二醇(PEG)。
在其中类似物与亲水部分(例如PEG)连接的所述实施方案中,所述类似物与缺乏亲水部分的类似物比较针对一种或多种受体的相对EC50可能更高,例如约高10-倍。例如,聚乙二醇化类似物对GIP受体激活的EC50为约10nM或更小,或所述类似物具有至少约0.1%、0.2%、0.3%、0.4%或0.5%的天然GIP针对GIP受体的活性。在相关实施方案中,聚乙二醇化类似物对GLP-1受体激活的EC50为约10nM或更小,或具有至少约0.1%、0.2%、0.3%、0.4%或0.5%的天然GLP-1针对GLP-1受体的活性。在另外的其它相关实施方案中,聚乙二醇化类似物对胰高血糖素受体激活的EC50为约10nM或更小,或具有至少约0.5%、1%、1.5%或2%的天然胰高血糖素针对胰高血糖素受体的活性。在某些实施方案中,类似物具有小于约1%的天然胰高血糖素针对胰高血糖素受体的活性。在其它实施方案中,类似物具有小于约10%、5%或1%的天然GLP-1针对GLP-1受体的活性。
胰高血糖素肽可为包含经由接头连接的至少二个、三个或更多个肽的二聚体、三聚体或高次多聚体的部分,其中至少一个或两个肽都为胰高血糖素肽。二聚体可为同二聚体或异二聚体。在某些实施方案中,接头选自双官能硫醇交联剂和双官能胺交联剂。在某些实施方案中,接头为PEG,例如5kDa PEG、20kDa PEG。在某些实施方案中,接头为二硫键。例如,二聚体的每一单体可包含Cys残基(例如末端Cys或内部位置Cys),每一Cys残基的硫原子参与二硫键的形成。在本发明某些方面,经由末端氨基酸(例如N-末端或C-末端)、经由内部氨基酸或经由至少一个单体的末端氨基酸和至少另一个单体的内部氨基酸来连接单体。在特定方面,经由N-末端氨基酸连接单体。在某些方面,以“尾对尾”的方向将多聚体的单体连接在一起,其中将每一单体的C-末端氨基酸连接在一起。可将缀合物部分共价连接到任何本文所述胰高血糖素肽,所述胰高血糖素肽包括二聚体、三聚体或高次多聚体。
可对胰高血糖素肽单独或联合施用任何以下本文所述修饰,所述修饰提高胰高血糖素受体活性,保留部分胰高血糖素受体活性,改进溶解性,提高稳定性或减少降解。在某些实施方案中,胰高血糖素肽在至少1mg/mL浓度时于6和8之间或6和9之间或7和9之间的pH(例如pH7)时为可溶,并在24小时后于25℃时任选保留原始肽的至少95%(例如原始肽的5%或更少被降解或裂解)。
提供了包含可药用载体或稀释剂的无菌药物组合物和包含器具(device)的药盒。提供了减少增重或诱导减重的方法,所述方法包括给予有需要的患者有效量的所述药物组合物,以减少增重或诱导减重。提供了治疗糖尿病的方法,所述方法包括给予有需要的患者有效量的所述药物组合物以降低血糖水平。
本文所述所有治疗方法、药物组合物、药盒和其它类似的实施方案涵盖术语肽、激动剂、共激动剂、三-激动剂或类似物的应用包括其所有可药用盐或酯。
前述简述并非意欲界定本发明的每一方面,在其它章节例如“详述”中阐述了其它实施方案。意欲将整篇文献叙述为统一的公开内容,应该理解,即使在本文的同一个句子或段落或章节中未同时找到本文所述特征的组合,但可涵盖所有可能的特征组合。
此外,本发明包括以任何方式比由本文特定段落定义的变体更窄范围的本发明的任何一个或所有的实施方案。例如,在将本发明某些方面阐述为某种类型(genus)时,应该理解该类型中的每一个成员单独是本发明实施方案,所述类型的两个或多个成员的组合也是本发明实施方案。
附图简述
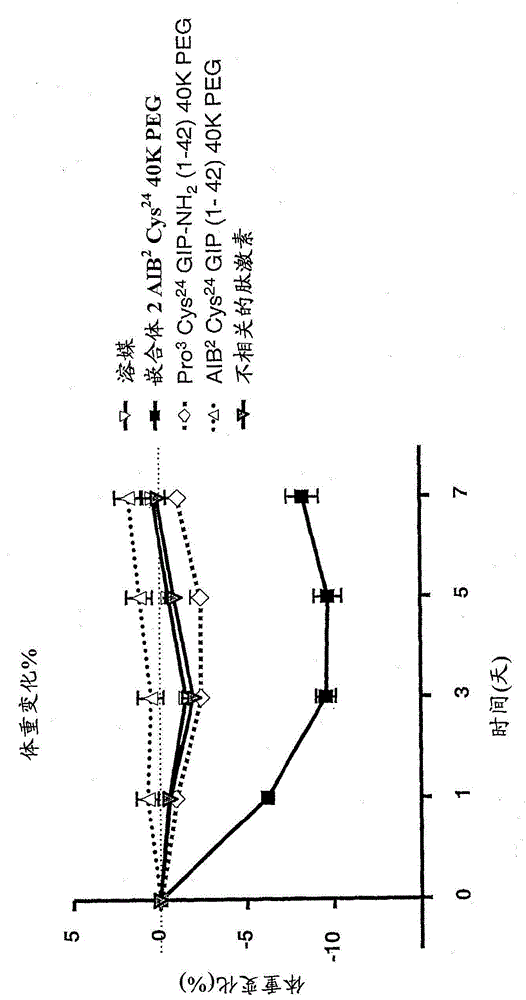
图1表示在给予单独溶媒(空心倒三角)、嵌合体2AIB2Cys24(40K PEG)(闭合方框)、GIP拮抗剂Pro3Cys24GIP-NH2(1-42)40K PEG(空心菱形)、GIP激动剂AIB2Cys24GIP(1-42)40K PEG(带点线的空心正三角)或不相关的肽激素(带阴影倒三角)后,作为时间(天)函数的小鼠体重变化%的图表。
图2表示在给予单独溶媒(空心倒三角)、嵌合体2AIB2Cys2440K PEG(闭合方框)、GIP拮抗剂Pro3Cys24GIP-NH2(1-42)40K PEG(空心菱形)、GIP激动剂AIB2Cys24GIP(1-42)40K PEG(带点线的空心正三角)或不相关的肽激素(带阴影倒三角)后,作为时间函数的小鼠摄食(以克表示)的图表。
图3表示在给予单独溶媒(黑条)、嵌合体2AIB2Cys24(40K PEG)(白条)、GIP拮抗剂Pro3Cys24GIP-NH2(1-42)40K PEG(阴影条)、GIP激动剂AIB2Cys24GIP(1-42)40K PEG(水平线条)或不相关肽激素(垂直线条)后第7天小鼠的血糖水平变化(mg/dL)的图表。
图4表示在给予单独溶媒(闭合倒三角)、嵌合体2AIB2(空心菱形)、嵌合体2AIB2内酰胺(空心三角)、三激动剂肽MT-170(空心方框)、GIP/胰高血糖素共激动剂肽MT-182(闭合菱形)、GLP-1/GIP共激动剂肽MT-178(带点线的阴影三角)或GIP/胰高血糖素共激动剂肽MT-179(闭合方框)后,作为时间函数(天)的小鼠体重变化%图表。注意聚乙二醇化MT-179作为三激动剂起作用。
图5为在给予单独溶媒(闭合正三角)、10nmol/kg(闭合倒三角)或35nmol/kg(空心方框)的GLP-1E 16激动剂、10nmol/kg(空心倒三角)或35nmol/kg(闭合菱形)的三激动剂肽MT-170或10nmol/kg(灰色倒三角)或35nmol/kg(灰色方框)的GLP-1/GIP共激动剂肽MT-178后,作为时间函数(天)的小鼠体重变化%图表。
图6在给予单独溶媒(黑条)、10nmol/kg(白条)或35nmol/kg(灰条)的GLP-1E 16激动剂、10nmol/kg(水平线条)或35nmol/kg(垂直线条)的三激动剂肽MT-170或10nmol/kg(右斜线线条)或35nmol/kg(左斜线线条)的GLP-1/GIP共激动剂肽MT-178后第7天小鼠的血糖水平变化(mg/dL)的图表。
图7表示在葡萄糖注射(在0时间点给予)前后作为时间函数的小鼠血糖水平(mg/dL)的图表,所述小鼠已经用溶媒对照、GLP-1激动剂肽对照、含有内酰胺(环状)的聚乙二醇化的具有GIP活性的胰高血糖素类似物(“mt-178”)或缺乏内酰胺(线性)的聚乙二醇化的具有GIP活性的胰高血糖素类似物(“mt-274”)以1、3或10nmol/kg/周进行注射(在-60的时间点)。本图数据排除了四只小鼠的数据,因为这些小鼠表现出攻击性行为并严重失重。
图8表示在葡萄糖注射(在0时间点给予)前后作为时间函数的小鼠血糖水平(mg/dL)的图表,所述小鼠已经用溶媒对照、GLP-1激动剂肽对照、mt-178或mt-274以1、3或10nmol/kg/周进行注射(在葡萄糖注射前24小时)。本图数据排除了四只小鼠的数据,因为这些小鼠表现出攻击性行为并严重失重。
图9表示在用溶媒对照、GLP-1激动剂肽对照、mt-178或mt-274以1、3或10nmol/kg/周进行注射后0或7天小鼠的血糖水平(mg/dL)的图表。本图数据排除了四只小鼠的数据,因为这些小鼠表现出攻击性行为并严重失重。
图10表示在用溶媒对照、GLP-1激动剂肽对照、mt-178或mt-274以1、3或10nmol/kg/周注射后的0、1、3、5和7天小鼠体重变化百分比的图表。本图数据排除了四只小鼠的数据,因为这些小鼠表现出攻击性行为并严重失重。
图11表示在用溶媒对照、GLP-1激动剂肽对照、mt-178、mt-178(TE)、mt-274或mt-274(TE)以10或35nmol/kg/周注射后的0或7天小鼠血糖水平(mg/dL)的图表。“TE”表示与40位Cys连接的PEG基团。
图12表示在用溶媒对照、GLP-1激动剂肽对照、mt-178、mt-178(TE)、mt-274或mt-274(TE)以10或35nmol/kg/周注射后7天小鼠的血糖(mg/dL)变化图表。“TE”表示与40位Cys连接的PEG基团。
图13表示在用溶媒对照、GLP-1激动剂肽对照、mt-178、mt-178(TE)、mt-274或mt-274(TE)以10或35nmol/kg/周注射后0、1、3、5、7和10天小鼠体重变化百分比的图表。“TE”表示与40位Cys连接的PEG基团。
图14表示在用溶媒对照、GLP-1激动剂肽对照、mt-178、mt-178(TE)、mt-274或mt-274(TE)以10或35nmol/kg/周注射后7天小鼠体重变化百分比的图表。“TE”表示与40位Cys连接的PEG基团。
图15表示在用溶媒对照、GLP-1激动剂肽对照、mt-178、mt-274、线性未聚乙二醇化未酰化的肽(“mt-311”)、C14脂肪酰化线性肽(“mt-309”)、C16脂肪酰化线性肽(“mt-298”)或C18脂肪酰化线性肽(“mt-310”)以10nmol/kg注射后0或7天小鼠血糖水平(mg/dL)的图表。
图16表示在用溶媒对照、GLP-1激动剂肽对照、mt-178、mt-274、mt-311、mt-309、mt-298或mt-310以10nmol/kg注射后的0、1、3、5和7天小鼠的体重变化百分比图表。
图17表示在用溶媒对照、GLP-1激动剂肽对照、mt-178、mt-274、mt-311、mt-309、mt-298或mt-310以10nmol/kg注射后7天小鼠体重变化百分比图表。
图18表示在用溶媒对照、利拉鲁肽(liraglutide)(酰化GLP-1类似物)、C14脂肪酰化的未聚乙二醇化线性肽(“mt-260”)、C16脂肪酰化的未聚乙二醇化线性肽(“mt-261”)或C18脂肪酰化的未聚乙二醇化线性肽(“mt-262”)以25或125nmol/kg每日(QD)注射持续7天后的0及7天小鼠的血糖水平变化(mg/dL)图表。
图19表示在用溶媒对照、利拉鲁肽、mt-260、mt-261或mt-262以25或125nmol/kg注射后0、1、3、5和7天小鼠的体重变化百分比图表。
图20表示在用溶媒对照、利拉鲁肽、mt-260、mt-261或mt-262以25或125nmol/kg注射后7天小鼠的体重变化百分比图表。
图21表示在用溶媒对照、利拉鲁肽(30nmol/kg/天)或mt-261(0.3、1、3、10或30hmol/kg/天)首次注射后0、1、3、5和7天小鼠的体重变化(g)图表。
图22表示在用溶媒对照、利拉鲁肽(30nmol/kg/天)或mt-261(0.3、1、3、10或30nmol/kg/天)首次注射后7天小鼠的脂肪量图表。
图23表示在用溶媒对照、利拉鲁肽(30nmol/kg/天)或mt-261(0.3、1、3、10或30nmol/kg/天)首次注射后0和7天小鼠血糖水平(mg/dL)图表。
图24表示在用mt-263、毒蜥外泌肽-4或溶媒对照以括号中表示的剂量(nmol/kg/天)注射的小鼠中体重变化(%变化)作为时间函数的线图。
图25表示在用mt-263、毒蜥外泌肽-4或溶媒对照以括号中表示的剂量(nmol/kg/天)注射的小鼠中体重总变化(%)(第7天的测量与第0天的测量进行比较)的条形图。
图26表示在用mt-263、毒蜥外泌肽-4或溶媒对照以括号中表示的剂量(nmol/kg/天)注射的小鼠中血糖水平变化(mg/dL)(第7天的测量与第0天的测量进行比较)的条形图。
图27表示在用溶媒对照、利拉鲁肽、mt-277、mt-278或mt-279首次注射后0、1、3、5和7天小鼠的体重变化%的图表。
图28表示在用溶媒对照、利拉鲁肽、mt-277、mt-278或mt-279首次注射后的0和7天小鼠的血糖水平(mg/dL)图表。
图29表示在给予mt-331、mt-311或溶媒对照后7天测量的小鼠体重的总变化(%)的图表。剂量(nmol/kg)表示在括号中。
图30表示给予mt-331、mt-311或溶媒对照后7天测量的小鼠的总摄食(g)的图表。剂量(nmol/kg)表示在括号中。
图31表示在给予mt-331、mt-311或溶媒对照后7天测量的小鼠的血糖水平总变化的图表。剂量(nmol/kg)表示在括号中。
图32表示在以括号中表示的剂量(nmol/kg)给予mt-331、mt-353或溶媒对照后7天测量的小鼠体重的总变化图表。
图33表示在以括号中表示的剂量(nmol/kg)给予mt-331、mt-353或溶媒对照后7天测量的小鼠总摄食(g)的图表。
图34表示在以括号中表示的剂量(nmol/kg)给予mt-331、mt-353或溶媒对照后7天测量的小鼠血糖水平变化(mg/dL)的图表
图35表示在首次给予mt-277、mt-278、mt-279或溶媒对照后7天测量的小鼠体重的总变化(%)图表。
图36表示在首次给予mt-261、mt-309或溶媒对照后6天测量的小鼠体重的总变化(%)图表。
图37表示在首次给予mt-261、mt-309或溶媒对照后6天测量的小鼠血糖水平(mg/dL)图表。同一式样的每对条块中的第一个条块是在第0天测量的血糖水平,每对条块中的第二个条块是第6天的水平。
图38表示在用溶媒对照或mt-261如本文进一步所述注射的小鼠在首次给予mt-261后6天测量的体重的总变化(%)(与给药第一天测量的体重进行比较)的条形图。
本发明详述
定义
在阐述及主张本发明权利过程中,将根据下面提出的定义来使用以下术语。
本文所用术语″约″意指比所述值或值的范围大或小10%,但并非意欲将任何值或值范围指定为只能是该较为宽泛的界限。由术语″约″修饰的每个值或值范围亦意欲包含所述绝对值或值范围的实施方案。
本文所用术语“可药用载体”包括任何标准药物载体,例如磷酸盐缓冲的盐水溶液、水、乳剂(例如油/水或水/油乳剂)及各种类型的湿润剂。本术语亦包含美国联邦政府管理机构批准的或美国药典列出的用于动物(包括人)的任何药剂。
本文所用术语″可药用盐″指保留母体化合物的生物学活性的化合物的盐,它们不会在生物学上或其它方面不利。本文公开的很多化合物由于存在氨基和/或羧基或与其类似的基团能够形成酸和/或碱盐。
可药用碱加成盐可自无机碱及有机碱制备。仅为了举例,来源于无机碱的盐包括钠、钾、锂、铵、钙和镁的盐。来源于有机碱的盐包括但不限于伯胺盐、仲胺盐和叔胺盐。
可药用酸加成盐可自无机酸及有机酸制备。来源于无机酸的盐包括盐酸、氢溴酸、硫酸、硝酸、磷酸等的盐。来源于有机酸的盐包括乙酸、丙酸、羟基乙酸、丙酮酸、草酸、苹果酸、丙二酸、琥珀酸、马来酸、富马酸、酒石酸、柠檬酸、苯甲酸、肉桂酸、扁桃酸、甲磺酸、乙磺酸、对甲苯磺酸、水杨酸等的盐。
本文所用术语″治疗″包括预防特定病症或病况,或减轻与特定病症或病况有关的症状,和/或预防或消除所述症状。例如,本文所用术语″治疗糖尿病″一般指改变血液葡萄糖水平到正常水平,视给定情况而定可包括提高或降低血糖水平。
本文所用胰高血糖素肽的″有效″量或″治疗有效量″指无毒但足以提供预期效应的肽的量。例如一种预期效应可能为防止或治疗低血糖症,其例如由提高血糖水平来测量。本发明胰高血糖素肽的备选的所需效应应包括:治疗高血糖症,例如由血糖水平变化接近正常来测量;或诱导减重/防止增重,例如由减轻体重来测量;或预防或减少体重增加;或使身体脂肪分布正常化。″有效″量在不同受试者之间将不相同,这要视个体年龄、一般状况、给药方式等而定。因此,指定准确的″有效量″一直都是不可能的。然而,本领域一般人员用常规实验方法可确定任何个体病例的合适的“有效”量。
术语″胃肠外″意指不通过消化道而是通过某些其它途径,例如皮下、肌肉内、脊柱内或静脉内。
本文所用术语″纯化的″等术语是指基本上无污染物的分子或化合物的分离物形式,而所述污染物在天然或自然环境中通常与所述分子或化合物结合在一起。本文所用术语″纯化的″不需要绝对纯度;相反,其意欲作为相对定义。本文所用术语″纯化的多肽″阐述与其它化合物分开的多肽,所述其它化合物包括但不限于核酸分子、脂类和碳水化合物。
术语″分离的″需要从其初始环境(例如若其为天然存在的物质则指自然环境)中移出所述物质。例如,存在于活体动物中的天然存在的多核苷酸未被分离,但与天然系统中所共存的某些或所有物质分开的同样的多核苷酸为分离的多核苷酸。
本文所用术语″肽″包含3个或更多个氨基酸且通常小于50个氨基酸的序列,其中所述氨基酸为天然存在的或非天然存在的氨基酸。非天然存在的氨基酸是指不在体内天然存在的氨基酸,但其可被引入到本文所述肽结构中。
本文所用术语″多肽″和″蛋白质″为可互换使用的术语,指氨基酸聚合物,而不考虑聚合物的长度。通常多肽和蛋白质具有长于“肽”的聚合物长度。
本文所用″胰高血糖素肽″包括包含SEQ ID NO:1氨基酸序列或SEQ ID NO:1氨基酸序列的任何类似物的任何肽,所述类似物包括肽的氨基酸取代、添加、缺失或翻译后修饰(例如甲基化、酰化、烷化、泛素化、分子内共价键合例如内酰胺桥形成、聚乙二醇化等),其中所述类似物刺激胰高血糖素或GLP-1或GIP受体活性,其例如用实施例16所述测定由cAMP产量来测量。
术语″胰高血糖素激动剂″指包含刺激胰高血糖素受体活性的胰高血糖素肽的复合物,其例如用实施例16所述测定由cAMP产量来测量。
本文所用氨基酸“修饰”指氨基酸的取代、添加或缺失,包括用人蛋白质中常见的20种氨基酸以及非典型或非天然存在的氨基酸中的任何一种来取代或添加。在整篇说明书中,所有由数字提及特定氨基酸位置(例如28位)都指在天然胰高血糖素(SEQ ID NO:1)中该位置的氨基酸或其任何类似物中对应的氨基酸位置。例如,本文提及“28位”应意指某种胰高血糖素类似物的对应的27位,在该类似物中缺失了SEQ ID NO:1的第一个氨基酸。同样地,本文提及“28位”应意指某种胰高血糖素类似物的对应的29位,在该类似物中在SEQ ID NO:1的N-末端之前添加了一个氨基酸。非典型氨基酸的商业来源包括Sigma-Aldrich(Milwaukee,WI)、ChemPep Inc.(Miami,FL)和Genzyme Pharmaceuticals(Cambridge,MA)。非典型氨基酸可购自商业供应商、从头合成或从其它氨基酸经化学修饰或衍生自其它氨基酸。
本文所用术语“天然胰高血糖素”指由SEQ ID NO:1序列组成的肽,术语“天然GIP”指由SEQ ID NO:4序列组成的肽,而术语“天然GLP-1”是指定为GLP-1(7-36)酰胺(由SEQ ID NO:3序列组成)、GLP-1(7-37)酸(由SEQ ID NO:2序列组成)或这两种化合物的混合物的通称。本文在缺乏任何进一步指定时一般提及“胰高血糖素”或“GIP”或“GLP-1”,分别意指天然胰高血糖素或天然GIP或天然GLP-1。
本文所用氨基酸″取代″指由不同的氨基酸残基来替换一个氨基酸残基。
本文所用术语″保守性氨基酸取代″在本文中定义为在以下5组之一中进行互换:
I.脂肪族的非极性或稍带极性的小残基:
Ala、Ser、Thr、Pro、Gly;
II.极性的带负电荷的残基及其酰胺和酯:
Asp、Asn、Glu、Gln、半胱磺酸和高半胱磺酸;
III.极性的带正电荷的残基:
His、Arg、Lys、鸟氨酸(Orn);
IV.脂肪族的非极性大残基:
Met、Leu、Ile、Val、Cys、正亮氨酸(Nle)、高半胱氨酸
V.芳香族大残基:
Phe、Tyr、Trp、乙酰苯丙氨酸
本文所用通用术语″聚乙二醇链″或″PEG链″,指由通式H(OCH2CH2)nOH代表的支链或直链形式的环氧乙烷及水的缩聚物的混合物,其中n为至少9。没有任何另外的界定,本术语意欲包括平均总分子量选自500-40,000道尔顿范围的乙二醇的聚合物。″聚乙二醇链″或″PEG链″与数字后缀联合使用,表示其大约平均分子量。例如,PEG-5,000指具有平均约5,000的总分子量的聚乙二醇链。
本文所用术语″聚乙二醇化的″及类似术语,指业已通过让聚乙二醇链与化合物连接来使化合物的天然结构得到改变的化合物。″聚乙二醇化的胰高血糖素肽″是具有与胰高血糖素肽共价结合的PEG链的胰高血糖素肽。
本文通常提及肽意欲包含氨基和羧基末端经过修饰的肽。例如,包含置换末端羧酸的酰胺基的氨基酸链意欲包括在指定为标准氨基酸的氨基酸序列中。
本文所用″接头″为让两个分开实体互相结合的键、分子或分子团。接头可为两个实体提供最佳间距,或可进一步提供允许这两个实体彼此分开的易分解连接。易分解连接包括光可裂解基团、酸-易分解部分、碱-易分解部分和酶可裂解基团。
本文所用″二聚体″为包含经由接头彼此共价结合的两个亚单位的复合体。当不用任何限定语言使用术语二聚体时,既包含同二聚体又包含异二聚体。同二聚体包含两个一样的亚单位,而异二聚体包含两个不同的亚单位,但这两个亚单位基本上彼此相似。
本文所用术语″带电荷的氨基酸″指在生理pH水溶液中包含带负电荷(即去质子化)或带正电荷(即质子化)的侧链的氨基酸。例如,带负电荷的氨基酸包括天冬氨酸、谷氨酸、半胱磺酸、高半胱磺酸和高谷氨酸,而带正电荷的氨基酸包括精氨酸、赖氨酸和组氨酸。带电荷的氨基酸包括在人蛋白质中常见的20种氨基酸以及非典型或非天然存在的氨基酸中的带电荷的氨基酸。
本文所用术语″酸性氨基酸″指包含第二个酸性部分的氨基酸,所述第二个酸性部分包括例如羧酸或磺酸基。
本文所用术语某分子相对于第二受体对第一受体的“选择性”指以下比率:该分子针对第二受体的EC50除以该分子针对第一受体的EC50。例如,具有对第一受体1nM的EC50和对第二受体100nM的EC50的分子对第一受体相对于对第二受体的选择性为100-倍。
本文所用分子的“胰高血糖素效价”指所述分子针对胰高血糖素受体的EC50除以天然胰高血糖素针对胰高血糖素受体的EC50的比率。
本文所用分子的“GIP效价”指所述分子针对GIP受体的EC50除以天然GIP针对GIP受体的EC50的比率。
本文所用分子的“GLP-1效价”指所述分子针对GLP-1受体的EC50除以天然GLP-1针对GLP-1受体的EC50的比率。
本文所用术语“烷基”指含有指定数目的碳原子的直链或支链烃。例示性烷基包括甲基、乙基和直链丙基。
本文所用术语“杂烷基”指含有指定碳原子数目及在主链结构中至少一个杂原子的直链或支链烃。用于本文目的的适当杂原子包括但不限于N、S和O。
本文所用术语“环烷基”指含有指定数目的碳原子的环烃基,例如环丙基、环丁基、环己基和环戊基。
本文所用术语“杂环”指含有指定数目的碳原子及独立选自氧、氮和硫的1-3个杂原子的环烃基。杂环烷基的非限制性实例包括哌啶、四氢呋喃、四氢吡喃、二氢呋喃、吗啉、噻吩等。
本文所用术语“芳基”指含有指定数目的碳原子的单环或多环芳香族基团,优选单环或二环芳香族基团,例如苯基或萘基。除非另外指出,否则芳基可不被取代或被取代。
本文所用术语“杂芳基”指含有指定数目的碳原子和选自氧、氮和硫的至少一个杂原子的单环或多环芳香族基团。除非另外指出,否则芳基可不被取代或被取代。
实施方案
本文所公开的修饰使得可操控胰高血糖素(SEQ ID NO:1),以制备表现出提高的GIP活性、胰高血糖素活性和/或GLP-1活性的胰高血糖素肽。本文公开的其它修饰延长所得到的肽的半衰期,增加溶解性或提高稳定性。本文公开的另一些修饰对活性没有影响,或可进行这些修饰而不会破坏一种或多种所需活性。可单独施用或联合施用为同一目的(例如提高GIP活性)的任何组合。可单独施用或联合施用提供增强的特性的任何单一组合或一套组合,例如可与延长半衰期联合提高GIP和/或GLP-1活性。
在例示性实施方案中,所述胰高血糖素肽相对于天然胰高血糖素序列可包含总共1个、至多2个、至多3个、至多4个、至多5个、至多6个、至多7个、至多8个、至多9个或至多10个氨基酸修饰。在某些实施方案中,所述胰高血糖素肽在天然胰高血糖素的对应位置保留至少22个、23个、24个、25个、26个、27个或28个天然存在的氨基酸(例如相对于天然存在的胰高血糖素有1-7、1-5或1-3个修饰)。在相关实施方案中,1、2、3、4、5、6或更多个氨基酸修饰可为非保守性取代、添加或缺失。在某些实施方案中,1、2、3、4、5、6或更多个氨基酸修饰可为保守性取代。在某些实施方案中,在2、5、7、10、11、12、13、14、17、18、19、20、21、24、27、28或29位中的任何位置进行1、2、3、4或5个非保守性取代,并在任何这些位置至多进行5个另外的保守性取代。在某些实施方案中,在1-16位的氨基酸内进行1、2或3个氨基酸修饰,并在17-26位的氨基酸内进行1、2或3个氨基酸修饰。
影响GIP活性的修饰
通过1位的氨基酸修饰提供提高的针对GIP受体的活性。例如,用芳香族大氨基酸取代1位His,所述氨基酸任选为Tyr、Phe、Trp、氨基-Phe、硝基-Phe、氯-Phe、磺基-Phe、4-吡啶基-Ala、甲基-Tyr或3-氨基Tyr。意想不到的是,1位Tyr与对应于12-29位氨基酸区域内的α螺旋的稳定化的组合,提供激活GIP受体以及GLP-1受体和胰高血糖素受体的胰高血糖素肽。可通过例如形成共价或非共价分子内桥,或用稳定α螺旋的氨基酸(例如α,α-二取代氨基酸)取代和/或插入大约12-29位的氨基酸,来稳定α螺旋结构。
通过在27和/或28位并任选在29位的氨基酸修饰,亦提供提高的针对GIP受体的活性。例如,用脂肪族大氨基酸取代27位Met,所述脂肪族大氨基酸任选Leu;用脂肪族小氨基酸取代28位Asn,所述脂肪族小氨基酸任选Ala;和用脂肪族小氨基酸取代29位Thr,所述脂肪族小氨基酸任选Gly。用LAG在27-29位取代相对于在这些位置的天然MNT序列提供提高的GIP活性。
通过在12位的氨基酸修饰,亦提供提高的针对GIP受体的活性。例如,用脂肪族非极性大氨基酸在12位取代,所述氨基酸任选Ile。
通过在17和/或18位的氨基酸修饰,亦提供提高的针对GIP受体的活性。例如,用极性残基在17位取代,所述残基任选Gln;用脂肪族小氨基酸在18位取代,所述氨基酸任选Ala。用QA在17和18位取代相对于这些位置的天然RR序列提供提高的GIP活性。
可单独施用或联合施用上述提高GIP受体活性的任何修饰。提高GIP受体活性的修饰组合比采用单独的任何所述修饰通常提供更高的GIP活性。
影响胰高血糖素活性的修饰
在某些实施方案中,提供提高效价并任选改进溶解性和稳定性的胰高血糖素类似物。在一个实施方案中,通过在天然胰高血糖素(SEQ ID NO:1)的16位的氨基酸修饰,提供提高的胰高血糖素效价。作为非限制性实例,可通过用谷氨酸或另一具有4个原子长的侧链的带负电荷的氨基酸,或作为备选用谷氨酰胺、高谷氨酸或高半胱磺酸,或用具有含至少一个杂原子(例如N、O、S、P)的侧链并具有约4(或3-5)个原子长的侧链的带电荷的氨基酸中的任何一种,取代天然存在的16位的丝氨酸,来提供所述提高的效价。在某些实施方案中,胰高血糖素肽保留其相对于GLP-1受体对胰高血糖素受体的原始选择性。
可通过在3位的氨基酸修饰,例如用酸性、碱性或疏水氨基酸取代3位的天然存在的谷氨酰胺,来降低胰高血糖素受体活性。例如,用谷氨酸、鸟氨酸或正亮氨酸在3位取代相当大地降低或破坏胰高血糖素受体活性。
可通过用谷氨酰胺类似物修饰3位的Gln,来实现保持或提高针对胰高血糖素受体的活性。例如,包含3位谷氨酰胺类似物的胰高血糖素肽,可表现出天然胰高血糖素(SEQ ID NO:1)针对胰高血糖素受体活性的约5%、约10%、约20%、约50%或约85%或更大。在某些实施方案中,包含3位谷氨酰胺类似物的胰高血糖素肽,可表现出具有与包含谷氨酰胺类似物的肽同样的氨基酸序列但3位氨基酸没有修饰的对应的胰高血糖素肽(例如SEQ ID NO:250或SEQ ID NO:251)针对胰高血糖素受体活性的约20%、约50%、约75%、约100%、约200%或约500%或更大。在某些实施方案中,包含3位谷氨酰胺类似物的胰高血糖素肽表现出提高的针对胰高血糖素受体的活性,但该提高的活性不大于天然胰高血糖素活性的或不大于具有与包含谷氨酰胺类似物的肽同样的氨基酸序列但3位氨基酸没有修饰的对应的胰高血糖素肽的活性的1000%、10,000%、100,000%或1,000,000%。
在某些实施方案中,所述谷氨酰胺类似物为包含结构I、II或III的侧链的天然存在的氨基酸或非天然存在的氨基酸:
其中R1为C0-3烷基或C0-3杂烷基;R2为NHR4或C1-3烷基;R3为C1-3烷基;R4为H或C1-3烷基;X为NH、O或S;和Y为NHR4、SR3或OR3。在某些实施方案中,X为NH或Y为NHR4。在某些实施方案中,R1为C0-2烷基或C1杂烷基。在某些实施方案中,R2为NHR4或C1烷基。在某些实施方案中,R4为H或C1烷基。在例示性实施方案中,提供包含结构I侧链的氨基酸,其中R1为CH2-S,X为NH,R2为CH3(乙酰氨甲基-半胱氨酸,C(Acm));R1为CH2,X为NH,R2为CH3(乙酰基二氨基丁酸,Dab(Ac));R1为C0烷基,X为NH,R2为NHR4和R4为H(氨基甲酰二氨基丙酸,Dap(脲));或R1为CH2-CH2,X为NH和R2为CH3(乙酰鸟氨酸,Orn(Ac))。在例示性实施方案中,提供包含结构II侧链的氨基酸,其中R1为CH2,Y为NHR4,R4为CH3(甲基谷氨酰胺,Q(Me));在例示性实施方案中,提供包含结构III的侧链的氨基酸,其中R1为CH2,R4为H(甲硫氨酸-亚砜,M(O));在特定实施方案中,3位氨基酸被Dab(Ac)取代。例如,胰高血糖素激动剂可包含SEQ ID NO:243-248、250、251和253-256中任何一种的氨基酸序列。
影响GLP-1活性的修饰
通过用电中性基团例如酰胺或酯代替C-末端氨基酸的羧酸,来提供提高的针对GLP-1受体的活性。
通过稳定胰高血糖素C-末端部分(大约12-29位氨基酸)的α-螺旋结构,例如通过形成两个氨基酸侧链之间的分子内桥,或用稳定α螺旋的氨基酸(例如α,α-二取代氨基酸)取代和/或插入大约12-29位的氨基酸,亦提供提高的针对GLP-1受体的活性。可通过氢键或离子相互作用,例如形成盐桥,或通过共价键,让这些氨基酸侧链彼此连接。在某些实施方案中,在被三个间插氨基酸分开的氨基酸之间形成桥,即在“i”位氨基酸和“i+4”位氨基酸之间形成桥,其中i为从12到25的任何整数(例如12、13、14、15、16、17、18、19、20、21、22、23、24或25)。在例示性实施方案中,12和16、13和17、16和20、17和21、20和24或24和28的氨基酸对(氨基酸对中的i=12、16、20或24)的侧链彼此连接,因此稳定胰高血糖素的α螺旋。
在其它实施方案中,在被两个间插氨基酸分开的氨基酸之间形成桥,即在“j”位氨基酸和“j+3”位氨基酸之间形成桥,其中j为从12到26的任何整数(例如12、13、14、15、16、17、18、19、20、21、22、23、24、25或26)。在例示性实施方案中,j为17。在另外的实施方案中,在被六个间插氨基酸分开的氨基酸之间形成桥,即在“k”位氨基酸和“k+7”位氨基酸之间形成桥,其中k为从12到22的任何整数(例如12、13、14、15、16、17、18、19、20、21或22)。在一个实施方案中,k为17。
在某些实施方案中,桥或接头长约8(或约7-9)个原子,尤其是当桥在i和i+4位置之间时。在某些实施方案中,桥或接头长约6(或约5-7)个原子,尤其是当桥在j和j+3位置之间时。
在某些实施方案中,通过以下方式来形成分子内桥:(a)用谷氨酸或用另一具有含4个原子长的侧链的带负电荷的氨基酸,或作为备选用谷氨酰胺、高谷氨酸或高半胱磺酸或具有含至少一个杂原子(例如N、O、S、P)的侧链并含约4(或3-5)个原子长的侧链的带电荷的氨基酸中的任何一种,取代天然存在的16位的丝氨酸;和(b)用另一具有带电荷或有形成氢键能力并至少约5(或约4-6)个原子长的侧链的亲水的氨基酸取代天然存在的20位的谷氨酰胺,所述亲水的氨基酸例如赖氨酸、瓜氨酸、精氨酸或鸟氨酸。所述16和20位的氨基酸侧链可形成盐桥,或可共价连接。
在一个实施方案中,这两个氨基酸彼此结合形成内酰胺环。内酰胺环的大小可视氨基酸侧链的长度而变化,在一个实施方案中,通过让赖氨酸氨基酸的侧链与谷氨酸的侧链连接形成内酰胺。内酰胺环的酰胺键的次序可逆(例如可在Lys12和Glu16侧链之间形成内酰胺环,或作为备选在Glu 12和Lys16侧链之间形成内酰胺环)。
在某些实施方案中,通过形成分子内桥而不是内酰胺桥来实现胰高血糖素肽的C-末端部分的α螺旋结构的稳定化。例如,合适的共价键合方法包括以下方法中的任何一种或多种:烯烃复分解(olefin metathesis)、基于羊毛硫氨酸的环化、二硫桥或修饰的含硫桥形成、使用α,ω-二氨基烷烃系链(α,ω-diaminoalkane tether)、形成金属-原子桥,使用其它的肽环化手段来稳定α螺旋。
可通过丙氨酸取代18位的天然精氨酸进一步提高针对GLP-1受体的效价。
可单独施用或联合施用上述任何提高GLP-1受体活性的修饰。提高GLP-1受体活性的修饰组合通常比单独采用任何所述修饰提供更高的GLP-1活性。例如,本发明提供以下胰高血糖素肽:包含在16位、20位和在C-末端羧酸基团的修饰的胰高血糖素肽,任选所述胰高血糖素肽在16和20位氨基酸之间含共价键;包含在16位和在C-末端羧酸基团的修饰的胰高血糖素肽;包含在16位和20位修饰的胰高血糖素肽,任选所述胰高血糖素肽在16和20位氨基酸之间含共价键;和包含在20位和在C-末端羧酸基团修饰的胰高血糖素肽。
可通过包含以下基团来降低GLP-1活性:(i)C-末端α羧酸酯基团;(ii)用缺乏羟基的氨基酸例如Abu或Ile取代7位Thr;(iii)缺失位于27或28位氨基酸的C-末端的一个或多个氨基酸(例如缺失28位氨基酸,缺失28和29位氨基酸),以产生长27个或28个氨基酸的肽;或(iv)其组合。
影响针对胰高血糖素、GLP-1和GIP受体每一种的活性的修饰
通过以下方式提供提高的针对胰高血糖素受体、GLP-1受体和GIP受体中的每一种的活性:(i)用式IV氨基酸进行16位Ser的氨基酸取代:
其中n为1-16或1-10或1-7或1-6或2-6或2或3或4或5,R1和R2各独立选自H、C1-C18烷基、(C1-C18烷基)OH、(C1-C18烷基)NH2、(C1-C18烷基)SH、(C0-C4烷基)(C3-C6)环烷基、(C0-C4烷基)(C2-C5杂环)、(C0-C4烷基)(C6-C10芳基)R7和(C1-C4烷基)(C3-C9杂芳基),其中R7为H或OH,式IV氨基酸侧链包含游离氨基;和(ii)用α,α-二取代氨基酸例如AIB进行20位Gln的氨基酸取代。在某些实施方案中,16位氨基酸为Orn、Dab、Lys或高Lys,20位氨基酸为AIB。在特定实施方案中,16位氨基酸为Lys,20位氨基酸为AIB。
可通过延长肽的长度,例如通过融合例如约1-21、约9-21、约6-18、约9-12或约10或11个氨基酸长的C-末端延伸肽,来进一步提高包含16位式IV氨基酸和20位α,α二-取代氨基酸的类似物针对胰高血糖素受体、GLP-1受体和胰高血糖素受体每一种的活性。在某些实施方案中,通过融合GPSSGAPPPS(SEQ ID NO:95)或XGPSSGAPPPS(SEQ ID NO:96)来延长C-末端,其中X为Gly或脂肪族或非极性或稍带极性的小氨基酸。在备选实施方案中,通过融合GPSSGAPPPS(SEQ ID NO:95)来延长C-末端,并将1-11个氨基酸融合到GPSSGAPPPS(SEQ ID NO:95)的C-末端。例如,类似物的C-末端突出端可包含GPSSGAPPPS(SEQ ID NO:95)接着在SEQ ID NO:95的C-末端后面有1、2、3、4、5、6、7、8、9、10或11个另外的氨基酸。这1-11个另外的氨基酸可为例如脂肪族小氨基酸,例如Ala。在这点上,C-末端突出端可例如包含GPSSGAPPPSAm氨基酸序列,其中m为1-11。
当对位于C-末端突出端内的氨基酸或C-末端氨基酸(例如添加到C-末端突出端的C-末端的氨基酸)进行酰化或烷化时,可进一步实现具有GIP活性的基于胰高血糖素的类似物针对胰高血糖素受体、GLP-1受体和GIP受体中的每一种的活性的提高,所述类似物包括包含16位式IV氨基酸和20位α,α二-取代氨基酸的类似物。酰化或烷化可为位于例如C-末端突出端的类似物的30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49和50位中的任何位置的氨基酸。在某些实施方案中,酰化或烷化的氨基酸位于C-末端延伸的类似物的37、38、39、40、41、42或43位。在某些实施方案中,酰化或烷化氨基酸为式I、II或III的氨基酸,例如Lys,所述氨基酸与酰基或烷基例如C10-C22连接。在某些实施方案中,Lys位于由SEQ ID NO:95组成的C-末端突出端的C-末端,致使Lys、Dab、Orn或高Lys位于类似物的40位。任选C-末端延长的肽在例如本文所述的任何位置(例如24位)还被聚乙二醇化。
可通过经由间隔物(例如氨基酸、二肽、三肽、亲水双官能间隔物、疏水双官能间隔物)的氨基酸酰化或烷化,另外实现具有GIP活性的基于胰高血糖素的类似物的针对胰高血糖素受体、GLP-1受体和GIP受体中每一种的活性的提高。在某些实施方案中,具有GIP活性的基于胰高血糖素的类似物包含经由间隔物的酰基或烷基,其中间隔物与类似物的10位氨基酸的侧链连接。在其它实施方案中,类似物包含位于29位氨基酸的C-末端的1-21个氨基酸的C-末端突出端(例如包含SEQ ID NO:95或96的氨基酸序列的延伸),并且与酰基或烷基共价连接的间隔物与在对应于关于SEQ ID NO:1的37-43位之一的位置处的突出端的氨基酸连接。在特定实施方案中,间隔物与关于SEQ ID NO:1的40位的氨基酸连接。在某些实施方案中,间隔物长3-10个原子。在特定方面,间隔物和酰基或烷基的总长为约14-约28个原子长。例如,间隔物可为氨基酸,包括但不限于本文所述的任何氨基酸。同样例如,间隔物可为包含本文所述氨基酸的二肽或三肽。在特定方面,间隔物为以下二肽之一:Ala-Ala、βAla-βAla或γGlu-γGlu。本文进一步阐述为提高针对胰高血糖素受体、GLP-1受体和GIP受体中的一种或多种的活性目的的另外的合适间隔物。
改善DPP-IV抗性的修饰
1和/或2位的修饰可提高肽对二肽基肽酶IV(DPP IV)裂解的抗性。例如,可用D-丝氨酸、D-丙氨酸、缬氨酸、甘氨酸、N-甲基丝氨酸、N-甲基丙氨酸或氨基异丁酸取代2位氨基酸。在某些实施方案中,可用D-组氨酸、去氨基组氨酸、羟基-组氨酸、乙酰基-组氨酸、高组氨酸(homo-histidine)、N-甲基组氨酸、α-甲基组氨酸、咪唑乙酸或α,α-二甲基咪唑乙酸(DMIA)取代1位氨基酸。
观察到2位修饰(例如2位AIB)并在某些情况下1位修饰(例如1位DMIA)可降低胰高血糖素活性,有时可显著降低;意想不到的是,可通过稳定胰高血糖素C-末端部分(大约12-29位氨基酸)的α-螺旋结构,例如如本文所述通过在两个氨基酸侧链之间形成共价键,来重新恢复胰高血糖素活性的这种降低。在某些实施方案中,共价键在“i”和“i+4”位或“j”和“j+3”位的氨基酸之间,例如在12和16、16和20、20和24、24和28或17和20位之间。在例示性实施方案中,该共价键为16位谷氨酸和20位赖氨酸之间的内酰胺桥。在某些实施方案中,该共价键为除内酰胺桥之外的分子内桥。例如,合适的共价键合方法(即形成共价分子内桥的手段)包括以下方法中的任何一种或多种:烯烃复分解、基于羊毛硫氨酸的环化、二硫桥或经修饰的含硫桥形成、使用α,ω-二氨基烷烃系链、形成金属-原子桥和其它的肽环化手段。
减少降解的修饰
在又一例示性实施方案中,可通过修饰SEQ ID NO:1的15和/或16位氨基酸以降低肽随时间的降解(尤其是在酸性或碱性缓冲液中),来进一步修饰任何胰高血糖素肽以改进稳定性。所述修饰降低Asp15-Ser16肽键的裂解。在例示性实施方案中,15位的氨基酸修饰是缺失Asp或是用谷氨酸、高谷氨酸、半胱磺酸或高半胱磺酸取代Asp。在其它例示性实施方案中,16位的氨基酸修饰是缺失Ser或用Thr或AIB取代Ser。在其它例示性实施方案中,用谷氨酸或用另一具有含长度为4个原子的侧链的带负电荷的氨基酸,或作为备选用谷氨酰胺、高谷氨酸或高半胱磺酸中的任何一种,取代16位的Ser。
在某些实施方案中,例如通过缺失或取代来修饰存在于天然肽的27位的甲硫氨酸残基。所述修饰可防止肽的氧化性降解。在某些实施方案中,用亮氨酸、异亮氨酸或正亮氨酸取代27位Met。在某些特定实施方案中,用亮氨酸或正亮氨酸取代27位Met。
在某些实施方案中,例如通过缺失或取代来修饰20和/或24位的Gln。所述修饰可降低通过Gln的脱酰胺化发生的降解。在某些实施方案中,用Ala或AIB取代20和/或24位的Gln。在某些实施方案中,用Lys、Arg、Orn或瓜氨酸取代20和/或24位的Gln。
在某些实施方案中,例如通过缺失或取代来修饰21位的Asp。所述修饰可减少通过Asp脱水以形成环状琥珀酰亚胺中间体接着异构化为异天冬氨酸盐而发生的降解。在某些实施方案中,21位被Glu、高谷氨酸或高半胱磺酸取代。在某些特定实施方案中,21位被Glu取代。
其它修饰
可修饰天然胰高血糖素肽的某些位置,同时保留母体肽的至少若干活性。因此,申请人预期位于2、5、10、11、12、13、14、17、18、19、20、21、24、27、28或29位中的一个或多个氨基酸可被不同于天然胰高血糖素肽中存在的氨基酸的氨基酸取代,并仍然保留针对胰高血糖素受体的活性。
在某些实施方案中,用选自Ala、Ser或Thr的氨基酸取代18位。在某些实施方案中,用Ser、Thr、Lys、Arg、Orn、瓜氨酸或AIB取代20位氨基酸。在某些实施方案中,用Glu、高谷氨酸或高半胱磺酸取代21位。在某些实施方案中,胰高血糖素肽包含选自16、17、18、20、21、23、24、27、28和29位的1-10个氨基酸修饰。在例示性实施方案中,所述修饰为选自Gln17、Ala18、Glu21、Ile23、Ala24、Val27和Gly29的一个或多个氨基酸取代。在某些实施方案中,选自17-26位的1-2个氨基酸不同于母体肽。在其它实施方案中,选自17-22位的1-2个氨基酸不同于母体肽。在另外的其它实施方案中,所述修饰为Gln17、Ala18、Glu21、Ile23和Ala24。
在某些实施方案中,将一个或多个氨基酸添加到胰高血糖素肽的羧基末端。所述氨基酸通常选自20种常见的氨基酸之一,在某些实施方案中,所述氨基酸具有代替天然氨基酸的羧酸的酰胺基。在例示性实施方案中,添加的氨基酸选自谷氨酸和天冬氨酸和甘氨酸。
不破坏活性的其它修饰包括W10或R20。
在某些实施方案中,可通过截短C-末端的一个或两个氨基酸残基来修饰本文公开的胰高血糖素肽,而仍保留针对胰高血糖素受体、GLP-1受体和/或GIP受体的类似的活性和效价。在这点上,可缺失29和/或28位的氨基酸。
α螺旋结构的稳定化
稳定胰高血糖素肽C-末端部分(大约12-29位氨基酸)的α-螺旋结构提供提高的GLP-1和/或GIP活性,并恢复业已通过在1和/或2位的氨基酸修饰降低的胰高血糖素活性。可通过例如形成共价或非共价分子内桥,或用稳定α螺旋的氨基酸(例如α,α-二取代氨基酸)取代和/或插入大约12-29位的氨基酸,来稳定α螺旋结构。
在某些实施方案中,在两个氨基酸侧链之间形成分子内桥以稳定胰高血糖素肽羧基末端部分(例如12-29位氨基酸)的三维结构。可通过非共价键,例如氢键、离子相互作用,例如形成盐桥,或通过共价键,让两个氨基酸侧链彼此连接。当两个氨基酸侧链通过一个或多个共价键彼此连接时,可认为本文的肽包含共价分子内桥。当两个氨基酸侧链通过非共价键(例如氢键、离子相互作用)彼此连接时,可认为本文肽包含非共价分子内桥。
在某些实施方案中,在相隔3个氨基酸的两个氨基酸之间形成分子内桥,例如i和i+4位置的氨基酸之间,其中i为12和25之间的任何整数(例如12、13、14、15、16、17、18、19、20、21、22、23、24和25)。更具体地,让氨基酸对12和16、16和20、20和24或24和28(氨基酸对中的i=12、16、20或24)的侧链彼此连接,因此稳定胰高血糖素的α螺旋。或者,i可为17。
在某些特定实施方案中,其中i和i+4位置的氨基酸通过分子内桥连接,接头的大小为约8个原子或约7-9个原子。
在其它实施方案中,在相隔两个氨基酸的两个氨基酸之间形成分子内桥,例如在j和j+3位置的氨基酸之间,其中j为12和26之间的任何整数(例如12、13、14、15、16、17、18、19、20、21、22、23、24、25和26)。在某些特定实施方案中,j为17。
在某些特定实施方案中,其中j和j+3位置的氨基酸通过分子内桥连接,接头大小为约6个原子或约5-7个原子。
在另外的其它实施方案中,在相隔6个氨基酸的两个氨基酸之间形成分子内桥,例如k和k+7位置的氨基酸之间,其中k为12和22之间的任何整数(例如12、13、14、15、16、17、18、19、20、21和22)。在某些特定实施方案中,k为12、13或17。在例示性实施方案中,k为17。
能够共价键合形成6个原子的连接桥的氨基酸配对实例包括Orn和Asp、Glu和式I氨基酸(其中n为2)、高谷氨酸和式I氨基酸(其中n为1),其中式I为:
能够共价键合形成7个原子的连接桥的氨基酸配对实例包括Orn-Glu(内酰胺环);Lys-Asp(内酰胺);或高ser-高glu(内酯)。可形成8个原子的接头的氨基酸配对实例包括Lys-Glu(内酰胺);高Lys-Asp(内酰胺);Orn-高glu(内酰胺);4-氨基Phe-Asp(内酰胺);或Tyr-Asp(内酯)。可形成9个原子的接头的氨基酸配对实例包括高Lys-Glu(内酰胺);Lys-高glu(内酰胺);4-氨基Phe-Glu(内酰胺);或Tyr-Glu(内酯)。可用其它化学基团另外取代这些氨基酸上的任何侧链,只要α-螺旋的三维结构不被破坏即可。本领域一般人员可设想形成类似大小和预期作用的稳定结构的备选配对或备选氨基酸类似物,其包括化学修饰的衍生物。例如,高半胱氨酸-高半胱氨酸二硫桥长度为6个原子,也可对其进行进一步修饰以提供所需作用。即使没有共价连接,上述氨基酸配对或本领域一般人员可设想的类似的配对,亦可通过非共价键(例如通过形成盐桥或氢键作用)为α-螺旋提供进一步的稳定性。
内酰胺环的大小可视氨基酸侧链的长度而变化,在一个实施方案中,通过让赖氨酸氨基酸的侧链与谷氨酸的侧链连接来形成内酰胺。另外的例示性实施方案包括任选含内酰胺桥的以下配对:12位的Glu与16位的Lys;12位的天然Lys与16位的Glu;16位的Glu与20位的Lys;16位的Lys与20位的Glu;20位的Glu与24位的Lys;20位的Lys与24位的Glu;24位的Glu与28位的Lys;24位的Lys与28位的Glu。或者,内酰胺环内的酰胺键的次序可逆(例如可在Lys12和Glu16侧链之间形成内酰胺环,或作为备选在Glu 12和Lys16之间形成内酰胺环)。
可使用除了内酰胺桥之外的分子内桥来稳定胰高血糖素类似物肽的α螺旋。在一个实施方案中,所述分子内桥为疏水桥。在这种情况下,分子内桥任选在胰高血糖素类似物肽α螺旋的疏水面部分的两个氨基酸侧链之间。例如,通过疏水桥连接的氨基酸之一可为10、14和18位的氨基酸。
在一个特定方面,用全-烃交联系统利用烯烃复分解来交联胰高血糖素肽的α螺旋的一个或两个转角(turn)。这种情况中的胰高血糖素肽可包含荷有不同长度的烯烃侧链的α-甲基化氨基酸,其在i和i+4或i+7位构成R或S立体化学。例如,烯烃侧链可包含(CH2)n,其中n为1-6之间的任何整数。在一个实施方案中,对于8个原子的交联长度,n为3。本领域阐述了形成所述分子内桥的合适的方法。参见例如,Schafmeister等,J.Am.Chem.Soc.122:5891-5892(2000)和Walensky等,Science 305:1466-1470(2004)。或者,胰高血糖素肽可包含位于邻近的螺旋转角的O-烯丙基Ser残基,其经由钌催化的环闭合复分解(ruthenium-catalyzed ring closing metathesis)桥联在一起。在例如Blackwell等,Angew,Chem.,Int.Ed.37:3281-3284(1998)中阐述了所述交联的方法。
在另一特定方面,利用非天然的硫-二丙氨酸氨基酸、羊毛硫氨酸(其作为胱氨酸的肽模拟物被广泛采用)来交联α螺旋的一个转角。基于羊毛硫氨酸的环化的合适的方法为本领域所知。参见例如,Matteucci等,Tetrahedron Letters 45:1399-1401(2004);Mayer等,J.Peptide Res.51:432-436(1998);Polinsky等,J.Med.Chem.35:4185-4194(1992);Osapay等,J.Med.Chem.40:2241-2251(1997);Fukase等,Bull.Chem.Soc.Jpn.65:2227-2240(1992);Harpp等,J.Org.Chem.36:73-80(1971);Goodman和Shao,Pure Appl.Chem.68:1303-1308(1996);和Osapay和Goodman,J.Chem.Soc.Chem.Commun.1599-1600(1993)。
在某些实施方案中,用位置i和i+7的两个Glu残基之间的α,ω-二氨基烷烃系链(例如1,4-二氨基丙烷和1,5-二氨基戊烷),来稳定胰高血糖素肽的α螺旋。所述系链导致形成9-个原子或更长的桥,这视二氨基烷烃系链的长度而定。本领域阐述了用所述系链产生肽交联的合适的方法。参见例如,Phelan等,J.Am.Chem.Soc.119:455-460(1997)。
在本发明再一实施方案中,用二硫桥来交联胰高血糖素肽α螺旋的一个或两个转角。或者,用经修饰的二硫桥来稳定胰高血糖素肽的α螺旋,所述二硫桥中的一个或两个硫原子都被亚甲基取代,从而导致电子等排大环化。用二硫桥修饰肽或基于硫的环化的合适的方法阐述于例如Jackson等,J.Am.Chem.Soc.113:9391-9392(1991)和Rudinger和Jost,Experientia 20:570-571(1964)中。
在又一实施方案中,经由i和i+4位的两个His残基或His与Cys对结合金属原子来稳定胰高血糖素肽的α螺旋。金属原子可为例如Ru(III)、Cu(II)、Zn(II)或Cd(II)。本领域已知所述基于金属结合的α螺旋稳定化的方法。参见例如,Andrews和Tabor,Tetrahedron 55:11711-11743(1999);Ghadiri等,J.Am.Chem.Soc.112:1630-1632(1990);和Ghadiri等,J.Am.Chem.Soc.119:9063-9064(1997)。
作为备选,可通过其它肽环化手段来稳定胰高血糖素肽的α螺旋,所述手段在Davies,J.PEPTIDE.Sci.9:471-501(2003)中综述。可经由形成酰胺桥、硫醚桥、硫酯桥、脲桥、氨基甲酸酯桥、磺酰胺桥等来稳定α螺旋。例如,可在C-末端和Cys残基的侧链之间形成硫酯桥。或者,可经由具有硫醇(Cys)和羧酸(例如Asp、Glu)的氨基酸侧链形成硫酯。在另一方法中,交联剂例如二羧酸、例如辛二酸(suberic acid或octanedioic acid)等可在氨基酸侧链的两个官能团之间引入连接,所述氨基酸侧链官能团例如为游离氨基、羟基、巯基及其组合。
根据本发明一个实施方案,通过在i和i+4位置引入疏水氨基酸来稳定胰高血糖素肽的α螺旋。例如,i可为Tyr且i+4可为Val或Leu;i可为Phe且i+4可为Cys或Met;I可为Cys且i+4可为Met;或i可为Phe且i+4可为Ile。应该理解,为本文目的上述氨基酸配对可相反,以至于位置i表示的氨基酸可作为备选位于i+4,而i+4的氨基酸可位于i位置。
根据本发明其它实施方案,通过在胰高血糖素肽的C-末端部分(大约12-29位氨基酸)引入(通过氨基酸取代或插入)一个或多个稳定α螺旋的氨基酸来稳定α螺旋。在特定实施方案中,稳定α螺旋的氨基酸为α,α-二取代氨基酸,其包括但不限于以下任何一种:氨基异丁酸(AIB)、被选自甲基、乙基、丙基和正丁基的相同或不同基团或被环辛烷或环庚烷(例如1-氨基环辛烷-1-甲酸)二取代的氨基酸。在某些实施方案中,胰高血糖素肽的16、17、18、19、20、21、24或29位中的一个、二个、三个、四个或更多个位置被α,α-二取代氨基酸取代。在特定实施方案中,16、20、21和24位中的一个、二个、三个或全部位置被α,α-二取代氨基酸(例如AIB)取代。例如,胰高血糖素肽可包含在缺乏分子内桥时用AIB在16位取代,所述分子内桥例如为非共价分子内桥(例如盐桥)或共价分子内桥(例如内酰胺)。所述缺乏分子内桥的肽方便地易于制备。
根据某些实施方案,缺乏分子内桥的胰高血糖素肽包含在12-29位氨基酸内的用α,α-二取代氨基酸的一个或多个取代和共价连接到胰高血糖素肽氨基酸(例如胰高血糖素肽的10或40位氨基酸)侧链的酰基或烷基。在特定实施方案中,所述酰基或烷基对于天然存在的氨基酸为非天然的。在某些方面,所述酰基或烷基对于10位氨基酸为非天然的。所述缺乏分子内桥的酰化或烷化的胰高血糖素肽与非酰化的相应肽比较,表现出提高的针对GLP-1和胰高血糖素受体的活性。可通过在肽的10或40位氨基酸的侧链与酰基或烷基之间引入间隔物,来实现进一步提高缺乏分子内桥的酰化的胰高血糖素肽针对GLP-1和胰高血糖素受体的活性。本文进一步阐述引入或不引入间隔物的酰化和烷化。
在特定实施方案中,酰化或烷化的胰高血糖素肽或其类似物进一步包含选择性地降低针对GLP-1受体活性的修饰。例如,酰化或烷化的胰高血糖素肽或其类似物包含以下中的一种或组合:C-末端α羧酸酯、缺失位于27或28位氨基酸的C-末端处氨基酸(例如缺失29位的氨基酸、缺失28和29位的氨基酸)、用脂肪族非极性大氨基酸例如Ile取代7位的Thr。
在某些实施方案中,16位或20位被α,α-二取代氨基酸例如AIB取代。在某些实施方案中,20位被α,α-二取代氨基酸例如AIB取代。在某些实施方案中,20位被α,α-二取代氨基酸例如AIB取代,并且16位被式IV氨基酸取代
其中n为1-16或1-10或1-7或1-6或2-6或2或3或4或5,R1和R2各独立选自H、C1-C18烷基、(C1-C18烷基)OH、(C1-C18烷基)NH2、(C1-C18烷基)SH、(C0-C4烷基)(C3-C6)环烷基、(C0-C4烷基)(C2-C5杂环)、(C0-C4烷基)(C6-C10芳基)R7和(C1-C4烷基)(C3-C9杂芳基),其中R7为H或OH,式IV氨基酸侧链包含游离氨基。在特定实施方案中,式IV氨基酸为2,3二氨基丙酸(DAP)、2,4-二氨基丁酸(DAB)、Orn、Lys或高Lys。16位的式IV氨基酸和α,α二取代氨基酸的组合有利地提供改进的针对胰高血糖素受体、GLP-1受体和GIP受体中任一种的活性。
亲水部分连接
在另一实施方案中,通过让亲水部分与肽共价连接来提高本文公开的胰高血糖素肽的溶解性。可在任何合适用于蛋白质与活化的聚合物分子反应的条件下将亲水部分连接到胰高血糖素肽。可使用本领域已知的任何手段,包括经由酰化、还原性烷化、Michael加成、硫醇烷化或通过PEG部分上的反应性基团(例如醛、氨基、酯、硫醇、α-卤代乙酰基、马来酰亚胺基或肼基)与靶标化合物上的活性基团(例如醛、氨基、酯、硫醇、α-卤代乙酰基、马来酰亚胺基或肼基)的其它化学选择性缀合/连接方法。可用于让水溶性聚合物与一种或多种蛋白质连接的活化基团包括但不限于砜、马来酰亚胺、巯基、硫醇、三氟甲磺酸基、三氟乙磺酸基、氮丙烯(azidirine)、环氧乙烷、5-吡啶基和α-卤代酰基(例如α-碘乙酸、α-溴乙酸、α-氯乙酸)。若通过还原性烷化与肽连接,则所选聚合物应该具有单一的反应性醛,以便控制聚合程度。参见例如,Kinstler等,Adv.Drug.Delivery Rev.54:477-485(2002);Roberts等,Adv.Drug Delivery Rev.54:459-476(2002);和Zalipsky等,Adv.Drug Delivery Rev.16:157-182(1995)。
在本发明的特定方面,用亲水部分例如PEG修饰胰高血糖素肽上具有硫醇的氨基酸残基。在某些实施方案中,在Michael加成反应中用马来酰亚胺活化的PEG修饰硫醇,以产生包含以下所示硫醚连接的聚乙二醇化的肽:
在某些实施方案中,在亲核取代反应中用卤代乙酰基活化的PEG修饰硫醇,产生包含以下所示硫醚连接的聚乙二醇化肽:
合适的亲水部分包括:聚乙二醇(PEG)、聚丙二醇、聚氧乙烯化多元醇(例如POG)、聚氧乙烯化山梨醇、聚氧乙烯化葡萄糖、聚氧乙烯化丙三醇(POG)、聚氧乙烯、聚乙二醇丙醛、乙二醇/丙二醇共聚物、单甲氧基-聚乙二醇、单-(C1-C10)烷氧基-或芳氧基-聚乙二醇、羧甲基纤维素、聚缩醛、聚乙烯醇(PVA)、聚乙烯吡咯烷酮、聚-1,3-二氧杂环戊烷、聚-1,3,6-三烷、乙烯/马来酸酐共聚物、聚(.β.-氨基酸)(同聚物或无规共聚物)、聚(n-乙烯基吡咯烷酮)聚乙二醇、聚丙二醇同聚物(PPG)和其它聚环氧烷、聚环氧丙烷/环氧乙烷共聚物、结肠酸(colonic acid)或其它多糖聚合物、Ficoll或右旋糖酐及其混合物。
本发明某些实施方案的亲水部分例如聚乙二醇链具有选自约500-约40,000道尔顿范围的分子量。在一个实施方案中,所述亲水部分例如PEG具有选自约500-约5,000道尔顿或约1,000-约5,000道尔顿范围的分子量。在另一实施方案中,所述亲水部分例如PEG具有约10,000-约20,000道尔顿的分子量。在另外的其它例示性实施方案中,亲水部分例如PEG具有约20,000-约40,000道尔顿的分子量。
在一个实施方案中,将右旋糖酐用作亲水部分。右旋糖酐为葡萄糖亚单位的多糖聚合物,主要以α1-6键合来连接。可获得很多分子量范围的右旋糖酐,例如约1kD-约100kD或从约5、10、15或20kD到约20、30、40、50、60、70、80或90kD。
涵盖直链或支链聚合物。得到的缀合物制剂可为基本上单分散或多分散,每个肽可具有约0.5、0.7、1、1.2、1.5或2个聚合物部分。
在一个实施方案中,亲水部分为聚乙二醇(PEG)链,其任选在16、17、21、24、29位、C-末端突出端内的位置(例如30、31、32、33、34、35、36、37、38、39位)或在C-末端氨基酸(例如40位)中的一个或多个位置与肽连接。在某些实施方案中,该位置的天然氨基酸被具有适于与亲水部分交联的侧链的氨基酸取代,以促进亲水部分与肽的连接。在例示性实施方案中,该位置的天然氨基酸被Lys、Cys、Orn、高半胱氨酸或乙酰基-苯丙氨酸残基取代。在其它实施方案中,将经修饰以包含亲水基团的氨基酸添加到肽的C-末端。
提高溶解性的其它修饰
在另一实施方案中,可通过取代和/或添加氨基酸来改进任何胰高血糖素肽的溶解性,所述取代和/或添加氨基酸优选在SEQ ID NO:1的27位的C-末端位置将带电荷的氨基酸引入到肽的C-末端部分。任选可将一个、两个或三个带电荷的氨基酸引入到C-末端部分内,优选引入到27位的C-末端。在某些实施方案中,用一个或两个带电荷的氨基酸取代28和/或29位的天然氨基酸,和/或在另一实施方案中,亦将1-3个带电荷的氨基酸添加到肽的C-末端。在例示性实施方案中,一个、两个或所有带电荷的氨基酸为带负电荷。在某些实施方案中,带负电荷的氨基酸(酸性氨基酸)为天冬氨酸或谷氨酸。
可对胰高血糖素肽进行另外的修饰,例如保守性取代,而使得其仍保留GIP活性(并任选GLP-1活性和/或胰高血糖素活性)。
缀合物和融合体
本发明还包含其它缀合物,其中本发明胰高血糖素肽任选经由共价键合并任选经由接头与缀合物部分连接。可通过共价化学键、物理作用力(例如静电、氢键、离子键、范德华力或疏水或亲水相互作用)来实现连接。可使用多种非共价偶联系统,包括生物素-亲和素、配体/受体、酶/底物、核酸/核酸结合蛋白、脂类/脂类结合蛋白、细胞粘连分子配偶体;或彼此具有亲和力的任何结合配偶体或其片段。
可通过肽的被靶向的氨基酸残基与有机衍生化试剂反应经由直接共价连接来使肽与缀合物连接,所述有机衍生化试剂能够与所选择的这些靶标氨基酸的侧链或N-或C-末端残基反应。肽或缀合物上的反应性基团包括例如醛、氨基、酯、硫醇、α-卤代乙酰基、马来酰亚胺基或肼基。衍生化试剂包括例如:磺基琥珀酰亚胺马来酰亚胺基苯甲酯(通过半胱氨酸残基缀合)、N-羟基琥珀酰亚胺(通过赖氨酸残基)、戊二醛、戊琥珀酐或本领域已知的其它试剂。或者,可间接通过中间体载体(例如多糖或多肽载体)将缀合物部分连接到肽。多糖载体的实例包括氨基右旋糖酐。合适的多肽载体实例包括聚赖氨酸、聚谷氨酸、聚天冬氨酸、其共聚物和这些氨基酸和其它氨基酸(例如丝氨酸)的混合聚合物,以赋予由此产生的带负载的载体所期需的溶解特性。
最常见的半胱氨酰残基与α-卤代乙酸酯(及相应的胺)(例如氯乙酸、氯乙酰胺)反应,产生羧甲基或羧基氨甲基衍生物。还通过与以下物质反应衍生半胱氨酰残基:溴三氟丙酮、α-溴-β-(5-imidozoyl)丙酸、氯乙酰基磷酸盐、N-烷基马来酰亚胺、3-硝基-2-吡啶二硫化物、甲基2-吡啶二硫化物、对-氯汞基苯甲酸盐、2-氯汞基-4-硝基苯酚或氯-7-硝基苯并-2-氧杂-1,3-二唑。
通过与焦炭酸二乙酯在pH 5.5-7.0下反应衍生组氨酰残基,因为焦炭酸二乙酯对组氨酰侧链有相对特异性。对溴苯甲酰基甲基溴也是有用的;反应优选在0.1M二甲胂酸钠中于pH 6.0下进行。
赖氨酰和氨基-末端残基与琥珀酸酐或其它羧酸酐反应。用这些试剂进行衍生化具有反转赖氨酰残基的电荷的作用。用于衍生含α-氨基的残基的其它合适的试剂包括亚氨酸酯(例如甲基吡啶亚胺甲酯)、磷酸吡哆醛、吡哆醛、氯硼氢化物、三硝基苯磺酸、O-甲基异脲、2,4-戊二酮和与乙醛酸的转氨酶催化反应。
通过与一种或若干种常规试剂反应来修饰精氨酰残基,所述常规试剂有苯甲酰甲醛、2,3-丁二酮、1,2-环己二酮和茚三酮。因为胍官能团的高pKa,精氨酸残基衍生化需要在碱性条件下进行反应。此外,这些试剂可与赖氨酸基团以及精氨酸ε-氨基反应。
可对酪氨酰残基进行特定修饰,特别感兴趣的是通过与芳香族重氮化合物或四硝基甲烷反应将光谱标记引入酪氨酰残基。最常用N-乙酰咪唑和四硝基甲烷来分别形成O-乙酰基酪氨酰物质和3-硝基衍生物。
通过与碳二亚胺(R-N.dbd.C.dbd.N-R′)反应来选择性地修饰羧基侧基(天冬氨酰或谷氨酰),其中R和R′为不同的烷基,例如1-环己基-3-(2-吗啉基-4-乙基)碳二亚胺或1-乙基-3-(4-氮阳离子(azonia)-4,4-二甲基戊基)碳二亚胺。另外,通过与铵离子反应将天冬氨酰和谷氨酰残基转化为天冬酰基及谷氨酰基残基。
其它修饰包括脯氨酸和赖氨酸的羟基化、丝氨酰或苏氨酰残基羟基的磷酸化、赖氨酸、精氨酸和组氨酸侧链的α-氨基的甲基化(T.E.Creighton,Proteins:Structure and Molecular Properties,W.H.Freeman&Co.,San Francisco,第79-86页(1983))、天冬酰胺或谷氨酰胺的脱酰胺化、N-末端胺的乙酰化和/或C-末端羧酸基团的酰胺化或酯化。
另一类共价修饰涉及化学上或酶学上使糖苷与肽偶联。可将糖连接到:(a)精氨酸和组氨酸;(b)游离羧基;(c)游离巯基,例如半胱氨酸的巯基;(d)游离羟基,例如丝氨酸、苏氨酸或羟基脯氨酸的羟基;(e)芳香族残基,例如酪氨酸或色氨酸的芳香族残基;或(f)谷氨酰胺的酰胺基团。这些方法在以下文献中阐述:1987年9月11日公开的WO87/05330和Aplin和Wriston,CRC Crit.Rev.Biochem.,第259-306页(1981)。
可与本文所述的任何胰高血糖素肽连接的例示性缀合物部分包括但不限于异源肽或异源多肽(包括例如血浆蛋白)、靶向剂、免疫球蛋白或其部分(例如可变区、CDR或Fc区)、诊断标记(例如放射性同位素、荧光团或酶标记)、包括水溶性聚合物在内的聚合物或其它治疗剂或诊断剂。在一个实施方案中,提供缀合物,所述缀合物包含本发明胰高血糖素肽和血浆蛋白,其中所述血浆蛋白选自白蛋白、转铁蛋白、纤维蛋白原和球蛋白。
在某些实施方案中,所述接头包含1-约60或1-30个原子或更长、2-5个原子、2-10个原子、5-10个原子或10-20个原子长的链。在某些实施方案中,链原子都为碳原子。在某些实施方案中,接头主链的链原子选自C、O、N和S。可按照其所需溶解性(亲水性)来选择链原子和接头,以便提供更可溶的缀合物。在某些实施方案中,接头提供官能团,所述官能团由酶或其它催化剂或在靶组织或器官或细胞中发现的水解条件所裂解。在某些实施方案中,接头长度长到足以降低位阻电势。若接头为共价键或肽基键并且缀合物为多肽,则整个缀合物可为融合蛋白。所述肽基接头可为任何长度。例示性接头长度为约1-50个氨基酸、5-50、3-5、5-10、5-15或10-30个氨基酸。作为备选,可通过本领域一般人员已知的重组遗传工程方法产生所述融合蛋白。
如上所述,在某些实施方案中,胰高血糖素肽被缀合,例如与免疫球蛋白或其部分(例如可变区、CDR或Fc区)融合。已知的免疫球蛋白(Ig)类型包括IgG、IgA、IgE、IgD或IgM。Fc区为Ig重链的C-末端区,其负责与实现活性的Fc受体结合,所述活性例如再循环(其导致半衰期延长)、抗体依赖性细胞介导的细胞毒性(ADCC)和补体依赖性细胞毒性(CDC)。
例如,根据某些定义,人IgG重链Fc区从重链的Cys226延伸到C-末端。″铰链区″通常从人IgG1的Glu216延伸到Pro230(可通过比对半胱氨酸键合中所涉及的半胱氨酸让其它IgG同种型的铰链区与IgG1序列进行比对)。IgG的Fc区包括两个恒定区CH2和CH3。人IgG Fc区的CH2结构域通常从氨基酸231延伸到氨基酸341。人IgG Fc区的CH3结构域通常从氨基酸342延伸到447。对免疫球蛋白或免疫球蛋白片段或区域的氨基酸编号的提及都基于Kabat等1991,Sequences of Proteins of Immunological Interest,马里兰州贝塞斯达的美国公共卫生部。在相关实施方案中,所述Fc区可包含来自免疫球蛋白重链的除CH1外的一个或多个天然或修饰的恒定区,所述恒定区例如IgG和IgA的CH2和CH3区或IgE的CH3和CH4区。
合适的缀合物部分包括免疫球蛋白序列的部分,所述部分包括FcRn结合位点。FcRn这种补救受体(salvage receptor)负责免疫球蛋白再循环并使其回到血液循环中。业已基于X射线结晶学阐述了结合FcRn受体的IgG Fc部分的区域(Burmeister等1994,Nature 372:379)。Fc与FcRn的主要接触区域靠近CH2和CH3结构域的接点。Fc-FcRn接触处全部在单一Ig重链内。主要接触位点包括CH2结构域的氨基酸残基248、250-257、272、285、288、290-291、308-311和314及CH3结构域的氨基酸残基385-387、428和433-436。
某些缀合物部分可包括或可不包括FcγR结合位点。FcγR负责ADCC和CDC。使得直接与FcγR接触的Fc区内的位置实例为氨基酸234-239(靠下部的铰链区)、氨基酸265-269(B/C环)、氨基酸297-299(C′/E环)和氨基酸327-332(F/G)环(Sondermann等,Nature 406:267-273,2000)。IgE的靠下部的铰链区亦牵涉到FcRI结合中(Henry等,Biochemistry 36,15568-15578,1997)。IgA受体结合中涉及的残基阐述于Lewis等,(J Immunol.175:6694-701,2005)中。IgE受体结合中涉及的氨基酸残基阐述于Sayers等(J Biol Chem.279(34):35320-5,2004)中。
可对免疫球蛋白的Fc区进行氨基酸修饰。所述变体Fc区包含至少一个Fc区的CH3结构域的氨基酸修饰(残基342-447)和/或至少一个Fc区的CH2结构域的氨基酸修饰(残基231-341)。认为致使对FcRn亲和力提高的突变包括T256A、T307A、E380A和N434A(Shields等2001,J.Biol.Chem.276:6591)。其它突变可降低Fc区与FcγRI、FcγRIIA、FcγRIIB和/或FcγRIIIA的结合而不显著降低对FcRn的亲和力。例如,用Ala或另一氨基酸取代Fc区297位的Asn,除去了高度保守的N-糖基化位点,并且可导致Fc区的免疫原性降低而同时延长半衰期,以及降低与FcγR的结合(Routledge等1995,Transplantation 60:847;Friend等1999,Transplantation 68:1632;Shields等1995,J.Biol.Chem.276:6591)。实施了对IgG1的233-236位的氨基酸修饰,该修饰降低与FcγR的结合(Ward和Ghetie 1995,Therapeutic Immunology 2:77和Armour等1999,Eur.J.Immunol.29:2613)。某些例示性氨基酸取代阐述于美国专利7,355,008和7,381,408中,其各自以其整体在此引作参考。
本公开内容亦包含胰高血糖素融合肽或融合蛋白,其中将第二个肽或多肽融合到胰高血糖素肽的末端(例如羧基末端)。在某些实施方案中,被加到胰高血糖素肽的羧基末端的第二肽为SEQ ID NO:95(GPSSGAPPPS)、SEQ ID NO:97(KRNRNNIA)或SEQ ID NO:98(KRNR),它们被连接到胰高血糖素肽的氨基酸29。在其它实施方案中,所述第二肽为XGPSSGAPPPS(SEQ ID NO:96),其中X选自20种常见氨基酸之一,例如谷氨酸、天冬氨酸或甘氨酸。在一个实施方案中,X表示氨基酸,例如Cys,所述氨基酸进一步包含共价连接到该氨基酸侧链的亲水部分。所述C-末端突出端改进溶解性,并且还可改进GIP或GLP-1活性。在某些实施方案中,胰高血糖素肽进一步包含羧基末端突出端,该突出端的羧基末端氨基酸以酰胺基团或酯基团而不是羧酸作为末端。
在某些实施方案中,例如在包含C-末端突出端的胰高血糖素肽中,用甘氨酸取代天然胰高血糖素肽的29位苏氨酸。例如,具有29位甘氨酸取代苏氨酸并包含C-末端突出端GPSSGAPPPS(SEQ ID NO:95)的胰高血糖素肽,与经修饰以包含同样的C-末端突出端的天然胰高血糖素肽相比,针对GLP-1受体的效力为4倍。这种T29G取代可与本文公开的其它修饰联合使用,以提高胰高血糖素肽对GLP-1受体的亲和力。例如,T29G取代可与S16E和N20K氨基酸取代联合,任选与氨基酸16和20之间的内酰胺桥并任选与添加本文所述PEG链联合。
在某些实施方案中,将氨基酸加到C-末端,添加的氨基酸选自谷氨酸、天冬氨酸和甘氨酸。
本公开内容亦包含本文公开的经修饰胰高血糖素肽的多聚体。用标准连接剂和本领域技术人员所知的方法,可将两种或更多种经修饰的胰高血糖素肽连接在一起。例如,通过用双官能硫醇交联剂和双官能胺交联剂,可在两种经修饰的胰高血糖素肽之间形成二聚体,尤其是对于被半胱氨酸、赖氨酸、鸟氨酸、高半胱氨酸或乙酰基苯丙氨酸残基取代的胰高血糖素肽。
酰化和烷化
根据某些实施方案,修饰本文公开的胰高血糖素肽以包含酰基或烷基,例如对于天然存在的氨基酸而言为非天然的酰基或烷基。酰化或烷化可提高循环中的胰高血糖素肽半衰期。酰化或烷化可有利地推迟针对胰高血糖素受体和/或GLP-1受体的作用起始和/或延长作用时间,和/或改进对蛋白酶例如DPP-IV的抗性,和/或改进溶解性。酰化后可保持胰高血糖素肽针对胰高血糖素受体和/或GLP-1受体和/或GIP受体的活性。在某些实施方案中,酰化的胰高血糖素肽效价与未酰化形式的胰高血糖素肽的效价相当。在备选实施方案中,酰化的胰高血糖素肽效价与未酰化形式的胰高血糖素肽的效价比较提高了。
在某些实施方案中,本发明提供经修饰以包含共价连接到胰高血糖素肽的10位氨基酸的酰基或烷基的胰高血糖素肽。胰高血糖素肽可进一步包含在胰高血糖素肽的10位氨基酸与所述酰基或烷基之间的间隔物。在某些实施方案中,所述酰基为脂肪酸或胆汁酸或其盐,例如C4-C30脂肪酸、C8-C24脂肪酸、胆酸、C4-C30烷基、C8-C24烷基或包含胆汁酸的类固醇部分的烷基。所述间隔物为具有用于连接酰基或烷基的合适的反应性基团的任何部分。在例示性实施方案中,间隔物包含氨基酸、二肽、三肽、亲水双官能或疏水双官能间隔物。在某些实施方案中,间隔物选自:Trp、Glu、Asp、Cys和包含NH2(CH2CH2O)n(CH2)mCOOH的间隔物,其中m为从1到6的任何整数,n为从2到12的任何整数。所述酰化或烷化的胰高血糖素肽亦可进一步包含亲水部分,任选聚乙二醇。任何前述胰高血糖素肽可包含两个酰基或两个烷基或其组合。
酰化可在胰高血糖素肽内的任何位置进行,包括1-29位、C-末端突出端或N-或C-末端氨基酸中的任何位置,前提是即使不提高GIP活性也要保留GIP活性(并任选GLP-1和/或胰高血糖素活性)。酰化可例如在添加到胰高血糖素序列(SEQ ID NO:1)中的任何氨基酸中发生,例如在N-或C-末端。非限制性实例包括胰高血糖素肽的1、5、10、11、12、13、14、16、17、18、19、20、21、24、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49或50位。酰基可直接与胰高血糖素肽的氨基酸共价连接,或经由间隔物与胰高血糖素肽的氨基酸间接连接,其中间隔物位于胰高血糖素肽的氨基酸和酰基之间。胰高血糖素肽可在连接亲水部分的同一个氨基酸位置被酰化,或在不同的氨基酸位置被酰化。非限制性实例包括10位或40位的酰化,并在胰高血糖素肽的C-末端部分的一个或多个位置(例如24、28或29位)、C-末端突出端内或在C-末端(例如通过添加C-末端Cys)聚乙二醇化。
在某些实施方案中,修饰胰高血糖素肽以包含SEQ ID NO:1胰高血糖素肽或其类似物C-末端的约1-约21个氨基酸的突出端,并且所述突出端中的至少一个氨基酸被酰化或烷化。例如,经修饰的胰高血糖素肽可包含SEQ ID NO:1胰高血糖素肽或其类似物的29位氨基酸C-末端的约1-约21个氨基酸的延伸。或者,若截短胰高血糖素肽或其类似物的一个或两个氨基酸,则约1-约21个氨基酸的突出端可为胰高血糖素肽或其类似物的27或28位氨基酸的C-末端。因此,C-末端突出端内的酰化或烷化氨基酸可为例如C-末端延伸的胰高血糖素肽的28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49或50位的任何氨基酸。某些实施方案中的C-末端突出端包含SEQ ID NO:95或96氨基酸序列。在某些实施方案中,胰高血糖素肽包含C-末端突出端,所述C-末端突出端包含SEQ ID NO:95氨基酸序列和SEQ ID NO:95的C-末端的添加的1-11个氨基酸,所述添加的氨基酸如本文所述被酰化或烷化。在特定实施方案中,酰化或烷化的氨基酸为Dab、Orn、Lys或高Lys残基,其位于所述C-末端延伸的胰高血糖素肽或其类似物的40位。
根据本发明一个实施方案,修饰胰高血糖素肽以包含经由酯、硫酯或酰胺键合连接到胰高血糖素肽的酰基,其目的在于延长循环半衰期和/或延迟作用开始和/或延长作用时间和/或改进对蛋白酶例如DPP-IV的抗性。
在本发明的特定方面,通过直接酰化胰高血糖素肽氨基酸侧链的胺、羟基或硫醇,来修饰胰高血糖素肽以包含酰基。在某些实施方案中,通过氨基酸侧链的胺、羟基或硫醇直接使胰高血糖素肽酰化。在某些实施方案中,在10、20、24、29或40位酰化。在这点上,酰化的胰高血糖素肽可包含SEQ ID NO:1氨基酸序列或其经修饰的氨基酸序列,所述经修饰的氨基酸序列包含一种或多种本文所述氨基酸修饰,且10、20、24、29和40位氨基酸中的至少一个被修饰为包含侧链胺、羟基或硫醇的任何氨基酸。在本发明某些特定实施方案中,通过10或40位氨基酸的侧链胺、羟基或硫醇使胰高血糖素肽直接酰化。
在某些实施方案中,包含侧链胺的氨基酸为式I氨基酸:
其中n=1-4
[式I]
在某些例示性实施方案中,式I氨基酸是其中n为4(Lys)或n为3(Orn)的氨基酸。
在其它实施方案中,包含侧链羟基氨基酸为式II氨基酸:
其中n=1-4
[式II]
在某些例示性实施方案中,式II氨基酸是其中n为1(Ser)的氨基酸。
在另外的其它实施方案中,包含侧链硫醇的氨基酸为式III氨基酸:
其中n=1-4
[式III]
在某些例示性实施方案中,式II氨基酸是其中n为1(Cys)的氨基酸。
在另外的其它实施方案中,包含侧链胺、羟基或硫醇的氨基酸为包含同样的式I、式II或式III结构的二取代氨基酸,不同的是用第二个侧链来置换键合到式I、式II或式III氨基酸的α碳的氢。
在本发明一个实施方案中,酰化的胰高血糖素肽包含肽和酰基之间的间隔物。在某些实施方案中,胰高血糖素肽与间隔物共价结合,所述间隔物与酰基共价结合。
被间隔物连接的氨基酸可为包含允许与间隔物连接的部分的任何氨基酸(例如单或双α-取代氨基酸)。例如,包含侧链NH2、-OH或-COOH(例如Lys、Orn、Ser、Asp或Glu)的氨基酸是合适的。在这点上,酰化的胰高血糖素肽可包含SEQ ID NO:1氨基酸序列或其经修饰的氨基酸序列,所述经修饰的氨基酸序列包含一种或多种本文所述氨基酸修饰,且10、20、24、29和40位氨基酸中的至少一个被修饰为包含侧链胺、羟基或羧酸酯的任何氨基酸。
在某些实施方案中,间隔物为包含侧链胺、羟基或硫醇或二肽或三肽的氨基酸,所述二肽或三肽包含包含侧链胺、羟基或硫醇的氨基酸。
当通过间隔物的胺基团发生酰化时,酰化可通过氨基酸的α胺或侧链胺发生。在其中α胺被酰化的情况下,间隔物氨基酸可为任何氨基酸。例如,间隔物氨基酸可为疏水氨基酸,例如Gly、Ala、Val、Leu、Ile、Trp、Met、Phe、Tyr、6-氨基己酸、5-氨基戊酸、7-氨基庚酸和8-氨基辛酸。或者,间隔物氨基酸可为酸性残基,例如Asp和Glu。
在其中间隔物氨基酸侧链胺被酰化的情况下,间隔物氨基酸为包含侧链胺的氨基酸,例如式I氨基酸(例如Lys或Orn)。在这种情况下,可能间隔物氨基酸的α胺和侧链胺二者都被酰化,由此胰高血糖素肽被二酰化。本发明实施方案包括所述二酰化的分子。
当通过间隔物的羟基发生酰化时,氨基酸或二肽或三肽的氨基酸之一可为式II氨基酸。在特定例示性实施方案中,所述氨基酸为Ser。
当通过间隔物的硫醇基团发生酰化时,氨基酸或二肽或三肽的氨基酸之一可为式III氨基酸。在特定例示性实施方案中,所述氨基酸为Cys。
在某些实施方案中,间隔物为亲水双官能间隔物。在某些实施方案中,亲水双官能间隔物包含两个或更多个活性基团,例如胺、羟基、硫醇和羧基或其任何组合。在某些实施方案中,亲水双官能间隔物包含羟基和羧酸酯。在其它实施方案中,亲水双官能间隔物包含胺基团和羧酸酯。在其它实施方案中,亲水双官能间隔物包含硫醇基团和羧酸酯。在特定实施方案中,所述间隔物包含氨基聚(烷氧基)羧酸酯。在这点上,间隔物可包含例如NH2(CH2CH2O)n(CH2)mCOOH,其中m为自1到6的任何整数,n为自2到12的任何整数,所述间隔物例如8-氨基-3,6-二氧杂辛酸,其可购自Peptides International,Inc.(Louisville,KY)。
在某些实施方案中,间隔物为疏水双官能间隔物。疏水双官能间隔物为本领域所知。参见例如Bioconjugate Techniques,G.T.Hermanson(Academic Press,San Diego,CA,1996),以其整体在此引作参考。在某些实施方案中,疏水双官能间隔物包含两个或更多个反应性基团,例如胺、羟基、硫醇和羧基或其任何组合。在某些实施方案中,疏水双官能间隔物包含羟基和羧酸酯。在其它实施方案中,疏水双官能间隔物包含胺基团和羧酸酯。在其它实施方案中,疏水双官能间隔物包含硫醇基团和羧酸酯。包含羧酸酯和羟基或硫醇基团的合适的疏水双官能间隔物为本领域已知,包括例如8-羟基辛酸和8-巯基辛酸。
在某些实施方案中,双官能间隔物不是包含羧酸酯基团之间的1-7个碳原子的非支链亚甲基的二羧酸。在某些实施方案中,双官能间隔物是包含羧酸酯基团之间的1-7个碳原子的非支链亚甲基的二羧酸。
特定实施方案中的间隔物(例如氨基酸、二肽、三肽、亲水双官能间隔物或疏水双官能间隔物)长度是3-10个原子(例如6-10个原子(例如6、7、8、9或10个原子)。在更特定实施方案中,所述间隔物长度为约3-10个原子(例如6-10个原子),并且所述酰基为C12-C18脂肪酰基,例如C14脂肪酰基、C16脂肪酰基,以使间隔物和酰基的总长为14-28个原子,例如约14、15、16、17、18、19、20、21、22、23、24、25、26、27或28个原子。在某些实施方案中,间隔物和酰基的长度为17-28(例如19-26、19-21)个原子。
根据某些前述实施方案,双官能间隔物可为合成的或天然存在的氨基酸(包括但不限于本文所述的任何氨基酸),所述氨基酸包含长度为3-10个原子的氨基酸主链(例如6-氨基己酸、5-氨基戊酸、7-氨基庚酸和8-氨基辛酸)。或者,间隔物可为二肽或三肽间隔物,其具有长度为3-10个原子(例如6-10个原子)的肽主链。二肽或三肽间隔物的每一个氨基酸可与该二肽或三肽的其它氨基酸相同或不同,并可独立选自:天然存在的和/或非天然存在的氨基酸,包括例如天然存在的氨基酸(Ala、Cys、Asp、Glu、Phe、GLy、His、Ile、Lys、Leu、Met、Asn、Pro、Arg、Ser、Thr、Val、Trp、Tyr)的任何D或L异构体,或选自以下的非天然存在的氨基酸的任何D或L异构体:β-丙氨酸(β-Ala)、N-α-甲基-丙氨酸(Me-Ala)、氨基丁酸(Abu)、γ-氨基丁酸(γ-Abu)、氨基己酸(ε-Ahx)、氨基异丁酸(Aib)、氨基甲基吡咯甲酸、氨基哌啶甲酸、氨基丝氨酸(Ams)、氨基四氢吡喃-4-甲酸、精氨酸N-甲氧基-N-甲基酰胺、β-天冬氨酸(β-Asp)、氮杂环丁烷甲酸、3-(2-苯并噻唑基)丙氨酸、α-叔-丁基甘氨酸、2-氨基-5-脲基-n-戊酸(瓜氨酸,Cit)、β-环己基丙氨酸(Cha)、乙酰氨甲基-半胱氨酸、二氨基丁酸(Dab)、二氨基丙酸(Dpr)、二羟苯丙氨酸(DOPA)、二甲基噻唑烷(DMTA)、γ-谷氨酸(γ-Glu)、高丝氨酸(Hse)、羟基脯氨酸(Hyp)、异亮氨酸N-甲氧基-N-甲基酰胺、甲基-异亮氨酸(MeIle)、六氢异烟酸(Isn)、甲基-亮氨酸(MeLeu)、甲基-赖氨酸、二甲基-赖氨酸、三甲基-赖氨酸、甲醇基脯氨酸、甲硫氨酸-亚砜(Met(O))、甲硫氨酸-砜(Met(O2))、正亮氨酸(Nle)、甲基-正亮氨酸(Me-Nle)、正缬氨酸(Nva)、鸟氨酸(Orn)、对氨基苯甲酸(PABA)、青霉胺(Pen)、甲基苯丙氨酸(MePhe)、4-氯苯丙氨酸(Phe(4-Cl))、4-氟苯丙氨酸(Phe(4-F))、4-硝基苯丙氨酸(Phe(4-NO2))、4-氰基苯丙氨酸((Phe(4-CN))、苯基甘氨酸(Phg)、哌啶基丙氨酸、哌啶基甘氨酸、3,4-脱氢脯氨酸、吡咯烷基丙氨酸、肌氨酸(Sar)、硒代半胱氨酸(Sec)、O-苯甲基-磷酸丝氨酸、4-氨基-3-羟基-6-甲基庚酸(Sta)、4-氨基-5-环己基-3-羟基戊酸(ACHPA)、4-氨基-3-羟基-5-苯基戊酸(AHPPA)、1,2,3,4,-四氢-异喹啉-3-甲酸(Tic)、四氢吡喃甘氨酸、噻吩基丙氨酸(Thi)、O-苯甲基-磷酸酪氨酸、O-磷酸酪氨酸、甲氧基酪氨酸、乙氧基酪氨酸、O-(双-二甲基氨基-膦酰基)-酪氨酸、硫酸酪氨酸四丁基胺、甲基-缬氨酸(MeVal)和烷化的3-巯基丙酸。
在某些实施方案中,间隔物包含整体负电荷(overall negative charge),例如包含一个或两个带负电荷的氨基酸。在某些实施方案中,二肽不是任何通常结构A-B的二肽,其中A选自Gly、Gln、Ala、Arg、Asp、Asn、Ile、Leu、Val、Phe和Pro,其中B选自Lys、His、Trp。在某些实施方案中,二肽间隔物选自:Ala-Ala、β-Ala-β-Ala、Leu-Leu、Pro-Pro、γ-氨基丁酸-γ-氨基丁酸和γ-Glu-γ-Glu。
在某些例示性实施方案中,通过酰化间隔物的胺、羟基或硫醇来修饰胰高血糖素肽以包含酰基,将所述间隔物连接到10、20、24、29或40位氨基酸或胰高血糖素肽的C-末端氨基酸的侧链。
在更为特定的实施方案中,将酰基连接到胰高血糖素肽的10或40位氨基酸,任选间隔物和酰基的长度为14-28个原子。在某些方面,10或40位氨基酸为式I氨基酸,例如Lys,或为与式I相关的二取代氨基酸。在更特定实施方案中,胰高血糖素肽缺乏分子内桥,例如共价分子内桥。例如,胰高血糖素肽可为包含一个或多个用于稳定肽的α螺旋的α,α-二取代氨基酸(例如AIB)的肽。如本文所述,所述包含共价连接到40位氨基酸侧链的酰化间隔物的肽针对GIP受体、GLP-1受体和胰高血糖素受体表现出提高的效价。
经由胺、羟基和硫醇使肽酰化的合适的方法为本领域已知。参见例如:实施例19(通过胺酰化的方法),Miller,Biochem Biophys Res Commun218:377-382(1996);Shimohigashi和Stammer,Int J Pept Protein Res 19:54-62(1982);和Previero等,Biochim Biophys Acta 263:7-13(1972)(通过羟基酰化的方法);和San和Silvius,J Pept Res 66:169-180(2005)(通过硫醇酰化的方法);Bioconjugate Chem.″Chemical Modifications of Proteins:History and Applications(蛋白质的化学修饰:历史和应用)″第1、2-12页(1990);Hashimoto等,Pharmacuetical Res.″Synthesis of Palmitoyl Derivatives of Insulin and their Biological Activity(胰岛素的棕榈酰衍生物的合成及其生物学活性)″第6卷,No:2第171-176页(1989)。
酰化的胰高血糖素肽的酰基可为任何大小,例如任何长度的碳链,且可为直链或支链的。在本发明某些特定实施方案中,所述酰基为C4-C30脂肪酸。例如,酰基可为C4脂肪酸、C6脂肪酸、C8脂肪酸、C10脂肪酸、C12脂肪酸、C14脂肪酸、C16脂肪酸、C18脂肪酸、C20脂肪酸、C22脂肪酸、C24脂肪酸、C26脂肪酸、C28脂肪酸或C30脂肪酸中的任何一种。在某些实施方案中,酰基为C8-C20脂肪酸,例如C14脂肪酸或C16脂肪酸。
在备选实施方案中,酰基为胆汁酸。胆汁酸可为任何合适的胆汁酸,包括但不限于胆酸、鹅脱氧胆酸、脱氧胆酸、石胆酸、牛磺胆酸、甘氨胆酸和胆固醇酸。
在本发明某些实施方案中,通过使胰高血糖素肽长链烷烃酰化来修饰胰高血糖素肽以包含酰基。在特定方面,所述长链烷烃包含胺、羟基或硫醇基团(例如十八胺、十四醇和十六烷硫醇),它们与胰高血糖素肽的羧基或其活化形式反应。胰高血糖素肽的羧基或其活化形式可为胰高血糖素肽的氨基酸(例如谷氨酸、天冬氨酸)的侧链部分,或可为肽主链部分。
在某些实施方案中,通过与胰高血糖素肽连接的间隔物使长链烷烃酰化来修饰胰高血糖素肽以包含酰基。在特定方面,所述长链烷烃包含胺、羟基或硫醇基团,它们与间隔物的羧基或其活化形式反应。本文阐述了包含羧基或其活化形式的合适的间隔物,其包括例如双官能间隔物,例如氨基酸、二肽、三肽、亲水双官能间隔物和疏水双官能间隔物。
本文所用术语“羧基的活化形式”指具有通式R(C=O)X的羧基,其中X为离去基团,且R为胰高血糖素肽或间隔物。例如,羧基的活化形式可包括但不限于酰基氯、酸酐和酯。在某些实施方案中,活化的羧基为含N-羟基琥珀酰亚胺酯(NHS)离去基团的酯。
对于通过胰高血糖素肽或间隔物来酰化长链烷烃的本发明这些方面,所述长链烷烃可为任何大小,且可包含任何长度的碳链。长链烷烃可为直链或支链的。在某些方面,长链烷烃为C4-C30烷烃。例如,长链烷烃可为C4烷烃、C6烷烃、C8烷烃、C10烷烃、C12烷烃、C14烷烃、C16烷烃、C18烷烃、C20烷烃、C22烷烃、C24烷烃、C26烷烃、C28烷烃或C30烷烃中的任何一种。在某些实施方案中,长链烷烃包含C8-C20烷烃,例如C14烷烃、C16烷烃或C18烷烃。
同样在某些实施方案中,用胆固醇酸来酰化胰高血糖素肽的胺、羟基或硫醇基团。在特定实施方案中,通过经修饰的Cys间隔物让胰高血糖素肽与胆固醇酸连接。
可进一步修饰本文所述酰化的胰高血糖素肽以包含亲水部分。在某些特定实施方案中,亲水部分可包含聚乙二醇(PEG)链。可通过任何合适的方式引入亲水部分,例如本文所述的任何方法。在这点上,酰化的胰高血糖素肽可包含包括任何本文所述修饰在内的SEQ ID NO:1,其中10、20、24、29和40位氨基酸中的至少一个位置包含酰基,并且在16、17、21、24、29或40位、C-末端突出端内的位置或C-末端氨基酸中至少一个氨基酸被修饰为Cys、Lys、Orn、高Cys或Ac-Phe,将氨基酸侧链共价键合到亲水部分(例如PEG)。在某些实施方案中,将酰基连接到10或40位,任选经由包含Cys、Lys、Orn、高Cys或Ac-Phe的间隔物,并且在24位Cys残基处引入亲水部分。
或者,酰化的胰高血糖素肽可包含间隔物,其中间隔物既被酰化又被修饰为包含亲水部分。合适的间隔物的非限制性实例包括包含选自Cys、Ac-Cys、Lys、Orn、高Cys和Ac-Phe的一个或多个氨基酸的间隔物。
在本发明的特定方面,酰化的胰高血糖素肽包含以下任何氨基酸序列:SEQ ID NO:101-106、113-115、117-119、123-125、128-130、132-134、136-138、141-145、148、151、152、154、156、158、160、162、163、165、166、231、234-239、257和258。
根据某些实施方案,修饰胰高血糖素肽以包含烷基,例如氨基酸上并非天然存在的烷基(例如对于天然存在的氨基酸为非天然的烷基)。不坚持任何特定的理论,认为胰高血糖素的烷化将会达到与胰高血糖素酰化相似(即使不是同样)的效果,例如延长循环半衰期,推迟作用起始,延长作用时间,改进对蛋白酶例如DPP-IV的抗性,和提高针对GLP-1受体、GIP受体和胰高血糖素受体的效价。
烷化可在胰高血糖素肽内的任何位置进行,包括1-29位、C-末端突出端内或N-或C-末端氨基酸中的任何位置,前提是即使不提高GIP活性也要保留GIP活性(并任选GLP-1和/或胰高血糖素活性)。烷化可例如在添加到胰高血糖素序列(SEQ ID NO:1)中的任何氨基酸中发生,例如在N-或C-末端。非限制性实例包括1、5、10、11、12、13、14、16、17、18、19、20、21、24、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49或50位。可将烷基直接与胰高血糖素肽的氨基酸共价连接,或经由间隔物间接与胰高血糖素肽的氨基酸连接,其中间隔物位于胰高血糖素肽的氨基酸和烷基之间。胰高血糖素肽可在连接亲水部分的同一个氨基酸位置被烷化,或在不同的氨基酸位置被烷化。非限制性实例包括10位或40位的烷化,并在胰高血糖素肽的C-末端部分的一个或多个位置(例如24、28、29或40位)、C-末端突出端内或在C-末端(例如通过添加的C-末端Cys)聚乙二醇化。
在本发明的特定方面,通过直接使胰高血糖素肽氨基酸侧链的胺、羟基或硫醇烷化,来修饰胰高血糖素肽以包含烷基。在某些实施方案中,通过氨基酸侧链的胺、羟基或硫醇直接使胰高血糖素肽烷化。在某些实施方案中,在10、20、24、29或40位烷化。在这点上,烷化的胰高血糖素肽可包含SEQ ID NO:1氨基酸序列或其经修饰的氨基酸序列,所述经修饰的氨基酸序列包含一个或多个本文所述氨基酸修饰,且10、20、24、29和40位氨基酸中的至少一个被修饰为包含侧链胺、羟基或硫醇的任何氨基酸。在本发明某些特定实施方案中,通过10位氨基酸的侧链胺、羟基或硫醇使胰高血糖素肽直接烷化。
在某些实施方案中,包含侧链胺的氨基酸为式I氨基酸。在某些例示性实施方案中,式I氨基酸是其中n为4(Lys)或n为3(Orn)的氨基酸。
在其它实施方案中,包含侧链羟基的氨基酸为式II氨基酸。在某些例示性实施方案中,式II氨基酸是其中n为1(Ser)的氨基酸。
在另外的其它实施方案中,包含侧链硫醇的氨基酸为式III氨基酸。在某些例示性实施方案中,式III氨基酸是其中n为1(Cys)的氨基酸。
在另外的其它实施方案中,包含侧链胺、羟基或硫醇的氨基酸为包含同样的式I、式II或式III结构的二取代氨基酸,不同的是用第二个侧链来置换键合到式I、式II或式III氨基酸的α碳的氢。
在本发明一个实施方案中,烷化的胰高血糖素肽包含肽和烷基之间的间隔物。在某些实施方案中,胰高血糖素肽与间隔物共价结合,所述间隔物与烷基共价结合。在某些例示性实施方案中,通过烷化间隔物的胺、羟基或硫醇来修饰胰高血糖素肽以包含烷基,将所述间隔物连接到胰高血糖素肽的10、20、24、29或40位氨基酸的侧链。被间隔物连接的氨基酸可为包含允许与间隔物连接的部分的任何氨基酸(例如单α-取代氨基酸或α,α-二取代氨基酸)。例如,包含侧链NH2、-OH或-COOH的氨基酸(例如Lys、Orn、Ser、Asp或Glu)是合适的。在这点上,烷化的胰高血糖素肽可包含SEQ ID NO:1氨基酸序列或其经修饰的氨基酸序列,所述经修饰的氨基酸序列包含一个或多个本文所述氨基酸修饰,且10、20、24、29和40位氨基酸中的至少一个被修饰为包含侧链胺、羟基或羧酸酯的任何氨基酸。
在某些实施方案中,间隔物为包含侧链胺、羟基或硫醇或二肽或三肽的氨基酸,所述二肽或三肽包含包含侧链胺、羟基或硫醇的氨基酸。
当通过间隔物的胺基团发生烷化时,烷化可通过氨基酸的α胺或侧链胺发生。在其中α胺被烷化的情况下,间隔物氨基酸可为任何氨基酸。例如,间隔物氨基酸可为疏水氨基酸,例如Gly、Ala、Val、Leu、Ile、Trp、Met、Phe、Tyr、6-氨基己酸、5-氨基戊酸、7-氨基庚酸和8-氨基辛酸。或者,间隔物氨基酸可为酸性残基,例如Asp和Glu,前提是烷化发生在酸性残基的α胺上。在其中间隔物氨基酸侧链胺被烷化的情况下,间隔物氨基酸为包含侧链胺的氨基酸,例如式I氨基酸(例如Lys或Orn)。在这种情况下,可能间隔物氨基酸的α胺和侧链胺二者都被烷化,由此胰高血糖素肽被二烷化。本发明实施方案包括所述二烷化的分子。
当通过间隔物的羟基发生烷化时,所述氨基酸或二肽或三肽的氨基酸之一可为式II氨基酸。在特定例示性实施方案中,所述氨基酸为Ser。
当通过间隔物的硫醇基团发生烷化时,所述氨基酸或二肽或三肽的氨基酸之一可为式III氨基酸。在特定例示性实施方案中,所述氨基酸为Cys。
在某些实施方案中,间隔物为亲水双官能间隔物。在某些实施方案中,亲水双官能间隔物包含两个或多个反应性基团,例如胺、羟基、硫醇和羧基或其任何组合。在某些实施方案中,亲水双官能间隔物包含羟基和羧酸酯。在其它实施方案中,亲水双官能间隔物包含胺基团和羧酸酯。在其它实施方案中,亲水双官能间隔物包含硫醇基团和羧酸酯。在特定实施方案中,所述间隔物包含氨基聚(烷氧基)羧酸酯。在这点上,间隔物可包含例如NH2(CH2CH2O)n(CH2)mCOOH,其中m为自1到6的任何整数,n为自2到12的任何整数,所述间隔物例如8-氨基-3,6-二氧杂辛酸,其可购自Peptides International,Inc.(Louisville,KY)。
在某些实施方案中,间隔物为疏水双官能间隔物。在某些实施方案中,疏水双官能间隔物包含两个或多个反应性基团,例如胺、羟基、硫醇和羧基或其任何组合。在某些实施方案中,疏水双官能间隔物包含羟基和羧酸酯。在其它实施方案中,疏水双官能间隔物包含胺基团和羧酸酯。在其它实施方案中,疏水双官能间隔物包含硫醇基团和羧酸酯。包含羧酸酯和羟基或硫醇基团的合适的疏水双官能间隔物为本领域已知,包括例如8-羟基辛酸和8-巯基辛酸。
特定实施方案中的间隔物(例如氨基酸、二肽、三肽、亲水双官能间隔物或疏水双官能间隔物)长度是3-10个原子(例如6-10个原子(例如6、7、8、9或10个原子)。在更特定实施方案中,所述间隔物长度为约3-10个原子(例如6-10个原子),所述烷基为C12-C18烷基,例如C14烷基、C16烷基,以使间隔物和烷基的总长为14-28个原子,例如约14、15、16、17、18、19、20、21、22、23、24、25、26、27或28个原子。在某些实施方案中,间隔物和烷基的长度为17-28(例如19-26、19-21)个原子。
根据某些前述实施方案,双官能间隔物可为合成的或天然存在的氨基酸,所述氨基酸包含长度为3-10个原子的氨基酸主链(例如6-氨基己酸、5-氨基戊酸、7-氨基庚酸和8-氨基辛酸)。或者,间隔物可为二肽或三肽间隔物,其具有长度为3-10个原子(例如6-10个原子)的肽主链。二肽或三肽间隔物可由天然和/或非天然氨基酸组成,包括例如本文教导的任何氨基酸。在某些实施方案中,间隔物包含整体负电荷,例如包含一个或两个带负电荷的氨基酸。在某些实施方案中,二肽间隔物选自:Ala-Ala、β-Ala-β-Ala、Leu-Leu、Pro-Pro、γ-氨基丁酸-γ-氨基丁酸和γ-Glu-γ-Glu。
经由胺、羟基和硫醇使肽烷化的合适的方法为本领域已知。例如,可用Williamson醚合成来形成胰高血糖素肽羟基和所述烷基之间的醚连接。同样,肽与卤代烷的亲核取代反应可产生任何醚、硫醚或氨基连接。
烷化的胰高血糖素肽的烷基可为任何大小,例如任何长度的碳链,并可为直链或有支链的。在本发明某些实施方案中,所述烷基为C4-C30烷基。例如,烷基可为C4烷基、C6烷基、C8烷基、C10烷基、C12烷基、C14烷基、C16烷基、C18烷基、C20烷基、C22烷基、C24烷基、C26烷基、C28烷基或C30烷基中的任何一种。在某些实施方案中,烷基为C8-C20烷基,例如C14烷基或C16烷基。
在某些特定实施方案中,烷基包含胆汁酸的类固醇部分,所述胆汁酸例如胆酸、鹅脱氧胆酸、脱氧胆酸、石胆酸、牛磺胆酸、甘氨胆酸和胆固醇酸。
在本发明某些实施方案中,通过让亲核长链烷烃与胰高血糖素肽反应来修饰胰高血糖素肽以包含烷基,其中胰高血糖素肽包含适于亲核取代的离去基团。在特定方面,长链烷烃的亲核基团包含胺、羟基或硫醇基团(例如十八胺、十四醇和十六烷硫醇)。胰高血糖素肽的离去基团可为氨基酸的侧链部分,或可为肽主链的部分。合适的离去基团包括例如N-羟基琥珀酰亚胺、卤素和磺酸酯。
在某些实施方案中,通过让亲核长链烷烃与连接到胰高血糖素肽的间隔物反应来修饰胰高血糖素肽以包含烷基,其中所述间隔物包含离去基团。在特定方面,长链烷烃包含胺、羟基或硫醇基团。在某些实施方案中,包含离去基团的间隔物可为本文所述的任何间隔物,例如进一步包含合适的离去基团的氨基酸、二肽、三肽、亲水双官能间隔物和疏水双官能间隔物。
关于通过胰高血糖素肽或间隔物来烷化长链烷烃的本发明这些方面,所述长链烷烃可为任何大小,并可包含任何长度的碳链。长链烷烃可为直链或支链的。在某些方面,长链烷烃为C4-C30烷烃。例如,长链烷烃可为C4烷烃、C6烷烃、C8烷烃、C10烷烃、C12烷烃、C14烷烃、C16烷烃、C18烷烃、C20烷烃、C22烷烃、C24烷烃、C26烷烃、C28烷烃或C30烷烃中的任何一种。在某些实施方案中,长链烷烃包含C8-C20烷烃,例如C14烷烃、C16烷烃或C18烷烃。
同样在某些实施方案中,可在胰高血糖素肽和胆固醇部分之间发生烷化。例如,胆固醇羟基可替代长链烷烃上的离去基团以形成胆固醇-胰高血糖素肽产物。
可进一步修饰本文所述烷化的胰高血糖素肽以包含亲水部分。在某些特定实施方案中,亲水部分可包含聚乙二醇(PEG)链。可通过任何合适的方式引入亲水部分,例如本文所述的任何方法。在这点上,烷化的胰高血糖素肽可包含SEQ ID NO:1或其经修饰的氨基酸序列,所述经修饰的氨基酸序列包含本文所述的一个或多个氨基酸修饰,其中在10、20、24、29和40位氨基酸位置中的至少一个包含烷基,且在16、17、21、24、29或40位、C-末端突出端内的位置或C-末端氨基酸中至少一个氨基酸被修饰为Cys、Lys、Orn、高Cys或Ac-Phe,并且将氨基酸侧链共价键合到亲水部分(例如PEG)。在某些实施方案中,将烷基连接到10或40位,任选经由包含Cys、Lys、Orn、高Cys或Ac-Phe的间隔物,且在24位Cys残基处引入亲水部分。
或者,烷化的胰高血糖素肽可包含间隔物,其中间隔物既被烷化又被修饰为包含亲水部分。合适的间隔物的非限制性实例包括包含选自Cys、Ac-Cys、Lys、Orn、高Cys和Ac-Phe中的一个或多个氨基酸的间隔物。
例示性实施方案
根据本发明某些实施方案,具有GIP激动剂活性的胰高血糖素(SEQ ID NO:1)类似物包含含以下修饰的SEQ ID NO:1:(a)赋予GIP激动剂活性的1位氨基酸修饰;(b)稳定类似物的C-末端部分(12-29位氨基酸)α螺旋结构的修饰;和(c)任选1-10(例如1、2、3、4、5、6、7、8、9、10)个另外的氨基酸修饰。在某些实施方案中,类似物表现出天然GIP针对GIP受体活性的至少约1%,或表现出针对本文所述GIP受体的任何其它活性水平。
在某些实施方案中,稳定α螺旋结构的修饰是提供或引入分子内桥,包括例如共价分子内桥,例如本文所述的任何分子内桥。在某些实施方案中,共价分子内桥为内酰胺桥。这些实施方案类似物的内酰胺桥可为本文所述的内酰胺桥。参见例如“α螺旋结构的稳定化”章节下内酰胺桥的教导。例如,内酰胺桥可为i和i+4位置处的氨基酸侧链之间或在j和j+3位置处的氨基酸侧链之间的内酰胺桥,其中i为12、13、16、17、20或24,其中j为17。在某些实施方案中,内酰胺桥可在16和20位氨基酸之间,其中16和20位的氨基酸之一被Glu取代,且16和20位的另一氨基酸被Lys取代。
在备选实施方案中,稳定α螺旋结构的修饰是在类似物的16、20、21和24位引入一个、二个、三个或四个α,α-二取代氨基酸。在某些实施方案中,α,α-二取代氨基酸为AIB。在某些方面,α,α-二取代氨基酸(例如AIB)在20位,16位氨基酸被带正电荷的氨基酸例如式IV氨基酸取代,这如本文所述。式IV氨基酸可为高Lys、Lys、Orn或2,4-二氨基丁酸(Dab)。
在本发明的特定方面,1位氨基酸修饰为用缺乏咪唑侧链的氨基酸例如芳香族大氨基酸(例如Tyr)取代His。
在某些方面,胰高血糖素类似物包含27、28和29位中的一个、两个或全部位置的氨基酸修饰。例如,27位的Met可被脂肪族大氨基酸取代,所述氨基酸任选Leu;28位Asn可被脂肪族小氨基酸取代,所述氨基酸任选Ala;29位的Thr可被脂肪族小氨基酸取代,所述氨基酸任选Gly;或前述两个或三个组合。在特定实施方案中,胰高血糖素类似物包含27位的Leu、28位的Ala和29位的Gly或Thr。
在本发明某些实施方案中,胰高血糖素类似物包含在29位氨基酸C-末端处的1-21个氨基酸的突出端。例如,所述突出端可包含SEQ ID NO:95或96氨基酸序列。另外或作为备选,胰高血糖素类似物可包含突出端,所述突出端的1-6个氨基酸为带正电荷的氨基酸。带正电荷的氨基酸可为式IV氨基酸,其包括但不限于Lys、高Lys、Orn和Dab。
在某些实施方案中,胰高血糖素类似物如本文所述被酰化或烷化。例如,可用或不用间隔物在类似物的10或40位将所述酰基或烷基连接到胰高血糖素类似物,其如本文进一步所述。可另外或作为备选修饰类似物以包含亲水部分,其如本文进一步所述。另外,在某些实施方案中,所述类似物包含以下修饰中的任何一种或组合:
(a)用D-Ser、Ala、D-Ala、Gly、N-甲基-Ser、AIB、Val或α-氨基-N-丁酸取代2位Ser;
(b)用Trp、Lys、Orn、Glu、Phe或Val取代10位Tyr;
(c)酰基与10位的Lys连接;
(d)用Arg或Ile取代12位Lys;
(e)用Glu、Gln、高谷氨酸、高半胱磺酸、Thr、Gly或AIB取代16位Ser;
(f)用Gln取代17位Arg;
(g)用Ala、Ser、Thr或Gly取代18位Arg;
(h)用Ser、Thr、Ala、Lys、瓜氨酸、Arg、Orn或AIB取代20位Gln;
(i)用Glu、高谷氨酸、高半胱磺酸取代21位Asp;
(j)用Ile取代23位Val;
(k)用Asn、Ser、Thr、Ala或AIB取代24位Gln;和
(l)在2、5、9、10、11、12、13、14、15、16、8、19、20、21、24、27、28和29位中的任何位置的保守性取代。
在例示性实施方案中,具有GIP激动剂活性的胰高血糖素(SEQ ID NO:1)类似物包含以下修饰:
(a)赋予GIP激动剂活性的1位氨基酸修饰;
(b)i和i+4位置的氨基酸侧链之间或j和j+3位置的氨基酸侧链之间的内酰胺桥,其中i为12、13、16、17、20或24,且其中j为17;
(c)在27、28和29位中的一个、两个或全部位置的氨基酸修饰,例如在27和/或28位的氨基酸修饰;和
(d)1-9或1-6个另外的氨基酸修饰,例如1、2、3、4、5、6、7、8或9个另外的氨基酸修饰;
并且类似物对GIP受体激活的EC50为约10nM或更小。
这些实施方案的类似物的内酰胺桥可为本文所述的内酰胺桥。参见例如“α螺旋结构的稳定化”章节下的内酰胺桥教导。例如,内酰胺桥可在16和20位氨基酸之间,其中16和20位的氨基酸之一被Glu取代,且16和20位的另一氨基酸被Lys取代。
根据这些实施方案,类似物可包含例如SEQ ID NO:5-94中任意的氨基酸序列。
在其它例示性实施方案中,具有GIP激动剂活性的胰高血糖素(SEQ ID NO:1)类似物包含以下修饰:
(a)赋予GIP激动剂活性的1位氨基酸修饰;
(b)类似物的16、20、21和24位中的一个、二个、三个或全部氨基酸被α,α-二取代氨基酸取代;
(c)在27、28和29位中的一个、两个或全部位置的氨基酸修饰,例如在27和/或28位的氨基酸修饰;和
(d)1-9或1-6个另外的氨基酸修饰,例如1、2、3、4、5、6、7、8或9个另外的氨基酸修饰;
并且类似物对GIP受体激活的EC50为约10nM或更小。
这些实施方案的类似物的α,α-二取代氨基酸可为任何α,α-二取代氨基酸,其包括但不限于氨基异丁酸(AIB)、用选自甲基、乙基、丙基和正丁基的相同或不同基团或用环辛烷或环庚烷(例如1-氨基环辛烷-1-甲酸)二取代的氨基酸。在某些实施方案中,α,α-二取代氨基酸为AIB。在某些实施方案中,20位的氨基酸被α,α-二取代氨基酸例如AIB取代。
根据这些实施方案,类似物可包含例如SEQ ID NO:99-141、144-164、166-169和173-178的任何氨基酸序列。
在另外的其它实施方案中,具有GIP激动剂活性的胰高血糖素(SEQ ID NO:1)类似物包含以下修饰:
(a)赋予GIP激动剂活性的1位氨基酸修饰;
(b)用式IV氨基酸对16位Ser的氨基酸取代:
其中n为1-16或1-10或1-7或1-6或2-6,R1和R2各独立选自H、C1-C18烷基、(C1-C18烷基)OH、(C1-C18烷基)NH2、(C1-C18烷基)SH、(C0-C4烷基)(C3-C6)环烷基、(C0-C4烷基)(C2-C5杂环)、(C0-C4烷基)(C6-C10芳基)R7和(C1-C4烷基)(C3-C9杂芳基),其中R7为H或OH,且式IV氨基酸侧链包含游离氨基;
(c)用α,α-二取代氨基酸进行20位Gln的氨基酸取代;
(d)在27、28和29位中的一个、两个或全部位置的氨基酸修饰,例如在27和/或28位的氨基酸修饰;和
(e)1-9或1-6个另外的氨基酸修饰,例如1、2、3、4、5、6、7、8或9个另外的氨基酸修饰;
并且类似物对GIP受体激活的EC50为约10nM或更小。
这些实施方案类似物的式IV氨基酸可为任何氨基酸,例如其中n为1、2、3、4、5、6、7、8、9、10、11、12、13、14、15或16的式IV氨基酸。在某些实施方案中,n为2、3、4或5,在这种情况下,所述氨基酸分别为Dab、Orn、Lys或高Lys。
这些实施方案类似物的α,α-二取代氨基酸可为任何α,α-二取代氨基酸,其包括但不限于氨基异丁酸(AIB)、用选自甲基、乙基、丙基和正丁基的相同或不同基团或用环辛烷或环庚烷(例如1-氨基环辛烷-1-甲酸)二取代的氨基酸。在某些实施方案中,α,α-二取代氨基酸为AIB。
根据这些实施方案,类似物可包含例如SEQ ID NO:99-165的任何氨基酸序列。
在另外的其它示例性实施方案中,具有GIP激动剂活性的胰高血糖素(SEQ ID NO:1)类似物包含:
(a)赋予GIP激动剂活性的1位氨基酸修饰;和
(b)在29位氨基酸C-末端处的约1-约21个氨基酸的突出端,其中所述突出端的至少一个氨基酸被酰化或烷化;
其中类似物对GIP受体激活的EC50为约10nM或更小。
在某些实施方案中,酰化或烷化的氨基酸为式I、II或III氨基酸。在更特定实施方案中,式I氨基酸为Dab、Orn、Lys或高Lys。同样在某些实施方案中,约1-约21个氨基酸的突出端包含:GPSSGAPPPS(SEQ ID NO:95)或XGPSSGAPPPS(SEQ ID NO:96)氨基酸序列,其中X为任何氨基酸;或GPSSGAPPPK(SEQ ID NO:170)或XGPSSGAPPPK(SEQ ID NO:171)或XGPSSGAPPPSK(SEQ ID NO:172),其中X为Gly或脂肪族或非极性或稍带极性的小氨基酸。在某些实施方案中,所述约1-约21个氨基酸可包含相对于SEQ ID NO:95、96、170、171或172含有一个或多个保守性取代的序列。在某些实施方案中,酰化或烷化的氨基酸位于C-末端延伸的类似物的37、38、39、40、41、42或43位。在某些实施方案中,酰化或烷化氨基酸位于C-末端延伸的类似物的40位。
在某些实施方案中,具有GIP激动剂活性的类似物进一步包含27、28和29位中的一个、两个或所有位置的氨基酸修饰,例如27和/或28位的氨基酸修饰。
在以上任何例示性实施方案中,赋予GIP激动剂活性的1位氨基酸修饰可为用缺乏咪唑侧链的氨基酸取代His。1位的氨基酸修饰可例如为用芳香族大氨基酸取代His。在某些实施方案中,芳香族大氨基酸为本文所述的任何芳香族大氨基酸,包括例如Tyr。
同样关于以上例示性的实施方案,27、28和29位中的一个、两个或所有位置的氨基酸修饰可为本文所述这些位置的任何修饰。例如,27位的Met可被脂肪族大氨基酸取代,所述氨基酸任选Leu;28位的Asn可被脂肪族小氨基酸取代,所述氨基酸任选Ala;和/或29位的Thr可被脂肪族小氨基酸取代,所述氨基酸任选Gly。或者,类似物可包含27和/或28位的所述氨基酸修饰。
以上例示性实施方案类似物可进一步包含1-9或1-6个另外的添加的氨基酸修饰,例如1、2、3、4、5、6、7、8或9个另外的氨基酸修饰,例如,提高或降低针对GIP、GLP-1和胰高血糖素受体的以下任何活性的本文所述任何修饰:改进溶解性,改进作用时间或循环半衰期,延迟作用开始或提高稳定性。类似物可进一步包含例如:12位的氨基酸修饰,任选用Ile取代;和/或17和18位的氨基酸修饰,任选用Q取代17位并用A取代18位;和/或向C-末端添加GPSSGAPPPS(SEQ ID NO:95)或XGPSSGAPPPS(SEQ ID NO:96)或相对于SEQ ID NO:95或96含有一个或多个保守性取代的序列。类似物可包含一个或多个以下修饰:
(i)用D-Ser、Ala、D-Ala、Gly、N-甲基-Ser、AIB、Val或α-氨基-N-丁酸取代2位Ser;
(ii)用Trp、Lys、Orn、Glu、Phe或Val取代10位Tyr;
(iii)酰基与10位Lys连接;
(iv)用Arg取代12位Lys;
(v)用Glu、Gln、高谷氨酸、高半胱磺酸、Thr、Gly或AIB取代16位Ser;
(vi)用Gln取代17位Arg;
(vii)用Ala、Ser、Thr或Gly取代18位Arg;
(viii)用Ala、Ser、Thr、Lys、瓜氨酸、Arg、Orn或AIB取代20位Gln;
(ix)用Glu、高谷氨酸、高半胱磺酸取代21位Asp;
(x)用Ile取代23位Val;
(xi)用Asn、Ala、Ser、Thr或AIB取代24位Gln;和
(xii)在2、5、9、10、11、12、13、14、15、16、17、18、19、20、21、24、27、28和29位任何位置的保守性取代。
某些实施方案类似物包含(i)到(xii)项修饰的组合。作为备选或另外,类似物可包含3位的氨基酸修饰(例如用Glu对Gln的氨基酸取代),其中类似物具有小于1%的胰高血糖素针对胰高血糖素受体的活性。作为备选或另外,类似物可包含7位的氨基酸修饰(例如用缺乏羟基的氨基酸例如Abu或Ile取代Thr氨基酸),其中类似物具有小于约10%的GLP-1针对GLP-1受体的活性。
关于例示性实施方案,类似物可与亲水部分共价连接。在某些实施方案中,类似物在16、17、20、21、24、29、40位或C-末端的任何氨基酸位置共价连接亲水部分。在某些实施方案中,类似物包含C-末端突出端(例如SEQ ID NO:95氨基酸序列)和包含亲水部分的氨基酸添加,以便让亲水部分在40位与类似物共价连接。
在某些实施方案中,亲水部分与类似物的Lys、Cys、Orn、高半胱氨酸或乙酰基-苯丙氨酸共价连接。Lys、Cys、Orn、高半胱氨酸或乙酰基-苯丙氨酸可为对胰高血糖素序列(SEQ ID NO:1)为天然的氨基酸,或其可为代替SEQ ID NO:1的天然氨基酸的氨基酸。在某些实施方案中,其中亲水部分与Cys连接,与亲水部分的连接可包含以下结构:
关于包含亲水部分的类似物,所述亲水部分可为本文所述的任何亲水部分。参见例如“亲水部分连接”章节下的教导。在某些实施方案中,亲水部分为聚乙二醇(PEG)。某些实施方案中的PEG具有约1,000道尔顿-约40,000道尔顿例如约20,000道尔顿-约40,000道尔顿的分子量。
关于例示性实施方案,类似物可包含其中侧链与酰基或烷基(例如对天然存在的氨基酸为非天然的酰基或烷基)共价连接的经修饰的氨基酸。酰化或烷化类似物可为符合“酰化和烷化”章节所述的酰化或烷化肽。在某些实施方案中,酰基为C4-C30脂肪酰基,例如C10脂肪酰基或烷基、C12脂肪酰基或烷基、C14脂肪酰基或烷基、C16脂肪酰基或烷基、C18脂肪酰基或烷基、C20酰基或烷基或C22酰基或烷基。酰基或烷基可与类似物的任何氨基酸共价连接,所述氨基酸包括但不限于10或40位或C-末端的氨基酸。在某些实施方案中,类似物包含C-末端突出端(例如SEQ ID NO:95氨基酸序列)和包含酰基或烷基的氨基酸添加,以至于酰基或烷基与类似物在40位共价连接。在某些实施方案中,酰基或烷基共价连接到式I、II或III氨基酸的侧链,所述氨基酸例如Lys残基。可将酰基或烷基共价连接到对胰高血糖素序列(SEQ ID NO:1)为天然的氨基酸,或可连接到添加到SEQ ID NO:1序列的氨基酸或添加到后接SEQ ID NO:95(在N-或C-末端)的SEQ ID NO:1序列的氨基酸,或可连接到代替天然氨基酸的氨基酸,例如SEQ ID NO:1的10位Tyr。
在其中类似物包含酰基或烷基的以上例示性实施方案中,类似物可如本文所述经由间隔物连接到酰基或烷基。所述间隔物例如长度可为3-10个原子,并可为例如氨基酸(例如6-氨基己酸、本文所述任何氨基酸)、二肽(例如Ala-Ala、βAla-βAla、Leu-Leu、Pro-Pro、γGlu-γGlu)、三肽或亲水的或疏水双官能间隔物。在某些方面,间隔物和酰基或烷基总长为约14-约28个原子。
在又一些例示性实施方案中,具有GIP激动剂活性的胰高血糖素类似物包含SEQ ID NO:227、228、229或230中任何一种的氨基酸序列,所述氨基酸序列进一步包含以下修饰:
(a)任选赋予GIP激动剂活性的1位氨基酸修饰;
(b)在29位氨基酸C-末端处的约1-约21个氨基酸的突出端,其中突出端的至少一个氨基酸被酰化或烷化;和
(d)至多6个另外的氨基酸修饰;
其中类似物对GIP受体激活的EC50为约10nM或更小。
在某些方面,酰化或烷化的氨基酸为式I、II或III氨基酸。在更特定实施方案中,式I氨基酸为Dab、Orn、Lys或高Lys。同样在某些实施方案中,所述约1-约21个氨基酸包含以下氨基酸序列:GPSSGAPPPS(SEQ ID NO:95)或XGPSSGAPPPS(SEQ ID NO:96),其中X为任何氨基酸;或GPSSGAPPPK(SEQ ID NO:170)或XGPSSGAPPPK(SEQ ID NO:171)或XGPSSGAPPPSK(SEQ ID NO:172),其中X为Gly或脂肪族或非极性或稍带极性的小氨基酸。在某些实施方案中,所述约1-约21个氨基酸可包含相对于SEQ ID NO:95、96、170、171或172含有一个或多个保守性取代的序列。在某些实施方案中,酰化或烷化氨基酸位于C-末端延伸的类似物的37、38、39、40、41、42或43位。在某些实施方案中,酰化或烷化氨基酸位于C-末端延伸的类似物的40位。
在以上任何例示性实施方案中,赋予GIP激动剂活性的1位氨基酸可为缺乏咪唑侧链的氨基酸。1位氨基酸可例如为芳香族大氨基酸。在某些实施方案中,芳香族大氨基酸为本文所述的任何芳香族大氨基酸,包括例如Tyr。
以上例示性实施方案的类似物可进一步包含1-6个另外的氨基酸修饰,例如可为具有以下作用的任何本文所述修饰:提高或降低针对任何GIP受体、GLP-1受体和胰高血糖素受体的活性,改进溶解性,改进作用时间或循环半衰期,延迟作用开始或提高稳定性。
在某些方面,以上例示性实施方案所述胰高血糖素类似物包含另外的27、28和29位中的一个、两个或所有位置的氨基酸修饰。这些位置的修饰可为关于这些位置的本文所述任何修饰。例如,关于SEQ ID NO:227、228、229或230,27位可被脂肪族大氨基酸(例如Leu、Ile或正亮氨酸)或Met取代,28位可被另一脂肪族小氨基酸(例如Gly或Ala)或Asn取代,和/或29位可被另一脂肪族小氨基酸(例如Ala或Gly)或Thr取代。或者,类似物可包含27和/或28位的所述氨基酸修饰。
类似物可进一步包含一个或多个以下另外的修饰:
(i)2位氨基酸为D-Ser、Ala、D-Ala、Gly、N-甲基-Ser、AIB、Val或α-氨基-N-丁酸中的任何一个;
(ii)10位氨基酸为Tyr、Trp、Lys、Orn、Glu、Phe或Val;
(iii)酰基与10位Lys连接;
(iv)12位氨基酸为Ile、Lys或Arg;
(v)16位氨基酸为Ser、Glu、Gln、高谷氨酸、高半胱磺酸、Thr、Gly或AIB中的任何一个;
(vi)17位氨基酸为Gln或Arg;
(vii)18位氨基酸为Ala、Arg、Ser、Thr或Gly中的任何一个;
(viii)20位氨基酸为Ala、Ser、Thr、Lys、瓜氨酸、Arg、Orn或AIB或另一α,α-二取代氨基酸中的任何一个;
(ix)21位氨基酸为Glu、Asp、高谷氨酸、高半胱磺酸中的任何一个;
(x)23位氨基酸为Val或Ile;
(xi)24位氨基酸为Gln、Asn、Ala、Ser、Thr或AIB中的任何一个;和
(xii)在2、5、9、10、11、12、13、14、15、16、17、18、19、20、21、24、27、28和29位中的任何位置的一个或多个保守性取代。
在某些实施方案中类似物包含(i)到(xii)的修饰组合。作为备选或另外,类似物可包含3位氨基酸修饰(例如用Glu对Gln的氨基酸取代),其中所述类似物具有小于1%的胰高血糖素针对胰高血糖素受体的活性。作为备选或另外,类似物可包含7位氨基酸修饰(例如用缺乏羟基的氨基酸例如Abu或Ile取代Thr氨基酸),其中所述类似物具有小于约10%的GLP-1针对GLP-1受体的活性。
关于例示性实施方案,类似物可与亲水部分共价连接。在某些实施方案中,类似物在16、17、20、21、24、29、40位或C-末端的任何氨基酸位置与亲水部分共价连接。在某些实施方案中,类似物包含在24位与类似物共价连接的亲水部分。
在某些实施方案中,亲水部分与类似物的Lys、Cys、Orn、高半胱氨酸或乙酰基-苯丙氨酸共价连接。Lys、Cys、Orn、高半胱氨酸或乙酰基-苯丙氨酸可为对SEQ ID NO:1、227、228、229或230天然的氨基酸,或其可为取代的氨基酸。在其中亲水部分与Cys连接的某些实施方案中,连接可包含以下结构:
关于包含亲水部分的类似物,亲水部分可为本文所述的任何亲水部分。参见例如“亲水部分连接”章节下的教导。在某些实施方案中,亲水部分为聚乙二醇(PEG)。某些实施方案中的PEG具有约1,000道尔顿-约40,000道尔顿例如约20,000道尔顿-约40,000道尔顿的分子量。
关于例示性实施方案,类似物可包含其中侧链与酰基或烷基共价连接的C-末端突出端内的经修饰的氨基酸。酰化或烷化类似物可为符合“酰化和烷化”章节所述的酰化或烷化肽。在某些实施方案中,酰基为C4-C30脂肪酰基,例如C10脂肪酰基或烷基、C12脂肪酰基或烷基、C14脂肪酰基或烷基、C16脂肪酰基或烷基、C18脂肪酰基或烷基、C20酰基或烷基或C22酰基或烷基。酰基或烷基可与类似物的任何氨基酸共价连接,所述氨基酸包括但不限于10或40位或C-末端的氨基酸。在某些实施方案中,酰基或烷基与式I、II或III氨基酸的侧链共价连接,所述氨基酸例如Lys残基。可将酰基或烷基共价连接到对SEQ ID NO:1、227、228、229或230为天然的氨基酸,或可连接到取代的氨基酸。可将酰基或烷基共价连接到对SEQ ID NO:95、96、171或172为天然的氨基酸,或可连接到取代的氨基酸。
在其中类似物包含酰基或烷基的以上例示性实施方案中,类似物可如本文所述经由间隔物与酰基或烷基连接。所述间隔物例如长度可为3-10个原子,并可为例如氨基酸(例如6-氨基己酸、本文所述任何氨基酸)、二肽(例如Ala-Ala、βAla-βAla、Leu-Leu、Pro-Pro、γGlu-yGlu)、三肽或亲水的或疏水双官能间隔物。在某些方面,间隔物和酰基或烷基总长为约14-约28个原子。
在某些极为具体的实施方案中,本发明类似物包含选自SEQ ID NO:99-141、144-164、166、192-207、209-221和223或选自SEQ ID NO:167-169、173-178和225的氨基酸序列。
另外,本发明类似物的特定实例包括但不限于表1-3所引用的任何类似物。
在又一些例示性实施方案中,具有GIP激动剂活性的胰高血糖素类似物包含酰基或烷基(例如对天然存在的氨基酸为非天然的酰基或烷基),其中酰基或烷基与间隔物连接,其中(i)间隔物与类似物10位氨基酸的侧链连接;或(ii)所述类似物包含在29位氨基酸的C-末端处的1-21个氨基酸的突出端,所述间隔物与对应于关于SEQ ID NO:1的37-43位之一的位置的氨基酸的侧链连接,其中类似物对GIP受体激活的EC50为约10nM或更小。
在所述实施方案中,类似物可包含含以下修饰的SEQ ID NO:1氨基酸序列:(i)赋予GIP激动剂活性的1位氨基酸修饰;(ii)27、28和29位中的一个、两个或所有位置的氨基酸修饰;(iii)至少以下之一:
(A)类似物包含i和i+4位置的氨基酸侧链之间或j和j+3位置的氨基酸侧链之间的内酰胺桥,其中i为12、13、16、17、20或24,且其中j为17;
(B)类似物的16、20、21和24位氨基酸中的一个、二个、三个或全部被α,α-二取代氨基酸取代;或
(C)类似物包含(i)用式IV氨基酸取代16位的Ser氨基酸:
其中n为1-7,其中R1和R2各独立选自H、C1-C18烷基、(C1-C18烷基)OH、(C1-C18烷基)NH2、(C1-C18烷基)SH、(C0-C4烷基)(C3-C6)环烷基、(C0-C4烷基)(C2-C5杂环)、(C0-C4烷基)(C6-C10芳基)R7和(C1-C4烷基)(C3-C9杂芳基),其中R7为H或OH,且式IV氨基酸侧链包含游离氨基;和(ii)用α,α-二取代氨基酸在20位的Gln进行氨基酸取代;
和(iv)至多6个另外的氨基酸修饰。
这些实施方案类似物的α,α-二取代氨基酸可为任何α,α-二取代氨基酸,其包括但不限于氨基异丁酸(AIB)、被选自甲基、乙基、丙基和正丁基的相同或不同基团或被环辛烷或环庚烷(例如1-氨基环辛烷-1-甲酸)二取代的氨基酸。在某些实施方案中,α,α-二取代氨基酸为AIB。
这些实施方案类似物的式IV氨基酸可为任何氨基酸,例如其中n为1、2、3、4、5、6、7、8、9、10、11、12、13、14、15或16的式IV氨基酸。在某些实施方案中,n为2、3、4或5,在这种情况下,所述氨基酸分别为Dab、Orn、Lys或高Lys。
在以上任何例示性实施方案中,赋予GIP激动剂活性的1位氨基酸修饰可为用缺乏咪唑侧链的氨基酸取代His。1位的氨基酸修饰可例如为用芳香族大氨基酸取代His。在某些实施方案中,芳香族大氨基酸为本文所述的任何芳香族大氨基酸,包括例如Tyr。
同样关于以上例示性的实施方案,27、28和29位中的一个、两个或所有位置的氨基酸修饰可为本文所述这些位置的任何修饰。例如,27位的Met可被脂肪族大氨基酸取代,所述大氨基酸任选Leu;28位的Asn可被脂肪族小氨基酸取代,所述小氨基酸任选Ala;和/或29位的Thr可被脂肪族小氨基酸取代,所述小氨基酸任选Gly。或者,所述类似物可包含27和/或28位的所述氨基酸修饰。
以上例示性实施方案的类似物可进一步包含1-9或1-6个另外的添加氨基酸修饰,例如1、2、3、4、5、6、7、8或9个另外的氨基酸修饰,例如,具有以下作用的本文所述任何修饰:提高或降低任何GIP受体、GLP-1受体和胰高血糖素受体的活性,改进溶解性,改进作用时间或循环半衰期,延迟作用开始或提高稳定性。类似物可进一步包含例如:12位的氨基酸修饰,任选用Ile取代;和/或17和18位的氨基酸修饰,任选用Q取代17位并用A取代18位;和/或添加GPSSGAPPPS(SEQ ID NO:95)或XGPSSGAPPPS(SEQ ID NO:96)或含有一个或多个关于SEQ ID NO:95或96保守性取代的序列至C-末端。类似物可包含一个或多个以下修饰:
(i)用D-Ser、Ala、D-Ala、Gly、N-甲基-Ser、AIB、Val或α-氨基-N-丁酸取代2位Ser;
(ii)用Trp、Lys、Orn、Glu、Phe或Val取代10位Tyr;
(iii)酰基与10位Lys连接;
(iv)用Arg取代12位Lys;
(v)用Glu、Gln、高谷氨酸、高半胱磺酸、Thr、Gly、Lys或AIB取代16位Ser;
(vi)用Gln取代17位Arg;
(vii)用Ala、Ser、Thr或Gly取代18位Arg;
(viii)用Ala、Ser、Thr、Lys、瓜氨酸、Arg、Orn或AIB取代20位Gln;
(ix)用Glu、高谷氨酸、高半胱磺酸取代21位Asp;
(x)用Ile取代23位Val;
(xi)用Asn、Ala、Ser、Thr或AIB取代24位Gln;和
(xii)在2、5、9、10、11、12、13、14、15、16、17、18、19、20、21、24、27、28和29位中的任何位置的保守性取代。
在某些实施方案中,类似物包含(i)到(xii)修饰的组合。作为备选或另外,类似物可包含3位氨基酸修饰(例如用Glu取代氨基酸Gln),其中所述类似物具有小于1%的胰高血糖素针对胰高血糖素受体的活性。作为备选或另外,类似物可包含7位氨基酸修饰(例如用缺乏羟基的氨基酸例如Abu或Ile取代Thr氨基酸)、位于27或28位氨基酸的C-末端的氨基酸缺失(产生27-或28-个氨基酸的肽)或其组合,其中所述类似物具有小于约10%的GLP-1针对GLP-1受体的活性。
关于例示性实施方案,类似物可与亲水部分共价连接。在某些实施方案中,类似物在16、17、20、21、24、29、40位或C-末端的任何氨基酸位置与亲水部分共价连接。在某些实施方案中,类似物包含C-末端突出端(例如SEQ ID NO:95的氨基酸序列)和包含亲水部分的氨基酸添加,以便让亲水部分与类似物在40位共价连接。
在某些实施方案中,亲水部分与类似物的Lys、Cys、Orn、高半胱氨酸或乙酰基-苯丙氨酸共价连接。Lys、Cys、Orn、高半胱氨酸或乙酰基-苯丙氨酸可为对胰高血糖素序列(SEQ ID NO:1)天然的氨基酸,或其可为取代SEQ ID NO:1的天然氨基酸的氨基酸。在其中亲水部分与Cys连接的某些实施方案中,与亲水部分的连接可包含以下结构:
关于包含亲水部分的类似物,亲水部分可为本文所述的任何亲水部分。参见例如“亲水部分连接”章节下的教导。在某些实施方案中,亲水部分为聚乙二醇(PEG)。某些实施方案中的PEG具有约1,000道尔顿-约40,000道尔顿例如约20,000道尔顿-约40,000道尔顿的分子量。
在其中类似物包含酰基或烷基的例示性实施方案中,所述酰基或烷基经由间隔物与类似物连接,所述间隔物可为本文所述的任何间隔物。所述间隔物例如长度可为3-10个原子,并可为例如氨基酸(例如6-氨基己酸、本文所述任何氨基酸)、二肽(例如Ala-Ala、3Ala-3Ala、Leu-Leu、Pro-Pro、γGlu-γGlu)、三肽或亲水的或疏水的双官能间隔物。在某些方面,间隔物和酰基或烷基总长为约14-约28个原子。
所述酰基或烷基为如本文所述的任何酰基或烷基,例如对天然存在的氨基酸为非天然的酰基或烷基。在某些实施方案中,酰基或烷基为C4-C30脂肪酰基,例如C10脂肪酰基或烷基、C12脂肪酰基或烷基、C14脂肪酰基或烷基、C16脂肪酰基或烷基、C18脂肪酰基或烷基、C20酰基或烷基或C22酰基或烷基或C4-C30烷基。在特定实施方案中,酰基为C12-C18脂肪酰基(例如C14或C16脂肪酰基)。
在某些实施方案中,所述在类似物的29位氨基酸C-末端处的约1-约21个氨基酸的突出端包含以下氨基酸序列:GPSSGAPPPS(SEQ ID NO:95)或XGPSSGAPPPS(SEQ ID NO:96),其中X为任何氨基酸;或GPSSGAPPPK(SEQ ID NO:170)或XGPSSGAPPPK(SEQ ID NO:171)或XGPSSGAPPPSK(SEQ ID NO:172),其中X为Gly或脂肪族或非极性或稍带极性的小氨基酸。在某些实施方案中,所述约1-约21个氨基酸可包含相对于SEQ ID NO:95、96、170、171或172含有一个或多个保守性取代的序列。在某些实施方案中,酰化或烷化氨基酸位于C-末端延伸的类似物的37、38、39、40、41、42或43位。在某些实施方案中,酰化或烷化氨基酸位于C-末端延伸的类似物的40位。
药物组合物和治疗方法
在某些方面,本发明提供包含本文公开的任何新型胰高血糖素肽和可药用稀释剂、载体或赋形剂的药物组合物,所述新型胰高血糖素肽优选无菌并优选以至少90%、91%、92%、93%、94%、95%、96%、97%、98%或99%的纯度水平。所述组合物可含有至少A浓度的胰高血糖素肽,其中A为0.001mg/ml、0.01mg/ml、0.1mg/ml、0.5mg/ml、1mg/ml、2mg/ml、3mg/ml、4mg/ml、5mg/ml、6mg/ml、7mg/ml、8mg/ml、9mg/ml、10mg/ml、11mg/ml、12mg/ml、13mg/ml、14mg/ml、15mg/ml、16mg/ml、17mg/ml、18mg/ml、19mg/ml、20mg/ml、21mg/ml、22mg/ml、23mg/ml、24mg/ml、25mg/ml或更高。在其它实施方案中,所述组合物可含有至多B浓度的胰高血糖素肽,其中B为30mg/ml、25mg/ml、24mg/ml、23,mg/ml、22mg/ml、21mg/ml、20mg/ml、19mg/ml、18mg/ml、17mg/ml、16mg/ml、15mg/ml、14mg/ml、13mg/ml、12mg/ml、11mg/ml 10mg/ml、9mg/ml、8mg/ml、7mg/ml、6mg/ml、5mg/ml、4mg/ml、3mg/ml、2mg/ml、1mg/ml或0.1mg/ml。在某些实施方案中,组合物可含有A-B mg/ml浓度范围的胰高血糖素肽,例如0.001-30.0mg/ml。在一个实施方案中,药物组合物包含无菌水溶液,并任选储存在不同容器中。可在某些实施方案中使用本发明化合物,以制备即用于注射的预配溶液剂。在其它实施方案中,药物组合物包含冻干粉。药物组合物可进一步包装为药盒的部分,所述药盒包括用于将组合物给予患者的一次性器具。容器或药盒可标明储存在环境室温或冷冻温度。
可用任何标准给药途径将胰高血糖素肽给予患者,所述标准给药途径包括胃肠外(例如静脉内、腹膜内、皮下或肌肉内)、鞘内、经皮、直肠、经口、经鼻或通过吸入。在一个实施方案中,皮下或肌肉内给予组合物。
在一个实施方案中,提供含将胰高血糖素组合物给予患者的器具的药盒,所述器具例如注射器针头、注射笔、喷射注射器或其它无针头注射器。作为备选或另外地,药盒可包括一种或多种容器,例如小瓶、试管、瓶子、单室或多室预充式注射器、药筒、输液泵(外置式或植入式)、喷射注射器、预充式注射笔等,任选含有呈冻干形式或处于水溶液中的胰高血糖素肽。优选药盒亦包括使用说明。在某些实施方案中,药盒器具为气雾剂分配器,其中将组合物预包装在气雾剂装置中。在另一实施方案中,药盒包含注射器和针头,在一个实施方案中,将无菌胰高血糖素组合物预包装在注射器中。
根据一个实施方案,提供药物组合物,其中所述组合物包含本发明的具有GIP活性的胰高血糖素类似物或其可药用盐和可药用载体。药物组合物可包含任何可药用成分,包括例如:酸化剂、添加剂、吸附剂、气溶胶喷射剂、空气清新剂、碱化剂、抗结块剂、抗凝血剂、抗微生物防腐剂、抗氧化剂、消毒剂、基料、粘合剂、缓冲剂、螯合剂、涂层剂、着色剂、干燥剂、去污剂、稀释剂、消毒剂、分解剂、分散剂、增溶剂、染料、润肤剂、乳化剂、乳液稳定剂、填充剂、薄膜形成剂、鲜味剂、矫味剂、助流剂、胶凝剂、粒化剂、保湿剂、润滑剂、粘膜粘着剂、软膏基料、软膏、油性溶媒、有机碱、锭剂基料、色素、增塑剂、抛光剂、防腐剂、掩蔽剂、皮肤渗透剂、增溶剂、溶剂、稳定剂、栓剂基料、表面活性剂、去污剂、助悬剂、甜味剂、治疗剂、增稠剂、张度剂、毒性剂、增粘剂、吸水剂、与水混溶助溶剂、水软化剂或湿润剂。
在某些实施方案中,药物组合物包含以下组分中的任何一种或组合:阿拉伯树胶、乙酰氨基磺酸钾、柠檬酸乙酰三丁酯、柠檬酸乙酰三乙酯、琼脂、白蛋白、醇、无水醇、变性酒精、稀释酒精、油桐酸、藻酸、脂肪族聚酯、氧化铝、氢氧化铝、硬脂酸铝、支链淀粉、α-直链淀粉、抗坏血酸、抗坏血酸棕榈酸酯、天冬氨酰苯甲氨酸甲酯、注射用抑菌水、膨润土、膨润土岩浆、苯扎氯铵、苄索氯铵、苯甲酸、苯甲醇、苯甲酸苄酯、溴硝醇、丁基羟基茴香醚、丁羟甲苯、对羟基苯甲酸丁酯、丁基对羟基苯甲酸钠、藻酸钙、抗坏血酸钙、碳酸钙、环己基氨基磺酸钙、无水磷酸氢钙、脱水磷酸氢钙、磷酸三钙、丙酸钙、硅酸钙、山梨酸钙、硬脂酸钙、硫酸钙、硫酸钙半水合物、芥花籽油、卡波姆(carbomer)、二氧化碳、羧甲基纤维素钙、羧甲基纤维素钠、β-胡萝卜素、角叉胶、蓖麻油、氢化蓖麻油、阳离子乳化钠、乙酸纤维素、乙酸邻苯二甲酸纤维素、乙基纤维素、微晶纤维素、粉状纤维素、硅化微晶纤维素、羧甲基纤维素钠、鲸脂醇、溴化十六烷基三甲铵、鲸蜡醇、氯己定、氯丁醇、氯甲酚、胆固醇、乙酸氯己定、葡萄糖酸氯己定、盐酸氯己定、氟利昂(HCFC)、一氯二氟甲烷、含氯氟烃(CFC)、氯苯氧基乙醇、氯二甲苯酚、淀粉糖浆干粉、无水柠檬酸、柠檬酸一水合物、可可油、着色剂、玉米油、棉籽油、甲酚、间甲酚、邻甲酚、对甲酚、交联甲羧纤维素钠、交联聚乙烯吡咯烷酮、环拉酸、环糊精、葡萄糖结合剂,糊精、右旋糖、无水右旋糖、双咪唑烷基脲、邻苯二甲酸二丁酯、癸二酸二丁酯、二乙醇胺,邻苯二甲酸二乙酯、二氟乙烷(HFC)、二甲基-β-环糊精、环糊精型化合物例如二甲基醚、邻苯二甲酸二甲酯、依地酸二钾、依地酸二钠、磷酸氢二钠、多库酯钙、多库酯钾、多库酯钠、没食子酸十二酯、十二烷基三甲基溴化铵、依地酸钙二钠、乙二胺四乙酸、乙葡胺、乙醇、乙基纤维素、没食子酸乙酯、月桂酸乙酯、乙基麦芽酚、油酸乙酯、对羟甲基苯甲酸乙酯、对羟甲基苯甲酸钾、乙基对羟甲基苯甲酸钠、乙基香兰素、果糖、液体果糖、磨碎的果糖、无热原果糖、粉状果糖、富马酸、白明胶、葡萄糖、液体葡萄糖、饱和植物脂肪酸的甘油酯混合物、甘油、山嵛酸甘油酯、单油酸甘油酯、单硬脂酸甘油酯、自乳化单硬脂酸甘油酯、硬脂酸棕榈酸甘油酯、甘氨酸、乙二醇、四乙二醇醚、瓜尔胶、七氟丙烷(HFC)、十六基三甲基溴化铵、高果糖糖浆、人血清白蛋白、烃(HC)、烯盐酸、II型氢化植物油、羟基乙基纤维素、2-羟基乙基-β-环糊精、羟基丙基纤维素、低取代羟基丙基纤维素、2-羟基丙基-β-环糊精、羟丙基甲基纤维素、羟丙基甲基纤维素邻苯二甲酸酯、咪脲、靛蓝、离子交换剂、氧化铁、异丙醇、豆蔻酸异丙酯、棕榈酸异丙酯、等渗盐水、高岭土、乳酸、乳糖醇、乳糖、羊毛脂、羊毛脂醇、无水羊毛脂、卵磷脂、硅酸镁铝、碳酸镁、正常碳酸镁、无水碳酸镁、碱式碳酸镁、氢氧化镁、月桂基硫酸镁、氧化镁、硅酸镁、硬脂酸镁、三硅酸镁、无水三硅酸镁、苹果酸、麦芽、麦芽糖醇、麦芽糖醇溶液、麦芽糊精、麦芽酚、麦芽糖、甘露醇、中链甘油三酯、甲葡胺、薄荷醇、甲基纤维素、甲基丙烯酸甲酯、油酸甲酯、对羟甲基苯甲酸甲酯、甲基对羟甲基苯甲酸钾、甲基对羟甲基苯甲酸钠、微晶纤维素和羧甲基纤维素钠、矿物油、轻矿物油、矿物油和羊毛脂醇、油、橄榄油、单乙醇胺、蒙脱石、没食子酸辛酯、油酸、棕榈酸、石蜡、花生油、矿脂、矿脂和羊毛脂醇、药用釉料、苯酚、液化苯酚、苯氧乙醇、苯氧丙醇、苯基乙醇、乙酸苯汞、硼酸苯汞、硝酸苯汞、波拉克林(polacrilin)、波拉克林钾、泊洛沙姆(poloxamer)、聚右旋糖、聚乙二醇、聚环氧乙烷、聚丙烯酸酯、聚乙烯-聚氧丙烯-嵌段聚合物、聚甲基丙烯酸、聚氧乙烯烷基醚、聚氧乙烯蓖麻油衍生物、聚氧乙烯山梨醇脂肪酸酯、硬脂酸聚氧乙烯酯、聚乙烯醇、聚乙烯吡咯烷酮、藻酸钾、苯甲酸钾、碳酸氢钾、硫酸氢钾、氯化钾、柠檬酸钾、无水柠檬酸钾、磷酸氢钾、偏亚硫酸氢钾、磷酸二氢钾、丙酸钾、山梨酸钾、聚乙烯吡咯酮、丙醇、丙酸、碳酸丙烯、丙二醇、丙二醇藻酸、没食子酸丙酯、对羟甲基苯甲酸丙酯、丙基对羟甲基苯甲酸钾、丙基对羟甲基苯甲酸钠、硫酸精蛋白、油菜籽油、Ringer氏溶液、糖精、糖精铵、糖精钙、糖精钠、红花油、皂石、血清蛋白质、芝麻油、硅胶、二氧化硅胶、藻酸钠、抗坏血酸钠、苯甲酸钠、碳酸氢钠、硫酸氢钠、氯化钠、无水柠檬酸钠、脱水柠檬酸钠、氯化钠、甜精钠、依地酸钠、十二烷基硫酸钠、月桂基硫酸钠、偏亚硫酸氢钠、磷酸氢二钠、磷酸二氢钠、磷酸三钠、无水丙酸钠、丙酸钠、山梨酸钠、淀粉羟基乙酸钠、硬脂酰醇富马酸钠、亚硫酸钠、山梨酸、山梨坦酯(山梨坦脂肪酯)、山梨醇、山梨醇溶液70%、大豆油、鲸蜡、淀粉、玉米淀粉、土豆淀粉、预胶化淀粉、灭菌玉米淀粉、硬脂酸、纯化的硬脂酸、硬脂醇、蔗糖、糖、可压缩糖、糖粉、糖球、转化糖、蔗糖-转化糖聚合物、晚霞黄FCF、合成石蜡、滑石、酒石酸、酒石黄、四氟乙烷(HFC)、梧桐油、硫汞撒、二氧化钛、α生育酚、乙酸生育酚、琥珀酸α生育酚、β-生育酚、δ-生育酚、γ-生育酚、西黄嗜胶、醋精、柠檬酸三丁酯、三乙醇胺、柠檬酸三乙酯、三甲基-β-环糊精、三甲基十四烷基溴化铵、tris缓冲液、依地酸三钠、香兰素、I型氢化植物油、水、软水、硬水、无二氧化碳水、无热原水、注射用水、吸入用无菌水、无菌注射用水、冲洗用无菌水、蜡、阴离子乳化钠、巴西棕榈蜡、阳离子乳化钠、鲸酯蜡、微晶蜡、非离子乳化钠、栓剂蜡、白蜡、黄蜡、白矿脂、羊毛脂、黄原胶、木糖醇、玉米蛋白、丙酸锌、锌盐、硬脂酸锌或Handbook of Pharmaceutical Excipients第三版,A.H.Kibbe(Pharmaceutical Press,London,UK,2000)中的任何赋形剂,该书以其整体在此引作参考。Remington’s Pharmaceutical Sciences第16版,E.W.Martin(Mack Publishing Co.,Easton,Pa.,1980)(以其整体在此引作参考)揭示了在调配可药用组合物中所用的各种组分及制备可药用组合物的已知技术。除了与药物组合物不相容的常规试剂外,还涵盖其在药物组合物中的应用。亦可将补充性的活性成分纳入所述组合物中。
可将本文公开的药物制剂设计为短效、快速释放、长效或持续释放,其如以下所述。药物制剂亦可调配为用于即释、控释或用与慢释。本发明组合物可进一步包含例如胶囊或脂质体或某些其它微囊形式,或可以以延释形式给予来提供延长的储存时间和/或递送效果。所公开的药物制剂可按照任何给药方案来给予,所述给药方案包括例如每日给药(每天1次、每天2次、每天3次、每天4次、每天5次、每天6次)、每两天一次、每三天一次、每四天一次、每五天一次、每六天一次、每周一次、每两周一次、每三周一次、每月一次或每两月一次给药。
在某些实施方案中,前述组分可以以任何浓度存在于药物组合物中,例如至少A,其中A为0.0001%w/v、0.001%w/v、0.01%w/v、0.1%w/v、1%w/v、2%w/v、5%w/v、10%w/v、20%w/v、30%w/v、40%w/v、50%w/v、60%w/v、70%w/v、80%w/v或90%w/v。在某些实施方案中,前述组分可以任何浓度存在于药物组合物中,例如至多B,其中B为90%w/v、80%w/v、70%w/v、60%w/v、50%w/v、40%w/v、30%w/v、20%w/v、10%w/v、5%w/v、2%w/v、1%w/v、0.1%w/v、0.001%w/v或0.0001%。在其它实施方案中,前述组分可以以任何浓度范围存在于药物组合物中,例如从约A到约B。在某些实施方案中,A为0.0001%,而B为90%。
可调配药物组合物以获得生理上相容的pH。在某些实施方案中,药物组合物的pH可为至少5、至少5.5、至少6、至少6.5、至少7、至少7.5、至少8、至少8.5、至少9、至少9.5、至少10或至少10.5,至多且包括pH 11,这视制剂和给药途径而定。在某些实施方案中,药物组合物可包含缓冲剂以获得生理相容的pH。缓冲剂可包括能够在所需pH处缓冲的任何化合物,例如磷酸盐缓冲液(例如PBS)、三乙醇胺、Tris、N,N-二(羟乙基)甘氨酸、TAPS、N-(羟甲基)甲基甘氨酸、HEPES、TES、MOPS、PIPES、甲次砷酸盐、MES和其它缓冲剂。在某些实施方案中,缓冲液浓度为至少0.5mM、至少1mM、至少5mM、至少10mM、至少20mM、至少30mM、至少40mM、至少50mM、至少60mM、至少70mM、至少80mM、至少90mM、至少100mM、至少120mM、至少150mM或至少200mM。在某些实施方案中,缓冲液浓度不大于300mM(例如至多200mM、至多100mM、至多90mM、至多80mM、至多70mM、至多60mM、至多50mM、至多40mM、至多30mM、至多20mM、至多10mM、至多5mM、至多1mM)。
可将为GIP/GLP-1共激动剂、胰高血糖素/GIP共激动剂和胰高血糖素/GIP/GLP-1三-激动剂的胰高血糖素肽用于先前业已阐述它们各自的活性为有用的任何适应症中。例如,胰高血糖素活性可提高葡萄糖水平,用于缓冲胰岛素的作用或在放射检查期间降低胃肠动力。GLP-1活性可降低葡萄糖水平,这种活性用于治疗高血糖症,例如糖尿病。GLP-1活性亦可例如通过降低食欲来诱导减重或防止增重。GIP活性亦可降低葡萄糖水平,这种活性可用于治疗高血糖症,例如糖尿病。
GIP/GLP-1共激动剂和胰高血糖素/GIP/GLP-1三-激动剂用于诱导减重或防止增重以及用于治疗高血糖症包括糖尿病尤其有利。本文公开的体内数据证明,GIP激动剂活性与GLP-1激动剂活性组合对减轻体重比单独GLP-1产生的效果更好。为了减少日常摄食和体重并提高胰岛素敏感性及能量消耗,拮抗GIP是可取的,鉴于本领域的这一教导,上述活性尤其出乎意料。(Irwin等,Diabetologia 50:1532-1540(2007);和Althage等,J Biol Chem,2008年4月17日的电子出版物)。
本文公开的体内数据亦证明GIP激动剂活性与GLP-1激动剂活性联合降低葡萄糖水平。
因此,预期将本文所述胰高血糖素肽用于降低或维持体重,或用于治疗高血糖症,或用于降低血糖水平,或用于使血糖水平正常化和/或稳定血糖水平。
在某些实施方案中,提供治疗高血糖症的方法或减少增重或诱导减重的方法,所述方法包括给予有效量的包含本发明胰高血糖素肽的水溶液。在另外的实施方案中,提供治疗糖尿病的方法,所述方法包括同时给予常规剂量或降低剂量的胰岛素和本发明胰高血糖素肽。亦提供用本发明胰高血糖素肽而不同时给予胰岛素的治疗糖尿病的方法。
预期所述用于治疗高血糖症的方法用于多种类型的高血糖症,包括糖尿病、I型糖尿病、II型糖尿病或妊娠期糖尿病、胰岛素依赖性或非胰岛素依赖性糖尿病,并降低包括肾病、视网膜病和血管病在内的糖尿病并发症。
预期将用于降低食欲或促进减重的方法用于减轻体重、防止增重或用于治疗各种原因的肥胖症,包括药物诱导的肥胖症,并用于减少与肥胖症有关的并发症,所述并发症包括血管病(冠状动脉疾病、中风、外周性血管病、缺血-再灌注等)、高血压、II型糖尿病发作、血脂过多症和肌骨病。
亦称为代谢综合征X、胰岛素抗性综合征或雷文综合征(Reaven’s syndrome)的代谢综合征,是影响超过5千万美国人的疾病。代谢综合征的特征通常为以下风险因子中的至少三个或更多个的聚类:(1)腹部肥胖症(在腹部内或周围过多的脂肪组织);(2)动脉粥样硬化异常脂血症(atherogenic dyslipidemia)(血液脂肪病,包括增加动脉壁斑块聚积的高甘油三酯、低HDL胆固醇和高LDL胆固醇);(3)升高血压;(4)胰岛素抗性或葡萄糖耐受;(5)血栓前状态(prothrombotic state)(例如血液中高纤维蛋白原或纤溶酶原激活物抑制剂-1);和(6)前炎性状态(pro-inflammatory state)(例如升高血液中的C-活性蛋白)。其它风险因子可包括衰老、激素失衡和遗传易感性。
代谢综合征与冠心病及与血管斑块聚积有关的其它疾病风险的增加有关,所述其它疾病例如中风和外周性血管病(又称为动脉粥样硬化心血管病(ASCVD))。代谢综合征患者可从其早期阶段的胰岛素抵抗状态发展到具有进一步增加的ASCVD风险的充分发展的II型糖尿病。并非意欲依附任何特定理论,但胰岛素抗性、代谢综合征和血管病之间的关系可涉及一种或多种同时发生的致病机制,包括损害胰岛素-刺激的血管舒张、由于增加氧化应激而产生的胰岛素抗性相关的NO可利用性降低和源自脂肪细胞的激素例如脂连蛋白异常(Lteif和Mather,Can.J.Cardiol.20(suppl.B):66B-76B(2004))。
根据2001年的美国国家胆固醇教育计划成人治疗组指南(ATP III),同一个体的任何以下三个特征满足代谢综合征标准:(a)腹部肥胖(男性腰围超过102cm,女性超过88cm);(b)血清甘油三酯(150mg/dl或以上);(c)HDL胆固醇(男性中40mg/dl或更低,女性中50mg/dl或更低);(d)血压(130/85或更高);和(e)禁食血糖(110mg/dl或以上)。根据世界卫生组织(WHO),具有高胰岛素水平(禁食血糖升高或仅餐后葡萄糖升高)和至少以下两条标准的个体满足代谢综合征的标准:(a)腹部肥胖(腰臀比率大于0.9,身体质量指数至少30kg/m2或腰围测量值超过37英寸);(b)胆固醇组显示至少150mg/dl的甘油三酯水平或低于35mg/dl的HDL胆固醇;(c)140/90或更高的血压或正在治疗高血压)。(Mathur,Ruchi,“Metabolic Syndrome(代谢综合征)”Shiel,Jr.,William C.编辑,MedicineNet.com,2009年5月11日)。
为本文目的,如果个体满足2001年美国国家胆固醇教育计划成人治疗组指南或WHO提出的标准中的任一个标准或两个标准都满足,那么认为该个体罹患代谢综合征。
不依附任何特定理论,本文所述胰高血糖素肽用于治疗代谢综合征。因此,本发明提供在受试者中预防或治疗代谢综合征或降低其一个、二个、三个或更多个风险因子的方法,所述方法包括给予受试者有效防止或治疗代谢综合征或其风险因子的量的本文所述胰高血糖素肽。
非酒精性脂肪肝病(NAFLD)指从单纯脂肪肝(脂肪变性)到非酒精性脂肪性肝炎(NASH)到肝硬化(不可逆的晚期肝瘢痕)的广谱肝脏疾病。NAFLD的所有阶段通常都在肝脏细胞(肝细胞)中聚积脂肪(脂肪浸润)。单纯脂肪肝是某种脂肪、甘油三酯类型在肝脏细胞中异常聚积但肝脏细胞无炎症或瘢痕。在NASH中,脂肪聚积与肝脏不同程度的炎症(肝炎)和瘢痕(纤维化)有关。炎症性细胞可破坏肝脏细胞(肝细胞坏死)。术语″脂肪性肝炎″和″脂肪坏死″中的脂肪性(steato)指脂肪浸润,肝炎指肝脏炎症,坏死指破坏肝脏细胞。NASH可最终导致肝脏瘢痕(纤维化),然后是不可逆的晚期瘢痕(肝硬化)。由NASH引起的肝硬化是NAFLD疾病谱的最后和最严重的阶段。(Mendler,Michel,“Fatty Liver:Nonalcoholic Fatry Liver Disease(NAFLD)and Nonalcoholic Steatohepatitis(NASH)(脂肪肝:非酒精性脂肪肝病(NAFLD)和非酒精性脂肪性肝炎(NASH),”Schoenfield,Leslie J.主编,MedicineNet.com,2005年8月29日)。
酒精性肝病或酒精诱导的肝病包含与过量消耗酒精有关或由其引起的三种病理上不同的肝脏疾病:脂肪肝(脂肪变性)、慢性或急性肝炎和肝硬化。酒精性肝炎的范围从温和的肝炎(异常实验室检测结果作为疾病的唯一指征)到严重的肝脏机能失调并有并发症例如黄疸病(由胆汁潴留引起的黄皮肤)、肝性脑病(由肝脏衰竭引起的神经机能障碍)、腹水(腹部的流体聚积)、出血性食管静脉曲张(食管的静脉曲张)、异常血液凝结和昏迷。酒精性肝炎在组织学上具有肝细胞气球样变性、中性粒细胞炎症及有时的马洛里小体(细胞中间体丝状蛋白异常聚集)的特征外观。肝硬化的解剖特征在于肝脏中广泛的节结与纤维化联合出现。(Worman,Howard J.,“Alcoholic Liver Disease(酒精性肝病)”,哥伦比亚大学医学中心网站)。
不依附任何特定理论,本文所述胰高血糖素肽用于治疗酒精性肝病、NAFLD或其任何阶段,包括例如脂肪变性、脂肪性肝炎、肝炎、肝脏炎症、NASH、肝硬化或并其发症。因此,本发明提供在受试者中预防或治疗酒精性肝病、NAFLD或其任何阶段的方法,所述方法包括给予受试者有效预防或治疗酒精性肝病、NAFLD或其阶段的量的本文所述胰高血糖素肽。所述治疗方法包括降低以下中的一个、二个、三个或更多个:肝脏脂肪含量、肝硬化的发生率或进展、肝细胞癌的发生率、炎症指征例如异常肝酶水平(例如天冬氨酸氨基转移酶AST和/或丙氨酸氨基转移酶ALT或LDH)、血清铁蛋白升高、血清胆红素升高和/或纤维化指征例如TGF-β水平升高。在优选实施方案中,将胰高血糖素肽用于治疗其进展超过单纯脂肪肝(脂肪变性)并表现出炎症或肝炎指征的患者。所述方法可导致例如AST和/或ALT水平降低。
可单独或与其它抗糖尿病药物或抗肥胖症药物联合给予本发明胰高血糖素肽。本领域已知或正在研究的抗糖尿病药物包括:胰岛素;磺脲类,例如甲苯磺丁脲(甲糖宁(Orinase))、乙酸己脲(戴美乐(Dymelor))、甲磺氮草脲(妥拉磺脲(Tolinase))、氯磺丙脲(特泌胰(Diabinese))、格列甲嗪(glipizide)((利糖妥片(Glucotrol))、格列本脲(glyburide)(达安宁(Diabeta)、优降糖(Micronase)、达安辽(Glynase))、格列美脲(glimepiride)(亚莫利(Amaryl))或格列齐特(gliclazide)(达美康(Diamicron));氯茴苯酸类,例如瑞格列奈(repaglinide)(Prandin)或那格列奈(nateglinide)(Starlix);双胍类,例如二甲双胍(格华止(Glucophage))或苯乙双胍;噻唑烷二酮类,例如罗格列酮(rosiglitazone)(文迪雅(Avandia))、匹格列酮(pioglitazone)(Actos)或曲格列酮(troglitazone)(瑞如林(Rezulin))或其它PPARγ抑制剂;抑制碳水化合物消化的α葡糖苷酶抑制剂,例如米格列醇(miglitol)(德赛天(Glyset))、阿卡波糖(acarbose)(阿卡糖(Precose)/拜糖平(Glucobay));艾塞那肽(exenatide)(百泌达(Byetta))或普兰林肽(pramlintide);二肽基肽酶-4(DPP-4)抑制剂,例如维格列汀(vildagliptin)或西格列汀(sitagliptin);SGLT(钠-依赖的葡萄糖转运蛋白1)抑制剂;葡糖酶激活剂(GKA);胰高血糖素受体拮抗剂(GRA);或FBPase(果糖1,6-二磷酸酶)抑制剂。
本领域已知或正在研究的抗肥胖症药物包括:瘦素(Leptin)和成纤维细胞生长因子21(FGF-21);食欲抑制剂,例如苯乙胺型刺激剂、苯丁胺(任选用氟苯丙胺或右旋氟苯丙胺)、二乙胺苯丙酮、苯二甲吗啉、苄非他明(benzphetamine)、西布曲明(sibutramine);利莫那班(rimonabant)、其它大麻受体拮抗剂;泌酸调节肽;盐酸氟西汀(fluoxetine hydrochloride)(Prozac);Qnexa(托吡酯(topiramate)和苯丁胺)、Excalia(安非拉酮(bupropion)和唑尼沙胺(zonisamide))或Contrave(安非拉酮和纳曲酮(naltrexone));或脂肪酶抑制剂,类似于赛尼可(xenical)(奥里斯特(Orlistat))或赛利司他(Cetilistat)(亦称为ATL-962)或GT 389-255。
可将保留胰高血糖素在低血糖症患者中升高葡萄糖作用的本发明胰高血糖素肽用于治疗低血糖症,例如预防或治疗急性、周期性的或夜间低血糖症。所述胰高血糖素肽亦可与胰岛素联合给予,以缓冲胰岛素的作用,并帮助糖尿病患者维持稳定的血糖水平。在所述实施方案中,提供在胰岛素依赖的患者中调节血糖水平的改良方法。本发明胰高血糖素肽可与胰岛素联合作为单一组合物给予,作为分开的溶液同时给予,或作为备选可让胰岛素和胰高血糖素肽在相对于彼此不同的时间给予。在某些实施方案中,所述方法包括给予治疗有效量的用于控制糖尿病的胰岛素和给予治疗有效量的用于防止低血糖症的经修饰的本发明新型胰高血糖素肽的步骤,其中所述给予步骤彼此在12小时内进行。修饰的胰高血糖素肽相对于给予的胰岛素的精确比率,部分视测定的患者葡萄糖水平和其它临床参数而定。“正常化”血液水平意指让血糖水平回到正常(例如若高于正常则为降低血糖水平,或若低于正常则为升高血糖水平)。“稳定”血糖水平意指减少一段时间内的血糖水平最大变化,所述一段时间例如8小时、16小时、24小时、2天、3天、4天、5天、6天或1周。例如,给予胰高血糖素肽比不给予胰高血糖素肽时导致血糖水平随时间保持更接近正常范围的葡萄糖值。
将保留所需活性的本发明胰高血糖素肽用于诱导放射学应用的消化道的临时麻痹,或用于治疗因低血液胰高血糖素水平而导致的其它代谢病。在所述实施方案中,提供用于诱导肠道临时麻痹的方法。所述方法包括将本文公开的一种或多种胰高血糖素肽给予患者的步骤。
本发明在不同方面提供减少增重或诱导减重或用于治疗高血糖症的方法,所述方法包括以有效降低增重或诱导减重或降低食欲的量同时给予有需要的患者GIP受体激动剂分子和GLP-1受体激动剂分子。这两种分子可一起存在于同一组合物中。或者,可以以所述方法给予激活GIP和GLP-1两种受体的分子。不同受体激动剂组合(即激活特性)提供意料之外的相加作用或协同作用或其它意料之外的临床益处。所述方法涵盖给予常规剂量的胰岛素、给予减少剂量的胰岛素或不给予胰岛素。例示性GIP受体激动剂分子包括GIP或GIP类似物,例如所述类似物在目视检查最大匹配比对后保留至少50%、60%、70%或80%的序列同一性。例示性GLP-1受体激动剂分子包括:GLP-1、GLP-1类似物,例如其在目视检查最大匹配比对后保留至少50%、60%、70%或80%的序列同一性;毒蜥外泌肽-4类似物,例如其在目视检查最大匹配比对后保留至少50%、60%、70%或80%的序列同一性;或其衍生物。表现出两种活性的例示性分子包括本发明胰高血糖素肽、激活GLP-1和GIP两种受体的GLP-1类似物、GIP和GLP-1融合体或GIP类似物和GLP-1类似物融合体或其化学修饰衍生物。
包括但不限于治疗低血糖症的本发明治疗方法可包括用任何标准给药途径给予患者本发明胰高血糖素肽的步骤,所述标准给药途径包括:胃肠外给药,例如静脉内、腹膜内、皮下或肌肉内给药;鞘内、经皮、直肠、经口、经鼻或通过吸入给药。
根据某些实施方案,在逐个疾病基础上从所述方法中排除现有技术公开的用于治疗特定疾病的任何胰高血糖素类似物或GLP-1类似物。在另一实施方案中,美国专利号6,864,069所述作为GLP-1激动剂和胰高血糖素拮抗剂起作用用于治疗糖尿病的肽亦被排除在外。在另一实施方案中,本发明可排除胰高血糖素拮抗剂治疗糖尿病的用途,例如Unson等,J.Biol.Chem.,264:789-794(1989)、Ahn等,J.Med.Chem.,44:3109-3116(2001)和Sapse等,Mol.Med.,8(5):251-262(2002)所述的拮抗剂。在某些实施方案中,泌酸调节肽或含有泌酸调节肽的8个C-末端氨基酸(SEQ ID NO:97)的胰高血糖素肽可被排除在外。
在小肠中发现的天然存在的消化性激素泌酸调节肽诱导减重(参见Diabetes 2005;54:2390-2395)。泌酸调节肽为含有胰高血糖素的29个氨基酸序列(即SEQ ID NO:1)接着8个氨基酸羧基末端突出端SEQ ID NO:97(KRNRNNIA)的37个氨基酸的肽。尽管本发明涵盖的是本文所述胰高血糖素肽可任选与所述8个氨基酸羧基末端突出端(SEQ ID NO:97)链接,但在本发明某些实施方案中,亦明确涵盖缺乏SEQ ID NO:97的8个邻接羧基氨基酸的胰高血糖素肽。
尽管可表现出所需的共激动剂或三-激动剂活性的对以下任何一种肽的进一步修饰、用所述化合物的药物组合物、药盒和治疗方法可包括在本发明中,但从本发明化合物中排除这些肽:含[Arg12]取代和C-末端酰胺的SEQ ID NO:1的肽;含[Arg12、Lys20]取代和C-末端酰胺的SEQ ID NO:1的肽;含[Arg12、Lys24]取代和C-末端酰胺的SEQ ID NO:1的肽;含[Arg12、Lys29]取代和C-末端酰胺的SEQ ID NO:1的肽;含[Glu9]取代的SEQ ID NO:1的肽;失去His1、含[Glu9、Glu16、Lys29]取代和C-末端酰胺的SEQ ID NO:1的肽;含[Glu9、Glu16、Lys29]取代和C-末端酰胺的SEQ ID NO:1的肽;含经由内酰胺桥连接的[Lys13、Glu17]取代和C-末端酰胺的SEQ ID NO:1的肽;含经由内酰胺桥连接的[Lys17、Glu21]取代和C-末端酰胺的SEQ ID NO:1的肽;失去His1的含经由内酰胺桥连接的[Glu20、Lys24]取代的SEQ ID NO:1的肽;以下专利中公开的肽:2008年2月13日提交的PCT/US2008/053857、2006年5月5日提交的PCT/US2006/017494、2007年8月17日提交的PCT/US2007/018415、2005年2月25日提交的PCT/GB2005/000710、2000年3月29体提交的PCT/GB00/01089、2006年2月10日提交的PCT/US2006/005020,它们各自以其整体在此引作参考。
实施例
可通过标准合成方法、重组DNA技术或制备肽和融合蛋白的任何其它方法来制备本发明化合物。尽管某些非天然氨基酸不能由标准重组DNA技术表达,但其制备技术为本领域已知。除了用合适的标准肽化学反应之外,还可通过标准有机化学反应合成包含非肽部分的本发明化合物。关于胰高血糖素肽的胰高血糖素和GLP-1活性的另外的数据亦公开在2008年2月13日提交的PCT/US2008/053857中,其以其整体在此引作参考。
实施例1
通用合成方案
在改良的Applied Biosystem 430A肽合成仪上,用HBTU-活化的“Fast Boc”单偶联(single coupling)从0.2毫摩尔的Boc Thr(OBzl)Pam树脂开始合成胰高血糖素类似物。Boc氨基酸和HBTU获自Midwest Biotech(Fishers,IN)。所用侧链保护基团为:Arg(Tos)、Asn(Xan)、Asp(OcHex)、Cys(pMeBzl)、His(Bom)、Lys(2Cl-Z)、Ser(OBzl)、Thr(OBzl)、Tyr(2Br-Z)和Trp(CHO)。N-末端His上的侧链保护基团是Boc。
用20%哌啶的二甲基甲酰胺溶液处理每一个完成的肽基树脂,以从色氨酸除去甲酰基。在对甲酚和二甲基硫醚存在下进行液态氟化氢裂解。用HF仪器(Penninsula Labs)在冰浴中进行1小时裂解。蒸发HF后,将残留物悬浮在乙醚中,过滤固体物质。将每种肽提取到30-70ml乙酸水溶液中,由HPLC分析稀释的等份样[Beckman System Gold,0.46x5cm Zorbax C8,1ml/分钟,45C,214nm,A缓冲液=0.1%TFA,B=0.1%TFA/90%乙腈,梯度为经10分钟10%-80%B]。
在FPLC上经2.2x 25cm Kromasil C18柱进行纯化,同时在214nm处监测UV,收集5分钟馏分。合并同类馏分并冻干,得到产物纯度为>95%。用MALDI-质谱分析确认准确的分子量和纯度。
实施例2
通用聚乙二醇化方案:(Cys-马来酰亚胺基)
通常让胰高血糖素Cys类似物溶解于磷酸盐缓冲的盐水(5-10mg/ml)中,加入0.01M乙二胺四乙酸(10-15%的总体积)。加入过量(2-倍)的马来酰亚胺基甲氧基PEG试剂(Nektar),在室温下搅拌反应物,同时用HPLC监测反应进程。8-24小时后,使反应混合物酸化,并将其装载到制备型反相柱上,用0.1%TFA/乙腈梯度进行纯化。合并合适的馏分并冻干,得到所期需的聚乙二醇化类似物。
实施例3
合成胰高血糖素Cys17(1-29)和类似的单Cys类似物
60ml反应瓶中有0.2毫摩尔Boc Thr(OBzl)Pam树脂(SynChem Inc),加入以下序列并让其在使用FastBoc HBTU-活化的单偶联的改良Applied Biosystems 430A肽合成仪上运行。
HSQGTFTSDYSKYLDSCRAQDFVQWLMNT
使用以下侧链保护基:Arg(Tos)、Asp(OcHex)、Asn(Xan)、Cys(pMeBzl)、Glu(OcHex)、His(Boc)、Lys(2Cl-Z)、Ser(Bzl)、Thr(Bzl)、Trp(CHO)和Tyr(Br-Z)。用20%哌啶/二甲基甲酰胺处理完成的肽基树脂,以除去Trp的甲酰基保护,然后转移到HF反应瓶中,在真空干燥。加入1.0ml对甲酚和0.5ml二甲基硫醚连同磁力搅拌棒。将反应瓶连接到HF仪器(Pennisula Labs),在干冰/甲醇浴中冷却,抽空,浓缩为大约10ml的液态氟化氢。在冰浴中将反应物搅拌1小时,然后真空除去HF。让残留物悬浮在乙基醚中;过滤固体,用醚洗涤,将肽提取到50ml乙酸水溶液中。对裂解提取物小样品进行分析型HPLC[0.46x 5cm Zorbax C8,1ml/分钟,45C,214nm,0.1%TFA的A缓冲液,0.1%TFA/90%ACN的B缓冲液,梯度=经10分钟10%B-80%B]。将其余的提取物装载到2.2x 25cm Kromasil C18制备型反相柱上,用Pharmacia FPLC系统运行乙腈梯度。收集馏分5分钟,同时在214nm(2.0A)处监测UV。A=0.1%TFA,B=0.1%TFA/50%乙腈。梯度=经450分钟30%B-100%B。
合并含有最纯产物(48-52)的馏分,冷冻并冻干,得到30.1mg。产物的HPLC分析证明纯度>90%,MALDI质谱分析证明所需的3429.7的质量。类似地制备胰高血糖素Cys21、胰高血糖素Cys24和胰高血糖素Cys29。
实施例4
合成胰高血糖素-Cex和其它C-末端延伸的类似物
将285mg(0.2毫摩尔)甲氧基二苯甲胺树脂(Midwest Biotech)置于60ml反应瓶中,加入以下序列并让其在使用FastBoc HBTU-活化的单偶联的改良Applied Biosystems 430A肽合成仪上运行。
HSQGTFTSDYSKYLDSRRAQDFVQWLMNTGPSSGAPPPS
使用以下侧链保护基:Arg(Tos)、Asp(OcHex)、Asn(Xan)、Cys(pMeBzl)、Glu(OcHex)、His(Boc)、Lys(2Cl-Z)、Ser(Bzl)、Thr(Bzl)、Trp(CHO)和Tyr(Br-Z)。用20%哌啶/二甲基甲酰胺处理完成的肽基树脂,以除去Trp的甲酰基保护,然后转移到HF反应瓶中,在真空干燥。加入1.0ml对甲酚和0.5ml二甲基硫醚连同磁力搅拌棒。将反应瓶连接到HF仪器(Pennisula Labs),在干冰/甲醇浴中冷却,抽空,浓缩为大约10ml的液态氟化氢。在冰浴中将反应物搅拌1小时,然后真空除去HF。让残留物悬浮在乙基醚中;过滤固体,用醚洗涤,将肽提取到50ml乙酸水溶液中。对裂解提取物等份样进行分析型HPLC[0.46x 5cm Zorbax C8,1ml/分钟,45C,214nm,0.1%TFA的A缓冲液,0.1%TFA/90%ACN的B缓冲液,梯度=经10分钟10%B-80%B]。将提取物装载到2.2x 25cm Kromasil C18制备型反相柱上,用Pharmacia FPLC系统进行乙腈梯度以洗脱。收集馏分5分钟,同时在214nm(2.0A)处监测UV。A=0.1%TFA,B=0.1%TFA/50%乙腈。梯度=经450分钟30%B-100%B。合并58-65馏分,冷冻并冻干,得到198.1mg。
产物的HPLC分析证明纯度大于95%,MALDI质谱分析证明所期需的4316.7的理论质量,产物含C-末端酰胺。从适当装载的PAM-树脂开始,类似地制备含C-末端羧酸的泌酸调节肽和泌酸调节肽-KRNR。
实施例5
胰高血糖素Cys17Mal-PEG-5K
让15.1mg胰高血糖素Cys17(1-29)和27.3mg平均分子量5000的甲氧基聚(乙二醇)马来酰亚胺(mPEG-Mal-5000,Nektar Therapeutics)溶解于3.5ml磷酸盐缓冲的盐水(PBS)中,加入0.5ml 0.01M乙二胺四乙酸(EDTA)。在室温搅拌反应物,由HPLC分析监测反应进展[0.46x 5cm Zorbax C8,1ml/分钟,45C,214nm(0.5A),A=0.1%TFA,B=0.1%TFA/90%ACN,梯度=经10分钟10%B-80%B]。5小时后将反应混合物装载到2.2x 25cm Kromasil C18制备型反相柱上。在Pharmacia FPLC上实施乙腈梯度,同时在214nm处监测UV波长,收集馏分5分钟。A=0.1%TFA,B=0.1%TFA/50%乙腈,梯度=经450分钟30%B-100%B。合并对应产物的馏分,冷冻并冻干,得到25.9mg。
在HPLC上分析该产物[0.46x 5cm Zorbax C8,1ml/分钟,45C,214nm(0.5A),A=0.1%TFA,B=0.1%TFA/90%ACN,梯度=经10分钟10%B-80%B],显示纯度大约90%。MALDI(基质辅助激光解吸电离)质谱分析显示8700-9500的广泛质量范围(PEG衍生物特有的)。这表明在起始胰高血糖素肽(3429)上加上了大约5,000原子质量单位(a.m.u.)的质量。
实施例6
胰高血糖素Cys21Mal-PEG-5K
让21.6mg胰高血糖素Cys21(1-29)和24mg mPEG-Mal-5000(Nektar Therapeutics)溶解于3.5ml磷酸盐缓冲的盐水(PBS),加入0.5ml 0.01M乙二胺四乙酸(EDTA)。在室温下搅拌反应物。2小时后,再加入12.7mg的mPEG-MAL-5000。8小时后将反应混合物装载到2.2x 25cm Vydac C18制备型反相柱上,在Pharmacia FPLC上以4ml/分钟实施乙腈梯度,同时收集馏分5分钟。A=0.1%TFA,B=0.1%TFA/50%ACN,梯度=经450分钟20%B-80%B。
合并对应于产物外观的馏分,冷冻并冻干,得到34mg。通过分析型HPLC进行该产物的分析[0.46x 5cm Zorbax C8,1ml/分钟,45C,214nm(0.5A),A=0.1%TFA,B=0.1%TFA/90%ACN,梯度=经10分钟10%B-80%B],显示不同于起始胰高血糖素肽的均一产物。MALDI(基质辅助激光解吸电离)质谱分析显示8700-9500的广泛质量范围(PEG类似物特有的)。这表明在起始胰高血糖素肽(3470)上加上了大约5,000原子质量单位的质量。
实施例7
胰高血糖素Cys24Mal-PEG-5K
让20.1mg胰高血糖素C24(1-29)和39.5mg mPEG-Mal-5000(Nektar Therapeutics)搅拌溶解于3.5ml PBS中,加入0.5ml 0.01M EDTA。在室温搅拌反应物7小时,然后再加40mg的mPEG-Mal-5000。在大约15小时后,将反应混合物装载到2.2x 25cm Vydac C18制备型反相柱上,用Pharmacia FPLC实施乙腈梯度。收集馏分5分钟,同时在波长214nm处监测UV(2.0A)。A缓冲液=0.1%TFA,B缓冲液=0.1%TFA/50%ACN,梯度=经450分钟30%B-100%B。合并对应于产物的馏分,冷冻并冻干,得到45.8mg。MALDI质谱分析显示典型的最大为9175.2的PEG宽信号,其比胰高血糖素C24(3457.8)大约多5,000原子质量单位。
实施例8
胰高血糖素Cys24Mal-PEG-20K
在室温下让25.7mg胰高血糖素Cys24(1-29)和40.7mg mPEG-Mal-20K(Nektar Therapeutics)搅拌溶解于3.5ml PBS中,加入0.5ml 0.01M EDTA。6小时后由HPLC测定的起始物质与产物的比率为大约60:40。再加入25.1mg的mPEG-Mal-20K,让反应物再搅拌16小时。产物比率没有显著提高,因此将反应混合物装载到2.2x 25cm Kromasil C18制备型反相柱上,并在Pharmacia FPLC上用经450分钟30%B-100%B的梯度进行纯化。A缓冲液=0.1%TFA,B=缓冲液0.1%TFA/50%ACN,流速=4ml/分钟,收集5分钟馏分,同时在波长214nm处监测UV(2.0A)。合并含同类产物的馏分,冷冻并冻干,得到25.7mg。由分析型HPLC测得纯度为大约90%。MALDI质谱分析显示23,000-27,000的宽峰,这比起始胰高血糖素C24(3457.8)大约多20,000原子质量单位。
实施例9
胰高血糖素Cys29Mal-PEG-5K
在室温下让20.0mg胰高血糖素Cys29(1-29)和24.7mg mPEG-Mal-5000(Nektar Therapeutics)搅拌溶解于3.5ml PBS中,加入0.5ml 0.01M EDTA。4小时后再加15.6mg的mPEG-Mal-5000以驱使反应完成。8小时后将反应混合物装载到2.2x 25cm Vydac C18制备型反相柱上,在Pharmacia FPLC系统上实施乙腈梯度。收集馏分5分钟,同时在波长214nm处监测UV。A=0.1%TFA,B=0.1%TFA/50%ACN。合并75-97的馏分,冷冻并冻干,得到40.0mg不同于在HPLC上回收的起始物质(58-63馏分)的产物。由分析型HPLC分析该产物[0.46x 5cm Zorbax C8,1ml/分钟,45C,214nm(0.5A),A=0.1%TFA,B=0.1%TFA/90%ACN,梯度=经10分钟10%B-80%B],显示纯度大于95%。MALDI质谱分析显示存在8,000-10,000(最大9025.3)的质量范围的PEG组分,其大于起始胰高血糖素肽(3484.8)5,540原子质量单位。
实施例10
胰高血糖素Cys24(2-丁内酯)
向24.7mg胰高血糖素Cys24(1-29)中加入4ml 0.05M碳酸氢铵/50%乙腈和5.5ul的2-溴-4-羟基丁酸-γ-内酯(100ul存在于900ul乙腈中)溶液。在室温搅拌3小时后,再向反应混合物中加入105ul内酯溶液,再搅拌15小时。用10%乙酸水溶液将反应混合物稀释到10ml,装载到2.2x 25cm Kromasil C18制备型反相柱上。在Pharmacia FPLC上实施乙腈梯度(经450分钟20%B-80%B),同时收集馏分5分钟,在214nm处监测UV(2.0A)。流速=4ml/分钟,A=0.1%TFA,B=0.1%TFA/50%ACN。合并74-77馏分,冷冻并冻干,得到7.5mg。HPLC分析显示纯度为95%,MALDI质谱分析显示3540.7的质量,即大于起始物质84的质量单位。该结果符合添加单一的丁内酯部分。
实施例11
胰高血糖素Cys24(S-羧甲基)
将18.1mg胰高血糖素Cys24(1-29)溶解于9.4ml 0.1M磷酸钠缓冲液(pH=9.2)中,加入0.6ml溴乙酸溶液(乙腈中1.3mg/ml)。室温下搅拌反应物,由分析型HPLC跟踪反应进程。1小时后再加入0.1ml溴乙酸溶液。将反应物再搅拌60分钟,然后用乙酸水溶液酸化,装载到2.2x 25cm Kromasil C18制备型反相柱上用于纯化。在Pharmacia FPLC上实施乙腈梯度(流速=4ml/分钟),同时收集5分钟馏分,在214nm处监测UV(2.0A)。A=0.1%TFA,B=0.1%TFA/50%ACN。合并馏分26-29,冷冻并冻干,得到若干mg产物。分析型HPLC显示纯度为90%,MALDI质谱分析确认所期需产物的质量为3515。
实施例12
胰高血糖素Cys24马来酰亚胺基、PEG-3.4K-二聚体
让16mg胰高血糖素Cys24和1.02mg平均分子量3400的Mal-PEG-Mal-3400聚(乙二醇)-双-马来酰亚胺(Nektar Therpeutics)溶解于3.5磷酸盐缓冲盐水和0.5ml 0.01M EDTA中,室温下搅拌反应物。16小时后,再加入16mg的胰高血糖素拌。大约40小时后,将反应混合物装载到Pharmcia PepRPC 16/10柱上,在Pharmacia FPLC上实施乙腈梯度,同时收集馏分2分钟,在214nm处监测UV(2.0A)。流速=2ml/分钟,A=0.1%TFA,B=0.1%TFA/50%ACN。合并馏分69-74,冷冻并冻干,得到10.4mg。分析型HPLC显示纯度为90%,MALDI质谱分析显示9500-11,000范围内的组分,这符合所期需的二聚体。
实施例13
合成胰高血糖素内酰胺
将285mg(0.2毫摩尔)甲氧基二苯甲胺树脂(Midwest Biotech)加入到60mL反应瓶中,用Boc DEPBT-活化的单偶联让以下序列在改良的Applied Biosystems 430A肽合成仪上装配。
HSQGTFTSDYSKYLDERRAQDFVQWLMNT-NH2(12-16内酰胺)
使用以下侧链保护基:Arg(Tos)、Asp(OcHx)、Asn(Xan)、Glu(OFm)、His(BOM)、Lys(Fmoc)、Ser(Bzl)、Thr(Bzl)、Trp(CHO)、Tyr(Br-Z)。若由16-20、20-24或24-28构建内酰胺,则12位用Lys(Cl-Z)。用20%哌啶/二甲基甲酰胺处理完成的肽基树脂1小时,旋转以除去Trp的甲酰基基团以及Lys12和Glu16的Fmoc和OFm保护。在由阳性茚三酮检测确认除去后,用二甲基甲酰胺接着用二氯甲烷然后再次用二甲基甲酰胺洗涤树脂。用二甲基甲酰胺和二异丙基乙基胺(DIEA)中的520mg(1毫摩尔)六氟磷酸苯并三唑-1-基-氧基-三-吡咯烷酮子基-(PyBOP)处理树脂。反应进行8-10小时,通过阴性茚三酮反应来确认环化。用二甲基甲酰胺接着用二氯甲烷洗涤树脂,随后用三氟乙酸处理10分钟。通过阳性茚三酮反应确认除去Boc基团。用二甲基甲酰胺和二氯甲烷洗涤树脂,干燥后转移到氢氟酸(HF)反应瓶中。加入500L对甲酚连同磁力搅拌棒。将反应瓶连接到HF仪器(Peninsula Labs),在干冰/甲醇浴中冷却,抽空,将大约10mL液态氢氟酸在反应瓶中浓缩。在冰浴中将反应物搅拌1小时,随后真空除去HF。让残留物悬浮在乙基醚中;过滤固体,用醚洗涤,用150mL 20%乙腈/1%乙酸溶解肽。
在以下条件下进行粗溶解肽的分析型HPLC分析[4.6X 30mm Xterra C8,1.50ml/分钟,220nm,A缓冲液0.1%TFA/10%ACN,B缓冲液0.1%TFA/100%ACN,梯度为经15分钟5-95%B]。用水将提取物稀释2倍,装载到2.2X 25cm Vydac C4制备型反相柱上,在Waters HPLC系统上用乙腈梯度洗脱(A缓冲液为0.1%TFA/10%ACN,B缓冲液为0.1%TFA/10%CAN,梯度为经120分钟0-100%B,流速为15.00ml/分钟)。纯化肽的HPLC分析显示大于95%的纯度,电子喷雾离子质谱分析确认12-16内酰胺的质量为3506Da。类似地制备16-20、20-24和24-28内酰胺。
实施例14
胰高血糖素溶解性测定
在0.01N HCl中制备胰高血糖素(或类似物)的溶液(1mg/ml或3mg/ml)。用0.01N HCl将100ul储液稀释到1ml,测定UV吸光度(276nm)。用200-250ul 0.1M Na2HPO4(pH 9.2)将剩余储液的pH调整到pH7。让溶液在4℃静置过夜,然后离心。然后用0.01N HCl将100ul上清液稀释到1ml,测定UV吸收度(一式两份)。
为体积增大对初始吸光度读数作补偿,用以下计算来确定溶解性百分比:
实施例15
胰高血糖素受体结合测定
在竞争结合测定中用闪烁亲近测定技术测量肽对胰高血糖素受体的亲和力。在96孔白色/透明底的板(Corning Inc.,Acton,MA)中让以下物质混合:在闪烁亲近测定缓冲液(0.05M Tris-HCl,pH 7.5,0.15M NaCl,0.1%w/v牛血清白蛋白)中进行3-倍系列稀释的肽、每孔1-6微克的0.05nM(3-[125I]-碘酪氨酰)Tyr10胰高血糖素(Amersham Biosciences,Piscataway,NJ)、从过表达人胰高血糖素受体的细胞制备的质膜片段和1mg/孔聚乙烯亚胺-处理的麦芽凝集素A型闪烁亲近测定珠粒(Amersham Biosciences,Piscataway,NJ)。在旋转振荡器上以800rpm振荡5分钟后,让板在室温孵育12小时,然后在MicroB1450液体闪烁计数仪(Perkin-Elmer,Wellesley,MA)上读数。测量孔中比试验样品最高浓度大4倍的“冷”天然配体的非特异性结合(NSB)的放射性,并检测无竞争物的孔中的总结合放射性。如下计算特异性结合的百分比:特异性结合%=((结合-NSB)/(总结合-NSB))X 100。用Origin软件(OriginLab,Northampton,MA)测定IC50值。
实施例16
功能测定-cAMP合成
在基于萤火虫荧光素酶报告测定中测量胰高血糖素类似物诱导cAMP的能力。在96孔聚-D-赖氨酸-包被的“Biocoat”板(BD Biosciences,San Jose,CA)中,于37℃、5%CO2条件下,通过在补充0.25%牛生长血清(HyClone,Logan,UT)的DMEM(Invitrogen,Carlsbad,CA)中培养16小时,来对用受体(胰高血糖素受体、GLP-1受体或GIP受体)和连接到cAMP响应元件的荧光素酶基因共转染的HEK293细胞实施血清剥夺,然后用系列稀释的胰高血糖素、GLP-1、GIP或新型胰高血糖素类似物孵育5小时。在结束孵育时,每孔加入100微升LucLite发光底物试剂(Perkin-Elmer,Wellesley,MA)。短时间振荡板,黑暗中孵育10分钟,在MicroB-1450液态闪烁计数仪(Perkin-Elmer,Wellesley,MA)上测量光输出。用Origin软件(OriginLab,Northampton,MA)计算有效50%浓度。
实施例17
胰高血糖素Cys-马来酰亚胺基PEG类似物的稳定性测定
将各种胰高血糖素类似物溶解于水或PBS中,进行初始HPLC分析。调整pH(4、5、6、7)后,让样品在37℃经特定时间孵育,重新用HPLC分析以测定肽的完整性。测定特定感兴趣的肽的浓度,计算相对于初始分析保留完整的百分比。
实施例18
制备酰化和/或聚乙二醇化肽
如下制备酰化和/或聚乙二醇化肽。用CS Bio 4886肽合成仪或Applied Biosystems 430A肽合成仪在固相载体树脂上合成肽。用Schnolzer等,Int.J.PEPTIDE Protein Res.40:180-193(1992)所述的原位中和化学。对于酰化的肽而言,用Nε-FMOC赖氨酸残基取代待酰化的靶标氨基酸残基(例如10位)。用20%哌啶/DMF将完成的N-末端BOC保护的肽处理30分钟除去FMOC/甲酰基基团。通过让10倍摩尔过量的FMOC-保护的间隔物氨基酸(过量FMOC-(N-BOC)-色氨酸-OH)或酰基链(过量C17-COOH)与DMF/DIEA中的PyBOP或DEPBT偶联试剂偶联,可实现与游离ε-氨基Lys残基的偶联。随后除去间隔物氨基酸的FMOC基团,接着重复与酰基链的偶联。用100%TFA的最后处理导致除去任何侧链保护基团和N-末端BOC基团。用5%DIEA/DMF中和肽树脂,干燥,然后用95∶5的HF/对甲酚在0℃经1小时使其从载体上裂解。在醚提取后,用5%HOAc溶液使粗肽成为溶剂化物。然后通过ESI-MS确证溶液样品含有符合分子量的肽。通过RP-HPLC用10%CH3CN/0.1%TFA到100%CH3CN中的0.1%TFA线性梯度纯化符合的肽。用Vydac C1822mm x 250mm蛋白质柱来纯化。通常用20∶80比率的缓冲液完成酰化肽类似物的洗脱。将各部分合并在一起,在分析型RP-HPLC上检查其纯度。冻干纯馏分产生白色固态肽。
若肽包含内酰胺桥和待酰化的靶标残基,则在将该氨基酸加到肽主链后进行上述酰化。
对于肽的聚乙二醇化,在7M脲、50mM Tris-HCl缓冲液中用将肽及PEG二者都溶解为澄清溶液所需的最小量溶剂(通常对于用2-3mg肽的反应小于2mL),让等摩尔的肽与40kDa甲氧基聚(乙二醇)马来酰亚胺基-丙酰胺(Chirotech Technology Ltd.)反应。室温剧烈搅拌4-6小时,由分析型RP-HPLC分析反应物。聚乙二醇化产物表现得与原料明显不同,其保留时间缩短。在Vydac C4柱上用与初始肽纯化所用相似的条件进行纯化。通常在大约50∶50缓冲液比率发生洗脱。收集并冻干纯聚乙二醇化肽馏分。
如以上实施例16所述测定肽的生物学活性。酰化肽可表现出提高的针对GLP-1受体的效价。包含色氨酸间隔物可提供更好的针对胰高血糖素受体的效价。
虽然酰化可让肽的半衰期延长数小时或更长,但以数十kDa重复的聚乙二醇化能延长更多。制备包含两种修饰类型的肽。预期这些肽表现出延长的循环半衰期以及对DPP-IV和其它蛋白酶的抗性。
实施例20
在体内对增重、食欲和血糖水平的影响
以下肽基本上如上所述合成。
(A)聚乙二醇化胰高血糖素/GLP-1共激动剂肽(嵌合体2AIB2C2440K PEG,其为用2位AIB、24位Cys进一步修饰的嵌合体2肽(参见实施例21),将24位Cys连接到40K PEG基团);
(B)聚乙二醇化GIP拮抗剂(Pro3C24GIP NH2(1-42)40K PEG,其为用3位Pro、24位Cys修饰的GIP的1-42位氨基酸(天然GIP序列为SEQ ID NO:4),将24位Cys连接到40K PEG基团,C-末端羧酸酯换成酰胺);
(C)GIP激动剂(AIB2C24GIP(1-42)40K PEG,其为用2位AIB、24位Cys修饰的GIP的1-42位氨基酸(天然GIP序列为SEQ ID NO:4),将24位Cys连接到40K PEG基团);和
通过用各种肽或单独溶媒每周一次(70或210nmol/kg/周)皮下注射饮食诱导的肥胖(DIO)小鼠,来进行肽的体内试验。每组含初始平均体重各为50g的8只小鼠。定期测定体重、机体组成、摄食和血糖水平。
如图1-3所示,与聚乙二醇化胰高血糖素/GLP-1共激动剂比较,GIP拮抗剂和GIP激动剂肽在降低小鼠体重、减少聚积性摄食和降低血糖水平方面都无效。
实施例21
肽的GIP、GLP-1和胰高血糖素活性
基本上如上所述合成SEQ ID NO:5-94的肽(每一种都包含取代C-末端羧酸酯的酰胺),如实施例16在体外测定其针对GIP受体、GLP-1受体和胰高血糖素受体的活性。每一种肽的EC50如表1所示。
基于这些数据,确定肽mt-140、mt-147、mt-151、mt-152、mt-158、mt-164、mt-165、mt-166、mt-169、mt-170、mt-172、mt-175和mt-179为例示性的GLP-1/GIP/胰高血糖素三激动剂肽,而肽mt-148、mt-149、mt-162、mt-174、mt-178、mt-201和mt-204为例示性的GLP-1/GIP共激动剂肽,肽mt-116、mt-176、mt-177和mt-182为例示性的GIP/胰高血糖素共激动剂肽。
实施例22
体内检测了实施例21的GLP-1/GIP/胰高血糖素三激动剂肽(mt-170)、GLP-1/GIP共激动剂肽(mt-178)和两种GIP/胰高血糖素共激动剂肽(mt-182和mt-179),其通过用上述这些肽、胰高血糖素/GLP-1共激动剂肽(嵌合体2AIB2(包含以下修饰的天然胰高血糖素氨基酸序列(SEQ ID NO:1):17位Gln、18位Ala、20位Lys、21位Glu、23位Ile和24位Ala及C-末端酰胺(“嵌合体2”),且在2位有另外的AIB修饰);或嵌合体2AIB2内酰胺(与嵌合体2AIB2一样有16位Glu和20位Lys的进一步修饰,其中内酰胺将Glu16和Lys20的侧链桥联在一起)或单独溶媒,每周一次(70或210nmol/kg/周)皮下注射饮食诱导的肥胖(DIO)小鼠来进行。每组含初始平均体重各为50g的8只小鼠。定期测定体重。
如图4所示,三激动剂和GLP-1/GIP共激动剂比嵌合体2AIB2对小鼠体重减轻的作用稍有效,但不如嵌合体2AIB2内酰胺有效,嵌合体2AIB2内酰胺显示出最强的降低体重的能力。与此相反,两种GIP/胰高血糖素共激动剂(尤其是mt-182)在减轻体重方面作用都较小。
实施例23
体内检测了GLP-1/GIP/胰高血糖素三激动剂肽(mt-170)和GLP-1/GIP共激动剂肽(mt-178),其通过用上述这些肽、GLP激动剂(包含具16位Glu的SEQ ID NO:3)或单独溶媒,每周一次(10nmol/kg/周进行4周或35nmol/kg/周进行2周)皮下注射饮食诱导的肥胖(DIO)小鼠来进行。每组含初始平均体重各为49g的8只小鼠。定期测定体重和血糖水平。如图5和6所示,GLP-1/GIP共激动剂和三激动剂二者都比GLP-1激动剂更有效降低体重并降低血糖水平。
实施例24
通过用AIB在16位代替mt-165(SEQ ID NO:64)和mt-170(SEQ ID NO:69)的内酰胺,研究了用α,α-二取代氨基酸代替内酰胺对基于胰高血糖素的类似物的α螺旋的稳定作用。将包含在16位用AIB代替内酰胺的mt-165序列的肽命名为“mt-241”,其具有SEQ ID NO:167的氨基酸序列,而将包含在16位用AIB代替内酰胺的mt-170序列的肽命名为“mt-248”,其具有SEQ ID NO:173的氨基酸序列。
基本上如上所述还制备缺乏内酰胺桥并包含16和/或20位AIB的其它线性肽。将这些肽命名为“mt-242”、“mt-249”、“mt-250”、“mt-251”、“mt-252”、“mt-255”、“mt-258”和“mt-259”,它们分别具有SEQ ID NO:168、174-176、107、108、177和258的氨基酸序列。基本上如实施例16所述检测这些肽中每一种针对胰高血糖素受体、GLP-1受体和GIP受体的体外生物学活性。结果示于表2中。
如表2中的结果所显示,不含内酰胺的线性肽提供针对GIP受体以及胰高血糖素受体和/或GLP-1受体的活性。更确切地说,mt-242、mt-248、mt-249、mt-250、mt-252、mt-255、mt-258和mt-259表现出胰高血糖素/GLP-1/GIP三激动剂的活性,而mt-251表现出GLP-1/GIP共激动剂的活性。具有16位Lys和20位AIB的肽mt-252表现出针对胰高血糖素受体和GLP-1受体的效价,并表现出提高的针对GIP受体的活性。实施例25
基本上如上所述制备缺乏内酰胺环并包含16位Lys或相似残基及20位AIB的线性肽。所述肽具有SEQ ID NO:99-141、144-164和166的氨基酸序列。基本上如实施例16所述在体外检测所述肽针对胰高血糖素受体、GLP-1和GIP受体的生物学活性。结果示于表3中。
如表3所示,所述线性肽对GIP受体有活性,且在很多情况下,所述肽还对胰高血糖素受体和/或GLP-1受体有活性。更具体地,mt-252、mt-255、mt-257、mt-260、mt-261、mt-262、mt-265、mt-266、mt-267、mt-275、mt-276、mt-277、mt-278、mt-279、mt-280、mt-286、mt-287、mt-288、mt-289、mt-290、mt-291、mt-292、mt-293、mt-295、mt-296、mt-297、mt-299、mt-306、mt-307、mt-310、mt-323、mt-324和mt-345全部表现出针对GIP受体、GLP-1受体和胰高血糖素受体的活性,而表3中的其它肽表现出针对GIP受体和GLP-1受体的活性(仅对GIP受体表现出活性的mt-285及对胰高血糖素受体和GIP受体表现出活性但对GLP-1受体无活性的mt-325除外)。
当将包含C-末端突出端的mt-252的数据与肽中不包含C-末端突出端的mt-257、mt-258和mt-259的数据进行比较时,显然C-末端突出端提高了针对所有胰高血糖素受体、GLP-1受体和GIP受体的活性。
当将包含16位Lys的mt-252的数据与肽中分别包含16位Orn残基和16位Dab残基的mt-275和mt-276的数据进行比较时,显然Lys可被与Lys类似的残基取代。
进一步地,当将包含3位Gln的mt-252的数据与肽中包含3位Glu的mt-256和mt-274的数据进行比较时,显然用Glu残基取代3位Gln获得对GLP-1受体和GIP受体优于胰高血糖素受体的选择性。
从mt-260到mt-263及mt-265到mt-272的数据明显看出用C14、C16和C18脂肪酸酰化的效果。从这些数据来看,显然用C16和C18脂肪酸酰化提供提高的针对GLP-1受体和GIP受体的活性。这些肽的酰化甚至使得即使是在该肽包含Gln3Glu取代时也提高针对胰高血糖素受体的活性。从三激动剂mt-277到mt-280的数据也可看到提高的针对胰高血糖素受体的活性。
实施例26
在DIO小鼠中测定了聚乙二醇化的环形含内酰胺的肽mt-178(SEQ ID NO:75)和聚乙二醇化的线性缺乏内酰胺的肽mt-274(SEQ ID NO:99)的体内活性,并将其与具有SEQ ID NO:179的基于GLP-1结构的纯GLP-1激动剂对照的体内活性进行比较。在第0天以1、3或10nmol/kg/周将肽或溶媒对照腹膜内注射给小鼠。
通过在用所述肽之一或溶媒对照注射后1小时,给小鼠腹膜内注射25%(w/v)葡萄糖盐水溶液,来对小鼠进行1小时葡萄糖耐受测定(GTT)。以1.5g/kg小鼠体重的剂量给予小鼠葡萄糖盐水溶液。在以下时间点测量血糖水平:注射肽或溶媒对照时(-60分钟)、注射葡萄糖盐水溶液时(0分钟)或在用葡萄糖盐水溶液注射后15、30、60或120分钟。1小时GTT结果示于图7中。
以与1小时GTT相同的方式也对小鼠进行24小时GTT,不同之处是给予小鼠葡萄糖盐水溶液是在用肽或溶媒对照注射后24小时之时。24小时的GTT结果示于图8中。
在用肽或溶媒对照注射后0天和7天测量每只小鼠的总血糖水平,将其示于图9中。
另外,在用肽或溶媒对照注射后0、1、3、5和7天测量每只小鼠的体重,将小鼠体重变化%示于图10中。
如图10所示,用mt-178和mt-274以3或10nmol/kg/周剂量注射的小鼠,与用GLP-激动剂对照肽(以10nmol/kg/周的剂量)注射的小鼠减重程度一样或减重程度更大。
如图7和8所示,用mt-178、mt-274或GLP-1激动剂对照注射的小鼠与用溶媒对照注射的小鼠比较,表现出降低的血糖水平。mt-178和mt-274的效价似乎大于GLP-1激动剂对照肽的效价,因为mt-178和mt-274以3nmol/kg/周剂量达到GLP-1激动剂对照肽以10nmol/kg/周剂量的同样的效果。mt-274似乎具有最高的效价,因为该肽以1nmol/kg/周剂量达到与GLP-1激动剂对照肽以10nmol/kg/周剂量相似的结果。
实施例27
再次在小鼠中检测与实施例26所述相同的肽,不同的是将较高剂量(10或35nmol/kg/周)的肽皮下注射给小鼠。亦以这些剂量检测两个另外的肽:一个肽具有与mt-178相同的结构,但包含经由亲核取代形成的更稳定的硫醚连接(-SCH2CO-)连接到40位Cys的PEG基团,所述更稳定的硫醚连接是相对于在mt-178中存在的通过马来酰亚胺PEG经由Michael加成形成的传统的硫醚连接而言;而第二个肽具有与mt-274相同的结构,但包含经由亲核取代形成的硫醚连接(-SCH2CO-)连接到40位Cys的PEG基团。本文分别称这些肽为mt-178(TE)和mt-274(TE)。
在用肽或溶媒对照注射后0及7天测量小鼠总血糖水平,其示于图11中。在用肽或溶媒对照注射后7天测量小鼠血糖的总变化,其示于图12中。
在用肽或溶媒对照注射后0、1、3、5、7和10天测量每只小鼠的体重。作为时间函数的小鼠体重变化%示于图13中,同时在用肽或溶媒对照注射后7天测量的小鼠体重的总变化示于图14中。
如图12所示,与用溶媒对照注射的小鼠比较,用任何所测肽注射的所有小鼠的血糖总变化降低。在用35nmol/kg/周的mt-274或mt-178(TE)注射的小鼠中观察到血糖最巨大的变化。
如图14所示,与用溶媒对照注射的小鼠比较,用任何所测肽注射的所有小鼠的体重总变化降低。与血糖总变化一样,在用35nmol/kg/周的mt-274或mt-178(TE)注射的小鼠中观察到体重最巨大的变化。
实施例28
将实施例26所述的肽的体内活性与线性mt-274肽的酰化形式的体内活性进行比较。更具体地,制备并检测了mt-274的三种酰化形式,其中C-末端氨基酸(Lys残基)与C16脂肪酰基、C14脂肪酰基或C18脂肪酰基共价连接。本文分别将这些肽称为mt-298、mt-309和mt-310。与母体肽mt-274一样,酰化肽亦包含40kDa的PEG基团。然而,酰化肽的PEG基团与肽的24位Cys残基侧链共价连接。本文提供酰化肽mt-298、mt-309和mt-310的氨基酸序列分别为SEQ ID NO:101-103。
制备并检测非酰化形式的mt-298、mt-209和mt-310(下文称为mt-311)。肽mt-311不同于mt-274,mt-311通过24位Cys残基侧链(与在mt-274中存在的C-末端Cys残基形成对比)与PEG基团共价连接,mt-311的C-末端残基是Lys残基,而不像mt-274中存在的一样为Cys残基。
在第0天以10nmol/kg将肽或溶媒对照皮下注射DIO小鼠1周。
在用肽或溶媒对照注射后0及7天测量小鼠血糖水平,并示于图15中。在用肽或溶媒对照注射后0、1、3、5和7天测量每只小鼠的体重。作为时间的函数的小鼠体重变化%示于图16中,而在用肽或溶媒对照注射后7天测量的小鼠体重的总变化示于图17中。
如图17所示,与用溶媒对照注射的小鼠比较,用任何所述肽注射的小鼠表现出体重降低。用聚乙二醇化环化的含内酰胺肽(mt-178)注射的小鼠证明在注射后7天显示最大的体重损失。
如图15所示,用mt-178、mt-274、mt-311或其C14或C16酰化的形式注射的小鼠的血糖水平降低。用C18脂肪酰基酰化似乎不引起血糖水平降低,这提示酰基大小可能对肽的降低葡萄糖的作用是重要的。
实施例29
基本上如上所述制备酰化但未聚乙二醇化的缺乏内酰胺的基于胰高血糖素的线性肽。具体而言,制备了包含C-末端氨基酸上的C14脂肪酰基的mt-260(SEQ ID NO:104)、包含C-末端氨基酸上的C16脂肪酰基的mt-261(SEQ ID NO:105)和包含C-末端氨基酸上的C18脂肪酰基的mt-262(SEQ ID NO:106)。这些肽每一种的结构都与mt-298、mt-309和mt-310的结构相似,但不同的是mt-260、mt-261和mt-262包含代替24位聚乙二醇化的Cys残基的Asn残基。
以25或125nmol/kg的剂量给小鼠每日一次注射7天mt-260、mt-261或mt-262肽、对照肽(利拉鲁肽,一种酰化的GLP-1类似物)或溶媒对照。
在用肽或溶媒对照注射后0和7天测量小鼠的血糖水平,并示于图18中。在用肽或溶媒对照注射后0、1、3、5和7天测量每只小鼠的体重。作为时间函数的小鼠体重变化%示于图19中,而在用肽或溶媒对照注射后7天测量的小鼠体重的总变化示于图20中。
如图18所示,酰化的未聚乙二醇化的线性肽(mt-260、mt-261和mt-262)对血糖水平的影响巨大。在25nmol/kg下,这些肽引起血糖水平的约50%降低;在较高剂量下,所述肽引起的血糖水平降低大于50%。
如图19所示,每一种酰化的未聚乙二醇化的线性肽(低或高剂量)引起的体重降低比低剂量的利拉鲁肽引起的体重降低更有效。在7天测定过程中体重持续降低。
这些结果提示,对GIP受体和GLP-1受体有活性的酰化但未聚乙二醇化的基于胰高血糖素的线性肽能够显著降低血糖水平和体重,由此表明这些肽可用于治疗代谢紊乱(包括糖尿病)和用于治疗肥胖症。
实施例30
以不同剂量在DIO小鼠(N=8只/组;平均初始体重=48g)中检测基于胰高血糖素的线性肽mt-261(SEQ ID NO:105)。仅用溶媒、利拉鲁肽(30nmol/kg体重)或mt-261(0.3、1、3、10或30nmol/kg体重)每日一次皮下注射小鼠1周。
在首次注射后0、1、3、5和7天测量小鼠体重。如图21所示,用mt-261或利拉鲁肽注射引起小鼠减重。肽mt-261表现出比利拉鲁肽更高的效价,因为3nmol/kg mt-261达到基本上与30nmol/kg利拉鲁肽一样的效果(图21)。
在首次注射后7天通过核磁共振成像测量小鼠脂肪量。如图22所示,增加mt-261剂量通常与降低脂肪量相关。用3nmol/kg mt-261注射的小鼠的脂肪量与用30nmol/kg利拉鲁肽注射的小鼠脂肪量接近相同,这表明mt-261与利拉鲁肽比较效价更高。
在首次注射后0和7天测量小鼠的血糖水平。如图23所示,低至3nmol/kg剂量的mt-261引起血糖水平显著降低。与脂肪量和体重测定结果一致,用3nmol/kg mt-261注射的小鼠的血糖水平的降低与用30nmol/kg利拉鲁肽注射的小鼠的血糖水平降低相似,这表明mt-261与利拉鲁肽比较效价更高。
在单独的实验中,在9组C57BI/6小鼠(每组8只小鼠)中检测未酰化的mt-261形式即mt-263(SEQ ID NO:111)对小鼠体重、摄食、血糖水平和脂肪量的体内作用。小鼠为11月龄,在研究时已经进行了9个月的致糖尿病饮食。小鼠平均体重为57g。用3、10或30nmol/kg mt-263每日一次皮下注射小鼠1周。对照组接受溶媒对照或10或30nmol/kg/天的毒蜥外泌肽-4。
为了评估对体重的体内作用,在第0、1、3、5和7天测量小鼠体重,其中第0天为注射的首日。如图24所示,以三种剂量中的任何一种注射mt-263在7天检测期内引起体重稳态降低。对体重的作用亦表现出剂量依赖,因为在增加mt-263肽剂量时体重的总变化(示于图25中)增加。另外,如图25所示,由三种mt-263剂量中任何一种实现的体重总变化基本上大于用毒蜥外泌肽-4注射(以任一种剂量)实现的体重总变化。
亦测定对摄食、脂肪量和血糖的体内作用。与溶媒对照和毒蜥外泌肽-4比较,第7天测量的用mt-263注射的小鼠的总摄食和脂肪量降低。另外,与用溶媒对照或毒蜥外泌肽-4注射的小鼠比较,用mt-263注射的小鼠血糖水平总变化(以第7天测量的与第0天测量的水平比较)显著降低(图26)。10nmol/kg剂量的肽似乎为最佳剂量,实现血糖水平的最大降低(几乎为-80mg/dL)。
亦将肽mt-263对体重、摄食和血糖水平的体内作用与肽mt-349(SEQ ID NO:262)、mt-280、mt-356和mt-357和溶媒对照的相应作用比较。给予小鼠30nmol/kg/天的所述肽之一1周。与溶媒对照比较,所有肽都有效减轻体重。
实施例31
测定酰化的基于胰高血糖素的线性肽mt-277、mt-278和mt-279的体内作用,并将其与利拉鲁肽的相应作用进行比较。用溶媒对照或10nmol/kg的利拉鲁肽、mt-277、mt-278或mt-279每日一次皮下注射DIO小鼠(每组8只小鼠;平均初始体重=51.4g)1周。
在首次注射后0、1、3、5和7天测量小鼠体重。如图27所示,用mt-277、mt-278或mt-279注射引起小鼠显著减重。所有这些肽进一步显示比利拉鲁肽的效价高。
在首次注射后0和7天测量小鼠的血糖水平。如图28所示,mt-277、mt-278和mt-279中的每一种引起血糖水平显著降低,这种降低显著大于在用利拉鲁肽注射的小鼠中观察到的降低。
实施例32
修饰具有GLP-1受体活性的基于胰高血糖素的类似物以包含SEQ ID NO:95氨基酸序列的C-末端突出端,进一步修饰以包含SEQ ID NO:95的C-末端Lys。用C14脂肪酰基酰化位于类似物40位的Lys残基。基本上如实施例16所述检测该酰化的类似物针对胰高血糖素受体、GLP-1受体和GIP受体的体外活性。让该体外活性与缺乏C-末端突出端和40位酰化的具有GLP-1受体活性的基于胰高血糖素的类似物母体的体外活性进行比较。C-末端延伸的酰化类似物显示针对GIP受体活性提高大约15%,针对胰高血糖素受体活性提高大约52%。当用C-末端延伸的酰化类似物刺激时,实际上降低针对GLP-1受体的活性。然而,该活性仍然大于100%的天然GLP-1针对GLP-1受体达到的活性。
实施例33
基本上如上所述合成酰化的胰高血糖素类似物肽(每一种都包含代替C-末端羧酸酯的酰胺)。肽mt-358、mt-367、mt-368和mt-369为酰化的单体,而mt-354、mt-376和mt-377为酰化的二聚体,其中各二聚体包含经由C-末端Cys残基连接的两个单体。肽mt-367、mt-368和mt-369包含目的为连接酰基的γGlu-γGlu二肽间隔物,而mt-358是在缺乏间隔物下被酰化。肽mt-225、mt-227和mt-294为聚乙二醇化单体,其包含在16位谷氨酸和20位赖氨酸之间的内酰胺桥。肽mt-225和mt-227包含为连接PEG目的的二肽间隔物,而mt-294经由通过与卤代乙酰基反应形成的硫醚来酰化。肽mt-356和mt-357起未酰化的对照肽作用,其中mt-357包含7位Ile,而mt-356包含Thr。所有这些肽针对GIP受体、GLP-1受体和胰高血糖素受体的体外活性的检测基本上如实施例16所述来进行。相对于各种肽的天然激素的EC50(nM)和活性示于表4中。
如表4所示,所有三种酰化的二聚体都显示针对GLP-1受体和GIP受体的有效活性。此外,与由mt-358显示的活性比较,由mt-368表现出的针对GLP-1受体的活性显著提高;与mt-358比较,mt-368针对GIP受体的活性基本上保持,这提示胰高血糖素肽经由间隔物酰化可提高针对GLP-1受体的活性,而保持针对GIP受体的强活性。经由胰高血糖素类似物10位间隔物的酰化,似乎与胰高血糖素类似物的40位的位置一样好,因为对于mt-367和mt-369而言,针对GLP-1受体和GIP受体的相对活性大体上一样。
实施例34
基本上如本文所述制备具有相同氨基酸序列但聚乙二醇化接头不同的两种酰化的胰高血糖素类似物肽:mt-331(SEQ ID NO:153)包含与以下PEG结构的连接:
而mt-311(SEQ ID NO:100)包含与以下PEG结构的连接:
经由每周一次皮下注射多组DIO小鼠(每组6只小鼠;平均体重=64.6g)1周来给予两种肽或溶媒对照。以10或35nmol/kg的剂量给予肽。
在给予肽或溶媒对照后0、1、3、5和7天测量小鼠体重。用较高剂量的mt-311或mt-331注射的小鼠体重经过该周时间平稳降低。体重的总变化(%)示于图29中。如该图所示,用mt-311注射的小鼠体重的总变化最大。
在给予肽或溶媒对照后0、1、3、5和7天亦测量每组小鼠的总摄食。如图30所示,与用溶媒对照注射的小鼠比较,用任何剂量mt-311或mt-331注射的小鼠组的总摄食降低。
在给予肽或溶媒对照后0及7天测量每组小鼠的血糖水平。在给予较高剂量的mt-311或mt-331后小鼠的血糖水平降低。如图31所示,用35nmol/kg mt-331注射的小鼠的血糖水平降低更大。
测量每组小鼠的脂肪量。然而,给予所述肽似乎对脂肪量没有影响。
实施例35
在7月龄的C57BI/6小鼠中检测两种氨基酸序列相同但因缺乏连接到40位Lys的酰基(mt-331(SEQ ID NO:153))或存在C14脂肪酰基(mt-353(SEQ ID NO:166))而不同的肽对体重、摄食、血糖水平和脂肪量的体内作用。对小鼠进行致糖尿病饮食5个月,平均初始体重为53g。将以0.1、0.3、3或10nmol/kg剂量的肽或溶媒对照皮下注射1周给予小鼠。
在给予肽或溶媒对照后0、1、3、5和7天测量体重。如图32所示,用10nmol/kg的mt-331或mt-353注射的小鼠的体重的总变化最显著。
在给予肽或溶媒对照后0、1、3、5和7天测量小鼠摄食。如图33所示,与给予溶媒对照的小鼠比较,用3或10nmol/kg的mt-331或mt-353注射的小鼠的总摄食降低。
亦监测小鼠的血糖水平。如图34所示,mt-331以剂量依赖方式引起血糖水平降低。mt-353的两种剂量另外引起血糖水平降低。给予任一种肽都没有显著影响脂肪量水平。
实施例36
在8组DIO小鼠(每组8只小鼠)中检测分别具有SEQ ID NO:123,124和125结构的三种酰化的三激动剂肽mt-277、mt-278和mt-279对体重、血糖水平和摄食的体内作用。所述肽具有相同的氨基酸序列但其所连接的脂肪酰基大小不同。利拉鲁肽以10nM/kg的浓度用作对照。每日一次皮下注射给予1周肽或溶媒对照。
检测了针对胰高血糖素受体、GLP-1受体和GIP受体的体外活性,每种肽相对于天然激素的%活性示于下表5中。
表5
在给予肽或溶媒对照后0、1、3、5和7天测量小鼠体重。经过该周后,与溶媒对照比较,用酰化的三激动剂肽中的一种注射的小鼠体重显著降低。如图35所示,用酰化的三激动剂肽中的一种注射的小鼠体重的总变化(%)大约为-15%,而利拉鲁肽达到的体重降低小于5%。
实施例37
在具有58g平均体重的7组DIO小鼠(每组8只小鼠)中检测了聚乙二醇化的酰化肽(mt-309;SEQ ID NO:102)和非聚乙二醇化的酰化肽(mt-261;SEQ ID NO:105)的给药频率对功效的影响。以以下剂量和频率皮下注射各种肽给小鼠:5nmol/kg的剂量每日一次、10nmol/kg的剂量每两天一次或30nmol/kg的剂量每周一次。研究持续6天,以使每组小鼠在研究期结束时接受30nmol/kg。在首次给予后0及6天测量体重和血糖水平。
如图36所示,用mt-309每周一次注射的小鼠体重的总变化(%)大约与用同一肽每日一次注射的小鼠体重的总变化一样。亦如图36所示,用mt-261每日一次注射的小鼠的体重的总变化与用该肽每两天一次注射的小鼠的体重的总变化接近一样。
对于血糖水平亦可观察到与体重一样的趋势(图37):每周一次注射mt-309与每日一次注射该肽实现同样的血糖水平下降,每日一次注射mt-261与每两天一次注射该肽实现同样的血糖水平下降。
实施例38
在具有56g初始体重的8组DIO小鼠(每组8只小鼠)中检测了酰化的胰高血糖素激动肽mt-261(SEQ ID NO:105)的给药频率对功效的影响,以5nmol/kg每天一次、10nmol/kg每两天一次、15nmol/kg每三天一次或1天30nmol/kg的剂量皮下注射,以使每组小鼠每周接受30nmol/kg的总剂量。小鼠为8月龄,已进行了6个月的致糖尿病饮食。测量各组的体重、摄食、血糖水平和脂肪量。如图38所示,用肽每三天一次注射的小鼠表现出体重的最大降低。有趣的是,用肽每天一次注射的小鼠和用肽每两天一次注射的小鼠表现出差不多相同的体重降低。
实施例39
基本上如本文所述通过固相肽合成来制备以下胰高血糖素类似物肽:仅对胰高血糖素受体而不对GIP受体具有可观的激动剂活性并且包含肽J主链且在3位有另外修饰的胰高血糖素类似物肽
HS-X-GTFTSDYSKYLDTRRAAEFVAWL(Nle)DE
(SEQ ID NO:240)
或仅对胰高血糖素受体而不对GIP受体具有可观的激动剂活性并且包含肽K主链且在3位有另外修饰的胰高血糖素类似物肽
HS-X-GTFTSDYSKYLD(Aib)RRAADFVAWLMDE
(SEQ ID NO:241)
。基本上如实施例16所述检测所述肽针对胰高血糖素受体的体外活性。每一肽EC50(nM)示于表6中。
表6
Q=谷氨酰胺;C(Acm)=乙酰氨甲基-半胱氨酸;Dab(Ac)=乙酰基二氨基丁酸;Dap(脲)=氨基甲酰基二氨基丙酸;Q(Me)=甲基谷氨酰胺;M(O)=甲硫氨酸-亚砜;Orn(Ac)=乙酰鸟氨酸.
如表6所示,多个氨基酸可取代3位Gln而对胰高血糖素受体活性没有实质性的损失,在某些情况下,修饰实际上提高了所述活性,例如肽K主链上的Dab(Ac)和Q(Me)修饰。
实施例40
基本上如本文所述制备了仅对胰高血糖素受体而不对GIP受体具有可观的活性并且在不同胰高血糖素类似物主链上包含3位Dab(Ac)的胰高血糖素类似物肽,检测了其针对胰高血糖素受体的体外活性。每一肽的结构和活性示于表7中
表7
实施例41
基本上如本文所述制备具有C-末端酰胺代替C-末端α羧酸酯的胰高血糖素类似物:
肽mt-367、mt-368和mt-369分别包含SEQ ID NO:235、236和237结构。肽mt-384包含具有以下氨基酸修饰的SEQ ID NO:1氨基酸:1位Tyr;20位AIB;10位Lys,其中Lys经由γ-Glu-γ-Glu二肽间隔物与C16脂肪酰基共价结合;12位Ile;16位Lys;17位Gln;18位Ala;20位AIB;21位Glu;24位Asn;27位Leu;28位Ala和29位Gly;接着是29位氨基酸C-末端的SEQ ID NO:95氨基酸。肽mt-385包含与肽mt-384相似的结构,但在mt-385中7位的Thr改变为Ile。
基本上如本文所述检测类似物针对胰高血糖素受体、GLP-1受体和GIP受体中每一种的体外活性。结果示于表8。
表8
用10nmol/kg表8中的一种肽每日一次皮下注射7天9组每组8只DIO小鼠(品系:C57B16WT)。小鼠的平均初始体重为57.6g。小鼠大约10个月龄,进行了约8个月的高脂肪饮食。
在第7天测量体重的总变化。与溶媒对照比较,用表8肽注射的所有小鼠显示体重降低。用mt-369注射的小鼠的减重量最大(约降低25%),接着是用mt-368注射的小鼠(约降低22%)和用mt-384注射的小鼠(约降低21%)。用mt-367或mt-385注射的小鼠表现出较低的但仍显著的减重(mt-367:约降低18%,而mt-385:约降低15%)。
本文引用的包括出版物、专利申请和专利在内的所有参考文献在此引作参考,引用程度如同每一参考文献被单独并明确地表示引作参考并在本文中以其整体提出一样。
除非本文另外指出或明确与上下文有矛盾,否则在阐述本发明上下文(尤其是在以上权利要求上下文)中术语″一个″和″一种″和″该″及类似说法的应用,应理解为既包括单数又包括复数。除非另外指出,否则术语″包含″、″具有″、″包括″和″含有″应理解为开放性术语(即意味着″包括但不限于″)。
本文值范围的列举仅意欲作为对单独提及每一个落入所述范围的单独值及每一个端点的速记方法,除非本文另外指出,否则本说明书包括每一个单独值及每一个端点,如同其在本文被单独列举一样。
除非本文另外指出或另外明确与上下文有矛盾,否则可以以任何合适的次序来实施本文所述方法。除非另外声明,否则本文提供的任何及所有实施例或例示性语言(例如″例如″)的应用仅意欲更好地阐明本发明,并非提出对本发明范围的限制。本发明书中的任何语言都不应该理解为表明任何未提出权利要求的部分对实行本发明是必不可少。
本发明优选实施方案如本文所述,包括发明者已知的实施本发明最好的方式。在阅读了前述说明后,本领域一般技术人员可明了优选实施方案的变体。本发明人希望技术人员酌情使用所述变体,本发明人希望本发明除了如本文所明确阐述那样实施外还能另外实施。因此,本发明如适用法律所允许那样包括附加权利要求所列举的主题的所有修改及等同内容。此外,除非本文另外指出或另外明确与上下文有矛盾,否则本发明包括上述元件以其所有可能变化的任何组合。
- 还没有人留言评论。精彩留言会获得点赞!