突变酶及使用所述突变酶的类萜的制备方法与流程
本发明涉及突变酶及使用所述突变酶的类萜的制备方法。根据本发明,能够大量生产经甲羟戊酸路径所产生的角鲨烯。
背景技术:
类萜为超过5万种的天然化合物群的总称,在基本骨架中具有碳原子数5的异戊二烯单元。类萜根据碳原子数可分类为半萜(C5)、单萜(C10)、倍半萜(C15)、二萜(C20)、二倍半萜(C25)、三萜(C30)、四萜(C40)及其他多萜,在生物合成中,首先,通过异戊烯焦磷酸(IPP)及异戊烯焦磷酸经异构化所生成的二甲基烯丙基焦磷酸(DMAPP)的缩聚,制备数量不同的各种异戊二烯焦磷酸。从碳原子数10的香叶基焦磷酸中生物合成单萜(C10),从碳原子数15的法呢基焦磷酸中生物合成倍半萜(C15),从碳原子数20的香叶基香叶基焦磷酸中生物合成二萜等。
在很长一段时间,人们相信在类萜的生物合成中不可或缺的IPP与DMAPP,只能通过经由甲羟戊酸即“甲羟戊酸路径”来进行生物合成,但濑户及葛山等,发现除了“甲羟戊酸路径”以外,经由存在于多数真细菌或植物的色素体中的磷酸甲基赤藓醇(MEP)路径,也可以进行生物合成(非专利文献1)。
在类萜中,除了(C5H8)n的不饱和烃以外,在多数的植物及动物体内发现了它们的氧化还原生成物(醇、酮、酸等)或脱碳的化合物等,其中大量包括具有生理活性的物质。例如包括脱落酸、赤霉素、油菜类固醇等植物激素、保幼激素等在生物体内担负极重要功能的化合物,或作为在结构的一部分中具有异戊二烯结构的复合萜的叶绿素、维生素K、泛醌、tRNA等表现有用生理活性的化合物。其中,维生素K为参与血液凝固体系的重要的维生素,除了被用作止血剂之外,在最近有启示其参与骨代谢,期待其在骨质疏松症治疗上的应用,叶绿醌与甲基萘醌作为医药品而被允许。此外,泛醌或维生素K类中,对船体或桥脚等建造物上附着贝类具有防附着作用,期待其在防贝类附着涂料上的应用。更进一步,类胡萝卜素具有抗氧化作用,β-胡萝卜素、虾青素及隐黄素等则作为具有预防癌症或免疫活化活性的物质而受到期待。
现有技术文献
专利文献
专利文献1:特表2011-520471号公报
专利文献2:特表2009-538601号公报
专利文献3:特表2010-539902号公报
非专利文献
非专利文献1:“生物科学,生物技术,生物化学(Bioscience,Biotechnology,and Biochemistry)”(日本)2002年,第66卷,p1691-1627
非专利文献2:“化学与生物”(日本)2012年,第50卷,p163-174
非专利文献3:“细菌学杂志(Journal of Bacteriology)”(美国)1999,第181巻,p.1256-1263
非专利文献4:“欧洲分子生物学学会杂志(The EMBO Journal)”(英国)2000年,第19卷,p819-830
非专利文献5:“应用微生物学与生物技术(Applied Microbiology and Biotechnology)”(1998)49:p66-71
技术实现要素:
本发明要解决的技术问题
随着与类萜合成相关的路径的清晰,人们对其进行了改良,并进行用于提高类萜的产量的研究(非专利文献2)。在这些类萜中,角鲨烯直接由法呢基焦磷酸生物合成,处于与多种三萜相连接的主要的中间体的位置,因而进行了各种以提高角鲨烯的产量为目的的研究。例如,专利文献1中,公开了一种含有以生成浓度增加的类异戊二烯的方式进行修饰而在遗传方面发生改变的酵母的组合物,其中记载,通过消除甲羟戊二酸单酰(hydroxymethylglutaryl)CoA还原酶(HMGR)的膜结合区域,而增加角鲨烯的产量。此外,在专利文献2及专利文献3中,公开了含有角鲨烯的类异戊二烯化合物的生产方法。
然而,专利文献1所述的角鲨烯的产量至多为菌体干重量的5%左右,无法说是充分。此外,专利文献2及3所公开的技术为用于调整制备条件的技术,并非显著超越了现有技术。
本发明的目的在于有效地生产有用的类萜化合物,特别是提供一种作为类萜的重要中间体的角鲨烯的制备方法。
解决技术问题的技术手段
本发明人等对类萜化合物的生产方法进行仔细研究,结果惊讶地发现,作为甲羟戊酸路径的酶之一的甲羟戊二酸单酰CoA还原酶,通过使用具有特定氨基酸序列的甲羟戊二酸单酰CoA还原酶,甲羟戊酸路径下游的化合物、特别是角鲨烯的产量飞跃性地增加。
本发明基于上述见解。
因此,本发明涉及:
[1]一种甲羟戊二酸单酰CoA还原酶,其含有甲羟戊二酸单酰CoA还原酶(HMGR)的(a)Sα2氨基酸序列中第10位的丙氨酸(A)以外的氨基酸、(b)HMG-CoA结合位点的DKK区域的C末端开始的第1位的脯氨酸(P)以外的氨基酸、(c)Lα2氨基酸序列中第1位的丙氨酸(A)以外的氨基酸、及(d)Lα2氨基酸序列中第6位的谷氨酸(E)以外的氨基酸;
[2]根据[1]所述的甲羟戊二酸单酰CoA还原酶,其中,所述Sα2氨基酸序列的第10位的氨基酸为丝氨酸(S),HMG-CoA结合位点的DKK区域的C末端开始的第1位的氨基酸为丙氨酸(A),Lα2氨基酸序列的第1位的氨基酸为丝氨酸(S),Lα2氨基酸序列的第6位的氨基酸为天冬酰胺(N);
[3]根据[1]或[2]所述的甲羟戊二酸单酰CoA还原酶,所述甲羟戊二酸单酰CoA还原酶(HMGR)进一步含有选自由(e)Sα2氨基酸序列中第7位的异亮氨酸(I)以外的氨基酸、(f)Lα2氨基酸序列中第5位的异亮氨酸(I)以外的氨基酸、及(g)Sα2氨基酸序列中第6位的丙氨酸(A)以外的氨基酸构成的组中的一种或两种以上的氨基酸;
[4]根据[3]所述的甲羟戊二酸单酰CoA还原酶,其中所述Sα2氨基酸序列中第7位的氨基酸为亮氨酸,Lα2氨基酸序列中第5位的氨基酸为苏氨酸,Sα2氨基酸序列中第6位的氨基酸为亮氨酸;
[5]根据[1]~[4]的任一项所述的甲羟戊二酸单酰CoA还原酶,其为含有下述(1)~(3)任一种氨基酸序列的多肽,且为具有甲羟戊二酸单酰CoA还原酶活性的多肽:(1)序列号1所表示的氨基酸序列的514位~1022位的氨基酸序列、(2)在序列号1所表示的氨基酸序列的514位~1022位构成的氨基酸序列中,经1个或多个氨基酸缺失、置换、插入及/或添加的氨基酸序列、或(3)与序列号1所表示的氨基酸序列的514位~1022位构成的氨基酸序列的一致性为80%以上的氨基酸序列;
[6]根据[1]~[5]的任一项所述的甲羟戊二酸单酰CoA还原酶,其为由下述(1)~(3)任一种氨基酸序列构成的多肽,且为具有甲羟戊二酸单酰CoA还原酶活性的多肽:(1)序列号1所表示的氨基酸序列、(2)在序列号1所表示的氨基酸序列中,经1个或多个氨基酸缺失、置换、插入及/或添加的氨基酸序列、或(3)与序列号1所表示的氨基酸序列的一致性为80%以上的氨基酸序列;
[7]根据[1]~[6]的任一项所述的甲羟戊二酸单酰CoA还原酶,其不含有膜结合区域;
[8]一种多核苷酸,其编码[1]~[7]任一项所述的甲羟戊二酸单酰CoA还原酶;
[9]一种微生物,其具有[8]所述的多核苷酸;
[10]一种载体,其含有包含[8]所述的多核苷酸的DNA;
[11]一种转化体,其具有[10]所述的载体;或
[12]一种类萜的制备方法,其特征在于,培养[11]所述的转化体。
所述[1]所述的甲羟戊二酸单酰CoA还原酶可置换为:
[13]一种甲羟戊二酸单酰CoA还原酶,其甲羟戊二酸单酰CoA还原酶(HMGR)的Sα2氨基酸序列中第10位的氨基酸为丙氨酸(A)以外的氨基酸,从Lα2氨基酸序列的氨基末端向HMGR的氨基末端的第2位的氨基酸为脯氨酸(P)以外的氨基酸,Lα2氨基酸序列中第1位的氨基酸为丙氨酸(A)以外的氨基酸,Lα2氨基酸序列中第5位的氨基酸为异亮氨酸(I)以外的氨基酸,Lα2氨基酸序列中第6位的氨基酸为谷氨酸(E)以外的氨基酸,且该甲羟戊二酸单酰CoA还原酶与Sα2氨基酸序列的第10位的氨基酸为丙氨酸(A)、从Lα2氨基酸序列的氨基末端向HMGR的氨基末端的第2位的氨基酸为脯氨酸(P)、Lα2氨基酸序列的第1位的氨基酸为丙氨酸(A)、Lα2氨基酸序列的第5位的氨基酸为异亮氨酸(I)、Lα2氨基酸序列的第6位的氨基酸为谷氨酸(E)、其他的氨基酸序列相同的甲羟戊二酸单酰CoA还原酶相比较,活性提高;或
[14]根据[1]所述的甲羟戊二酸单酰CoA还原酶,其所述Sα2氨基酸序列的第10位的氨基酸为丝氨酸(S),从Lα2氨基酸序列的氨基末端向HMGR的氨基末端的第2位的氨基酸为丙氨酸(A),Lα2氨基酸序列的第1位的氨基酸为丝氨酸(S),Lα2氨基酸序列的第5位的氨基酸为苏氨酸(T),Lα2氨基酸序列的第6位的氨基酸为天冬酰胺(N)。
发明效果
根据本发明的突变酶及使用所述突变酶的类萜的制备方法,可以有效地生产有用的类萜化合物。例如,通过使用本发明的甲羟戊二酸单酰CoA还原酶,在甲羟戊酸路径中能够使甲羟戊酸的产量增加。此外,能够大量有效地产生作为类萜重要的中间体的角鲨烯。
附图说明
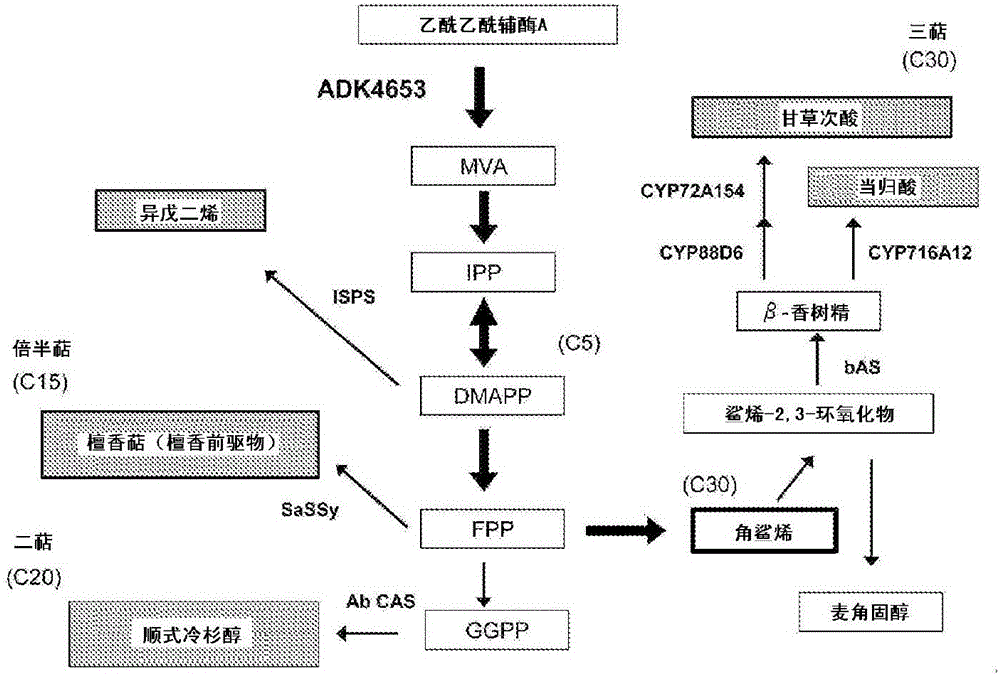
图1为表示甲羟戊酸路径及其下游的类萜化合物的产生路径的概略图。
图2为将本发明的ADK4653HMGR及目前所报告的HMGR的Sα2附近的氨基酸序列进行取平对齐的图,凡例记号如下所示:
ADK_HMGR:本发明的酶的氨基酸序列/HMG1:表示酿酒酵母菌(Saccharomyces cerevisiae)(DDBJ的检索号M22002)/HMG2:表示来自酿酒酵母菌(DDBJ检索号M22255)的酶的氨基酸序列/AF273765:表示来自Homo sapiens(人)的酶的氨基酸序列。(DDBJ:DNA Data Bank of Japan<www.ddbj.nig.ac.jp/>)此外,以下的凡例记号表示UniProt(Universal Protein Resource<www.uniprot.org/>)的检索号。Q6BSE8:表示汉氏德巴利氏酵母菌(Debaryomyces hansenii)(ATCC 36239)/G3AY61:表示纤维假丝酵母(Candida tenuis)(ATCC 10573)/J8PYR1:表示Saccharomyces arboricola(菌株H-6)/G8B666:表示近平滑假丝酵母(Candida parapsilosis)(ATCC MYA-4646)/A3LX63:表示树干毕赤酵母(Scheffersomyces stipitis)(ATCC 58785)/H2AW26:表示Kazachstania africana(ATCC 22294)/G8Y9W2:表示毕赤酵母(Pichia sorbitophila)(ATCC MYA-4447)/F2QRB0:表示来自Komagataella pastoris(ATCC 76273)的酶的氨基酸序列。
图3为将本发明的ADK4653HMGR及目前所报告的HMGR的HMG-CoA结合位点的DKK区域及Lα2附近的氨基酸序列进行取平对齐的图,凡例记号与上述图2的说明相同。
图4为表示基于含有全长ADK4653基因的清酒酵母(酿酒酵母菌协会701号)的甲羟戊酸的产生的增加的图表。
图5为表示基于含有全长ADK4653基因的清酒酵母的角鲨烯产生的图表(SQ表示角鲨烯,ERG表示麦角固醇)。
图6为表示基于含有缩短型ADK4653基因及清酒酵母的缩短型HMGR基因的清酒酵母的角鲨烯产生的图表(SQ表示角鲨烯,ERG表示麦角固醇)。
图7-1为对ADK4653HMGR的氨基酸序列及清酒酵母HMGR的氨基酸序列、来自人的酶蛋白质的氨基酸序列进行比较的图。凡例记号如下所示:ADK_HMGR:本发明的酶的氨基酸序列/K7HMG1:酿酒酵母菌来自协会7号的酶的氨基酸序列(DDBJ的检索号DG000049,CDS114719..117883)/AF273765:来自Homo sapiens(人)的酶蛋白质的氨基酸序列(DDBJ的检索号AF273765)。
图7-2为对ADK4653HMGR的氨基酸序列及清酒酵母HMGR的氨基酸序列、来自人的酶蛋白质的氨基酸序列进行比较的图。凡例记号与上述图7-1的说明相同。
图8为表示基于含有全长ADK4653基因或缩短型ADK4653基因的清酒酵母的角鲨烯产生的经时变化的图表。
图9为将ADK4653HMGR的Lα2氨基酸序列中第1位的氨基酸(c)由丝氨酸置换为丙氨酸,或将第5位的氨基酸(f)由苏氨酸置换为异亮氨酸,或进行其组合的置换,并对角鲨烯产量进行研究的图表。
图10为将ADK4653HMGR的Sα2氨基酸序列中第10位的氨基酸(a)由丝氨酸置换为丙氨酸,并对角鲨烯产量进行研究的图表。
图11为将HMG-CoA结合位点的DKK区域的C末端开始的第1位的氨基酸(b)(Lα2区域的N末端侧到N末端侧第2位的位置上存在的氨基酸)由丙氨酸置换为脯氨酸,并对角鲨烯产量进行研究的图表。
图12为将ADK4653HMGR的Lα2氨基酸序列中第6位的氨基酸(d)由天冬酰胺置换为谷氨酸,并对角鲨烯产量进行研究的图表。
图13为对使在清酒酵母(K701菌株)的缩短型HMGR的氨基酸序列中构成Sα2的氨基酸的3个残基、位于HMG-CoA结合位点与Lα2之间的氨基酸1个残基及构成Lα2的氨基酸的3个残基中导入突变的突变酶(K701_突变型(Mutant))进行表达的酵母的角鲨烯产量进行研究的图表。具体而言,将清酒酵母(K701菌株)的缩短型HMGR的氨基酸序列中Sα2区域的第7位的氨基酸(e)由异亮氨酸置换为亮氨酸,将Sα2区域的第10位的氨基酸(a)由丙氨酸置换为丝氨酸,将Sα2区域的第6位的氨基酸(g)由丙氨酸置换为亮氨酸,HMG-CoA结合位点的DKK区域的C末端的第1位的氨基酸(b)(从Lα2区域的氨基末端向HMGR的氨基末端的第2位上存在的氨基酸)由脯氨酸置换为丙氨酸,将Lα2区域的第1位的氨基酸(c)由丙氨酸置换为丝氨酸,将Lα2区域的第5位的氨基酸(f)由异亮氨酸置换为苏氨酸,将Lα2区域的第6位的氨基酸(d)由谷氨酸置换为天冬酰胺,并对角鲨烯产量进行研究。
图14为将ADK4653HMGR的Sα2氨基酸序列中第6位的氨基酸(g)由亮氨酸置换为丙氨酸(实施例7),将Sα2氨基酸序列中第7位的氨基酸(e)由亮氨酸置换为异亮氨酸(实施例8),并对角鲨烯产量进行研究的图表。
图15为将清酒酵母(K701菌株)的缩短型HMGR的氨基酸序列中Sα2区域的第7位的氨基酸(e)由异亮氨酸置换为亮氨酸,将Sα2区域的第10位的氨基酸(a)由丙氨酸置换为丝氨酸,将HMG-CoA结合位点的DKK区域的C末端开始的第1位的氨基酸(b)(从Lα2区域的氨基末端向HMGR的氨基末端的第2位上存在的氨基酸)由脯氨酸置换为丙氨酸,将Lα2区域的第1位的氨基酸(c)由丙氨酸置换为丝氨酸,将Lα2区域的第5位的氨基酸(f)由异亮氨酸置换为苏氨酸,将Lα2区域的第6位的氨基酸(d)由谷氨酸置换为天冬酰胺,并对角鲨烯产量进行研究的图表(实施例9)。
图16为将清酒酵母(K701菌株)的缩短型HMGR的氨基酸序列中Sα2区域的第7位的氨基酸(e)由异亮氨酸置换为亮氨酸,将Sα2区域的第10位的氨基酸(a)由丙氨酸置换为丝氨酸,将HMG-CoA结合位点的DKK区域的C末端开始的第1位的氨基酸(b)(从Lα2区域的氨基末端向HMGR的氨基末端的第2位上存在的氨基酸)由脯氨酸置换为丙氨酸,将Lα2区域的第1位的氨基酸(c)由丙氨酸置换为丝氨酸,将Lα2区域的第6位的氨基酸(d)由谷氨酸置换为天冬酰胺,并对角鲨烯产量进行研究的图表(实施例10)。此外,还为将清酒酵母(K701菌株)的缩短型HMGR的氨基酸序列中Sα2区域的第7位的氨基酸(e)由异亮氨酸置换为亮氨酸,将Sα2区域的第10位的氨基酸(a)由丙氨酸置换为丝氨酸,将Sα2区域的第6位的氨基酸(g)由丙氨酸置换为亮氨酸,将HMG-CoA结合位点的DKK区域的C末端开始的第1位的氨基酸(b)(从Lα2区域的氨基末端向HMGR的氨基末端的第2位上存在的氨基酸)由脯氨酸置换为丙氨酸,将Lα2区域的第1位的氨基酸(c)由丙氨酸置换为丝氨酸,将Lα2区域的第6位的氨基酸(d)由谷氨酸置换为天冬酰胺,并对角鲨烯产量进行研究的图表(实施例11)。
具体实施方式
[1]甲羟戊二酸单酰CoA还原酶
本发明的甲羟戊二酸单酰CoA还原酶含有:(a)Sα2氨基酸序列中第10位的丙氨酸(A)以外的氨基酸、(b)HMG-CoA结合位点的DKK区域的C末端开始的第1位的脯氨酸(P)以外的氨基酸、(c)Lα2氨基酸序列中第1位的丙氨酸(A)以外的氨基酸、及(d)Lα2氨基酸序列中第6位的谷氨酸(E)以外的氨基酸。此外,所述Sα2氨基酸序列的第10位的氨基酸(a)优选为丝氨酸(S),HMG-CoA结合位点的DKK区域的C末端开始的第1位的氨基酸(b)优选为丙氨酸(A),Lα2氨基酸序列的第1位的氨基酸(c)优选为丝氨酸(S),Lα2氨基酸序列的第6位的氨基酸(d)优选为天冬酰胺(N)。
甲羟戊二酸单酰CoA还原酶(HMGR)可进一步含有选自由(e)Sα2氨基酸序列中第7位的异亮氨酸(I)以外的氨基酸、(f)Lα2氨基酸序列中第5位的异亮氨酸(I)以外的氨基酸、及(g)Sα2氨基酸序列中第6位的丙氨酸(A)以外的氨基酸所构成的组中的一种或两种以上的氨基酸。所述Sα2氨基酸序列中第7位的氨基酸优选为亮氨酸,Lα2氨基酸序列中第5位的氨基酸优选为苏氨酸,Sα2氨基酸序列中第6位的氨基酸优选为亮氨酸。
本发明的甲羟戊二酸单酰CoA还原酶与Sα2氨基酸序列的第10位的氨基酸(a)为丙氨酸(A)、HMG-CoA结合位点的DKK区域的C末端开始的第1位的氨基酸(b)为脯氨酸(P)、Lα2氨基酸序列的第1位的氨基酸(c)为丙氨酸(A)、Lα2氨基酸序列的第6位的氨基酸(d)为谷氨酸(E)、Sα2氨基酸序列中第7位的氨基酸(e)为异亮氨酸、Lα2氨基酸序列的第5位的氨基酸(f)为异亮氨酸、Sα2氨基酸序列中第6位的氨基酸(g)为丙氨酸的甲羟戊二酸单酰CoA还原酶相比,活性提高。
此外,所述“HMG-CoA结合位点的DKK区域的C末端开始的第1位的氨基酸(b)”为存在于与“从Lα2区域的氨基末端向HMGR的氨基末端的第2位上存在的氨基酸”相同位置的氨基酸。
《甲羟戊二酸单酰CoA还原酶》
甲羟戊二酸单酰CoA还原酶(以下,有时称作HMGR)为膜结合蛋白质,由膜结合部位和活性部位构成。HMGR在甲羟戊酸路径中还原3-羟基-3-甲基戊二酸CoA(以下,有时称作HMGCoA),从而变换为甲羟戊酸(MVA)的酶。在活性部位上,被称作模体A~G的区域从真核生物至真细菌、古细菌被高度保存(非专利文献3)。此外,通过人的HMGR的结晶解析,Lα1~9、Lβ1~6、Sα1~3、及Sβ1~4的区域被识别(非专利文献4)。
在本发明中,作为所使用的HMGR优选来自真核生物或古细菌,更优选来自真核生物。如上所示虽然HMGR的活性区域被高度保存,但通过来自真核生物或古细菌的HMGR,可期待更大的效果。
本发明的甲羟戊二酸单酰CoA还原酶中,特征性的氨基酸之一为存在于图2所示的(a)Sα2的区域的第10位上的丙氨酸(A)以外的氨基酸。其没有限定,优选破坏α螺旋结构的氨基酸,例如丝氨酸、酪氨酸、甘氨酸或脯氨酸,或者对α螺旋结构无影响的氨基酸,例如异亮氨酸、缬氨酸、半胱氨酸、苏氨酸或天冬酰胺,最优选为丝氨酸(S)。此外,本发明的甲羟戊二酸单酰CoA还原酶中,特征性的氨基酸之一为图3所示的(b)HMG-CoA结合位点的DKK区域的C末端开始的第1位的氨基酸,从Lα2区域的N末端向HMGR的N末端侧的第2位的位置上存在的氨基酸为脯氨酸(P)以外的氨基酸。作为脯氨酸(P)以外的氨基酸没有特别限定,优选形成坚固α螺旋结构的氨基酸,例如谷氨酸、丙氨酸、蛋氨酸、亮氨酸、赖氨酸、组氨酸、谷氨酰胺、苯丙氨酸、天冬氨酸,或表现容易形成α螺旋结构倾向的氨基酸,例如色氨酸、精氨酸,最优选为丙氨酸。
此外,本发明的甲羟戊二酸单酰CoA还原酶中特征性的氨基酸之一为存在于图3所示的(c)Lα2的区域的第1位上的丙氨酸(A)以外的氨基酸。其没有限定,优选为破坏α螺旋的结构的氨基酸,例如丝氨酸、酪氨酸、甘氨酸或脯氨酸,或优选为对α螺旋结构无影响的氨基酸,例如异亮氨酸、缬氨酸、半胱氨酸、苏氨酸或天冬酰胺,最优选为丝氨酸(S)。
本发明的甲羟戊二酸单酰CoA还原酶中特征性的氨基酸之一为图3所示的(d)Lα2的区域的第6位的氨基酸为谷氨酸(E)以外的氨基酸。作为谷氨酸(E)以外的氨基酸没有特别限定,优选为破坏α螺旋的结构的氨基酸,例如丝氨酸、酪氨酸、甘氨酸或脯氨酸,或优选为对α螺旋结构无影响的氨基酸,例如异亮氨酸、缬氨酸、半胱氨酸、苏氨酸或天冬酰胺,最优选为天冬酰胺(N)。
本发明的甲羟戊二酸单酰CoA还原酶中所优选的氨基酸之一为(e)所述Sα2区域的第7位的氨基酸为异亮氨酸(I)以外的氨基酸。作为异亮氨酸(I)以外的氨基酸没有特别限定,可列举丝氨酸、酪氨酸、甘氨酸、脯氨酸、异亮氨酸、缬氨酸、半胱氨酸、苏氨酸、天冬酰胺或亮氨酸,特别优选具有形成α螺旋结构的性质的氨基酸,最优选为亮氨酸(L)。
本发明的甲羟戊二酸单酰CoA还原酶中优选的氨基酸之一为存在于图3所示的(f)Lα2的区域的第5位上的异亮氨酸(I)以外的氨基酸。其没有限定,优选为破坏α螺旋结构的氨基酸,例如丝氨酸、酪氨酸、甘氨酸或脯氨酸,或优选为对α螺旋结构无影响的氨基酸,例如缬氨酸、半胱氨酸、苏氨酸或天冬酰胺,最优选为苏氨酸(T)。
本发明的甲羟戊二酸单酰CoA还原酶中优选的氨基酸之一为图2所示的(g)Sα2区域的第6位的氨基酸为丙氨酸(A)以外的氨基酸。作为丙氨酸(A)以外的氨基酸没有特别的限定,优选为丝氨酸、酪氨酸、甘氨酸、脯氨酸、异亮氨酸、缬氨酸、半胱氨酸、苏氨酸、天冬酰胺或亮氨酸,最优选为亮氨酸(L)。
如表1所示,在所述(a)、(b)、(c)、(d)、(e)、(f)及(g)的七个位置的氨基酸中,(a)、(b)、(c)、(d)四个位置的氨基酸分别为丙氨酸(A)以外的氨基酸、脯氨酸(P)以外的氨基酸、丙氨酸(A)以外的氨基酸及谷氨酸(E)以外的氨基酸是尤其重要的。具体而言,由比较例3~比较例6的结果可知,若将ADK4653_tHMGR的(a)、(b)、(c)及(d)的位置的氨基酸的任意一个置换为K701_tHMGR的氨基酸,则角鲨烯的产量的相对值急剧下降至0~13.9。因此,所述(a)、(b)、(c)及(d)的位置的氨基酸在甲羟戊二酸单酰CoA还原酶的角鲨烯的产生中是尤其重要的。
更进一步,由实施例6~11的结果可知,通过使(e)、(f)及(g)三个位置的氨基酸的任一个为异亮氨酸(I)以外的氨基酸、异亮氨酸(I)以外的氨基酸或丙氨酸(A)以外的氨基酸,表现出比K701_tHMGR更优异的角鲨烯的产量。
由比较例2及实施例3可知,与K701_tHMGR(a=A,b=P,c=A,d=E,e=I,f=I,g=A)相比较,(a)、(b)、(c)、(d)、(e)、(f)及(g)位置的七个氨基酸不同的ADK4653_tHMGR(a=S,b=A,c=S,d=N,e=L,f=T,g=L)的角鲨烯的产量显著优异。更进一步,由实施例5可知,通过将K701_tHMGR的(a)、(b)、(c)、(d)、(e)、(f)及(g)位置的七个氨基酸置换为ADK4653_tHMGR的七个氨基酸,角鲨烯的产量的相对值为92.1,基本与ADK4653_tHMGR相同。ADK4653_tHMGR与K701_tHMGR的氨基酸序列长度不同,缩短型HMGR(tHMGR)的氨基酸序列的同一性为78%。在K701_tHMGR的氨基酸中,通过仅将7个氨基酸置换为ADK4653_tHMGR的氨基酸,角鲨烯的产量与ADK4653_tHMGR相同,这是值得惊讶的。
所述Sα2的区域具有12个氨基酸的长度。现有所报告的Sα2的氨基酸序列按顺序为(E/I/S)、E、G、(Q/S/F)、(N/K/S/A)、(L/A/S/T/V)、(I/V/M)、K、(K/N/E)、A、F、(N/D)。就本发明人等所知,作为Sα2的第10位的氨基酸,现有所报告的氨基酸仅为丙氨酸(A),没有报告具有丙氨酸以外的氨基酸的甲羟戊二酸单酰CoA还原酶。
此外,所述Lα2的区域具有6个氨基酸的长度。现有所报告的Lα2的氨基酸序列按顺序为A、I、N、W、(I/L)、(E/N)。作为Lα2的第1位的氨基酸,现有所报告的氨基酸仅为丙氨酸(A),没有报告具有丙氨酸以外的氨基酸的甲羟戊二酸单酰CoA还原酶。此外,作为Lα2的第5位的氨基酸所报告的氨基酸仅为亮氨酸(L)及异亮氨酸(I),没有报告具有亮氨酸及异亮氨酸以外的氨基酸的甲羟戊二酸单酰CoA还原酶。更进一步,作为Lα2的第6位的氨基酸报告的氨基酸几乎全为谷氨酸(E),含有天冬酰胺(N)的甲羟戊二酸单酰CoA还原酶据本发明人等所知只有一种。更进一步作为从Lα2氨基酸序列的氨基末端向HMGR的氨基末端的第2位的氨基酸而被报告的氨基酸几乎全为脯氨酸(P),只报告有各具有一个缬氨酸(V)、丙氨酸(A)或丝氨酸(S)的甲羟戊二酸单酰CoA还原酶。
所述HMG-CoA结合位点是在HMGR的活性中起到重要作用的区域。HMG-CoA结合位点的一部份位于从上述Lα2区域到N末端侧的数个氨基酸的位置,天冬氨酸(D)、赖氨酸(K)、赖氨酸(K)的序列被高度保存(非专利文献4)。
在本发明的甲羟戊二酸单酰CoA还原酶中,所述的(a)~(g)的7个氨基酸,分别最优选(a)丙氨酸(A)以外的氨基酸、(b)脯氨酸(P)以外的氨基酸、(c)丙氨酸(A)以外的氨基酸、(d)谷氨酸(E)以外的氨基酸、(e)异亮氨酸(I)以外的氨基酸、(f)异亮氨酸(I)以外的氨基酸、及(g)丙氨酸(A)以外的氨基酸。然而,(a)~(d)的4个氨基酸分别可以为所述氨基酸以外的氨基酸。更进一步,除了(a)~(d)的4个氨基酸以外,(e)~(g)的任一个氨基酸(即5个氨基酸)也可以是所述氨基酸以外的氨基酸。更进一步,除了(a)~(d)的4个氨基酸以外,(e)~(g)的2个氨基酸(即6个氨基酸)也可以是所述氨基酸以外的氨基酸。
更进一步,选自(a)~(g)的氨基酸的6个以上的氨基酸可以为各自的氨基酸以外的。例如,(a)、(b)、(c)、(d)、(f)及(g)的6个氨基酸可以为各自的氨基酸以外的,(a)~(f)的6个氨基酸也可以为各自的氨基酸以外的。
与Sα2氨基酸序列的第10位的氨基酸为丙氨酸(A)、HMG-CoA结合位点的DKK区域的C末端开始的第1位的氨基酸为脯氨酸(P)、Lα2氨基酸序列的第1位的氨基酸为丙氨酸(A)、Lα2氨基酸序列的第6位的氨基酸为谷氨酸(E)、且其他氨基酸序列相同的甲羟戊二酸单酰CoA还原酶相比,本发明的甲羟戊二酸单酰CoA还原酶活性提高。即,通过Sα2氨基酸序列中第10位的氨基酸为丙氨酸(A)以外的氨基酸、HMG-CoA结合位点的DKK区域的C末端开始的第1位的氨基酸为脯氨酸(P)以外的氨基酸、Lα2氨基酸序列中第1位的氨基酸为丙氨酸(A)以外的氨基酸、Lα2氨基酸序列的第6位的氨基酸为谷氨酸(E)以外的氨基酸,甲羟戊二酸单酰CoA还原酶的活性提高。
此外,与Sα2氨基酸序列的第10位的氨基酸为丙氨酸(A)、HMG-CoA结合位点的DKK区域的C末端开始的第1位的氨基酸为脯氨酸(P)、Lα2氨基酸序列的第1位的氨基酸为丙氨酸(A)、Lα2氨基酸序列的第5位的氨基酸为异亮氨酸(I)、Lα2氨基酸序列的第6位的氨基酸为谷氨酸(E)、且其他氨基酸序列相同的甲基戊二酰CoA还原酶相比,本发明的甲羟戊二酸单酰CoA还原酶活性提高。即,通过Sα2氨基酸序列中第10位的氨基酸为丙氨酸(A)以外的氨基酸、从Lα2氨基酸序列的氨基末端向HMGR的氨基末端的第2位的氨基酸为脯氨酸(P)以外的氨基酸、Lα2氨基酸序列中第1位的氨基酸为丙氨酸(A)以外的氨基酸、Lα2氨基酸序列中第5位的氨基酸为异亮氨酸(I)以外的氨基酸、Lα2氨基酸序列的第6位的氨基酸为谷氨酸(E)以外的氨基酸,甲羟戊二酸单酰CoA还原酶的活性提高。
本说明书中,“甲羟戊二酸单酰CoA还原酶的活性”基本指还原HMGCoA,变换为甲羟戊酸(MVA)。然而,作为活性的测定方法并不限于测定甲羟戊酸的产生,也可以包括测定甲羟戊酸路径下游的各种类萜的产生。例如,如实施例所述,通过测定角鲨烯的积累,可测定甲羟戊二酸单酰CoA还原酶的活性。
本发明的甲羟戊二酸单酰CoA还原酶可使用公知的转基因技术等获得。例如,获得酵母的mRNA,使用适宜的引物,通过PCR等对甲羟戊二酸单酰CoA还原酶的基因进行扩增。将得到的基因整合到适当的载体中,确定基因序列。在(a)Sα2氨基酸序列的第10位的氨基酸为丙氨酸、(b)HMG-CoA结合位点的DKK区域的C末端开始的第1位的氨基酸为脯氨酸、(c)Lα2氨基酸序列的第1位的氨基酸为丙氨酸、(d)Lα2氨基酸序列的第6位的氨基酸为谷氨酸的情况下,通过导入对其以外的氨基酸的突变,能够获得编码本发明的甲羟戊二酸单酰CoA还原酶的基因。更进一步,在(e)Sα2区域的第7位的氨基酸为异亮氨酸、(f)Lα2氨基酸序列的第5位的氨基酸为异亮氨酸、(g)Sα2区域的第6位的氨基酸为丙氨酸的情况下,可以导入对其以外的氨基酸的突变。通过将该基因整合到酵母等宿主中,使其表达,可得到本发明的甲羟戊二酸单酰CoA还原酶。
此外,编码本发明的甲羟戊二酸单酰CoA还原酶的基因可通过公知的合成基因的合成方法进行合成,例如Khorana等的方法(Gupta et al.,1968)、Narang等的方法(Scarpulla et al.,1982)或Rossi等的方法(Rossi et al.,1982)。然后通过使合成的基因表达,可得到本发明的甲羟戊二酸单酰CoA还原酶。
本发明的甲羟戊二酸单酰CoA还原酶优选为由含有(1)序列号1所表示的氨基酸序列的514位~1022位的氨基酸序列的多肽构成的甲羟戊二酸单酰CoA还原酶。序列号1所表示的氨基酸序列的514位~1022位的氨基酸序列构成的多肽如实施例所述,表现出甲羟戊二酸单酰CoA还原酶的优异活性。因此,含有序列号1所表示的氨基酸序列的514位~1022位的氨基酸序列的多肽也同样表现出甲羟戊二酸单酰CoA还原酶的优异活性。例如,作为含有序列号1所表示的氨基酸序列的514位~1022位的氨基酸序列的多肽,为了提高甲羟戊二酸单酰CoA还原酶的表达,可列举在所述多肽的N末侧或C末侧融合谷胱甘肽S-转移酶(GST)或组氨酸标签等的融合蛋白质。这样的融合蛋白质不损害甲羟戊二酸单酰CoA还原酶的功能,容易进行提纯等。
本发明的甲羟戊二酸单酰CoA还原酶优选为由下述多肽构成的甲羟戊二酸单酰CoA还原酶,所述多肽为含有在(2)序列号1所表示的氨基酸序列的514位~1022位构成的氨基酸序列中经1个或多个氨基酸缺失、置换、插入及/或加成的氨基酸序列的多肽,且为具有甲羟戊二酸单酰CoA还原酶活性的多肽。
本说明书中,“氨基酸序列中经1个或多个氨基酸缺失、置换、插入、及/或加成的氨基酸”指通过氨基酸的置换等而发生改变。氨基酸的改变个数,优选为1~30个,更优选为1~10个,进一步优选为1~5个,最优选为1~2个。可用于本发明的突变肽的改变氨基酸序列的例子,可优选该氨基酸为具有1个或数个(优选为1、2、3或4个)的保存性置换的氨基酸序列。
这里的“保存性置换”是指用另外化学上类似的氨基酸残基置换1个或数个的氨基酸残基。例如可列举,通过其他疏水性残基置换某个疏水性残基的情况下,通过具有相同电荷的其他极性残基置换某个极性残基的情况等。能够进行这样的置换的在功能上类似的氨基酸,每个氨基酸在本技术领域中是公知的。作为非极性(疏水性)氨基酸,例如可列举丙氨酸、缬氨酸、异亮氨酸、亮氨酸、脯氨酸、色氨酸、苯丙氨酸、蛋氨酸等。作为极性(中性)氨基酸,例如可列举甘氨酸、丝氨酸、苏氨酸、酪氨酸、谷氨酰胺、天冬酰胺、半胱氨酸等。作为带有正电荷(碱性)氨基酸,可列举精氨酸、组氨酸、赖氨酸等。此外,作为带有负电荷(酸性)的氨基酸,可列举天冬氨酸、谷氨酸等。
选自由本发明的甲羟戊二酸单酰CoA还原酶中的(a)Sα2氨基酸序列的第10位的氨基酸向丙氨酸(A)以外的氨基酸的置换(突变)、(b)HMG-CoA结合位点的DKK区域的C末端开始的第1位的氨基酸(从Lα2氨基酸序列的氨基末端向HMGR的氨基末端的第2位的氨基酸)向脯氨酸(P)以外的氨基酸的置换(突变)、(c)Lα2氨基酸序列的第1位的氨基酸向丙氨酸(A)以外的氨基酸的置换(突变)、(f)Lα2氨基酸序列的第5位的氨基酸向异亮氨酸(I)以外的氨基酸的置换(突变)、(d)Lα2氨基酸序列中第6位的氨基酸向谷氨酸(E)以外的氨基酸的置换(突变)、(g)Sα2区域的第6位的氨基酸向丙氨酸(A)以外的氨基酸的置换(突变)、及(e)Sα2区域的第7位的氨基酸向异亮氨酸(I)以外的氨基酸的突变(置换)构成的组中的4个以上的突变(置换),优选为5个以上的突变(置换),更优选为6个以上的突变(置换)最优选为7个的突变(置换)是为了提高甲羟戊二酸单酰CoA还原酶的活性的积极的置换(突变),所述保存性置换是为了用于保持甲羟戊二酸单酰CoA还原酶活性的置换,本领域技术人员可容易地进行实施。
本发明的甲羟戊二酸单酰CoA还原酶优选为由下述多肽构成的甲羟戊二酸单酰CoA还原酶,所述多肽为含有与(3)序列号1所表示的氨基酸序列的514位~1022位构成的氨基酸序列的一致性为80%以上的氨基酸序列的多肽,且为具有甲羟戊二酸单酰CoA还原酶活性的多肽。
本发明的甲羟戊二酸单酰CoA还原酶优选为(1)序列号1所表示的氨基酸序列构成的甲羟戊二酸单酰CoA还原酶。由序列号1所表示的氨基酸序列构成的多肽如实施例所述,表现出甲羟戊二酸单酰CoA还原酶的优异活性。
本发明的甲羟戊二酸单酰CoA还原酶优选为由下述多肽构成的甲羟戊二酸单酰CoA还原酶,所述多肽为在(2)序列号1所表示的氨基酸序列中经1个或多个氨基酸缺失、置换、插入及/或加成的氨基酸序列构成的多肽,且为由具有甲羟戊二酸单酰CoA还原酶活性的多肽。这里的“氨基酸序列中经1或多个氨基酸缺失、置换、插入及/或加成的氨基酸”与前述相同,指通过氨基酸的置换等而发生改变。例如,在序列号1所表示的氨基酸构成的甲羟戊二酸单酰CoA还原酶中,即使第1位~513位的氨基酸缺失,也能表现甲羟戊二酸单酰CoA还原酶的活性。因此,特别是在第1位~513位中,可以在不阻碍甲羟戊二酸单酰CoA还原酶的活性的条件下进行缺失、置换或插入。
本发明的甲羟戊二酸单酰CoA还原酶优选为由下述多肽构成的甲羟戊二酸单酰CoA还原酶,所述多肽为由与(3)序列号1所表示的氨基酸序列的一致性为80%以上的氨基酸序列、更优选该一致性为90%以上的氨基酸序列、最优选为该一致性为95%以上的氨基酸序列构成的多肽,且为具有甲羟戊二酸单酰CoA还原酶活性的多肽。此外,其中一致性是指氨基酸序列的相同性。
在本发明的甲羟戊二酸单酰CoA还原酶的优选形态中,不含膜结合区域。已知甲羟戊二酸单酰CoA还原酶为由膜结合(贯通)结构域、连接部位及活性结构域构成的蛋白质,例如有关于S.cerevisiae的膜结合区域(非专利文献5)等的记载。
此外,本发明中“不含膜结合区域”是指除了仅不含膜结合区域的情况之外,也指同时不含有一部份的连接区域的情况。在序列号1所述的氨基酸序列中,上述膜结合区域为第1~第513位的氨基酸序列。
[2]多核苷酸
本发明的多核苷酸只要为编码本发明的甲羟戊二酸单酰CoA还原酶的多核苷酸,则没有特别限定。即,可列举出编码(a)Sα2氨基酸序列中第10位的氨基酸为丙氨酸(A)以外的氨基酸、(b)HMG-CoA结合位点的DKK区域的C末端开始的第1位的氨基酸(从Lα2氨基酸序列的氨基末端向HMGR的氨基末端的第2位的氨基酸)为脯氨酸以外的氨基酸、(c)Lα2氨基酸序列中第1位的氨基酸为丙氨酸(A)以外的氨基酸、(d)Lα2氨基酸序列中第6位的氨基酸为谷氨酸(E)以外的氨基酸的甲羟戊二酸单酰CoA还原酶的多核苷酸。作为本发明的多核苷酸,除所述的氨基酸外,进一步可优选例举出编码选自由(e)Sα2区域的第7位的氨基酸为异亮氨酸(I)以外的氨基酸、(f)Lα2氨基酸序列中第5位的氨基酸为异亮氨酸(I)以外的氨基酸、及(g)Sα2区域的第6位的氨基酸为丙氨酸(A)以外的氨基酸所构成的组中的一种或两种以上氨基酸的甲羟戊二酸单酰CoA还原酶的多核苷酸。
具体而言,可列举含有由序列号2所表示的碱基序列所构成的序列的多核苷酸、或含有序列号2所表示的碱基序列中1540位~3066位的碱基所构成的序列的多核苷酸。
更进一步,还可以列举,与由序列号2所表示的碱基序列构成的多核苷酸、或含有由序列号2所表示的碱基序列中1540位~3066位的碱基构成的序列的多核苷酸在严格的条件下杂交,并具有甲羟戊二酸单酰CoA还原酶活性的多核苷酸。此外,本说明书中的用语“多核苷酸”包含DNA及RNA两者。
本说明书中的“严格的条件”是指只有在序列间存在90%以上的一致性、优选为95%以上的一致性、更优选为97%以上的一致性时发生杂交。具体而言,作为严格的条件,可列举在65℃下实施一晚杂交,在室温下用2×SSC进行5分钟的清洗以去除非特异反应,然后使用含有0.1%SDS的0.2×SSC,重复两次在65℃下进行30分钟的清洗等。2×SSC的组成为0.3mol/L NaCl及30mmol/L柠檬酸钠(pH7.0).
[3]微生物
本发明的微生物为具有本发明的多核苷酸的微生物。即,只要在细胞内含有本发明的多核苷酸,则没有特别限定,例如可列举大肠菌、枯草菌、放线菌、面包酵母或链孢霉。
[4]载体
本发明的载体为含有具有本发明的多核苷酸的DNA的载体。即,本发明的载体只要含有本发明的所述多核苷酸,则没有特别限定,例如可列举在根据所用的宿主细胞而适当选择的公知的表达载体中,通过插入本发明的所述多核苷酸而获得的载体。
作为表达载体,优选在作为宿主的大肠菌、面包酵母等中可独立复制或可整合到染色体中、外来蛋白质的表达效率高的表达载体。用于使所述多核苷酸表达的表达载体优选为在微生物中可独立复制的同时,由启动子、核糖体结合序列、所述DNA及转录终止序列所构成的重组载体。此外,也可以含有控制启动子的基因。
更具体而言,作为表达载体,例如可列举pBTrp2、pBTac1、pBTac2(均由Boehringer Mannheim社市售)、pKK233-2(Pharmacia社制)、pSE280(Invitrogen社制)、pGEMEX-1(Promega社制)、pQE-8(QIAGEN社制)、pQE-30(QIAGEN社制)、pKYP10(特开昭58-110600)、pKYP200〔Agricultural Biological Chemistry,48,669(1984)〕、pLSA1[.Agric.Biol.Chem,53,277(1989)]、pGEL1[Proc.Natl.Acad.Sci.USA,82,4306(1985)]、pBluescriptII SK+,pBluescriptII SK(-)(Stratagene社制)、pTr S30(FERMBP-5407),pTrS 32(FERM BP-5408),pGEX(Pharmacia社制)、pET-3(Novagen社制)、pTerm2(US4686191,US4939094,US5160735)、pSupex、pUB110、pTP5、pC194、pUC18[gene,33,103(1985)]、pUC19[Gene,33,103(1985)]、pSTV28(宝酒造社制)、pSTV29(宝酒造社制)、pUC118(宝酒造社制)、pPA1(特开昭63-233798号公报)、pEG400[J.Bacteriol.,172,2392(1990)]等。
作为启动子,只要能在作为宿主的大肠菌、面包酵母等中进行表达则可以为任意。例如可列举出trp启动子(Ptrp)、lac启动子(Plac)、PL启动子、PR启动子、PSE启动子等来自大肠菌或噬菌体等的启动子,SPO1启动子、SPO2启动子、penP启动子等。或也可以使用诸如将2个Ptrp串联的启动子(Ptrpx2)、tac启动子、letI启动子、lacT7启动子等经人工设计改变的启动子等。在本发明中,在上述启动子中,更优选与组织无关而经常使目的基因表达的启动子,即组成性启动子。作为组成性启动子,可列举醇脱氢酶1基因(ADH1)、翻译延伸因子TF-1α基因(TEF1)、磷酸甘油酸激酶基因(PGK1)、磷酸丙糖异构酶基因(TPI1)、磷酸丙糖脱氢酶基因(TDH3)、丙酮酸激酶基因(PYK1)的启动子。
[5]转化体
本发明的转化体只要含有本发明的所述多核苷酸,则没有特别限定,例如,可以是本发明的所述多核苷酸整合到宿主细胞染色体中的转化体,或者可以是以含有本发明的所述多核苷酸的载体的形式而包含的转化体。此外,也可以是表达本发明的多肽的转化体,或者也可以是不表达本发明的多肽的转化体。本发明的转化体例如可以通过本发明的所述载体、或通过本发明的所述多核苷酸其自身、通过转化所希望的宿主细胞而得到。
宿主细胞没有特别限定,优选大肠菌、枯草菌、放线菌、酵母、链孢霉等容易操作的菌株,也可使用昆虫细胞、植物细胞、动物细胞等。但最优选酵母。作为最优选的酵母菌株,可列举清酒酵母。特别优选列举出清酒酵母协会7号或701号。协会701号酵母为从协会7号培育的无泡酵母,特长在于不形成高泡,其他性质则相同。
[6]类萜的制备方法及角鲨烯的制备方法
通过对以表达载体转化的宿主细胞进行培养,可制备类萜或角鲨烯。例如,若对酵母记载,酵母可通过通常使用的YPD培养基等进行培养。将通过同源重组进行基因导入的酵母或具有表达载体的酵母进行预培养,更进一步,向YPD培养基等进行植菌,然后培养24~240小时左右,优选培养72~120小时左右。培养基中分泌的类萜或角鲨烯可直接提纯使用,或通过公知的方法提纯使用。细胞中积累的类萜或角鲨烯可通过以下方式获得。即可通过常用技术例如细胞的酶处理、超声波将细胞破碎后用适当的有机溶剂提取,更进一步,可通过使用离心分离、各种层析法等进行提纯。
根据本发明可通过提高在类萜生物合成路径中位于上游的HMGR的活性而有效地生产各种类萜化合物,其中,可特别有效地生产角鲨烯,进一步可特别有效地生产经由角鲨烯而生物合成的麦角固醇、胆固醇等各种固醇化合物等。
实施例
以下,通过实施例对本发明进行具体说明,但本发明并不受其所限。
《实施例1:HMGR基因的克隆》
在本实施例中,进行HMGR基因的克隆。
使用含有ML-236B的培养基对酵母(扣囊复膜酵母菌(Saccharomycopsis fibuligera))进行培养,从所得到的ML-236B耐性菌株中获得HMGR基因(以下,有时将该从ML-236B耐性菌株中得到的HMGR基因称为“ADK4653”或“ADK4653基因”)。
(1)来自ML-236B耐性菌株的全长HMGR的获得
将ML-236B耐性菌株的基因组DNA作为模版,通过PCR法扩增HMGR基因。基因组DNA的制备通过Zymolyase 20T(Kirinkyowa-foods社)消化细胞壁后用常规方法进行,使用NucleoBond AXG 20柱(MACHEREY-NAGEL社)进行提纯,PCR使用PrimeSTAR Max DNA聚合酶(takara-bio社)、下述引物(序列号3及4)、热循环仪(TP240,takara-bio社)进行。
5′-AATCAACTGGTACCCGGGATGTTTAGCCTTAGTAATTATGT-3′
(序列号3)
5′-TTAGTTAACCTCTAGAGCTCTTAAGATTTGATACAGATCTTTGA-3′
(序列号4)
PCR以3步骤的反应(98℃:10秒,55℃:5秒,72℃:15秒)进行35次循环。在引物的5’末端上加成克隆中使用的载体的克隆位点的同源序列。PCR产物在通过琼脂糖凝胶电泳确认有无目标尺寸的DNA及额外带之后,使用NucleoSpin Gel and PCR Clean-up柱(MACHEREY-NAGEL社)进行提纯。
(2)表达载体的构筑
在克隆中使用表达用载体pAUR123(takara-bio社)。载体经限制酶(SacI,takara-bio社)及限制酶(SmaI,takara-bio社)处理后,通过琼脂糖凝胶电泳切取目标DNA片段,使用NucleoSpin Gel and PCR Clean-up柱(MACHEREY-NAGEL社)进行提纯。对HMGR基因的载体的克隆则使用GeneArt Seamless Cloning and Assembly Enzyme Mix(Inbitrogen社),按照操作说明书进行反应。反应液直接通过大肠菌感受态细胞(HST08,takara-bio社)进行转化而使用。阳性克隆在确认通过菌落PCR导入目标基因之后,使用NucleoSpin质粒(MACHEREY-NAGEL社)制备质粒。菌落PCR使用TaKaRa Ex Taq(takara-bio社)、引物(序列号5及6)。用小片或牙签拾取极微量的通过转化而得到的大肠菌菌落,将其悬浊于PCR反应液中。PCR反应在94℃下进行1分钟的变性处理后,在进行30循环的由98℃:10秒、61℃:30秒、72℃:3分钟构成的反应工序后,在72℃下附加3分钟的扩展反应。在PCR后,通过琼脂糖凝胶电泳确认有无插入,获得ML-236B耐性菌株的全长HMGR(以下有时称作“ADK4653_HMGR”)表达载体
5′-TCTGCACAATATTTCAAGC-3′
(序列号5)
5′-TTCGTTTTAAAACCTAAGAGTCAC-3′
(序列号6)
(3)缩短型HMGR(tHMGR)基因的克隆
以上述ML-236B耐性菌株的基因组DNA作为模版,通过PCR法扩增缩短型HMGR基因。基因组DNA的制备为,通过常用方法提取DNA后,使用NucleoBond AXG20柱(MACHEREY-NAGEL社)提纯。PCR使用PrimeSTAR Max DNA聚合酶(takara-bio社),3步骤的反应(98℃:10秒,55℃:5秒,72℃:10秒)进行35次循环。PCR引物使用序列号7及8。
5′-AATCAACTGGTACCCGGGATGTCTCAACGTCTTAGCAAGGCTAT T-3′
(序列号7)
5′-TTAGTTAACCTCTAGAGCTCTTAAGATTTGATACAGATCTTTGA-3′
(序列号8)
在引物的5’末端加成克隆中使用的载体的克隆位点的同源序列。
PCR产物在通过琼脂糖凝胶电泳确认后,使用NucleoSpin Gel and PCR Clean-up柱(MACHEREY-NAGEL社)进行提纯。在克隆中使用表达用载体pAUR123(takara-bio社),通过GemeArt Seamless Clonig and Assembly Enzyme Mix(Inbitrogen社)进行反应。反应液直接通过大肠菌感受态细胞(HST08,takara-bio社)的转化而使用。阳性克隆在确认通过菌落PCR导入目标基因后,使用NucleoSpin质粒(MACHEREY-NAGEL社)制备质粒。通过序列解析确认在克隆的缩短型HMGR基因中不含有PCR反应造成的错误。序列解析以提纯的质粒为模版,使用序列号5及6所示的引物通过DNA序列分析仪(Applied Biosystems社,3730xl)进行分析,获得ML-236B耐性菌株的缩短型HMGR(以下有时称作“ADK4653_tHMGR”)的表达载体。
《比较例1》
在本比较例中从清酒酵母中进行缩短型HMGR(tHMGR)基因的克隆。
除了使用清酒酵母(Saccharomycescerevisiae协会701号)替代ML-236B耐性菌株,及使用作为引物的序列号9及10的引物以外,重复实施例1(3)的操作,构筑清酒酵母的缩短型HMGR(以下有时称作“K701_tHMGR”)的表达载体。
5′-AATCAACTGGTACCCGGGATGGACCAATTGGTGAAAACT-3′
(序列号9)
5′-TTAGTTAACCTCTAGAGCTCTTAGGATTTAATGCA-3′
(序列号10)
《实施例2》
在本实施例中,使用实施例1(2)中得到的载体,得到酵母的转化体。使用该转化体,进行甲羟戊酸的生产及角鲨烯或麦角固醇的生产。
(1)酵母的转化
使用在实施例1(2)中得到的全长HMGR表达载体,转化清酒酵母(酿酒酵母菌协会701号)。载体预先通过限制酶(EcoO65I(BstEII,BstPI),takara-bio社)在抗性标记基因内的一处切断,通过以直链状使用,进行基于同源重组的基因导入。即在与作为载体的抗性标记的金黄担子素抗性基因(AUR-C)表现出一致性的宿主酵母的感受性基因部位上,引发同源重组,在宿主酵母的感受性基因部位插入载体基因。酵母的转化使用冷冻-EZ酵母转化(Frozen-EZ Yeast Transformation)II(ZYMO RESARCH社),以作为常用方法的醋酸锂法为标准的方法进行。转化体以含有0.5μg/mL抗生素(金黄担子素A,takara-bio社)的YPD培养基进行选拔。所得到的克隆确认通过菌落PCR导入目标基因。在菌落PCR中使用Tks Gflex DNA聚合酶(takara-bio社)、引物(序列号5及6)。拾取极微量酵母菌落,在细胞壁消化酶液(Zymolyase 20T,Kirinkyowa-foods社,3mg/mL,pH7.4)中悬浊,在37℃下反应15分钟,消化细胞壁。将酶处理反应液作为模版DNA进行PCR反应。PCR反应在94℃下进行1分钟的变性处理后,进行30次循环由98℃:10秒、60℃:15秒、68℃:90秒构成的反应工序后,在68℃下附加2分钟的扩展反应。在PCR后通过琼脂糖凝胶电泳确认插入。
(2)甲羟戊酸、角鲨烯或麦角固醇的产生的确认
ADK4653基因通过表达用载体pAUR123(takara-bio社)的构成表达启动子(ADH1基因的启动子)进行组成性表达。通过测定作为该路径代谢产物的甲羟戊酸、角鲨烯或麦角固醇,确认到除了清酒酵母本来具有的HMGR基因之外,通过经转化导入的ADK4653基因的过剩表达,甲羟戊酸路径增强。对照实验区将通过未插入插入片段的载体的转化而得到的转化体作为对照组。
培养使用容量500mL的带有挡板的三角烧瓶,将在50mL YPD培养基(葡萄糖5%)中添加培养基的1%量的预培养了24小时的菌体,以28℃、250rpm旋转搅拌的同时进行培养。在规定的时间中取样。甲羟戊酸、角鲨烯及麦角固醇的定量通过以下方式进行。
(甲羟戊酸的定量)
甲羟戊酸,测定培养基中分泌生产的甲羟戊酸浓度。通过直接HPLC分析培养液的离心上清。HPLC通过HITACHI社LaChrom(Column Oven L-2300,Pump L-2130,Autosampler L-2200,UV Detector L-2400),使用柱(Thermo SCIENTIFIC社,AQUASIL C18)。洗脱液为水:三乙胺:乙酸=1000:1:1的等度洗脱,设定为柱温度40℃、流量1.0mL/min,检测通过UV(210nm)分析。
(角鲨烯及麦角固醇的定量)
将菌体破碎后用氯仿-甲醇提取,测定角鲨烯、麦角固醇。将2mL培养液离心,去除上清后,以容积计向菌体中添加0.6mL用于破碎的锆珠(Nikkato社,YTZ珠,)、0.4mL甲醇,使用珠式破碎机(Taitec社,uT-12)进行5分钟粉碎(3200r/min)。向破碎液中加入0.8mL氯仿,翻倒搅拌至均匀。通过5分钟超声波处理、悬浊后,进行离心分离(16000rpm,5min),回收有机层。样本经过滤器(ADVANTEC社,DISMIC-13HP)处理后提供于HPLC分析。HPLC通过日本分光工业社的系统(JASCO Intelligent HPLC Pump 880-PU,Ternary Gradient Umit 880-02,Intelligent UV/VIS Detector 870-UV,Senshu Scientific社,SSC-2100,GL Sciences Degassing Unit DG660B),使用柱(SIGMA-ALDRICH社,SUPELCOSIL LC-18)。洗脱液为乙腈:THF=8:2的等度洗脱,设定柱温度30℃,流量1.0mL/min,检测通过UV(220nm)分析。
甲羟戊酸的产生的结果如图4所示。在使ADK4653_HMGR表达的宿主中,积累了对照组的2-2.8倍(185-355mg/L)的甲羟戊酸。
此外,角鲨烯及麦角固醇的产生的结果如图5所示的。没有确认到使ADK4653_HMGR表达的清酒酵母的麦角固醇量的显著变化。另一方面,角鲨烯的生产量表现出显著增加,可确认到甲羟戊酸路径的增强效果。
此外,图4、5的“无插入片段(no insert)”表示导入不含外部基因的pAUR123载体,不表达外部基因的条件。此外,ADK表示ADK4653。(以下的图表相同。)
《实施例3》
本实施例中,使用实施例1(3)得到的载体,获得酵母的转化体。使用该转化体,进行角鲨烯或麦角固醇的产生。
除了使用ADK4653_tHMGR表达载体替代ADK4653_HMGR表达载体之外,重复实施例2(1)及(2)的操作。其结果如图6所示。
《比较例2》
本比较例中,使用比较例1中得到的K701_tHMGR表达载体,研究角鲨烯的生产性。除了使用K701_tHMGR表达载体替代ADK4653_tHMGR表达载体之外,重复实施例3的操作,确认到角鲨烯的产生(培养时间为5天)。其结果如图6所示。
如图6所示,若使用ADK4653_tHMGR替代ADK4653_HMGR进行表达,与ADK4653_HMGR相比较,表现出12倍的角鲨烯生产性。培养基中的角鲨烯生产量达到1.66g/L,干燥菌体的生产量表现为102mg/g(10.2%)。另一方面,在比较例2的K701_tHMGR中,未确认到角鲨烯的增产效果。
所述ADK4653_HMGR及清酒酵母(酿酒酵母菌协会7号)的HMGR、人(Homo sapiens,AF273765)HMGR的氨基酸序列的比较如图7-1及图7-2所示。如图7-1及图7-2所示,在从清酒酵母得到的HMGR中,Sα2氨基酸序列的第10位的氨基酸为丙氨酸,与此相对,ADK4653_HMGR为丝氨酸。此外,在从清酒酵母得到的HMGR中,从Lα2氨基酸序列的氨基末端向HMGR的氨基末端的第2位的氨基酸为脯氨酸,与此相对,ADK4653_HMGR为丙氨酸。此外,在从清酒酵母得到的HMGR中,Lα2氨基酸序列中第1位的氨基酸为丙氨酸,第5位的氨基酸为异亮氨酸,第6位的氨基酸为谷氨酸,与此相对,在ADK4653_HMGR中分别为丝氨酸及苏氨酸及天冬酰胺。
此外,上述清酒酵母(酿酒酵母菌协会7号)与清酒酵母(酿酒酵母菌协会701号)的缩短型HMGR部分中的氨基酸序列相同。
《实施例4》
在本实施例中,对由ADK4653_tHMGR造成的角鲨烯生产量的经时变化进行了研究。
除了将培养时间设为3天、4天、5天、6天、7天或10天、或者3天、5天、7天或10天以外,重复实施例3的操作,测定角鲨烯的生产量。此外,同时测定细胞的重量变化。结果如图8所示。
在使ADK4653_tHMGR表达的酵母中,与对照组(无插入片段)相比较,表现出显著的角鲨烯生产量。此外,细胞在达到静止期3天以后的角鲨烯量的变化少,通过3天内的培养可获得充分的收益量。另一方面,麦角固醇的含量则没有确认到对照组(无插入片段)与表达缩短型的基因(ADK4653_tHMGR)的酵母的差异。
《比较例3》
在本比较例中,使用在实施例1(3)中得到的ADK4653_tHMGR表达载体,进行Lα2氨基酸序列中第1位的氨基酸的丝氨酸向丙氨酸的置换、或进行Lα2氨基酸序列中第1位的氨基酸的丝氨酸向丙氨酸的置换与第5位的氨基酸的苏氨酸向异亮氨酸的置换的组合,研究角鲨烯生产量。此外,K701_tHMGR作为比较对象(以下,比较例4~6也相同)。
角鲨烯生产量的测定通过以实施例2(2)为基准的方法进行。培养为使用带隔板的三角烧瓶,在YPD培养基(葡萄糖5%)中添加经预培养的菌体,以28℃、250rpm进行旋转搅拌同时进行培养。在2天的培养后,回收培养菌体,测定角鲨烯产量。
以所述ADK4653_tHMGR表达载体作为模版,导入氨基酸置换突变。具体而言,制备将Lα2区域的第1位的氨基酸由丝氨酸置换为丙氨酸的S820A载体,及将第1位的氨基酸由丝氨酸置换为丙氨酸、第5位的氨基酸由苏氨酸置换为异亮氨酸的S820A/T824I载体。将得到的S820A载体或S820A/T824I载体导入到作为宿主的清酒酵母,获得过剩表达的S820A菌株或S820A/T824I菌株。将各自菌株的角鲨烯产量作为指标,比较甲羟戊酸路径的增强效果。结果如图9所示。角鲨烯的产量以每组培养液的生产量为基础,将不导入突变的ADK4653_tHMGR的产量设为100%,以相对值表示(图10~图16也相同)。
此外,导入了突变的表达载体的制备以使用PrimeSTAR DNA聚合酶(takara-bio社),通过PCR法按照操作说明书(PrimeSTAR Mutagenesis Basal Kit产品编码R046A)进行。用灭菌蒸馏水稀释导入突变的质粒,以使反应液中为2pg/μL的方式添加。以使最终浓度为0.2μM的方式添加引物,PCR以3步骤(98℃:10秒、55℃:15秒、72℃:45秒)进行40次循环,通过琼脂糖凝胶电泳确认到目标尺寸的扩增产物。向20μL感受态细胞(JM109,takara-bio社)中添加0.4μL PCR反应液,进行转化。从通过转化得到的大肠菌中提纯导入有突变的质粒,解析编码HMGR的结构基因的碱基序列。通过碱基序列的解析,验证突变导入的正确性(作为目标的突变被导入、不存在不想要的PCR错误)。通过导入了突变的表达载体,对作为宿主的清酒酵母实施转化,解析角鲨烯的生产性。突变导入用引物以合成下述的引物进行使用(序列号11、12、15及16)。
在Lα2氨基酸序列中第1位的氨基酸的丝氨酸置换为丙氨酸的情况下,角鲨烯产量降低,在同时置换2个氨基酸的突变体中,几乎不表现高生产性。
由以上结果可知,与HMG-CoA结合部位相邻的模体(Lα2)上存在的丝氨酸及苏氨酸,是与角鲨烯的高生产性相关的重要的氨基酸残基。突变酶(S820A)
5′-GCCATTAACTGGACCAATGGTCGTGGTAAGAGT-3′
(序列号11)
5′-GGTCCAGTTAATGGCAGCGGCTTTCTTATCAGT-3′
(序列号12)
突变酶(S820A/T824I)
5′-GCCATTAACTGGATCAATGGTCGTGGTAAGAGT-3′
(序列号15)
5′-GATCCAGTTAATGGCAGCGGCTTTCTTATCAGT-3′
(序列号16)
《比较例4》
在本比较例中,使用由实施例1(3)得到的ADK4653_tHMGR表达载体,将Sα2氨基酸序列在第10位的氨基酸由丝氨酸置换为丙氨酸,研究角鲨烯产量。培养为重复比较例3的操作,之后测定角鲨烯的产量。结果如图10所示。其结果,在将第10位的氨基酸由丝氨酸置换为丙氨酸的突变体中,几乎未表现出高生产性。
突变酶(S744A)
5′-TGAAAAAAGCTTTCAATTCTACTTCTA-3′
(序列号17)
5′-ATTGAAAGCTTTTTTCAACAAGTTTTG-3′
(序列号18)
《比较例5》
在本比较例中使用在实施例1(3)中得到的ADK4653_tHMGR表达载体将位于HMG-CoA结合位点与Lα2之间的第818位的氨基酸由丙氨酸置换为脯氨酸,研究角鲨烯产量。培养除了将培养时间设定为3天以外,重复比较例3的操作,之后测定角鲨烯的产量。结果如图11所示。其结果,在将第818位的氨基酸由丙氨酸置换为脯氨酸的突变体中,几乎未表现出高生产性。
突变酶(A818P)
5′-TGATAAGAAACCAGCTTCTATTAACTG-3′
(序列号19)
5′-GCTGGTTTCTTATCAGTACAGTAGTTA-3′
(序列号20)
《比较例6》
在本比较例中,使用实施例1(3)中得到的ADK4653_tHMGR表达载体,将第825位的氨基酸由天冬酰胺置换为谷氨酸,研究角鲨烯产量。培养除了将培养时间设定为3天以外,重复比较例3的操作,之后测定角鲨烯的产量。结果如图12所示。其结果,将第825位的氨基酸由天冬酰胺置换为谷氨酸的突变体中,几乎未表现出高生产性。
突变酶(N825E)
5′-TGGACCGAAGGTCGTGGTAAGAGTATTG-3′
(序列号21)
5′-ACGACCTTCGGTCCAGTTAATAGAAGCG-3′
(序列号22)
《实施例5》
在本实施例中,使用比较例1中得到的K701_tHMGR表达载体,向构成Sα2区域的氨基酸的3个残基、位于HMG-CoA结合位点与Lα2区域之间的氨基酸的1个残基及构成Lα2区域的氨基酸的3个残基中导入突变,制备突变酶,研究角鲨烯产量。
以下,对突变导入进行具体说明。此外,本实施例中对突变部位进行特定的号以图7-1及图7-2所示的清酒酵母(酿酒酵母菌协会7号)的序列号进行代用。如上所述,虽然本申请中使用的是清酒酵母(酿酒酵母菌协会701号),但由于活性部位(缩短型HMGR部分)的氨基酸序列与清酒酵母(酿酒酵母菌协会7号)相同,因此在本申请中用于位置特定。
如图7-1及图7-2所示,清酒酵母(酿酒酵母菌协会701号)的Sα2区域的氨基酸序列为EEGQNAIKKAFN,HMG-CoA结合位点~Lα2区域的氨基酸序列为DKKPAAINWIE。
在K701_tHMGR表达载体中,以使Sα2区域的氨基酸序列为EEGQNLLKKSFN,且使HMG-CoA结合位点~Lα2区域的氨基酸序列为DKKAASINWTN的方式导入氨基酸置换突变。即,将存在于Sα2区域的第6位的丙氨酸(第772位)置换为亮氨酸,将存在于Sα2区域的第7位的异亮氨酸(第773位)置换为亮氨酸,将存在于Sα2区域的第10位的丙氨酸(第776位)置换为丝氨酸。并在HMG-CoA结合位点之后,将存在于从Lα2区域的氨基末端向HMGR的氨基末端的第2位的脯氨酸(第850位)置换为丙氨酸,更进一步将存在于Lα2区域的第1位的丙氨酸(第852位)置换为丝氨酸,将存在于Lα2区域的第5位的异亮氨酸(第856位)置换为苏氨酸,将存在于Lα2区域的第6位的谷氨酸(第857位)置换为天冬酰胺。
氨基酸置换突变的导入以所述K701_tHMGR表达载体作为模版,使用与比较例3相同的方法,在重复改变引物的操作的同时,通过导入顺序突变,构筑置换了7个氨基酸残基的载体。突变导入用引物将下述的引物合成而使用(序列号23~32)。
将构筑的载体导入到作为宿主的清酒酵母中,获得K701_突变型菌株,将各菌株的角鲨烯产量作为指标,比较甲羟戊酸路径的增强效果。角鲨烯产量的测定通过以实施例2(2)为基准的方法进行。培养则使用带挡板的三角烧瓶,向YPD培养基(葡萄糖5%)添加经过预培养的菌体,在28℃、250rpm下进行旋转搅拌的同时进行培养。在2天培养后,回收培养菌体,测定角鲨烯产量。此外,将ADK4653_tHMGR及K701_tHMGR作为比较对象。结果如图13所示。使置换了7个残基的氨基酸的突变酶进行表达的酵母的角鲨烯产量,与K701_tHMGR相比显著增加,表现出与ADK4653_tHMGR同等的产量。
从以上结果可知,与NADP(H)结合部位相邻的模体(Sα2)及与HMG-CoA结合部位相邻的模体(Lα2)附近所存在的7个残基的氨基酸,是与角鲨烯的高生产性相关的重要氨基酸,通过导入了该突变的突变酶的表达,使甲羟戊酸路径的增强变为可能。
突变酶(K701_突变型:A852S/I856T)
5′-TCTATCAACTGGACCGAAGGTCGTGGTAAGAGT-3′
(序列号23)
5′-GGTCCAGTTGATAGAAGCTGGTTTTTTGTCGGT-3′
(序列号24)
突变酶(K701_突变型:A776S)
5′-AAAAAATCATTTAACTCTACATCAAGA-3′
(序列号25)
5′-GTTAAATGATTTTTTAATTTGCGTTTTG-3′
(序列号26)
突变酶(K701_突变型:E857N)
5′-TGGACCAATGGTCGTGGTAAGAGTGTC-3′
(序列号27)
5′-ACGACCATTGGTCCAGTTGATAGAAGC-3′
(序列号28)
突变酶(K701_突变型:P850A)
5′-CGACAAAAAAGCCGCTTCTATCAACTG-3′
(序列号29)
5′-GCGGCTTTTTTGTCGGTACAGTAGTTA-3′
(序列号30)
突变酶(K701_突变型:A772L/I773L)
5′-AAAACTTGTTGAAAAAATCATTTAACTC-3′
(序列号31)
5′-TTTTCAACAAGTTTTGTCCCTCTTCTG-3′
(序列号32)
《实施例6》
在本实施例中,使用实施例1(3)中得到的ADK4653_tHMGR表达载体,Lα2氨基酸序列中第5位氨基酸的苏氨酸置换为异亮氨酸,研究角鲨烯产量。
作为突变导入用引物,除了使用下述的序列号13及14的引物以外,重复比较例3的操作,得到T824I载体。将T824I载体导入清酒酵母,获得T824I菌株。以角鲨烯产量作为指标,比较甲羟戊酸路径的增强效果。结果如图9所示。
在Lα2氨基酸序列中第5位氨基酸的苏氨酸置换为异亮氨酸的情况下,角鲨烯产量为ADK4653_tHMGR的50.3%,但与K701_tHMGR相比显著提高。
突变酶(T824I)
5′-TCTATTAACTGGATCAATGGTCGTGGTAAGAGT-3′
(序列号13)
5′-GATCCAGTTAATAGAAGCGGCTTTCTTATCAGT-3′
(序列号14)
《实施例7及8》
在本实施例中,使用实施例1(3)中得到的ADK4653_tHMGR表达载体,将第740位的氨基酸由亮氨酸置换为丙氨酸,或将第741位的氨基酸由亮氨酸置换为异亮氨酸,测定角鲨烯产量。突变的导入通过与比较例3相同的方法,使用下述的引物进行。
培养为重复比较例3的操作,测定角鲨烯的产量。结果如图14所示。其结果,在将第740位的氨基酸由亮氨酸置换为丙氨酸的情况下,角鲨烯产量为ADK4653_tHMGR的54.2%,但与K701_tHMGR相比显著提高。此外,在将第741位的氨基酸由亮氨酸置换为异亮氨酸的情况下,角鲨烯产量为ADK4653_tHMGR的18.8%,但与K701_tHMGR相比显著提高。
突变酶(L740A)
5′-AAAACGCATTGAAAAAATCATTCAATTC-3′
(序列号33)
5′-TTTTCAATGCGTTTTGACCTTCTTCAGTA-3′
(序列号34)
突变酶(L741I)
5′-ACTTGATTAAAAAATCATTCAATTCTA-3′
(序列号35)
5′-ATTTTTTAATCAAGTTTTGACCTTCTTCA-3′
(序列号36)
《实施例9》
在本实施例中,使用在比较例1中得到的K701_tHMGR表达载体,除了将向构成Sα2区域的氨基酸中导入的突变由3个残基变为2个残基以外,以与实施例5相同的方式制备突变酶,研究角鲨烯产量(对突变部位进行特定的序号的定义与实施例5相同。)
即,在K701_tHMGR表达载体中,以使Sα2区域的氨基酸序列为EEGQNALKKSFN、且HMG-CoA结合位点~Lα2区域的氨基酸序列为DKKAASINWTN的方式导入氨基酸置换突变。即,将存在于Sα2区域的第7位的异亮氨酸(第773位)置换为亮氨酸,将存在于Sα2区域的第10位的丙氨酸(第776位)置换为丝氨酸。且在HMG-CoA结合位点之后,将存在于从Lα2区域的氨基末端向HMGR的氨基末端的第2位的脯氨酸(第850位)置换为丙氨酸,更进一步,将存在于Lα2区域的第1位的丙氨酸(第852位)置换为丝氨酸,将存在于Lα2区域的第5位的异亮氨酸(第856位)置换为苏氨酸,将存在于Lα2区域的第6位的谷氨酸(第857位)置换为天冬酰胺。
氨基酸置换突变的导入以所述K701_tHMGR表达载体为模版,以与比较例3相同的方法,重复改变引物的操作,通过导入顺序突变,构筑置换了6个残基的氨基酸的载体。突变导入用引物使用在实施例5中所使用的引物(序列号23~30),及将下述的引物进行合成而使用(序列号37~38)。
将所构筑的载体导入到作为宿主的清酒酵母中,获得K701_突变型2菌株。将各菌株的角鲨烯产量作为指标,比较甲羟戊酸路径的增强效果。角鲨烯产量的测定使用以实施例2(2)为基准的方法进行。培养则使用带挡板的三角烧瓶,向YPD培养基(葡萄糖5%)添加经过预培养的菌体,在28℃、250rpm下进行旋转搅拌的同时进行培养。在2天培养后,回收培养菌体,将ADK4653_tHMGR、K701_tHMGR作为比较对象,测定角鲨烯产量。结果如图15所示。对置换了6个残基的氨基酸的突变酶(K701_突变型2)进行表达的酵母的角鲨烯产量与K701_tHMGR相比显著增加。
突变酶(K701_突变型:I773L)
5′-ACGCATTGAAAAAATCATTTAACTCTA-3′
(序列号37)
5′-ATTTTTTCAATGCGTTTTGTCCCTCTTC-3′
(序列号38)
《实施例10》
在本实施例中,使用在比较例1中得到的K701_tHMGR表达载体,除了将构成Sα2区域的氨基酸中导入的突变由3个残基变为2个残基,且构成Lα2区域的氨基酸中导入的突变由3个残基变为2个残基以外,以与实施例5相同的方式制备突变酶,研究角鲨烯产量(对突变部位进行特定的序号的定义与实施例5相同。)。
即,在K701_tHMGR表达载体中,以使Sα2区域的氨基酸序列为EEGQNALKKSFN,且HMG-CoA结合位点~Lα2区域的氨基酸序列为DKKAASINWIN的方式导入氨基酸置换突变。即,将存在于Sα2区域的第7位的异亮氨酸(第741位)置换为亮氨酸,将存在于Sα2区域的第10位的丙氨酸(第776位)置换为丝氨酸。且在HMG-CoA结合位点之后,将存在于从Lα2区域的氨基末端向HMGR的氨基末端的第2位的脯氨酸(第850位)置换为丙氨酸,更进一步,将存在于Lα2区域的第1位的丙氨酸(第852位)置换为丝氨酸,将存在于Lα2区域的第6位的谷氨酸(第857位)置换为天冬酰胺。
突变导入为,通过所述引物(序列号23~29及37~38)导入突变,更进一步,通过下述的引物(序列号39~40)导入回复突变。
氨基酸置换突变的导入以所述K701_tHMGR表达载体作为模版,以与比较例3相同的方法,重复改变引物的操作,同时导入顺序突变,由此构筑置换了5个残基的氨基酸的载体。
将构筑的载体导入到作为宿主的清酒酵母中,获得K701_突变型3菌株。将各菌株的角鲨烯产量作为指标,比较甲羟戊酸路径的增强效果。角鲨烯产量的测定使用以实施例2(2)为基准的方法进行。培养则使用带挡板的三角烧瓶,向YPD培养基(葡萄糖5%)添加经过预培养的菌体,在28℃、250rpm下进行旋转搅拌的同时进行培养。在2天培养后,回收培养菌体,以ADK4653_tHMGR、K701_tHMGR作为比较对象测定角鲨烯产量。结果如图16所示。使置换了5个残基的氨基酸的突变酶(K701_突变型3)进行表达的酵母的角鲨烯产量与K701_tHMGR相比明显增加。
突变酶(K701_突变型:T856I)
5′-AACTGGATCAATGGTCGTGGTAAGAGT-3′
(序列号39)
5′-ACCATTGATCCAGTTGATAGAAGCGGC-3′
(序列号40)
《实施例11》
在本实施例中,使用比较例1中得到的K701_tHMGR表达载体,除了将向构成Lα2区域的氨基酸中导入的突变由3个残基变为2个残基以外,以与实施例5相同的方式制备突变酶,研究角鲨烯产量(对突变部位进行特定的序号的定义与实施例5相同。)。即,在K701_tHMGR表达载体中,以使Sα2区域的氨基酸序列为EEGQNLLKKSFN,且HMG-CoA结合位点~Lα2区域的氨基酸序列为DKKAASINWIN的方式导入氨基酸置换突变。即,将存在于Sα2区域的第6位的丙氨酸(第772位)置换为亮氨酸,将存在于Sα2区域的第7位的异亮氨酸(第773位)置换为亮氨酸,将存在于Sα2区域的第10位的丙氨酸(第776位)置换为丝氨酸。且在HMG-CoA结合位点之后,将存在于从Lα2区域的氨基末端向HMGR的氨基末端的第2位的脯氨酸(第850位)置换为丙氨酸,更进一步,将存在于Lα2区域的第1位的丙氨酸(第852位)置换为丝氨酸,将存在于Lα2区域的第6位的谷氨酸(第857位)置换为天冬酰胺。
氨基酸置换突变的导入以所述K701_tHMGR表达载体作为模版,通过与比较例3相同的方法,重复改变引物的操作,通过导入顺序突变构筑置换了6个残基的氨基酸的载体。
突变导入为通过所述引物(序列号23~32)导入突变,更进一步,通过上述引物(序列号39~40)导入回复突变。
将构筑的载体导入到作为宿主的清酒酵母中,获得K701_突变型4菌株。将各菌株的角鲨烯产量作为指标,比较甲羟戊酸路径的增强效果。角鲨烯产量的测定使用以实施例2(2)为基准的方法进行。培养则使用带挡板的三角烧瓶,向YPD培养基(葡萄糖5%)添加经过预培养的菌体,在28℃、250rpm下进行旋转搅拌的同时进行培养。在2天培养后,回收培养菌体,以ADK4653_tHMGR、K701_tHMGR作为比较对象,测定角鲨烯产量。结果如图16所示。使置换了6个残基的氨基酸的突变酶(K701_突变型4)进行表达的酵母的角鲨烯产量与K701_tHMGR相比明显增加。
将实施例3及5~11、以及比较例2~6的(a)~(g)的位置的氨基酸(来自ADK4653_tHMGR或K701_tHMGR的氨基酸的置换)及ADK4653_tHMGR设为100时,各实施例及比较例的角鲨烯的产量的相对值总结于表1。此外,氨基酸以直线表示。
[表1]
表中的网线的氨基酸表示K701_tHMGR的氨基酸。
(a)Sα2区域的第10位:ADK4653_tHMGR的第744位氨基酸、K701_tHMGR的第776位氨基酸
(b)DKK区域的C末端的第1位:ADK4653_tHMGR的第818位氨基酸、K701_tHMGR的第850位氨基酸
(c)Lα2区域的第1位:ADK4653_tHMGR的第820位氨基酸、K701_tHMGR的第852位氨基酸
(d)Lα2区域的第6位:ADK4653_tHMGR的第825位氨基酸、K701_tHMGR的第857位氨基酸
(e)Sα2区域的第7位:ADK4653_tHMGR的第741位氨基酸、K701_tHMGR的第773位氨基酸
(f)Lα2区域的第5位:ADK4653_tHMGR的第824位氨基酸、K701_tHMGR的第856位氨基酸
(g)Sα2区域的第6位:ADK4653_tHMGR的第740位氨基酸、K701_tHMGR的第772位氨基酸
由比较例2及实施例3可知,与K701_tHMGR(a=A、b=P、c=A、d=E、e=I、f=I、g=A)相比,(a)、(b)、(c)、(d)、(e)、(f)及(g)位置的7个氨基酸不同的ADK4653_tHMGR(a=S、b=A、c=S、d=N、e=L、f=T、g=L)的角鲨烯的产量显著优异。更进一步,由实施例5可知,通过将K701_tHMGR的(a)、(b)、(c)、(d)、(e)、(f)及(g)位置的7个氨基酸置换为ADK4653_tHMGR的7个氨基酸,角鲨烯的产量的相对值为92.1,与ADK4653_tHMGR基本相同。ADK4653_tHMGR与K701_tHMGR的氨基酸序列长度也不同,缩短型HMGR(tHMGR)的氨基酸序列的同一性为78%。令人感到惊讶的是,K701_tHMGR的氨基酸中,仅通过将7个碱基的氨基酸置换为ADK4653_tHMGR的氨基酸,角鲨烯的产量与ADK4653_tHMGR相同。即认为,在甲羟戊二酸单酰CoA还原酶的角鲨烯的生产中,所述(a)、(b)、(c)、(d)、(e)、(f)及(g)位置的7个氨基酸起到了重要的作用。
更进一步,由比较例3~比较例6的结果可知,若将ADK4653_tHMGR的(a)、(b)、(c)及(d)位置的氨基酸的任意一个置换为K701_tHMGR的氨基酸,角鲨烯的产量的相对值为0~13.9,急剧下降。即认为,所述(a)、(b)、(c)及(d)位置的氨基酸尤其在甲羟戊二酸单酰CoA还原酶的角鲨烯的生产是重要的。
此外,由实施例6~11的结果可知,(e)、(f)及(g)位置的3个氨基酸的任意一个为K701_tHMGR的氨基酸的情况下,角鲨烯的产量的相对值为18.2~54.2。即,与(a)、(b)、(c)及(d)位置的氨基酸相比,(e)、(f)及(g)位置的氨基酸即使为K701_tHMGR的氨基酸,仍表现出高的角鲨烯的生产性。
工业实用性
根据本发明,在类萜化合物的生产中,能够提高甲羟戊酸的产生及角鲨烯的产生。因此,通过本发明而得到的甲羟戊酸及角鲨烯,可用作例如医药品的生产原料。
以上根据特定的形态对本发明进行了说明,本领域技术人员的显而易见的变形或改良也包含在本发明的范围内。
- 还没有人留言评论。精彩留言会获得点赞!