分离、培养和遗传工程改造用于过继治疗的免疫细胞群的方法与流程
本申请要求2014年4月23日提交的美国临时专利申请号61/983,415的优先权,通过引用将该申请的内容全文纳入本文。
通过引用纳入序列表
本申请与电子格式的序列表一同提交。所提供的序列表名称为735042000240seqlist.txt,创建于2015年4月22日,其文件大小为13kb。该序列表的电子格式的信息通过引用其全文纳入本文。
技术领域
本发明在一些方面中涉及方法、细胞,和用于制备细胞的组合物,以及用于遗传工程改造和细胞治疗的组合物。在一些实施方式中,提供流线式细胞制备方法,例如,用于细胞和细胞群的分离、处理、孵育和遗传工程改造。还提供通过所述方法产生的细胞和组合物,及其使用方法。所述细胞可包括免疫细胞,例如T细胞,并且一般包括多种分离的T细胞群或T细胞亚型。在一些方面中,所述方法能够制备多种不同的细胞群用于过继治疗,相比其它方法,其采用较少的步骤和/或资源和/或减少的处理。
背景
多种方法可用于制备细胞供于治疗应用。例如,多种方法可用于分离、处理和工程改造细胞,包括T细胞和其它免疫细胞。多种方法可用于分离所述细胞并表达遗传工程改造的抗原受体,例如高亲和性T细胞受体(TCR)和嵌合抗原受体(CAR)。多种方法可用于过继性转移所述细胞进入对象。需要改善的方法来制备(例如,分离、处理、培养和工程改造)细胞以用于细胞治疗。具体而言,需要用于制备和工程改造细胞(例如多种分离的细胞类型或亚型)的方法,所述方法具有改善的效率、安全性、变异性和资源保护。提供满足此类需求的方法、细胞、组合物、试剂盒和系统。
概述
提供用于制备和工程改造细胞和细胞群的方法,以及通过该方法产生的细胞和组合物。在一些实施方式中,所述细胞可用于免疫治疗,例如与过继免疫治疗方法联用。在一些方面中,所提供的方法包括:从相同起始样品(例如单一样品,例如单一单采样品、白细胞去除术样品或包含外周血单核细胞(PBMC)的样品)分离、选择或富集CD4+和CD8+细胞或其亚群。在一些实施方式中,所述方法包括在单一处理流中选择或富集至少两种细胞的群,例如CD4+细胞群和CD8+群,其中,没有从该处理中的CD4+或CD8+之一的第一选择或富集中弃去阴性部分样品,然后进行针对CD4+或CD8+细胞中另一者的第二选择。在一些实施方式中,所述第一和第二选择可同时或依次进行。
在一些方面中,对于两种细胞的群(例如CD4+和CD8+细胞)的所述选择、富集和/或分离同时进行,例如在相同器皿中或采用相同设备进行,或作为系统或设备的部分依次进行,其中用于进行该第一和第二选择的器皿(例如柱、腔室)是操作性地连接的。在一些实施方式中,所述同时和/或依次富集或选择可作为单一处理流进行,而不需要处理作为第一和/或第二选择或富集的部分制备的任何阳性或阴性部分。在一些方面中,对于不同的群的分离、培养和/或工程改造从相同起始组合物或材料,例如从相同样品进行。
在一些实施方式中,所述方法包括:通过从包含原代人T细胞的样品中富集CD4+或CD8+细胞之一以产生第一选择群和未选择的群,来进行第一选择,和,从该未选择的群,通过富集CD4+细胞或CD8+细胞中的另一者,来进行第二选择,其中,所述方法产生包含针对CD4+细胞进行富集的细胞和针对CD8+进行富集的细胞的细胞组合物。
在一些实施方式中,所述第二选择通过如下方式进行:从通过第一选择产生的所述未选择的群富集其它T细胞亚型。因此,在一些实施方式中,本文提供的方法不同于其中来自第一选择的阴性部分被弃去的其它选择方法,相反,其作为进一步选择的基础以富集另一细胞类型。一般而言,其中,如果第一选择中富集的T细胞亚组是CD4+亚组(或其中,第一选择富集CD4+细胞),则其遵循:设计第一选择以使它不富集那些将在第二选择中富集的其它亚型的细胞。例如,在一些实施方式中,所述第一选择富集CD4+细胞且不富集CD8+细胞,并且,第二选择从回收自第一选择的阴性部分富集CD8+细胞。同样地,一般而言,如果在第一选择中富集的T细胞亚组是CD8+亚组(或其中,第一选择富集CD8+细胞),则其遵循:设计第一选择以使它不富集那些将在第二选择中富集的其它亚型的细胞。例如,在一些实施方式中,所述第一选择富集CD8+细胞且不富集CD4+细胞,并且,第二选择从回收自第一选择的阴性部分富集CD4+细胞。
在一些实施方式中,所述方法还涉及第三、第四等的进一步选择,其可从来自任何先前的选择步骤的选择的和/或非选择的群富集细胞。例如,在一些实施方式中,来自给定步骤(例如,第二选择步骤)的选择的群或未选择的群的细胞被进一步富集。例如,在一些实施方式中,选择的CD8+细胞进一步针对CD8+细胞的亚型,例如静息细胞或中心记忆细胞进行富集。
在一些实施方式中,提供用于产生遗传工程改造的T细胞的方法,其包括:(a)提供培养起始组合物,所述组合物如下产生:在封闭系统中进行第一选择,所述第一选择包括从包含原代人T细胞的样品中富集CD4+细胞和CD8+细胞之一,由此产生第一选择群和未选择的群,并且,在所述封闭系统中进行第二选择,所述第二选择包括从该未选择的群富集CD4+细胞和CD8+细胞中的另一者,由此产生第二选择群;(b)在培养器皿中于刺激条件下孵育培养起始组合物,其包含第一选择群的细胞和第二选择群的细胞,由此产生受激的细胞;和(d)将遗传工程改造的抗原受体引入(b)中产生的受激的细胞,其中所述方法由此产生输出组合物,其包含表达所述遗传工程改造的抗原受体的CD8+T细胞和CD4+T细胞。
在一些实施方式中,提供方法,其包括同时富集或选择第一和第二细胞群,例如CD4+和CD8+细胞群。在一些实施方式中,所述方法包括:在孵育组合物中,于一定条件下,使包含原代人T细胞的样品的细胞与特异性结合至CD4的第一免疫亲和试剂和特异性结合至CD8的第二免疫亲和试剂接触,由此,所述免疫亲和试剂分别特异性结合至所述样品中的细胞表面上的CD4和CD8分子,和,回收结合至第一和/或第二免疫亲和试剂的细胞,由此产生包含CD4+细胞和CD8+细胞的富集的组合物。在一些实施方式中,进行所述方法以在所述孵育组合物中包括处于次优产出浓度的第一和/或第二免疫亲和试剂的浓度,从而,该富集的组合物包含所述孵育组合物中的少于70%,少于60%,少于50%,少于40%,少于30%,少于20%或更少的总CD4+细胞,或包含所述孵育组合物中的少于70%,少于60%,少于50%,少于40%,少于30%,少于20%或更少的CD8+细胞。
在一些实施方式中,提供富集CD4+和CD8+T细胞的方法,所述方法包括提供CD4+和CD9+T细胞的富集的组合物,所述富集的组合物通过如下方式产生:在孵育组合物中,于一定条件下,使包含原代人T细胞的样品的细胞与特异性结合至CD4的第一免疫亲和试剂和特异性结合至CD8的第二免疫亲和试剂接触,由此,所述免疫亲和试剂分别特异性结合至所述样品中的细胞表面上的CD4和CD8分子;和,回收结合至第一和/或第二免疫亲和试剂的细胞,由此产生以培养物起始比(culture-initiating ratio)包含CD4+细胞和CD8+细胞的富集的组合物,其中:第一和/或第二免疫亲和试剂在所述孵育组合物中以次优产出浓度存在,由此,所述富集的组合物包含所述孵育组合物中的少于70%的总CD4+细胞和/或所述孵育组合物中的少于70%的CD8+细胞,由此产生富集CD4+和CD8+T细胞的组合物。
在所提供的实施方式中任一种的一些实施方式中,所述方法通过基于免疫亲和性的选择进行,例如,通过使细胞与特异性结合细胞表面标志物(例如CD4、CD8或其它细胞表面标志物,例如表达在原初、静息或中心记忆T细胞上的标志物)的抗体接触。在一些实施方式中,所述固体支持物是球,例如珠,例如微珠或纳米珠。在一些实施方式中,所述珠可以是磁珠。在一些实施方式中,所述固体支持物可以是柱或有效于进行柱色谱的其它器皿。
在一些实施方式中,所述抗体包含一种或多种结合伴侣,其能够与固定在固体(例如球或色谱基质)表面上的结合试剂形成可逆键,其中,所述抗体可逆固定至所述固体表面。在一些实施方式中,表达由所述固体表面上的抗体结合的细胞表面标志物的细胞能够通过如下方式从基质回收:破坏所述结合试剂和结合伴侣之间的可逆的结合。在一些实施方式中,所述结合试剂是链霉亲和素或是链霉亲和素类似物或突变体,例如SEQ ID NO:11-16中任一项所示的,或与SEQ ID NO:11-16中任一项所示的序列显示至少90%,91%,92%,93%,94%,95%,96%,97%,98%,99%或更多序列相同性并保留与结合伴侣(例如生物素或肽)的结合性的氨基酸序列所示的,链霉亲和素、类似物或突变体。在一些实施方式中,所述结合伴侣是生物素、生物素类似物或能够结合至所述结合试剂的肽。在一些实施方式中,所述结合伴侣是或包含能够结合所述结合试剂(例如链霉亲和素结合肽)的肽,例如包含SEQ ID NO:1-10中任一项所示的序列的肽。在一些实施方式中,所述方法包括:在使所述样品中的细胞与包含固定于其上的抗体作为第一和/或第二选择的部分的固体支持物接触之后,施加竞争试剂,以破坏所述结合伴侣和结合试剂之间的键,由此从所述固体表面回收选择的细胞。在一些实施方式中,所述竞争试剂是生物素或生物素类似物。
在一些实施方式中,所述方法产生选择的或富集的组合物,其包含以培养物起始比存在的,选择的或富集的CD4+细胞与CD8+细胞,或其亚群。在一些实施方式中,CD4+与CD8+细胞的培养物起始比介于是或约是10:1和是或约是1:10之间,介于是或约是5:1和是或约是1:5之间或介于是或约是2:1和是或约是1:2之间,例如是或约是1:1。技术人员有能力挑选或选择基于免疫亲和性的试剂,例如抗体被覆的珠(例如磁珠)或亲和色谱基质或基质的足够的量或足够的相对量,以在产生的组合物,例如包含针对CD4、CD8或其亚群进行富集或选择的细胞的培养起始组合物中实现或产生培养物起始比。此类方法的示例于下文描述。
在一些实施方式中,所述细胞包括免疫系统的细胞,例如淋巴细胞,例如,T细胞(例如,CD4+和CD8+T细胞及其分离的亚群),和NK细胞。在一些实施方式中,所述细胞以多重细胞群或细胞类型的组合存在,其在一些方面中以所述细胞或细胞类型的具体比率或数量包括在所述组合物中。还提供用于最优化所述方法的方法,例如通过选择或确定与所述方法联用的细胞类型和群的合适的比率和数量,例如培养物起始比和所需的输出比和剂量。
还提供用于所述方法中和由所述方法产生的细胞、细胞群及其组合物。还提供用于进行所述方法的系统、装置、设备、试剂、化合物和试剂盒。还提供用于由所述方法产生的细胞和组合物的治疗方法和应用,例如用于过继细胞治疗的方法。
在一些实施方式中,提供用于产生细胞以供过继细胞治疗的方法,用于产生细胞以供遗传工程改造的方法,和用于产生遗传工程改造的细胞的方法。在一些方面中,所述细胞是T细胞,例如CD4+和CD8+T细胞和/或其亚型。在一些方面中,所述细胞治疗是T细胞治疗。
在一些实施方式中,所述方法通过如下方式进行:(a)从样品分离细胞群,和(b)在包含该分离的群的细胞的培养器皿中孵育培养起始组合物。在一些方面中,所述方法还包括:遗传工程改造该孵育的细胞或所述培养器皿中的细胞,例如通过(c)将遗传工程改造的抗原受体引入培养器皿中的细胞。
在一些实施方式中,所述方法通过如下方式进行:(a)在以具体培养物起始比或具体细胞数量包含多种细胞群的培养器皿中孵育培养起始组合物;和(b)遗传工程改造所述细胞,例如,通过将遗传工程改造的抗原受体引入所述培养器皿中的细胞。
在一些实施方式中,将所述遗传工程改造的抗原受体引入所述培养器皿中的细胞,例如,引入所述培养器皿中不同的细胞类型或亚群,例如,引入所述培养器皿中的CD4+和CD8+细胞。
在一些方面中,所述方法产生用于遗传工程改造或过继细胞治疗或包含表达遗传工程改造的抗原受体的细胞的输出组合物。
在一些实施方式中,所述分离包括或通过如下方式进行:从所述样品分离CD4+原代人T细胞群和/或CD8+原代人T细胞群。在一些方面中,其包括针对CD4+细胞的亚群进行消耗或富集,和/或针对CD8+细胞的亚群进行消耗或富集。因此,在一些方面中,所述培养起始组合物包括分离的CD4+和CD8+原代人T细胞。
在一些方面中,所述富集或消耗通过基于免疫亲和性的选择来进行,例如结合至识别细胞上的表面标志物的抗体或其它结合分子。在一些方面中,所述抗体或其它分子偶联至磁性响应或磁性颗粒,例如,珠。在一些方面中,所述选择包括正和/或负选择步骤。
在一些实施方式中,CD8+原代人T细胞群的分离包括对CD8+细胞的亚群进行消耗或富集。在一些实施方式中,CD4+原代人T细胞群的分离包括对CD4+细胞的亚群进行消耗或富集。在一些方面中,T细胞群的分离包括对TCM细胞进行富集。在一些方面中,CD8+和/或CD4+原代人T细胞群的分离包括针对中心记忆T(TCM)细胞进行富集。在一些方面中,针对中心记忆T(TCM)细胞的富集包括:对于表达原初T细胞上存在的表面标志物(例如CD45RA)的细胞进行负选择,或对于表达存在于中心记忆T细胞上但不存在于原初T细胞上的表面标志物(例如CD45RO)的细胞进行正选择;和/或对于表达存在于中心记忆T(TCM)细胞上但不存在于另一记忆T细胞亚群上的表面标志物(例如CD62L、CCR7、CD27、CD127和/或CD44)的细胞进行正选择。
在一些实施方式中,所述分离包括:(i)基于CD4的表面表达对所述样品进行正选择,导致阳性和第一阴性部分,其中所述阳性部分是分离的CD4+群;和(ii)基于非T细胞标志物原初T细胞上存在的表面标志物的表面表达对所述第一阴性部分进行负选择,由此产生第二阴性部分;和(iii)基于存在于中心记忆T(TCM)细胞表面上但不存在于另一记忆T细胞亚群的表面上的标志物的表面表达对第二阴性部分进行正选择。
在一些方面中,原初T细胞上存在的标志物包括CD45RA。在一些方面中,存在于中心记忆T(TCM)细胞表面上但不存在于另一记忆T细胞亚群的上的表面标志物包括CD62L、CCR7、CD27、CD127和/或CD44。
在一些方面中,所述分离或选择在相同的分离器皿中进行。在一些方面中,所述分离包括:(i)对所述样品进行第一选择,由此产生CD4+和CD8+原代人T细胞群之一和非选择的样品;和(ii)对所述非选择的样品进行第二选择,由此产生CD4+和CD8+原代人T细胞群中的另一者。在一些方面中,所述CD4+原代人T细胞群在第一选择中产生,并且,所述CD8+原代人T细胞群在第二选择中产生。在一些方面中,所述第一和/或第二选择包括多个正或负选择步骤。
在一些方面中,一种或多种所述群,例如原代人T细胞群、原代人CD4+T细胞群,或原代人CD8+T细胞群的分离包括基于CD62L、CCR7、CD44或CD27的表面表达的正选择。在一些方面中,一种或多种所述群,例如原代人T细胞群、原代人CD4+T细胞群,或原代人CD8+T细胞群的分离包括基于CD45RA的表面表达的负选择或基于CD45RO的表面表达的正选择。
在一些实施方式中,所述各种分离,例如所述多种细胞群,例如,CD4+和CD8+群的分离,在相同的分离器皿中进行。在一些方面中,所述分离器皿是或包括管、管组、腔室、单元、孔、培养器皿、袋,和/或柱。在一些方面中,在分离过程中,所述分离器皿将所述细胞保留在包含的或无菌的环境中。
在一些实施方式中,所述孵育在刺激条件下进行。在一些方面中,所述培养起始组合物以培养物起始比包含CD4+和CD8+原代人T细胞群。在一些方面中,所述培养物起始比经设计,以在所述孵育之后,或在稍晚的时间(例如在工程改造、冻存之后),或在将要给予之前(例如在床边融化时),产生CD4+与CD8+细胞的所需输出比(或所述亚群的所需T细胞总数或数量)。
在一些实施方式中,所需输出比介于是或约是5:1和是或约是1:5之间(或大于约1:5且少于约5:1),例如介于是或约是1:3和是或约是3:1之间(或大于约1:3且少于约3:1),例如介于是或约是2:1和是或约是1:5之间(或大于约1:5且少于约2:1),或介于是或约是2:1和是或约是1:5之间的范围。在一些方面中,所需的输出比是或约是3:1、2.9:1、2.8:1、2.7:1、2.6:1、2.5:1、2.4:1、2.3:1、2.2:1、2.1:1、2:1、1.9:1、1.8:1、1.7:1、1.6:1、1.5:1、1.4:1、1.3:1、1.2:1、1.1:1、1:1、1:1.1、1:1.2、1:1.3、1:1.4、1:1.5、1:1.6、1:1.7、1:1.8、1:1.9、1:2、1:2.5、1:3、1:3.5、1:4、1:4.5,或1:5。
在一些方面中,所述方法导致所述输出组合物中的两种不同的细胞类型或群的比率,例如CD4+与CD8+细胞之比,是介于是或约是5:1和是或约是1:5之间(或大于约1:5且少于约5:1),例如介于是或约是1:3和是或约是3:1之间(或大于约1:3且少于约3:1),例如介于是或约是2:1和是或约是1:5之间(或大于约1:5且少于约2:1),或是或约是3:1、2.9:1、2.8:1、2.7:1、2.6:1、2.5:1、2.4:1、2.3:1、2.2:1、2.1:1、2:1、1.9:1、1.8:1、1.7:1、1.6:1、1.5:1、1.4:1、1.3:1、1.2:1、1.1:1、1:1、1:1.1、1:1.2、1:1.3、1:1.4、1:1.5、1:1.6、1:1.7、1:1.8、1:1.9、1:2、1:2.5、1:3、1:3.5、1:4、1:4.5,或1:5。
在一些方面中,所需的输出比是1:1或约是1:1。
在一些方面中,所述方法导致所述输出组合物中所需的输出比或细胞数量,使得所述输出组合物中的比率或数量处于此类所需输出比或数量的某一耐受差异或误差范围之内,和/或使得所述比率或数量是所述方法进行时间的某一百分数,例如至少是或约是所述时间的50%、55%、60%、65%、70%、75%、80%、85%、90%、95%,或多于95%。
在一些方面中,所述耐受差异在所需比例的约1%、约2%、约3%、约4%约5%、约10%、约15%、约20%、约25%、约30%、约35%、约40%、约45%、约50%之内。在一些方面中,所述输出比在所需比率的20%之内,和/或在所述方法进行时间的至少80%的比率之内。
在一些实施方式中,所述耐受差异和/或所需的输出比或数量是或已通过如下方式确定:以多种测试比率或数量,给予不同的细胞类型,例如给予CD4+和CD8+细胞,至一个或多个对象,并评估一项或多项参数。在一些方面中,对于所需的输出比或数量或耐受差异的确定包括在给予所述对象之后评估一项或多项结果。在一些方面中,所述结果包括选自以下的那些:疾病症状的减轻和指示安全性和/或低毒性或不存在毒性的结果。
在一些实施方式中,所述培养物起始比基于分离的各种细胞类型,例如CD4+和/或CD8+原代人T细胞群的增殖速率或存活能力来选择。在一些实施方式中,所述培养物起始比基于所述样品的来源,例如衍生所述样品的对象来选择。例如,在一些方面中,所述样品源自对象,并且所述培养物起始比基于如下方面来选择:影响所述对象的疾病或病症和/或所述对象正在接受、已接受,或将接受的治疗,例如与过继性细胞治疗的给予共同治疗。在一些方面中,所述培养物起始比基于经分离或培养的一种或多种细胞或细胞亚型的表型来选择,例如CD4+和/或CD8+细胞群的表型,例如细胞表面标志物的表达或一种或多种因子(例如细胞因子或趋化因子)的合成或分泌。
在一些实施方式中,所述方法包括:在所述孵育步骤之前选择所述培养物起始比。在一些方面中,所述选择通过如下方式进行:检测分离的细胞群或经孵育的细胞群中一种或多种(例如CD4+原代人T细胞和/或分离的CD8+原代人T细胞)的增殖速率或存活能力。在一些方面中,所述选择通过如下方式进行:评估分离的CD4+原代人T细胞和/或分离的CD8+原代人T细胞的表型。在一些方面中,所述表型从表面标志物的表达和细胞因子或其它因子的分泌来选择。在一些方面中,所述选择通过如下方式进行:评估所述样品的来源,例如,当基于影响衍生所述样品的对象的疾病或病症来选择培养物起始比时。
在一些实施方式中,所述方法还包括:确定中间细胞比率或数量,例如所述孵育起始之后的时间点的所述培养器皿中的中间CD4+与CD8+细胞之比。在一些方面中,所述方法还包括:基于所述中间比率,调节一种或多种参数和/或增加或减少用于进行所述孵育和/或工程改造步骤的时间。一方面,所述调节包括增加或减少所述培养器皿中的一种或多种细胞群的数量或富集所述培养器皿中的一种或多种细胞群,例如增加或富集所述培养器皿中的CD4+或CD8+细胞,调节温度,添加刺激剂至所述培养器皿,调节所述培养器皿中一种或多种刺激剂的浓度,和/或添加细胞亚群至所述培养器皿和/或从所述培养器皿移除细胞亚群。在一些方面中,进行所述确定和/或调节,同时保持所述组合物在无菌或包含的环境中孵育。在一些方面中,所述确定和/或调节以自动化方式进行,例如通过与其中进行所述步骤的装置连接的计算机控制。
在一些方面中,所述分离、孵育和/或工程改造步骤在无菌或包含的环境中和/或以自动化模式进行,例如通过与其中进行所述步骤的装置连接的计算机控制。
在一些方面中,所述培养起始组合物中的CD8+群包含至少50%中心记忆T(TCM)细胞或包含少于20%的原初T(TN)细胞。
在一些实施方式中,所述样品获自对象。在一些方面中,所述对象是将向其给予所述遗传工程改造的细胞,例如,T细胞,或用于过继细胞治疗的细胞的对象,或需要此类给予的对象。在其它方面中,所述对象不是将向其给予所述遗传工程改造的细胞,例如,T细胞,或用于过继细胞治疗的细胞的对象,或所述对象是不需要此类治疗的对象。所述样品包括血液和血液源性的样品,例如血液白细胞样品、单采样品、白细胞去除术样品、外周血单核细胞(PBMC)样品,和全血。
在一些方面中,用于所述孵育或工程改造的刺激条件包括这样的条件,其使得所述培养起始组合物的T细胞增殖或扩增。例如,在一些方面中,所述孵育在下述试剂存在下进行:能够活化TCR复合物的一种或多种组分的一种或多种胞内信号转导结构域(例如CD3ζ链)的试剂,或能够活化通过此类复合物或组分的信号转导的试剂。在一些方面中,所述孵育在如下物质的存在下进行:抗CD3抗体,和抗CD28抗体、抗4-1BB抗体,例如,所述抗体偶联至或存在于固体支持物(例如珠)的表面上,和/或细胞因子,例如IL-2、IL-15、IL-7和/或IL-21。
在一些实施方式中,所述遗传工程改造的抗原受体是或包括T细胞受体(TCR),例如高亲和性TCR,或功能性非TCR抗原受体,例如嵌合抗原受体(CAR)。在一些方面中,所述受体特异性结合至由待治疗的疾病或病症的细胞表达的抗原。在一些方面中,所述CAR包含胞外抗原-识别结构域。在一些方面中,其还包含胞内信号转导结构域,该结构域包含含有ITAM的序列,和T细胞共刺激分子的胞内信号转导结构域。
还提供细胞和组合物,包括药物组合物,其通过所述方法或实施方式中任一种产生,包括遗传工程改造的细胞和用于过继细胞治疗的细胞。还提供用于给予所述细胞和组合物至对象的方法和所述细胞和组合物在此类方法中的应用。例如,提供处理方法,其通过如下方式进行:根据所述细胞生成方法产生细胞,并给予输出组合物或其衍生的组合物中的细胞至对象。提供处理方法,其包括给予本文提供的细胞或组合物至对象。在一些方面中,从中分离所述细胞的样品源自向其给予所述细胞的对象。在一些方面中,所述样品来自不同的对象。因此,所述方法包括自体和同种异体方法。在一些实施方式中,所述方法减轻、治疗或防止所述对象的疾病或病症的一种或多种症状。在一些方面中,所述疾病或病症是癌症或相关症状。在一些实施方式中,所述癌症包括:白血病、淋巴瘤、例如、慢性淋巴细胞白血病(CLL)、ALL、非霍奇金氏淋巴瘤、急性骨髓性白血病、多发性骨髓瘤、难治滤泡性淋巴瘤淋巴瘤、套细胞淋巴瘤、惰性B细胞淋巴瘤、B细胞恶性瘤、结肠癌、肺癌、肝癌、乳腺癌、前列腺癌、卵巢癌、皮肤癌(包括黑素瘤)、骨癌、和脑癌、卵巢癌、上皮癌、肾细胞癌、胰腺腺癌、霍奇金淋巴瘤、宫颈、结肠直肠癌、胶质母细胞瘤、成神经细胞瘤、尤文肉瘤、成神经管细胞瘤、骨肉瘤、滑膜肉瘤,和/或间皮瘤。
附图简要说明
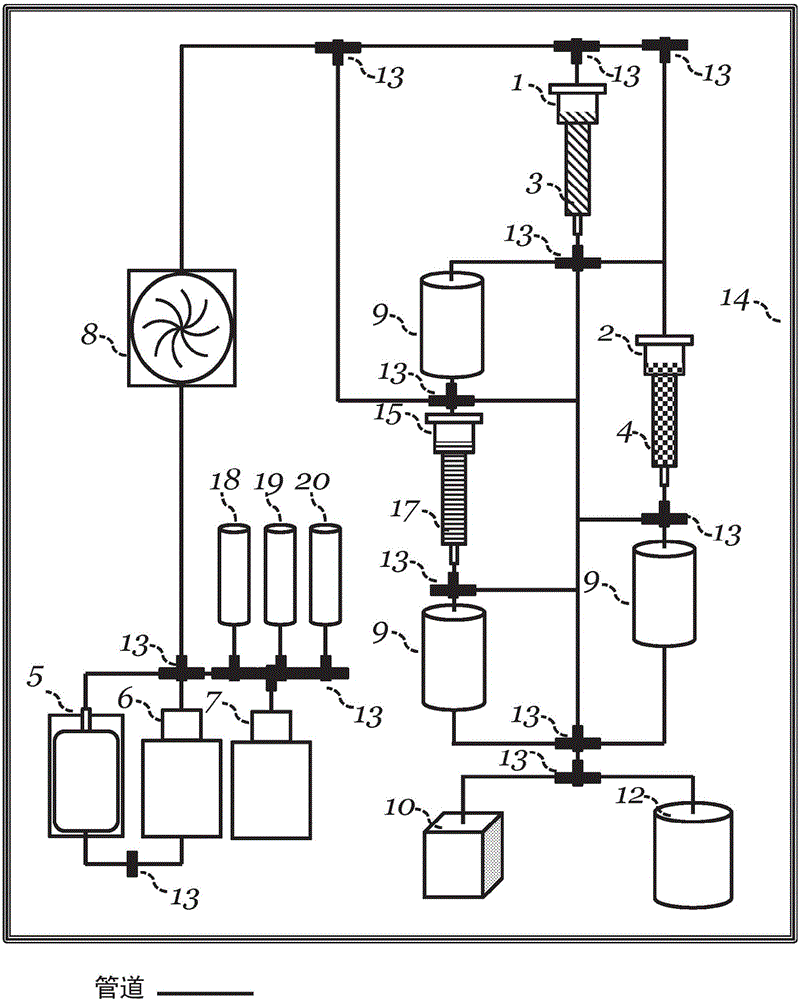
图1A:提供用于本文提供的方法的实施方式的封闭系统的实施方式的示意图。描述的示例性系统包括细胞样品5、清洗缓冲液储器6、洗脱缓冲液储器7、第一Fab储器18、第二Fab储器19,和泵8,其通过一系列管道和阀13连接至第一色谱柱1,所述第一色谱柱1包含第一基质3,其通过一系列管线操作性地连接至第二色谱柱2,所述第二色谱柱2包含第二基质4。第二色谱柱2操作性地连接至移除腔室9。移除腔室9操作性地连接至阀13,其通过一系列管线将细胞和流体导向废料容器10或培养器皿12。所述系统在围隔物14中封闭。
图1B:提供用于本文提供的方法的实施方式的封闭系统的实施方式的示意图。描述的示例性系统包括细胞样品5、清洗缓冲液储器6、洗脱缓冲液储器7、第一Fab储器18、第二Fab储器19、第三Fab储器20,和泵8,其通过一系列管道连接至第一色谱柱1,所述第一色谱柱1包含第一基质3。操作性地连接至一系列管道的阀13通过一系列管道导向流体。阀13操作性地连接至第一色谱柱1,其将细胞和流体导向第二色谱柱2,所述第二色谱柱2包含第二基质4,其操作性地连接至移除腔室9。操作性地连接至第一色谱柱1的阀13也将细胞和流体导向移除腔室9,其操作性地连接至第三色谱柱15,所述第三色谱柱15包含第三基质16。第三色谱柱15操作性地连接至移除腔室9。移除腔室9通过所述一系列管线和阀13操作性地连接至第一废料容器10或培养器皿12。所述系统在围隔物14中封闭。
发明详述
除非另外定义,本文使用的所有专业术语、符号和其它技术和科学术语或专有词汇旨在具有本发明所属领域技术人员通常所理解的相同含义。在一些情况中,本文出于阐明和/或便于引用目的对具有常规理解含义的术语加以限定,本文中包括此类限定不应理解为表示与本领域常规理解的有显著差异。
本发明中提及的所有出版物,包括专利文件、学术论文和数据库,均以各个体出版物好似独立地通过引用纳入的相同程度通过引用其全文纳入本文用于所有目的。如果本文所示的定义与通过引用纳入本文的专利、公开申请和其它出版物中所示的定义不同或其它情况下不一致,则相对于通过引用纳入本文的文件中的定义,以本文所示的定义为主。
本文所用章节标题仅用于组织目的,而不应理解为限制所述客体。
I.用于过继治疗的分离、培养,和工程改造细胞的方法和系统
提供制备细胞,例如,T细胞的方法,所述细胞用于遗传工程改造和治疗方法,例如过继细胞治疗。具体而言,在一些实施方式中,所述方法采用或产生包含多种不同的细胞群或细胞类型,例如分离的CD4+和CD8+T细胞群和亚群,的组合物。在一些实施方式中,所述方法包括分离一种或多种细胞群(一般是多种细胞群)的步骤。所述细胞通常从源自对象的样品分离。
在一些方面中,所述方法通过采用同时或连续的选择或富集来进行,其中,从样品(例如包含原代人T细胞的样品)选择、富集和/或分离多种不同的细胞群,例如CD4+或CD8+细胞。在一些实施方式中,此类方法采用单一处理流进行,其中,从第一群选择、富集和/或分离第一细胞群,例如CD4+或CD8+细胞,和第二细胞群,例如CD4+或CD8+细胞中的另一者,但不弃去任何细胞,然后进行对第二细胞群的选择。在一些方面中,所述第一和第二选择可同时或依次进行。在一些实施方式中,所述选择方法通过如下方式以单一处理流进行:进行第一选择以从样品(例如包含原代人T细胞的样品)富集第一细胞群,例如CD4+和CD8+细胞之一,和采用来自第一选择的非选择的细胞作为供于第二选择的细胞来源,例如供于来自所述样品的CD4+或CD8+细胞中的另一者。
在一些实施方式中,可对第一或第二选择的细胞进一步进行一种或多种选择。在一些实施方式中,所述进一步选择富集表达中心记忆T(TCM)细胞上的标志物的CD4+或CD8+细胞的亚群,和/或,富集表达CD62L、CD45RA、CD45RO、CCR7、CD27、CD127或CD44的细胞亚群。
在一些实施方式中,所述选择方法在封闭系统或设备中进行。在一些实施方式中,在封闭系统或设备中,产生组合物,例如培养起始组合物,其包含富集的或选择的细胞群,例如,在相同组合物中同时包含富集的或选择的CD4+和CD8+群。
例如,在一些方面中,所述一个或多个步骤采用在相同组合物中合并的,或在相同器皿中,例如,在相同封闭系统或设备中,或在相同器皿、单元或腔室中,例如相同柱,例如,磁性分离柱、管、管组、培养或培育腔室、培养器皿、处理单元、细胞分离器皿、离心腔室中存在的多种细胞群来进行,或采用相同分离基质、培养基和/或试剂,例如相同磁性或磁响应性基质、颗粒或珠,相同相同固体支持物,例如,亲和性标记的固体支持物,和/或相同抗体和/或其它结合伴侣,例如荧光标记的抗体和结合伴侣,针对多种细胞群来进行。在一些实施方式中,所述一种或多种器皿、单元或腔室(例如柱)在所述相同封闭系统或设备中操作性地连接,从而所述分离、选择和/或富集的方法以单一处理流进行,其中,来自第一选择的非选择的细胞群可用作供于第二选择的细胞来源。
在一些实施方式中,对于待培养或工程改造以供过继治疗的细胞的一种或多种特定群或亚群,例如,CD4+和CD8+T细胞的分离或富集,提供一种或多种益处。例如,针对多种不同的细胞群或细胞类型,例如分离的CD4+和CD8+T细胞群和亚群,富集的工程改造细胞,能够改善功效或减少或避免不希望的作用。在一些方面中,所述分离或富集能增加最终给予对象的细胞的保持、扩增、变得活化和/或体内移入或给予对象后的能力。在一些方面中,其改善或增加一种或多种效应功能或活化表型。例如,在一些方面中,富集T细胞群,例如CD8+T细胞群,的中心记忆(TCM)细胞,能提供此类益处。在一些方面中,此类益处中的一种或多种通过如下方式提供:合并两种或更多种分离的群或亚型,例如CD8+和CD4+T细胞的分离的群或亚群,例如TCM-富集的CD8+群和CD4+群。例如,在一些方面中,相比单独的CD8+群,通过给予CD4+和CD8+群可获得此类益处。
在一些实施方式中,所述方法包括处理产生的组合物,所述组合物包含多种分离的或选择的细胞群,例如选择的或富集的CD4+细胞和CD8+细胞的群。在一个实施方式中,对于产生的组合物的处理包括:在刺激条件下孵育所述细胞,例如在一些方面中,以使所述活化以供工程改造或转导或以供细胞扩增。在一些实施方式中,所述方法包括用于工程改造多种细胞类型的步骤,例如CD4+细胞和CD8+细胞,例如分离的和孵育的组合物(例如培养起始组合物)中存在的那些。在一些方面中,进行所述工程改造以将遗传工程改造的抗原受体引入所述细胞,例如TCR,例如,高亲和性TCR,或功能性非TCR抗原受体,例如嵌合抗原受体(CAR)。在一些方面中,所述方法包括进一步处理,例如进一步孵育,例如在或约在37℃±2℃下进行所述进一步孵育,和/或配制细胞和包含所述细胞的组合物。在一些实施方式中,所述处理产生所得的输出组合物,其包含遗传工程改造的细胞,例如遗传工程改造的CD4+细胞和CD8+细胞。在一些实施方式中,所得的处理的输出组合物可用于将通过所述方法制备的细胞和组合物给予患者的方法,例如,与过继细胞治疗相联合。
在某些实施方式中,所述分离(isolation)或分开(separation)采用进行所述方法的分离、细胞制备、分离、处理、孵育、培养和/或配制步骤中的一种或多种的系统、装置或设备来进行。在一些方面中,所述系统用以在封闭或无菌环境中进行这些步骤中的各个步骤,例如,以使误差、用户处理和/或污染最小化。在一个实例中,所述系统是国际专利申请公开号WO2009/072003,或US 20110003380 A1中描述的系统。在一些实施方式中,所述系统是封闭设备或系统,例如描述于图1A或图1B。在一些实施方式中,所述系统或设备是自动化的和/或以自动化模式根据所述方法进行所述选择步骤以富集细胞。
在一些实施方式中,所述系统或设备进行所述分离,例如选择或富集步骤。在一些实施方式中,可采用其它系统或设备,例如封闭系统或设备,来进行一个或多个其它步骤,例如所述方法的细胞制备、处理、孵育、培养和/或配制步骤。在一些实施方式中,所述系统或设备在整合或独立系统中,和/或以自动化的或可编程的形式,进行分离、处理、工程改造和配制步骤中的一个或多个,例如,全部。在一些方面中,所述系统或设备包括与所述系统或设备信息连通的计算机和/或计算机程序,其允许用户编程、控制、评估处理、分离、工程改造和配制步骤的结果,和/或调节处理、分离、工程改造和配制步骤的各方面。
在一些实施方式中,因为富集的组合物(例如培养起始组合物)是通过本文提供的方法产生以包含不同的细胞群,例如CD4+和CD8+,所产生的组合物可一起且在相同条件下同时处理,并且在一些方面中,在封闭系统中进行。因此,在一些方面中,所述方法提供一种手段,以单一处理流的方式产生并处理选择、富集或分离的细胞的群,其包含不同的细胞的群,例如CD4+和CD8+细胞。在一些方面中,这不同于现有技术方法(包括处理细胞供于工程改造以供过继细胞治疗的现有技术方法),其通常包括针对各个不同的细胞群的分开的处理流,例如至少两个处理流。例如,在现有方法的一些方面中,CD4+T细胞在刺激条件下分开地分离、富集和/或选择和处理以供遗传工程改造,CD8+T细胞在刺激条件下分开地分离、富集和/或选择和处理以供遗传工程改造,然后将分开处理和工程改造的CD4+和CD8+T细胞重新合并,再给予对象。
在一些实施方式中,所述方法提供相比其它制备、分离、孵育和工程改造方法的一种或多种益处,例如成本节约、时间节约和/或资源节约。此类益处可包括:相比其它方法,能够以增加的效率和/或减小的复杂性、时间、成本和/或所用资源,来分离、处理(例如孵育)和/或工程改造以所需比率或接近所需比率存在的多种细胞群。
在一些实施方式中,此类益处通过使一个或多个所述方法步骤流线化来获得。例如,在一些方面中,不同的群的分离、培养和/或工程改造采用相同设备或装备和/或同时进行。在一些方面中,不同的群的分离、培养和/或工程改造基于相同起始组合物来进行。在一些方面中,相比其中在分开的器皿中,采用分开的装备,在分开时间,和/或以不同的起始组合物起始地分开分离、孵育和/或工程改造细胞群的方法,所述方法的此类特征减少时间的量、方法步骤、成本、复杂性和/或资源数量。
在一些方面中,所述分离、孵育和工程改造细胞方法导致其中不同的细胞群或细胞类型,例如CD4+细胞和CD8+细胞,以所需比率或在所需比例的某一耐受误差程度上存在的输出组合物。所述比率包括视为最优选用于治疗应用的那些,例如,视为合适或最优选用于联合过继细胞治疗给予患者的输出比。还提供给予通过所述方法制备的细胞和组合物至患者的方法,例如,联合过继细胞治疗。
在一些实施方式中,进行分离或选择的方法,从而实现以所选的CD4+细胞与CD8+细胞或其亚群的培养物起始比选择细胞。在一些方面中,所述比率包括视作最优选起始点的比率,其用于在所述方法或一种或多种步骤结束时,例如在培养、孵育和/或工程改造步骤之后实现最优选比率,例如输出组合物中的所需比率。在一些实施方式中,以培养物起始比,例如CD4+细胞与CD8+细胞之比,提供细胞,该比率考虑在采用不同的试剂刺激或活化之后可能会出现的CD4+和CD8+T细胞的扩增差异,以实现输出组合物中的所需比率。
在一些实施方式中,所述方法产生工程改造的细胞或用于工程改造的细胞,所述细胞处于所需输出比的某一百分数或在其范围内,或在至少某一时间百分数之内进行。所需的输出比通常是已经确定最优选于通过过继转移给予患者的比率。在一些实施方式中,所述细胞的群或亚型,例如CD8+和CD4+T细胞,在或处于总细胞的所需剂量,例如T细胞的所需剂量的耐受差异之内给予。在一些方面中,所需剂量是所需的细胞数量或所需的细胞数量/向其给予所述细胞的对象的体重单位,例如,细胞/kg。在一些方面中,所需剂量是或高于最小细胞数量或最小细胞数量/体重单位。在一些方面中,在以所需剂量给予的总细胞中,个体群或亚型以或接近所需的输出比(例如CD4+与CD8+之比)存在,例如,处于所述比率的某一耐受差异或误差之内。
在一些实施方式中,所述细胞以或在细胞的一种或多种个体群或亚型的所需剂量的耐受差异之内给予,例如CD4+细胞的所需剂量和/或CD8+细胞的所需剂量。在一些方面中,所需剂量是所述亚型或群的所需细胞数量,或此类细胞的所需数量/向其给予所述细胞的对象的体重单位,例如,细胞/kg。在一些方面中,所需剂量是或高于所述群或亚型的最小细胞数量,或所述群或亚型的最小细胞数量/体重单位。
因此,在一些实施方式中,所述剂量基于总细胞的所需固定剂量和所需比率,和/或基于所述个体亚型或亚群的一种或多种(例如各自)的所需固定剂量。因此,在一些实施方式中,所述剂量基于T细胞的所需固定或最小剂量和所需CD4+与CD8+细胞之比,和/或基于CD4+和/或CD8+细胞的所需固定或最小剂量。
在一些实施方式中,提供用于确定此类最优选输出比和/或所需剂量,和/或基于所需的输出比或所需的剂量的能被耐受的变异水平(例如耐受差异)的方法。在一些实施方式中,为了实现所需输出比或剂量(或为了实现某一时间百分数的比率或在某一耐受差异之内),所述细胞群以经设计以实现过继转移所需输出比的比率(例如,培养物起始比)合并或孵育。
还提供用于确定培养物起始比的方法,所述培养物起始比经设计从而在某一耐受差异和/或某一时间百分数之内实现所需输出比或剂量。还提供用于评估,例如,各种方法步骤(例如,孵育)的进程过程中的一个或多个时间段处的细胞群的临时比率或数量的方法。还提供基于例如评估结果来调节各种条件(例如培养条件)的方法。在一些方面中,进行所述调节以确保实现或在耐受差异内实现具体输出比或剂量。
在一个具体实施方式中,提供制备组合物的流线式方法,其处于或接近CD4+T细胞群和CD8+T细胞群(例如,针对T细胞亚型例如中心记忆T细胞富集的CD8+群)的所需输出比,和/或T细胞和/或CD4+和CD8+T细胞的所需剂量(例如,数量或数量/体重单位),用于引入用于过继细胞治疗的遗传工程改造的抗原受体,其中,所述细胞群以组合方式分离、孵育和/或工程改造,并且相比其中所述群被分开地分离、孵育和/或工程改造的方法,所述方法与增加的效率和/或减小的复杂性、时间、成本和/或资源使用相关联。
还提供通过所述方法制备的细胞和组合物,包括药物组合物和制剂,和用于进行所述方法的试剂盒、系统和装置。还提供用于通过所述方法制备的细胞和组合物的使用的方法,包括治疗方法,例如用于过继细胞治疗的方法,和用于给予对象的药物组合物。
A.分离方法、分离的细胞和其它处理步骤
提供的实施方式包括用于从样品分离多种细胞和细胞群的方法,以及通过此类方法产生的,经分离的(例如富集的)细胞。所述分离可包括各种细胞制备和分离步骤中的一个或多个,包括基于一种或多种性质,例如尺寸、密度、敏感性或对于具体试剂的抗性,和/或对于抗体或其它结合伴侣的亲和性,例如,免疫亲和性,来分离。在一些方面中,所述分离采用相同设备或装备在单一处理流中依次和/或同时进行。在一些方面中,对于不同的群的分离、培养和/或工程改造从相同起始组合物或材料,例如从相同样品进行。
在一些方面中,所述多种细胞群在相同封闭系统或设备中,和/或在相同器皿或器皿组中,例如,相同(或相同组的)单元、腔室、柱,例如磁性分离柱,管、管组、培养或培育腔室、培养器皿、处理单元、细胞分离器皿、离心腔室中分离。例如,在一些情况中,多种细胞群的分离,采用单一或相同分离或分离器皿或器皿组,例如单一柱或柱组,和/或相同管,或管组,例如,无需将细胞群、组合物或悬液从一个器皿(例如,管组)转移至另一个的方式,在系统或设备中进行。
在一些方面中,此类方法通过单一处理流实现,例如通过采用同时或连续选择在封闭系统中实现,其中,从样品(例如包含原代人T细胞的样品)选择、富集和/或分离多种不同的细胞群,例如CD4+或CD8+细胞。在一个实施方式中,通过同时富集CD4+和CD8+群对包含细胞的样品进行选择。在一些方面中,在相同器皿或器皿组(例如,管组)中进行的所述分开(separation)或分离(isolation)通过如下方式实现:进行依次正和负选择步骤,后续步骤对来自先前步骤的阴性和/或阳性部分进行进一步选择,其中整个过程在相同管或管组中进行。在一个实施方式中,对待选择的包含细胞的样品进行连续选择,其中进行第一选择以富集CD4+或CD8+群之一,并且采用来自第一选择的非选择的细胞作为用于第二选择的细胞来源,以富集CD4+或CD8+群中的另一者。在一些实施方式中,可进行进一步的一个或多个选择来富集CD4+或CD8+群之一或两者的亚群,例如,中心记忆T(TCM)细胞。
在具体方面中,第一选择步骤采用由CD4结合分子例如抗体(或识别此类分子的第二试剂)标记的珠进行,并且,保留来自第一选择步骤的阳性和阴性部分,然后对阴性部分进行进一步正或负选择,以富集CD8+细胞,例如通过采用用CD8-结合分子标记的珠,和,任选地从CD8+部分选择选择细胞亚群,例如中心记忆CD8+T细胞和/或表达一种或多种标志物CD62L、CD45RA、CD45RO、CCR7、CD27、CD127,或CD44的细胞。在一些实施方式中,可颠倒选择的顺序。在一些实施方式中,CD4选择总是最先进行,在第二选择中,例如,通过针对CD45RA+和CD14中的一种或多种进行负选择,和/或针对CD62L、CCR7和/或中心记忆细胞上表达的其它标志物中的一种或多种进行正选择,从阴性部分(CD4-)富集CD8+部分。
在一些实施方式中,分离多种细胞群,例如,CD4+T细胞群和CD8+T细胞群,例如,以产生包含该多种细胞群的培养起始组合物。培养起始组合物通常以培养物起始比包含细胞,该培养物起始比经设计以在一个或多个孵育、培养、培育,和/或工程改造步骤之后产生两种或更多种细胞类型的具体所需的输出比,例如具体CD4+与CD8+之比。在一些实施方式中,所需输出比是经设计以最优选用于,例如,在过继细胞治疗中将细胞给予患者的比率。
在一些方面中,在单一或在相同分离或分离器皿或器皿组(例如单一柱或柱组),和/或相同管或管组中或采用相同分离基质或培养基或试剂,例如相同磁性基质、亲和性标记的固体支持物,或抗体或其它结合伴侣进行的,多个群的分离,具有使分离流线化的特点,例如,导致减少的成本、时间、复杂性,对样品处理、资源使用、试剂或装备的需求。在一些方面中,此类特点的有利之处在于,它们使与该方法相关联的成本、效率、时间和/或复杂性最小化,和/或避免对于细胞产物的潜在损害,例如由感染、污染和/或温度变化造成的损害。
在一些实施方式中,所得的用于本文所述方法的分离的细胞群是无菌。在一些情况中,细胞分离产物的微生物污染可导致受者对象,例如无法对抗感染的免疫力低下的受者患者,的感染。在一些实施方式中,所述细胞、细胞群和组合物在GMP(良好生产实践)条件下产生。在一些实施方式中,GMP条件包括严格的批量测试。在某些实施方式中,组织分型在移植之前进行,例如,以避免人白细胞抗原(HLA)错配和防止例如移植物抗宿主(graft-versus-host)疾病的问题。在一些实施方式中,本文提供的方法减少个体用户操作,并且自动化各种步骤,其在一些方面中能够增加分离的细胞群和组合物的一致性,并且减少误差,由此促进治疗一致性和安全性。
1.细胞和细胞的群
在一些实施方式中,所述方法包括对细胞样品(例如原代人细胞样品)进行选择、分离和/或富集。分离的细胞群通常包括多种细胞群,一般是如下细胞的群:血液或血液源性的细胞,例如造血细胞、白细胞(血液白细胞)、外周血单核细胞(PBMC),和/或免疫系统的细胞,例如,先天或过继性免疫的细胞,例如骨髓或淋巴样细胞,例如,淋巴细胞,通常是T细胞和/或NK细胞。在一些实施方式中,所述样品是单采或白细胞去除术样品。在一些实施方式中,所述选择、分离和/或富集可包括从所述样品正或负选择细胞。
在一些实施方式中,所述样品是包含原代人T细胞(例如CD4+和CD8+T细胞)的样品。在具体实施方式中,所述样品其中分离了多种T细胞群的样品,例如CD4+细胞的群和CD8+T细胞的群。因此,在一些实施方式中,所述分离包括针对表达CD4的细胞或表达CD8的细胞进行正选择,和/或,针对表达非T细胞标志物(例如骨髓或B细胞标志物)的细胞进行负选择,例如,针对表达CD14、CD19、CD56、CD20、CD11b和/或CD16的细胞进行负选择。
在一些实施方式中,所述样品是包含多种群的样品,所述群包括T细胞群,例如全T细胞或CD4+群,和NK细胞群。可被富集、分离和/或选择的T细胞群包括如下细胞的群:未分级分离的T细胞、未分级分离的CD4+细胞、未分级分离的CD8+细胞,CD4+和/或CD8+T细胞的亚群,包括通过针对具体亚型的细胞或基于具体表面标志物表达概况进行富集或消耗而产生的T细胞的亚群。
例如,可被富集、分离和/或选择的T细胞亚型(例如,CD4+或CD8+T细胞)是通过如下方面确定的那些:功能、活化状态、成熟度、分化潜力、扩增、再循环、定位,和/或持久能力、抗原-特异性、抗原受体类型、在具体器官或区隔中的存在、标志物或细胞因子分泌概况,和/或分化程度。
可被富集、分离和/或选择的T细胞和/或CD4+和/或CD8+T细胞的亚型和亚群包括:原初T(TN)细胞、效应T细胞(TEFF)、记忆T细胞及其亚型、例如干细胞记忆T(TSCM)、中心记忆T(TCM)、效应记忆T(TEM)、或最终分化的效应记忆T细胞、肿瘤-浸润性淋巴细胞(TIL)、不成熟T细胞、成熟T细胞、辅助T细胞、细胞毒性T细胞、粘膜相关的非变体T(MAIT)细胞、天然产生的和过继性调节T(Treg)细胞、辅助T细胞、例如TH1细胞、TH2细胞、TH3细胞、TH17细胞、TH9细胞、TH22细胞、滤泡辅助T细胞、α/βT细胞,和δ/γT细胞。
在一些实施方式中,通过本文提供的方法从样品富集、分离和/或选择的T细胞群中的一种或多种是:呈阳性(标志物+)或表达高水平(标志物高)的一种或多种具体标志物(例如表面标志物)的细胞,或呈阴性(标志物-)或表达相对较低的水平(标志物低)的一种或多种标志物的细胞。在一些情况中,此类标志物在某些T细胞群(例如非记忆细胞)上不存在或以相对较低的水平表达,但在某些其它T细胞群(例如记忆细胞)上存在或以相对较高的水平表达的那些。在一个实施方式中,对所述细胞(例如CD8+细胞或T细胞,例如,CD3+细胞)富集(即,正选择)CD45RO、CCR7、CD28、CD27、CD44、CD127和/或CD62L呈阳性或表达高表面水平的CD45RO、CCR7、CD28、CD27、CD44、CD127和/或CD62L的细胞,和/或,消耗(例如,负选择)CD45RA阳性或表达高表面水平的CD45RA的细胞。在一些实施方式中,对细胞富集或消耗CD122、CD95、CD25、CD27和/或IL7-Rα(CD127)阳性细胞或表达高表面水平的CD122、CD95、CD25、CD27和/或IL7-Rα(CD127)的细胞。在一些实例中,对CD8+T细胞富集CD62L和CD45RO阳性(或CD45RA阴性)细胞。
在一些实施方式中,对CD4+T细胞群和CD8+T细胞亚群,例如,富集中心记忆(TCM)细胞的亚群。
在一些实施方式中,所述细胞是自然杀伤(NK)细胞。在一些实施方式中,所述细胞是单核细胞或粒细胞,例如,骨髓细胞、巨噬细胞、嗜中性粒细胞、树突细胞、肥大细胞、嗜酸性粒细胞,和/或嗜碱性粒细胞。
2.样品
所述细胞和细胞群通常分离自样品,例如生物样品,例如,获自或源自对象的样品,例如具有具体疾病或病症或需要细胞治疗或将向其给予细胞治疗的对象。在一些方面中,所述对象是人,例如作为需要具体治疗性介入的患者的对象,所述治疗性介入例如是过继细胞治疗,用于治疗的细胞经分离、处理和/或工程改造。因此,在一些实施方式中,所述细胞是原代细胞,例如,原代人细胞。所述样品包括直接取自对象的组织、体液和其它样品,以及获自一个或多个处理步骤,例如分离、离心、遗传工程改造(例如采用病毒载体的转导)、清洗和/或孵育的样品。所述生物样品可以是直接获自生物来源的样品或经处理的样品。生物样品包括但不限于,体液,例如血液、血浆、血清、脑脊髓液、滑膜液、尿液和汗液,组织和器官样品,包括源自它们的经处理的样品。
在一些方面中,所述样品是血液或血液源性的样品,或者,是或源自单采或白细胞去除术产物。示例性样品包括全血、外周血单核细胞(PBMC)、白细胞、骨髓、胸腺、组织活检物、肿瘤、白血病、淋巴瘤、淋巴结、肠相关的淋巴样组织、粘膜相关的淋巴样组织、脾、其它淋巴样组织、肝、肺、胃、肠、结肠、肾、胰腺、乳腺、骨、前列腺、子宫颈、睾丸、卵巢、扁桃体,或其它器官,和/或源自其中的细胞。在细胞治疗(例如,过继细胞治疗)的情况中,样品包括来自自体和同种异体来源的样品。
在一些实施方式中,所述细胞源自细胞系,例如,T细胞系。在一些实施方式中,细胞获自异种异体来源,例如,获自小鼠、大鼠、非人灵长类,和猪。
3.细胞处理,制备和非基于亲和性的分离
在一些实施方式中,细胞或群的分离包括一个或多个制备和/或非基于亲和性的细胞分离步骤。在一些实例中,细胞在一种或多种试剂的存在下经清洗、离心和/或孵育,例如,以移除不需要的组分,富集所需组分,裂解或移除对具体试剂敏感的细胞。在一些实例中,细胞基于一种或多种性质,例如密度、粘附性质、尺寸、对具体组分的敏感性和/或抗性被分离。
在一些实例中,例如,通过单采或白细胞去除术,获得来自对象循环血液的细胞。在一些方面中,所述样品包括淋巴细胞,包括T细胞、单核细胞、粒细胞、B细胞、其它有核血液白细胞、血红细胞,和/或血小板,和,在一些方面中包括与血红细胞和血小板不同的细胞。
在一些实施方式中,从所述对象收集的血液细胞经清洗,例如,以移除血浆部分,并将该细胞置于合适的缓冲液或培养基中以供后续处理步骤。在一些实施方式中,所述细胞用磷酸盐缓冲盐水(PBS)清洗。在一些实施方式中,清洗溶液缺乏钙和/或镁和/或许多或全部二价阳离子。在一些方面中,清洗步骤按照生产商说明,通过半自动化的“流通”离心法(例如,Cobe 2991细胞处理器,Baxter)完成。在一些方面中,清洗步骤按照生产商说明,通过内切流过滤(TFF)完成。在一些实施方式中,在清洗后,所述细胞在多种生物相容缓冲液中重悬,例如,无Ca++/Mg++PBS。在某些实施方式中,移除血液细胞样品组分,并将细胞直接重悬于培养基中。
在一些实施方式中,所述方法包括基于密度的细胞分离方法,例如,通过裂解血红细胞并通过Percoll或Ficoll梯度离心来从外周血制备血液白细胞。
4.基于亲和性和/或标志物概况的分离
在一些实施方式中,所述分离方法包括,基于细胞中一种或多种特定分子,例如表面标志物,例如,表面蛋白质、胞内标志物或核酸的表达或存在来分离不同的细胞类型。在一些实施方式中,可采用基于此类标志物进行分离的任何已知方法。在一些实施方式中,所述分离是基于亲和性或基于免疫亲和性的分离。例如,在一些方面中,所述分离包括基于细胞的一种或多种标志物(通常是细胞表面标志物)的表达或表达水平来分离细胞和细胞群,例如,通过与特异性结合至此类标志物的抗体或结合伴侣孵育,随后通常是清洗步骤,和从尚未结合至所述抗体或结合伴侣的那些细胞分离已结合所述抗体或结合伴侣的细胞。
此类分离步骤可基于正选择,其中已结合所述试剂的细胞被保留用于进一步应用,和/或,负选择,其中尚未结合至所述抗体或结合伴侣的细胞被保留。在一些实例中,两种部分均保留用于进一步应用。在一些方面中,当没有可用于在异质群中特异性地鉴定细胞类型的抗体时,负选择可能是特别有用的,从而分离最好基于通过与所需群不同的细胞表达的标志物进行。
所述分离不需导致具体细胞群或表达具体标志物的细胞的100%的富集或移除。例如,正选择或富集具体类型的细胞,例如表达标志物的那些,指的是,增加所述细胞的数量或百分数,但不需要导致不表达所述标志物的细胞完全不存在。同样地,负选择、移除或消耗具体类型的细胞,例如表达标志物的那些,指的是,减少所述细胞的数量或百分数,但不需要导致所有此类细胞的完全移除。例如,在一些方面中,对于CD4+或CD8+群之一的选择富集所述群(CD4+或CD8+群),但还可包含一些残余的或小百分比的其它非选择的细胞,在一些情况中,其可包括仍存在于该富集的群中的CD4或CD8群中的另一者。
在一些实例中,进行多轮分离步骤,其中,对来自一个步骤的正或负选择的部分进行另一分离步骤,例如后续正或负选择。在一些实例中,单一分离步骤同时消耗表达多重标志物的细胞,例如通过孵育使细胞与各自对负选择靶向的标志物具有特异性的多种抗体或结合伴侣孵育。同样地,可通过将细胞与各种细胞类型上表达的多种抗体或结合伴侣孵育来对多重细胞类型进行同时正选择。
例如,在一些方面中,T细胞的特定亚群,例如一种或多种表面标志物阳性细胞或表达高水平的一种或多种表面标志物的细胞,例如,CD28+、CD62L+、CCR7+、CD27+、CD127+、CD4+、CD8+、CD45RA+和/或CD45RO+T细胞,通过正或负选择技术分离。
例如,CD3+、CD28+ T细胞可以采用CD3/CD28连接的磁珠(例如, M-450 CD3/CD28 T细胞扩增器)来正选择。
在一些实施方式中,分离通过如下方式进行:通过正选择富集具体细胞群或通过负选择消耗具体细胞群。在一些实施方式中,正或负选择通过将细胞与特异性结合至一种或多种表面标志物的一种或多种抗体或其它结合试剂孵育来完成,所述一种或多种表面标志物分别在正选择或负选择的细胞上表达(标志物+)或以相对较高水平表达(标志物高)。
在一些实施方式中,T细胞通过对在非T细胞(例如B细胞、单核细胞或其它血液白细胞)上表达的标志物(例如CD14)进行负选择来从PBMC样品分离分离。在一些实施方式中,所述方法包括对CD4+和CD8+细胞进行分离、选择和/或富集。在一个实例中,为了通过负选择对CD4+细胞进行富集,单克隆抗体混合物通常包括针对CD14、CD20、CD11b、CD16和HLA-DR的抗体。在一个实例中,为了通过负选择对CD8+群进行富集,其通过消耗表达CD14和/或CD45RA的细胞来进行。在一些方面中,CD4+或CD8+选择步骤,例如针对CD4的正选择和针对CD8的正选择,用于分离CD4+辅助和CD8+细胞毒性T细胞。在一些方面中,此类选择同时进行,且在其它方面中,此类选择以某一顺序依次进行。
在一些方面中,所述方法包括针对CD4+细胞进行第一正选择,其中,来自第一选择的非选择的细胞(CD4-细胞)用作供于第二正选择的细胞来源,以针对CD8+细胞进行富集。在一些方面中,所述方法包括针对CD8+细胞进行第一正选择,其中,来自第一选择的非选择的细胞(CD8-细胞)用作供于第二正选择的细胞来源,以针对CD4+细胞进行富集。通过针对一种或多种原初、记忆和/或效应T细胞亚群上表达或以相对较高的程度表达的标志物进行正或负选择,可将此类CD4+和CD8+群进一步分选成亚群。
在一些实施方式中,CD4+细胞针对原初、中心记忆、效应记忆和/或中心记忆干细胞进行进一步富集或消耗,例如通过基于与对应群相关联的表面抗原进行正或负选择。通过鉴定具有细胞表面抗原的细胞群,将CD4+T辅助细胞分选成原初、中心记忆和效应细胞。CD4+淋巴细胞可通过标准方法获得。在一些实施方式中,原初CD4+T淋巴细胞是CD45RO-,CD45RA+,CD62L+,CD4+T细胞。在一些实施方式中,中心记忆CD4+细胞是CD62L+和CD45RO+。在一些实施方式中,效应CD4+细胞是CD62L-和CD45RO。
在一些实施方式中,CD8+细胞针对原初、中心记忆、效应记忆和/或中心记忆干细胞进行进一步富集或消耗,例如通过基于与对应亚群相关联的表面抗原进行正或负选择。在一些实施方式中,进行针对中心记忆T(TCM)细胞的富集,以增加功效,例如以改善长期存活、扩增和/或给予后的植入,在一些方面中,其在此类亚群中特别强健。参见Terakura等.(2012)Blood.1:72–82;Wang等(2012)J Immunother.35(9):689-701。在一些实施方式中,将TCM-富集的CD8+T细胞与CD4+T细胞合并以进一步增强功效。
在实施方式中,记忆T细胞在CD8+外周血淋巴细胞的CD62L+和CD62L-亚组中存在。PBMC可以针对CD62L-CD8+和/或CD62L+CD8+部分进行富集或消耗,例如采用抗CD8和抗CD62L抗体。
在一些实施方式中,针对中心记忆T(TCM)细胞的富集基于CD45RO、CD62L、CCR7、CD28、CD3、CD27和/或CD127阳性或高表面表达;在一些方面中,其基于CD45RA和/或粒酶B表达或高度表达的细胞进行负选择。
在一些实施方式中,所提供的方法包括:从样品分离、选择和/或富集CD8+细胞,例如通过基于CD8的表面表达进行正选择。在一些实施方式中,所述方法还可包括:针对中心记忆T(TCM)细胞进行富集。一方面,富集的CD8+细胞可针对中心记忆T(TCM)细胞,通过选择在中心记忆T(TCM)细胞上表达的一种或多种标志物,例如CD45RO、CD62L、CCR7、CD28、CD3、CD27和/或CD127中的一种或多种进行进一步富集。所述选择可在CD4+细胞的分离、选择和/或富集之前或之后进行。在一些方面中,此类选择同时进行,且在其它方面中,此类选择以某一顺序依次进行。
在一些方面中,所述方法包括针对CD4+细胞的第一正选择,其中,来自第一选择的非选择的细胞(CD4-细胞)用作供于第二选择的细胞来源,以针对CD8+细胞进行富集,并且,富集的或选择的CD8+细胞在第三选择中用于针对表达在中心记忆T(TCM)细胞上表达的一种或多种标志物的细胞进行进一步富集,例如通过第三选择以针对CD45RO+、CD62L+、CCR7+、CD28+、CD3+、CD27+和/或CD127+细胞进行富集。在一些方面中,所述方法包括针对CD8+细胞的第一正选择,其中,来自第一选择的非选择的细胞(CD8-细胞)用作供于第二选择的细胞来源,以针对CD4+细胞进行富集,并且,来自第一选择的富集的或选择的CD8+细胞也用于第三选择,以针对表达在中心记忆T(TCM)细胞上表达的一种或多种标志物进行进一步富集,例如通过第三选择以针对CD45RO+、CD62L+、CCR7+、CD28+、CD3+、CD27+和/或CD127+细胞进行富集。
在一些方面中,针对TCM细胞富集的CD8+群的分离通过如下方式进行:消耗表达CD4、CD14、CD45RA的细胞,和正选择或针对表达CD62L的细胞进行富集。一方面,针对中心记忆T(TCM)细胞的富集通过如下方式进行:由基于CD4表达选择的细胞的阴性部分起始,其基于CD14和CD45RA的表达进行负选择,和基于CD62L进行正选择。在一些方面中,此类选择同时进行,且在其它方面中,此类选择以某一顺序依次进行。在一些方面中,相同的基于CD4表达的选择步骤用于制备CD8+细胞群或亚群,也用以产生CD4+细胞群或亚群,从而保留来自基于CD4分离的阳性和阴性部分,并任选地在一种或多种进一步正或负选择步骤之后,用于所述方法的后续步骤。
在具体实例中,对PBMC样品或其它血液白细胞样品进行CD4+细胞选择,其中保留阴性和阳性部分。然后,基于CD14和CD45RA或CD19的表达对阴性部分进行负选择,并基于中心记忆T细胞特征性标志物,例如CD62L或CCR7,进行正选择,其中所述正和负选择以某一顺序进行。
在一些实施方式中,所述用于细胞分离、选择和/或富集的方法,例如通过基于一种或多种细胞表面标志物的表达进行正或负选择,例如通过任何上述方法,可包括基于免疫亲和性的选择。在一些实施方式中,所述基于免疫亲和性的选择包括使包含细胞的样品,例如包含CD4+和CD8+细胞的原代人T细胞,与特异性结合至一种或多种细胞表面标志物的抗体或结合伴侣接触。在一些实施方式中,使所述抗体或结合伴侣结合至固体支持物或基质,例如球或珠,例如微珠、纳米珠,包括琼脂糖、磁珠或顺磁珠,以允许分离用于正和/或负选择的细胞。在一些实施方式中,可将所述球或珠填充进入柱以有效进行免疫亲和色谱,其中,使包含细胞的样品,例如包含CD4+和CD8+细胞的原代人T细胞,与所述柱的基质接触,然后从中经洗脱或释放。
a.免疫亲和性珠
例如,在一些实施方式中,所述细胞和细胞群采用免疫磁性(或亲和性磁性)分离技术分开(separated)或分离(isolated)(综述参见《分子医学方法》(Methods in Molecular Medicine),第58卷:代谢研究方法(Metastasis Research Protocols),第2卷:细胞体外和体内性能(Cell Behavior In Vitro and In Vivo),第17-25页,S.A.Brooks和U.Schumacher编新泽西州托托华的胡玛纳出版社(Humana Press Inc.))。
在一些方面中,使待分离的样品或细胞组合物与较小的可磁化或磁响应性材料(例如磁响应性颗粒或微粒,例如顺磁珠)孵育。所述磁响应性材料(例如,颗粒)一般直接或间接连接至结合伴侣(例如,抗体),其特异性结合至某一分子,例如,需要分离(例如需要进行负或正选择)的一种或多种细胞或细胞群上存在的表面标志物。此类珠是已知的,并且市售可得自多个来源,包括,在一些方面中,(加利福尼亚卡尔斯巴德的生命技术公司(Life Technologies))、珠(加利福尼亚州圣迭戈的美天旎生物技术公司(Miltenyi Biotec))或珠试剂(德国IBA)。
在一些实施方式中,所述磁性颗粒或珠包含磁响应性材料,其结合至特异性的结合部分,例如抗体或其它结合伴侣。有多种熟知的磁响应性材料用于磁性分离方法。合适的磁性颗粒包括描述于Molday,美国专利号4,452,773和欧洲专利说明书EP 452342 B中的那些,其通过引用纳入本文。胶体定形的颗粒,例如描述于Owen美国专利号4,795,698的那些,而Liberti等,美国专利号5,200,084是其它实例。
孵育一般在一定条件下进行,由此,所述抗体或结合伴侣或分子,例如二抗或其它试剂,其特异性结合至所述抗体或结合伴侣,其连接至所述磁性颗粒或珠,特异性结合至所述样品中的细胞上(如果)存在的细胞表面分子。
在一些方面中,将所述样品置于磁场中,并且,具有与其连接的磁性响应或可磁化颗粒的那些细胞将被磁铁吸引,并与未标记的细胞分离。对于正选择而言,保留被磁铁吸引的细胞;对于负选择而言,保留不被吸引的细胞(未标记的细胞)。在一些方面中,在相同选择步骤中进行正和负选择的组合,其中,保留阳性和阴性部分,并进一步处理或进行进一步分离步骤。
在某些实施方式中,所述磁响应性颗粒在一抗或其它结合伴侣、二抗、凝集素、酶或链霉亲和素中被覆。在某些实施方式中,所述磁性颗粒通过对一种或多种标志物具有特异性的一抗的覆层连接至细胞。在某些实施方式中,所述细胞,而非珠,用一抗或结合伴侣标记,然后,添加细胞类型特异性的二抗或其它结合伴侣(例如,链霉亲和素)被覆的磁性颗粒。在某些实施方式中,链霉亲和素被覆的磁性颗粒与生物素化一抗或二抗联用。
在一些实施方式中,使所述磁响应性颗粒保留连接至待经后续孵育、培养和/或工程改造的细胞;在一些方面中,保留所述颗粒连接至用于给予患者的细胞。在一些实施方式中,从所述细胞移去可磁化的或磁响应性颗粒。用于从细胞移去可磁化颗粒的方法是已知的,并且包括,例如,采用竞争性非标记的抗体、可磁化颗粒或连接至可切割接头的抗体等。在一些实施方式中,所述可磁化颗粒是生物可降解的。
在一些实施方式中,所述基于亲和性的选择通过磁性活化的细胞分选(MACS)(加利福尼亚奥本的美天旎生物技术公司(Miltenyi Biotech))进行。磁性活化的细胞分选(MACS)系统能够高纯度选择其上连接有磁化的颗粒的细胞。在某些实施方式中,MACS以如下模式操作,其中在施加外部磁场之后,依次洗脱非靶标和靶标物质。即,使附接至磁化的颗粒的细胞保持在原位,而洗脱未附接的物质。然后,在该第一洗脱步骤完成后,将滞留在磁场中且防止被洗脱的物质以某种方式解放,从而它们可以被洗脱和回收。在某些实施方式中,所述非靶细胞带标记并从异质细胞群消耗。
在一些实施方式中,所述基于亲和性的选择采用其是磁珠,例如纳米珠或微珠,例如1-2μM,在一些方面中,其通过链霉亲和素突变体,例如或Strep-Tactin(参见例如美国专利号6,103,493,PCT国际申请公开号WO/2013011011,WO 2014/076277)连接至结合伴侣免疫亲和试剂,例如抗体。在一些实施方式中,所述链霉亲和素突变体在珠上是功能化的、被覆的和/或固定的。
在一些实施方式中,所述链霉亲和素突变体显示的对于包含SEQ ID NO:1-6中任一项所示的氨基酸序列的肽配体,例如SEQ ID NO:5和/或SEQ ID NO:6(例如Strep-tag)的结合亲和性,高于未修饰的或野生型链霉亲和素,例如SEQ ID NO:11或SEQ ID NO:14所示的未修饰的或野生型链霉亲和素。在一些实施方式中,所述链霉亲和素突变体显示的结合亲和性是对于此类肽恒定的亲和性,即比野生型链霉亲和素对于相同肽的结合亲和性大5倍、10倍、50倍、100倍、200倍或更大。
链霉亲和素突变蛋白相比未修饰的链霉亲和素,例如野生型链霉亲和素或其片段,包含一种或多种氨基酸差异。术语“未修饰的链霉亲和素”指,对其进行一种或多种修饰的起始多肽。在一些实施方式中,所述起始或未修饰的多肽可以是SEQ ID NO:11所示的野生型多肽。在一些实施方式中,所述未修饰的链霉亲和素是野生型链霉亲和素的片段,其在N-末端和/或C-末端缩短。此类最小的链霉亲和素包括如下任何形式:N末端起始于SEQ ID NO:11的氨基酸位置10-16的区域中,且C末端终止于SEQ ID NO:11的氨基酸位置133-142的区域中。在一些实施方式中,所述未修饰的链霉亲和素具有SEQ ID NO:14所示的氨基酸序列。在一些实施方式中,所述未修饰的链霉亲和素,例如SEQ ID NO:14所示的,还可包含位于对应于Ala13(按照SEQ ID NO:11所示编号)的位置处的N末端甲硫氨酸。本文提供的链霉亲和素中的残基的编号参照SEQ ID NO:11中残基的编号。
术语“链霉亲和素突变蛋白”、“链霉亲和素突变体”其变化形式,指,相比未修饰的或野生型链霉亲和素,例如SEQ ID NO:11或SEQ ID NO:14所示的链霉亲和素,包含一种或多种氨基酸差异的链霉亲和素蛋白。所述一种或多种氨基酸差异可以是氨基酸突变,例如一种或多种氨基酸替代(取代)、插入或缺失。在一些实施方式中,链霉亲和素突变蛋白相比野生型或未修饰的链霉亲和素可具有至少1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20个氨基酸差异。在一些实施方式中,所述氨基酸替代(取代)是保守或非保守性突变。包含所述一种或多种氨基酸差异的链霉亲和素突变蛋白对于肽配体(Trp Arg His Pro Gln Phe Gly Gly;也称SEQ ID NO:5所示)显示的结合亲和性是恒定的亲和性,其大于2.7x104M-1。在一些实施方式中,所述链霉亲和素突变体对于肽配体(Trp Ser His Pro Gln Phe Glu Lys;也称 II,SEQ ID NO:6所示)显示的结合亲和性是恒定的亲和性,其大于1.4x104M-1。在一些实施方式中,结合亲和性可通过本领域已知的方法确定,例如下文所述的任一种。
在一些实施方式中,所述链霉亲和素突变蛋白在44、45、46和/或47中的一个或多个残基处包含突变。在一些实施方式中,所述链霉亲和素突变体包含残基Val44-Thr45-Ala46-Arg47,例如SEQ ID NO:12或SEQ ID NO:15所示的示例性链霉亲和素突变蛋白中所示。在一些实施方式中,所述链霉亲和素突变蛋白包含残基Ile44-Gly45-Ala-46-Arg47,例如SEQ ID NO:13或16所示的示例性链霉亲和素突变蛋白中所示。在一些实施方式中,所述链霉亲和素突变蛋白显示:SEQ ID NO:12、13、15或16所示的氨基酸序列,或与SEQ ID NO:12、13、15或16所示的氨基酸序列显示至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更多序列相同性并与肽配体(Trp Arg His Pro Gln Phe Gly Gly;也称SEQ ID NO:5所示)显示大于2.7x104M-1的结合亲和性和/或与肽配体(Trp Ser His Pro Gln Phe Glu Lys;也称 II,SEQ ID NO:6所示)显示大于1.4x104M-1的结合亲和性的氨基酸序列。
在一些实施方式中,所述链霉亲和素突变蛋白是描述于PCT国际申请公开号WO 2014/076277的突变体。在一些实施方式中,参照SEQ ID NO:11所示的氨基酸位置,所述链霉亲和素突变蛋白在氨基酸位置44-53的区域中包含至少两个半胱氨酸残基。在一些实施方式中,所述半胱氨酸残基位于位置45和52处以产生连接这些氨基酸的二硫桥。在此类实施方式中,氨基酸44通常是甘氨酸或丙氨酸,且氨基酸46通常是丙氨酸或甘氨酸,且氨基酸47通常是精氨酸。在一些实施方式中,参照SEQ ID NO:11所示的氨基酸位置,所述链霉亲和素突变蛋白在氨基酸残基115-121的区域中包含至少一个突变或氨基酸差异。在一些实施方式中,所述链霉亲和素突变蛋白包含,氨基酸位置117、120和121处的至少一个突变,和/或,氨基酸118和119缺失,和至少氨基酸位置121处的取代。
在一些实施方式中,链霉亲和素突变蛋白可包含任何组合形式的任何上述突变,只要所得的链霉亲和素突变蛋白显示对于肽配体(Trp Arg His Pro Gln Phe Gly Gly;也称SEQ ID NO:5所示)的结合亲和性大于2.7x104M-1,和/或,对于肽配体(Trp Ser His Pro Gln Phe Glu Lys;也称 II,SEQ ID NO:6所示)的结合亲和性大于1.4x104M-1即可。
在一些实施方式中,链霉亲和素突变体对于肽配体结合试剂的结合亲和性大于5x104M-1、1x105M-1、5x105M-1、1x106M-1、5x106M-1或1x107M-1,但一般低于1x1013M-1、1x1012M-1或1x1011M-1。
在一些实施方式中,所述链霉亲和素突变体还显示结合至其它链霉亲和素配体,例如但不限于,生物素、亚氨基生物素、硫辛酸、脱硫生物素、二氨基生物素、HABA(羟基偶氮苯-苯甲酸)或/和二甲基-HABA。在一些实施方式中,所述链霉亲和素突变蛋白显示对于另一链霉亲和素配体的结合亲和性,例如生物素或脱硫生物素,其大于所述链霉亲和素突变蛋白对肽配体(Trp Arg His Pro Gln Phe Gly Gly;也称SEQ ID NO:5)所示或肽配体(Trp Ser His Pro Gln Phe Glu Lys;也称 II,SEQ ID NO:6所示)的结合亲和性。
在一些实施方式中,所述链霉亲和素突变蛋白是多聚体。多聚体可采用本领域已知的任何方法,例如描述于公开的美国专利申请号US2004/0082012中的任何方法。在一些实施方式中,突变蛋白的寡聚物或聚合物可通过将羧基残基引入多糖,例如右旋糖酐来制备。在一些方面中,然后,可在第二步骤中采用常规碳化二亚胺化学法,使链霉亲和素突变蛋白通过内部赖氨酸残基和/或游离N末端的伯氨基偶联至右旋糖酐主链中的羧基基团。在一些实施方式中,所述偶联反应以约60摩尔链霉亲和素突变体/摩尔右旋糖酐的摩尔比进行。在一些实施方式中,寡聚物或聚合物也可经通过双功能接头(例如戊二醛)的交联或通过本领域已知的其它方法来获得。
在一些方面中,免疫亲和性珠,例如或其它免疫亲和性珠,可包含如下产自或源自杂交瘤的抗体:OKT3(αCD3)、13B8.2(αCD4)、OKT8(αCD8)、FRT5(αCD25)、DREG56(αCD62L)、MEM56(αCD45RA)。在一些实施方式中,任何上述抗体可在重和轻链可变区的框架区中包含一种或多种突变,但不靶向高度可变CDR区。在一些方面中,所述抗体的示例包括,抗CD4抗体,如美国专利号7,482,000和Bes等(2003)J.Biol.Chem.,278:14265-14273所述。在一些实施方式中,抗原-结合片段,例如Fab片段,可以由采用本领域已知方法从所述抗体产生,例如,在一些方面中,扩增重链和轻链的高变序列并克隆以允许与编码合适的恒定区的序列相组合。在一些实施方式中,所述恒定区来自人亚类IgG1/κ。所述抗体可在羧基末端与肽链霉亲和素结合分子(例如SEQ ID NO:10所示)融合。所述抗体的示例描述于Stemberget等(2102)PLoS One,7:35798和PCT国际申请号WO2013/011011。
在一些实施方式中,特异性地结合与珠或其它表面相联或被覆在珠或其它表面上的细胞表面标志物的抗体是全长抗体或是其抗原结合片段,包括a(Fab)片段、F(ab')2片段、Fab'片段、Fv片段、能够特异性地结合所述抗原的可变重链(VH)区、单链抗体片段,包括单链可变片段(scFv),和单一结构域抗体(例如,sdAb、sdFv、纳米抗体)片段。在一些实施方式中,所述抗体是Fab片段。在一些实施方式中,所述抗体可以是单价、二价或多价抗体。在一些实施方式中,所述抗体,例如Fab,是多聚体。在一些实施方式中,所述抗体,例如Fab多聚体,与所述细胞表面标志物形成多价复合物。
在一些实施方式中,所述抗体,例如与Streptamer相关联的Fab,显示特定结合亲和性动力学测量值(例如解离常数,KD,缔合常数KA,解离率或结合亲和性的其它动力学参数)。此类测量值可以是采用技术人员已知的任何结合试验来确定。在具体实例中,可采用基于亲和性的生物传感器技术作为结合亲和性的测量手段。示例性生物传感器技术包括,例如,Biacore技术、BioRad ProteOn、Reichert、GWC技术、IBIS SPIR成像、Nomadics SensiQ、Akubio RAPid、ForteBio Octet、IAsys、纳米膜等(参见例如Rich等(2009)Analytical Biochemistry,386:194-216)。在一些实施方式中,结合亲和性通过荧光滴定或滴定量热法来确定。
在一些实施方式中,所述抗体,例如Fab,显示与细胞上的细胞表面标志物结合的k0ff速率(也称解离速率常数)为:大于约0.5x10-4/秒、约1x10-4/秒、约2x10-4/秒、约3x10-4/秒、约4x10-4/秒、约5x10-4/秒、约1x10-3/秒、约1.5x10-3/秒、约2x10-3/秒、约3x10-3/秒、约4x10-3/秒、约5x10-3/秒、约1x10-2/秒,或约5x10-1/秒或更大。具体k0ff速率可确定抗体试剂能够从通过其与细胞表面标志物相结合的其与细胞的相互作用解离时的速率(参见例如PCT国际申请公开号WO/2013011011)。例如,在一些方面中,该k0ff范围可根据如下方面在某一范围内选择:例如,选择或富集的细胞的具体应用或使用,包括如下因素,例如是否希望从细胞表面移除结合的抗体,细胞培养或孵育的时间,对于细胞的敏感性,及其它因素。在一个实施方式中,抗体具有高k0ff速率,例如,大于4.0x10-4/秒,从而,在多价结合复合物的破坏之后,所述抗体中的大多数可在1小时内被移除,因为,在一些方面中,考虑所述复合物的半衰期T1/2,在56分钟之内,复合物的浓度降低至原始浓度的25%,假设再结合作用因足够的稀释而可忽略不计)。在另一实施方式中,对于具有例如1.0x10-4/秒的较低k0ff速率的抗体,解离可能耗时较长,例如大致或约212分钟或约3个半小时以从所述表面移除75%的所述抗体。
在一些实施方式中,所述抗体,例如Fab,显示的与细胞上的细胞表面标志物结合的解离常数(Ka)可以在如下范围:约10-2M-约10-8M,或约10-2M-约10-9M,或约10-2M-约0.8x10-9M,或约10-2M-约0.6x10-9M,或约10-2M-约0.4x10-9M,或约10-2M-约0.3x10-9M,或约10-2M-约0.2x10-9,或约10-2M-约0.15x10-9M,或约10-2-约10-10,在一些实施方式中,与细胞上的细胞表面标志物的结合的解离常数(Ka)可以在如下范围:约10-7M-约10-10M,或约10-7M-约0.8x10-9M,或约10-7M-约0.6x10-9M,约10-7M-约0.3x10-9M,1.1x10-7M-约10-10M,或约1.1x10-7M-约0.15x10-9M,或约1.1x10-7M-约0.3x10-9M,或约1.1x10-7M-约0.6x10-9M,或约1.1x10-7M-约0.8x10-9M。
在一些实施方式中,所述免疫亲和试剂,例如抗体,例如Fab,直接或间接连接至肽配体,例如能够结合至链霉亲和素突变体的肽配体(参见例如美国专利号5,506,121)。在一些实施方式中,所述肽包含SEQ ID NO:1-6中任一项所示的氨基酸序列。在一些实施方式中,所述免疫亲和试剂,例如抗体,例如Fab,直接或间接连接至包含SEQ ID NO:6所示的氨基酸序列的肽配体。
在一些实施方式中,所述免疫亲和试剂,例如抗体,例如Fab,直接或间接与包含依次排列的至少两个链霉亲和素-结合模块的肽序列融合,其中,所述两个模块之间的距离是至少0且不大于50个氨基酸,其中,一个结合模块具有3-8个氨基酸且至少包含序列His-Pro-Xaa(SEQ ID NO:1),其中Xaa是谷氨酰胺、天冬酰胺或甲硫氨酸,且其中另一个结合模块具有相同或不同的链霉亲和素肽配体的序列,例如SEQ ID NO:3所示(参见例如PCT国际申请公开号WO02/077018;美国专利号7,981,632)。在一些实施方式中,直接或间接融合至免疫亲和试剂,例如抗体,例如Fab,的肽配体包含SEQ ID NO:7或8中任一项所示的序列。在一些实施方式中,所述肽配体具有SEQ ID NO:9、10或17-19中任一项所示的氨基酸序列。
或者,可采用本领域已知的其它链霉亲和素-结合肽,例如如Wilson等(Proc.Natl.Acad.Sci.USA 98(2001),3750-3755)所述。在一些实施方式中,所述肽融合至蛋白质的N-和/或C-末端。
在一些实施方式中,将融合至能够结合链霉亲和素突变体的肽配体抗体,例如Fab,与包含珠的链霉亲和素突变体接触,以用抗体被覆所述珠。在一些实施方式中,被覆的珠可用于本文所述的富集和选择方法,通过使此类珠与待富集或选择的包含细胞的样品接触来进行。
在一些实施方式中,肽配体结合伴侣和链霉亲和素突变蛋白结合试剂之间的键是可逆的。在一些实施方式中,肽配体结合伴侣和链霉亲和素突变蛋白结合试剂之间的键合性高,例如如上所述,但低于链霉亲和素结合试剂对于生物素或生物素类似物的结合亲和性。因此,在一些实施方式中,可添加生物素(维生素H)或生物素类似物以竞争结合,以破坏珠上的链霉亲和素突变蛋白结合试剂和特异性结合至所述表面上的细胞标志物的抗体相关的肽配体结合伴侣之间的结合相互作用。在一些实施方式中,在低浓度的生物素或类似物的存在下,例如在0.1MM-10MM,0.5MM-5MM或1MM-3MM,例如一般至少或约至少1MM或至少2MM,例如是或约是2.5MM的生物素或类似物的存在下,所述相互作用是可逆的。在一些实施方式中,孵育在竞争剂,例如生物素或生物素类似物,的存在下进行,从而从选择的细胞释放珠。
b.免疫亲和色谱
在一些实施方式中,所述基于亲和性的选择采用免疫亲和色谱。在一些方面中,免疫亲和色谱方法包括,如美国公开专利申请号US2015/0024411中所述的一种或多种色谱基质。在一些实施方式中,所述色谱方法是流相色谱,通常是液相色谱。在一些实施方式中,所述色谱可以流通模式进行,其中施加包含待分离的细胞的流体样品,例如,通过重力流或通过包含色谱基质的柱的一个末端处的泵,并且其中所述流体样品从该柱的另一末端流出该柱。此外,在一些方面中,所述色谱可以“上下(up and down)”模式进行,其中施加包含待分离的细胞的流体样品,例如,通过移液器在包含色谱基质的柱的一个末端在吸管端内施加,并且其中,所述流体样品进入并在该柱的另一末端流出色谱基质/吸管端。在一些实施方式中,所述色谱还可以批量模式进行,其中,色谱材料(固定相)用包含所述细胞的样品孵育,例如,在振荡、旋转或重复接触的条件下,然后,例如,通过移液器移除所述流体样品。
在一些实施方式中,所述色谱基质是固定相。在一些实施方式中,所述色谱是柱色谱。在一些实施方式中,可采用任何合适的色谱材料。在一些实施方式中,所述色谱基质具有固相或半固相的形式。在一些实施方式中,所述色谱基质可包括聚合树脂或金属氧化物或类金属氧化物。在一些实施方式中,所述色谱基质是非磁性材料或不可磁化的材料。在一些实施方式中,所述色谱基质是衍生化的二氧化硅或交联的凝胶,例如以天然聚合物,例如多糖的形式。在一些实施方式中,所述色谱基质是琼脂糖凝胶。用于色谱基质的琼脂糖凝是本领域已知的,且在一些方面中包括,SuperflowTM琼脂糖或Sepharose材料,例如SuperflowTM它们以不同的珠和孔径市售可得。在一些实施方式中,所述色谱基质是与右旋糖酐共价结合的具体的交联琼脂糖基质,例如本领域已知的任何示例,例如在一些方面中,或其以不同的珠和孔径可得。
在一些实施方式中,色谱基质由合成聚合物制成,例如聚丙烯酰胺、苯乙烯-二乙烯基苯凝胶、丙烯酸酯和二醇的共聚物或丙烯酰胺和二醇的共聚物、多糖和琼脂糖的共聚物,例如聚丙烯酰胺/琼脂糖复合体、多糖和N,N’-亚甲基双丙烯酰胺,或偶联至合成或天然聚合物的衍生化的二氧化硅。
在一些实施方式中,所述色谱基质,例如琼脂糖珠或其它基质,的尺寸是至少或约至少50μm,60μm,70μm,80μm,90μm,100μm,120μm或150μm或更大。尺寸排阻色谱基质的排除限制经选择以低于样品中靶细胞,例如T细胞,的最大宽度。在一些实施方式中,所述基质的体积是至少0.5ML,1ML,1.5ML,2ML,3ML,4ML,5ML,6ML,7ML,8ML,9ML,10ML或更多。在一些实施方式中,所述色谱基质被填充进入柱。
在一些实施方式中,所述色谱基质为免疫亲和色谱基质,包括固定至其上的亲和试剂,例如抗体或抗原-结合片段,例如Fab。所述抗体或抗原-结合片段,例如Fab,可以是如上所述的任何类型,在一些方面中,包括本领域已知的抗体、具有具体k0ff速率的抗体和/或具有具体解离常数(Ka)的抗体。
在一些实施方式中,所述亲和性试剂,例如抗体或抗原-结合片段,例如Fab,是固定的。在一些实施方式中,所述免疫亲和试剂,例如抗体或抗原-结合片段,例如Fab,融合或连接至与固定在所述基质上的结合试剂相互作用的结合伴侣。在一些实施方式中,色谱基质的结合能力足以吸附或能够吸附至少1x107细胞/mL,5x107细胞/mL,1x108细胞/mL,5x108细胞/mL,1x109细胞/ml或更多,其中所述细胞是表达被亲和性试剂例如抗体或Fab特异性识别的细胞表面标志物的细胞。
在一些实施方式中,所述结合试剂和结合伴侣之间的相互作用形成可逆键,从而所述抗体与所述基质的结合是可逆的。在一些实施方式中,所述可逆的结合可通过如下物质介导:链霉亲和素突变体结合伴侣和固定在所述基质上的结合试剂,其为链霉亲和素、链霉亲和素类似物或突变蛋白、抗生物素蛋白或抗生物素蛋白类似物或突变蛋白。
在一些实施方式中,亲和性试剂,例如抗体或抗原-结合片段,例如Fab的可逆的结合通过肽配体结合试剂和链霉亲和素突变蛋白相互作用来进行,如上文关于免疫亲和性珠所述。在色谱基质的方面中,所述基质,例如琼脂糖珠或其它基质,是功能化的或连接至链霉亲和素突变蛋白,例如上述任意一种,例如SEQ ID NO:12、13、15或16中任一项所示。在一些实施方式中,所述抗体或抗原-结合片段,例如Fab,直接或间接融合或连接之能够结合至链霉亲和素突变体(例如上述任意一种)的肽配体。在一些实施方式中,所述肽配体是上述任意一种,例如包含SEQ ID NO:1-10或17-19中任一项所示的氨基酸序列的肽。在一些实施方式中,使所述色谱基质柱接触此类亲和试剂,例如抗体或抗原-结合片段,例如Fab,以将所述亲和性试剂固定或可逆结合至所述柱。
在一些实施方式中,所述免疫亲和色谱基质可用于本文所述的富集和选择方法,通过使所述基质与包含待富集或选择的细胞的样品接触来进行。在一些实施方式中,通过破坏所述结合伴侣/结合试剂的相互作用,所选择的细胞从所述基质洗脱或释放。在一些实施方式中,结合伴侣/结合试剂通过肽配体和链霉亲和素突变体相互作用介导,并且,释放或选择的细胞的进行可归因于可逆键的存在。例如,在一些实施方式中,肽配体结合伴侣和链霉亲和素突变蛋白结合试剂之间的键合性高,例如如上所述,但低于链霉亲和素结合试剂对于生物素或生物素类似物的结合亲和性。因此,在一些实施方式中,可添加生物素(维生素H)或生物素类似物以竞争结合,以破坏基质上的链霉亲和素突变蛋白结合试剂和特异性结合至所述表面上的细胞标志物的抗体相关的肽配体结合伴侣之间的结合相互作用。在一些实施方式中,在低浓度的生物素或类似物的存在下,例如在0.1MM-10MM,0.5MM-5MM或1MM-3MM,例如一般至少或约至少1MM或至少2MM,例如是或约是2.5MM的生物素或类似物的存在下,所述相互作用是可逆的。在一些实施方式中,洗脱在竞争剂,例如生物素或生物素类似物,的存在下进行,从而从基质释放选择的细胞。
在一些实施方式中,本文提供的方法中的免疫亲和色谱采用操作性地连接的至少两个色谱基质柱来进行,由此,针对CD4或CD8之一的亲和性或结合试剂,例如抗体,例如Fab,在第一选择柱中偶联至第一色谱基质,并且,针对CD4或CD8中另一者的亲和性或结合试剂,例如抗体,例如Fab,在第二选择柱中偶联至第二色谱基质。在一些实施方式中,所述至少两个色谱基质柱存在于封闭系统或设备,例如无菌的封闭系统或设备中。
在一些实施方式中,本文还提供封闭系统或设备,其包含操作性地连接的至少两个色谱基质柱,由此,针对CD4或CD8之一的亲和性或结合试剂,例如抗体,例如Fab,在第一选择柱中偶联至第一色谱基质,并且,针对CD4或CD8中另一者的亲和性或结合试剂,例如抗体,例如Fab,在第二选择柱中偶联至第二色谱基质。示例性的此类系统和方法描述于图1A和图1B,以及实施例中。
在一些实施方式中,所述封闭系统是自动化的。在一些实施方式中,与所述系统相关联的组件可包括整合的微型计算机、蠕动泵,和各种阀,例如夹管阀或转闩,以控制所述系统的各种部件之间的流体的流。在一些方面中,整合的计算机控制所述仪器的所有组件,并指示所述系统以标准化的顺序进行重复的步骤。在一些实施方式中,所述蠕动泵控制通过管组的流速,并且,与夹管阀一起,确保通过所述系统的缓冲液的受控的流。
参照图1A和图1B,在一些实施方式中,第一选择柱1中的包含第一亲和性或结合试剂的第一亲和基质3:i)通过管道和阀13操作性地偶联至第二选择柱2中的包含第二亲和性或结合试剂的第二亲和性基质4,从而已经通过第一亲和色谱基质且未结合至其上的第一亲和性或结合试剂的细胞能够通入第二亲和性基质,和ii)操作性地偶联至输出容器,例如培养器皿12,以从第一亲和基质收集结合至其上的第一亲和性或结合试剂的选择的细胞,例如在从第一亲和基质洗脱并释放所述细胞之后。在一些实施方式中,第二选择柱2中的包含第二亲和性或结合试剂的所述第二亲和性基质4也操作性地偶联至所述输出容器,例如培养器皿12,以从第二亲和性基质收集结合至其上的第二亲和性或结合试剂的选择的细胞,例如在从第二亲和性基质洗脱和释放所述细胞之后。在一些实施方式中,所述第二选择柱2通过移除腔室9操作性地连接至所述输出容器,例如培养器皿12,所述移除腔室9包含结合试剂,例如链霉亲和素突变体,其能够以高亲和性,例如大于10-10M-1,结合至洗脱试剂,例如生物素。
在一些实施方式中,第一选择柱1和第二选择柱2的尺寸,例如长度和/或直径,可以相同或不同。在一些实施方式中,第一柱1或第二柱2的尺寸,例如长度和/或直径,比所述柱中的另一者的尺寸大至少1.2倍、1.5倍、2倍、3倍、4倍、5倍、5倍、7倍、8倍、9倍、10倍或更多。
在一些实施方式中,第一选择柱1的包含第一亲和性或结合试剂的第一亲和基质3也通过管道和阀13操作性地连接至第三选择柱15中的包含第三亲和性或结合试剂的第三亲和基质17,从而,从第一亲和基质选择的结合至其上的第一亲和性或结合试剂的细胞能够进入第三亲和基质,例如在从第一亲和基质洗脱和释放所述细胞之后。在一些实施方式中,所述第一选择柱1通过移除腔室9操作性地连接至第三选择柱15,所述通过移除腔室9包含结合试剂,例如链霉亲和素突变体,其能够以高亲和性,例如大于10-10M-1,结合至洗脱试剂,例如生物素。在一些实施方式中,第三选择柱15中的包含第三亲和性或结合试剂的第三亲和基质17也操作性地偶联至所述输出容器,例如培养器皿12,以从第三亲和基质收集已结合至其上的第三亲和性或结合试剂(并且先前已结合至第一亲和性或结合试剂)的选择的细胞,例如在从第三亲和基质(并且先前从第一亲和基质)洗脱和释放所述细胞之后。在一些实施方式中,所述第三选择柱15通过移除腔室9操作性地连接至所述输出容器,例如培养器皿12,所述移除腔室9包含结合试剂,例如链霉亲和素突变体,其能够以高亲和性,例如大于10-10M-1,结合至洗脱试剂,例如生物素。
在一些实施方式中,第一选择柱1和第三选择柱15的尺寸,例如长度和/或直径,可以相同或不同。在一些实施方式中,第一柱1或第三柱15的尺寸,例如长度和/或直径,比所述柱中的另一者的尺寸大至少1.2倍、1.5倍、2倍、3倍、4倍、5倍、5倍、7倍、8倍、9倍、10倍或更多。
在一些实施方式中,第一选择柱1例如通过管道、阀和泵8,操作性地偶联至包含细胞样品5的贮存储器,以使细胞样品进入第一选择柱。
在一些实施方式中,所述第一选择柱1也例如通过管道和阀操作性地偶联至包含清洗缓冲液的清洗储器6和/或包含洗脱液的洗脱储器7,以允许清洗缓冲液或洗脱缓冲液分别通入第一选择柱中的第一色谱基质。在一些实施方式中,归因于第一和第二选择柱之间的操作性连接,所述清洗缓冲液和/或洗脱缓冲液可操作性地通入第二柱。在一些实施方式中,归因于第一和第三选择柱之间的操作性连接,所述清洗缓冲液和/或洗脱缓冲液可操作性地通入第三选择柱。
在一些实施方式中,所述第二选择柱2也例如通过管道和阀操作性地偶联至包含清洗缓冲液的清洗储器6和/或包含洗脱液的洗脱储器7,以允许清洗缓冲液或洗脱缓冲液分别通入第一选择柱中的第一色谱基质。
清洗缓冲液可以是与细胞相容的任何生理学缓冲液,例如磷酸盐缓冲盐水。在一些实施方式中,所述清洗缓冲液包含牛血清白蛋白,人血清白蛋白,或重组人血清白蛋白,例如以0.1%-5%或0.2%-1%,例如或在约0.5%的浓度。在一些实施方式中,所述洗脱液是生物素或生物素类似物,例如脱生物素(desbiotin),例如其量是或约是至少0.5MM,1MM,1.5MM,2MM,2.5MM,3MM,4MM,或5MM。
在一些实施方式中,第一选择柱1中的第一亲和基质3通过管道和阀操作性地连接至第一亲和性试剂储器(例如Fab储器)18,其包含第一亲和性或结合试剂,例如抗体,例如Fab,例如用于固定至第一亲和基质上。在一些实施方式中,第二柱2中的第二亲和性基质4通过管道和阀操作性地连接至第二亲和性或结合试剂储器(例如Fab储器)19,其包含第二亲和性或结合试剂,例如抗体,例如Fab,例如用于固定至第二亲和性基质上。在一些实施方式中,第三选择柱15中的第三亲和基质17通过管道和阀操作性地连接至第三亲和性或结合试剂储器(例如Fab储器)20,其包含第三亲和性或结合试剂,例如抗体,例如Fab,例如用于固定至第二亲和性基质上。
在一些实施方式中,所述第一和/或第二亲和性试剂特异性结合CD4或CD8,其中第一和第二亲和性试剂不相同。在一些实施方式中,所述第三亲和性试剂特异性结合原初、静息或中心记忆T细胞上的标志物,或特异性结合CD45RO、CD62L、CCR7、CD28、CD3、CD27和/或CD127标志物。
5.富集和产生的组合物的比率
在一些实施方式中,采用如上所述的方法进行第一和第二选择,从样品分别富集表达第一细胞表面标志物的第一细胞群和表达第二细胞表面标志物的第二细胞群。在具体实例中,富集的细胞的第一和/或第二群可以是针对CD4+细胞进行富集的细胞群,并且所述富集的细胞群中的另一者,即第一或第二细胞群中的另一者,可以是针对CD8+进行富集的群。如上所述,在一些实施方式中,可进行第三、第四或后续选择以针对来自先前在第一、第二或后续富集中富集的细胞群的其它细胞亚群进行富集,例如CD4+细胞的亚群和/或CD8+细胞的亚群。
在一些实施方式中,所述方法产生富集的细胞组合物,其包含第一和第二群富集的细胞,例如,针对CD4+细胞进行富集的细胞群和针对CD8+细胞进行富集的细胞群。在一些实施方式中,所述富集的细胞组合物是指定的培养起始组合物并用于后续处理步骤,例如涉及富集的细胞的孵育、刺激、活化、工程改造和/或配制的后续处理步骤。在一些实施方式中,在进一步处理步骤,例如涉及孵育、刺激、活化、工程改造和/或配制的处理步骤之后,在一些方面中,产生输出组合物,其可包含含有表达遗传工程改造的抗原受体的CD4+细胞和CD8+细胞的遗传工程改造的细胞。
在一些实施方式中,所述富集的细胞组合物是从如上所述的起始样品富集的细胞,其中,所述起始样品中的细胞数量至少大于富集的组合物例如培养起始组合物中所需的细胞数量。在一些实施方式中,所述起始样品中的细胞数量比富集的组合物中的所需细胞数量大至少10%,20%,30%,40%,50%,60%,70%,80%,90%,100%,500%,1000%,5000%或更多。在一些实例中,富集的群(包括富集的CD4+细胞、CD8+细胞或其亚群)中的所需细胞数量是至少1x106个细胞,2x106个细胞,4x106个细胞,6x106个细胞8x106个细胞,1x107个细胞,2x107个细胞,4x107个细胞,6x107个细胞,8x107个细胞,1x108个细胞,2x108个细胞,4x108个细胞,6x108个细胞,8x108个细胞,1x109个细胞或更大。在一些实施方式中,所述起始样品中的细胞数量是至少1x108个细胞,5x108个细胞,1x109个细胞,2x109个细胞,3x109个细胞,4x109个细胞,5x109个细胞,6x109个细胞,7x109个细胞,8x109个细胞,9x109个细胞,1x1010个细胞或更多。
在一些实施方式中,所述富集的组合物中的第一和/或第二群或其亚群的产量,即,所述群或亚群中富集的细胞的数量,相比于起始样品中的相同群或细胞亚群的数量,是10%-100%,例如20%-80%,20%-60%,20%-40%,40%-80%,40%-60%,或60%,至80%。在一些实施方式中,第一和/或第二细胞群或其亚群的产量少于70%,少于60%,少于50%,少于40%,少于30%或少于20%。
在一些实施方式中,富集的组合物中的第一和/或第二细胞群或其细胞亚群的纯度,即,对选择的细胞表面标志物呈阳性的细胞的百分数,对比富集的细胞的群中的总细胞,是至少90%,91%,92%,93%,94%,并且一般是至少95%,96%,97%,98%,99%或更大。
在一些实施方式中,所述富集的细胞组合物,例如培养起始组合物,包含处于培养物起始比的CD4+细胞与CD8+细胞之比。所述培养物起始比是培养起始组合物中包括的两种细胞类型或分离的细胞群所处的比率或细胞数量,其经设计以导致,在孵育和/或工程改造步骤或其它处理步骤完成时和/或融化后和/或即将给予对象前的所需的输出比或剂量(例如用于给予患者的比率或剂量),或处于其耐受误差率或差异之内。在本文提供的方法的实施方式中,第一和/或第二选择,或对于其亚群的选择,可以某一方式进行以导致所选的培养物起始比。此类方法的示例描述于下文和实施例中。
a.培养物起始比和数量
在一些实施方式中,CD4+或其亚群与CD8+细胞或其亚群的培养物起始比介于是或约是10:1和是或约是1:10之间,介于是或约是5:1和是或约是1:5之间,或介于是或约是2:1和是或约是1:2之间。在一些实施方式中,CD4+细胞或其亚群与CD8+细胞或其亚群的培养物起始比是或约是1:1。
在一些实施方式中,CD4+与CD8+细胞或其亚群的培养物起始比不同于来自所述对象的样品中的CD4+与CD8+细胞或其亚群之比。在一些实施方式中,经报道,来自对象的样品(例如血液样品)中的CD4+与CD8+T细胞的比率介于1:1和14:1CD4+:CD8+细胞之间,并且一般介于约1.5:1和约2.5:1CD4+:CD8+细胞之间。在一些实施方式中,样品(例如血液样品)中的CD4+与CD8+T细胞的比率约是2:1CD4+:CD8+细胞,在一些实施方式中,样品(例如血液样品)中的CD4+与CD8+T细胞的比率约是1:1。(参见例如Amadori,A等,Nature Med.1:1279-1283,1995;Chakravarti,A.,Nature Med.1:1240-1241,1995;Clementi,M.等,Hum.Genet.105:337-342,1999.)在一些实施方式中,对象比率是少于1:1CD4+:CD8+细胞。(参见例如Muhonen,T.J Immunother Emphasis Tumor Immunol.1994年1月;15(1):67-73.)。在一些实施方式中,CD4+与CD8+细胞的培养物起始比是至少10%、至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少90%、至少100%、至少125%、至少150,至少200%、至少300%、至少400%,或至少500%大于或小于来自所述对象的样品中的CD4+与CD8+细胞之比。
在一些实施方式中,在进行该第一和/或第二选择之前,确定来自所述对象的样品中的CD4+与CD8+T细胞的比率。基于所述对象中的CD4+与CD8+T细胞的具体比率(其可根据不同对象而不同),可以对对象个性化具体的选择模式,例如通过测量色谱柱的大小或选择免疫亲和试剂的量或浓度,以实现所需或所选的培养物起始比。对象中的各种细胞群的相对水平或频率可基于对存在于此类群或亚群上的一种或多种标志物的表面表达的评估来确定。可采用用于评估表面标志物或蛋白质的表达水平的许多熟知的方法,例如通过如下方法的检测:基于亲和性的方法,例如,基于免疫亲和性的方法,例如,在细胞表面蛋白质方面,例如通过流式细胞术。
在一些情况中,具体细胞类型的合适的培养物起始比可视情况而定,例如,对于具体疾病、病症,或对于治疗衍生细胞的对象的先前治疗,和/或所述细胞的具体抗原特异性,细胞中各种亚群的具体类型(例如,CD8+T细胞)的相对值表示(relative representation),例如,效应对比记忆对比原初细胞,和/或孵育细胞的一种或多种条件,例如培养基、刺激剂、培养时间、缓冲液、含氧量、二氧化碳含量、抗原、细胞因子、抗体,和其它组分。因此,通常或一般已知比另一类型更快速地增殖或扩增的细胞类型并非在每种情况中都展现这样的性质。因此,在一些方面中,所述培养物起始比基于常规或典型情况中细胞类型的已知能力,联合对于所述细胞或衍生所述细胞的对象的表型或状态的评估,和/或实验性证据来确定。
在一些实施方式中,所述培养物起始比在浓度方面基于对已知或确定的具体细胞类型的这些特征中的一种或多种的了解。在一些实施方式中,所述培养起始组合物中的CD4+与CD8+细胞之比,或多或少,分别比CD4+与CD8+的所需输出比大或小1.5倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍。
在一些实施方式中,例如,在一些情况中,已知在某一刺激条件孵育时,CD4+细胞相比CD8+细胞具有更小程度或更慢的增殖或扩增。参见例如,Foulds等.(2002)J Immunol.168(4):1528-1532;Caggiari等.(2001)Cytometry.46(4)233-237;Hoffman等.(2002)Transplantation.74(6):836-845;和Rabenstein等.(2014)J Immunol.在2014年3月17日线上发表,doi:10.4049/jimmunol.1302725。因此,在一些实例中,培养起始组合物中的CD4+与CD8+细胞之比是所需输出比的10倍或100倍。例如,如果需要1:1(或50%/50%)CD4/CD8输出比,则CD4+和CD8+群在一个实例中可以如下比率包括在所述培养起始组合物中:2:1、3:1、4:1、5:1、6:1、7:1、8:1、9:1、10:1、20:1、30:1、40:1、50:1、60:1、70:1、80:1、90:1或100:1,例如,考虑具体时程期间的扩增速率差异。根据CD4+或CD8+细胞或其亚群与另一者的扩增或增殖速率的差异,技术人员能通过经验确定培养物起始比以在具体刺激或活化条件下处理后实现所需输出比。
培养物起始比不必与所需输出比相同或甚至近似。例如,如果需要以1:1或其某一误差之内给予CD4+和CD8+工程改造的(例如,CAR-表达)T细胞,则CD4+和CD8+细胞的培养物起始比通常不是1:1。在一些实施方式中,导致所需输出比的培养物起始比根据如下因素而不同,例如,根据细胞来源、待培养的细胞类型、待给予所述细胞的患者、分离或衍生了所述细胞的一个或多个对象,例如所述对象缩环的疾病或病症,待治疗的疾病、培养条件,和其它参数。
在一些实施方式中,所述培养物起始比基于各细胞亚群的组合。在某些实施方式中,所述培养物起始比基于所述细胞群在其被遗传工程改造之前被培养的时长。在一些实施方式中,所述培养物起始比基于各细胞群的增殖速率。
作为另一方面,在一些实施方式中,所述方法还包括:确定培养物起始比或数量。在一些实施方式中,所提供的方法包括:用于确定合适的比率、剂量和细胞数量、细胞类型,和细胞的群的方法和步骤。例如,提供用于确定CD4+/CD8+细胞、群和/或亚群的比率和确定所述细胞和亚型的合适的剂量的方法。在一些实施方式中,提供用于确定组合物(例如培养起始组合物)中待包含的细胞类型或细胞群的合适的比率或数量以实现所需结果的方法。在一些方面中,所述比率或数量经设计以用于孵育或工程改造步骤,以实现所需输出比或剂量。在一些实施方式中,提供用于确定用于给予对象或患者的细胞、类型或群的所需比率,和/或其细胞数量的方法。
在一些实施方式中,所选的培养物起始比基于在此类条件下孵育时,各细胞群或细胞类型(例如CD4+对比CD8+细胞)在培养中存活和/或增殖或扩增速率方面的不同的细胞类型或群的相对能力。因此,在一些方面中,在测试孵育之后,例如,在孵育后和/或在冻存或冷冻步骤之后和/或在此类步骤之后的融化之后,例如给予前即刻(例如,在床边)的具体一个或多个时间点,检测或评估增殖速率、存活和/或输出比,以确定培养起始的最优选比率。任何数量的熟知的方法用于确定体外或离体细胞增殖速率或存活,包括流式细胞术方法,例如用羧基荧光素二醋酸盐琥珀酰亚胺酯(CFSE)或相似的荧光染料在孵育之前标记,然后通过流式细胞术评估荧光强度,和/或评估细胞与Annexin V或其它化合物识别标志物在凋亡细胞上或内的结合,和/或DNA间螯合剂,例如碘化丙啶或7AAD的摄取,并且通过流式细胞术评估摄取和/或细胞周期阶段作为增殖或凋亡的检测手段。
在一些实施方式中,所述培养物起始比通过如下方式来确定:以测试组合物的不同的比率范围,在某测试条件下,通过孵育细胞的两个分离的群(例如,亚群),并且评估一种或多种结果,例如某一时期之后获得的输出比。在一些方面中,所述条件是刺激的条件,例如待用于孵育培养起始组合物用于培养和/或工程改造步骤的那些类似条件。例如,在一些方面中,所述测试组合物在一种或多种,例如,各种相同刺激剂、培养基、缓冲液、气体含量的存在下给予,和/或在相同类型的容器或器皿中给予,和/或给予相同或约相同量的时间,作为待用于孵育和/或工程改造步骤中的参数,其待用于制备或产生最终组合物,例如用于给予的工程改造的组合物。
用于测试培养起始组合物的示例性测试比率可包括:是或约是90%/10%,80%/20%,70%/30%,60/40%,50/50%,40/60%,30/70%,20%/80%,和10%/90%,或0.1:1,0.5:1,0.7:1,0.8:1,0.9:1,1:1,1:1.1,1:1.2.,1:1.3,1:1.4,1:1.5,或多于是或约是1:1.5,或是或约是1:0.1,1:0.4,1:0.7,1:0.8,1:0.8,1.1:1,1.2:1,1.3:1,1.4:1,或1.5;1,或更多。
在一些情况中,用以在生产末期实现所需CD4:CD8比率的CD4+与CD8+细胞的合适的培养物起始比基于如下方面来确定:基于具体分离的细胞产物中CD4+和/或CD8+亚群的分数,例如具体分离的组合物中存在的原初、效应和各种记忆区隔的存在和/或百分数。此类评估可通过,例如通过流式细胞术确定细胞上的各种表面标志物的存在或水平来进行。
在一些实施方式中,所述培养物起始比基于各细胞群的表型。在某些实施方式中,所述培养物起始比基于培养条件(例如,例如培养基的组成,生长因子、刺激剂和/或其它试剂的存在和/或不存在、温度、通气条件等)。
在本文所述方法的一些实施方式中,所述培养物起始比产生包含一定比率的CD4+:CD8+细胞或所述亚型的数量或总细胞数量的输出组合物,其在所需比率或剂量的约10%,约15%,约20%,约25%,约30%,约35%,约40%,约45%或约50%之内,包括这些值之间的任何范围。在本文所述方法的一些实施方式中,所述培养物起始比在所用时间的至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%,或多于95%时(包括这些值之间的任何范围)产生具有所需的CD4+:CD8+细胞比率或所述细胞剂量的输出组合物。在所述方法的某些实施方式中,所述培养物起始比产生所述输出组合物中的CD4+与CD8+细胞之比,其在至少80%的时间时处于所需输出比的20%之内。在本文所述方法的一些实施方式中,所述输出组合物包含处于所需输出比的耐受差异之内的CD4+与CD8+细胞之比,所述耐受差异已如上所述,例如,通过给予多种比率的CD4+和CD8+细胞至一个或多个对象来确定。
b.输出比和剂量
在一些实施方式中,所述方法在培养起始组合物的一个或多个处理步骤,例如细胞的孵育、刺激、活化、工程改造和/或配制之后产生输出组合物。在一些实施方式中,进行所述方法以实现或获得所需CD4+与CD8+细胞或其亚群之比,其介于是或约是2:1和是或约是1:5之间,介于是或约是2:1和是或约是1:2之间,介于是或约是1.5:1和是或约是1:5之间,介于是或约是1.5:1和是或约是1:2之间,或介于是或约是1:1和是或约是1:2之间。在一些实施方式中,输出组合物中的CD4+与CD8+细胞的所需输出比是1:1或约是1:1。
在一些实施方式中,所述方法产生或生成输出组合物,例如包含遗传工程改造的CD4+T细胞和CD8+T细胞或其亚群的组合物,其中,所述组合物或其亚群中的CD4+T与CD8+T细胞的输出比介于是或约是2:1和是或约是1:5之间,介于是或约是2:1和是或约是1:2之间,介于是或约是1.5:1和是或约是1:5之间,介于是或约是1.5:1和是或约是1:2之间,或介于是或约是1:1和是或约是1:2之间。在一些实施方式中,所述方法产生或生成包含CD4+与CD8+细胞输出比是1:1或约是1:1的输出组合物。
在一些实施方式中,CD4+与CD8+T细胞的输出比是作为用于免疫治疗,例如联合过继免疫治疗方法的T细胞剂量的部分所需的比率。
在一些实施方式中,确定所需剂量,例如所述细胞类型或群的所需细胞数量和/或所需输出比(例如,最优选用于治疗性给予患者的比率)。在一些实施方式中,所述方法包括用于确定基于所需输出或给予比率或剂量的耐受误差或耐受差异的步骤,即,给定组合物(例如,工程改造的组合物)中的比率可与所需输出比相差该误差范围,但仍实现所需结果,例如对象或患者中的可接受程度的安全性,或治疗具体疾病或病症的功效或其它疗效。
在一些实施方式中,所需剂量、比率和/或所述耐受误差取决于,待治疗的疾病或病症、对象、细胞来源,例如细胞是否源自具有具体病症或疾病的对象,以及细胞是否用于自体或同种异体移植,例如,它们是否分离自待在过继细胞治疗中接受该细胞的对象,和/或,所述对象是否已接受或正在接受另一治疗,和/或所述治疗的同一性。在一些实施方式中,所述比率、数量和/或耐受差异或误差取决于,所述细胞的一种或多种其它性质,例如增殖速率、存活能力、具体标志物的表达或因子(例如细胞因子)的分泌,或在孵育和工程改造步骤之前分离的具体亚群。在一些实例中,所需比率和/或耐受误差或差异可根据如下因素变化:年龄、性别、健康和/或对象体重,作为疾病性状的指示的生物标志物,待共同给予或先前已给予所述对象的治疗。
在一些实施方式中,所需比率、剂量和/或耐受误差通过如下方式确定:给予各种测试组合物(其各自包含不同的比率或不同的数量的感兴趣的细胞类型或群)至测试对象,然后评估一种或多种结果或参数,例如指示安全性、治疗功效、体内浓度或细胞定位的参数,和/或其它所需结果。
在一些实施方式中,所述测试对象是非人动物,例如正常动物或疾病动物模型,例如待通过给予所述细胞治疗的疾病或病症。在一些实施方式中,用于给予测试对象的各种测试比率是或约是90%/10%,80%/20%,70%/30%,60/40%,50/50%,40/60%,30/70%,20%/80%,和10%/90%,例如,表达为一种细胞类型或亚型(例如,CD4+T细胞或其亚型)和另一细胞类型(例如,CD8+T细胞或NK细胞或其亚型)之比,及其之间的值(interim value)。该比率可表达为相对百分比或任何其它形式,例如如下比率:是或约是0.1:1,0.5:1,0.7:1,0.8:1,0.9:1,1:1,1:1.1,1:1.2.,1:1.3,1:1.4,1:1.5,或多于是或约是1:1.5,或是或约是1:0.1,1:0.4,1:0.7,1:0.8,1:0.8,1.1:1,1.2:1,1.3:1,1.4:1,或1.5;1,或更多,包括这些值之间的任何范围。在一些实施方式中,该测试对象是人。在一些实施方式中,所需比率是具有特定的最优选效果的的测试对象的平均、算术平均,或中值比率。在一些方面中,所需比率是安全性对比功效的一些最优选平衡所实现的比率。在一些方面中,所需比率或剂量是实现所有测试比率或剂量中的最高功效但仍保持安全性阈限的的比率或剂量。在一些方面中,所需比率或剂量是实现最高程度的安全性且同时保持功效阈限或在功效范围之内的比率或剂量。在一些情况中,最优选比率或剂量以范围形式表达,例如一种细胞类型与另一种之比介于1:1和1:2之间,或介于104和109或介于105和106细胞/kg体重之间。
在一些实施方式中,监测基于来自所需平均测试对象的离差而确定的耐受误差以评估各百分比组合的治疗功效和/或安全性。在一些实施方式中,所述耐受误差将在所需比率的约1%,约2%,约3%,约4%约5%,约10%,约15%,约20%,约25%,约30%,约35%,约40%,约45%,约50%之内,包括这些范围之间的任何值。
6.选择或富集细胞的示例性方法
a.采用免疫磁珠的单一处理流和/或同时选择
在一些实施方式中,所述分离和/或步骤采用免疫磁珠进行。在一些实施方式中,使包含CD4+和CD8+细胞的细胞样品(例如原代人T细胞样品)接触,包含结合至CD4或CD8的第一免疫亲和试剂的磁珠,和包含结合至CD4或CD8中另一者的第二免疫亲和试剂的磁珠。所述分离和/或步骤可同时和/或依次进行。
在一些实施方式中,使所述细胞与磁珠的接触同时进行,由此,对于包含表面标志物CD4和CD8的细胞的富集也同时进行。在一些这样的方面中,所述方法包括:在孵育组合物中,于一定条件下,使包含原代人T细胞的样品的细胞与特异性结合至CD4的第一免疫亲和试剂和特异性结合至CD8的第二免疫亲和试剂接触,由此,所述免疫亲和试剂分别特异性结合至所述样品中的细胞表面上的CD4和CD8分子,和,回收结合至第一和/或第二免疫亲和试剂的细胞,由此产生以培养初始比包含CD4+细胞和CD8+细胞的富集的组合物。
在一些实施方式中,第一和/或第二免疫亲和试剂在所述孵育组合物中以次优产出浓度存在,由此,所述富集的组合物包含所述孵育组合物中的少于70%的总CD4+细胞和/或所述孵育组合物中的少于70%的CD8+细胞,由此产生富集CD4+和CD8+T细胞的组合物。
在一些实施方式中,所述亲和性试剂的次优产出浓度是这样一种浓度,该浓度低于所用浓度或低于使结合的细胞在给定选择或富集(涉及采用所述试剂孵育细胞和回收或分离已结合至所述试剂的细胞)中实现最优或最大产量所需的浓度(“产量”或“产出”,例如,是如此回收或选择的细胞相比于所述孵育中的总细胞数量的的数量,其被所述试剂靶向或所述试剂对其具有特异性,或其具有所述试剂具有特异性且能结合的标志物)。所述次优产出浓度一般是试剂的浓度或量,其在所述过程或步骤中,在回收已结合至所述试剂的细胞之后,获得超过70%产量的结合的细胞。在一些实施方式中,通过该次优浓度获得不超过是或约是50%,45%,40%,30%,或25%的产量。所述浓度可以如下形式表示:每细胞的颗粒或表面的数量或质量,和/或每细胞的试剂质量或分子数量(例如,抗体,例如抗体片段)。
例如,在一些实施方式中,所述次优产出浓度少于,所述孵育组合物中,每1x109,每2x109细胞,每3x109细胞,每4x109细胞,每5x109细胞,每10x109细胞,每15x109细胞,或每20x109细胞是或约是30μM试剂(例如,抗体)。在一些实施方式中,所述次优产出浓度是,在所述孵育组合物中,每1x109,每2x109细胞,每3x109细胞,每4x109细胞,每5x109细胞,每10x109细胞,每15x109细胞,或每20x109细胞少于或约30μM试剂(例如,抗体);在一些实施方式中,所述次优产出浓度是,在所述孵育组合物中,每1x109,每2x109细胞,每3x109细胞,每4x109细胞,每5x109细胞,每10x109细胞,每15x109细胞,或每20x109细胞少于或约20μM试剂(例如,抗体);在一些实施方式中,所述次优产出浓度是,在所述孵育组合物中,每1x109,每2x109细胞,每3x109细胞,每4x109细胞,每5x109细胞,每10x109细胞,每15x109细胞,或每20x109细胞少于或约10μM试剂(例如,抗体);在一些实施方式中,所述次优产出浓度是,在所述孵育组合物中,每1x109,每2x109细胞,每3x109细胞,每4x109细胞,每5x109细胞,每10x109细胞,每15x109细胞,或每20x109细胞少于或约15μM试剂(例如,抗体);在一些实施方式中,所述次优产出浓度是,在所述孵育组合物中,每1x109,每2x109细胞,每3x109细胞,每4x109细胞,每5x109细胞,每10x109细胞,每15x109细胞,或每20x109细胞少于或约10μM试剂(例如,抗体);在一些实施方式中,所述次优产出浓度是,在所述孵育组合物中,每1x109,每2x109细胞,每3x109细胞,每4x109细胞,每5x109细胞,每10x109细胞,每15x109细胞,或每20x109细胞少于或约5μM试剂(例如,抗体);在一些实施方式中,所述次优产出浓度是,在所述孵育组合物中,每1x109,每2x109细胞,每3x109细胞,每4x109细胞,每5x109细胞,每10x109细胞,每15x109细胞,或每20x109细胞少于或约1μM试剂(例如,抗体);在一些实施方式中,所述次优产出浓度是,在所述孵育组合物中,每1x109,每2x109细胞,每3x109细胞,每4x109细胞,每5x109细胞,每10x109细胞,每15x109细胞,或每20x109细胞少于或约0.5μM试剂(例如,抗体);在一些实施方式中,所述次优产出浓度是,在所述孵育组合物中,每1x109,每2x109细胞,每3x109细胞,每4x109细胞,每5x109细胞,每10x109细胞,每15x109细胞,或每20x109细胞少于或约0.2μM试剂(例如,抗体)。
在一些实施方式中,所述次优产出浓度是,在所述孵育组合物中,每1x109,每2x109细胞,每3x109细胞,每4x109细胞,每5x109细胞,每10x109细胞,每15x109细胞,或每20x109细胞少于或约15Mg珠、颗粒、表面或总试剂;在一些实施方式中,所述次优产出浓度是,在所述孵育组合物中,每1x109,每2x109细胞,每3x109细胞,每4x109细胞,每5x109细胞,每10x109细胞,每15x109细胞,或每20x109细胞少于或约10Mg珠、颗粒、表面或总试剂;在一些实施方式中,所述次优产出浓度是,在所述孵育组合物中,每1x109,每2x109细胞,每3x109细胞,每4x109细胞,每5x109细胞,每10x109细胞,每15x109细胞,或每20x109细胞少于或约5Mg珠、颗粒、表面或总试剂;在一些实施方式中,所述次优产出浓度是,在所述孵育组合物中,每1x109,每2x109细胞,每3x109细胞,每4x109细胞,每5x109细胞,每10x109细胞,每15x109细胞,或每20x109细胞少于或约4Mg珠、颗粒、表面或总试剂;在一些实施方式中,所述次优产出浓度是,在所述孵育组合物中,每1x109,每2x109细胞,每3x109细胞,每4x109细胞,每5x109细胞,每10x109细胞,每15x109细胞,或每20x109细胞少于或约3Mg珠、颗粒、表面或总试剂;在一些实施方式中,所述次优产出浓度是,在所述孵育组合物中,每1x109,每2x109细胞,每3x109细胞,每4x109细胞,每5x109细胞,每10x109细胞,每15x109细胞,或每20x109细胞少于或约2Mg珠、颗粒、表面或总试剂;在一些实施方式中,所述次优产出浓度是,在所述孵育组合物中,每1x109,每2x109细胞,每3x109细胞,每4x109细胞,每5x109细胞,每10x109细胞,每15x109细胞,或每20x109细胞少于或约1Mg珠、颗粒、表面或总试剂;在一些实施方式中,所述次优产出浓度是,在所述孵育组合物中,每1x109,每2x109细胞,每3x109细胞,每4x109细胞,每5x109细胞,每10x109细胞,每15x109细胞,或每20x109细胞少于或约0.5Mg珠、颗粒、表面或总试剂。
在一些实施方式中,例如,当以与两种或更多种标志物或细胞具有亲和性的两种或更多种选择试剂中的各种或一种或多种的次优产出浓度操作时,一种或多种所述试剂以高于所述试剂中的其它一种或多种的浓度使用,以使通过该试剂识别的细胞类型的比率相比通过另一种识别的细胞类型具有偏差。例如,需用以使比率具有偏差的特异性地结合至标志物的试剂可以如下浓度包括(例如,试剂或质量/细胞),所述浓度相比其它浓度增加一半,1倍,2倍,3倍,4倍,5倍,10倍,或更多,这取决于需要使比率增加多少。
在一些实施方式中,采用次优产出浓度以使一个或两个细胞群产生偏差能够实现所需或所选的培养物起始比。在一些实施方式中,从样品(其是包含CD4+和CD8+细胞的样品)进行所述选择,其包含大量的细胞,例如至少1x109细胞,2x109细胞,3x109细胞,4x109细胞,5x109细胞,6x109细胞,7x109细胞,8x109细胞,1x1010细胞,2x1010细胞,3x1010细胞,4x1010细胞,5x1010细胞或更多。在一些实施方式中,该大量细胞足以确保免疫亲和试剂在所述样品中对于表达其中所述试剂特异性结合的标志物(例如CD4或CD8)的细胞饱和。
在一些实施方式中,当在次优范围内和/或采用足够细胞以实现试剂饱和的操作中,免疫亲和试剂的量与富集的细胞的近似产量成比例。在一个实施方式中,为了实现CD4+细胞与CD8+细胞的约或约1:1的培养物起始比,CD4+细胞和CD8+细胞的选择可采用针对CD4和CD8的免疫亲和试剂的各自的相同或约相同的次优产出浓度来进行。在另一个示例性实施方式中,为了实现CD4+细胞与CD8+细胞的约或约2:1的培养物起始比,CD4+细胞的选择可采用比针对CD8的免疫亲和试剂的次优产出浓度高大致或大约两倍的针对CD4的免疫亲和试剂的次优产出浓度进行。鉴于上述示例,根据包含富集或选择的细胞的产生的组合物的所需或所选的培养物起始比,技术人员有能力通过经验选择或挑选免疫亲和试剂的合适的量或浓度。
在一些实施方式中,所述分离和/或步骤采用磁珠进行,其中免疫亲和试剂例如通过肽配体相互作用与链霉亲和素突变蛋白可逆结合,如上所述。示例性的所述磁珠是在一些实施方式中,所述分离和/或步骤采用磁珠进行,例如市售可得自美天旎生物技术公司的那些。
在一些方面中,进行所述分离和/或其它步骤以供在封闭和无菌系统中进行临床级别水平的细胞的自动化分离。组件可包括整合的微型计算机、磁性分离单元、蠕动泵,和各种夹管阀。在一些方面中,整合的计算机控制所述仪器的所有组件,并指示所述系统以标准化的顺序进行重复的步骤。在一些方面中,所述磁性分离单元包括可移动的永久磁铁和用于所述选择柱的支持物(holder)。所述蠕动泵控制通过管组的流速,并且,与夹管阀一起,确保通过所述系统的缓冲液的受控流和细胞的连续悬液。在一些方面中,所述分离和/或其它步骤采用CliniMACS系统(美天旎生物技术公司)进行。
在一些实施方式中,所述自动化的分离,例如采用CliniMACS系统,在一些方面中采用抗体偶联的可磁化颗粒,其以无菌、无热源溶液的形式提供。在一些实施方式中,在用磁性颗粒标记细胞之后,所述细胞经清洗以移除过量的颗粒。然后,将细胞制备袋连接至管组,其进一步连接至包含缓冲液的袋和细胞收集袋。所述管组由预组装的无菌管道组成,包括前置柱和分离柱,并且仅用于单一使用。在分离程序起始之后,所述系统自动化地将所述细胞样品施加至分离柱上。使带标记的细胞保留在柱中,而通过一系列清洗步骤移除未标记的细胞。在一些实施方式中,用于本文所述方法的细胞群是未标记的,并且不被保留在柱中。在一些实施方式中,用于本文所述方法的细胞群是经标记的,并且被保留在柱中。在一些实施方式中,在移除磁场之后,从所述柱洗脱用于本文所述方法的细胞群,并收集在细胞收集袋中。
在某些实施方式中,分离和/或其它步骤采用装配有细胞处理单元的系统进行,所述细胞处理单元允许自动化清洗和通过通过离心分级分离细胞。在一些方面中,所述分离和/或其它步骤采用CliniMACS Prodigy系统(美天旎生物技术公司)进行。具有细胞处理单元的系统还可包括内置摄像机和图像识别软件,其通过识别来源细胞产物的宏观层来确定最优选细胞分级分离终点。例如,外周血被自动化地分离成红细胞、血液白细胞和血浆层。细胞处理系统,例如CliniMACS Prodigy系统,还可包括整合的细胞培育腔室,其完成细胞培养方案,例如,细胞分化和扩增、抗原加载和长期细胞培养。输入端口可允许无菌移除和补充培养基,并且细胞可采用整合显微镜来监测。参见例如Klebanoff等.(2012)J Immunother.35(9):651–660,Terakura等.(2012)Blood.1:72–82,和Wang等.(2012)J Immunother.35(9):689-701。
在一些实施方式中,本文所述的细胞群通过流式细胞术收集和富集(或消耗),其中针对多重细胞表面标志物被染色的细胞携载于流体中。在一些实施方式中,本文所述的细胞群通过制备规模(FACS)分选法收集和富集(或消耗)。在某些实施方式中,本文所述的细胞群通过采用微电机系统(MEMS)芯片联合基于FACS的检测系统来收集和富集(或消耗)(参见例如,WO 2010/033140,Cho等(2010)Lab Chip 10,1567-1573;和Godin等(2008)J Biophoton.1(5):355–376。在这两种情况中,细胞可以用多重标志物标记,以允许以高纯度分离明确界定的T细胞亚组。
在一些实施方式中,所述抗体或结合伴侣用一种或多种可检测标志物标记,以促进用于正和/或负选择的分离。例如,分离可基于与荧光标记的抗体的结合。在一些实例中,将基于抗体或对一种或多种细胞表面标志物具有特异性的其它结合伴侣的结合所进行的细胞分离携载于流体流中,例如通过荧光活化的细胞分选(FACS)(其包括制备规模(FACS)和/或微电机系统(MEMS)芯片),例如,与流式细胞术检测系统联合。此类方法允许进行基于多重标志物的同时正和负选择。
b.采用免疫亲和色谱的单一处理流和/或连续选择
在一些实施方式中,细胞群的第一选择或富集和细胞群的第二选择和/或富集采用基于免疫亲和性的试剂进行,其至少包括分别具有固定于其上的抗体的第一和第二亲和色谱基质。在一些实施方式中,第一和/或第二选择之一或两者可采用多种亲和色谱基质和/或抗体,由此,用于相同选择(即第一选择或第二选择)的多种基质和/或抗体是串联连接的。在一些实施方式中,用于第一和/或第二选择的亲和色谱基质或基质吸附或能够选择或富集至少约50x106细胞/mL,100x106细胞/mL,200x106细胞/mL或400x106细胞/mL。在一些实施方式中,所述吸附能力可基于所述柱的直径和/或长度来调整。在一些实施方式中,选择或富集的组合物的培养物起始比通过选择足够的量的基质和/或以基于例如所述柱的吸附能力或用于选择细胞的柱而假设足以实现该培养物起始比的相对量来获得。
在一个示例性实施方式中,所述一种或多种基质的吸附能力在第一和第二选择之间是相同的,例如对于两者是或约是1x108细胞/mL,由此,第一选择和第二选择中细胞的富集或选择导致包含培养物起始比是或约是1:1的CD4+细胞和CD8+细胞的组合物。在另一个示例性实施方式中,用于第一选择或第二选择之一的一种或多种基质的吸附能力比用于第一选择或第二选择中另一者的一种或多种基质的吸附能力强至少1.5倍,2.0倍,3.0倍,4.0倍,5.0倍,6.0倍,7.0倍,8.0倍,9.0倍,10.0倍或更多,由此导致这样的培养物起始比,其中采用更高吸附能力选择的细胞,例如CD4+细胞或CD8+细胞,在所述培养物中存在的起始比率的量比另一细胞群大至少1.5倍,2.0倍,3.0倍,4.0倍,5.0倍,6.0倍,7.0倍,8.0倍,9.0倍,10.0倍或更大。根据产生的包含富集或选择的细胞的组合物的所需或所选培养物起始比,技术人员有能力选择或挑选用于第一和/或第二选择的亲和基质色谱柱的合适的体积、直径或数量。
用于进行通过本文提供的方法的选择的示例性方法示于实施例2。在一些实施方式中,所述方法实现富集或产生的组合物中的所需培养物起始比。
在一些实施方式中,本文提供的方法中的第一和/或第二选择包括针对CD4+或CD8+细胞之一的第一富集,和随后的,针对细胞亚群的富集,其基于,例如,在静息、原初或中心记忆T细胞上表达的标志物的表面表达,例如CD28、CD62L、CCR7、CD127或CD27标志物。在一些实施方式中,所述第一和/或第二选择包括针对CD8+细胞进行富集,所述选择还包括针对中心记忆T(TCM)细胞进行富集,其中,所述第一和/或第二选择之另一者包括针对CD4+细胞进行富集。在一些实施方式中,进行所述方法以针对CD4+细胞进行富集或选择,和针对CD8+/CD28+、CD8+/CD62L+、CD8+/CCR7+、CD8+/CD127+或CD8+/CD27+细胞亚群进行富集或选择。在一些实施方式中,第一选择包括针对CD8+细胞进行富集,并且第二选择包括针对CD4+细胞进行富集,其中第一选择(其包括针对CD8+细胞进行富集的细胞)还包括针对中心记忆T(TCM)细胞进行富集或针对表达CD28、CD62L、CCR7、CD127或CD27标志物的细胞进行富集,由此产生组合物,例如培养起始组合物,其包含CD4+细胞和针对中心记忆T(TCM)细胞或表达CD28、CD62L、CCR7、CD127或CD27标志物的细胞进行富集的CD8+。在一些实施方式中,第一选择包括针对CD4+细胞进行富集,并且第二选择包括针对CD8+细胞进行富集,其中第二选择(其包括针对CD8+细胞进行富集的细胞)还包括针对中心记忆T(TCM)细胞进行富集或针对表达CD28、CD62L、CCR7、CD127或CD27标志物的细胞进行富集,由此产生组合物,例如培养起始组合物,其包含CD4+细胞和针对中心记忆T(TCM)细胞或表达CD28、CD62L、CCR7、CD127或CD27标志物的细胞进行富集的CD8+。
在涉及亚细胞的群的进一步富集以实现CD4+细胞或其亚群与CD8+细胞或其亚群的培养物起始比的一些所述实施方式中,调节一种或多种柱基质的吸附能力,以考虑亚群频率的差异,即,针对静息、原初、中心记忆细胞或表达CD28、CD62L、CCR7、CD127或CD27标志物的细胞富集的CD4+或CD8+细胞,相比于来自对象的起始样品中的对应CD4+或CD8+母群的细胞的频率。对象中的各种细胞群的相对水平或频率可基于对存在于此类群或亚群上的一种或多种标志物的表面表达的评估来确定。可采用用于评估表面标志物或蛋白质的表达水平的许多熟知的方法,例如通过如下方法的检测:基于亲和性的方法,例如,基于免疫亲和性的方法,例如,在细胞表面蛋白质方面,例如通过流式细胞术。
在示例性实施方式中,样品针对CD4+和CD8+/CD62L+细胞进行富集以生成1:1的CD4+与CD8+之比。在该示例性实施方式,第一选择可包括采用柱针对CD8+细胞进行富集,所述柱的吸附能力针对已知存在于所述样品中的CD4+细胞与CD8+/CD62L+细胞的相对频率,或采用一般估计的此类样品中的比率来调节。例如,收集自人对象的CD8+细胞的CD62L+亚群有时可能是总CD8+T细胞部分的约25%。参见例如Maldonado,Arthritis Res Ther.2003;5(2):R91–R96。在此类实施方式中,所述柱可经阵列调整以收集比CD4+细胞多4倍的CD8+细胞,以产生1:1培养物起始比的CD4+细胞和CD8+亚群,其还包含CD62L+细胞。因此,假设各选择柱具有相似的吸附能力和效率,CD8+柱可比CD4选择柱或CD62L选择柱大大约或大致4倍。所述柱的尺寸也可对预期产量进行调节。例如,如果各柱仅具80%效率,则可考虑各后续选择的效率来调节各柱的尺寸。
例如所需或所选的培养起始组合物可以是包含200x106CD4+细胞和200x106CD8+/CD62L+细胞的组合物。在该实例中,假设如上所述的比率,待富集的样品可包含至少或约200x106CD4+细胞和至少或约800x106CD8+细胞,其中约25%(200x106)也可以是CD62L+。假设各2ML的选择基质可针对大约或大致200x106细胞进行富集,则具有8ML选择基质的CD8选择柱可结合大约或大致800x106CD8+细胞,同时流通通过CD4选择柱。具有2ML选择基质的CD4选择柱可结合大约或大致200x106CD4+细胞。CD8+细胞可通过将CD8+细胞洗脱进入CD62L选择柱来针对CD62L进行进一步富集。在该示例性实施方式中,CD62L选择柱可包含2ML的选择基质,因此,针对大约或大致200x106CD8+/CD62L+细胞进行富集。CD4和CD8/CD62L柱可被洗脱进入培养器皿,产生起始培养组合物或具有大致或大约1:1培养物起始比的组合物。
在另一个示例性实施方式中,样品针对CD4+和CD8+/CCR7+细胞进行富集以生成1:1的CD4+与CD8+之比。在该示例性实施方式,第一选择可包括采用柱针对CD8+细胞进行富集,所述柱的吸附能力针对已知存在于所述样品中的CD4+细胞与CD8+/CCR7+细胞的相对频率,或采用一般估计的此类样品中的比率来调节。例如,收集自人对象的CD8+细胞的CCR7+亚群有时可能是总CD8+T细胞部分的约60%。参见例如,Chen,Blood.2001年7月1日;98(1):156-64。所述柱可经阵列调整以收集比CD4+细胞多31/3倍的CD8+细胞,以产生1:1的培养物起始比。假设各选择柱具有相似的吸附能力和效率,CD8+柱可比CD4选择柱或CCR7选择柱高大约或大致31/3倍。所述柱的尺寸也可对预期产量进行调节。例如,如果各柱仅具80%效率,则可考虑各后续选择的效率来调节各柱的尺寸。
例如,所需起始培养物可包含200x106CD4+细胞和200x106CD8+/CCR7+细胞。在该实例中,假设如上所述的比率,待富集的样品可包含至少200x106CD4+细胞和至少或约6.6x106CD8+细胞,其中约60%(200x106)也可以是CCR7+。假设各2ML的选择基质可针对200x106细胞进行富集,则具有31/3mL选择基质的CD8选择柱可结合大约或大致6.6x106CD8+细胞,同时流通通过CD4选择柱。具有2ML选择基质的CD4选择柱可结合大约或大致200x106CD4+细胞。CD8+细胞可通过将CD8+细胞洗脱进入CD62L选择柱来针对CCR7进行进一步富集。在该示例性实施方式中,CCR7选择柱可包含1ML的选择基质,因此,针对大约或大致200x106CD8+/CCR7+细胞进行富集。CD4和CCCR7柱可洗脱进入培养器皿,产生起始培养物,其包含大约或大致200x106CD4+细胞和大约或大致200x106CD8+/CCR7+细胞,或1:1的培养物起始比。
根据产生的包含富集或选择的细胞的组合物的所需或所选的培养物起始比、各亚群的预期频率、各选择柱的变化效率和技术人员水平范围内的其它因素,并鉴于上述示例,技术人员有能力通过经验选择或挑选用于第一和/或第二和/或第三选择的亲和基质色谱柱的合适的体积、直径或数量。
B.分离的细胞的孵育
在一些实施方式中,所提供的方法包括:用于孵育分离的细胞和细胞群(例如根据本文所述的方法分离的群)的多种步骤中的一个或多个,例如用于孵育分离的CD4+T细胞群,例如,未分级分离的CD4+T细胞群或其亚群,和分离的CD8+T细胞群,例如,分离的未分级分离的CD8+T细胞群或其亚群的步骤。在一些实施方式中,所述细胞群在培养起始组合物中孵育。
所述多种分离的细胞群,例如,CD4+和CD8+细胞群(例如,未分级分离的或其亚群)一般在相同培养器皿中与培养起始组合物中合并的细胞群孵育,所述相同培养器皿例如相同单元、腔室、孔、柱、管、管组、阀、小瓶、培养皿、袋,或用于培养或培育细胞的其它容器。
在一些方面中,在孵育和/或工程改造步骤之后,或经设计以在某一时间百分数进行时,所述细胞群或细胞类型以培养物起始比存在于培养起始组合物中,例如,CD4+和CD8+细胞的比率经设计以实现具体所需输出比,或处于此类所需输出比的耐受误差的某一范围之内的比率。所述输出比,例如,可以是最优选用于在例如,通过过继细胞治疗给予患者之后实现一种或多种疗效的比率。在一些方面中,所述培养物起始比通过经验确定,例如,采用本文所述的确定方法,例如,以确定在具体情况中用于实现所需输出比的最优选培养物起始比。
孵育步骤可包括:培养、培育、刺激、活化、传代,包括通过在刺激条件存在下孵育,所述刺激条件例如,经设计以诱导群中的细胞增殖、扩增、活化和/或存活的条件,以模拟抗原暴露和/或以使细胞备于遗传工程改造,例如备于引入遗传工程改造的抗原受体。
所述条件可包括如下一种或多种:具体培养基、温度、含氧量、二氧化碳含量、时间、试剂、例如、营养物、氨基酸、抗生素、离子,和/或刺激因子,例如细胞因子、趋化因子、抗原、结合伴侣、融合蛋白、重组可溶性受体,和经设计以活化细胞的任何其它试剂。在一个实例中,刺激条件包括一种或多种试剂,例如,配体,其打开或起始T细胞中的TCR/CD3胞内信号转导级联。此类试剂可包括抗体,例如对TCR组分和/或共刺激受体具有特异性的那些,例如,抗CD3、抗CD28、抗4-1BB,例如,其结合至固体支持物例如珠,和/或一种或多种细胞因子。任选地,扩增方法还可包括如下步骤:向培养基(例如,以至少约0.5ng/ml的浓度)添加抗CD3和/或抗CD28抗体。任选地,扩增方法还可包括如下步骤:向培养基添加IL-2和/或IL-15和/或IL-7和/或IL-21(例如,其中IL-2的浓度是至少约10单元/ml)。
在一些方面中,孵育根据技术,例如授予Riddell等的美国专利号6,040,1 77,Klebanoff等.(2012)J Immunother.35(9):651–660,Terakura等.(2012)Blood.1:72–82和/或Wang等.(2012)J Immunother.35(9):689-701中所述的那些进行。
在一些实施方式中,所述细胞群,例如CD4+和CD8+群或亚群,通过如下方式扩增:添加至培养起始组合物饲养层细胞,例如非分裂型外周血单核细胞(PBMC),(例如,从而针对待扩增的初始群中的各T淋巴细胞,所得细胞群包含至少约5,10,20,或40或更多PBMC饲养层细胞);并孵育所述培养物(例如足以扩增所述数量的T细胞的时间)。在一些方面中,所述非分裂型饲养层细胞可包括γ-辐照的PBMC饲养层细胞。在一些实施方式中,所述PBMC用约3000-3600拉德范围内的γ射线辐照以防止细胞分裂。在一些方面中,所述饲养层细胞在添加T细胞的群之前添加至培养基。
在一些实施方式中,所述刺激条件包括适于人T淋巴细胞生长的温度,例如,至少约25摄氏度,一般至少约30度,且一般是或约是37摄氏度。在一些实施方式中,在培养过程中施加温度变化,例如从37摄氏度至35摄氏度。任选地,孵育还可包括添加非分裂型EBV-转化的类淋巴母细胞(LCL)作为饲养层细胞。LCL可以用约6000-10,000拉德范围内的γ射线辐照。在一些方面中,LCL饲养层细胞以任何合适的量提供,例如LCL饲养层细胞与初始T淋巴细胞的比率是至少约10:1。
在实施方式中,抗原特异性的CD4+和CD8+的群可通过用抗原刺激原初或抗原特异性T淋巴细胞来获得。例如,抗原特异性T细胞系或克隆可针对巨细胞病毒抗原产生,通过从感染的对象分离T细胞并采用相同抗原体外刺激细胞来进行。也可采用原初T细胞。
临时评估和调节
在一些实施方式中,所述方法包括孵育或培养起始之后的时间,例如在孵育过程中的时间对细胞或包含所述细胞的组合物进行评估和/或调节。评估可包括获取包含细胞的组合物或器皿的一种或多种度量结果,例如评估细胞的增殖速率,存活程度,表型,例如一种或多种表面或胞内标志物如蛋白质或多核苷酸的表达,和/或评估组合物或器皿的温度,培养基组分,氧或二氧化碳含量,和/或一种或多种因子,物质,组分,和/或细胞类型,包括亚型的存在或不存在或量或相对量。在一些实施方式中,评估包括确定孵育中的组合物或器皿中的多种例如两种细胞类型(例如CD4+和CD8+T细胞)的中间比率。在一些方面中,所述评估以自动化模式进行,例如,采用本文所述的装置,和/或设定在孵育过程中的某一时间点之前进行。在一些方面中,评估结果,例如确定的两种细胞类型的临时比率,表明应进行调节,例如添加或移除一种或多种细胞类型。
调节可包括调节任何细胞培养因素或参数,例如温度,孵育或将要进行的其步骤的长度(时间)(孵育时长),孵育中的组合物中的一种或多种组分的补充、添加和/或移除,例如,培养基或缓冲液或其组分、物质,例如,营养物、氨基酸、抗生素、离子和/或刺激因子,例如细胞因子、趋化因子、抗原、结合伴侣、融合蛋白、重组可溶性受体或细胞或细胞类型或细胞的群。在一些方面中,各种组分或其它调节的移除或添加以自动化方式进行,例如,采用本文所述的装置或系统。在一些实施方式中,所述系统经编程,从而调节基于来自临时评估的某一读出以自动化方式起始。例如,在一些情况中,系统或装置经编程以在具体时间进行一种或多种评估;所述情况中的所述系统或装置可经进一步编程,从而所述评估的具体结果,例如一种细胞类型与另一种的具体比率,起始具体调节,例如一种或多种所述细胞类型的添加。
在一些方面中,所述调节通过如下方式进行:以不破坏包含所述细胞和组合物的封闭环境的方式进行添加或移除,例如通过输入和/或移除阀,其经设计以,例如在一种或多种本文所述的装置或系统中,添加或移除组分同时保持无菌。
在一个具体实施方式中,在孵育期间评估CD4+与CD8+T细胞的临时比率。在一些实施方式中,所述评估在1,2,3,4,5,6或7天后进行,例如3-5天,和/或在其中所有细胞处于或疑似处于细胞周期的时间点进行。在一些方面中,如此确定的临时比率表明CD4+或CD8+T细胞,例如CD4+T细胞的分离的群或CD8+T细胞的分离的群(例如,亚群,例如中心记忆CD8+T细胞)的细胞,应被添加至培养器皿或在培养器皿中富集或添加至孵育中的组合物。因此,在一些方面中,所述评估之后进行所述添加或移除,通常是添加。在一些方面中,在孵育过程中,多重评估和可能的调节,例如,以交互方式进行。
在一些实施方式中,当细胞经工程改造的,例如,以引入遗传工程改造的抗原受体时,在一种或多种刺激剂的存在下进行的孵育在所述工程改造阶段过程中持续。
在一些实施方式中,所述细胞总计或在工程改造之前孵育是或约是1,2,3,4,5,6,7,8,9,10,11,12,13,或14天。
C.工程改造、工程改造的抗原受体,和工程改造的细胞
在一些实施方式中,所述方法包括分离的和/或孵育的细胞的遗传工程改造,例如以引入细胞重组基因用于分子,例如受体,例如,抗原受体的表达,其可用于过继治疗。
用于引入的基因包括:用以例如通过促进转移的细胞的活力和/或功能改善治疗功效的那些;用以提供遗传标志物以供选择和/或评价细胞的基因,例如以评估体内存活或定位;用以改善安全性的基因,例如,通过使细胞对体内负选择易感,如Lupton S.D.等,Mol.and Cell Biol.,11:6(1991);和Riddell等,Human Gene Therapy 3:319-338(1992)所述;也参见Lupton的公开号PCT/US91/08442和PCT/US94/05601等,其描述显性阳性可选择的标志物与阴性可选择的标志物的融合衍生的双功能可选择的融合基因的应用。这可根据已知技术(参见例如,Riddell等,美国专利号6,040,177,第14-17栏)或其对于本领域技术人员基于本发明而显而易见的变化形式来进行。
工程改造一般包括引入一种或多种基因,用于表达遗传工程改造的抗原受体。此类抗原受体包括遗传工程改造的T细胞受体(TCR)及其组分,和功能性非TCR抗原受体,例如嵌合抗原受体(CAR)。
在一些实施方式中,所述抗原受体特异性结合至待靶标细胞或疾病上的配体,例如癌症或其它疾病或病症,包括本文所述的采用本文提供的方法和组合物靶向的那些。示例性抗原是孤儿酪氨酸激酶受体RORl、tEGFR、Her2、Ll-CAM、CD19、CD20、CD22、间皮素、CEA、和肝炎B表面抗原、抗叶酸受体、CD23、CD24、CD30、CD33、CD38、CD44、EGFR、EGP-2、EGP-4、0EPHa2、ErbB2、3、或4、FBP、胎儿乙酰胆碱e受体、GD2、GD3、HMW-MAA、IL-22R-α、IL-13R-α2、kdr、κ轻链、Lewis Y、L1-细胞粘附分子、MAGE-A1、间皮素、MUC1、MUC16、PSCA、NKG2D配体、NY-ESO-1、MART-1、gp100、癌胚抗原、ROR1、TAG72、VEGF-R2、癌胚抗原(CEA)、前列腺特异性抗原、PSMA、Her2/neu、雌激素受体、孕酮受体、酪氨酸蛋白激酶B2、CD123、CS-1、c-Met、GD-2,和MAGE A3和/或生物素化分子,和/或通过HIV、HCV、HBV或其它病原体表达的分子。
抗原受体
在一个实施方式中,所述工程改造的抗原受体是CAR。CAR一般包括遗传工程改造的受体,其包括连接至一种或多种胞内信号转导组分的胞外配体结合结构域。此类分子通常模拟或近似通过天然抗原受体的信号和/或通过此类受体联合共刺激受体的信号。
在一些实施方式中,构建的CAR针对具体标志物具有特异性,例如,通过过继治疗靶标的具体细胞类型表达的标志物,例如,癌症标志物。在一些方面中,这通过在CAR的胞外部分中包合一种或多种抗原结合分子,例如一种或多种抗原-结合片段、结构域或部分,或一种或多种抗体可变结构域,和/或抗体分子来实现。在一些实施方式中,所述CAR包括抗体分子的一个或多个抗原-结合部分,例如源自单克隆抗体(mAb)的可变重(VH)链和可变轻(VL)链的单链抗体片段(scFv)。
在一些实施方式中,所述CAR包含特异性结合待靶标的细胞或疾病的细胞表面抗原抗体重链结构域,例如肿瘤细胞或癌细胞,例如本文所述的或本领域已知的任何靶抗原。
在一些实施方式中,所述肿瘤抗原或细胞表面分子是多肽。在一些实施方式中,所述肿瘤抗原或细胞表面分子是相比相同组织的非肿瘤细胞在肿瘤细胞上选择性表达的或过表达的。
在一些实施方式中,所述CAR结合病原体特异性抗原。在一些实施方式中,所述CAR对病毒抗原(例如HIV,HCV,HBV等),细菌抗原,和/或寄生性抗原具有特异性。
在一些方面中,所述抗原特异性结合或识别组分连接至一种或多种跨膜和胞内信号转导结构域。在一些实施方式中,CAR包括与该CAR的胞外结构域融合的跨膜结构域。在一个实施方式中,使用天然关联CAR中结构域之一的跨膜结构域。在一些情况中,所述跨膜结构域通过氨基酸取代来选择或修饰,以避免所述结构域结合至相同或不同表面膜蛋白的跨膜结构域,以使与受体复合物的其它成员的相互作用最小化。
在一些实施方式中,所述跨膜结构域源自天然或合成来源。当所述来源是天然来源时,在一些方面中,所述结构域源自任何膜结合或跨膜蛋白。跨膜区包括源自T-细胞受体的α、β或ζ链,CD28,CD3ε,CD45,CD4,CD5,CD8,CD9,CD 16,CD22,CD33,CD37,CD64,CD80,CD86,CD 134,CD137,CD 154的那些(即包含至少它们的跨膜区域)。或者,在一些实施方式中,所述跨膜结构域是合成的。在一些方面中,所述合成跨膜结构域主要包含疏水残基例如亮氨酸和缬氨酸。在一些方面中,苯丙氨酸、色氨酸和缬氨酸的三聚体将出现在合成的跨膜结构域的各末端。
在一些实施方式中,存在短的寡肽或多肽接头,例如,长度为2-10个氨基酸的接头,例如包含甘氨酸和丝氨酸,例如,甘氨酸-丝氨酸双联体的接头,并在CAR的胞质信号转导结构域和跨膜结构域之间形成连接。
CAR一般包括一种或多种胞内信号转导组分。在一些实施方式中,所述CAR包括TCR复合物的胞内组分,例如介导T-细胞活化和细胞毒性的TCR CD3+链,例如,CD3ζ链。因此,在一些方面中,所述抗原结合分子连接至一种或多种细胞信号转导模块。在一些实施方式中,细胞信号转导模块包括CD3跨膜结构域、CD3胞内信号转导结构域,和/或其它CD跨膜结构域。在一些实施方式中,所述CAR还包括一种或多种其它分子的部分,例如Fc受体γ、CD8、CD4、CD25或CD16。例如,在一些方面中,所述CAR包括CD3-ζ(CD3-ζ)或Fc受体γ和CD8、CD4、CD25或CD16之间的嵌合分子。
在一些实施方式中,在CAR的连接之后,该CAR的胞质结构域或胞内信号转导结构域活化免疫细胞的正常效应功能的至少一种,例如,工程改造的T细胞以表达该细胞。例如,在一些情况中,CAR诱导T细胞的功能,例如溶细胞活性或T-辅助活性,例如细胞因子或其它因子的分泌。在一些实施方式中,抗原受体组分或共刺激分子的胞内信号转导结构域的截短部分。在一些方面中,例如,如果其转导效应功能信号,则此类截短部分用于替代完整免疫刺激链。在一些实施方式中,所述一种或多种胞内信号转导结构域包括T细胞受体(TCR)的胞质序列,且在一些方面中,在天然情况下与此类受体一起作用以在抗原受体衔接之后起始信号转导的共同受体的那些,和/或此类分子的任何衍生物或变体,和/或具有相同功能性能力的任何合成序列。
在天然TCR的情况中,完全活化一般不仅需要通过TCR的信号转导,而且需要共刺激信号。因此,在一些实施方式中,为了促进完全活化,用于产生第二或共刺激信号的组分也包括在所述CAR中。在一些方面中,T细胞活化描述为通过两类胞质信号转导序列介导:通过TCR起始抗原依赖性第一活化的那些(第一胞质信号转导序列),和以抗原非依赖性方式作用以提供第二或共刺激信号的那些(第二胞质信号转导序列)。在一些方面中,所述CAR包括此类信号转导组分之一或两者。
在一些方面中,第一胞质信号转导序列可以刺激方式,或以抑制方式调节TCR复合物的第一活化。以刺激方式作用的第一胞质信号转导序列可包含信号转导基序,其已知是免疫受体基于酪氨酸的活化基序或ITAM。ITAM的实例包括第一胞质信号转导序列,其包括源自如下的那些:TCRζ,FcRγ,FcRβ,CD3γ,CD3δ,CD3ε,CDS,CD22,CD79a,CD79b,和CD66d。在一些实施方式中,CAR中的胞质信号转导分子包含胞质信号转导结构域,其部分,或源自CD3ζ的序列。
在一些实施方式中,所述CAR包括共刺激受体的跨膜部分和/或信号转导结构域,例如CD28,4-1BB,OX40,DAP10,和ICOS。
在某些实施方式中,所述胞内信号转导结构域包含CD28跨膜和信号转导结构域,其连接至CD3胞内结构域。在一些实施方式中,所述胞内信号转导结构域包含嵌合CD28和CD137共刺激结构域,其连接至CD3胞内结构域。在一些实施方式中,CAR还可包括转导标志物(例如,tEGFR)。在一些实施方式中,CD8+细胞毒性T细胞的胞内信号转导结构域与CD4+辅助T细胞的胞内信号转导结构域相同。在一些实施方式中,CD8+细胞毒性T细胞的胞内信号转导结构域与CD4+辅助T细胞的胞内信号转导结构域不同。
在一些实施方式中,所述CAR涵盖与胞质部分中的活化结构域(例如,第一活化结构域)合并的两种或更多种共刺激结构域。一个实例是包括CD3-ζ、CD28和4-1BB的胞内组分的受体。
CAR和生产及其引入可包括描述于如下文献中的那些,例如,公开的专利公开文本WO200014257,US6451995,US2002131960,US7446190,US8252592,EP2537416,US2013287748,和WO2013126726,和/或描述于如下文献中的那些:Sadelain等,Cancer Discov.2013年4月;3(4):388–398;Davila等.(2013)PLoS ONE 8(4):e61338;Turtle等,Curr.Opin.Immunol.,2012年10月;24(5):633-39;Wu等,Cancer,2012年3月18(2):160-75。
在一些实施方式中,所述T细胞用重组T细胞受体修饰。在一些实施方式中,所述重组TCR对于抗原具有特异性,一般是存在于靶细胞上的抗原,例如肿瘤特异性抗原,在与自体免疫或炎性疾病相关联的具体细胞类型上表达的抗原,或源自病毒病原体或细菌病原体的抗原。
在一些实施方式中,所述T细胞经工程改造以表达克隆自天然产生的T细胞的T细胞受体(TCR)。在一些实施方式中,鉴定分离自患者的针对靶抗原(例如,癌症抗原)的亲和性T细胞克隆,并引入所述细胞。在一些实施方式中,所述针对靶抗原的TCR克隆已在用人免疫系统基因(例如,人白细胞抗原系统,或HLA)工程改造的转基因小鼠中产生。参见例如,肿瘤抗原(参见例如,Parkhurst等.(2009)Clin Cancer Res.15:169–180和Cohen等.(2005)J Immunol.175:5799–5808。在一些实施方式中,使用病原体展示以针对靶抗原的分离TCR(参见例如,Varela-Rohena等(2008)Nat Med.14:1390–1395和Li(2005)Nat Biotechnol.23:349–354。
在一些实施方式中,在获得T-细胞克隆之后,将TCRα和β链分离并克隆进入基因表达载体。在一些实施方式中,所述TCRα和β基因通过小核糖核酸病毒2A核糖体跳跃肽(skip peptide)连接,从而两条链共同表达。在一些实施方式中,TCR的遗传转移(genetic transfer)通过逆转录病毒或慢病毒载体,或通过转座子完成(参见例如,Baum等(2006)Molecular Therapy:The Journal of the American Society of Gene Therapy.18:1748–1757;和Hackett等.(2010)Molecular Therapy:The Journal of the American Society of Gene Therapy.18:674–683。
在一些实施方式中,基因转移(gene transfer)通过如下方式完成:首先刺激T细胞生长,然后转导活化的细胞并在培养物中扩增至足够用于临床应用的数量。
在一些情况中,刺激因子(例如,淋巴因子或细胞因子)的过表达可能对对象具有毒性。因此,在一些情况中,工程改造的细胞包括,例如在过继免疫治疗中给予之后,使细胞对体内负选择易感的基因区段。例如在一些方面中,所述细胞经工程改造,从而它们可因它们所给予的患者的体内状况的变化而被消除。可负选择的表型可通过将提供对给予的试剂(例如,化合物)的敏感性的基因来产生。可负选择的基因包括:单纯疱疹病毒I型胸苷激酶(HSV-I TK)基因(Wigler等,Cell II:223,I977),其提供更昔洛韦敏感性;细胞次黄嘌呤磷酸核糖基转移酶(HPRT)基因,细胞腺嘌呤磷酸核糖基转移酶(APRT)基因,细菌胞嘧啶脱氨酶(Mullen等,Proc.Natl.Acad.Sci.USA.89:33(1992))。
在一些方面中,所述细胞进一步经工程改造以促进细胞因子的表达,例如促炎性细胞因子,例如,IL-2,IL-12,IL-7,IL-15,IL-21。
遗传工程改造的组分的引入
用于引入遗传工程改造的组分,例如,抗原受体(例如,CAR)的各种方法是熟知的,并可采用本文提供的方法和组合物。示例性方法包括用于转移编码受体的核酸的那些,包括通过病毒,例如,逆转录病毒或慢病毒,转导,转座子,和电穿孔。
在一些实施方式中,采用重组感染性病毒颗粒将重组核酸转移进入细胞,例如,源自猿病毒40(SV40)、腺病毒、腺相关病毒(AAV)的载体。在一些实施方式中,采用重组慢病毒载体或逆转录病毒载体,例如γ-逆转录病毒载体,将重组核酸转移进入T细胞(参见例如,Koste等(2014)Gene Therapy 2014年4月3日.doi:10.1038/gt.2014.25;Carlens等.(2000)Exp Hematol 28(10):1137-46;Alonso-Camino等.(2013)Mol Ther Nucl Acids 2,e93;Park等,Trends Biotechnol.2011年11月;29(11):550–557。
在一些实施方式中,所述逆转录病毒载体具有长末端重复序列(LTR),例如,源自莫洛尼鼠白血病病毒(MoMLV),骨髓增生性肉瘤病毒(MPSV),鼠胚胎干细胞病毒(MESV),鼠干细胞病毒(MSCV),脾病灶形成病毒(SFFV),或腺相关病毒(AAV)的逆转录病毒载体。大多数逆转录病毒载体源自鼠逆转录病毒。在一些实施方式中,所述逆转录病毒包括源自任何禽或哺乳动物细胞来源的那些。逆转录病毒通常是双嗜性的,这意味着它们能够感染数种物种(包括人类)的宿主细胞。在一个实施方式中,用待表达的基因替代逆转录病毒gag、pol和/或env序列。已描述许多示例性逆转录病毒系统(例如,美国专利号5,219,740;6,207,453;5,219,740;Miller和Rosman(1989)BioTechniques 7:980-990;Miller,A.D.(1990)Human Gene Therapy 1:5-14;Scarpa等(1991)Virology 180:849-852;Burns等(1993)Proc.Natl.Acad.Sci.USA 90:8033-8037;和Boris-Lawrie和Temin(1993)Cur.Opin.Genet.Develop.3:102-109。
慢病毒转导方法是已知的。示例性方法描述于,例如,Wang等(2012)J.Immunother.35(9):689-701;Cooper等.(2003)Blood.101:1637–1644;Verhoeyen等.(2009)Methods Mol Biol.506:97-114;和Cavalieri等.(2003)Blood.102(2):497-505。
在一些实施方式中,通过电穿孔将重组核酸转移进入T细胞(参见例如,Chicaybam等,(2013)PLoS ONE 8(3):e60298和Van Tedeloo等.(2000)Gene Therapy 7(16):1431-1437)。在一些实施方式中,通过转位将重组核酸转移进入T细胞(参见例如,Manuri等(2010)Hum Gene Ther 21(4):427-437;Sharma等.(2013)Molec Ther Nucl Acids 2,e74;和Huang等.(2009)Methods Mol Biol506:115-126)。在免疫细胞中引入和表达遗传物质的其它方法包括磷酸钙转染(例如,描述于《分子生物学方案新编》(Current Protocols in Molecular Biology),约翰威利父子公司(John Wiley&Sons),纽约州纽约)、原生质体融合、阳离子脂质体介导的转染;钨颗粒促进的微粒轰击(Johnston,Nature,346:776-777(1990));和磷酸锶DNA共沉淀(Brash等,Mol.Cell Biol.,7:2031-2034(1987))。
在一些实施方式中,将相同CAR引入各CD4+和CD8+T淋巴细胞。在一些实施方式中,将不同的CAR引入各CD4+和CD8+T淋巴细胞。在一些实施方式中,这些群中各群中的CAR具有抗原结合分子,其特异性结合至相同抗原。在一些实施方式中,这些群中各群中的CAR结合至不同的分子。在一些实施方式中,这些群中各群中的CAR具有不同的细胞信号转导模块。在一些实施方式中,CD4+或CD8+T淋巴细胞各自在转导前被分选成原初、中心记忆、效应记忆或效应细胞。
在其它实施方式中,所述细胞,例如,T细胞,未经工程改造以表达重组受体,而是包括对所需抗原具有特异性的天然产生的抗原受体,例如体外或离体培养的肿瘤-浸润性淋巴细胞和/或T细胞,例如,在孵育步骤过程中,以促进具有具体抗原特异性的细胞的扩增。例如,在一些实施方式中,产生所述细胞用于过继细胞治疗,其通过分离肿瘤特异性T细胞,例如自体肿瘤浸润性淋巴细胞(TIL)来进行。在一些情况中,采用自体肿瘤浸润性淋巴细胞直接靶向人肿瘤可介导肿瘤转归(参见Rosenberg SA等.(1988)N Engl J Med.319:1676–1680)。在一些实施方式中,从切除的肿瘤提取淋巴细胞。在一些实施方式中,此类淋巴细胞是体外扩增的。在一些实施方式中,此类淋巴细胞用淋巴因子(例如,IL-2)培养。在一些实施方式中,此类淋巴细胞介导自体肿瘤细胞但非同种异体肿瘤或自体常规细胞的特异性裂解。
在一些方面中,所述孵育和/或工程改造步骤和/或所述方法一般导致所需输出比(或处于所述比率的耐受误差或差异之内的比率),或在所述方法进行的某一时间百分数之内完成。
D.冻存
在一些实施方式中,所提供的方法包括:冷冻步骤,例如,在分离、孵育和/或工程改造之前或之后,冻存所述细胞。在一些实施方式中,所述冷冻和后续融化步骤移除粒细胞,并且,在某种程度上,移除细胞群中的单核细胞。在一些实施方式中,例如,在清洗步骤以移除血浆和血小板之后,将所述细胞悬浮于冷冻溶液中。在一些方面中,可采用任何各种已知冷冻溶液和参数。一个实例涉及采用包含20%DMSO和8%人血清白蛋白(HSA)的PBS,或其它合适的细胞冷冻培养基。然后,其用培养基1:1稀释,从而DMSO和HSA的终浓度分别是10%和4%。然后,以1°/分钟的速率将细胞冷冻至-80℃,并贮存在液氮储罐的汽相中。
II.试剂盒和系统
还提供可用于进行本文提供的方法的系统、设备和试剂盒。在一个实例中,提供单一系统,其进行如下处理中的一种或多种:分离(isolation)、细胞制备、分开(separation),例如,基于密度、对一种或多种组分的亲和性、敏感性或其它性质的分离,清洗、处理、孵育、培养和/或所述方法的配制步骤。在一些方面中,所述系统用以在封闭或无菌环境中进行这些步骤中的各个步骤,例如,以使错误、用户处理和/或污染最小化。在一个实例中,所述系统是国际专利申请公开号WO2009/072003,或US 20110003380 A1中描述的系统。
在一些实施方式中,所述系统或设备在整合或独立系统中,和/或以自动化的或可编程的形式,进行分离、处理、工程改造和配制步骤中的一个或多个,例如,全部。在一些方面中,所述系统或设备包括与所述系统或设备信息连通的计算机和/或计算机程序,其允许用户编程、控制、评估处理、分离、工程改造和配制步骤的结果,和/或调节处理、分离、工程改造和配制步骤的各方面。
还提供用于进行本文提供的方法的试剂盒。在一些实施方式中,所述试剂盒包括抗体或其它结合伴侣,其一般偶联至固体支持物,用于所述方法的分离,例如,用于基于免疫亲和性的分离步骤。
在一些实施方式中,所述试剂盒包含用于正和负选择的抗体,其结合至磁珠。在一个实施方式中,所述试剂盒包含用于进行选择的指示,所述选择采用样品,例如PBMC样品起始,通过基于被试剂盒提供的抗体中的一种或多种识别的第一表面标志物的表达来选择,同时保留阳性和阴性部分。在一些方面中,所述指示还包括如下指示:用以采用所得的阳性和/或阴性部分作为起始来进行一种或多种其它选择步骤,例如,同时保持组合物在包含的环境和/或在相同分离器皿中。
在一个实施方式中,试剂盒包含抗CD4,抗CD14,抗CD45RA,抗CD14,和抗CD62L抗体,其结合至磁珠。在一个实施方式中,所述试剂盒包含指示,以进行采用样品,例如PBMC样品作为起始的选择,该选择通过基于CD4表达来进行,同时保留阳性和阴性部分,并且对于阴性部分,进一步采用抗CD14、抗CD45RA抗体对该部分进行负选择,和采用抗CD62L抗体进行正选择,上述选择以任何顺序进行。或者,根据本文所述的任何分离实施方式对所述组分和指示进行调节。
在一些实施方式中,所述试剂盒还包括指示,以将通过选择步骤分离的细胞群转移至培养、培育或处理器皿,同时将所述细胞保持在独立系统中。在一些实施方式中,所述试剂盒包括指示,以具体比率转移不同的分离的细胞。
III.细胞、组合物,和给予方法
还提供细胞、细胞群,和包含所述细胞和群的组合物(包括药物和治疗组合物),其通过本文提供的方法产生。还提供方法,例如,用于将所述细胞和组合物备于对象(例如患者)的治疗方法。
提供给予所述细胞、群和组合物的方法,和所述细胞、群和组合物用于治疗或防止疾病、病症和紊乱,包括癌症,的应用。在一些实施方式中,将所述细胞、群和组合物给予具有具体待治疗(例如,通过过继细胞治疗,例如过继T细胞治疗)的疾病或病症的对象或患者。在一些实施方式中,将通过本文提供的方法制备的细胞和组合物,例如在孵育和/或其它处理步骤之后工程改造的组合物和生产终末组合物,给予对象,例如具有所述疾病或病症或有风险患上所述疾病或病症的对象。在一些方面中,所述方法由此治疗,例如,减轻所述疾病或病症的一种或多种症状,例如通过减小表达由工程改造的T细胞识别的抗原的癌症中的肿瘤负荷。
用于给予用于过继细胞治疗的细胞的方法是已知的,并可与本文提供的方法和组合物联用。例如,过继T细胞治疗方法描述于,例如,Gruenberg等的美国专利申请公开号2003/0170238;Rosenberg的美国专利号4,690,915;Rosenberg(2011)Nat Rev Clin Oncol.8(10):577-85)。参见例如Themeli等.(2013)Nat Biotechnol.31(10):928-933;Tsukahara等.(2013)Biochem Biophys Res Commun 438(1):84-9;Davila等.(2013)PLoS ONE 8(4):e61338。
在一些实施方式中,所述细胞治疗,例如,过继T细胞治疗,通过如下方式进行:自体转移,其中所述细胞经分离和/或在其它情况中从接受所述细胞治疗的对象或从源自此类对象的样品制备。因此,在一些方面中,所述细胞源自需要治疗和所述细胞的对象(例如,患者),其在分离和处理之后给予同一对象。
在一些实施方式中,所述细胞治疗,例如,过继T细胞治疗,通过如下方式进行:同种异体转移,其中所述细胞分离和/或在其它情况中从对象制备,该对象与待接受或最终接受所述细胞治疗的对象(例如,第一对象)不同。在此类实施方式中,然后将所述细胞给予相同物种的不同对象,例如,第二对象。在一些实施方式中,所述第一和第二对象是遗传学相同的。在一些实施方式中,所述第一和第二对象是遗传学相似的。在一些实施方式中,所述第二对象表达与第一对象相同的HLA类别或超类型。
在一些实施方式中,向其给予所述细胞、细胞群或组合物的对象(例如,患者)是哺乳动物,通常是灵长类,例如人。在一些实施方式中,所述灵长类是猴子或猿。所述对象可以是男性或女性,并且可以是任何合适的年龄,包括婴儿,少年,青少年,成人,和老年对象。在一些实施方式中,所述对象是非灵长类哺乳动物,例如啮齿类。
还提供用于此类方法的药物组合物。
用于采用本文提供的组合物、细胞、方法和应用治疗的所述疾病、病症和紊乱包括:肿瘤,包括实体肿瘤、血液恶性肿瘤,和黑素瘤,以及感染性疾病,例如病毒或其它病原体,例如,HIV,HCV,HBV,CMV的感染,和寄生性疾病。在一些实施方式中,所述疾病或病症是肿瘤,癌症,恶性肿瘤,赘生物,或其它增殖性疾病。所述疾病包括但不限于:白血病、淋巴瘤、例如、慢性淋巴细胞白血病(CLL)、ALL、非霍奇金氏淋巴瘤、急性骨髓性白血病、多发性骨髓瘤、难治滤泡性淋巴瘤淋巴瘤、套细胞淋巴瘤、惰性B细胞淋巴瘤、B细胞恶性瘤、结肠癌、肺癌、肝癌、乳腺癌、前列腺癌、卵巢癌、皮肤癌(包括黑素瘤)、骨癌、和脑癌、卵巢癌、上皮癌、肾细胞癌、胰腺腺癌、霍奇金淋巴瘤、宫颈、结肠直肠癌、胶质母细胞瘤、成神经细胞瘤、尤文肉瘤、成神经管细胞瘤、骨肉瘤、滑膜肉瘤,和/或间皮瘤。
在一些实施方式中,所述疾病或病症是感染性疾病或病症,例如但不限于,病毒、逆转录病毒、细菌和原生动物感染、免疫缺陷、巨细胞病毒(CMV)、EB病毒(EBV)、腺病毒、BK多瘤病毒。在一些实施方式中,所述疾病或病症是自体免疫或炎性疾病或病症,例如关节炎,例如类风湿性关节炎(RA),I型糖尿病,系统性红斑狼疮(SLE),炎性肠病,牛皮癣,硬皮病,自身免疫性甲状腺疾病,格雷夫斯病,克罗恩病多发性硬化,哮喘和/与移植相关的疾病或病症。
在一些实施方式中,与所述疾病或紊乱相关联的抗原选择自下组:孤儿酪氨酸激酶受体RORl、tEGFR、Her2、Ll-CAM、CD19、CD20、CD22、间皮素、CEA、和肝炎B表面抗原、抗叶酸受体、CD23、CD24、CD30、CD33、CD38、CD44、EGFR、EGP-2、EGP-4、0EPHa2、ErbB2、3、或4、FBP、胎儿乙酰胆碱e受体、GD2、GD3、HMW-MAA、IL-22R-α、IL-13R-α2、kdr、κ轻链、Lewis Y、L1-细胞粘附分子、MAGE-A1、间皮素、MUC1、MUC16、PSCA、NKG2D配体、NY-ESO-1、MART-1、gp100、癌胚抗原、ROR1、TAG72、VEGF-R2、癌胚抗原(CEA)、前列腺特异性抗原、PSMA、Her2/neu、雌激素受体、孕酮受体、酪氨酸蛋白激酶B2、CD123、CS-1、c-Met、GD-2,和MAGE A3和/或生物素化分子,和/或通过HIV、HCV、HBV或其它病原体表达的分子。
在一些实施方式中,所述细胞和组合物以药物组合物的形式给予对象,例如包含所述细胞或细胞群和药学上可接受的运载体或赋形剂的组合物。在一些实施方式中,所述药物组合物还包含其它药物活性试剂或药物,例如化疗剂,例如,天冬酰胺酶,白消安,卡铂,顺铂,柔红霉素,多柔比星,氟尿嘧啶,吉西他滨,羟基脲,甲氨蝶呤,紫杉醇,利妥昔单抗,长春碱,长春新碱等。在一些实施方式中,所述试剂以盐,例如,药学上可接受的盐,的形式给予。合适的药学上可接受的酸加成盐包括源自无机酸的那些,例如盐酸、氢溴酸、磷酸、偏磷酸、硝酸和硫酸,和有机酸,例如酒石酸、乙酸、柠檬酸、苹果酸、乳酸、富马酸、苯甲酸、乙醇酸、葡萄糖酸、琥珀酸和芳基磺酸,例如,对甲苯磺酸。
所述药物组合物中所用的运载体部分通过具体工程改造的CAR或TCR、载体,或表达CAR或TCR的细胞来确定,以及通过用以给予所述载体或表达所述CAR的宿主细胞的具体方法来确定。因此,存在多种合适的配方。例如,所述药物组合物可包含防腐剂。合适的防腐剂可包括,例如,对羟基苯甲酸甲酯、对羟基苯甲酸丙酯、苯甲酸钠和苯扎氯铵。在一些方面中,采用两种或更多种防腐剂的混合物。防腐剂或其混合物的存在量通常是约0.0001%至约2%(以组合物总重量计)。
此外,在一些方面中,所述组合物包含缓冲剂。合适的缓冲剂包括,例如,柠檬酸、柠檬酸钠、磷酸、磷酸钾和多种其他酸和盐。在一些方面中,采用两种或更多种缓冲剂的混合物。缓冲剂或其混合物的存在量通常是约0.001%至约4%(以组合物总重量计)。用于制备可给予的药物组合物的方法是已知的。示例性方法具体描述于,例如,《雷明顿:药物科学与实践》(Remington:The Science and Practice of Pharmacy),LWW公司(Lippincott Williams&Wilkins);第21版.(2005年5月1日)。
在某些实施方式中,所述药物组合物配制为包合复合物,例如环糊精包合复合物,或配制为脂质体。脂质体可用以靶向宿主细胞(例如,T-细胞或NK细胞)至具体组织。许多方法可用于制备脂质体,例如描述于,例如,Szoka等,Ann.Rev.Biophys.Bioeng.,9:467(1980)和美国专利4,235,871、4,501,728、4,837,028和5,019,369中的那些。
在一些实施方式中,所述药物组合物采用时间-释放、延迟释放和/或持续释放递送系统,从而所述组合物的递送在待治疗的部位敏化之前发生,并且具有足够的时间造成该部位敏化。许多类型的释放递送系统是本领域技术人员可以获得和已知的。在一些方面中,此类系统能避免重复给予所述组合物,由此提高对象和医师的便利度。
在一些实施方式中,所述药物组合物以有效于治疗或防止所述疾病或病症的量,例如治疗有效或预防有效量,包含所述细胞或细胞群。因此,在一些实施方式中,所述给予方法包括给予有效量的细胞和群。在一些实施方式中,通过定期评估治疗的对象来监测治疗或预防性功效。对于经数天或更长时间的重复给药,可根据所述病症使治疗重复直至疾病症状得到所需抑制。然而,其它剂量方案可能是有用的并可以确定。所需剂量可以通过单药丸给予所述组合物,通过多药丸给予所述组合物,或通过连续输注给予组合物来递送。
在一些实施方式中,所述细胞以所需剂量给予,其在一些方面中包括所需剂量或细胞数量或细胞类型和/或所述细胞类型的所需比率。因此,在一些实施方式中,细胞剂量基于总细胞数量(或数量/kg体重)和个体群或亚型的所需比率,例如CD4+与CD8+之比。在一些实施方式中,细胞剂量基于个体群中细胞的所需总数(或数量/kg体重)或个体细胞类型。在一些实施方式中,所述剂量基于此类特征的组合,例如总细胞所需数量、所需比率,和个体群中的所需总细胞数量。
在一些实施方式中,所述细胞的群或亚型,例如CD8+和CD4+T细胞,在或处于总细胞的所需剂量,例如T细胞的所需剂量的耐受差异之内给予。在一些方面中,所述所需的剂量是所需的细胞数量或所需的细胞数量/向其给予所述细胞的对象的体重单位,例如,细胞/kg。在一些方面中,所需剂量是或高于最小细胞数量或最小细胞数量/体重单位。在一些方面中,在以所需剂量给予的总细胞中,个体群或亚型以或接近所需的输出比(例如CD4+与CD8+之比)存在,例如,处于所述比率的某一耐受差异或误差之内。
在一些实施方式中,所述细胞以或在细胞的一种或多种个体群或亚型的所需剂量的耐受差异之内给予,例如CD4+细胞的所需剂量和/或CD8+细胞的所需剂量。在一些方面中,所需剂量是所述亚型或群的所需细胞数量,或此类细胞的所需数量/向其给予所述细胞的对象的体重单位,例如,细胞/kg。在一些方面中,所需剂量是或高于所述群或亚型的最小细胞数量,或所述群或亚型的最小细胞数量/体重单位。
因此,在一些实施方式中,所述剂量基于总细胞的所需固定剂量和所需比率,和/或基于所述个体亚型或亚群的一种或多种,例如,各自,的所需固定剂量。因此,在一些实施方式中,所述剂量基于T细胞的所需固定或最小剂量和所需CD4+与CD8+细胞之比,和/或基于CD4+和/或CD8+细胞的所需固定或最小剂量。
在某些实施方式中,所述细胞,或细胞亚型的个体群,以如下范围给予所述对象:约100万-约1000亿细胞,例如,100万-约500亿细胞(例如,约5百万细胞,约2500万细胞,约500亿细胞,约10亿细胞,约50亿细胞,约200亿细胞,约300亿细胞,约400亿细胞,或前述任何两个值之间确定的范围),例如约1000万-约1000亿细胞(例如,约2000万细胞,约3000万细胞,约4000万细胞,约6000万细胞,约7000万细胞,约8000万细胞,约9000万细胞,约100亿细胞,约250亿细胞,约500亿细胞,约750亿细胞,约900亿细胞,或前述任何两个值之间确定的范围),和在一些情况中,约1亿细胞-约500亿细胞(例如,约1.2亿细胞,约2.5亿细胞,约3.5亿细胞,约4.5亿细胞,约6.5亿细胞,约8亿细胞,约9亿细胞,约30亿细胞,约300亿细胞,约450亿细胞)或这些范围之间任何值。
在一些实施方式中,总细胞剂量和/或细胞个体亚群剂量在如下范围中:介于是或约是104和是或约是109细胞/千克(kg)体重之间,例如介于105和106细胞/kg体重之间,例如,是或约是1x105细胞/kg,1.5x105细胞/kg,2x105细胞/kg,或1x106细胞/kg体重。例如,在一些实施方式中,所述细胞以如下量或在一定误差范围内给予:介于是或约是104和是或约是109T细胞/千克(kg)体重之间,例如介于105和106T细胞/kg体重之间,例如,是或约是1x105T细胞/kg,1.5x105T细胞/kg,2x105T细胞/kg,或1x106T细胞/kg体重。
在一些实施方式中,所述细胞以如下量或在一定误差范围内给予:介于是或约是104和是或约是109CD4+和/或CD8+细胞/千克(kg)体重之间,例如介于105和106CD4+和/或CD8+细胞/kg体重之间,例如,是或约是1x105CD4+和/或CD8+细胞/kg,1.5x105CD4+和/或CD8+细胞/kg,2x105CD4+和/或CD8+细胞/kg,或1x106CD4+和/或CD8+细胞/kg体重。
在一些实施方式中,所述细胞以如下量或在一定误差范围内给予:大于和/或至少约1x106,约2.5x106,约5x106,约7.5x106,或约9x106CD4+细胞,和/或至少约1x106,约2.5x106,约5x106,约7.5x106,或约9x106CD8+细胞,和/或至少约1x106,约2.5x106,约5x106,约7.5x106,或约9x106T细胞。在一些实施方式中,所述细胞以如下量或在一定误差范围内给予:介于约108和1012或介于约1010和1011T细胞之间,介于约108和1012或介于约1010和1011CD4+细胞之间,和/或介于约108和1012或介于约1010和1011CD8+细胞之间。
在一些实施方式中,所述细胞按如下量或在一定误差范围内给予:多重细胞群或亚型,例如CD4+和CD8+细胞或亚型的所需输出比。在一些方面中,所需比率可以是特定比率或可以是比率范围。例如,在一些实施方式中,所需比率(例如,CD4+与CD8+细胞之比)介于是或约是5:1和是或约是5:1(或大于约1:5和少于约5:1)之间,或介于是或约是1:3和是或约是3:1(或大于约1:3和少于约3:1)之间,例如介于是或约是2:1和是或约是1:5(或大于约1:5和少于约2:1,例如是或约是5:1,4.5:1,4:1,3.5:1,3:1,2.5:1,2:1,1.9:1,1.8:1,1.7:1,1.6:1,1.5:1,1.4:1,1.3:1,1.2:1,1.1:1,1:1,1:1.1,1:1.2,1:1.3,1:1.4,1:1.5,1:1.6,1:1.7,1:1.8,1:1.9,1:2,1:2.5,1:3,1:3.5,1:4,1:4.5或1:5。在一些方面中,所述耐受差异在所需比率的约1%,约2%,约3%,约4%约5%,约10%,约15%,约20%,约25%,约30%,约35%,约40%,约45%,约50%之内,包括这些范围之间的任何值。
在一些实施方式中,细胞群和组合物采用标准给予技术给予对象,包括口服,静脉内,腹膜内,皮下,经肺,经皮,肌内,鼻内,颊,舌下或栓剂给予。在一些实施方式中,所述细胞群胃肠外给予。本文所用的术语"胃肠外",包括静脉内,肌内,皮下,直肠,阴道和腹膜内给予。在一些实施方式中,所述细胞群通过静脉内,腹膜内或皮下注射采用外围全身递送给予对象。
在一些实施方式中,采用本文所述的方法获得的细胞群与一种或多种其它治疗试剂共同给予,或与另一治疗介入联合,同时或以任何顺序依次进行。在一些情况中,所述细胞与另一治疗在足够接近的时间共同给予,从而所述细胞群增强一种或多种其它治疗试剂的作用,反之亦然。在一些实施方式中,所述细胞群在一种或多种其它治疗试剂之前给予。在一些实施方式中,所述细胞群在一种或多种其它治疗试剂之后给予。
在给予细胞之后,在一些实施方式中,检测工程改造的细胞群的生物活性,例如,通过任何数量的已知方法进行。用以评估的参数包括:工程改造的或天然T细胞或其它免疫细胞与抗原的特异性结合,体内方式(例如,通过成像)或离体方式(例如,通过ELISA或流式细胞术)。在某些实施方式中,工程改造的细胞破坏靶细胞的能力可采用本领域已知的任何合适的方法来检测,例如描述于如下文献的细胞毒性试验,例如,Kochenderfer等,J.Immunotherapy,32(7):689-702(2009),和Herman等.J.Immunological Methods,285(1):25-40(2004)。在某些实施方式中,通过测定一种或多种细胞因子,例如CD 107a,IFNγ,IL-2和TNF的表达和/或分泌,来检测细胞的生物活性。在一些方面中,生物活性通过评估临床结果,例如肿瘤负荷或负载的减少,来检测。
在某些实施方式中,所述工程改造的细胞以任何数量的方式进一步修饰,从而增加其治疗或预防性功效。例如,通过所述群表达的工程改造的CAR或TCR可通过接头直接或间接连接靶向部分。连接化合物,例如,将CAR或TCR连接至靶向部分的实践是本领域已知的。参见例如,Wadwa等,J.Drug Targeting 3:1 1 1(1995),和美国专利5,087,616。
IV.定义
如本文所用,单数形式的“一个”、“一种”和“该”包括复数指代对象,除非文本中另有明确说明。例如,“一种”或“一个”指“至少一种或一个”或“一种(个)或多种(个)”。
本公开内容中,请求保护的主题的各个方面均以范围形式呈现。应当理解,范围形式的描述仅仅是为了方便和简洁,并且不应被解释为对所要求保护的主题的范围的硬性限制。因此,范围的描述应当被认为已经具体公开了所有可能的子范围以及该范围内的单个数值。例如,在提供值的范围的情况下,应当理解,在该范围的上限和下限之间的每个中间值以及在所述范围内的任何其他所述的或中间的值均被包括在要求保护的主题内。所述较小范围内可独立地包含这些较小范围的上下限,它们也属于请求保护的主题的范围,除非明确地排除所述范围的上下限。设定范围包含一个或两个限值时,请求保护的主题也包括排除所述限值之一个或两个的范围。这适用而无关范围的宽度。
本文使用的术语“约”是指本技术领域技术人员容易知晓的各值的通常误差范围。本文中述及“约”值或参数,包括(并描述)指向该值或参数本身的实施方式。
如本文所用,单数形式的“一个”、“一种”和“该”包括复数指代对象,除非文本中另有明确说明。例如,“一种”或“一个”指“至少一种或一个”或“一种(个)或多种(个)”。
本公开内容中,请求保护的主题的各个方面均以范围形式呈现。应当理解,范围形式的描述仅仅是为了方便和简洁,并且不应被解释为对所要求保护的主题的范围的硬性限制。因此,范围的描述应当被认为已经具体公开了所有可能的子范围以及该范围内的单个数值。例如,在提供值的范围的情况下,应当理解,在该范围的上限和下限之间的每个中间值以及在所述范围内的任何其他所述的或中间的值均被包括在要求保护的主题内。所述较小范围内可独立地包含这些较小范围的上下限,它们也属于请求保护的主题的范围,除非明确地排除所述范围的上下限。设定范围包含一个或两个限值时,请求保护的主题也包括排除所述限值之一个或两个的范围。这适用而无关范围的宽度。
当用于氨基酸序列(参照多肽序列)时,本文中所用的“氨基酸序列相同性百分数(%)”和“相同性百分数”定义为,序列比对和引入间隙(必要时)以实现最大序列相同性百分比之后,候选序列(例如,链霉亲和素突变蛋白)中与参照多肽序列的氨基酸残基相同的氨基酸残基的百分数,且不考虑任何保守取代作为序列相同性的部分。以测定氨基酸序列相同性百分率为目的比对可以本领域技术范围内的不同方式实现,例如,使用公共渠道可获得的计算机软件如BLAST、BLAST-2、ALIGN或Megalign(DNASTAR)软件。本领域技术人员能够确定用于比对序列的合适参数,包括使比较的序列实现全长最大对齐所需任何算法。
氨基酸取代可包括多肽中的一种氨基酸被另一种氨基酸替代。氨基酸一般可以根据如下常规侧链性质分类:
1.(1)疏水:正亮氨酸,Met,Ala,Val,Leu,Ile;
2.(2)中性亲水:Cys,Ser,Thr,Asn,Gln;
3.(3)酸性:Asp,Glu;
4.(4)碱性:His,Lys,Arg;
5.(5)影响链取向的残基:Gly,Pro;
6.(6)芳香族:Trp,Tyr,Phe。
非保守性氨基酸取代将涉及这些类别之一的成员与另一类别交换。
本文中所用的对象包括任何活的生物体,例如人类和其它哺乳动物。哺乳动物,包括但不限于,人类和非人动物,包括农场动物,体育动物,啮齿类和宠物。
本文中所用的组合物指,两种或更多种产物、物质或化合物,包括细胞,的任何混合物。其可以是溶液、悬液、液体、粉末、糊剂、水性、非水性或其任何组合。
当述及一种或多种具体细胞类型或细胞群时,本文中所用的“消耗”指,所述细胞类型或群的数量或百分数的减少,例如,相比于组合物中的总细胞数量或所述组合物的体积,或相对于其它细胞类型,例如通过基于由所述群或细胞表达的标志物的负选择,或通过基于不存在于待消耗的细胞群或细胞上的标志物的正选择。该术语不需要从所述组合物完全移除所述细胞、细胞类型或群。
当述及一种或多种具体细胞类型或细胞群时,本文中所用的“富集”指,所述细胞类型或群的数量或百分数的增加,例如,相比于组合物中的总细胞数量或所述组合物的体积,或相对于其它细胞类型,例如通过基于由所述群或细胞表达的标志物的正选择,或通过基于不存在于待消耗的细胞群或细胞上的标志物的负选择。该术语不需要从所述组合物完全移除其它细胞、细胞类型或群,并且不需要如此富集的细胞以100%或甚至接近100%地在所述富集的组合物中存在。
本文中所用的术语“治疗”、“治疗的”和“治疗性”指完全或部分减轻或减少疾病或病症或紊乱,或与其相关的症状、不利作用或结果,或表型。在某些实施方式中,所述作用是治疗性的,从而其部分或完全治愈疾病或病症或与其相关的不利症状。
本文中所用的化合物或组合物或组合的“治疗有效量”指,某一个量,其在剂量上和必需时程上,有效于实现所需治疗结果,例如疾病、病症或紊乱的治疗,和/或该治疗的药物动力学或药代动力学效果。治疗有效量可根据多种因素变化,例如,疾病状态、年龄、性别,和对象体重,以及给予的细胞群。
本文中所用的,称细胞或细胞群针对具体标志物呈“阳性”指,所述细胞上或细胞中具体标志物(通常是表面标志物)的可检测的存在。当述及表面标志物时,该术语指,通过流式细胞术检测到存在表面表达,例如,通过用特异性结合至所述标志物的抗体染色,并检测所述抗体,其中,所述染色可被流式细胞术以一定水平检测到,所述水平显著高于采用同种型匹配的对照或荧光扣除(FMO)门选对照在其它条件相同的情况下进行相同步骤时检测到的染色的水平、和/或基本相似于已知对所述标志物呈阳性的细胞的水平、和/或显著高于已知对所述标志物呈阴性的细胞的水平。
本文中所用的,称细胞或细胞群针对具体标志物呈“阴性”指,所述细胞上或细胞中具有具体标志物,通常是表面标志物,的基本可检测的不存在。当述及表面标志物时,该术语指,通过流式细胞术检测到不存在表面表达,例如,通过用特异性结合至所述标志物的抗体染色,并检测所述抗体,其中,所述染色以一定水平未被流式细胞术检测到,所述水平显著高于采用同种型匹配的对照或荧光扣除(FMO)门选对照在其它条件相同的情况下进行相同步骤时检测到的染色的水平、和/或显著低于已知对所述标志物呈阳性的细胞的水平、和/或基本类似于已知对所述标志物呈阴性的细胞的水平。
在一些实施方式中,所述标志物中的一种的表达的减少指,平均荧光强度损失1log10和/或细胞显示的标志物的百分数相比参照细胞群减小所述细胞的至少约20%,所述细胞的25%,所述细胞的30%,所述细胞的35%,所述细胞的40%,所述细胞的45%,所述细胞的50%,所述细胞的55%,所述细胞的60%,所述细胞的65%,所述细胞的70%,所述细胞的75%,所述细胞的80%,所述细胞的85%,所述细胞的90%,所述细胞的95%,所述细胞的和100%,和20和100%之间的任何%。在一些实施方式中,对于所述标志物之一呈阳性的细胞群指,显示所述标志物的细胞的百分比相比参照细胞群是所述细胞的至少约50%,所述细胞的55%,所述细胞的60%,所述细胞的65%,所述细胞的70%,所述细胞的75%,所述细胞的80%,所述细胞的85%,所述细胞的90%,所述细胞的95%,所述细胞的和所述细胞的100%,以及50和100%之间的任何%。
V.示例性实施方式
本文中提供的实施方式包括:
1.一种针对CD4+或CD8+T细胞进行富集的方法,所述方法包括:
(a)在封闭系统中进行第一选择,所述第一选择包括:从包含原代人T细胞的样品,针对(i)CD4+细胞和(ii)CD8+细胞之一进行富集,所述富集由此产生第一选择群和未选择的群;和
(b)在所述封闭系统中进行第二选择,所述第二选择包括:从所述未选择的群,针对(i)CD4+细胞和(ii)CD8+细胞中另一者进行富集,所述富集由此产生第二选择群,
其中,所述方法产生富集的组合物,其针对CD4+细胞和CD8+细胞富集,并且包括第一选择群的细胞和第二选择群的细胞。
2.如实施方式1所述的方法,其还包括(c)将第一选择群的细胞和第二选择群的细胞合并,由此产生富集的组合物,和/或,其中,所述富集的组合物中的CD4+和CD8+细胞以CD4+细胞与CD8+细胞的培养物起始比存在。
3.如实施方式2所述的方法,其中,所述合并在所述封闭系统中进行。
4.一种产生遗传工程改造的T细胞的方法,所述方法包括:
(a)在封闭系统中进行第一选择,所述第一选择包括:从包含原代人T细胞的样品,针对(i)CD4+细胞和(ii)CD8+细胞之一进行富集,所述富集由此产生第一选择群和未选择的群;和
(b)在所述封闭系统中进行第二选择,所述第二选择包括:从所述未选择的群,针对(i)CD4+细胞和(ii)CD8+细胞中另一者进行富集,所述富集由此产生第二选择群;
(c)在培养器皿中于刺激条件下,孵育培养起始组合物,其包含第一选择群的细胞和第二选择群的细胞,由此产生受激的细胞;和
(d)将遗传工程改造的抗原受体引入(c)中产生的受激的细胞,
其中,所述方法由此产生输出组合物,其包含表达所述遗传工程改造的抗原受体的CD8+T细胞和CD4+T细胞。
5.如实施方式4所述的方法,其还包括,在步骤(c)之前,将第一和第二选择的细胞群的细胞合并,以产生培养起始组合物,和/或,其中所述培养起始组合物中的CD4+和CD8+细胞以CD4+细胞与CD8+细胞的培养物起始比存在。
6.如实施方式5所述的方法,其中,所述合并在所述封闭系统中进行。
7.如实施方式1-6中任一项所述的方法,其中,所述步骤中的一个或多个以自动化方式进行,和/或,其中所述封闭系统是自动化的。
8.如实施方式2-7中任一项所述的方法,其中,CD4+与CD8+细胞的培养物起始比介于是或约是10:1和是或约是1:10之间,介于是或约是5:1和是或约是1:5之间,或介于是或约是2:1和是或约是1:2之间。
9.如实施方式2-8中任一项所述的方法,其中,CD4+与CD8+细胞的培养物起始比是或约是1:1。
10.如实施方式2-6中任一项所述的方法,其中所述样品获自人对象,并且:
CD4+与CD8+细胞的培养物起始比不同于来自所述对象的样品中的CD4+与CD8+细胞之比;和/或
CD4+与CD8+细胞的培养物起始比至少10%、至少20%、至少30%、至少40%,或至少50%大于或小于来自所述对象的样品中的CD4+与CD8+细胞之比。
11.如实施方式1-10中任一项所述的方法,其中,在第一和/或第二选择中富集细胞包括:基于细胞表面标志物的表达进行正选择或负选择。
12.如实施方式11所述的方法,其中,在第一和/或第二选择富集细胞包括:负选择,其包括消耗表达非T细胞表面标志物的细胞。
13.如实施方式12所述的方法,其中,所述非T细胞标志物包括CD14。
14.如实施方式1-13中任一项所述的方法,其中,第一或第二选择中的富集细胞包括:基于一种或多种细胞表面标志物的表达,进行多个正或负选择步骤,以针对CD4+或CD8+细胞进行富集。
15.如实施方式1-14中任一项所述的方法,其中,在第一和/或第二选择中富集细胞包括:基于免疫亲和性的选择。
16.如实施方式15所述的方法,其中,所述基于免疫亲和性的选择通过如下方式进行:使细胞与能够特异性结合至细胞表面标志物的抗体接触,和,回收结合至所述抗体的细胞,由此进行正选择,或回收未结合至所述抗体的细胞,由此进行负选择,其中,回收的细胞富集CD4+细胞,或CD8+细胞,并且抗体是固定在磁性颗粒上的。
17.如实施方式1-13中任一项所述的方法,其中,第一选择和第二选择在分开的分离器皿中进行,其是操作性地连接的。
18.如实施方式17所述的方法,其中,所述分离器皿通过管道操作性地连接。
19.如实施方式15-18中任一项所述的方法,其中,基于免疫亲和性的选择通过如下方式进行:使细胞与固定在色谱基质上或附接至亲和色谱基质的抗体接触,所述抗体能够特异性结合至细胞表面标志物,以进行针对CD4+或CD8+细胞的正或负选择。
20.如实施方式19所述的方法,其中:
所述抗体还包括一种或多种结合伴侣,其能够与固定在所述基质上的结合试剂形成可逆键,由此,所述抗体在所述接触过程中可逆结合至所述基质;和
通过破坏所述结合试剂和结合伴侣之间的可逆结合,能够从所述基质回收表达被所述基质上的所述抗体特异性结合的细胞表面标志物的细胞。
21.如实施方式17所述的方法,其中:
所述结合伴侣选自:生物素、生物素类似物,和能够结合至所述结合试剂的肽;和
所述结合试剂选自:链霉亲和素、链霉亲和素类似物或突变蛋白、抗生物素蛋白和抗生物素蛋白类似物或突变蛋白。
22.如实施方式21所述的方法,其中:
所述结合伴侣包括SEQ ID NO:6所示的氨基酸序列;和/或
所述结合试剂是链霉亲和素突变蛋白,其包括SEQ ID NO:12、13、15或16所示的氨基酸序列。
23.如实施方式19-21中任一项所述的方法,其还包括,在第一选择和/或第二选择中,在使所述样品中的细胞与亲和色谱基质接触之后,施加竞争试剂,以破坏所述结合伴侣和结合试剂之间的键,由此从所述基质回收选择的细胞。
24.如实施方式23所述的方法,其中,所述竞争试剂是生物素或生物素类似物。
25.如实施方式20-24中任一项所述的方法,其中,所述第一和/或第二选择中的一种或多种抗体的与所述细胞表面标志物结合的解离速率常数(koff)大于或约大于3x10-5/秒。
26.如实施方式20-25中任一项所述的方法,其中,所述第一和/或第二选择中的一种或多种抗体对于细胞表面标志物的亲和性的解离常数(Kd)在约10-3-10-7范围内或在约10-7-约10-10范围内。
27.如实施方式20-26中任一项所述的方法,其中第一和/或第二选择的色谱基质在分离器皿中填充,所述分离器皿是柱。
28.如实施方式19-27所述的方法,其中,所述亲和色谱基质吸附和/或能够选择至少或至少约50x106细胞/mL,100x106细胞/mL,200x106细胞/mL或400x106细胞/mL。
29.如实施方式19-28中任一项所述的方法,其中,第一和第二选择步骤包括:使用所述亲和色谱基质,并且,用于第一和第二选择步骤的基质处于足以实现所述培养物起始比的相对量。
30.如实施方式1-29中任一项所述的方法,其中,针对CD4+细胞进行富集包括:基于CD4的表面表达进行正选择。
31.如实施方式1-29中任一项所述的方法,其中,针对CD8+细胞进行富集包括:基于CD8的表面表达进行正选择。
32.如实施方式1-29中任一项所述的方法,其中,包括针对CD8+细胞进行富集的第一和第二选择之一还包括:针对中心记忆T(TCM)细胞进行富集;和/或
针对表达选自CD28、CD62L、CCR7、CD127和CD27的标志物的细胞进行富集。
33.如实施方式1-32中任一项所述的方法,其中:
第一选择包括针对CD8+细胞进行富集且第二选择包括针对CD4+细胞进行富集;和
第一选择还包括针对中心记忆T(TCM)细胞进行富集和/或针对表达选自CD28、CD62L、CCR7、CD127和CD27的标志物的细胞进行富集。
34.如实施方式32或实施方式33或实施方式35所述的方法,其中,针对中心记忆T(TCM)细胞进行富集和/或针对表达所述标志物的细胞进行富集包括:
从针对CD8+细胞进行富集的第一和/或第二选择细胞群选择表达CD62L的细胞;和/或
从针对CD8+细胞进行富集的第一和/或第二选择细胞选择表达CD27的细胞;和/或
从针对CD8+细胞进行富集的第一和/或第二选择细胞群选择表达CCR7的细胞;和/或
从针对CD8+细胞进行富集的第一和/或第二选择细胞群选择表达CD28的细胞;和/或
从针对CD8+细胞进行富集的第一和/或第二选择细胞群选择表达CD127的细胞。
35.如实施方式1-32中任一项所述的方法,其中:
第一选择包括针对CD4+细胞进行富集且第二选择包括针对CD8+细胞进行富集;和
第二选择还包括针对中心记忆T(TCM)细胞进行富集。
36.如实施方式35所述的方法,其中:
(i)第一选择包括:基于CD4的表面表达,通过正选择,富集CD4+细胞,由此产生第一选择群,其针对CD4+原代人T细胞进行富集,和所述非选择的样品;
(ii)第二选择包括:针对CD8+细胞进行富集,并且还包括针对中心记忆T(TCM)细胞对第二选择的样品进行富集,其中,针对中心记忆T(TCM)细胞进行富集包括:
负选择以消耗表达在原初T细胞上存在的表面标志物的细胞,和对表达存在于中心记忆T(TCM)细胞上但不存在于另一记忆T细胞亚群上的表面标志物的细胞进行正选择;或
对表达存在于中心记忆T细胞上但不存在于原初T细胞上的表面标志物的细胞进行正选择,和,对表达存在于中心记忆T(TCM)细胞上但不存在于另一记忆T细胞亚群上的表面标志物的细胞进行正选择;
由此产生针对TCM细胞富集的CD8+原代人T细胞。
37.如实施方式36所述的方法,其中:
原初T细胞上存在的标志物包括CD45RA;和
针对中心记忆T(TCM)细胞进行富集包括:负选择以消耗表达CD45RA的细胞,和,针对表达存在于中心记忆T(TCM)细胞上但不存在于另一记忆T细胞亚群上的表面标志物的细胞进行正选择。
38.如实施方式37所述的方法,其中:
所述存在于中心记忆T细胞上但不存在于原初T细胞上的表面标志物包括CD45RO;
针对中心记忆T(TCM)细胞的富集包括:针对表达CD45RO的细胞进行正选择,和,针对表达存在于中心记忆T(TCM)细胞上但不存在于另一记忆T细胞亚群上的表面标志物的细胞进行正选择。
39.如实施方式36-38中任一项所述的方法,其中,存在于中心记忆T(TCM)细胞表面上但不存在于另一记忆T细胞亚群的上的表面标志物选自下组:CD62L,CCR7,CD27,CD127,和CD44。
40.如实施方式39所述的方法,其中,存在于中心记忆T(TCM)细胞表面上但不存在于另一记忆T细胞亚群的上的表面标志物是CD62L。
41.如实施方式32-40中任一项所述的方法,其中,富集的组合物或培养起始组合物中的CD8+群包括:至少50%中心记忆T(TCM)细胞或包括少于20%的原初T(TN)细胞或包括至少80%CD62L+细胞。
42.一种富集CD4+和CD8+T细胞的方法,所述方法包括:在孵育组合物中,于一定条件下,使包含原代人T细胞的样品的细胞与特异性结合至CD4的第一免疫亲和试剂和特异性结合至CD8的第二免疫亲和试剂接触,由此,所述免疫亲和试剂分别特异性结合至所述样品中的细胞表面上的CD4和CD8分子;和
回收结合至第一和/或第二免疫亲和试剂的细胞,由此产生富集的组合物,其以培养物起始比包括CD4+细胞和CD8+细胞,其中:
第一和/或第二免疫亲和试剂在所述孵育组合物中以次优产出浓度存在,由此,所述富集的组合物包含所述孵育组合物中的少于70%的总CD4+细胞和/或所述孵育组合物中的少于70%的CD8+细胞,由此产生富集CD4+和CD8+T细胞的组合物。
43.一种产生遗传工程改造的T细胞的方法,所述方法包括:
(a)从包含原代人T细胞的样品,针对原代人T细胞进行富集,包括:
在孵育组合物中,于一定条件下,使所述样品的细胞与特异性结合至CD4的第一免疫亲和试剂和特异性结合至CD8的第二免疫亲和试剂接触,由此,所述免疫亲和试剂分别特异性结合至所述样品中的细胞表面上的CD4和CD8分子;和
回收结合至第一和/或第二免疫亲和试剂的细胞,由此产生富集的组合物,其以培养物起始比包括CD4+细胞和CD8+细胞,其中:
第一和/或第二免疫亲和试剂在所述孵育组合物中以次优产出浓度存在,由此,所述富集的组合物包含所述孵育组合物中的少于70%的总CD4+细胞和/或所述孵育组合物中的少于70%的CD8+细胞;和
(b)在刺激条件下,在培养器皿内的培养起始组合物中,孵育所述富集的组合物的细胞,由此产生受激的细胞,其中,所述细胞处于或基本处于所述培养物起始比;和
(c)将遗传工程改造的抗原受体引入(b)的受激的细胞,由此产生输出组合物,其包括表达所述遗传工程改造的抗原受体的CD8+T细胞和CD4+T细胞。
44.如实施方式42或实施方式43所述的方法,其中,针对原代人T细胞的富集在封闭系统中进行。
45.如实施方式42-44中任一项所述的方法,其中,第一和第二免疫亲和试剂在所述孵育组合物中以次优产出浓度存在,由此,所述富集的组合物包含所述孵育组合物中的少于70%的总CD4+细胞和所述孵育组合物中的少于70%的总CD8+细胞。
46.如实施方式42-45中任一项所述的方法,其中:
第一免疫亲和试剂以次优产出浓度存在于所述孵育组合物中,由此,富集的组合物包含少于60%,少于50%,少于40%,少于30%或少于20%的所述孵育组合物中的总CD4+细胞;和/或
第二免疫亲和试剂以次优产出浓度存在于所述孵育组合物中,由此,所述富集的组合物包含少于60%,少于50%,少于40%,少于30%或少于20%的所述孵育组合物中的总CD8+细胞。
47.如实施方式42-46中任一实施方式所述的方法,其中,所述样品包含至少1x109CD3+T细胞。
48.如实施方式42-47中任一项所述的方法,其中,在所述孵育组合物中,第一和第二免疫亲和试剂之一的浓度大于另一者的浓度,由此该较大浓度分别实现所述富集的组合物中CD4+细胞或CD8+细胞相比于CD4+或CD8+细胞之另一者的较高产量,由此在所述富集的组合物中产生培养物起始比。
49.如实施方式48所述的方法,其中:
第一和第二免疫亲和试剂之一的浓度比第一和第二免疫亲和试剂中另一者的浓度大至少1.2倍,1.4倍,1.6倍,1.8倍,2.0倍,3.0倍,4.0倍,5.0倍,6.0倍,7.0倍,8.0倍,9.0倍或10倍;和/或
富集的浓度中的较高产量是增大1.2倍,1.4倍,1.6倍,1.8倍,2.0倍,3.0倍,4.0倍,5.0倍,6.0倍,7.0倍,8.0倍,9.0倍或10倍。
50.如实施方式42-49中任一项所述的方法,其中,CD4+与CD8+细胞的培养物起始比是,介于是或约是10:1和是或约是1:10之间,介于是或约是5:1和是或约是1:5之间或介于是或约是2:1和是或约是1:2之间。
51.如实施方式42-50中任一项所述的方法,其中,CD4+与CD8+细胞的培养物起始比是或约是1:1。
52.如实施方式42-51中任一项所述的方法,其中:
CD4+与CD8+细胞的培养物起始比不同于来自所述对象的样品中的CD4+与CD8+细胞之比;和/或
CD4+与CD8+细胞的培养物起始比至少10%、至少20%、至少30%、至少40%,或至少50%大于或小于来自所述对象的样品中的CD4+与CD8+细胞之比。
53.如实施方式42-52中任一项所述的方法,其中,所述培养起始组合物中大于95%或大于98%的所述细胞是CD4+细胞和CD8+细胞。
54.如实施方式42-53中任一项所述的方法,其中,所述免疫亲和试剂各自包含抗体。
55.如实施方式54所述的方法,其中,所述抗体固定在球的外表面上。
56.如实施方式55所述的方法,其中,所述球是磁珠。
57.如实施方式55或实施方式56所述的方法,其中:
所述抗体包含一种或多种结合伴侣,其能够与固定在所述球上的结合试剂形成可逆键,由此,所述抗体可逆地固定至所述球;和
所述方法还包括:在使所述样品中的细胞与第一和第二免疫亲和试剂接触之后,施加竞争试剂,以破坏所述结合伴侣和结合试剂之间的键,由此从所述球回收选择细胞。
58.如实施方式57所述的方法,其中:
所述结合伴侣选自:生物素、生物素类似物,或能够结合至所述结合试剂的肽;和
所述结合试剂选自:链霉亲和素、链霉亲和素类似物或突变蛋白,抗生物素蛋白,抗生物素蛋白类似物或突变蛋白。
59.如实施方式58所述的方法,其中:
所述结合伴侣包括含有SEQ ID NO:6所示的氨基酸序列的肽,和/或
所述结合试剂是链霉亲和素突变蛋白,其包括SEQ ID NO:12、13、15或16所示的氨基酸序列。
60.如实施方式58或实施方式59所述的方法,其中:
所述结合试剂是包括链霉亲和素或链霉亲和素突变蛋白的一种或多种单体的多聚体;和
所述结合伴侣是肽,其包括至少两种模块的依次排列,所述至少两种模块各能够可逆结合所述结合试剂的至少一种单体。
61.如实施方式60所述的方法,其中,所述结合伴侣包含SEQ ID NO:7-10中任一项所示的氨基酸序列。
62.如实施方式57-61中任一项所述的方法,其中,所述竞争试剂是生物素或生物素类似物。
63.如实施方式42-63中任一项所述的方法,其中,所述第一和/或第二选择中的一种或多种抗体的所述抗体和细胞表面标志物之间的结合的解离速率常数(koff)是大于或约大于3x10-5/秒。
64.如实施方式42-63中任一项所述的方法,其中,所述第一和/或第二选择中的一种或多种抗体的亲和性具有约10-3-10-7范围内的解离常数(Kd)或具有约10-7-约10-10范围内的解离常数。
65.如实施方式42-63中任一项所述的方法,其中,所述一个或多个步骤以自动化方式进行,和/或,其中所述封闭系统是自动化的。
66.如实施方式2、3和5-41中任一项所述的方法,包括:
在进行第一选择和/或第二选择之前,确定所述样品中CD4+与CD8+T细胞的比率;和
基于所述样品中的CD4+与CD8+T细胞的比率,调节第一和/或第二选择,以产生以所述培养物起始比包括CD4+细胞和CD8+细胞的组合物。
67.如实施方式66所述的方法,其中:
第一和/或第二选择包括基于免疫亲和性的选择包括亲和色谱基质;和
调节第一和/或第二选择包括:选择第一和/或第二选择中足以实现所述培养物起始比的亲和色谱基质的量。
68.如实施方式42-65中任一项所述的方法,包括:
在使所述样品的细胞与第一和第二免疫亲和试剂接触之前,确定所述样品中CD4+与CD8+T细胞的比率;和
基于所述样品中CD4+与CD8+T细胞的比率,选择第一和/或第二免疫亲和试剂的浓度,以产生所述富集的组合物,其以所述培养物起始比包括CD4+细胞和CD8+细胞。
69.如实施方式1-68中任一项所述的方法,其中,所述方法获得包括CD4+与CD8+细胞之比的输出组合物,所述CD4+与CD8+细胞之比介于是或约是2:1和是或约是1:5之间。
70.如实施方式69所述的方法,其中,所述输出组合物中的CD4+与CD8+细胞之比是1:1或约是1:1。
71.如实施方式1-70中任一项所述的方法,其中所述样品获自对象。
72.如实施方式71所述的方法,其中,所述对象是将向其给予所述遗传工程改造的T细胞或用于过继细胞治疗的细胞的对象。
73.如实施方式72所述的方法,其中,所述对象是与将向其给予所述遗传工程改造的T细胞或用于过继细胞治疗的细胞的对象不同的对象。
74.如实施方式1-73中任一项所述的方法,其中所述样品是血液或血液源性的样品。
75.如实施方式1-74中任一项所述的方法,其中所述样品是血液白细胞样品。
76.如实施方式1-75中任一项所述的方法,其中所述样品是单采、外周血单核细胞(PBMC),或白细胞去除术样品。
77.如实施方式4-41或43-76中任一项所述的方法,其中,在培养器皿中于刺激条件下对该组合物的孵育在引入遗传工程改造的抗原受体之前、过程中和/或之后进行。
78.如实施方式4-41或43-76中任一项所述的方法,其中,在培养器皿在刺激条件下对该组合物的孵育在引入遗传工程改造的抗原受体之前、过程中和之后进行。
79.如实施方式4-41或43-78中任一项所述的方法,其中,所述刺激条件包括使所述组合物的T细胞增殖的条件。
80.如实施方式4-41或43-79中任一项所述的方法,其中,所述刺激条件包括能够活化TCR复合物的一种或多种组分的一种或多种胞内信号转导结构域的试剂。
81.如实施方式80所述的方法,其中,所述TCR复合物的一种或多种组分包括CD3ζ链。
82.如实施方式4-41或43-81中任一项所述的方法,其中,所述刺激条件包括存在抗CD3抗体,和抗CD28抗体,抗4-1BB抗体,和/或细胞因子。
83.如实施方式82所述的方法,其中,所述抗CD3抗体和/或所述抗CD28抗体存在于固体支持物的表面上。
84.如实施方式83所述的方法,其中,所述细胞因子包括IL-2,IL-15,IL-7,和/或IL-21。
85.如实施方式4-41或43-84中任一项所述的方法,其中,所述遗传工程改造的抗原受体包括T细胞受体(TCR)或功能性非TCR抗原受体。
86.如实施方式85所述的方法,其中,所述受体特异性结合至由待治疗的疾病或病症的细胞表达的抗原。
87.如实施方式85或86中任一项所述的方法,其中,所述抗原受体是嵌合抗原受体(CAR)。
88.如实施方式87所述的方法,其中,所述CAR包含胞外抗原-识别结构域和胞内信号转导结构域,其包括包含ITAM的序列,和T细胞共刺激分子的胞内信号转导结构域。
89.一种处理方法,所述所述方法包括:
(a)产生输出组合物,其包括根据实施方式1-88中任一项所述的CD4+T细胞和CD8+T细胞;和
(b)给予所述输出组合物的细胞至对象。
90.如实施方式89所述的方法,其中,从中分离所述细胞的样品源自给予所述细胞的对象。
91.一种通过如实施方式1-88中任一项所述的方法产生的细胞组合物。
92.如实施方式91所述的组合物,其包括药学上可接受的运载体。
93.一种处理方法,所述方法包括:给予对象如实施方式91或92所述的细胞组合物。
94.如实施方式93所述的方法,其中,所述遗传工程改造的抗原受体特异性结合至与所述疾病或病症相关联的抗原。
95.如实施方式94所述的处理方法,其中,所述疾病或病症是癌症。
96.如实施方式91或实施方式92所述的组合物,其用于治疗对象中的疾病或病症。
97.如实施方式91或实施方式92所述的组合物在制备用于治疗对象中的疾病或紊乱的药物中的应用。
98.如实施方式96所述的组合物或如实施方式97所述的应用,其中,所述遗传工程改造的抗原受体特异性结合至与所述疾病或病症相关联的抗原。
99.如实施方式96-98中任一项所述的组合物或应用,其中,所述疾病或病症是癌症。
100.一种用于纯化靶细胞的封闭设备系统,其包括:
a)包括固定于其上的第一结合试剂的第一亲和色谱基质,所述结合试剂特异性结合至第一细胞上存在的第一细胞表面标志物,其中,第一亲和色谱基质通过第一操作性连接操作性地连接至包括细胞样品的贮存储器,所述第一操作性连接能够允许细胞从所述贮存储器通向第一亲和色谱基质,并且其中,第一亲和色谱基质通过第二操作性连接操作性地连接至输出器皿;和
b)包括固定于其上的第二结合试剂的第二亲和色谱基质,所述第二结合试剂特异性结合至第二细胞上存在的第二细胞表面标志物,其中,第一亲和色谱基质通过第三操作性连接操作性地连接至第二亲和色谱基质,所述第三操作性连接能够允许已通过第一亲和色谱基质且未结合至第一结合试剂的细胞通向第二亲和色谱基质,并且,第二亲和色谱基质通过第四操作性连接操作性地连接至所述输出器皿,第四操作性连接能够允许已结合至第一和/或第二亲和色谱基质并已从第一和/或第二亲和色谱基质洗脱的细胞的通过,并且,第二亲和色谱基质通过第五操作性连接操作性地连接至废料器皿,所述第五操作性连接能够允许已通过第一亲和色谱基质且未结合至第一结合试剂和已通过第二亲和色谱基质且未结合至第二结合试剂的细胞的通过;
c)所述输出器皿;和
d)所述废料器皿,
其中,所述系统经设置以允许,在所述封闭系统中于所述输出器皿中以单一组合物形式收集下述细胞:(i)已结合至第一亲和色谱基质且从第一亲和色谱基质回收的细胞,和(ii)已通过且未结合至第一亲和色谱基质且已结合至第二色谱基质且从第二色谱基质回收的细胞。
101.如实施方式100所述的封闭设备,其中,所述操作性连接中的一种或多种包括连接所述贮存储器、第一亲和色谱基质、第二亲和色谱基质和/或培养器皿的管道。
102.如实施方式101所述的封闭设备,其中,所述管道连接至闩、阀或夹。
103.如实施方式100-102中任一项所述的封闭设备系统,其中:
(a)第一亲和色谱基质是CD4+亲和色谱基质或CD8+亲和色谱基质之一;和
(b)第二亲和色谱基质是所述CD4+亲和色谱基质或所述CD8+亲和色谱基质中的另一者。
104.如实施方式100-103中任一项所述的封闭设备系统,其还包括:
d)包括固定于其上的第三结合试剂的第三亲和色谱基质,所述结合试剂特异性结合至第三细胞表面标志物,由此,第三结合试剂能够结合表达第三细胞表面标志物的细胞,其中,第三操作性连接还将第三亲和色谱基质操作性地连接至第一基质,和,第六操作性连接将第三亲和色谱基质操作性地连接至所述输出容器,从而,第六操作性连接能够允许已结合至第一基质且从第一基质回收且已结合至第三基质且从第三基质回收至输出容器的细胞通过,和
第五操作性连接进一步地将第三亲和色谱基质操作性地连接至所述废料容器,从而,第五操作性连接能够允许已通过且未结合至第三柱的细胞通至废料容器。
105.如实施方式100-103中任一项所述的封闭设备系统,其还包括:
d)包括固定于其上的第三结合试剂的第三亲和色谱基质,所述结合试剂特异性结合至第三细胞表面标志物,由此,第三亲和色谱基质能够结合表达第三细胞表面标志物的细胞,其中
第二操作性连接还将第三亲和色谱基质操作性地连接至第一基质和所述输出容器,从而,第二操作性连接能够允许已结合至第一基质并从第一基质回收且已结合至第三基质并从第三基质回收细胞通至所述输出容器。
106.如实施方式104或105所述的封闭设备系统,其中:
第一亲和色谱基质包括特异性结合CD8的结合试剂;
第二亲和色谱基质包括特异性结合CD4的结合试剂;和
第三亲和色谱基质包括特异性结合中心记忆T(TCM)细胞上表达的标志物的结合试剂。
107.如实施方式106所述的封闭设备系统,其中,第三亲和色谱基质的结合试剂选择性地结合至选自下组的细胞表面标志物:CD62L,CD45RA,CD45RO,CCR7,CD27,CD127,和CD44。
108.如实施方式100-107中任一项所述的封闭设备系统,其中,一种或多种或全部所述亲和色谱基质进一步地操作性地连接至包括一种或多种竞争试剂的洗脱缓冲液储器。
109.如实施方式100-107中任一项所述的封闭设备系统,其中,所述竞争试剂选自下组的一种或多种:生物素、生物素类似物,和能够结合至所述色谱基质的肽。
110.如实施方式100-107中任一项所述的封闭设备系统,其中,第三、第四或第六操作性连接中的一种或多种或全部还包括竞争试剂移除腔室。
111.如实施方式110所述的封闭设备系统,其中,所述竞争试剂移除腔室还包含结合试剂。
112.如实施方式111中任一项所述的封闭设备系统,其中,所述结合试剂包括选自下组的一种或多种:链霉亲和素、链霉亲和素类似物或突变蛋白、抗生物素蛋白和抗生物素蛋白类似物或突变蛋白。
113.如实施方式100-112中任一项所述的封闭设备系统,其中,所述结合试剂中的一种或多种或全部是抗体。
114.如实施方式100-112中任一项所述的封闭设备系统,其中,所述结合试剂中的一种或多种或全部可逆结合至所述亲和色谱基质。
VI.实施例
下面的实施例仅是为了阐述,而不是用来限制本发明的范围。
实施例1:采用单一处理流,通过免疫磁性分离,产生CD4+和CD8+T细胞组合物,用于遗传工程改造和过继细胞治疗
在示例性方法中,针对中心记忆T细胞进行富集的CD4+T细胞群和CD8+T细胞群分离自单采产物样品,其经后续孵育的和工程改造,然后给予对象。所述分离步骤采用单一处理流,采用 Prodigy系统,通过免疫磁性分离进行。该过程相比其它方法是流线式的,其中CD4+细胞从第一单采血浆成分分离且CD8+细胞从第二单采血浆成分分离并进一步消耗/富集,采用 Prodigy装置和三个分离管组进行。
该流线式过程采用用于分离CD4+和CD8+细胞群的一个管组进行,无需将该细胞群从一个器皿(例如,管组)转移至另一个。
CD4+细胞群通过孵育单采样品和 CD4试剂来分离。然后,细胞通过the Prodigy装置组分离,以运行富集程序,然后保留两种细胞部分(即,免疫磁性选择的富集的CD4+细胞部分和流通细胞部分)。富集的(阳性)部分是分离的CD4+T细胞群。CD8+T细胞的群通过孵育流通(阴性)部分和 CD14试剂和 CD45RA试剂或CD19试剂来分离。设置 Prodigy装置以运行消耗程序。然后,细胞/试剂混合物通过 Prodigy装置,采用第一分离步骤中所用的相同管组分离。其中已消耗CD14+/CD45RA+或CD14+/CD19+细胞的流通(阴性)部分与 CD62L试剂孵育。采用 Prodigy装置,采用相同管组运行富集程序来分离细胞/试剂混合物。阳性部分是针对中心记忆细胞富集的分离的CD8+细胞群。
分离的CD4+和CD8+群在相同培养器皿中于培养起始组合物中以培养物起始比合并。在孵育和/或工程改造步骤之后,所述培养物起始比经设计以实现具体所需输出比,或处于所需输出比的耐受误差的某一范围中的比率,或经设计以在某一时间百分数实现。细胞在刺激条件下孵育,例如在Prodigy系统中,采用抗CD3/抗CD28珠,在IL-2(100IU/mL)存在下于37℃孵育72小时。
任选地定期评估细胞组合物和/或在孵育或培养起始之后的一个或多个时间(例如在孵育过程中的时间)调节细胞组合物。评估包括检测增殖速率,检测存活程度,确定表型,例如,一种或多种表面或胞内标志物,例如蛋白质或多核苷酸的表达,和/或调节组合物或器皿的温度,培养基组分,氧或二氧化碳含量,和/或一种或多种因子,试剂,组分,和/或细胞类型,包括亚型的存在或不存在或量或相对量。
然后,如此孵育的细胞经遗传工程改造,通过引入细胞重组基因,用于重组抗原受体,例如嵌合抗原受体(CAR)或重组TCR的表达。所述引入在 Prodigy装置中于包含的环境中进行,其中CD4+和CD8+细胞存在于相同组合物和器皿中。
所述方法导致具有工程改造的CD4+和CD8+T细胞的输出组合物。
实施例2:通过在封闭系统中依次纯化来产生CD4+和CD8+T细胞组合物
该实施例显示从获自对象的单采产物样品富集或选择CD4+T细胞群和CD8+T细胞群的示例性方法。该方法采用封闭系统,使用多重色谱柱用于从相同起始样品依次正选择CD4+和CD8+T细胞群来进行。
A.针对CD4+T细胞群和CD8+T细胞群的富集
在示例性的方法中,如图1A所示,封闭设备14中排布了一系列免疫色谱选择柱和移除柱,其操作性地彼此连接,以及蠕动泵8,其通过各种管线和阀13以控制液相流。
第一选择柱1包含所选体积的亲和色谱基质3,例如琼脂糖树脂,例如已公开的美国专利申请号US2015/0024411所述用于分离T细胞的树脂,例如排除限制经设计以大于T细胞尺寸的树脂,例如获自西班牙马德里的琼脂糖珠技术公司(Agarose Beads Technologies)的琼脂糖,其相比SuperflowTM琼脂糖具有减小的排阻尺寸,其排阻尺寸为6x106道尔顿。第一柱中的基质结合至的多聚体(例如包含SEQ ID NO:12、13、15或16中任一项所示的链霉亲和素突变体,IBA有限公司,德国或如PCT国际申请公开号WO 2014/076277中所述)。第二选择柱2包含所选体积的亲和色谱基质4,例如琼脂糖树脂,例如如上所述的树脂,其也结合至多聚体。
包含抗CD8 Fab片段18的储器经加载以通过泵8、管道和阀13运行,从而,抗CD8 Fab被施加至第一选择柱1,由此,抗CD8 Fab逐渐固定于具有Fab片段中的Twin 的亲和基质3的上(例如SEQ ID NO:10所示;IBA有限公司),其融合至其重链的羧基末端(参见例如公开的美国专利申请号US2015/0024411)。在一些实施方式中,加载来自清洗缓冲液储器6的清洗缓冲液,例如包含0.5%牛血清白蛋白、人血清白蛋白,或重组人血清白蛋白的磷酸盐缓冲盐水(PBS),以通过操作性耦合的管道跑动通过第一选择柱。流通物通过操作性地连接第一选择柱和废料容器的阀13导向废料容器10。在一些实施方式中,该清洗步骤重复多次。
加载包含抗CD4 Fab片段19的储器以跑动通过泵8、管道和阀13,从而将抗CD4 Fab施加至第二选择柱2,由此,抗CD8 Fab逐渐固定在具有Twin 的亲和基质4上的上。在一些实施方式中,使来自清洗缓冲液储器6的清洗缓冲液通过操作性耦合的管道跑动通过第二选择柱。流通物通过操作性地连接第二选择柱和废料容器的阀13导向废料容器10。在一些实施方式中,该清洗步骤重复多次。
第一选择柱和第二选择柱中包含的亲和基质试剂的体积可以是相同或不同的,并且可基于选择后CD4+细胞与CD8+细胞的选择所需产量和/或所需比率来选定。如此选择的体积基于对填充的柱的每1ML体积能够选择的1x108细胞的平均产量的假设。在一个示例性的方法中,柱体积是相同的,例如,对于用于抗CD8 Fab片段的柱采用2ML体积,和对于抗CD4 Fab片段采用2ML柱。可选择柱长和/或柱直径以配合所需体积,例如,以实现CD4+细胞与CD8+细胞的所需培养物起始比。在一些实施方式中,为了适应亲和基质的体积,可以系列方式直接添加具有固定至其上的相同Fab试剂的多个柱,并且其通过管线操作性地连接至彼此。
为了实现对细胞的选择,将单采样品施加至第一选择柱1,由此,CD8+T细胞,如果存在于所述样品中,保留结合至第一柱的树脂3,因为未选择的细胞(包含CD8-细胞)通过该柱。在一些实例中,基于基质的合并体积,例如柱用于各选择的能力的量(例如具有大于2亿CD8+细胞且大于2亿CD4+细胞的量,例如,至少约10%更大或20%更大或更大),选择所用的起始样品中的细胞数量作为上述待选择的细胞的数量。然后,使包含未选择的细胞(阴性部分)的流通物从第一柱通过操作性耦合的管道通至第二选择柱2。CD4+T细胞保留结合至第二柱中的树脂4。包含流体和进一步未选择的细胞(阴性细胞)的流通物通过操作性地连接第二选择柱和废料容器的阀13导向废料容器10。
在一些实施方式中,所述第一选择柱可替代性地是抗CD4亲和色谱基质,并且第二选择柱可以是抗CD8亲和色谱基质。
从清洗缓冲液储器6,清洗缓冲液通过操作性耦合的管道跑动通过第一柱和第二柱。包含从第一和第二柱清洗下来的任何细胞的流通物通过操作性地连接第二选择柱和废料容器阀13导向废料容器10。在一些实施方式中,该清洗步骤重复多次。
从洗脱缓冲液储器7,加载包含洗脱液(例如低浓度的生物素或其类似物,例如2.5MM脱硫生物素)的缓冲液以通过操作性耦合的管道跑动通过第一柱和第二柱。在一些实施方式中,所述洗脱液包含细胞培养基。包含富集的CD4+和CD8+细胞和残余生物素或类似物的流通物导向移除腔室9以移除生物素或其类似物。移除腔室9是SuperflowTM珠的柱,其具有固定至其上的具有足以从所述样品移除生物素或生物素类似物的体积,例如具有6ML的床体积,具有300纳摩尔生物素/mL的结合能力的柱。包含针对CD4+和CD8+进行正选择的富集的细胞的流通物通过操作性地连接移除腔室9和培养器皿的阀导向培养器皿12,例如袋。在一些实施方式中,重复所述洗脱步骤。
在一些实施方式中,在进行该洗脱步骤之后,用包含T-细胞活化试剂(例如抗CD3,抗CD28,IL-2,IL-15,IL-7,和/或IL-21)的活化缓冲液替代清洗缓冲液,并导向通过移除腔室,并且将流通物导向至培养器皿。收集于培养器皿中的阳性部分是分离且合并的CD4+和CD8+细胞群。
B.针对CD4+T细胞群和CD8+T细胞群的富集,针对表达中心记忆T(TCM)细胞上的标志物的细胞的富集
在示例性的方法中,如图1B所示,封闭设备14中排布了一系列免疫色谱选择柱和移除柱,其操作性地彼此连接,以及蠕动泵8,其通过各种管线和阀13以控制液相流。
第一选择柱1和第二选择柱2与上文关于实施例2A所述相同。此外,该方法还包括第三选择柱15,其包含所选体积的亲和基质17,例如琼脂糖树脂,例如描述于公开的美国专利申请号US2015/0024411中的用于分离T细胞的树脂,例如如上文在实施例2A中所述的那样。
如上文关于实施例2A所述的,将抗CD8 Fab和抗CD4 Fab分别施加至第一柱和第二柱。加载包含针对中心记忆T(TCM)细胞上表达的标志物的其它Fab片段的储器20,例如CD28、CD62L、CCR7、CD27或CD127之一,以跑动通过泵8、管道和阀13,从而,将所述其它Fab施加至第三选择柱15,由此,所述其它Fab变得连接至具有所述Fab片段中的Twin (SEQ ID NO:10;IBA有限公司)的亲和基质17上的其融合至其重链的羧基末端,如实施例2A中所述。在一些实施方式中,加载清洗缓冲液,如实施例2A所述,以通过操作性耦合的管道跑动通过第三选择柱。流通物加载通过操作性地连接第三选择柱和废料容器的阀13导向废料容器10。在一些实施方式中,该清洗步骤重复多次。
第一选择、第二和/或第三选择柱中包含的亲和基质试剂的体积可以是相同或不同的,并且可基于选择后针对表达中心记忆T(TCM)细胞上表达的标志物的细胞富集的CD4+细胞与CD8+细胞的选择所需产量和/或所需比率来选定。如此选择的体积基于对填充的柱的每1ML体积能够选择的1x108细胞的平均产量的假设。同样地,对于具体所选的培养物起始比,例如,CD4+细胞与包含针对中心记忆T(TCM)细胞上表达的标志物富集的CD8+细胞的群(例如基于对于CD28,CD62L,CCR7,CD27或CD127之一的进一步选择富集的CD8+细胞的群)的1:1的培养物起始比,用于富集的群(例如CD8+细胞)的母群的选择的基质体积大于用于CD4+或CD8+T细胞群中另一者(例如CD4+群)的选择的基质。基于相比于所述样品中存在的母群(例如CD8+细胞)的分数或百分比,所述样品中进一步富集的细胞群的分数或百分比(例如CD8+/CD28+,CD8+/CD62L+,CD8+/CCR7+,CD8+/CD27+或CD8+/CD127+),来选择大于其它一种或多种基质的体积的,其中用以选择进一步富集的群的母群的基质体积的量或程度,例如包含抗CD8 Fab片段的基质。这可基于患者或健康供者中的平均值来估计,或者,它可针对对其进行选择的给定患者进行测量,然后确定所用柱的尺寸。
在一个示例性的方法中,用于该方法中的柱体积是,例如,具有抗CD4 Fab片段的2ML柱,具有抗CD8 Fab片段的6ML柱,和具有抗CD62L Fab片段的2ML柱。可选择柱长和/或柱直径以配合所需体积,例如,以实现CD4+细胞与针对表达心记忆T(TCM)细胞上表达的标志物的细胞,例如CD8+/CD28+,CD8+/CD62L+,CD8+/CCR7+,CD8+/CD27+或CD8+/CD127+细胞进行富集的CD8+细胞的所需培养物起始比。在一些实施方式中,为了适应亲和基质的体积,可以系列方式直接添加具有固定至其上的相同Fab试剂的多个柱,并且其通过管线操作性地连接至彼此。
为了实现对细胞的选择,将单采样品施加至第一选择柱1,由此,CD8+T细胞,如果存在于所述样品中,保留结合至第一柱的树脂,因为未选择的细胞(包含CD8-细胞)通过该柱。在一些实例中,基于基质的合并体积,例如柱用于各选择的能力的量(例如具有大于2亿CD8+/CD62L+细胞且大于2亿CD4+细胞的量,例如,至少约10%更大或20%更大或更大),选择所用的起始样品中的细胞数量作为上述待选择的细胞的数量。包含未选择的细胞(阴性部分)的流通物通过操作性地连接第一和第二柱阀13导向通至第二柱2。CD4+T细胞保留结合至第二柱中的树脂。包含流体和进一步未选择的细胞(阴性细胞)的流通物通过操作性地连接第二选择柱和阴性部分容器的阀13导向第一废料容器10。
从清洗缓冲液储器6加载清洗缓冲液(例如描述于实施例2A)以通过操作性地连接所述柱的阀和管跑动通过第一柱和第二柱。包含从第一和第二柱清洗下来的任何细胞的流通物通过操作性地连接第二选择柱和废料容器阀13导向废料容器10。在一些实施方式中,该清洗步骤重复多次。
从洗脱缓冲液储器7,加载包含洗脱液(例如生物素或其类似物,例如2.5MM脱硫生物素)的缓冲液,以通过操作性地连接所述洗脱缓冲液储器和第二柱的阀13和管道跑动通过第二柱2。在一些实施方式中,所述洗脱缓冲液包含细胞培养基。包含富集的CD4+细胞和残余生物素的流通物,指向移除腔室9以移除生物素,例如描述于实施例2A,其通过阀13和管道操作性地连接至第二柱。包含针对CD4+进行正选择的富集的细胞的流通物通过操作性地连接移除腔室9和培养器皿的阀13导向培养器皿12,例如袋。在一些实施方式中,重复所述洗脱步骤。在一些实施方式中,在进行该洗脱步骤之后,包含T-细胞活化试剂(例如抗CD3、抗CD28、IL-2、IL-15、IL-7,和/或IL-21)的活化缓冲液替代清洗缓冲液,并通过阀和管道从清洗缓冲液储器导向第二柱、移除腔室并进入所述培养器皿。收集在培养器皿中的阳性部分是分离的CD4+细胞群。
从洗脱缓冲液储器7,加载包含洗脱液(例如生物素)的缓冲液,以通过操作性地连接所述洗脱缓冲液储器和第一柱的阀13和管道跑动通过第一柱1。在一些实施方式中,所述洗脱缓冲液包含细胞培养基。包含富集的CD8+细胞和残余生物素或其类似物的流通物,指向移除腔室9以移除生物素或生物素类似物,例如描述于实施例2A,其通过阀13和管道操作性地连接至第一柱。包含针对CD8+正选择的富集的细胞的流通物通过操作性地连接所述移除腔室9和第三柱的阀13导向通至第三柱15。CD8+细胞的CD62L+亚组保留结合至第三柱中的树脂。包含流体和进一步未选择的细胞(阴性细胞)的流通物通过操作性地连接第三选择柱和第二废料容器的阀13导向第二废料容器11。
从清洗缓冲液储器6,加载清洗缓冲液(例如描述于实施例2A),以通过操作性地连接所述清洗缓冲液储器和第三柱的阀13和管道跑动通过第三柱15。包含从第三柱清洗下来的任何细胞的流通物通过操作性地连接第三选择柱和第二废料容器的阀13导向第二废料容器11。在一些实施方式中,该清洗步骤重复多次。
从洗脱缓冲液储器7,加载包含洗脱液(例如生物素或其类似物,例如2.5MM脱硫生物素)的缓冲液,以通过操作性地连接所述洗脱缓冲液储器和第三柱的阀13和管道跑动通过第三柱15。在一些实施方式中,所述洗脱缓冲液包含细胞培养基。包含针对表达CD28,CD62L,CCR7,CD27或CD127之一的中心记忆T(TCM)细胞富集的CD8+细胞和残余生物素或其类似物的流通物导向移除腔室9以移除生物素或生物素类似物,例如描述于实施例2A,其通过阀13和管道操作性地连接至第三柱。包含针对CD8和中心记忆T(TCM)细胞上表达的标志物,例如CD28,CD62L,CCR7,CD27或CD127之一进行正选择的富集的T细胞记忆细胞的流通物通过操作性地连接所述移除腔室9和培养器皿的阀13导向培养器皿12,例如袋。在一些实施方式中,所述培养器皿包含T-细胞活化试剂、细胞培养基,或两者。在一些实施方式中,重复所述洗脱步骤。在一些实施方式中,在进行该洗脱步骤之后,包含T-细胞活化试剂(例如抗CD3、抗CD28、IL-2、IL-15、IL-7,和/或IL-21)的活化缓冲液替代清洗缓冲液,并通过阀和管道从清洗缓冲液储器导向第一和/或第三柱、移除腔室并进入所述培养器皿。包含CD8+细胞和对于中心记忆T(TCM)细胞上的标志物(例如CD28,CD62L,CCR7,CD27或CD127之一)呈阳性的细胞的阳性部分收集于具有先前收集的CD4+阳性部分的培养器皿中。在一些实施方式中,所述方法的步骤可以不同顺序进行,例如通过如下方式:在富集CD4+细胞之前,对包含CD8+细胞的细胞和对于中心记忆T(TCM)细胞上的标志物(例如CD28,CD62L,CCR7,CD27或CD127之一)呈阳性的细胞进行第一富集。
实施例3:通过在封闭系统中依次纯化,产生CD4+和CD8+T细胞组合物,用于遗传工程改造和过继细胞治疗
该实施例显示,用于选择和产生细胞组合物的方法,所述细胞组合物包含包含CD4+和CD8+T细胞,例如以一定培养物起始比存在的CD4+和CD8+T细胞,用于与过继细胞治疗联用的与细胞的遗传工程改造相关联的方法中的孵育/活化和转导。
通过对CD4+和CD8+细胞进行选择产生的细胞组合物(如实施例2A(CD4+和CD8+)或实施例2B(针对CD62L+富集CD4+和CD8+)所述进行),在刺激条件下孵育,例如在IL-2(100IU/mL)存在下采用抗CD3/抗CD28,例如,在37℃孵育72小时。然后,受激细胞经遗传工程改造,通过(例如通过病毒转导)引入细胞重组基因,用于重组抗原受体,例如嵌合抗原受体(CAR)或重组TCR的表达。在一些实施方式中,在所述引入之后,细胞经进一步孵育,一般在37摄氏度,例如,以允许细胞扩增。
所述方法导致具有工程改造的CD4+和CD8+T细胞的输出组合物。在一些实施方式中,基于选择柱的所选的体积,在工程改造之前在刺激条件下孵育的组合物中的CD4+与CD8+细胞之比(培养物起始比)导致在孵育、刺激和/或工程改造步骤之后的CD4+与CD8+细胞或工程改造的CD4+细胞与工程改造的CD8+细胞之间的特定所需输出比,或处于所需输出比的耐受误差的某一范围之内的比率。在一些实施方式中,处于耐受误差范围之内的所需输出比或比率通过某一耐受的时间百分数来实现。
实施例4:采用次优产出浓度的Fab被覆的表面的细胞选择
处于不同细胞数量的范围的人单采源性的PBPC样品在单一组合物中与连接至抗CD4 Fab的磁性微珠和连接至抗CD8 Fab的磁性微珠孵育,伴随约30分钟的温和混合。该孵育之后,洗脱非选择的细胞,并如上所述利用磁场进行回收。采用0.05~1.5ML的各微珠试剂/百万细胞的回收分别产生低产量的CD4+或CD8+细胞(回收用于相应选择的细胞相比孵育中的阳性细胞),其在该研究中通常在15-70%范围内)。平均来看,采用所述次优产出浓度,在较高浓度的试剂/细胞观察到较大产量。
因此,在一个实例中,进行选择,其中PBMC与次优浓度/细胞数量的偶联至CD4-结合试剂的珠和偶联至CD8-结合试剂的珠孵育,然后利用磁场回收细胞。基于观察到的每细胞试剂浓度和所用珠的产量之间的关系,CD4-结合或CD8-结合试剂中之一或另一者以较高浓度包括(例如,每细胞包括较高数量的Cd4或CD8结合分子),由此在选择之后产生CD8+:CD4+细胞的输出比,其大于或少于1,例如1.5:1或2:1或3:1或1:1.5,1:2,或1:3。该输出比可基于包含在一个或多个额外步骤(例如活化、转导和/或扩增)之后产生的工程改造的细胞的组合物中的CD8对比CD4细胞的所需比率来选择。
序列表
<110> 朱诺治疗学股份有限公司(Juno Therapeutics, Inc.)
C·拉姆斯伯格(RAMSBORG, Chris)
M·L·邦哈迪(BONYHADI, Mark)
C·陈(CHEN, Calvin)
P·博谢纳(BEAUCHESNE, Pascal)
<120> 分离、培养和遗传工程改造用于过继治疗的免疫细胞群的方法
<130> 735042000240
<140> 尚未分配
<141> 现随本文
<150> US 61/983,415
<151> 2014-04-23
<160> 19
<170> FastSEQ for Windows Version 4.0
<210> 1
<211> 3
<212> PRT
<213> 人工序列
<220>
<223> 合成的
<220>
<223> 链霉亲和素结合肽
<220>
<221> 变体
<222> 3
<223> Xaa选自谷氨酰胺、天冬酰胺和甲硫氨酸
<400> 1
His Pro Xaa
1
<210> 2
<211> 4
<212> PRT
<213> 人工序列
<220>
<223> 合成的
<220>
<223> 链霉亲和素结合肽
<400> 2
His Pro Gln Phe
1
<210> 3
<211> 8
<212> PRT
<213> 人工序列
<220>
<223> 合成的
<220>
<223> 链霉亲和素结合肽
<220>
<221> 变体
<222> 1
<223> Xaa = Trp, Lys或Arg
<220>
<221> 变体
<222> 2
<223> Xaa = 任何氨基酸
<220>
<221> 变体
<222> 7
<223> Xaa = Gly或Glu
<220>
<221> 变体
<222> 8
<223> Xaa = Gly, Lys或Arg
<400> 3
Xaa Xaa His Pro Gln Phe Xaa Xaa
1 5
<210> 4
<211> 8
<212> PRT
<213> 人工序列
<220>
<223> 合成的
<220>
<223> 链霉亲和素结合肽
<220>
<221> 变体
<222> 2
<223> Xaa = 任何氨基酸
<220>
<221> 变体
<222> 7
<223> Xaa = Gly或Glu
<220>
<221> 变体
<222> 8
<223> Xaa = Gly, Lys或Arg
<400> 4
Trp Xaa His Pro Gln Phe Xaa Xaa
1 5
<210> 5
<211> 8
<212> PRT
<213> 人工序列
<220>
<223> 合成的
<220>
<223> 链霉亲和素结合肽
<400> 5
Trp Arg His Pro Gln Phe Gly Gly
1 5
<210> 6
<211> 8
<212> PRT
<213> 人工序列
<220>
<223> 合成的
<220>
<223> Strep-tag(注册商标) II
<400> 6
Trp Ser His Pro Gln Phe Glu Lys
1 5
<210> 7
<211> 28
<212> PRT
<213> 人工序列
<220>
<223> 合成的
<220>
<223> 链霉亲和素结合肽的顺序模块
<220>
<221> 变体
<222> (9)...(20)
<223> 第9-20位的Xaa可以是任何氨基酸,并且它们中的4个可缺失
<400> 7
Trp Ser His Pro Gln Phe Glu Lys Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa
1 5 10 15
Xaa Xaa Xaa Xaa Trp Ser His Pro Gln Phe Glu Lys
20 25
<210> 8
<211> 28
<212> PRT
<213> 人工序列
<220>
<223> 合成的
<220>
<223> 链霉亲和素结合肽的顺序模块
<220>
<221> 变体
<222> (9)...(12)
<223> 这些氨基酸可缺失
<400> 8
Trp Ser His Pro Gln Phe Glu Lys Gly Gly Gly Ser Gly Gly Gly Ser
1 5 10 15
Gly Gly Gly Ser Trp Ser His Pro Gln Phe Glu Lys
20 25
<210> 9
<211> 30
<212> PRT
<213> 人工序列
<220>
<223> 合成的
<220>
<223> Twin-Strep-Tag
<400> 9
Ser Ala Trp Ser His Pro Gln Phe Glu Lys Gly Gly Gly Ser Gly Gly
1 5 10 15
Gly Ser Gly Gly Gly Ser Trp Ser His Pro Gln Phe Glu Lys
20 25 30
<210> 10
<211> 30
<212> PRT
<213> 人工序列
<220>
<223> 合成的
<220>
<223> Twin-Strep-Tag
<400> 10
Ser Ala Trp Ser His Pro Gln Phe Glu Lys Gly Gly Gly Ser Gly Gly
1 5 10 15
Gly Ser Gly Gly Ser Ala Trp Ser His Pro Gln Phe Glu Lys
20 25 30
<210> 11
<211> 159
<212> PRT
<213> 阿维丁链霉菌(Streptomyces Avidinii)
<220>
<223> 链霉亲和素
<400> 11
Asp Pro Ser Lys Asp Ser Lys Ala Gln Val Ser Ala Ala Glu Ala Gly
1 5 10 15
Ile Thr Gly Thr Trp Tyr Asn Gln Leu Gly Ser Thr Phe Ile Val Thr
20 25 30
Ala Gly Ala Asp Gly Ala Leu Thr Gly Thr Tyr Glu Ser Ala Val Gly
35 40 45
Asn Ala Glu Ser Arg Tyr Val Leu Thr Gly Arg Tyr Asp Ser Ala Pro
50 55 60
Ala Thr Asp Gly Ser Gly Thr Ala Leu Gly Trp Thr Val Ala Trp Lys
65 70 75 80
Asn Asn Tyr Arg Asn Ala His Ser Ala Thr Thr Trp Ser Gly Gln Tyr
85 90 95
Val Gly Gly Ala Glu Ala Arg Ile Asn Thr Gln Trp Leu Leu Thr Ser
100 105 110
Gly Thr Thr Glu Ala Asn Ala Trp Lys Ser Thr Leu Val Gly His Asp
115 120 125
Thr Phe Thr Lys Val Lys Pro Ser Ala Ala Ser Ile Asp Ala Ala Lys
130 135 140
Lys Ala Gly Val Asn Asn Gly Asn Pro Leu Asp Ala Val Gln Gln
145 150 155
<210> 12
<211> 159
<212> PRT
<213> 阿维丁链霉菌(Streptomyces Avidinii)
<220>
<223> 突变蛋白链霉亲和素Val44-Thr45-Ala46-Arg47
<400> 12
Asp Pro Ser Lys Asp Ser Lys Ala Gln Val Ser Ala Ala Glu Ala Gly
1 5 10 15
Ile Thr Gly Thr Trp Tyr Asn Gln Leu Gly Ser Thr Phe Ile Val Thr
20 25 30
Ala Gly Ala Asp Gly Ala Leu Thr Gly Thr Tyr Val Thr Ala Arg Gly
35 40 45
Asn Ala Glu Ser Arg Tyr Val Leu Thr Gly Arg Tyr Asp Ser Ala Pro
50 55 60
Ala Thr Asp Gly Ser Gly Thr Ala Leu Gly Trp Thr Val Ala Trp Lys
65 70 75 80
Asn Asn Tyr Arg Asn Ala His Ser Ala Thr Thr Trp Ser Gly Gln Tyr
85 90 95
Val Gly Gly Ala Glu Ala Arg Ile Asn Thr Gln Trp Leu Leu Thr Ser
100 105 110
Gly Thr Thr Glu Ala Asn Ala Trp Lys Ser Thr Leu Val Gly His Asp
115 120 125
Thr Phe Thr Lys Val Lys Pro Ser Ala Ala Ser Ile Asp Ala Ala Lys
130 135 140
Lys Ala Gly Val Asn Asn Gly Asn Pro Leu Asp Ala Val Gln Gln
145 150 155
<210> 13
<211> 159
<212> PRT
<213> 阿维丁链霉菌(Streptomyces Avidinii)
<220>
<223> 突变蛋白链霉亲和素Ile44-Gly45-Ala-46-Arg47
<400> 13
Asp Pro Ser Lys Asp Ser Lys Ala Gln Val Ser Ala Ala Glu Ala Gly
1 5 10 15
Ile Thr Gly Thr Trp Tyr Asn Gln Leu Gly Ser Thr Phe Ile Val Thr
20 25 30
Ala Gly Ala Asp Gly Ala Leu Thr Gly Thr Tyr Ile Gly Ala Arg Gly
35 40 45
Asn Ala Glu Ser Arg Tyr Val Leu Thr Gly Arg Tyr Asp Ser Ala Pro
50 55 60
Ala Thr Asp Gly Ser Gly Thr Ala Leu Gly Trp Thr Val Ala Trp Lys
65 70 75 80
Asn Asn Tyr Arg Asn Ala His Ser Ala Thr Thr Trp Ser Gly Gln Tyr
85 90 95
Val Gly Gly Ala Glu Ala Arg Ile Asn Thr Gln Trp Leu Leu Thr Ser
100 105 110
Gly Thr Thr Glu Ala Asn Ala Trp Lys Ser Thr Leu Val Gly His Asp
115 120 125
Thr Phe Thr Lys Val Lys Pro Ser Ala Ala Ser Ile Asp Ala Ala Lys
130 135 140
Lys Ala Gly Val Asn Asn Gly Asn Pro Leu Asp Ala Val Gln Gln
145 150 155
<210> 14
<211> 126
<212> PRT
<213> 阿维丁链霉菌(Streptomyces Avidinii)
<220>
<223> 最小链霉亲和素
<400> 14
Glu Ala Gly Ile Thr Gly Thr Trp Tyr Asn Gln Leu Gly Ser Thr Phe
1 5 10 15
Ile Val Thr Ala Gly Ala Asp Gly Ala Leu Thr Gly Thr Tyr Glu Ser
20 25 30
Ala Val Gly Asn Ala Glu Ser Arg Tyr Val Leu Thr Gly Arg Tyr Asp
35 40 45
Ser Ala Pro Ala Thr Asp Gly Ser Gly Thr Ala Leu Gly Trp Thr Val
50 55 60
Ala Trp Lys Asn Asn Tyr Arg Asn Ala His Ser Ala Thr Thr Trp Ser
65 70 75 80
Gly Gln Tyr Val Gly Gly Ala Glu Ala Arg Ile Asn Thr Gln Trp Leu
85 90 95
Leu Thr Ser Gly Thr Thr Glu Ala Asn Ala Trp Lys Ser Thr Leu Val
100 105 110
Gly His Asp Thr Phe Thr Lys Val Lys Pro Ser Ala Ala Ser
115 120 125
<210> 15
<211> 126
<212> PRT
<213> 阿维丁链霉菌(Streptomyces Avidinii)
<220>
<223> 突变蛋白链霉亲和素Val44-Thr45-Ala46-Arg47
<400> 15
Glu Ala Gly Ile Thr Gly Thr Trp Tyr Asn Gln Leu Gly Ser Thr Phe
1 5 10 15
Ile Val Thr Ala Gly Ala Asp Gly Ala Leu Thr Gly Thr Tyr Val Thr
20 25 30
Ala Arg Gly Asn Ala Glu Ser Arg Tyr Val Leu Thr Gly Arg Tyr Asp
35 40 45
Ser Ala Pro Ala Thr Asp Gly Ser Gly Thr Ala Leu Gly Trp Thr Val
50 55 60
Ala Trp Lys Asn Asn Tyr Arg Asn Ala His Ser Ala Thr Thr Trp Ser
65 70 75 80
Gly Gln Tyr Val Gly Gly Ala Glu Ala Arg Ile Asn Thr Gln Trp Leu
85 90 95
Leu Thr Ser Gly Thr Thr Glu Ala Asn Ala Trp Lys Ser Thr Leu Val
100 105 110
Gly His Asp Thr Phe Thr Lys Val Lys Pro Ser Ala Ala Ser
115 120 125
<210> 16
<211> 126
<212> PRT
<213> 阿维丁链霉菌(Streptomyces Avidinii)
<220>
<223> 突变蛋白链霉亲和素Ile44-Gly45-Ala-46-Arg47
<400> 16
Glu Ala Gly Ile Thr Gly Thr Trp Tyr Asn Gln Leu Gly Ser Thr Phe
1 5 10 15
Ile Val Thr Ala Gly Ala Asp Gly Ala Leu Thr Gly Thr Tyr Ile Gly
20 25 30
Ala Arg Gly Asn Ala Glu Ser Arg Tyr Val Leu Thr Gly Arg Tyr Asp
35 40 45
Ser Ala Pro Ala Thr Asp Gly Ser Gly Thr Ala Leu Gly Trp Thr Val
50 55 60
Ala Trp Lys Asn Asn Tyr Arg Asn Ala His Ser Ala Thr Thr Trp Ser
65 70 75 80
Gly Gln Tyr Val Gly Gly Ala Glu Ala Arg Ile Asn Thr Gln Trp Leu
85 90 95
Leu Thr Ser Gly Thr Thr Glu Ala Asn Ala Trp Lys Ser Thr Leu Val
100 105 110
Gly His Asp Thr Phe Thr Lys Val Lys Pro Ser Ala Ala Ser
115 120 125
<210> 17
<211> 28
<212> PRT
<213> 人工序列
<220>
<223> 合成的
<220>
<223> Twin-Strep-tag
<400> 17
Trp Ser His Pro Gln Phe Glu Lys Gly Gly Gly Ser Gly Gly Gly Ser
1 5 10 15
Gly Gly Gly Ser Trp Ser His Pro Gln Phe Glu Lys
20 25
<210> 18
<211> 24
<212> PRT
<213> 人工序列
<220>
<223> 合成的
<220>
<223> Twin-Strep-tag
<400> 18
Trp Ser His Pro Gln Phe Glu Lys Gly Gly Gly Ser Gly Gly Gly Ser
1 5 10 15
Trp Ser His Pro Gln Phe Glu Lys
20
<210> 19
<211> 28
<212> PRT
<213> 人工序列
<220>
<223> 合成的
<220>
<223> Twin-Strep-tag
<400> 19
Trp Ser His Pro Gln Phe Glu Lys Gly Gly Gly Ser Gly Gly Gly Ser
1 5 10 15
Gly Gly Ser Ala Trp Ser His Pro Gln Phe Glu Lys
20 25
- 还没有人留言评论。精彩留言会获得点赞!