经修饰的自然杀伤细胞及其用途的制作方法
本申请要求于2014年5月15日提交的美国临时申请No.61/993,494的权益。上述申请的全部教导通过引用并入本文。
背景技术:
NK细胞在体内存活和增殖需要细胞因子(例如IL-2和IL-15)的刺激。例如,在对免疫缺陷小鼠进行注射后,活化的NK细胞在1周后变得不可检出,但如果还施用人IL-2,其持续长达一个月仍可检出。因此,使用NK细胞输注的临床方案通常依赖于IL-2施用来延长NK细胞在患者中的存活。然而,IL-2可具有相当大的副作用。除了发热和寒战以外,IL-2施用可导致更严重和可能致命的后果,例如毛细血管渗漏综合征(capillary leak syndrom)。降低IL-2的剂量应当降低副作用的风险,但是可导致刺激调节性T细胞,所述调节性T细胞可抑制NK细胞功能并且可能使其抗癌作用无效。
因此,开发在体外和/或体内促进NK细胞扩增和活性的替代方式将是重要的。
附图简述
本专利或申请文件包含至少一幅彩色附图。在提出请求并支付必要的费用后,官方将提供带有彩色附图的该专利或专利申请公开的副本。
前述内容将由以下本发明的一些实例实施方案的更具体的描述而显而易见,如附图所示,在不同视图中相同的附图标记表示相同部件。附图不一定按比例绘制,而着重于示出本发明的一些实施方案。
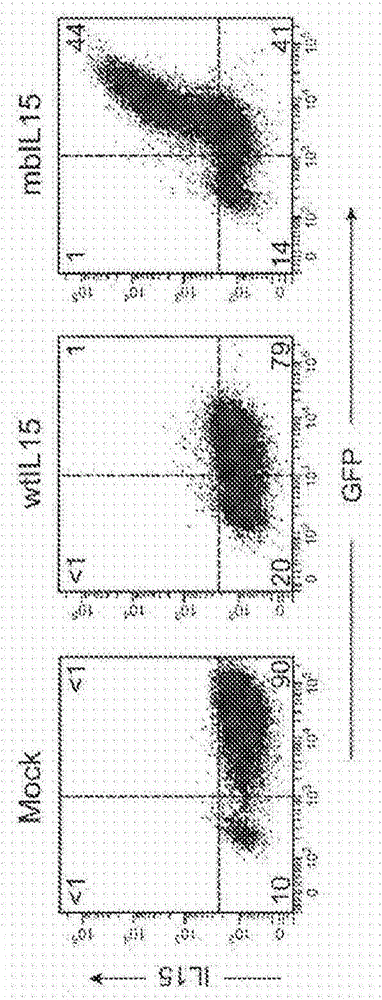
图1A-1C:IL-15构建体的设计和表达。1A.本研究中使用的野生型和膜结合IL-15构建体(“wtIL15”和“mbIL15”)的示意图。1B.用mbIL15转导的NK细胞表面之IL-15的表达。扩增的NK细胞用wtIL15、mbIL15或用仅含有GFP的载体(“模拟(Mock)”)转导。流式细胞术点图示出了如通过抗IL15抗体(R&D Systems)和与藻红蛋白(phycoerythrin)缀合的山羊抗小鼠二抗(Southern Biotechnology Associates)检测到的GFP和IL-15的表达。示出了每个象限中的细胞百分比(>98%CD56+CD3-NK细胞)。1C.用wtIL15转导的NK细胞的IL-15分泌。对来自3个不同供体的NK细胞一式三份地测试。条表示在无IL-2的情况下培养24和48小时后收集的上清液中进行的ELISA测量的平均值±SD。在模拟转导的细胞的上清液中未检测到IL-15。
图2A-2C:表达IL-15的NK细胞在体外的存活和扩增。2A.与来自15个供体的模拟转导和mbIL15转导的细胞(左图)以及来自9个供体的mbIL15或wtIL15转导的细胞之无IL-2的7天平行培养后的输入细胞相比的NK细胞回收百分比。水平条表示中值。示出了成对t检验的结果。用IL-2(10和100IU/mL)培养的结果示于补充图S1中。2B.用低剂量IL-2(10IU/mL)的来自6个供体的模拟转导和mbIL15转导的NK细胞的存活和扩增。2C.来自一个供体的不用IL-2或用低剂量IL-2(100IU/mL IL2的结果示于图6中)培养的用mbIL15、wtIL15转导或模拟转导的NK细胞之扩增和长期存活。示出了在指定培养天数的NK细胞回收百分比。
图3A-3C:表达mb-IL15的NK细胞在体内的存活和扩增。3A.在输注后7天和11天,注射了有或无IL-2的模拟转导或mbIL15转导的NK细胞的小鼠(总计16只小鼠)的外周血中人CD45+细胞的绝对数目(在第7天无IL-2的P=0.004,有IL-2的P=0.021;在第11天P=0.044和0.026)。3B.流式细胞点图示出了不用IL-2处理(上部)和用IL-2处理(下部)的小鼠外周血中人CD45+、GFP+NK细胞的存在。示出了有或无GFP表达的人CD45+细胞的百分比。3C.在注射后第11天收集的注射了有或无IL-2的模拟转导或mbIL15转导的NK细胞的小鼠多种组织中人CD45+细胞的百分比。总体而言,mbIL15的人CD45+细胞的百分比显著较高(无IL-2的P<0.001,有IL-2的P=0.002)。
图4A-4C:表达mbIL15的NK细胞的性质。4A.在用mbIL15转导或模拟转导的NK细胞群中培养7天之前和之后的GFP+细胞的相对比例。示出了来自13个供体的NK细胞的结果;对于mbIL15P<0.001,对于模拟不显著。4B.mbIL15转导的NK细胞的免疫表型特征。通过流式细胞术对在无IL-2的情况下培养48小时的NK细胞进行细胞标志物分析。所有结果概述于表中。4C.将模拟转导和mbIL15转导的NK细胞在无IL-2的情况下培养48小时,并通过Kinex抗体微阵列(Kinexus)分析细胞裂解物。在测试的809个抗磷蛋白抗体中,示出了信号的Z比值>0.5且误差范围%<100的那些。条表示与模拟转导的NK细胞中的归一化强度相比表达mbIL15的NK细胞中的信号变化百分比。
图5A-5D:表达mbIL15的NK细胞的抗肿瘤能力。5A.以1∶4和1∶1E∶T比例(在每种比例下进行15次实验;两种比例的P<0.001)的来自9个供体的mbIL15和模拟转导的NK细胞抗Nalm-6、U937、K562、Daudi、SK-BR-3和ES8细胞系的24小时细胞毒性测定结果。在4小时和24小时细胞毒性测定中用单个细胞系获得的结果示于图7中。5B.表达mbIL15的NK细胞在靶细胞存在下释放裂解性颗粒提高。在以1∶1E∶T的4小时细胞毒性测定后CD107a+NK细胞的百分比。示出了来自3个供体的NK细胞抗2种细胞系的结果(P=0.007)。5C.表达mbIL15的NK细胞在体内表现出抗肿瘤活性。向NOD-SCID-IL2RGnull小鼠i.p.注射1×104个用萤光素酶标记的U937细胞。在3只小鼠中,未进行处理(“无NK”),而4只小鼠在第3天和第7天接受模拟转导的NK细胞(1×107i.p.),并且另外4只小鼠以相同的剂量和方案接受mbIL15转导的NK细胞。示出了肿瘤生长的体内成像结果(腹部图像)。5D.不同处理组中小鼠的总体存活比较。当生物发光达到1×1011个光子/秒时,对小鼠实施安乐死。示出了3条曲线的对数秩检验的P值以及在2条曲线的每一条之间的比较。
图6A-6C:表达IL-15的NK细胞在体外的存活和扩增。6A.在不存在IL-2的情况下表达mbIL15的NK细胞的扩增被抗IL-15中和抗体抑制。符号示出在用mbIL15转导的NK细胞的实验中与输入细胞相比培养期间的平均NK细胞回收(±SD;n=3)。6B.与用低剂量(10IU/mL)和高剂量(100IU/mL)IL-2对来自6个供体的模拟转导、mbIL15转导和wtIL15转导的细胞进行7天平行培养后的输入细胞相比NK细胞回收的百分比。水平条表示中值。示出了成对t检验的结果。6C.来自一个供体的用mbIL15或wtIL15转导并用100IU/mL IL2培养的NK细胞的扩增和长期存活。示出了在指定培养天数的NK细胞回收百分比。
图7A-7B:表达mbIL15的NK细胞的抗肿瘤能力。示出了以1∶4、1∶2和1∶1E∶T比例的mbIL15和模拟转导的NK细胞抗Naim-6、U937、K562、Daudi、SK-BR-3和ES8细胞系的4小时(7A)和24小时(7B)细胞毒性测定结果。每个符号表示用来自3个不同供体的NK细胞对U937、K562、ES8以及来自2个供体的NK细胞对Nalm-6、Daudi和SK-BR-3的实验中的平均值±SD细胞毒性,所有实验一式三份地进行(对于所有实验P<0.001)。
图8A-8C:表达mbIL15的NK细胞的抗肿瘤能力。向NOD-SCID-IL2RGnull小鼠i.p.注射用萤光素酶标记的1×105个ES8细胞。在7只小鼠中,未进行处理(“无NK”),而11只小鼠在第3天接受模拟转导的NK细胞(1×107i.p.),并且另外12只小鼠以相同的剂量和方案接受mbIL15转导的NK细胞。8A.肿瘤生长的体内成像结果。示出了在每组中具有最高肿瘤信号的4只小鼠的腹部图像。8B.肿瘤生长的体内成像结果。每个符号对应于一次生物发光测量(每只小鼠中相关天数3次测量的光子/秒)。8C.不同处理组中小鼠的总体存活比较。当生物发光达到1×1010个光子/秒时,对小鼠实施安乐死。示出了3条曲线的对数秩检验的P值以及在2条曲线的每一条之间的比较。
图9示出了膜结合的IL-15的核苷酸序列(SEQ ID NO:1)和氨基酸序列(SEQ ID NO:2)。
图10示出了人IL-15(NCBI参考序列:NM_000585.4)的核苷酸序列(SEQ ID NO:3)和氨基酸序列(SEQ ID NO:4)。
图11A-11C:mbIL15通过顺式呈递刺激NK细胞。11A.在含有GFP的载体中将NK92细胞用mbIL15(左)或wtIL15(右)转导,分选以获得100%GFP+细胞,并与未转导的NK92细胞以1∶1的比例共培养。示出了相对于培养开始时的细胞数,GFP+和GFP-细胞在培养后的细胞回收百分比(±SD;n=3)。11B.在所示的组合中,将表达mbIL15或未转导的NK92细胞与用mbIL15转导或未转导的K562细胞(“K”)以1∶2的比例共培养。K562细胞用PKH26(Sigma)标记并用Streck细胞防腐剂(Streck,Omaha,NE)处理以防止在培养前的细胞分裂。示出了相对于培养开始时的细胞数,培养后NK92细胞回收的百分比(±SD;n=3)。11C.在浓度递增的外源性IL-15的存在下与未转导的NK92细胞之增殖相比的表达mbIL15的NK92细胞的增殖。在不存在IL-2的情况下(左)或者用10IU/mL(中间)或100IU/mL(右)的IL-2进行培养。示出了相对于培养开始时的细胞数,培养后细胞回收的百分比(±SD;n=3)。
图12A-12C.mb15-NK细胞中KIR的表达和功能。12A.由其转导前和模拟转导或mb15转导后的KIR表达所限定的NK细胞亚群。流式细胞点图示出了来自2个供体的CD56+CD3-细胞中用抗KIR抗体染色的结果。示出了KIR+细胞的百分比。12B.在培养721.221细胞或表达CD158a结合Cw6HLA的相同细胞4小时后CD158a阳性和CD158a阴性亚群中CD107a表达的结果。示出了来自3个供体的NK细胞的4次独立实验的平均值(±SD)(**P<0.0001;*P=0.0002)。12C.在12B中所示的相同实验中IFNγ分泌的结果(**P<0.0001)。
图13A和13B:表达mbIL15的NK细胞的抗体依赖性细胞毒性(Antibody-dependent cell cytotoxicity,ADCC)。在利妥昔单抗或曲妥珠单抗的存在下,mbIL15和模拟转导的NK细胞分别抗(13A)Daudi和(13B)SK-BR-3的4小时ADCC测定结果;使用相同浓度的免疫治疗抗体(1μg/mL)的IgG作为对照。每个符号表明来自每个供体的NK细胞的一式三份实验中的平均值±SD细胞毒性。在免疫治疗抗体的存在下,mbIL15-NK细胞较模拟转导的细胞表现出显著更高的ADCC(在用Daudi或SK-BR-3的测试中对于任一供体P<0.001)。无抗体的mbIL15-NK细胞的细胞毒性也显著更高(在用Daudi或SK-BR-3的测试中对于任一供体P<0.001)。
法明详述
本发明的一些实例实施方案描述如下。
自然杀伤(NK)细胞的公知的抗白血病活性表明了NK细胞输注的治疗潜力。NK细胞存活(以及因此细胞毒性)需要细胞因子支持。本文中描述的是研究非分泌性膜结合形式的白介素-15(IL-15)的表达是否可以维持NK细胞生长的实验。将人IL15基因与编码CD8α跨膜结构域的基因连接(“mbIL15”)。在逆转录病毒转导后,人NK细胞在细胞表面上表达mbIL-15,但IL-15分泌是可忽略的。无IL-2的mbIL15-NK细胞的存活和扩增极大优于模拟转导的细胞(在7天培养后,P<0.0001,n=15)的存活和扩增,并优于分泌非膜结合的IL-15的NK细胞(P=0.025,n=9)的存活和扩增;活的mbIL15-NK细胞在长达2个月仍可检出。在免疫缺陷小鼠中,mbIL15-NK细胞在无IL-2的情况下扩增,并且可以在所有检查的组织(除了脑以外)中以较模拟转导的NK细胞高得多的数量检出(P<0.001)。在有IL-2时,体外和体内扩进一步提高。mbIL15刺激的主要机制是自分泌;其活化IL-15信号传导和抗凋亡信号传导。抗白血病、淋巴瘤和实体瘤细胞系的细胞毒性始终高于mbIL15-NK细胞。以1∶4E∶T的中值24小时细胞毒性为71%,而模拟转导的细胞为22%,在1∶1E∶T时,其为99%与54%(P<0.0001)。在移植有白血病(U937)或肉瘤(ES8)细胞的免疫缺陷小鼠中,增强的抗肿瘤能力也是明显的。因此,mbIL15使NK细胞能够独立生长并增强其抗肿瘤能力。输注mbIL15-NK细胞允许NK细胞治疗而没有IL-2的不良作用。
因此,本文中提供了表达白介素-15(IL-15)的全部或功能部分的(一种或更多种;多种)细胞,其中所述细胞是响应于IL-15的细胞。响应于IL-15的细胞包括其中其一种或更多种活性受IL-15调节的细胞。这样的细胞的实例包括自然杀伤(NK)细胞、T细胞、树突细胞和单核细胞。一种或更多种(例如,分离的)细胞可以表达IL-15的全部或功能部分作为膜结合多肽、作为分泌蛋白或作为其组合。
一方面,本发明涉及表达白介素-15(IL-15)的全部或功能部分的自然杀伤(NK)细胞。一种或更多种(例如,分离的)NK细胞可以表达IL-15的全部或功能部分作为膜结合多肽、作为分泌蛋白或作为其组合。
如本文使用的“自然杀伤细胞”(“NK细胞”)是指免疫系统的一种细胞毒性淋巴细胞。NK细胞对病毒感染的细胞提供迅速响应并且响应于转化细胞。通常来说,免疫细胞检测来自病原体的由被感染细胞表面上的主要组织相容性复合体(Major Histocompatibility Complex,MHC)分子呈递的肽,引发细胞因子释放、引起溶胞(lysis)或凋亡。然而,NK细胞是独特的,因为其具有识别应激细胞的能力,而不管来自病原体的肽是否存在于MHC分子上。因为它们不需要预先活化以杀死目标的最初见解,故它们被命名为“自然杀伤细胞”。NK细胞是大颗粒淋巴细胞(large granular lymphocyte,LGL),并且已知在骨髓(然后它们在此进入循环)中分化并成熟。
在一些方面,NK细胞是哺乳类NK细胞。“哺乳类”或“哺乳动物”的实例包括灵长类(例如,人)、犬科动物(canine)、猫科动物(feline)、啮齿动物、猪、反刍动物等。具体实例包括人、狗、猫、马、牛、绵羊、山羊、兔、豚鼠、大鼠和小鼠。在一个具体方面,哺乳类NK细胞是人NK细胞。
如本文中使用的“白介素-15”(“IL-15”)是指调节T和NK细胞活化和增殖的细胞因子。该细胞因子和白介素2共有许多生物活性。发现它们结合共同的受体亚基,并且可竞争相同的受体,并因此负调节彼此的活性。显示CD8+记忆细胞的数量由IL-15和IL-2之间的平衡控制。这种细胞因子诱导JAK激酶的活化以及转录活化剂STAT3、STAT5和STAT6的磷酸化和活化,并且可通过STAT6的转录活化活性来提高凋亡抑制剂BCL2L1/BCL-x(L)的表达,并因此防止凋亡。
IL-15的“功能部分”(“生物活性部分”)是指保持全长或成熟IL-15的一种或更多种功能的IL-15的一部分。这样的功能包括促进NK细胞存活、调节NK细胞和T细胞活化和增殖以及维持来自造血干细胞的NK细胞发育。
如本领域技术人员将理解的,多种IL-15分子的序列是本领域已知的。在一个方面,IL-15是野生型IL-15。在一些方面,IL-15是哺乳类IL-15(例如,人(Homo sapiens)白介素15(IL15)、转录物变体3、mRNA、NCBI参考序列:NM_000585.4;家犬(canis lupus familiaris)白介素15、mRNA、NCBI参考序列:NM_001197188.1;家猫(Felis catus)白介素15(IL15)、mRNA、NCBI参考序列:NM_001009207.1)。“哺乳类”或“哺乳动物”的实例包括灵长类(例如,人)、犬科动物、猫科动物、啮齿动物、猪、反刍动物等。具体实例包括人、狗、猫、马、牛、绵羊、山羊、兔、豚鼠、大鼠和小鼠。在一个具体方面,哺乳类IL-15是人IL-15。
IL-15的全部或功能部分可以由一种或更多种NK细胞(作为膜结合和/或分泌的多肽)以多种方式表达。例如,IL-15的全部或功能部分可以在NK细胞内表达并由NK细胞分泌和/或可以使用本领域已知的多种接头(Hermanson,G.,Bioconjugate Techniques,Academic Press 1996)中的任一种直接或间接地(例如,离子键、非离子键、共价键)与NK细胞的表面(例如,在NK细胞的表面上或膜内)连接(缀合;融合)。在一些具体方面,IL-15的全部或功能部分与跨膜蛋白的全部或一部分连接。在一个方面,NK细胞表达包含与跨膜蛋白的全部或一部分融合的IL-15的全部或一部分的融合蛋白。在一个具体方面,跨膜蛋白的一部分包含跨膜蛋白的跨膜结构域的全部或一部分。
本文中使用的“跨膜蛋白”或“膜蛋白”是位于膜(例如生物膜(例如,生物膜如细胞膜)的磷脂双层)处和/或膜内的蛋白质。膜蛋白使膜能够进行其独特的活动。附着到膜上的蛋白质的补足物(complement)根据细胞类型和亚细胞定位而不同。一些蛋白质仅结合到膜表面上,而另一些蛋白质具有一个或更多个埋入膜中的区域和/或膜一侧或两侧上的结构域。细胞外膜表面上的蛋白质结构域通常参与细胞-细胞信号传导或相互作用。位于膜的胞质表面的结构域具有广泛的功能,从锚定细胞骨架蛋白到膜至触发细胞内信号传导途径。本文中膜内的区域被称为“跨膜结构域”,特别是形成通道和孔使分子移动穿过膜的那些。“跨膜结构域”是三维蛋白质结构,其在膜(例如,囊泡(例如细胞)的膜)中是热力学稳定的。跨膜结构域的实例包括单个α螺旋、几个跨膜α螺旋的稳定复合物、跨膜β桶形结构(beta barrel)、短杆菌肽A的β螺旋或任何其他结构。跨膜螺旋通常为约20个氨基酸长。
通常来说,基于膜-蛋白质相互作用的性质,将膜蛋白分为两大类,整合的(内在的)和外周的(外在的)。大多数生物膜包含两种类型的膜蛋白。
整合膜蛋白(也称为内在蛋白)具有嵌入磷脂双层的一个或更多个片段。整合膜蛋白包括跨膜蛋白和脂质锚定蛋白。大多数整合蛋白包含具有疏水性侧链的残基,所述疏水性侧链与膜磷脂的脂肪酰基相互作用,从而将蛋白锚定到膜上。大多数整合蛋白跨越整个磷脂双层。这些跨膜蛋白包含一个或更多个跨膜结构域以及4至几百个残基长的延伸到双层每侧上的水性介质中的结构域。通常来说,跨膜结构域是一个或更多个(例如,约1、2、3、4、5、6、7、8、9、10或更多个)α螺旋和/或β链(β strand)。跨膜α螺旋结构域通常通过与双层内部脂质的疏水相互作用以及还可能通过与磷脂(例如,血型糖蛋白)的极性头部基团的离子相互作用而嵌入到膜中。β链的结构通常是跨膜桶形结构(例如,孔蛋白)的形式。一些整合蛋白通过共价结合的脂肪酸锚定到膜小叶(leaflet)之一。在这些蛋白质中,结合的脂肪酸嵌入膜中,但多肽链不进入磷脂双层。一些细胞表面蛋白通过连接到C末端的复合糖基化磷脂(例如,糖基磷脂酰肌醇、碱性磷酸酶)锚定到质膜的脂膜外面(exoplasmic face)。一些胞质蛋白通过共价连接到C末端附近的半胱氨酸的烃部分(例如,异戊二烯基、法尼基和牻牛儿基牻牛儿基基团)锚定到膜的胞质面。在另一组脂质锚定胞质蛋白中,脂肪酰基(例如,肉豆蔻酸酯或棕榈酸酯)通过酰胺键与N-末端甘氨酸残基连接。
外周膜蛋白或外源性蛋白不与磷脂双层的疏水核相互作用。相反,它们通常通过与整合膜蛋白的相互作用间接地或者通过与脂质极性头部基团的相互作用直接地结合到膜上。定位于质膜的胞质面的外周蛋白包括红细胞中的细胞骨架蛋白血影蛋白和肌动蛋白以及酶蛋白激酶C。这种酶在胞质溶胶和质膜的胞质面之间穿梭并在信号转导中发挥作用。其他外周蛋白(包括细胞外基质的某些蛋白质)定位于质膜的外(脂膜外)表面。
跨膜蛋白的实例包括受体、配体、免疫球蛋白、血型糖蛋白或其组合。跨膜蛋白的具体实例包括CD8α、CD4、CD3ε、CD3γ、CD3δ、CD3ζ、CD28、CD137、FcεRIγ、T细胞受体(TCR,例如TCRα和/或TCRβ)、烟碱型乙酰胆碱受体、GABA受体或其组合。免疫球蛋白的具体实例包括IgG、IgA、IgM、IgE、IgD或其组合。血型糖蛋白的具体实例包括血型糖蛋白A、血型糖蛋白D或其组合。
除了与跨膜蛋白的全部或一部分连接之外,IL-15的全部或功能部分可以与例如以下其他组分连接:信号肽(例如,CD8α信号序列)、前导序列、分泌信号、标记(例如,报道基因)等。在一个具体方面,IL-15的全部或功能部分与CD8α的信号肽和CD8α的跨膜结构域的全部或一部分融合。
在另一方面,本发明涉及产生表达白介素-15(IL-15)的全部或功能部分的自然杀伤(NK)细胞的方法。IL-15的全部或一部分可以表达为膜结合多肽、分泌多肽或其组合。所述方法包括将编码IL-15的全部或功能部分的核酸导入到一个或更多个NK细胞中。在一方面,编码IL-15的全部或功能部分的核酸与跨膜蛋白的全部或一部分连接(例如,融合)。作为替代或补充,将编码IL-15的全部或功能部分的核酸引入到NK细胞(例如,野生型IL-15)中。如本领域技术人员显而易见的,其中将编码IL-15的全部或功能部分以及与跨膜蛋白之全部或一部分融合的IL-15的全部或功能部分的核酸引入到NK细胞中的方面可以使用单个核酸或多个(例如,单独的;两个)核酸如此进行。将NK细胞维持在其中IL-15的全部或功能部分表达为膜结合多肽和/或表达为分泌多肽的条件下,从而产生表达IL-15的全部或功能部分作为膜结合多肽和/或作为分泌多肽的NK细胞。在一个具体方面,将编码IL-15的全部或功能部分的核酸与CD8α的信号肽融合,并且将CD8α的跨膜结构域的全部或一部分引入到NK细胞中。
在又一方面,本发明涉及增强NK细胞的扩增和/或存活(例如,体外、离体和/或体内)的方法。所述方法包括引入编码IL-15的全部或功能部分的核酸。可以将编码IL-15(例如,野生型IL-15)的全部或一部分和/或编码与跨膜蛋白之全部或一部分融合的IL-15的全部或功能部分的核酸引入到NK细胞中。因此,NK细胞可表达IL-15的全部或功能部分作为膜结合多肽、分泌多肽或作为其组合。将NK细胞维持在其中IL-15的全部或一部分表达为膜结合多肽、分泌多肽或其组合以及其中NK细胞增殖的条件下。在一个具体方面,将编码IL-15的全部或功能部分的核酸与CD8α的信号肽融合,并将CD8α的跨膜结构域的全部或一部分引入到NK细胞中。在一些方面,所述方法还可包括使包含膜结合的IL-15和/或分泌的IL-15的NK细胞与IL-2接触。在一些方面,IL-2的浓度为约10IU/ml至约1000IU/ml。在另一些方面,IL-2的浓度为约20、40、60、80、100、120、140、160、180、200、220、240、260、280、300、320、340、360、380、400、420、440、460、480、500、520、540、560、580、600、620、640、660、680、700、720、740、760、780、800、820、840、860、880、900、920、940、960、980IU/ml。
对于本领域技术人员显而易见的是,可以使用多种用于将编码作为跨膜多肽和/或作为分泌多肽的IL-15的全部或功能部分的核酸引入到NK细胞中的方法(例如,转染、转导和/或转座子系统)。这样的方法的实例包括基于化学的方法(例如,涉及使用磷酸钙;高度支化的有机化合物(例如,树状聚合物);脂质体(脂质转染);和/或阳离子聚合物(例如,DEAE葡聚糖;聚乙烯亚胺)),基于非化学的方法(例如,电穿孔;细胞挤压;声致穿孔(sonoporation);光学转染;穿刺转染(impalefection);流体动力学递送),基于粒子的方法(例如,基因枪;磁转染;粒子轰击),基于载体的方法(例如,包含病毒载体(例如逆转录病毒载体、慢病毒载体、腺病毒载体等)的载体),核转染,基于转座子的方法(例如,Sleeping Beauty、PiggyBAC等)和/或RNA转染。
对于本领域技术人员显而易见的还有将NK细胞维持在以下条件下的多种方法:其中(i)IL-15的全部或功能部分表达为膜结合多肽和/或作为分泌多肽和/或(ii)可以使用包含膜结合的IL-15和/或分泌的IL-15增殖物的NK细胞。例如,NK细胞可以在合适的温度和气体混合物(例如,在细胞培养箱中约25℃至约37℃,约5%CO2)下生长和/或维持。培养条件可以广泛地变化,并且特定细胞类型的条件变化可导致不同的表型。除了温度和气体混合物之外,培养系统中通常变化的因素是细胞生长培养基。生长培养基的配方可以在pH、葡萄糖浓度、生长因子和其他营养物的存在方面不同。用于补充培养基的生长因子通常来源于动物血液的血清,例如胎牛血清(fetal bovine serum,FBS)、小牛血清、马血清、猪血清和/或人血小板裂解物(human platelet lysate,hPL)。考虑用于维持细胞的其他因素包括接种密度(每体积培养基的细胞数)和悬浮培养或贴壁培养中细胞的生长。
所述方法还可包括隔离或分离通过本文中提供的方法产生的一种或更多种NK细胞。另外,所述方法还可包括培养所述一种或更多种NK细胞。在一些方面,产生NK细胞系。
本发明还涵盖通过本文中所述的方法产生的(一种或更多种)自然杀伤(NK)细胞或细胞系以及包含本文提供的NK细胞的组合物。在一个具体方面,所述组合物是包含本文提供的一种或更多种NK细胞或细胞系的药物组合物。所述药物组合物还可包含IL-2的全部或功能部分(例如,(一种或更多种)IL-2蛋白质的全部或功能部分;编码IL-2的全部或功能部分的核酸)。
本文使用的“IL-2”是指还包括IL-4、IL-7、IL-9、IL-15和IL-21的细胞因子家族的成员。IL-2通过由三条链(称为α、β和γ)组成的受体复合物发信号。γ链由该细胞因子受体家族的所有成员共享。IL-2(其类似于IL-15)促进由B细胞产生的免疫球蛋白的产生并诱导NK细胞的分化和增殖。在适应性免疫应答中发现IL-2与IL-15之间的主要差异。例如,IL-2对于对外来病原体的适应性免疫是必需的,因为其是发生免疫记忆的基础。在另一方面,IL-15对于通过维持CD8记忆T细胞的存活来保持高度特异性T细胞应答是必需的。
在另一方面,本发明涉及在有此需要的个体中治疗涉及NK细胞治疗的疾病和/或病症的方法,其包括向所述个体施用表达细胞介素-15(IL-15)的全部或功能部分的自然杀伤(NK)细胞。在一些具体方面,NK细胞表达IL-15的全部或功能部分作为膜结合多肽和/或作为分泌多肽。如本领域已知的,涉及NK细胞治疗的疾病和/或病症包括NK细胞缺陷、癌症、自身免疫病、感染性疾病等。
在一个具体方面,本发明涉及在有此需要的个体中治疗癌症(例如,肿瘤)的方法,其包括向所述个体施用表达白介素-15(IL-15)的全部或功能部分的自然杀伤(NK)细胞。IL-15的全部或功能部分可以表达为膜结合多肽和/或分泌多肽。
所述方法还可包括施用一种或更多种对癌症(例如,肿瘤)具有特异性的抗体、抗原片段和/或其融合体。例如,所述方法还可包括施用针对一种或更多种肿瘤抗原的一种或更多种抗体。如本领域技术人员将理解的,所述一种或更多种抗体可以是多克隆抗体、单克隆抗体、多价(例如,二价、三价)抗体、嵌合抗体、人源化抗体等及其组合。多种抗原片段和/或融合体也是本领域已知的,并且包括Fab’、F(ab’)2、单链可变片段(scFv)、多价scFv(例如,di-scFv、tri-scFv)、单结构域抗体(纳米抗体)等。
在一些方面,癌症是白血病(例如,急性淋巴细胞白血病、急性髓细胞白血病、慢性髓细胞源性白血病、慢性淋巴细胞白血病)、骨髓增生异常综合征、淋巴瘤(例如,B细胞非霍奇金淋巴瘤(non-Hodgkin lymphoma)、霍奇金淋巴瘤、T细胞成淋巴细胞淋巴瘤(T-cell lymphoblastic lymphoma)、间变性大细胞淋巴瘤(anaplastic large cell lymphoma))、实体瘤(例如,乳腺癌、前列腺癌、胃癌、结肠癌、肝细胞癌、鼻咽癌、神经母细胞瘤、高级别胶质瘤(high grade glioma))、肉瘤(例如,尤因肉瘤(Ewing sarcoma)、横纹肌肉瘤、非横纹肌肉瘤软组织肉瘤(non-rhabdomyosarcoma soft-tissue sarcoma)、骨肉瘤)。
治疗癌症的方法还可包括向个体施用IL-2(IL-2蛋白的全部或功能部分;编码IL-2的全部或功能部分的核酸)。在一个方面,IL-2是哺乳类IL-2,例如人IL-2。在一个具体方面,向个体施用低剂量的IL-2。本文中使用的“低剂量”的IL-12是指约1百万IU/m2或更小剂量(例如,约800,000IU/m2;600,000IU/m2;400,000IU/m2;200,000IU/m2;100,000IU/m2;80,000IU/m2;60,000IU/m2;40,000IU/m2;20,000IU/m2;10,000IU/m2;8,000IU/m2;6,000IU/m2;4,000IU/m2;2,000IU/m2;1,000IU/m2;800IU/m2;600IU/m2;400IU/m2;200IU/m2;100IU/m2)的IL-2。相比之下,IL-2的正常剂量为约1百万IU/m2至约5百万IU/m2。
表达白介素-15(IL-15)的全部或功能部分的一种或更多种自然杀伤(NK)细胞(例如,治疗化合物;药物组合物)以治疗有效量(即,足以治疗癌症的量,例如通过减轻与癌症相关的症状,预防或延迟癌症的发作,还降低癌症症状的严重程度或频率和/或预防、延迟或克服癌症转移)施用。在特定个体的治疗中治疗有效的量将取决于病症(例如,癌症)的症状和严重程度,并且可以通过标准临床技术确定。此外,可以任选地使用体外或体内测定来帮助确定最佳剂量范围。待用于制剂中的精确剂量还将取决于施用途径和癌症的严重性,并且应当根据从业者的判断和每个患者的情况来决定。有效剂量可由来源于体外或动物模型测试系统的剂量响应曲线推断。
治疗化合物可以以如上所述的组合物(例如,药物组合物)递送或通过自身递送。它们可以全身施用或者可以靶向特定组织。治疗性化合物可以通过多种方式产生,例如,包括化学合成;重组产生;体内产生(例如,转基因动物,例如Meade等的美国专利No.4,873,316),并且可使用标准方式(例如本文所述的那些)来分离。也可以使用任何上述治疗方法的组合。
可将用于本文中所述方法的化合物与生理学上可接受的载体或赋形剂一起配制以制备药物组合物。载体和组合物可以是无菌的。制剂应适合施用方式。
合适的可药用载体包括但不限于:水、盐溶液(例如,NaCl)、盐水、缓冲盐水、醇、甘油、乙醇、阿拉伯胶、植物油、苄醇、聚乙二醇、明胶、碳水化合物(例如乳糖)、直链淀粉或淀粉、右旋糖、硬脂酸镁、滑石、硅酸、黏性石蜡、芳香油、脂肪酸酯、羟甲基纤维素、聚乙烯吡咯烷酮等,及其组合。如果期望的话,可以将药物制剂与助剂,例如,不与活性化合物有害地反应的润滑剂、防腐剂、稳定剂、润湿剂、乳化剂、用于影响渗透压的盐、缓冲剂、着色剂、矫味剂和/或芳香物质等混合。
如果期望的话,所述组合物还可包含少量润湿剂或乳化剂或pH缓冲剂。所述组合物可以是液体溶液、混悬剂、乳剂、片剂、丸剂、胶囊剂、缓释制剂或散剂。用传统的黏合剂和载体(例如甘油三酯),可将所述组合物配制成栓剂。经口制剂可包含标准载体,例如药用级甘露醇、乳糖、淀粉、硬脂酸镁、聚乙烯吡咯烷酮、糖精钠、纤维素、碳酸镁等。
引入这些组合物的方法包括但不限于皮内、肌内、腹膜内、静脉内、皮下、表面(topical)、经口和鼻内。其他合适的引入方法还可包括基因治疗(如下所述)、可再装载或可生物降解的装置、粒子加速装置(“基因枪”)和缓释聚合物装置。本发明的药物组合物还可作为与其他化合物的组合治疗的一部分施用。
可以根据常规步骤将组合物配制为适合施合于人的药物组合物。例如,用于静脉内施用的组合物通常是无菌等渗水性缓冲剂中的溶液。必要时,组合物还可包含增溶剂和局部麻醉剂以缓解注射部位的疼痛。通常来说,成分单独提供或以单位剂型混合在一起提供,例如,作为干燥的冻干粉或无水浓缩物,装在标明活性化合物量的密封容器如安瓿或药囊(sachette)中。在通过输注施用组合物的情况下,其可以用含有无菌药用级水、盐水或右旋糖/水的输液瓶分发。在通过注射施用组合物的情况下,可以提供无菌注射用水或盐水的安瓿以便可以在施用前混合成分。
对于表面施用,可以使用包含与表面施用相容的载体并且动力黏度优选大于水的黏稠至半固体或固体形式的不可喷雾形式。合适的制剂包括但不限于:溶液剂、混悬剂、乳剂、乳膏剂、软膏剂、散剂、灌肠剂、洗剂、溶胶剂(sol)、搽剂、油膏剂(salve)、气雾剂等,如果期望的话,将它们灭菌或与助剂(例如,防腐剂、稳定剂、润湿剂、用于影响渗透压的缓冲剂或盐等)混合。
可将本文中所述的化合物配制成中性或盐形式。可药用盐包括与游离氨基形成的那些盐,例如来自于盐酸、磷酸、乙酸、草酸、酒石酸等的那些盐,以及与游离羧基形成的那些盐,例如来自于氢氧化钠、氢氧化钾、氢氧化铵、氢氧化钙、氢氧化铁、异丙胺、三乙胺、2-乙基氨基乙醇、组氨酸、普鲁卡因等的那些盐。
在另一些方面,本发明涉及包含一种或更多种NK细胞的药物组合物,所述NK细胞表达白介素-15(IL-15)的全部或功能部分作为膜结合多肽。本发明还涉及在治疗中用作药物的组合物(例如,药物组合物)。例如,本文中鉴定的药剂可用于治疗癌症。此外,本文中鉴定的药剂可用于制备用于治疗癌症的药物。
本文中使用的“个体”是指动物,并且在一个具体方面是指哺乳动物。哺乳动物的实例包括灵长类、犬科动物、猫科动物、啮齿动物等。具体实例包括人、狗、猫、马、牛、绵羊、山羊、兔、豚鼠、大鼠和小鼠。术语“有此需要的个体”是指如由研究者、兽医、医师或其他临床医生确定的需要治疗或预防的个体。在一个实施方案中,有此需要的个体是哺乳动物,例如人。
本文中使用的(一种或更多种)“分离的”、“基本上纯的”或“基本上纯的且分离的”NK细胞是指这样的NK的细胞:其是从其自然存在的复杂细胞环境,或当通过重组技术产生时的培养基,或当化学合成时的化学前体或其他化学物质中分离的(相对于基本上分离的)。在一些情况下,分离的材料将形成组合物(例如,含有其他物质的粗提取物)、缓冲体系或试剂混合物的一部分。在另一些情况下,可以将材料纯化至基本上同质,例如,如通过琼脂糖凝胶电泳或柱色谱法(例如HPLC)确定的。优选地,NK细胞包含存在的所有大分子物质的至少约50%、80%、90%、95%、98%或99%(以摩尔为基础计)。
除非相反地指出或者以其他方式从上下文中显而易见,否则没有数量词修饰的名词表示一个/种或更多个/种。
在本文中的说明书和权利要求书中使用的短语“和/或”应当被理解为意指这样结合的要素中的“任一个或两者”。用“和/或”列出的多个要素应当以相同的方式解释,即,如此结合的要素中的“一个或更多个”。除了由“和/或”条款具体指出的元素之外,可任选地存在其他要素。如本文中的说明书和权利要求书中使用的“或”应理解为与如上定义的“和/或”具有相同含义。例如,当用于要素列表时,“或”或“和/或”应解释为包括性的,即,包括元素列表中的至少一个,但任选地多于一个,以及任选地,另外的未列出的要素。仅明确指示相反的术语,例如“仅有其一”或“恰好其一”指包含多个要素或要素列表中的恰好一个要素。除非相反地指出,否则在一群组中的一个或更多个成员之间包括“或”的权利要求书被视为满足在给定产物或方法中存在、采用一个、多于一个或全部群组成员,或者一个、多于一个或全部群组成员与给定产物或方法有关。提供了在给定产物或方法中存在、采用恰好一个组成员、或者恰好一个组成员以其他方式与给定产物或方法有关的一些实施方案。提供了在给定产物或方法中存在、采用多于一个或全部群组成员、或者多于一个或全部群组成员以其他方式与给定产物或方法有关的一些实施方案。可以对任一个或更多个权利要求进行修改以明确排除任何实施方案、方面、特征、要素或特性或其任何组合。可以对任一个或更多个权利要求进行修改以排除任何试剂、组合物、量、剂量、施用途径、细胞类型、靶标、细胞标志物、抗原、靶向部分或其组合。
示例
材料和方法
肿瘤细胞系
人细胞系Nalm-6(B系急性淋巴细胞白血病)、Daudi(B细胞淋巴瘤)、K562和U937(急性髓细胞白血病)和SK-BR-3(乳腺癌)获得自美国典型培养物保藏中心(American Type Culture Collection),尤因肉瘤细胞系ES8来自St.Jude Children’s Research Hospital组织库。所有细胞系用含有萤火虫萤光素酶基因的MSCV-内部核糖体进入位点(internal ribosome entry site,IRES)-GFP逆转录病毒载体(来自St.Jude Vector Development and Production Shared Resource)转导。用MoFlo(Beckman Coulter,Miami,FL)或FACSAria(BD Biosciences,San Jose,CA)选择转导细胞用于其GFP表达。使用补充有10%胎牛血清(FBS;Thermo Fisher Scientific,Waltham,MA)和抗生素的RPMI-1640(Invitrogen,Carlsbad,CA)来维持所有细胞系。细胞系由供应商以分子和/或基因表达特征来表征;通过流式细胞术定期测试白血病和淋巴瘤细胞系的细胞标志物谱以确保未发生变化,并在DSMZ(Braunschweig,德国)通过DNA指纹识别(fingerprinting)验证ES8。
人NK细胞扩增
外周血样品获得自来自健康成人供体的血小板收集物的废弃副产物。单个核细胞通过在Accu-Prep密度分级(density step)(Accurate,Westbury,NY)上离心来纯化,并在RPMI-1640中洗涤两次。为了扩增CD56+CD3-NK细胞,如先前在Fujisaki等,Cancer Res,69(9):4010-4017(2009);Imai等,Blood,106:376-383(2005))中所述,将外周血单个核细胞和基因修饰的K562-mb15-41BBL细胞系共培养。简言之,在6孔组织培养板中,将外周血单个核细胞与100Gy辐照的K562-mb15-41BBL细胞以1.5∶1的比例在含有10%FBS、抗生素和10IU/mL重组人白介素-2(IL-2;Roche,Mannheim,德国)的SCGM(CellGenix,Freiburg,Germany)中培养。每2天部分更换组织培养基。共培养7天后,用Dynabeads CD3(Invitrogen)除去残留T细胞,得到含有>95%CD56+CD3-NK细胞的细胞群。
质粒、病毒产生和基因转导
pMSCV-IRES-GFP、pEQ-PAM3(-E)和pRDF获得自St.Jude Vector Development and Production Shared Resource。由用作模板的人脾cDNA库(来自Dr Neiger,St Jude Children′s Research Hospital)通过聚合酶链反应(PCR)对具有长信号肽的白细胞介素-15(IL-15)进行亚克隆。编码CD8α的信号肽的cDNA、IL-15的成熟肽和CD8α的跨膜结构域通过重叠延伸剪接PCR(splicing by overlapping extension by PCR,SOE-PCR)装配以编码膜结合形式的IL-15(“mbIL15“);还测试制备了野生型形式的IL-15(不与CD8α跨膜结构域连接;“wtIL15”)。将所得的表达组件(expression cassette)亚克隆到鼠干细胞病毒内部核糖体进入位点-绿色荧光蛋白(MSCV-IRES-GFP)的EcoRI和XhoI位点中。
为了产生RD144假型逆转录病毒,使用X-tremeGENE 9DNA(Roche,Mannheim,德国)转染3.0×106个293T细胞,与3.5μg编码mbIL15构建体的cDNA、3.5μgpEQ-PAM3(-E)和3μgpRDF一起保持在10cm组织培养皿中18小时。在24小时用具有10%FBS和抗生素的RPMI-1640更换培养基后,在36-96小时收获含有逆转录病毒的条件培养基并添加至包被有RetroNectin(Takara,Otsu,日本)的聚丙烯管中,将其在1400g下离心10分钟并在37℃和5%CO2下孵育4小时。在另外离心并除去上清液后,将扩增的NK细胞(0.5-1×106)添加至管中并在37℃下放置12小时;将这些步骤在2-3天内重复多达6次。然后将细胞保持在具有FBS、抗生素和100IU/ml IL-2的RPMI-1640中。在转导后3-29天对转导的细胞进行测定。
使用抗人IL-15抗体(R&D,Minneapolis,MN)和藻红蛋白缀合的山羊抗小鼠IgG1(Southern Biotech,Birmingham,AL)通过流式细胞术分析mbIL-15的表面表达。用Fortessa流式细胞仪(Becton Dickinson)检测抗体染色。用Quantikine免疫测定法(R&D)测量培养物上清液中IL-15的水平。
NK细胞在体外的功能分析
为了在体外评估NK细胞存活和生长,将转导的NK细胞(1×106个细胞/mL)重悬于具有10%FBS和抗生素的RPMI-1640中,置于24孔板或96孔板(Costar,Corning,NY)的孔中,并在无或有IL-2(10-100IU/ml)的情况下培养。在用碘化丙啶染色后,用Accuri C6流式细胞仪(Becton Dickinson)测定活的GFP+细胞的数目。在一些实验中,在培养之前,将细胞与中和抗IL-15抗体(R&D)或同种型匹配的非反应性抗体孵育10分钟。
使用表中列出的抗体进行NK细胞免疫分型,用Fortessa流式细胞仪显示,并通过Diva(Becton Dickinson)和FlowJo(TreeStar,Ashland,OR)软件进行分析。对于磷蛋白分析,在无IL-2的情况下将模拟转导和mbIL15转导的NK细胞(1×107)培养48小时。使用含有20mM 3-(N-吗啉代)丙磺酸、2mM EGTA、5mM EDTA、30mM氟化钠、60mM β-甘油磷酸盐、20mM焦磷酸钠、1mM原钒酸钠、1%Triton X-100、Complete Mini蛋白酶抑制剂混合物(Roche,Mannheim,德国)和1mM二硫苏糖醇的裂解缓冲液制备细胞裂解物。超声处理后,将裂解物在-80℃下冷冻并在干冰中运送至Kinexus(Vancouver,CA)用于Kinex抗体微阵列分析。
对于细胞毒性测定,将萤光素酶标记的靶细胞和NK细胞(在无IL-2的情况下培养48小时)以多种效应物:靶标(E∶T)比例接种在96孔平底黑色Viewplates(Corning)中并培养4或24小时。在添加NK细胞之前,将贴壁细胞系在37℃和5%CO2下孵育4小时以使得细胞附着。对于抗体依赖性细胞毒性测定,在NK细胞之前添加利妥昔单抗(Rituxan,Roche;Mannheim,德国)、曲妥珠单抗(Herceptin,Roche)或纯化的人IgG(R&D Systems,Minneapolis,MN)(全部为1μg/mL)。在培养结束时,然后向每个测试孔中添加等体积的Bright-Glo萤光素酶试剂(Promega,Madison,WI),5分钟后,使用板读数器测量发光并用Gen52.00软件(均来自BioTek,Tucson,AZ)进行分析。在每个板中,使用仅包含靶细胞的孔的发光信号计算靶细胞生存力。所有实验一式三份地进行。
为了测量裂解性颗粒的释放,将NK细胞(在无IL-2的情况下培养48小时)与K562、U937细胞或721.221细胞及其表达Cw6的变体共培养4小时。在培养开始时添加PE缀合或PE-Cy7缀合的抗CD107a抗体(BD Biosciences),1小时后添加GolgiStop(0.15μL;BD Biosciences)。通过流式细胞术测定CD107a+NK细胞的百分比。
免疫缺陷小鼠中NK细胞的扩增和细胞毒性
为了在体内测试NK细胞扩增,将用mbIL15转导或模拟转导(每只小鼠6-9×106个细胞)转导的人NK细胞注射到NOD.Cg-PrkdcscidIL2rgtm1Wj1/SzJ(NOD/scid IL2RGnull)小鼠(Jackson Laboratories,Bar Harbor,ME)的尾静脉中。在一些小鼠中,腹膜内(i.p.)注射20000IU的IL-2,每周3次。在第7天和第11天,用细胞计数器(Beckman Coulter)对血细胞进行计数;在用红细胞血液裂解溶液(Invitrogen)处理细胞并用藻青蛋白缀合的小鼠抗人CD45和藻红蛋白缀合的大鼠抗小鼠CD45抗体(两者均来自BD Biosciences)染色后,通过流式细胞术对人和小鼠CD45+细胞进行计数。安乐死后,如上所述对骨髓、肝、脾、肾、肺和脑中的人NK细胞进行计数。所有动物实验按照新加坡国立大学机构动物护理和使用委员会(National University of Singapore Institutional Animal Care and Use Committee)批准的方案进行。
为了测试小鼠中的肿瘤细胞杀伤,制备了两种异种移植模型。在第一种中,将表达萤光素酶的U937细胞i.p.注射到NOD.Cg-PrkdcscidIL2rgtm1Wj1/SzJ(NOD/scid IL2RGnull)小鼠(每只小鼠1×104个细胞)中。3天后,i.p.注射用仅包含GFP或mbIL15的MSCV载体转导的NK细胞(每只小鼠1×107个细胞);在第7天重复NK细胞注射。作为对照,一组小鼠接受组织培养基而不是NK细胞。在第二种模型中,对小鼠进行ES8细胞(i.p.;每只小鼠1×105个细胞)移植,然后如上所述在第3天进行1次NK细胞注射。使用Xenogen IVIS-200系统(Caliper Life Sciences,Hopkinton,MA)对肿瘤移植和进展进行评价,i.p.注射D荧光素钾盐水溶液(每只小鼠3mg)5分钟后开始成像。使用Living Image 4.3.1软件程序量化由萤光素酶表达细胞发射的光子。
结果
IL-15构建体的设计和在NK细胞中的表达
如本文中所述,在人NK细胞中表达两种形式的IL15基因:膜结合形式,其由其中人IL15基因与编码CD8α的跨膜结构域的基因连接的构建体(“mbIL15”)得到,以及野生型未经修饰的形式(”wtIL15“)。将两种构建体插入到含有GFP的MCSV逆转录病毒载体中(图1A),所述载体用于转导用刺激性细胞系K562-mb15-41BBL.28培养外周血单个核细胞后获得的增殖性NK细胞。在培养结束时,在逆转录病毒转导之前,用抗CD3免疫磁珠耗竭残留T细胞,得到>95%纯度的CD56+CD3-细胞。含有mbIL15的构建体的中值GFP表达为71%(23%-97%,n=60),而含有wtIL15的构建体的中值GFP表达为69%(范围,20%-91%,n=25)。来自相同供体的也用仅含有GFP的载体转导的NK细胞之中值GFP表达为84%(53%-98%,n=60)(图1B)。
在用mbIL15转导后,IL-15在NK细胞膜上表达:40%-63%(中值,52;n=7)的GFP+NK细胞具有如通过抗IL15抗体检测的IL-15(图1B)。相比之下,在用wtIL15转导的细胞(n=4)或模拟转导的NK细胞(n=7)中未检测到IL-15。通过对培养24和48小时后收集的上清液进行测试来确定转导的NK细胞之可溶性IL-15的产生。如图1C所示,表达wtIL15的细胞分泌显著量的IL-15,而这在mbIL15-NK细胞中是最少的,并且在模拟转导的NK细胞中不可检出。
表达IL-15的NK细胞具有自主存活和扩增能力
为了确定IL-15的表达是否可替代外源性IL-2以维持NK细胞存活,将来自15个供体的NK细胞用mbIL15构建体转导并在不存在IL-2的情况下培养;然后将培养后的细胞数与用模拟转导的NK细胞平行培养的细胞数进行比较。如图2A中所示,mbIL-15的表达显著提高NK细胞存活:培养7天后,中值细胞回收率为85%,而实际上未检测到活的模拟转导的NK细胞(<1%;通过成对t检验P<0.0001)。如果将抗IL-15中和抗体添加至培养物中,则mbIL15的作用显著降低(图6A-6B)。在15个供体中的9个中,还将mbIL15NK细胞的回收率与表达wtIL15的NK细胞的回收率进行比较:其显著高于前者(中值,85%与56%,P=0.026;图2A)。
在平行实验中,测定在外源性IL-2存在下IL15表达的支持效应。当培养物含有10IU/mL的IL-2时,表达mbIL15或wtIL15的NK细胞的7天回收率保持显著高于模拟转导的细胞的回收率;在这些条件下,在2种形式的IL15之间未观察到显著差异(图6A-6B)。仅当外源性IL-2以高浓度(100IU/mL)存在时,模拟转导的NK细胞的7天回收率与用IL15转导的NK细胞的7天回收率相匹配(图6A)。
在用来自9个供体中的6个的扩增的NK细胞进行的实验中,测定了mbIL15用低剂量IL-2(10IU/mL)维持NK细胞存活超过7天的能力。在第14天,在6种培养物中的4种中维持或提高mbIL15NK细胞数目;在6种培养物中的2种中,这些细胞在第21天前进一步扩增。在来自相同供体的模拟转导的NK细胞的6种培养物中,仅2种在第14天和第21天维持细胞数,并且未观察到细胞生长;在第21天,mbIL15NK细胞的中值细胞回收率为205%,而模拟转导的NK细胞的中值细胞回收率为80%。因此,即使在低剂量IL-2的存在下,表达mbIL15赋予显著的存活和生长优势。
在来自一个供体的NK细胞的培养物中,当表达IL15时,在第7天观察到特别高的细胞回收率(在不存在IL-2的情况下,mbIL15为261%且wtIL15为161%;在10IU/mL IL-2的存在下为266%和188%)。监测这些培养物2个月,观察到由mbIL15表达引起的细胞扩增和存活的显著改善(图2C)。即使在不存在IL-2的情况下,mbIL-15NK细胞继续存活直至第21天,并且它们在培养开始后75天仍可检出,而模拟转导的细胞在第7天变得不可检出且wtIL15转导的NK细胞在第42天变得不可检出。在低浓度(10IU/mL)的IL-2存在下,培养开始后2个月表达mbIL15的NK细胞的数目与最初接种的数目相同,而活的模拟转导和wtIL15转导的NK细胞已很早开始下降。如附图6B所示,当向培养物中添加高剂量(100IU/mL)的IL-2时,用mbIL155或wtIL15转导的NK细胞具有相似的持久性特性,即使在这些条件下,这两种细胞类型较模拟转导的NK细胞存活得更长。
mbIL15NK细胞在体内的扩增和归巢(homing)
在体外进行的实验表明IL15表达改善NK细胞的存活和扩增,并且mbIL15产生总体上更好的刺激。接着测定mbIL15表达是否将维持NOD/scid IL2RGnull小鼠中人NK细胞的扩增。将来自4个供体的活化的NK细胞用mbIL15(52%-74%GFP阳性)转导并注射到4只小鼠(每个供体一只小鼠)中;4只对照小鼠注射来自相同供体的模拟转导的NK细胞。表达mbIL15的NK细胞较模拟转导的NK细胞扩增多得多:注射后7天,mbIL15NK细胞/μl血液的中值数为44.5(范围,42-60),而模拟转导的NK细胞为6.5(0-12)(P=0.004)(图3A)。用相同的细胞进行平行实验,这次还每2天i.p.施用20,000IU人IL-2(图3A)。在这些条件下,mbIL15NK细胞扩增得甚至更多(中值NK细胞/μl,101;范围,60-167),而模拟转导的细胞仍然很低(中值,18;范围,6-20;P=0.021)。
在注射后第11天,mbIL15NK细胞在不存在IL-2的情况下包含168.5个细胞/μl(范围,94-355)的外周血单个核细胞,而当还施用IL-2时包含382个细胞/μl(151-710)(图3A、B)。相比之下,在注射模拟转导的NK细胞的小鼠中,人CD45细胞在无IL-2的情况下几乎不可检出,而当还注射IL-2时人CD45细胞以低水平(中值27;范围9-207;P=0.026)存在。人CD45+细胞还表达CD56且缺乏CD3(未示出)。值得注意的是,GFP+的比例从注射前的66.5%±9.9%提高到第7天的93.8%±4.4%和第11天的94.8%±3.4%(对于这两种比较P<0.01)。
在第11天安乐死后,对4只小鼠中的3只的多个组织中人CD45+细胞的存在进行检查。如果表达mbIL15,则在骨髓、肝、脾、肾和肺中检测到相当大数量的人NK细胞;在所有组织中,数目显著高于用模拟转导的细胞观察到的数目(图3C):与模拟转导的细胞的0.04%±0.09%和0.4%±0.6%相比,无IL-2的表达mbIL15的CD45+细胞的平均(±SD)百分比为1.2%±1.5%,而有IL-2的为3.0%±4.3%(分别为P<0.001和P=0.002)。唯一例外是脑,其中既不可检出mbIL15转导的NK细胞,也不可检出模拟转导的NK细胞。
mbIL15刺激机制
为了确定mbIL15主要以反式(trans)(存在于一个NK细胞上的刺激相邻细胞的IL-15(据报道在生理上发生的机制))还是顺式(cis)(通过mbIL15与在同一细胞中表达的受体的直接结合)刺激细胞,在培养7天后评估培养物中GFP+和GFP-NK细胞的比例。如果反式机制是主要的,则GFP+与GFP-NK细胞之间的比在培养期间应保持不变;如果顺式是主要的,则GFP+细胞的比例应当提高。图4A示出了这样的分析的结果:如果表达mbIL15,则在无IL-2的情况下培养7天后检查的NK细胞中GFP+细胞的百分比始终提高,而其在具有模拟转导的细胞的培养物中不始终提高:与第0天的71.2%±19.0%和80.5%±17.1%相比,第7天的GFP+细胞构成总细胞群的95.9%±3.3%和57.5%±18.6%(P<0.0001)。因此,在NK细胞中表达的mbIL-15的主要刺激机制是自分泌。
表达IL15的细胞基本上保留活化的NK细胞的免疫表型。然而,当与模拟转导的NK细胞相比在IL-2抽取2天后检查时,mbIL15NK细胞表达适度更高水平的活化受体NKG2D、NKp44(CD336)和NKp30(CD337)以及适度更高水平的CD16和CD56,而NKp46(CD335)的表达降低,且其他分子如DNAM-1(CD226)的表达保持不变(图4B;表)。还确定了通过mbIL15的表达活化的信号转导途径。如图4C所示,与模拟转导的NK细胞相比,mbIL-15NK细胞具有数种高度磷酸化的分子。这些包括已知响应于IL-15信号传导而磷酸化的分子,例如转录因子STAT1、STAT3和STAT5、激酶src、Erk1/2和Mek1。值得注意的是,观察到Bad的显著磷酸化以及胱天蛋白酶(Caspase)7和9的磷酸化,共同说明了抗凋亡作用。mbIL15NK细胞中的在IL-15信号传导中的作用不清楚的其他高度磷酸化的分子包括CDK6和RafA。
mbIL-15对体外和体内NK细胞抗肿瘤细胞毒性的影响
由mbIL15的表达引起的NK细胞存活和增殖的改善表明NK介导的肿瘤细胞杀伤也可能提高。首先通过比较由mbIL15-NK细胞表现的肿瘤细胞细胞毒性与来自同一供体的模拟转导的NK细胞的细胞毒性来测试这种见解。用来自9个供体的靶向白血病细胞系Nalm-6(B系急性淋巴细胞白血病)、U937和K562(急性髓细胞白血病)以及Daudi(B细胞淋巴瘤)、SKBR3(乳腺癌)和ES8(尤因肉瘤)的NK细胞以不同的E∶T比例和共培养时间进行实验,总计进行90次实验。图5A示出了24小时测定的结果:在1∶4E∶T时,模拟转导的NK细胞的中值细胞毒性为22%,而在1∶1E∶T时为54%;用mbIL15NK细胞,分别为71%和99%(P<0.0001)。单个细胞系的结果示于图7A-7B中。尽管提高的细胞毒性可能与培养物中NL细胞的存活提高相关,但是如由用K562或U937细胞培养后的CD107a染色所显示的,还观察到提高的由mb IL15-NK细胞释放的裂解性颗粒(lytic granule)(P=0.0067;图5B)。
与mbIL15的表达相关的体外细胞毒性的提高反映在移植有人肿瘤细胞的NOD/scid IL2RGnull小鼠的实验中。在一组实验中,向小鼠注射人急性髓细胞白血病(acute myeloid leukemia,AML)细胞系U937,然后用mbIL15或模拟转导的NK细胞处理。如图5C和5D所示,接受mbIL15转导的NK细胞的小鼠较未经处理的小鼠和用模拟转导的NK细胞处理的小鼠具有更慢的肿瘤生长和显著更长的存活(P=0.014,趋势的对数秩检验)。还在第二种异种移植模型中对细胞进行测试,在所述第二异种移植模型中向NOD/scid IL2RGnull小鼠注射尤因肉瘤细胞系ES8,所述小鼠具有更慢的生长速率,并且用一次NK细胞注射处理小鼠。如附图8A-8C所示,用mbIL15NK细胞处理的小鼠(n=12)的结果优于模拟转导的NK细胞处理的小鼠(n=11)的结果和未经处理的小鼠(n=7)的结果:中值存活分别为162、49和21天(P=0.005)。
讨论
在决定癌症的基于NK细胞的治疗成功的因素中,也许最基本的一个是NK细胞持续足够的数量以实现可能引起肿瘤细胞降低的E∶T比例。本文中证实,在人NK细胞中IL-15的膜结合形式的表达维持其在不存在IL-2的情况下的自主扩增和延长存活。表达mbIL15的NK细胞在无外源性IL-2的情况下可以在体外维持长达2个月。表达mbIL15的NK细胞可以在免疫缺陷小鼠中扩增并浸润多个组织,在所述组织中它们可以以比模拟转导的细胞更大的数量存在。在体外和体内,mbIL-15NK细胞的扩增通过低浓度的IL-2进一步提高。mbIL15的表达不损害NK细胞的细胞毒性能力。事实上,在异种移植模型中,mbIL15NK细胞表现出比模拟转导的细胞更强的抗癌活性,表明该方法可提高NK细胞输注的抗肿瘤能力,同时避免IL-2施用的副作用。
本文中的发现表明,当IL-15以膜结合形式而不是以分泌形式存在时,IL-15在人NK细胞中的异位表达引起更强的存活促进作用。然而,值得注意的是,当IL-15由其他细胞提供时,在NK细胞中表达的mbIL15优先以顺式而不是以反式刺激。也就是说,mbIL15看来优先结合同一细胞上的IL-15受体,导致自分泌刺激。该机制说明了当用抗IL-15抗体标记mbIL15转导的NK细胞时始终观察到的IL-15表达模式,显示出显著比例的具有强GFP表达但表面上(ostensibly)缺乏IL-15的细胞(图1B)。推测在这些细胞中,IL-15表达但不能接近抗体,因为其结合其受体和/或内化。mbIL15促进NK细胞生存力的能力可能解释了由这些细胞表现的细胞毒性提高,特别是在24小时体外测定和在体内中。然而,mbIL15-NK细胞的优势在短期(4小时)测定中也是明显的,并且根据CD107a测试这些细胞还释放更多的裂解性颗粒。因此,mbIL15的表达可能通过其他方式(可能通过增强其活化状态)来提高NK细胞细胞毒性。
NK细胞的临床施用通常依赖于IL-2以支持其在体内存活和扩增。然而,与IL-2施用有关的多种副作用是潜在严重的并且常常致使该细胞因子的施用耐受性差。停止IL-2施用或降低其剂量可导致NK细胞扩增降低和抗肿瘤作用不充分,所述抗肿瘤作用可通过刺激调节性T细胞进一步抑制。为此,用IL-15替代IL-2具有潜在的吸引力,但IL-15的临床制剂仍在测试中。尽管当施用于恒河猴(rhesus macaques)时其总体具有良好的耐受性,但在一些动物中观察到不良作用,包括腹泻、呕吐、体重减轻、暂时性中性粒细胞减少、转氨酶提高和低钠血症。除了T和NK细胞扩增以外,已观察到调节性T细胞的扩增。与用wtIL15转导的NK细胞相反,用mbIL15转导的那些NK细胞在上清液中释放非常少量的IL-15。因此,任何潜在的可能由IL-15与除NK细胞以外的细胞的相互作用引起的副作用应当通过此方法最小化。值得注意的是,鼠大颗粒淋巴细胞长期暴露于IL-15导致其白血病生长。这对患者中IL-15施用以及对表达IL-15的NK细胞的使用提出了潜在的安全性问题,特别是如果将这样的细胞以低复发风险施用于患者。然而,在本文中所述的实验中,与表达可溶性IL-15的T细胞克隆报道的一年或更长相比,表达mbIL15的NK细胞通常存活短得多的时间。此外,根据超过9个月的随访,在免疫缺陷小鼠中未观察到持续的NK扩增。
有相当多的临床证据支持NK细胞的抗癌潜力。在用单克隆抗体治疗的患者中,NK细胞还在介导抗体依赖性细胞毒性中发挥关键作用。因此,输注NK细胞在多种情况下可能是有益的。人NK细胞的大量离体扩增是可行的;已经建立了用于此目的的稳健的大规模方法并且正用于临床试验中。通过逆转录病毒转导或电穿孔的NK细胞的基因修饰也是可能的。因此,将本文中所述的方法转化为临床级条件是实际可行的并且其通过mbIL15-NK细胞的优异扩增和细胞毒性来保证。
表模拟转导和mbIL15转导的NK细胞中的表面标志物表达1
1在不存在IL-2的情况下培养48小时后对细胞标志物进行分析。抗体来自BD Biosciences(CD56 PE、CD16 PE-Cy7、CD69 PE,CD25 PE-Cy7、CD122 BV421、CD158b PE),Beckman Coulter(CD335 PE、CD336 PE、CD337 PE、CD158ah PE、CD159a PE),Miltenyi Biotech(CD226PE、CD158e APC),R&D Systems(NKG2D PE),Biolegend(CD132APC)。
2百分比是指表达标志物的GFP+细胞。
3过表达的标志物以粗体字突出显示。
MFI意指平均荧光强度
本文中引用的所有专利、公开的申请和参考文献的教导通过引用整体并入。
虽然已参考本发明的一些实例实施方案具体示出和描述了本发明,但是本领域技术人员将理解,可以在其中进行形式和细节上的多种改变而不脱离所附权利要求书涵盖的本发明的范围。
- 还没有人留言评论。精彩留言会获得点赞!