抗体纯化方法与流程
相关申请的交叉援引
本申请要求2014年7月25日提交的美国临时申请62/028,994的优先权,本文援引并采纳该临时申请的全部内容。
背景技术:
通常要求纯化单克隆抗体和其它生物材料的已知方法能够去除不希望其存在的杂质,这对于用于医疗目的生物制品而言尤其重要。去除杂质的方法之一是渗滤。渗滤是一种已知方法,相关记载可见于例如:waynep.olson,《分离技术:药学与生物技术应用》(separationstechnology:pharmaceuticalandbiotechnologyapplications)(英特法姆出版社(interpharmpress),1995;munircheryan,《超滤与微滤手册》(ultrafiltrationandmicrofiltrationhandbook),第二版,crc出版社(crcpress),1998;stefanbehme,《药用蛋白质的制造》(manufacturingofpharmaceuticalproteins)(wiley-vch出版社2009);以及glynn.stacey,《来自动物细胞培养的药品》(medicinesfromanimalcellculture)(约翰威立出版社(johnwiley)2007);本文援引并采纳以上文献的全部内容。
ch14.18(本文中亦称“dinutuximab”)是一种抗-gd2单克隆抗体,参见gillies等,journalofimmunologicalmethods,125:191-202(1989),本文援引并采纳其全部内容。当ch14.18抗体用于治疗,去除杂质(例如二(2-羟乙基)氨基-三(羟甲基)甲烷(bis-tris))非常重要,为的是确保该单克隆抗体的安全性和有效性。因此,需要更多去除生物组合物中不希望其存在的杂质的方法。
发明概述
本文中许多实施方式涉及纯化生物组合物的方法,所述方法包括用磷酸盐缓冲液(pbs)对生物组合物进行渗滤,从而获得纯化组合物。
实施方式之一中,生物组合物包含至少一种分离的蛋白质。
实施方式之一中,分离的蛋白质是单克隆抗体。实施方式之一中,单克隆抗体是ch14.18。
实施方式之一中,生物组合物还含有至少一种杂质。实施方式之一中,杂质是二(2-羟乙基)氨基-三(羟甲基)甲烷(bis-tris)。实施方式之一中,生物组合物中bis-tris的浓度是ph6.3至6.7下10至50mmbis-tris。
实施方式之一中,渗滤去除生物组合物中至少50%的bis-tris。实施方式之一中,渗滤去除生物组合物中至少70%的bis-tris。
实施方式之一中,pbs的浓度是10至50mm磷酸钠和100至200mmnacl。
实施方式之一中,在被渗滤成为含pbs的组合物之前,单克隆抗体被浓集至至少2.0至5.0au的浓度。实施方式之一中,在被渗滤成为含pbs的组合物之前,单克隆抗体被浓集至至少4.0至6.0au的浓度。
实施方式之一中,本文中的方法还包括用至少一种层析柱分离和纯化单克隆抗体。
实施方式之一中,本文中的方法包括用至少一种亲和层析柱、至少一种阳离子交换层析柱和/或至少一种阴离子交换层析柱分离和纯化单克隆抗体。实施方式之一中,阴离子交换层析柱是captotm附着柱。实施方式之一中,用含bis-tris的组合物将单克隆抗体从captotm附着柱上洗脱。
实施方式之一中,至少三体积单位生物组合物被渗滤成为一体积单位的含pbs的组合物。实施方式之一中,至少五体积单位生物组合物被渗滤成为一体积单位的含pbs的组合物。
实施方式之一中,纯化的组合物经进一步渗滤成为含组氨酸的组合物。
本文所述还包括一种纯化单克隆抗体的方法,包括:(a)使含单克隆抗体的第一组合物过亲和层析柱,得到含所述单克隆抗体的第二组合物;(b)调低第二组合物的ph,得到第三组合物;(c)用溶剂-除垢剂清洗第三组合物,得第四组合物;(d)清洗第四组合物以去除溶剂-除垢剂,得第五组合物;(e)使第五组合物过阳离子交换层析柱,得到含所述单克隆抗体的第六组合物;(f)对第六组合物进行纳滤,得第七组合物;(g)使第七组合物过阴离子交换层析柱,得到含所述单克隆抗体和bis-tris的第八组合物:(h)渗滤第八组合物成为含pbs的组合物,得含有所述单克隆抗体且基本不含bis-tris的第九组合物。
附图说明
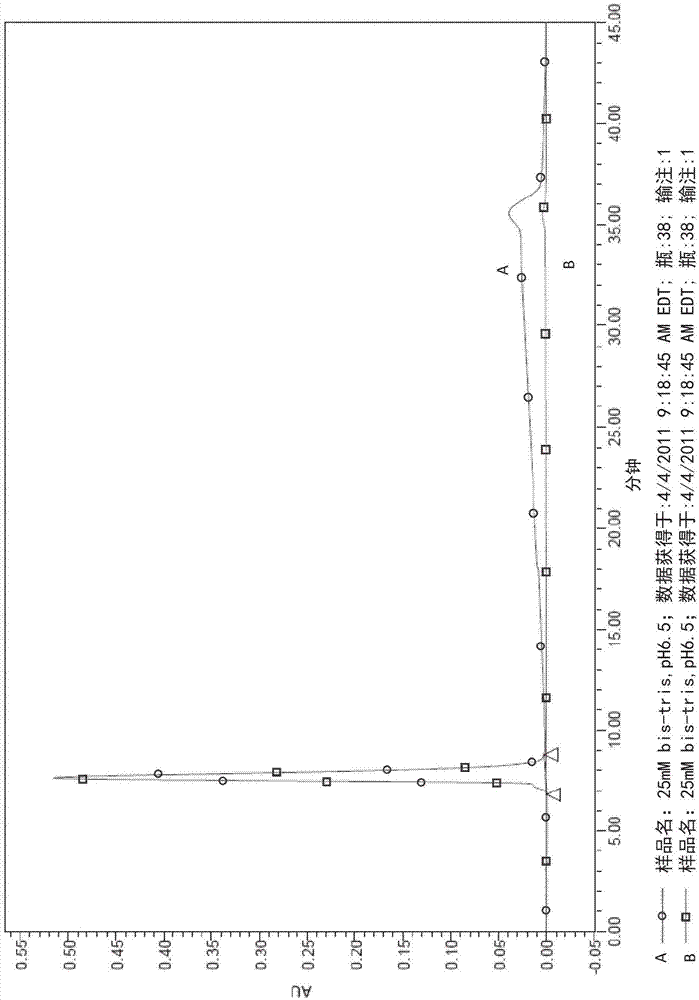
图1:ch14.18经pbs渗滤后的弱阳离子交换hplc分析。谱线a代表经pbs渗滤的ch14.18。谱线b代表渗滤入hbs的ch14.18,均为215nm监测。
图2:25mmbis-tris样品加载到弱阳离子交换hplc柱,滞留时间约7分钟处的峰来自bis-tris。对25mmbis-tris的弱阳离子交换分析。谱线a显示215nm处监测的吸光度。谱线b显示280nm处监测的吸光度。
图3:captotm附着柱采用新树脂或曾用树脂所得的汇合洗脱物的弱阳离子hplc,滞留时间约7分钟处的峰来自bis-tris,而不是来自柱上因此前用过而残留的污染物。captotm附着柱汇合洗脱物样品均无源自新层析柱或曾用层析柱的ch14.18。谱线a是来自新柱的样品。谱线b是来自曾用柱的样品。
图4:渗滤入pbs前掺入了污染物的ch14.18的弱阳离子交换hplc层析结果。谱线a代表没有掺混污染物的ch14.18。谱线b代表掺混了磷酸三丁酯和聚山梨醇酯80的ch14.18。谱线c代表掺混了氨甲蝶呤的ch14.18。约7分钟处的峰非纯化过程中任何痕量添加剂所致(图1和2)。
图5:单克隆抗体(如ch14.18)纯化实施方式之一的流程图。该纯化过程最初是国家癌症研究所(nci)研发的(见实施例2),后经联合治疗公司(unitedtherapeuticscorp)改进(见实施例1)。
优选实施方式说明
本文中许多实施方式涉及纯化生物组合物的方法,包括用磷酸盐缓冲液(pbs)对生物组合物进行渗滤,从而获得纯化的组合物。
生物组合物
本文所述的方法能够纯化许多本领域所知的生物组合物。生物组合物可包含生物过程产生而非化学合成的至少一种物质,例如蛋白质、核酸、细胞、组织、疫苗,以及血液或其组分。
例如,生物组合物可包含至少一种分离的蛋白质,包括重组蛋白质。例如,生物组合物可包含至少一种分离的核酸。例如,生物组合物可包含至少一种单克隆抗体。例如,生物组合物可包含至少一种嵌合、改造或人源化的抗体。
特定实施方式之一中,生物组合物含有至少ch14.18单克隆抗体,但其他抗体和生物材料也可用本文所述的方法纯化。
例如,生物组合物可含有至少一种杂质。杂质可以是例如不希望其存在的盐,如bis-tris。生物组合物中bis-tris杂质的浓度可能是例如1至100mmbis-tris,或10至50mmbis-tris,或20至40mmbis-tris。ph可以是例如6至7、或6.3至6.7或6.4至6.6。
pbs渗滤
某些实施方式中,本文所述方法包括将至少两、至少三、至少四、至少五或至少六体积单位的生物组合物渗滤入一体积单位pbs。
某些实施方式中,生物组合物含有不希望其存在的bis-tris,本文所述方法包括:通过pbs渗滤从所述生物组合物去除至少30%、至少50%、至少70%、至少90%或至少95%的bis-tris。
pbs的浓度可以是例如10至50mm磷酸钠和100至200mmnacl。
某些实施方式中,用pbs渗滤之前,先将生物组合物浓集。
某些实施方式中,pbs渗滤之后,将生物组合物渗滤成为含20mm组氨酸、150mmnacl和0.05%吐温20(tween20)盐溶液(hbs)的制剂。
单克隆抗体的分离
本文所述数个实施方式中,所述方法还包括在pbs渗滤前分离和纯化单克隆抗体。例如,单克隆抗体可用至少一种层析柱来分离和纯化。例如,单克隆抗体可用至少一种亲和层析柱、至少一种阳离子交换层析柱和/或至少一种阴离子交换层析柱来分离和纯化。例如,阴离子交换层析柱可以是captotm附着柱。
captotm附着柱是已知的,可购自通用医疗集团生命科学部(gehealthcarelifesciences)。它是一种混合模式介质,用于单克隆抗体在经由填充床层析在蛋白a介质上捕获后的中级纯化和精制。本文所述的某些实施方式包括用captotm附着柱纯化单克隆抗体,并用含bis-tris缓冲剂的组合物洗脱单克隆抗体。然后,洗下的抗体制剂必须渗滤成为前述含pbs的制剂,或任选地,还可以再渗滤成为含hbs的制剂。
例如,本文所述方法还可包括对包含收获所得单克隆抗体的生物组合物进行浓集。
例如,本文所述方法还可包括将生物组合物渗滤入蛋白a平衡缓冲液。作为一具体例,蛋白a平衡缓冲液可含25至100mm磷酸钠、0.5至2.0mnacl,ph7.0至8.0。
例如,本文所述方法还可包括将生物组合物过亲和层析柱,例如蛋白a亲和柱。
例如,本文所述方法还可包括通过调低生物组合物的ph来进行病毒灭活。
例如,本文所述方法还可包括用溶剂-除垢剂清洗生物组合物来进行病毒灭活。作为一具体例,溶剂-除垢剂可包含10至25%聚山梨醇酯(polysorbate)(tween),5至10%磷酸三丁酯。
例如,本文所述方法还可包括清洗生物组合物从而清除所有溶剂-除垢剂。
例如,本文所述方法还可包括将生物组合物渗滤入50hs平衡缓冲液。作为一具体例,50hs平衡缓冲液可含有5至20mm柠檬酸盐、5至30mm磷酸盐、15至100mm氯化钠,ph4.0至5.5。
例如,本文所述方法还可包括将生物组合物过阳离子交换亲和层析柱,例如50hs柱。
例如,本文所述方法还可包括对生物组合物进行纳滤。
例如,本文所述方法还可包括在pbs渗滤前将生物组合物过阴离子交换亲和层析柱例如captotm附着柱。可用bis-tris缓冲液从captotm附着柱上洗脱单克隆抗体。
例如,本文所述方法还可包括在pbs渗滤之后将生物组合物渗滤进入组氨酸缓冲液。
实施方式之一中,本文所述方法包括以下步骤:
(a)使含单克隆抗体的第一组合物过亲和层析柱,得含有所述单克隆抗体的第二组合物;
(b)将第二组合物ph调低,得第三组合物;
(c)用溶剂-除垢剂清洗第三组合物,得第四组合物;
(d)清洗第四组合物以去除溶剂-除垢剂,得第五组合物;
(e)使第五组合物过阳离子交换层析柱,得含有所述单克隆抗体的第六组合物;
(f)对第六组合物进行纳滤,得第七组合物;
(g)使第七组合物过阴离子交换层析柱,得到含所述单克隆抗体和bis-tris的第八组合物;以及
(h)渗滤第八组合物成为含pbs的组合物,得含有所述单克隆抗体且基本不含bis-tris的第九组合物。
实施例
实施例1-弱阳离子交换hplc分析的发展
ch14.18纯化过程研发中,目标之一曾是对最早由国家癌症研究所(nci)研发的纯化过程(图5:最早由nci研发的纯化过程)进行改进。然后的目标是升级到层析树脂(例如通用健康(gehealthcare)的captotm附着树脂),其具有更高的容量、更好的流动性、或者对苛性化合物具有更高耐性(在对树脂进行清洗以备下次使用时可能会用到苛性化合物)。
就最后两步层析而言(图5第18、19段),nci采用superdex200尺寸排阻层析柱来去除ch14.18的聚集体和二聚体,接着用qsepharose阴离子交换树脂作为精制树脂。它们被升级为采用能够去除病毒、聚集体和痕量污染物的树脂——通用医疗(gehealthcare)的captotm附着树脂(例如通用医疗集团生命科学部(gehealthcarelifesciences),使用说明28-9064-05captotm附着亲和层析产品手册,本文援引并采纳其全部内容,见https://www.gelifesciences.com/gehcls_images/gels/related%20content/files/1334667780708/litdoc28906405_20120420104439.pdf)。这是一种混合模式树脂,组合了阴离子交换与疏水相互作用。其以流通模式运行,污染物与树脂结合,但ch14.18单克隆抗体不结合而是留在流通相中。
ch14.18纯化不断改进的同时,质量指示分析(qualityindicatingassays)也在不断发展。其中之一是弱阳离子交换层析hplc分析。为此,用东曹公司(tosoh)的tskgelcm-3sw柱分析ch14.18的纯度。为此,结合该柱后从该柱洗脱在盐梯度溶液中的抗体流过该柱。该柱在低盐磷酸钠缓冲液(缓冲液a)中平衡,并使磷酸钠/高氯酸钠缓冲液(缓冲液b)浓度逐渐升高从而形成梯度。用这种分离方法,215nm处监测柱流出物,ch14.18洗脱峰出现在注入后约15-19分钟。ch14.18的滞留时间随方法和梯度优化而不同。这项分析发展过程中,试验了多种ch14.18样品,其中部分测到一个滞留时间约7.5分钟的较大的峰。为了确认这一污染物,向ch14.18样品中掺入制造过程早期加入的各种污染物(见图1)。在无污染ch14.18样品中掺入氨甲蝶或磷酸三丁酯和聚山梨醇酯80。似乎这些都不是滞留时间7.5分钟那个峰的来源。
通过追踪样品来源以及样品来自纯化过程的哪个步骤发现,该峰仅见于captotm附着层析之后,而captotm附着层析是纯化过程最后的精制步骤。这一污染物疑为某种痕量污染物,诸如来自细胞培养工程的宿主细胞蛋白,其在柱上随同纯化并浓集。对曾加载于曾用柱或新柱的captotm附着柱上模拟运行的样品进行弱阳离子交换层析hplc分析(见图2)。两类样品都有7.5分钟处的污染物峰,浓度大致相同,由此表明该污染物并非来自上游污染物。
通过追踪含有和不含该样品的ch14.18样品的来源,发现该污染物是bis-tris,即用于captotm附着纯化步骤的缓冲盐(见图3)。
鉴定了该污染物,接着调查为什么经历完整纯化过程的纯化ch14.18样品中有些有bis-tris峰,有些则没有。同时得到一最终的抗体制剂,配制在20mm组氨酸、150mmnacl、0.05%tween20盐溶液(hbs)中,该制剂由nci所用的磷酸盐缓冲液(pbs)制剂改进而来。我们发现,如果含ch14.18的captotm附着层析产物集合直接用hbs缓冲液渗滤,则无法从截留物集合中渗滤分离出bis-tris峰。然而,如果该集合先用磷酸盐缓冲液渗滤,然后用hbs缓冲液渗滤,就能够完全清除溶液中的bis-tris。图4显示captotm附着层析所得ch14.18,分别为hbs渗滤所得试样或经pbs渗滤的试样。
总之,captotm附着柱是生物技术产业中单克隆抗体纯所常用的。它可用于清除痕量污染物例如残留的蛋白a配体、残留的宿主细胞dna、残留的宿主细胞蛋白质、抗体聚集体和病毒。pbs渗滤被证明是在形成最终的单克隆抗体(例如ch14.18)制剂之前清除bis-tris杂质的有效方法。
实施例2–流程图
图5给出一流程图,所示为单克隆抗体(例如ch14.18)纯化的实施方式之一。过程本身不受该图局限,可以根据实际需要和情况进行调整。图5中的过程主要涉及以下步骤:
第8段.单克隆抗体收获物(例如粗制收获物)的初次汇合与过滤。
第9段.使第8段的收获物过亲和层析柱(例如蛋白a层析柱),得含所述单克隆抗体的第二组合物。
第10段.将第二组合物ph调低来灭活病毒,得第三组合物。用溶剂-除垢剂清洗第三组合物,得第四组合物,随后洗去第四组合物中的溶剂-除垢剂,得第五组合物。
第11段.使第五组合物过阳离子交换层析柱(例如sp琼脂糖ff层析(spsepharoseff)),得含所述单克隆抗体的第六组合物。可以重复蛋白a层析(第12段),接着重复病毒灭活(第13段),接着重复阳离子交换层析(例如“sepharose”)(第14段)。然后汇集“sepharose”层析产物,形成第六组合物。
第16段.对第六组合物进行纳滤进一步清除病毒,得第七组合物。
第17、18、19段.第七组合物过“superdex200”尺寸排阻层析柱来清除单克隆抗体聚集体和二聚体。组合物然后过“qsepharose”阴离子交换树脂,得含单克隆抗体的第八组合物。
第20段.浓集和最后过滤。然后,对第八组合物进行浓集和最后的过滤,包括渗滤成为含pbs的组合物,得含单克隆抗体的第九组合物。
其他实施方式
实施方式1–一种纯化生物组合物的方法,包括用磷酸盐缓冲液(pbs)对生物组合物进行渗滤从而获得纯化组合物。
实施方式2–如实施方式1所述的方法,所述生物组合物包含至少一种分离的蛋白质。
实施方式3–如实施方式1或2所述的方法,所述生物组合物包含至少一种分离的单克隆抗体,如ch14.18。
实施方式4–如实施方式1至3中任一项所述的方法,所述生物组合物还含有至少一种杂质如二(2-羟乙基)氨基-三(羟甲基)甲烷(bis-tris)。
实施方式5–如实施方式1至4中任一项所述的方法,所述生物组合物还包含ph6.3至6.7下10至50mmbis-tris。
实施方式6–如实施方式1至5中任一项所述的方法,所述渗滤从生物组合物去除至少50%、至少70%或至少90%的bis-tris。
实施方式7–如实施方式1至6中任一项所述的方法,pbs的浓度是10至50mm磷酸钠和100至200mmnacl。
实施方式8–如实施方式1至7中任一项所述的方法,在被渗滤成为含pbs的组合物之前,所述单克隆抗体被浓集至至少2.0至5.0au的浓度。
实施方式9–如实施方式1至8中任一项所述的方法,包括用至少一种层析柱分离和纯化单克隆抗体。
实施方式10–如实施方式1至9中任一项所述的方法,包括用至少一种亲和层析柱、至少一种阳离子交换层析柱和/或至少一种阴离子交换层析柱如captotm附着柱分离和纯化单克隆抗体。
实施方式11–如实施方式1至10中任一项所述的方法,用pbs渗滤之前,用含bis-tris的组合物从captotm附着柱上洗脱所述单克隆抗体。
实施方式12–如实施方式1至11中任一项所述的方法,至少三体积单位、至少四体积单位、至少五体积单位或至少六体积单位的生物组合物被渗滤成为一体积单位的含pbs的组合物。
实施方式13–如实施方式1至12中任一项所述的方法,纯化的组合物再度渗滤成为含组氨酸的组合物。
实施方式14–一种纯化单克隆抗体的方法,包括:(a)使含单克隆抗体的第一组合物过亲和层析柱,得到含所述单克隆抗体的第二组合物;(b)调低第二组合物的ph,得到第三组合物;(c)用溶剂-除垢剂清洗第三组合物,得第四组合物;(d)清洗第四组合物以去除溶剂-除垢剂,得第五组合物;(e)使第五组合物过阳离子交换层析柱,得到含所述单克隆抗体的第六组合物;(f)对第六组合物进行纳滤,得第七组合物;(g)使第七组合物过阴离子交换层析柱,得到含所述单克隆抗体和bis-tris的第八组合物:以及(h)渗滤第八组合物成为含pbs的组合物,得含有所述单克隆抗体且基本不含bis-tris的第九组合物。
- 还没有人留言评论。精彩留言会获得点赞!